«УТВЕРЖДАЮ»
Главный Государственный санитарный врач РФ, Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
Дата введения: t Ллиашм^ uUtftOcUuQ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ по определению остаточных количеств феноксапроп-П-этнла по метаболиту феноксапропу-П в капусте, горохе и моркови методом высокоэффективной жидкостной хроматографии
1. ВВОДНАЯ ЧАСТЬ
Фирма производитель: Байер КропСаЙенс (Германия)
Торговое название: Пума супер, Фуроре Ультра
Действующее вещество: феноксапроп-П-этил
Этил (К)-2-(4-[(6-хлор-2-бензоксазолил)окси]фенокси]пропаноат (С.А.)
СНз
0-СН-С-ОС0Н<. II 1 0 О
Эмпирическая формула: CiaHieClNOj Молекулярная масса: 361,8 Белое твердое вещество без запаха Температура плавления: 89-91°С
■/№
Давление паров при 20°С: 5,3x1 O'4 мПа Коэффициент распределения н-октанол/вода: К** log Р = 4,58 Растворимость (г/л) при 20°С: ацетон -200, толуол - 200, эти л ацетат - более 200, этанол - 24; растворимость в воде 0,7 мг/л.
Вещество стабильно в течение 90 дней при 50°С, не разрушается на свету, нестабильно в нейтральной и особенно щелочной средах: DT50 =1000 дней (pH 5), 100 дней (pH 7), 2,4 дня (pH 9).
Краткая токсикологическая характеристика:
Острая пероральная токсичность (LDso) для крыс 3150-4000, для мышей - более 5000 мг/кг; острая дермальная токсичность (LD50) для крыс - более 2000 мг/кг, острая ингаляционная токсичность (LC50) для крыс - более 1,224 мг/л воздуха. Феноксапроп-П-этил не вызывает раздражения кожи. LCso для рыб - 0,46-0,58 мг/л (96час.). Феноксапроп-П-этил нетоксичен для пчел, птиц, дождевых червей.
Гигиенические нормативы: ОДК в почве - 0,04 мг/кг; ПДК в воде - 0,0003 мг/дм3; МДУ в зерне хлебных злаков, моркови, свекле столовой, подсолнечнике (масло) и луке - 0,01, свекле сахарной, сое - 0,05, капусте - 0,02, рапсе, горохе - 0,2 мг/кг.
Основной метаболит феноксалроп-П-этила: феноксалроп-П (К)-2-(4-[(6-хлорбензоксазол-2-илокси)]фенокси]пропионовая кислота (ИЮПАК) (К)-2-[4-[(6-хлор-2-бензоксазолил)окси]фенокси]пропановая кислота (С.А.)
Эмпирическая формула: C16H12CINO5 Молекулярная масса: 333,7 Светлобежевый порошок со слабым запахом Температура плавления: 155-161°С Давление паров при 20°С: 1,8 х 10-1 мПа
Коэффициент распределения н-октанол/вода: Kow log Р = 1,83 - 0,24 (pH 5 - pH 9)
■/м
H, х А х V
X = —
Но х m
X - содержание феноксалропа-П в пробе, мг/кг;
Hi - высота пика образца, мм;
Но - высота пика стандарта, мм;
А - концентрация стандартного раствора феноксапропа-П, мкг/мл;
V - объем экстракта, подготовленного для хроматографирования, мл;
ш - масса анализируемой части образца, г (для зерна - 1 г, для корнплодов и кочанов - 3 г).
При расчете содержания феноксапропа-П в эквивалентах феноксапроп-П-этила полученное значение X умножают на 1,08.
3. ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ
Необходимо соблюдать общепринятые правила безопасности при работе с органическими растворителями, токсичными веществами, электронагревательными приборами.
4. КОНТРОЛЬ ПОГРЕШНОСТИ ИЗМЕРЕНИЙ
Оперативный контроль погрешности и воспроизводимости измерений осуществляется в соответствии с рекомендациями МИ 2335-95. ГСИ. Внутренний контроль качества результатов количественного химического анализа.
5. РАЗРАБОТЧИКИ
Талалакина Т.Н., науч. сотр.; Макеев А.М., зав. лабораторией, канд. биол. наук.
ВНИИфитопатологии, 143050, Московская обл., п/о Большие Вяземы, тел.592-92-20
Подпись руки Талалакиной Т.Н. и Макеева А.М. заверяю
Зав. канцелярией ВНИИФ
(Банюлис Г.Г.)
Растворимость (г/л) при 20°С: толуол - 0,5, метанол - 34, этилацетат - 36, ацетон -80, вода - 0,27 (pH 5,1) и 61 (pH 7,0)
Другие физикогхимические и токсикологические характеристики феноксапроп-П отсутствуют.
Область применения препарата
Феноксапроп-П-этил - послевсходовый гербицид системного действия из группы ингибиторов синтеза жирных кислот. Вещество быстро поглощается листьями и хорошо передвигается в акропетальном и базилеталъном направлении в различные органы растения. Феноксапроп-П-этил эффективно уничтожает однолетние и многолетние злаковые сорняки в посевах свеклы, моркови, сои, льна, арахиса, хлопчатника, капусты, лука и картофеля, а в комбинации с антидотом используется для этих же целей и на посевах пшеницы, ржи и тритикале.
Проходит регистрационные испытания в России и странах СНГ под торговым названием Пума-супер, КЭ (100 г феноксапроп-П-этила и 27 г антидота мефенпир-диэтила в 1 л препарата) и Фуроре Ультра, ЭМВ (ПО г феноксапроп-П-этила в 1 л препарата) на посевах озимой и яровой пшеницы, свеклы, капусты, подсолнечника, гороха и моркови в качестве послевсходового гербицида при норме расхода 0,8-1,2 л/га и однократной обработке за сезон.
Феноксапроп-П-этил весьма лабильное вещество и при попадании в воду, почву или растение очень быстро метаболизируется до более устойчивого соединения - (R)-2-[4-[(6-хлорбензоксазол-2-илокси)]фенокси]пропионовой кислоты /феноксапроп-П/. Поэтому контроль за содержанием феноксапроп-П-этила в продукции растительного происхождения ведут по феноксапропу-П.
2. МЕТОДИКА ОПРЕДЕЛЕНИЯ ОСТАТОЧНЫХ КОЛИЧЕСТВ ФЕНОКСАПРОП-П-ЭТИЛА ПО МЕТАБОЛИТУ ФЕНОКСАПРОПУ-П В КАПУСТЕ, ГОРОХЕ И МОРКОВИ МЕТОДОМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ
2.1 Основные положения
2.1.1 Принцип методики
Методика основана на определении феноксапроп-П с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) с
ультрафиолетовым детектором после извлечения метаболита из растительного материала водным ацетонитрилом при ультразвуковой обработке, очистки экстрактов перераспределением в системе несмешивающихся растворителей и на колонке с силикагелем.
Количественное определение проводится методом абсолютной калибровки.
2.1.2 Избирательность метода
В предлагаемых условиях метод специфичен в присутствии пестицидов, применяемых в интенсивной технологии выращивания капусты, гороха и моркови.
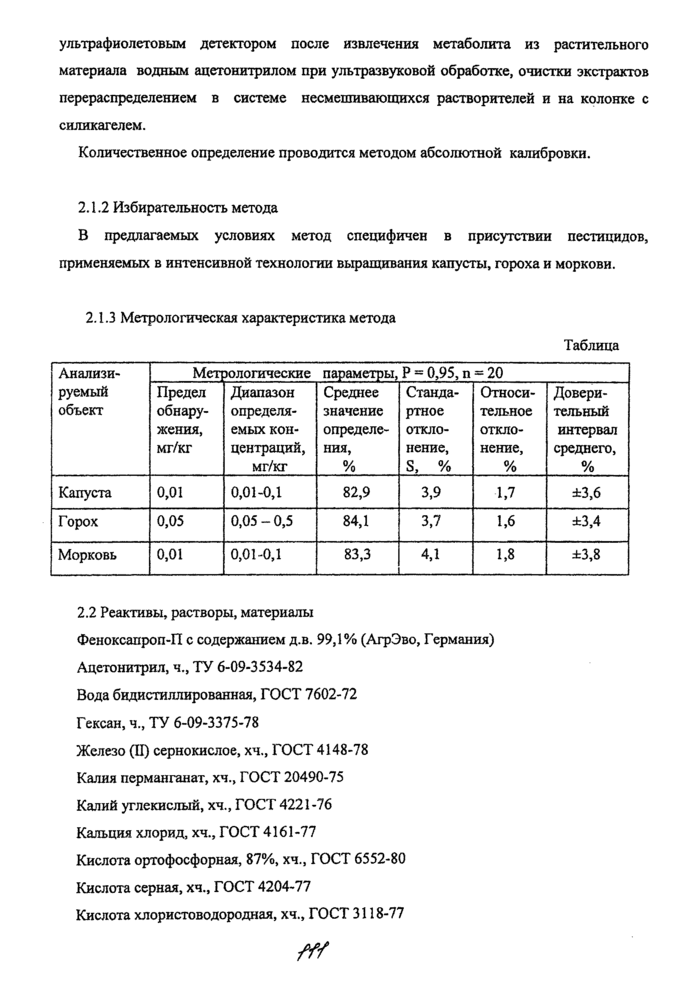
2.1.3 Метрологическая характеристика метода
|
Таблица |
|
Анализа-
руемый
объект |
Mctj |
^логические параметры, Р = 0,95, п = 20 |
|
Предел
обнару
жения,
мг/кг |
Диапазон определяемых концентраций, мг/кг |
Среднее
значение
определе
ния,
% |
Стандартное отклонение, S, % |
Относи
тельное
откло
нение,
% |
Довери
тельный
интервал
среднего,
% |
|
Капуста |
0,01 |
0,01-0,1 |
82,9 |
3,9 |
1,7 |
±3,6 |
|
Горох |
0,05 |
0,05-0,5 |
84,1 |
3,7 |
1,6 |
±3,4 |
|
Морковь |
0,01 |
0,01-0,1 |
83,3
_ |
4,1
_ |
1,8 |
±3,8 |
|
2.2 Реактивы, растворы, материалы
Феноксапроп-П с содержанием д.в. 99,1% (АгрЭво, Германия)
Ацетонитрил, ч., ТУ 6-09-3534-82
Вода бидистиллированная, ГОСТ 7602-72
Гексан, ч., ТУ 6-09-3375-78
Железо (II) сернокислое, хч., ГОСТ 4148-78
Калия перманганат, хч., ГОСТ 20490-75
Калий углекислый, хч., ГОСТ 4221-76
Кальция хлорид, хч., ГОСТ 4161-77
Кислота ортофосфорная, 87%, хч., ГОСТ 6552-80
Кислота серная, хч., ГОСТ 4204-77
Кислота хлористоводородная, хч., ГОСТ 3118-77
Натрия гидроксид, хч., ГОСТ 4328-77 Натрия сульфат безводный, хч., ГОСТ 4166-76 Натрий углекислый, хч., ГОСТ 83-63 Натрия хлорид, хч., ГОСТ 4233-77 Спирт метиловый, хч., ГОСТ 6995-77 Фосфора пентаксид, ч., МРТУ 6-09-5759-69 Этилацетат, ГОСТ 22300-76 Эфир диэтиловый, ГОСТ 6265-74
Элюент N1 для колоночной хроматографии: смесь этил ацетат-метанол (7:3, по объему)
Элюент N2 для колоночной хроматографии: смесь этил ацетат-метанол (6:4, по объему)
Подвижная фаза для ВЭЖХ: смесь ацетонитрил-вода-ортофосфорная кислота (54:45,9:0,1 , по объему)
Силикагель для адсорбционной хроматографии (Всльм, Германия) 1 степени активности или силикагель КСК (60-100 меш)
Стекловата
Фильтры бумажные, синяя лента, ТУ 6-09-1678
2.3 Приборы, аппаратура, посуда
Жидкостный хроматограф с ультрафиолетовым детектором фирм Altex (США), Knauer (Германия) или аналогичный
Хроматографическая колонка стальная, длиной 15 см, внутренним диаметром 4 мм, заполненная Диасфером-110-С 18 или Диасорбом 130-С 16 Т (ЗАО БиоХимМак, РФ;
119899, Москва, Ленинские горы)
Шприц для ввода образцов в жидкостной хроматограф
Весы аналитические типа ВЛР-200, ГОСТ 19401-74
Водоструйный насос, ГОСТ 10696-75
Встряхиватель механический, ТУ 64-1-1081-73
Гомогенизатор, МРТУ 42-1505-63, или аналогичный
Иономер ЭВ-74, ГОСТ 22261-76, или аналогичный
Мельница электрическая лабораторная, ТУ 46-22-236-79 или аналогичная
Ротационный испаритель тип ИР-1М, ТУ 25-11-917-76
/rft
Баня ультразвуковая, модель D-50, Branson Instr. Со., США или аналогичная Баня водяная, ТУ 46-22-603-75 Воронка Бюхнера, ГОСТ 0147-73
Воронки делительные вместимостью 100,250 мл, ГОСТ 25336-82 Воронки для фильтрования, стеклянные, ГОСТ 8613-75 Колба Бунзена, ГОСТ 5614-75
Колбы круглодонные на шлифе вместимостью 100, 250 и 500 мл, ГОСТ 9737-70 Колбы конические с притертыми пробками вместимостью 250 мл, ГОСТ 25336-82 Колбы мерные вместимостью 25, 50,100 и 1000 мл, ГОСТ 1770-74 Колбы грушевидные вместимостью 100, 250 и 500 мл, ГОСТ 25336-82 Пипетки мерные вместимостью 1,2, 5 и 10 мл, ГОСТ 20292-74Е Пробирки градуированные с притертыми пробками вместимостью 5 и 10 мл, ГОСТ 10515-75
Цилиндры мерные вместимостью 50, 100, 250 и 500 мл, ГОСТ 1770-74
2.4 Отбор проб
Отбор проб производится в соответствии с «Унифицированными правилами отбора проб сельскохозяйственной продукции, продуктов питания и объектов окружающей среды для определения микроколичеств пестицидов» (N 2051-79 от 21.08.79 г.).
Отобранные пробы зерна гороха подсушивают до стандартной влажности и хранят в стеклянной или полиэтиленовой таре в холодильнике при температуре не выше 4°С не более трех месяцев. Кочаны и корнеплоды хранят в стеклянной посуде в холодильнике при температуре не выше 4°С не более двух дней; при длительном хранении (не более трех месяцев) пробы замораживают и хранят в морозильной камере при температуре -18°С.
Перед анализом зерно размалывают на мельнице, сегменты кочанов и корнеплодов измельчают ножом.
2.5 Подготовка к определению
2.5.1 Подготовка и очистка реактивов и растворителей
/ИЗ
Органические растворители перед началом работы очищают,сушат и перегоняют в соответствии с типовыми методиками. Гексан встряхивают с небольшими порциями концентрированной серной кислоты до тех пор, пока свежая порция кислоты не перестанет окрашиваться. Затем гексан последовательно промывают водой, 2%-ным раствором гидроксида натрия и снова водой, после чего его сушат над гидроксидом натрия и перегоняют.
Этил ацетат промывают равным объемом 5%-ного раствора углекислого натрия, сушат над хлористым кальцием и перегоняют.
Диэтиловый эфир (1 л) предварительно встряхивают с 20 мл свежеприготовленного раствора железного купороса (30 г сульфата железа в 55 мл воды с добавлением 1,5 г концентрированной серной кислоты). Затем диэтиловый эфир последовательно промывают 0,5%-ным раствором перманганата калия, 5%-ным раствором гидроксида натрия и водой, после чего сушат над хлористым кальцием и перегоняют.
Ацетонитрил сушат над пентоксидом фосфора и перегоняют; отогнанный растворитель повторно перегоняют над углекислым калием.
2.5.2 Подготовка подвижной фазы для ВЭЖХ
При подготовке подвижной фазы для ВЭЖХ отмеряют 540 мл ацетонитрила, переносят в колбу на 1000 мл, добавляют 459 мл бидистиллированной воды и 1 мл ортофосфорной кислоты, перемешивают, фильтруют и дегазируют.
2.5.3 Кондиционирование колонки
Промыть колонку для ВЭЖХ смесью ацетонитрил-вода- ортофосфорная кислота (54:45,9:0,1, по объему) в течение 30 минут при скорости подачи растворителя 1 мл/мин. Включить детектор и подождать стабилизации базовой линии (15-30 минут).
2.5.4 Приготовление стандартных растворов
Основной стандартный раствор феноксапропа-П с содержанием 100 мкг/мл готовят растворением 0,010 г препарата, содержащего 99,1% д.в., в ацетонитриле в мерной колбе на 100 мл. Раствор хранят в холодильнике при температуре - 12°С не более месяца.
Рабочие стандартные растворы с концентрациями 0,01 , 0,02,0,05 и 0,10 мкг/мл готовят из основного стандартного раствора метаболита соответствующим
т
последовательным разбавлением подвижной фазой для ВЭЖХ (п.2.5.2) непосредственно в день проведения анализа.
При изучении полноты открывания феноксапропа-П в модельных матрицах используются ацетонитрильные растворы вещества.
2.5.5 Построение калибровочного графика
Для построения калибровочного графика в инжектор хроматографа вводят по 20 мкл рабочего стандартного раствора феноксапропа-П с концентрацией 0,01, 0,02, 0,05, 0,10 мкг/мл. Осуществляют не менее 5 параллельных измерений и находят среднее значение высоты хроматографического пика для каждой концентрации. Строят калибровочный график зависимости высоты хроматографического пика в мм от концентрации метаболита в растворе в мкг/мл.
2.5.6 Подготовка колонки с силикагелем
В нижнюю часть стеклянной колонки длиной 25 см и внутренним диаметром 0,8 см вставляют тампон из стекловаты, закрывают кран и вносят суспензию 5 г силикагеля в 20 мл этилацетата. Дают растворителю стечь до верхнего края сорбента и помещают на него слой безводного сульфата натрия высотой 1 см. Колонку промывают 30 мл смеси этилацетат-метанол (1:1, по объему) со скоростью 1-2 капли в секунду и затем 20 мл этилацетата.
2.5.7 Проверка хроматографического поведения феноксапропа-П на колонке с силикагелем
В круглодонную колбу емкостью 10 мл отбирают 0,1 мл стандартного раствора феноксапропа-П с концентрацией 10 мкг/мл, отдувают растворитель потоком теплого воздуха, остаток растворяют в 2-3 мл этилацетата и наносят на подготовленную колонку. Промывают колонку 40 мл элюента № 1 (смесь этилацетат-метанол, 7:3) и затем 60 мл элюента № 2 (смесь этилацетат-метанол, 6:4) со скоростью 1-2 капли в секунду. Отбирают фракции по 5 мл каждая, упаривают досуха, остаток растворяют в 2,5 мл подвижной фазы для ВЭЖХ (п.2.5.2) и анализируют на содержание феноксапропа-П по п.2.7.
Фракции, содержащие феноксапроп-П, объединяют, упаривают досуха, остаток растворяют в 10 мл подвижной фазы для ВЭЖХ и вновь анализируют по п.2.7.
Рассчитывают содержание вещества в элюате, определяют полноту смывания с колонки и необходимый для очистки объем элюента.
ПРИМЕЧАНИЕ: Профиль вымывания фсноксапропа-П может меняться при использовании новых партий сорбента и растворителей.
2.6 Описание определения
2.6.1.Экстракция феноксапропа-П
2.6.1.1 Зерно. Навеску размолотого зерна (10 г) помещают в коническую колбу емкостью 250 мл, приливают 100 мл 80%-ного ацетонитрила и помещают в ультразвуковую баню на 5 минуты. Суспензию фильтруют под вакуумом на воронке Бюхнера через бумажный фильтр. Растительный материал повторно экстрагируют 50 мл 80%-ного ацетонитрила в ультразвуковой бане в течение 3 минут и суспензию фильтруют. Из объединенного экстракта муки отбирают аликвоту (около 70 мл) раствора, эквивалентную 5 г зерна. Дальнейшую очистку проводят по пп. 2.6.2 и 2.6.3.
2.6.1.2 Корнеплоды, кочаны. К навеске (25 г) измельченного материла добавляют 125 мл 80%-ного ацетонитрила и гомогенизируют 3 минуты при 10000 об/мин, после чего суспензию помещают в ультразвуковую баню на 5 минут. К суспензии добавляют 2 г целита и фильтруют под вакуумом на воронке Бюхнера через бумажный фильтр в колбу на 250 мл. Осадок на фильтре промывают 50 мл 80%-ного ацетонитрила. Из объединенного экстракта отбирают пятую часть объема (около 35 мл) раствора, эквивалентную 5 г растительной ткани. Дальнейшую очистку проводят по пп. 2.6.2 и 2.6.3.
2.6.2 Очистка экстрактов
Отобранные аликвоты растительных (из пп.2.6.1.1 и 2.6.1.2) экстрактов упаривают до объема 5-10 мл на роторном испарителе при температуре 40°С. Водный остаток переносят в делительную воронку вместимостью 100 мл, приливают 15 мл бидистиллированной воды, 20 мл гексана и смесь встряхивают в течение 1 минуты. Органический слой отбрасывают. Водную фазу подкисляют 1 н HCI до pH 2, переносят в делительную воронку, прибавляют 20 мл диэтилового эфира и смесь встряхивают 1 минуту. Собирают органическую фазу и экстракцию водной фракции диэтиловым эфиром повторяют еще два раза (по 10 мл). Объединенную органическую фазу
#6
пропускают через слой безводного сульфата натрия и упаривают досуха на роторном испарителе при температуре 30°С.
2.6.3 Очистка на колонке с силикагелем
Остаток в колбе, полученный при упаривании очищенных по п.2.6.3 экстрактов зерна, корнеплодов и кочанов, растворяют в 5 мл этил ацетата и 3 мл полученного экстракта моркови и капусты или 1 мл экстракта зерна гороха вносят в подготовленную хроматографическую колонку (п.2.5.6). Колонку промывают 20 мл смеси этилацетат-метанол (7:3, по объему), которые отбрасывают. Метаболит элюируют 40 мл смеси этилацетат-метанол (6:4, по объему) и собирают элюат в i-рушевидную колбу емкостью 100 мл. Раствор упаривают досуха на роторном испарителе при температуре 30°С. Сухой остаток экстрактов кочанов и корнеплодов растворяют в 3 мл, а экстракта зерна в 5 мл подвижной фазы для ВЭЖХ (п.2.5.2) и анализируют на содержание феноксалропа-П по п. 2.7.
2.7 Условия хроматографирования
Жидкостный хроматограф с ультрафиолетовым детектором Knauer (Германия)
Колонка стальная длиной 15 см, внутренним диаметром 4 мм, заполненная Диасфером 110-С 18, зернением 5 мкм.
Температура колонки: комнатная
Подвижная фаза: ацетонитрил-вода-ортофосфорная кислота (54:45,9:0,1, по объему)
Скорость потока элюента: 0,7 мл/мин
Рабочая длина волны: 240 нм
Чувствительность: 0,01 ед. абсорбции на шкалу
Объем вводимой пробы - 20 мкл
Время выхода метаболита: 9,5 мин.
Линейный диапазон детектирования: 0,2-2,5 нг.
Образцы, дающие пики большие, чем стандартный раствор с концентрацией 0,1 мкг/мл, разбавляют подвижной фазой для ВЭЖХ.
2.8 Обработка результатов анализа
Содержание фсноксапропа-П рассчитывают методом абсолютной калибровки по формуле: