МР 2959-84
Методические рекомендации по осуществлению санитарно-микробиологического контроля окружающей среды в районах размещения птицеводческих предприятий
Купить МР 2959-84 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Рекомендации предназначены для научно-исследовательских и практических учреждений гигиенического профиля, занимающихся изучением влияния птицеводческих предприятий на окружающую среду
Оглавление
Введение
I. Санитарно-микробиологический анализ воздушной среды
II. Санитарно-микробиологический контроль снежного покрова
III. Санитарно-микробиологический контроль почвы
IV. Санитарно-микробиологический анализ сточных вод
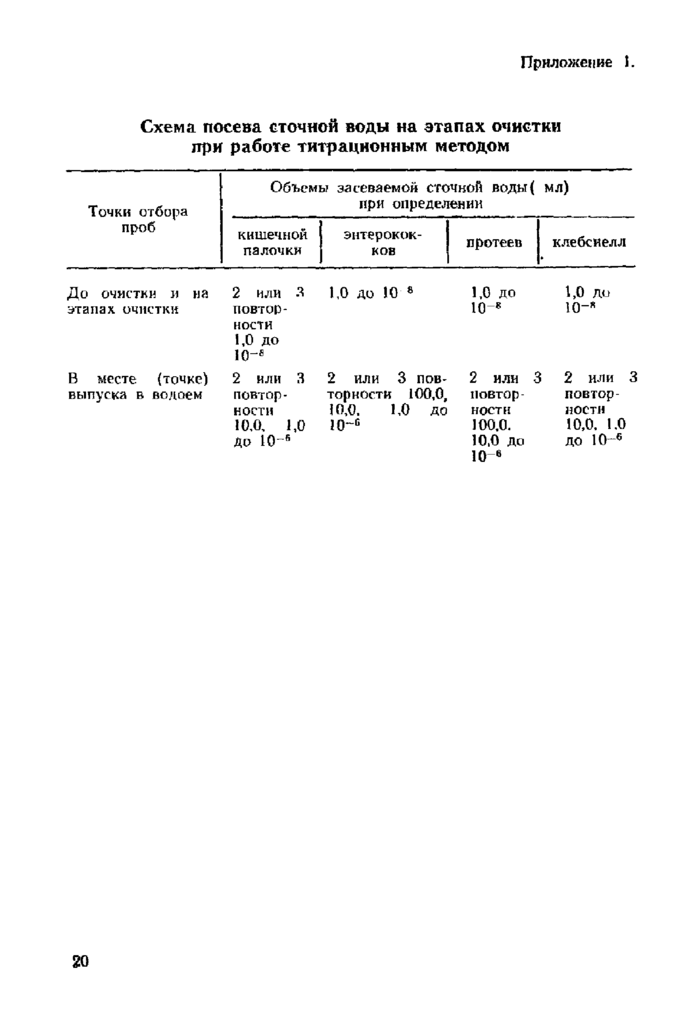
Приложение 1. Схема посева сточной воды на этапах очистки при работе титрационным методом
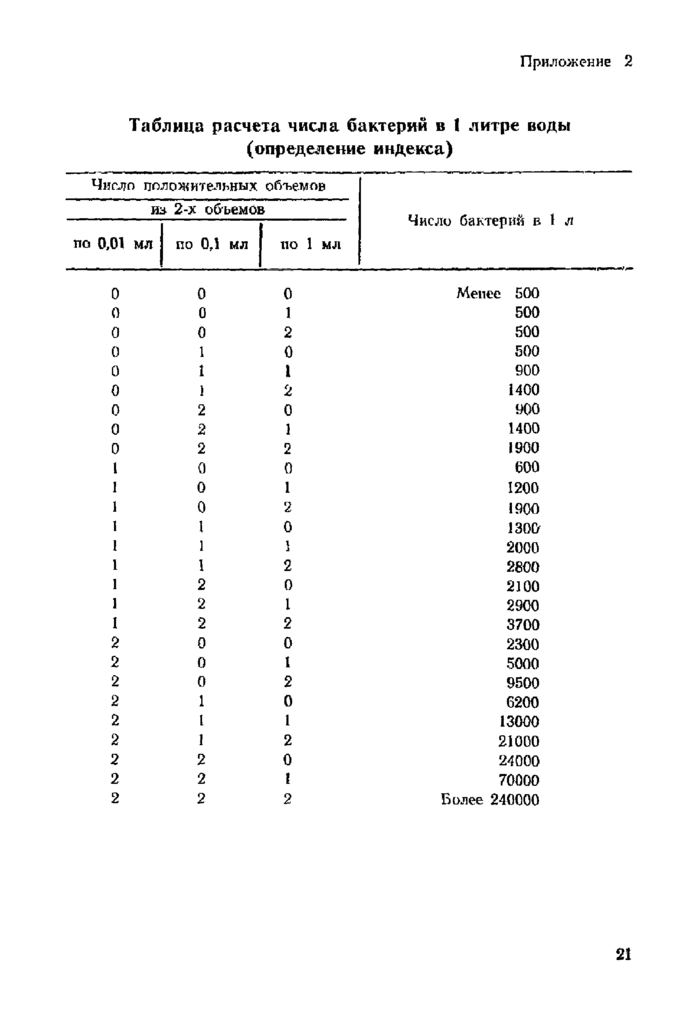
Приложение 2. Таблица расчета числа бактерий в 1 литре воды (определение индекса)
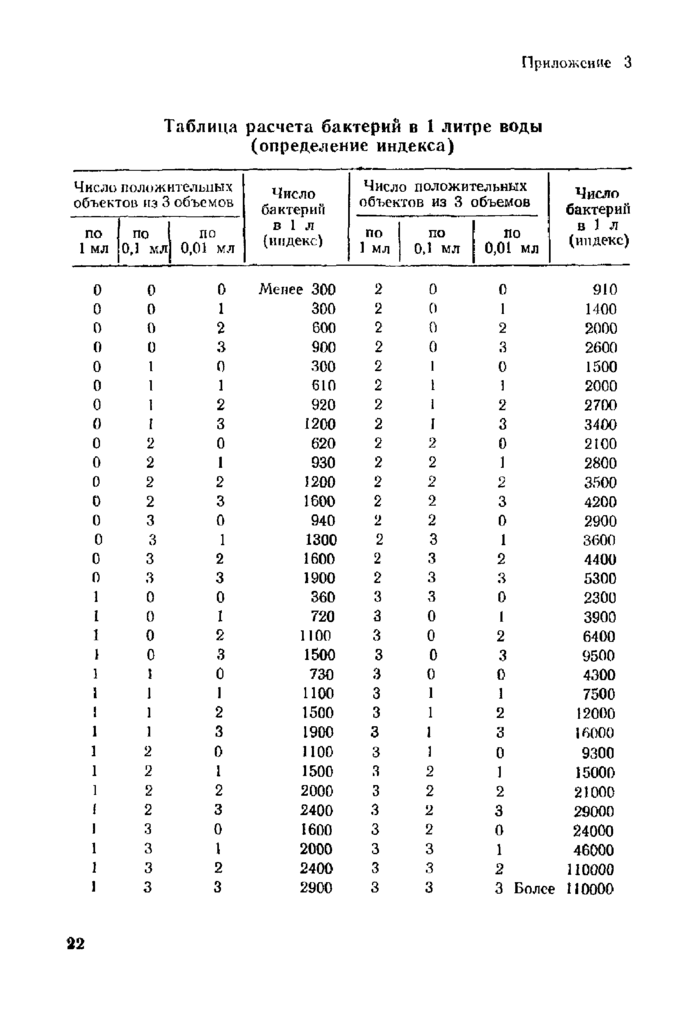
Приложение 3. Таблица расчета бактерий в 1 литре воды (определение индекса)
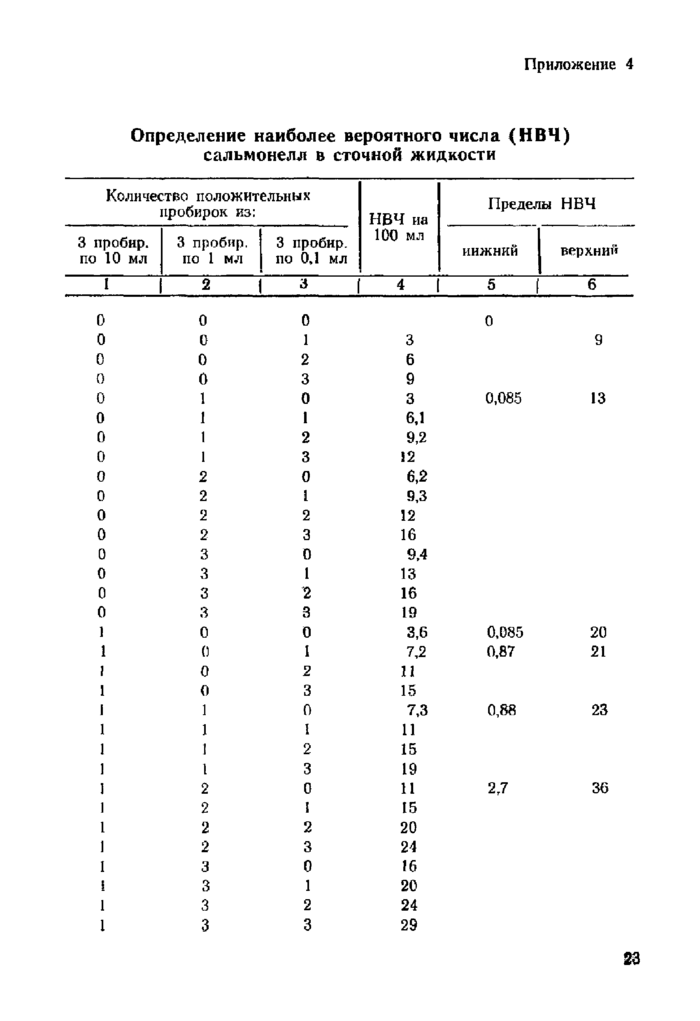
Приложение 4. Определение наиболее вероятного числа (НВЧ) сальмонелл в сточной жидкости
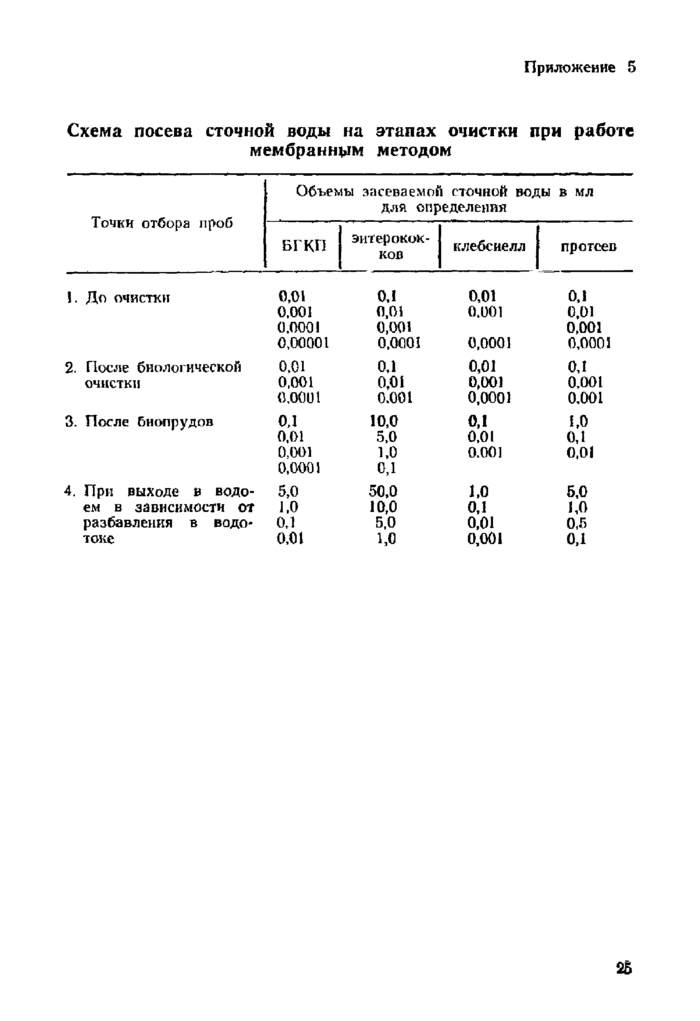
Приложение 5. Схема посева сточной воды на этапах очистки при работе мембранным методом
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 02.01.1984 | Утвержден | Минздрав СССР | 2959-84 |
|---|---|---|---|
| Разработан | Московский НИИ гигиены им. Ф.Ф. Эрисмана | ||
| Разработан | Саратовский НИИ сельской гигиены | ||
| Разработан | Таллинский НИИ микробиологии, эпидемиологии и гигиены |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
стр. 20
стр. 21
стр. 22
стр. 23

стр. 24
стр. 25

стр. 26
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР ГЛАВНОЕ САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОЕ УПРАВЛЕНИЕ
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОСУЩЕСТВЛЕНИЮ САНИТАРНО-МИКРОБИОЛОГИЧЕСКОГО КОНТРОЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ В РАЙОНАХ РАЗМЕЩЕНИЯ ПТИЦЕВОДЧЕСКИХ ПРЕДПРИЯТИИ
Москва — 19S4
.Методические рекомендации разработаны Саратовским НИН сельском гигиены (Махонько Н. И.. Мироненко М. А., Половцев О. П.). Московским НИИ гигиены им. Ф. Ф. Эрнсмаиа (Влидавсц В. В., Трухина Г. М.) и Таллинским НИИ микробиологии, эпидемиологии и гигиены СКзльслайд Л. И.).
Рекомендации предназначены для научно-исследовательских и практических учреждений гигиенического профиля, занимающихся изучением влияния птицеводческих предприятий на окружающую среду.
цочвы, размер образна должен! быть равным 30X30X3 см и т. гг
Отбор поверхностных проб почвы осуществляется в каждой выбранной точке с помощью небольшой прикопки размером 0,2Х0,ЗХ0,2 м; в среднем с глубины 5 25 см заби
рается проба почвы п количестве 200 г.
Пробы почвы для бактериологических исследований помещают в банки с притертыми пробками, матерчатые или брезентовые стерильные мешки. Каждой пробе присваивают номер согласие) схематическому чертежу изучаемой территории объекта,
3.4. Пробы почвы с глубины более 0,5 м отбирают с помощью бура Некрасова. При бурении скважин глубиной более 2 м штангу бура наращивают на глубину заданной отметки. Для отбора проб на участках с суглинистыми почвами используют винтовой бур. ] 1ерсд каждым спусканием бура в скважину проводят фламбирование наконечника и штанги бура, а также устья скважины.
3.5. Приготовление среднего образца проб почвы для бактериологического исследования проводят на стерильном плотном листе бумаги. Пробы почвы тщательно перемешивают стерильным шпателем, при этом отбрасывают посторонние предметы (камни, стекла и пр.). Если проба почвы однородна по составу, допускается тщательное се перемешивание в доставленных в лабораторию банках.
Перед посевом почву диспергируют. С этой целью ее просеивают через стерильное сито диаметром 3 мм. При просеивании почвы сито покрывают сверху стерильной бумагой. Торфяную почву, содержащую значительное количество органических веществ, предварительно растирают в ступке. Неперегнившую растительную массу отбрасывают.
Из средней пробы берут навеску почвы в 10 г, которую используют для бактериологического исследования.
3.6. Загрязненность почвы определяют с помощью прямых и косвенных санитарных показателей.
К прямым санитарным показателям относятся: коли-ин-декс (коли-титр), микробное число (титр анаэробов, протей, патогенные серотипы кишечной палочки, сальмонеллы),
К косвенным санитарным показателям следует отнести общую численность почвенной микрофлоры, количество акти-номицетов и грибов.
3.7. Определение прямых и косвенных показателей загрязненности почвы проводят в соответствии с методиками, изложенными в «Методических указаниях по санитарно-микробиологическому исследованию почвы», М., 1977 г.
и
3.8. Определение общей численности почвенной микрофлоры проводят методом: прямой микроскопии почвы (метод капилляроскопии по Перфильеву и Габбе с последующей люминесцентной или электронной микроскопией), или по методу С. М. Виноградской в модификации О. ГГ Шульгиной. Приведенные методы определения общего количества почвенной микрофлоры учитывают использование как специальной сложной аппаратуры (электронный микроскоп), так и общепринятых методов в зависимости от оснащенности лабораторий.
При невозможности использования метода прямой микроскопии проводит посев почвы и учет микроорганизмов на средах, в состав которых входят почвенные экстракты или вытяжки,
3.9. Для учета почвенных актиномицетов и грибов используют те же методы посева (крахмально-аммиачный агар, агар Вексмана, при учете грибов — сусло-агар или минеральная среда Чапека).
3.10. Аммонифицирующие микроорганизмы определяют путем посева материала на МГ1А, а при необходимости — на жидкие пептонные среды (мясопептонный бульон, пептон-пая вода с индикаторными бумажками).
На МПА результаты выражаются в количестве бактерий на 1 г почвы. Титр аммонифицирующих микроорганизм мов определяют по последней пробирке, в которой еще обнаруживается аммиак (на 10-е сутки) после инкубации в термостате при температуре 25—30° С.
IV. САНИТАРНО-МИКРОБИОЛОГИЧЕСКИЙ АНАЛИЗ СТОЧНЫХ вод
4.1. Отбор, хранение и транспортировка проб сточной воды.
4.ГГ Отбор проб сточной воды проводится санитарным врачом, осуществляющим надзор за эксплуатацией птицеводческих комплексов, его помощниками или специально инструктированным по методике отбора проб лицом.
4.1.2. При текущем санитарном надзоре пробы отбирают в точках после механической очистки на очистных сооружениях и при спуске воды в водоем. В последней точке качество воды должно соответствовать требованиям, предъявляемым ГОСТ 17.1.502-80 «Гигиенические требования к зонам рекреации водных объектов» по данному водоему.
При выборочном контроле для оценки эффективности очистных сооружений в целом, пробы отбирают на каждом
12
этапе очистки сточных жидкостей (например, до поступления в аэротенки, после каждого аэротенка, после биопрудов, на выходе в водоем и после полного смешения с водой водоприемника) и их количество зависит от цели исследования.
4.1.3. Пробу жидкости отбирают с соблюдением правил стерильности: в стерильную посуду, которая прикрепляется к батометру. Посуду открывают непосредственно перед отбором, снимая пробку вместе со стерильным колпачком, во время отбора пробка- и горлышко не должны с чем-либо соприкасаться. После наполнения емкость закрывают стерильной пробкой, обеспечивающей герметичность (корковой, притертой, резиновой и т. п.). Загрязненная часть батометра и наружная часть флакона обрабатываются ватным тампоном, смоченным 70—06° спиртом; если флаконы термостойкие — то над пламенем горелки, я закрывают стерильным колпачком. Посуду с пробами доставляют в сумках-холодильниках или в ящиках с теплоизолирующей прокладкой.
4.1.4. Объем пробы зависит от цели исследования.
4.1.5., Каждая проба должна сопровождаться документом, где четким почерком должно быть отражено:
— название птицефабрики, фермы или хозяйства;
— точное наименование точки отбора проб;
— подчеркнуть особые обстоятельства при отборе проб, такие как: убой птицы, на прудах утки, пруды покрыты льдом и т. п,;
— время отбора;
— дата отбора;
— фамилия, имя, отчество лица, отобравшего пробу.
4.1.6. Время отбора проб до начала их анализа не
должно превышать 6 часов. Оптимальным временем являются 2 часа. Если срок доставки увеличивается, чтобы сохранять при температуре от +1 до +5° С в резиновых мешках или в специальных аккумуляторах холода, выпускаемых промышленностью с сумкой-термосом ТСП-2.
4.2. Определение числа бактерий группы кишечных палочек (ВГКП).
К бактериям группы кишечных палочек относят грам-отрицательные, не образующие спор палочки, ферментирующие лактозу с образованием кислоты и газа при +37° С в течение 24 часов.
БГПК — показатели степени фекального загрязнения. Число БГКП в сточных жидкостях определяют титрацион-ным методом. Метод мембранных фильтров при большом
13
количестве взвешенных веществ требует применения дополнительного фильтра.
4.2.1. Титрадионный метод.
4.2.1.1. Объем воды для посева.
Объем воды для посева выбирается с таким расчетом, чтобы в минимальных объемах или в наиболее высоком разбавлении получить один или несколько отрицательных результатов. Можно ориентироваться на результаты предыдущих исследований в этих же точках очистных сооружений и на рекомендации таблицы в приложении 1. Учитывая, что степень точности получаемых результатов том выше, чем больше повторностей, выбирают схему посева в 2-х или 3-х параллельных рядах.
4.2.1.2. Выполнение анализа.
Посевы 100,0 и 10,0 мл воды производятся во флаконы и пробирки соответственно с 10,0 и 1,0 мл концентрированной лактозо-пептонной среды, посев 1,0 мл десятикратных разведений вносят в пробирки с 10,0 мл среды нормальной концентрации. Посевы инкубируют при температуре +37± 0,5° С в течение 24 часов.
4.2.1.3. Учет результатов.
Отрицательный результат — полное отсутствие изменения среды или помутнения без образования газа.
Положительный результат — наличие газа в поплавках и «образование кислоты» (желтый цвет).
Из каждой положительной пробирки высев делают на модифицированную среду Эндо (ГОСТ 18963-73 «Вода питьевая»). Посевной материал следует брать с таким расчетом, чтобы получить изолированные колонии. Чашки инкубируют в термостате при +37=ь5° С, в течение 18 часов.
При наличии в среде накоплении помутнения и газа, па среде Эндо характерны* колоний для БГКП (темно-красных с металлическим блеском или без него) дают положительный ответ,
В случае, когда на модифицированной среде Эндо выросли нетипичные колонии, подтверждают принадлежность выросших колоний к БГКП. По 2 колонии каждого вида засевают в среду ВР с лактозой (или полужидкую среду с лактозой) и инкубируют посевы при температуре +37^ С. Через 18 часов инкубации посевов производят учет. При образовании кислоты и газа, хотя бы в одной пробирке, дают положительный ответ на наличие БГКП в исследуемом объеме. При отсутствии изменений среды дают отрицательный ответ.
4.2.1.4. Учет результатов наиболее вероятного числа БГКП на 1 литр производят по таблицам приложения 2 и 3.
4.3, Определение числа энтерококков*
В группу энтерококков входят 2 основных вида; Str. faecalis с биоварами Liquefaciens et b. Zymogenes, имеющие основное индикаторное значение и Str. faecium с биоваром Durans.
Энтерококки — грамм положительные, полиморфные, круглые или слегка вытянутые с заостренными концами клетки, располагающиеся попарно или в короткие цепочки.
В практике санитарно-бактериологических исследований определяют всю группу энтерококков «энтерококки» и «фекальные стрептококки» — Str. faecalis с его вариантами.
Содержание энтерококков в сточной воде в месте выпуска ее в водоем должно соответствовать требованиям, предъявляемым в «Методических указаниях по санитарно-микробиологическому анализу воды поверхностных водоемов», М., 1981 г.
4.3.1. Титрационный метод.
Объем воды для исследований выбирают с расчетом, чтобы в минимальных объемах получить один или несколько отрицательных результатов (приложения 1).
4.3.2. Выполнение анализа.
Объем воды по 100,0 и 10,0 мл засевают в равные объемы щелочно-гголимиксиновой среды двойной концентрации. Посевы производят в параллельных рядах и инкубируют при температуре +37±5°С.
4.3.3. Учет результатов.
Через 48 часов отмечают положительный результат — помутнение или изменение среды в желтый цвет. Нередко в последних положительных пробирках наблюдается изменение цвета в их нижней части, верхняя часть остается без изменения цвета среды.
Из всех положительных пробирок высевают на 4—6 секторов плотной молочно-ингибиторной среды. Через 24— 48 часов инкубации посевов на молочно-ингибиторной среде при температуре +37±0,5°С положительных результатов отмечают виды энтерококков: Str. faecalis — аспидно-чер-ные выпуклые колонии с металлическим блеском, биовар Mquefaeciens — такие же колонии, окруженные зоной просветления с выпадением по перифирии осадка параказеина повышенной мутности. Str. faecium и биовар Durans — серые, мелкие, плоские колонии.
16
Число энтерококков в исследуемой воде определяют по таблицам в приложении 2 и 3.
В качестве плотной среды можно использовать цитрат-азиднуго среду. При посеве из щелочно-полимиксиновой среды на цитрат-азидной среде через 48 часов отмечается рост крупных темно-красных с узким розовым ободком, круглые колонии — Str. faecalis и его биовары. Розовые и бесцветные колонии с небольшим темно-красным центром — Str. faecinm, Str. faecium b. Durans — мелкие темно-красные колонии.
4.4. Определение числа клебсиелл.
В сточной воде определяют род клебсиелл (К1. pneumonia, Ю. oxitoca, К.1. aerogenes, исключая Kl. ozaenae et Kl. rbinosclcromatis). Клебсмеллы—короткие, граммотрица-тсльные полиморфные палочки, способные образовывать ясно выраженную капсулу.
4.4.1. Титрациоиный метод.
4.4.1.1. Объем воды выбирают для исследования с расчетом, чтобы в минимальных объемах получить один или несколько отрицательных результатов (приложение 1).
4.4Л.2. Объем сточной соды 10,0 мл засевают в равные объемы двойной концентрации среды К-1.1 мл и разведения сточной воды засевают в 5 мл среды обычной концентрации. Посевы производят в 2—3 параллельных рядах. Посевы инкубируют при +37° С в течение 24 часов.
4.4.1.3. Полное отсутствие роста и изменения среды К-1 дает отрицательный ответ. Помутнение среды и изменение цвета в синий, а в дальнейшем в желтый, дает положительный результат. Предварительное определение числа клебсиелл в среде К-1 приводят по таблицам (в приложении 2—3). Из каждой пробирки, где отмечено изменение цвета и помутнение среды и из последующего разведения, в котором не обнаружен рост, делают высев на Va чашки с дифференциальной средой К-2. Посевы со средой К-2 инкубируют при 4-37° С 24 часа. Окончательный результат производят на среде К-2, где отмечается рост крупных бледно-желтых слизистых колоний с ровными краями. Иногда наблюдается рост мелких зеленоватых и бесцветных колоний, которые не учитываются. В сомнительных случаях идентификацию колоний производят по тестам: определение подвижности и орнитин-декарбоксилазы. Клебсиеллы неподвижны, не декарбоксилируют орнитин.
В среду с орнитнном засевают исследуемые колонии и сверху заливают стерильным вазелиновым маслом. Посевы инкубируют в термостате при температуре +37° С в течение
24 часов. Изменение цвета сред в желтый как и в контроле дает отрицательный результат (орнитин не декарбоксили-руется), фиолетовый цвет среды — положительный результат.
4.5. Определение числа протеев.
В род Proteus включают четыре основных вида: Рг. vulgaris, Pr. mirabilis, Pr. morgana, Pr. rettgeri.
Наибольшее индикаторное значение имеют: Pr. mirabilis et Pr. morganii.
4.5.1. Титрациониый метод.
4.5.1 Л. Объем воды для исследования выбирают с расчетом, чтобы в минимальных объемах получить одни или несколько отрицательных результатов (приложение 1).
4.5.1.2. Выполнение анализа.
Объемы воды 100,0 и 10,0 мл засевают в равные объемы среды II—I двойной концентрации, а 1 мл разведения сточной воды засевают в 5 мл среды И—I обычной концентрации в 2-х или 3-х параллельных рядах. Посевы инкубируют при температуре +371 С 24 часа.
4.5.1.3. Учет результатов.
Полное отсутствие роста и изменения цвета среды II—I дает отрицательный ответ. Помутнение среды или изменение цвета в синий (в присутствии сопутствующей микрофлоры — в желтый) дает положительный ответ.
Из каждой пробирки, где отмечены признаки роста, и из одной пары последующего разведения, делают высев на '/г чашки с дифференциальной средой П-2. Посевы инкубируют при 4-37° С 24 часа.
На среде П-2 Pr. vulgaris образует крупные, желтые с черным центром колонии, Pr. mirabilis — малиновые с черным центром колонии, Pr. morganii et Providencia — малиновые колонии без центра, Pr. rettgeri — желтые без центра колонии.
Определение Pr. vulgaris и Pr. mirabilis по характеру колонии на П-2, в 96—98% совпадают с последующей идентификацией и поэтому в дальнейшем подтверждении не нуждаются. В тех случаях, когда необходимо определить вид Pr, morganii, Pr. rettgeri — колонии без черного центра, проводят идентификацию по тестам: определение диаминазной активности, инозита, адонита, наличие орнитин-дскарбокил азы.
Определение числа протеев проводят согласно таблицам расчета числа бактерий в 1 л воды (приложения 2 и 3).
4.6. Определение сальмонелл.
На птицеводческих предприятиях из патогенных бактерий представляют интерес только сальмонеллы. Шигеллеза-
17
ми куры не болеют. Обнаружение в сточной воде птицефабрики новых сероваров сальмонелл может служить предвестником эпидемической опасности для птиц.
4.вЛ. Количественное определение.
4.6.1.1. Ход исследования.
В качестве накопительной среды применяется магниевая среда. Посевы производят в 3-х параллельных рядах: с объемами воды 100,0 мд, 10,0 мл, 1,0 мл. Объемы воды 100,0 и 10,0 мл засевают в равные объемы магниевой среды двойной концентрации, объемы 1,0 и 0,1 мл в среду обычной концентрации. Посевы инкубируют при Т°С 37±0,5 в течение 24 часов. Из всех объемов накопительной среды делают посев на висмут-сульфитный агар. Чашки инкубируют в термостате при +37а С в течение 24 часов. Колонии сальмонелл на виемут-сульфитном агаре круглые, черные с сероватым металлическим ободком, вызывающие потемнение среды под колонией. При отсутствии роста через 24 часа чашки с посевами оставляют в термостате еще на 24 часа. Для идентификации сальмонелл с каждой чашки снимают по 4—5 колоний на среду Росселя илг Олькеницкого с целью подтверждения принадлежности выделенных бактерий к роду сальмонелл (I этап). Окончательное определение сероваров проводится согласно требованиям, предъявляемым в «Методических указаниях по санитар но-микробиологическому анализу поверхностных водоемов», М., 1981
(II этап идентификации).
4.6.2. Учет сальмонелл.
Наиболее вероятное число сальмонелл рассчитывается по таблице в приложении 4.
4.7. Определение числа БГКП, энтерококков, клебсиелл и протеев методом мембранных фильтров.
Сущность метода заключается в концентрировании бактерий из определенного объема анализируемой сточной воды на мембранные фильтры, выращивании их на соответствующих селективных средах, дифференцировании выросших колоний и подсчета количества бактерий в 1 л воды.
4.7.1. Объем сточной воды выбирают в зависимости от степени предполагаемого загрязнения с таким расчетом, чтобы не менее чем на 2-х фильтрах выросли изолированные колонии в количестве от 30 до 50, но не менее 3—4-х десятикратных ее объема. При этом можно ориентироваться на результаты предыдущих исследований и на рекомендации таблицы в приложении 5.
4.7.2. Выполнение анализа.
Для фильтрования используют мембранные фильтры со средним диаметром пор 0,5 ммк. При наличии взвешенных веществ следует дополнительно использовать фильтр № 6 (4 ммк). Подготовку мембранных фильтров к анализу осуществляют в соответствии с инструкцией завода изготовителя. Фильтрование воды выполняют с помощью специальных приборов с соблюдением правил стерильности» Фильтруют сначала меньшие, а затем большие объемы воды через 1 фильтровальный аппарат, меняя фильтры. После окончания фильтрования мембранный фильтр снимают при сохранении вакуума для удаления излишка влаги на нижней стороне фильтра. Фильтр переносят на соответствующие селективные среды (Эндо, молочно-ингибиторную среду или среду Сланеца-Бертли, К2, П-2) и добиваются полного прилегания его к среде без пузырьков воздуха. На одну чашку можно поместить несколько фильтров. Если для фильтрования используются 2 фильтра, то после окончания фильтрования фильтры переносят на среды раздельно и при выведении результатов анализа учитывают колонии, выросшие на обоих фильтрах.
Чашки с посевом помещают в термостат при температуре +37° С в течение 18—24 часов.
4.7.3. Учет результатов.
Для учета выбирают фильтры, на которых выросли изолированные колонии и число колоний не более 30—50. На среде Эндо учитывают все темнокрасные с металлическим блеском колонии и без него, а также розовые слизистые крупные выпуклые, розовые с темнокрасным центром окси-дазоотрицательные колонии.
На молочно-ингибиторной среде считают все аспидно-черные и серые колонии или на среде Сланеца-Бертли все красные и розовые колонии. На среде К-2 учитывают все крупные слизистые желтые колонии. На среде П-2 все виды протеев: малиновые с черным центром, желтые с темным центром, малиновые без центра, желтые без центра. Длп дальнейшей идентификации снимают 2—3 колонии каждого подсчитанного типа.
Результаты анализа выражают в виде числа БГКП, энтерококков, клебсиелл, протеев в 1 л воды. Суммируют количество подсчитанных колоний и делят на объем воды, профильтрованный через эти фильтры, выраженный в литрах.
19
Приложение I.
Схема посева сточной воды на этапах очистки при работе титрационным методом
|
Объемы засеваемой сточной воды( мл) при определении | |||||||||||||||
|
го
«УТВЕРЖДАЮ»
Начальник Главного саантарио-эпидемиологического управления Минздрава СССР
В. Е. Ковш ил о 2 января 1984 г.
№ 2959-84
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
по осуществлению санитарно-микробиологического контроля окружающей среды в районах размещения птицеводческих
предприятий
ВВЕДЕНИЕ
XXVI съезд КПСС одобрил планомерную политику партии и правительства по дальнейшему развитию специализации и концентрации сельскохозяйственного производства. В специальных постановлениях ЦК КПСС и Совета Министров СССР нашла свое отражение программа строительства птицеводческих комплексов. Концентрация, укрупнение и перевод птицеводства на промышленную основу выдвинули перед гигиенистами новые задачи, связанные с изучением и разработкой рекомендаций по предупреждению загрязнен кия окружающей среды.
Проведенные исследования показали, что птицеводческие комплексы являются мощными источниками бактериального загрязнения окружающей среды в том числе патогенными и условно патогенными микроорганизмами.
В связи с высоким уровнем бактериального загрязнения на птицефабриках (ПТФ) и на территориях, прилегающих к ним, является необходимым разработка методических приемов санитарно-микробиологического исследования объектов окружающей среды.
Большое значение приобретает и изучение вопросов интенсивности и дальности распространения микрофлоры как на территории птицефабрик, так и в районах их размещения, с учетом основных климатических факторов. Дальнейшего уточнения требует вопрос определения видового состава микроорганизмов как санитарно-показательных для объектов окружающей среды в районах размещения птицефабрик.
При оценке уровня и характера неблагоприятного воздействия ПТФ на человека следует учитывать широкие воз-
з
Приложение 2
Таблица расчета числа бактерий в 1 литре воды (определение индекса)
|
Число положительных объемов | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
21
можности непосредственного бытового, хозяйственного и профессионального контакта людей с большими количествами птиц на малых пространствах птицефабрик.
Только комплексные мероприятия сельскохозяйственного, инженерного, технического, планировочного характера, включающие санитарно-защитное зонирование, очистку сточных вод и вредных выбросов птицефабрик, обработку помета с целью его обеззараживания, обезвреживания и дезодорации, позволят резко снизить микробное загрязнение объектов окружающей среды в районах размещения крупных птицеводческих комплексов.
Предлагаемые «Методические рекомендации..,» являются первым методическим документом по вопросам изучения загрязнения окружающей среды от птицеводческих комплексов и позволяют оценить влияние птицеводческих предприятий на окружающую среду и могут быть использованы при проведении санитарно-микробиологических исследований НИИ гигиенического профиля, а также в процессе, санитарного надзора органами и учреждениями санитарно-эпидемиологической службы.
I. САНИТЛРНО-МНКРОБИОЛОГИЧЕСКИП АНАЛИЗ ВОЗДУШНОЙ СРЕДЫ
1.1. Формирование бактериальных загрязнений воздушной среды производственных помещений и атмосферного воздуха в районах птицеводческих предприятий.
1.1.1. Поступление микроорганизмов в воздушную среду производственных помещений птицефабрик, т. с. в состояние аэрозоля, происходит следующими путями:
— через содержащие бактерии пылевые частицы. Основная часть пыли — это мелкие частицы помета, остатки корма, обломки пера и эпителия. Пыль является естественным резервуаром и основным путем миграции микроорганизмов. Между количеством пыли и бактерий в воздухе наблюдается параллелизм;
— через органы дыхания птиц, в слизистой оболочке которых постоянно находятся микроорганизмы.
Количество микроорганизмов в воздухе птичников зависит от вида, возраста, количества и концентрации птиц в птичниках, способов содержания и кормления, планировочных решений ПТФ, вентиляции, температуры и влажности воздуха, сезона года и других факторов.
4
1.1.2. Воздух выполняет роль фактора, постоянно дей-ствующего на рассеивание и временное пребывание в нем микрофлоры.
Воздух из производственных помещений, загрязненный продуктами жизнедеятельности птиц, вредными газами и микроорганизмами, поступает в атмосферный воздух и распространяется в виде бактериальных аэрозолей. Распространение загрязнений в атмосферном воздухе зависит от метеорологических условий, времени суток, планировки и застройки, мощности предприятия и системы вентиляции.
Споровые формы микробов в состоянии аэрозоля могут распространяться на десятки километров, однако с удалением биологического аэрозоля от очага его образования концентрация микроорганизмов уменьшается и тем самым вероятность загрязнения снижается.
1.2. Методы изучения бактериального загрязнения атмосферного воздуха.
1.2.1. Изучение состояния атмосферного воздуха в районах размещения птицеводческих комплексов проводится в двух основных направлениях:
а) путем натурного наблюдения за бактериальным загрязнением воздуха в ближайшем населенном пункте;
б) путем изучения зонального распространения бактериального загрязнения воздуха от комплекса.
1.2.2. В атмосферном воздухе определяются; общая микробная обсемененность, бактерии группы кишечных палочек (БГКП), энтерококки,
стафилококки,
сальмонеллы.
1.2.3. Определение ведется по методам, изложенным в руководстве «Методы санитарно микробиологического исследования объектов окружающей среды» под редакцией Г. И. Сидоренко, М., 1978 г.
1.2.4. Самым старым и простейшим способом выделения микроорганизмов из воздуха является метод седиментации или осаждения (метод Коха). Открытую чашку Петри с питательной средой выставляют на 5—10 минут, после чего ее закрывают крышкой и переносят в термостат для выращивания и их последующего изучения. Получить точное количественное выражение таким способом невозможно, т. к. нельзя установить, из какою объема воздуха выделяются соответствующие микроорганизмы. Методом осаждения определяются преимущественно крупные частицы. Но благодаря единому времени экспозиции можно получить ориенти-
5
ровочную характеристику микрофлоры на различных участках.
1.2.5. Принудительное осаждение бактерии с помощью ударного действия струи воздуха (щелевой прибор Ю. А. Кротова) — позволяет определить1 2 учитывая количество выросших колоний и количество исследованного воздуха, содержание микроорганизмов в 1 м3 воздуха2.
1.2.6. Метод электроосаждения при помощи пробоотбор-ника аэрозоля ба«териологического ПАБ-1 позволяет улавливать биологический аэрозоль с целью дальнейшего исследования проб на общую бактериальную обсемененность и наличие патогенных и условно патогенных бактерий. Принцип действии его основан на осаждении электрически заряженных частиц в поле высокого напряжения. Осаждение частиц может производиться как на плотную, так и на жидкую питательную среду, что дает возможность улавливать из исследуемого объема воздуха практически все виды аэромикрофлоры.
1.2.7. При проведении исследований бактериального загрязнения атмосферного воздуха в районах размещения птицеводческих комплексов (изучении зонального распространения загрязнения) отбор проб воздуха следует проводить с подветренной стороны от комплексов (в факеле загрязнения) и контрольной точке с наветренной стороны вне зоны его влияния.
1.2.8. Точку отбора проб следует располагать на различных расстояниях от комплексов (через каждые 100, 200, 500 метров и т. л. в зависимости от мощности объекта) 2.
1.2.9. Отбор проб рекомендуется проводить на высоте не менее 40—50 см от земли и, желательно, одновременно на различных расстояниях в 2—3 точках с подветренной стороны и в контрольной точке. Во время отбора проб исследователь постоянно наблюдает за направлением факела загрязнения.
1.2.10. Отбор аспирационных проб проводится лосезонно, В период исследований пробы отбираются ежедневно I — 2 раза в сутки с тем, чтобы охватить периоды наиболее интенсивного загрязнения атмосферного воздуха.
1.2Л1. Время отбора проб и количество Исследуемого воздуха зависит от точки отбора и прибора, с помощью которого производится отбор. При отборе проб воздуха с высоким содержанием микрофлоры (например, внутри птичника) количество пропущенного воздуха должно быть порядка 25 л, т. е, при отборе прибором Кротова экспозиция не должна превышать 1 минуты, с прибором ПАБ-1 не более 10 секунд с последующим пересчетом на 1 Если количество воздуха превысит 25 л, то на чашке наблюдается сплошной рост микроорганизмов, не позволяющих произвести количественный подсчет колоний.
] .2.12. При изучении общей микробной обсемененности атмосферного воздуха следует отобрать 100 л воздуха с последующим пересчетом количества микробов в 1 м3, Посев воздуха производится на 2% мясопептонный агар (МПА).
1.2.13. Для изучения патогенной и условно патогенной микрофлоры (БГКП, энтерококки, стафилококки, сальмонеллы) необходимо увеличить экспозицию и пропустить через прибор не менее 500—600 л воздуха.
1.2.14. Для выявления в атмосферном воздухе стафилококков можно применять молочно-желточио-солевой агар или 5% кровяной агар. При проведении исследований воздуха на энтерококки, БГКП, сальмонеллы используются элективные среды: молочно-ингибиторная (МИС), ЭНДО, висмут-сульфит агар.
1.2.15. Подсчет колоний и изучение качественного состава микрофлоры атмосферного воздуха производится после 24-часовой инкубации при температуре +373 С с дополнительным выращиванием при комнатной температуре в течение 24 часов.
1.2.16. Для оценки состояния атмосферного воздуха в данной точке необходим отбор в течение нескольких дней не менее 8-10 проб на каждый вид микроорганизмов. Если при этом в 2-х пробах и более будут найдены микроорганизмы в количествах, превышающих контрольные, то загрязненность воздуха п данной точке следует считать не соответствующей гигиеническим требованиям. Сопоставление результатов с полученными в контрольной точке, т. е, вис зоны влияния ПТФ, является обязательным.
1.2.17. При обработке результатов исследования загрязнения атмосферного воздуха от птицеводческих комплексов необходимо выявить следующие данные:
7
максимально разовые, средние и минимальные Количества микроорганизмов на различных расстояниях от комплекса;
— процент положительных проб по отношению к общему числу проб (и отдельно по расстояниямJ по каждому виду микрофлоры;
— влияние метеорологических факторов на степень загрязнения атмосферного воздуха:
— влияние различных режимов работ и предприятии на степень загрязненности атмосферного воздуха;
— влияние загрязнения атмосферного воздуха на санитарно-бытовые условия и здоровье населения (инфекционные заболевания, аллергозы и др.);
— величину санитарпо-защитной зоны (проектную и фактическую).
На основании этих данных разрабатываются мероприятия по уменьшению загрязнения атмосферного воздуха.
1.2.18. Определение границ ожидаемого распространения загрязнения.
В качестве ориентировочного метода (перед проведением натурных исследований или при невозможности их осуществления) может быть рекомендован расчетный метод определения границ распространения загрязнения атмосферного воздуха от птицеводческих комплексов различной мощности.
Для определения границ ожидаемого распространения загрязнений от птицеводческих комплексов могут быть применены расчетные формулы:
1) ХИ1|11 —323 + 4,781 -М — для яичного направления.
ХЯ||[, — распространение загрязнений атмосферного воздуха (в метрах).
М —- мощность птицефабрики (в тыс. кур).
2) Х6р.= 0,431 4 0,782 * — для ПТФ бройлерного направления.
ХСр. распространение загрязнений атмосферного воздуха (в километрах).
М — мощность птицефабрики (в млн. бройлеров).
323; 4.781; 0,431; 0,782 — вычисленные при помощи
ЭВМ параметры формул.
В
И- САНИТАРНО-МИКРОБИОЛОГИЧЕСКИИ КОНТРОЛЬ СНЕЖНОГО ПОКРОВА
В зимний период производится санитарно-микробиологн-ческие исследования снежного покрова в районах размещения ПТФ.
2.Г Отбор, храпение и транспортировка снега.
2.1. Г Отбор проб снега осуществляется санитарным врачом, бактериологом или специально инструктированным лицом по методике отбора проб.
2.1.2. Пробы снега отбирают на территории самой ПТФ и до границ ожидаемого распространения загрязнений (и. 1.2.18) с подветренной стороны, количество проб зависит от цели исследования.
2.1.3. Пробу снега отбирают с соблюдением правил стерильности в стерильную посуду стерильной ложкой. Отбор проб осуществляется методом «конверта», т. е. в пяти точках, на глубине от 0 до 5 см., на площади 1 м2. Посуду с пробами доставляют в сумках холодильниках или в ящиках с термоизолирующей прокладкой.
2.1.4. Объем пробы снега должен быть не менее 0,5 л.
2.1.5. Каждая проба должна сопровождаться документом, где должны быть четко отражены положения, изложенные в и. 4,1.5. настоящих рекомендаций.
2.1.6. Время отбора проб до начала исследований не должно превышать 6 часов.
2-2. Определение общего микробного числа.
2.2.1. Доставленные пробы оставляют при комнатной температуре до полного таяния снега.
2.2.2. Из каждой пробы берется не менее 2-х разведений для посева. Каждое разведение в отдельности засевают параллель по на 2-х чашках Петри с мясопептопным агаром. В стерильные чашки заранее наливают по 1 мл растаявшего снега, а затем в каждую чашку наливают 15 мл расплавленного и остуженного до 45° С МПА, хорошо перемешивают, дают агару застыть и ставят в термостат при 37е С па 48 часов. По истечении срока инкубации подсчитывают общее число выросших на 2-х чашках одного разведения колоний, выводят среднеарифметическое число и затем подсчитывают количество колоний, приходящихся на 1 г снега.
2.3. Определение титра бактерий группы кишечных палочек.
2.3.1. Проводится по методикам, приведенным в пункте
4.2. настоящих рекомендаций.
9
2.4. Дополнительные исследования*
2.4.1. Определение числа энтерококков.
2.4.2. Определение сальмонелл.
Определение энтерококком и сальмонелл проводятся по методикам, изложенным в плг. 4.3. и 4.6. настоящих методических рекомендаций.
III. С A11ИТЛ Р110 - МIIК РО БИОЛОГ И ЧЕСКИ П КОНТРОЛЬ
ПОЧВЫ
3.1. Изучение интенсивности загрязнения почвы проводят па основании показателей исследованных проб с опытных и контрольных земельных участков. Контролем могут служить земельные участки, на которые ранее не вносились отходы животноводческих комплексов, не проводился выпас скота и имеющие одинаковый природный, по отношению к опытным, состав почвы. Выбор опытного участка для изу-чения интенсивности загрязнения почвы проводится в зависимости от характера и свойств загрязнений и почвенноклиматических условий. При этом, основными требованиями являются:
— отсутствие на территории опытного участка дополнительных посторонних источников загрязнения;
— образцовое санитарное состояние участка; соответствующая высота строения «зеркала» грунтовых вод (не менее 1,5) от поверхности земли (требование ОНТП-17-81).
3.2. При гигиенической оценке степени загрязнения почвы больших площадей территорий отбор проб проводят согласно следующим рекомендациям: па каждые 100 га поля намечают к отбору проб 6—7 земельных участков площадью 25 м2. При выраженном пересеченном рельефе количество намеченных участков увеличивается до 8—10. При небольшой площади полей (до 0,3 га) отбор опытных и контрольных проб почвы проводят на участках по 25 м2. В каждой из намеченных точек пробы почвы отбирают но «конверту» или «диагонали», из которых и составляется средняя проба.
3.3. Отбор почвы с пахотного поля (0—30 см) проводят в каждой из намеченных точек участка. Предварительно профламбированным (обожженным огнем) инструментом (лопата, ножи и пр.) выкапывают приямок (шурф) сечением 0,3X0,3 м и глубиной 0,3 м. На поверхности одной из стенок вырезают образец, размер которого обусловлен заданной навеской. Так, если необходимо отобрать 200 г
ю
1
* Отбор проб воздуха па агар возможен при температуре воздуха выше (FC.
2
При отборе проб воздуха вдали от источников электропитания (220 В) рекомендуется применение переоборудованных (лод 12 В постоянного тока) аппаратов Кротова и ПОВ-1.