МУК 4.2.2495-09
Определение чувствительности возбудителей опасных бактериальных инфекций (чума, сибирская язва, холера, туляремия, бруцеллез, сап, мелиоидоз) к антибактериальным препаратам
Купить МУК 4.2.2495-09 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания предназначены для лабораторий, имеющих разрешение на работу с возбудителями опасных инфекционных болезней I - II и II - IV групп патогенности, противочумных станций, противочумных институтов и специализированных противоэпидемических бригад ФГУЗ противочумных институтов.
Оглавление
1. Область применения
2. Нормативные и методические документы
3. Общие сведения
4. Обоснование для исследования чувствительности всех выделенных культур возбудителей ООИ к антибактериальным препаратам
5. Методы определения чувствительности возбудителей ООИ к антибактериальным препаратам
5.1 Общая характеристика методов
5.2 Выбор контрольных штаммов
5.3 Выбор питательных сред
5.4 Требования к культуре, используемой для инокуляции
5.5 Выбор антибактериальных препаратов
5.6 Интерпретация результатов исследования
5.7 Метод серийных разведений в агаре
5.8 Диско-диффузионный метод
6. Определение чувствительности чумного микроба (Yersinia pestis) к антибактериальным препаратам
6.1 Контрольные штаммы
6.2 Питательные среды
6.3 Антибактериальные препараты
6.4 Посевная доза, инокуляция, инкубация
6.5 Критерии оценки чувствительности/устойчивости чумного микроба к антибактериальным препаратам
7. Определение чувствительности возбудителя сибирской язвы (Bacillus anthracis) к антибактериальным препаратам
7.1 Контрольные штаммы
7.2 Питательные среды
7.3 Антибактериальные препараты
7.4 Посевная доза, инокуляция, инкубация
7.5 Критерии оценки чувствительности/устойчивости сибиреязвенного микроба к антибактериальным препаратам
8. Определение чувствительности холерного вибриона (Vibrio cholerae) к антибактериальным препаратам
8.1 Контрольные штаммы
8.2 Питательные среды
8.3 Антибактериальные препараты
8.4 Посевная доза, инокуляция, инкубация
8.5 Критерии оценки чувствительности/устойчивости холерного вибриона к антибактериальным препаратам
9. Определение чувствительности туляремийного микроба (Francisella tularensis) к антибактериальным препаратам
9.1 Контрольные штаммы
9.2 Питательные среды
9.3 Антибактериальные препараты
9.4 Посевная доза, инокуляция, инкубация
9.5 Критерии оценки чувствительности/устойчивости туляремийного микроба к антибактериальным препаратам
10. Определение чувствительности бруцелл (Brucella spp.) к антибактериальным препаратам
10.1 Контрольные штаммы
10.2 Питательные среды
10.3 Антибактериальные препараты
10.4 Посевная доза, инокуляция, инкубация
10.5 Критерии оценки чувствительности/устойчивости возбудителя бруцеллеза к антибактериальным препаратам
11. Определение чувствительности возбудителей сапа и мелиоидоза (Burkholderia mallei и Burkholderia pseudomallei) к антибактериальным препаратам
11.1 Контрольные штаммы
11.2 Питательные среды
11.3 Антибактериальные препараты
11.4 Посевная доза, инокуляция, инкубация
11.5 Критерии оценки чувствительности/устойчивости возбудителей сапа и мелиоидоза к антибактериальным препаратам
Приложение. Питательные среды для определения чувствительности возбудителей особо опасных инфекций бактериальной природы к антибактериальным препаратам
Список сокращений
| Дата введения | 01.06.2009 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
Организации:
- Федеральный закон 52-ФЗ О санитарно-эпидемиологическом благополучии населения
- МУ 3.1.2007-05 Эпидемиологический надзор за туляремией
- МУ 3.4.1030-01 Организация, обеспечение и оценка противоэпидемической готовности медицинских учреждений к проведению мероприятий в случае завоза или возникновения особо опасных инфекций, контагиозных вирусных геморагических лихорадок, инфекционных болезней неясной этиологии, представляющих опасность для населения Российской Федерации и международных сообщений
- СП 3.1.1086-02 Профилактика холеры. Общие требования к эпидемиологическому надзору за холерой
- МУК 4.2.2218-07 Лабораторная диагностика холеры
- СП 3.4.2318-08 Санитарная охрана территории Российской Федерации
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21
стр. 22
стр. 23
стр. 24
стр. 25
стр. 26

стр. 27

стр. 28

стр. 29
стр. 30
Государственное санитарно-эпидемиологическое нормирование _Российской Федерации_
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Определение чувствительности возбудителей опасных бактериальных инфекций (чума, сибирская язва, холера, туляремия, бруцеллез, сап, мелиоидоз) к антибактериальным препаратам
Методические указания МУК 4.2.2495—09
Издание официальное
Москва • 2010
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Определение чувствительности возбудителей опасных бактериальных инфекций (чума, сибирская язва, холера, туляремия, бруцеллез, сап, мелиоидоз) к антибактериальным препаратам
Методические указания МУК 4.2.2495—09
МУК 4.2.2495—09
вызванной микроорганизмом, относящимся к этой категории, обычно эффективно;
• промежуточный - МПК АБП в отношении штаммов этой категории выше, чем в отношении чувствительных, но находится в пределах, достигаемых при максимально допустимых режимах дозирования. Лечение инфекции, вызванной микроорганизмом, относящимся к этой категории, может быть эффективным при применении АБП в повышенных дозах, однако не исключен отбор вариантов возбудителя, характеризующегося более высоким значением МПК, сопровождающегося отсутствием эффекта антибиотикотерапии;
• устойчивый - штамм не подавляется при концентрациях АБП, создающихся в органах и тканях при рекомендуемых режимах дозирования. Использование АБП, к которому культура микроорганизмов устойчива, недопустимо.
Основным количественным показателем, характеризующим микробиологическую активность АБП, является значение МПК, которое может быть получено при использовании МСР. Для определения МПК заданные концентрации АБП вносят в питательную среду. Питательную среду с двукратно увеличивающимися концентрациями АБП засевают исследуемой культурой микроорганизма, посевы инкубируют при оптимальной для данного вида возбудителя температуре в течение 18—48 ч и затем оценивают наличие или отсутствие видимого роста.
Для получения антибиотикограммы микроорганизмов ДДМ используют стандартизированные условия (состав и количество среды, количество засеваемых микробных клеток, температура и сроки инкубирования, стандартные диски). В определенных пределах величина диаметра зоны подавления роста обратно пропорциональна МПК, т. к. существует линейная связь между логарифмом МПК, измеренной при использовании МСР, и диаметром зоны задержки роста при использовании ДДМ.
Для окончательной характеристики чувствительности/устойчивости культур необходимо использовать МСР АБП в плотной питательной среде для получения наиболее достоверных результатов и адекватного выбора средств специальной экстренной профилактики и этиотропной терапии эпидемически опасных инфекционных заболеваний бактериальной природы.
Необходима строгая стандартизация процедуры определения антибиотикограммы, внедрение внутреннего контроля качества на всех эта-
МУК 4.2.2495—09
пах исследования, использование критериев интерпретации результатов для каждого вида возбудителя ООИ.
5.2. Выбор контрольных штаммов
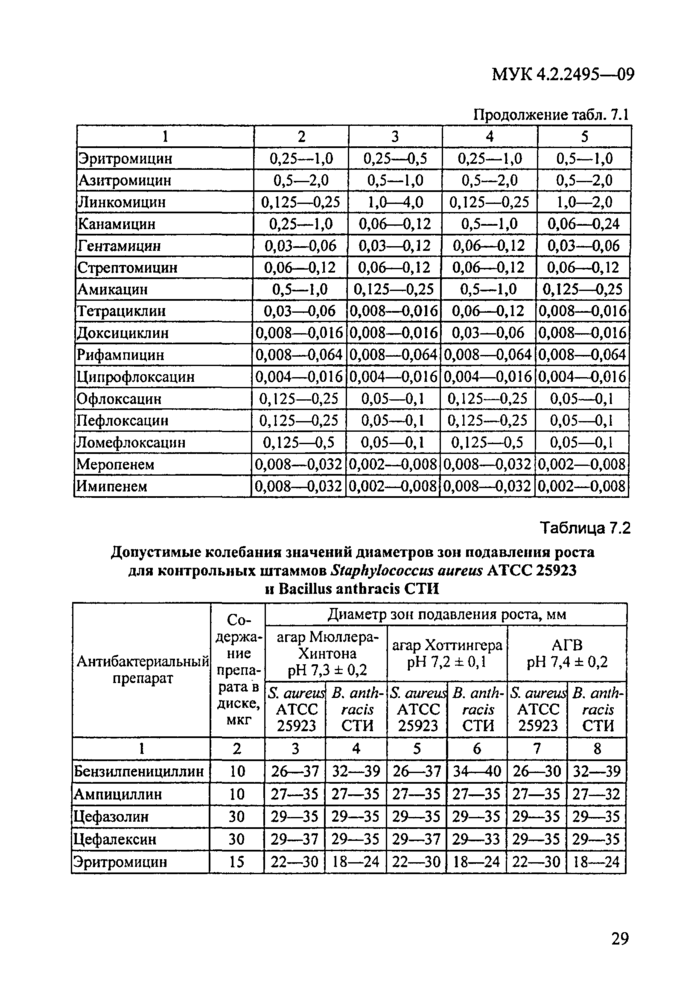
Выбор референтных (контрольных) штаммов определяется видом тестируемого микроорганизма. В качестве контрольных тест-штаммов используют типичные штаммы с хорошо изученными фенотипическими характеристиками, включая чувствительность к АБП, отличающиеся генетической стабильностью. К таковым относятся вакцинные штаммы Yersinia pestis EV НИИЭГ, Francisella tularensis 15, Brucella abortus 19BA, Bacillus anthracis СТИ, а также Vibrio cholerae non 01 KM 162 (P9741), депонированный в качестве референтного антибиотикочувствительного тест-штамма в ГК ПБ РосНИПЧИ «Микроб», типичные штаммы буркхольдерий - Burkholderia mallei NCTC 10230 и Burkholderia pseudomallei CIP 6086. Контрольные штаммы, соответствующие каждому виду возбудителей ООИ, используют на этапах предварительного изучения качества питательных сред, применяемых при определении антибиотикочувствительности, контроля активности дисков с антибиотиками и АБП для их последующего использования в случае эпидемических осложнений (МУ 3.4.1030—01).
Для внутреннего контроля качества определения антибиотико-граммы используют также эталонные референс-штаммы Escherichia coli АТСС 25922 (для возбудителей чумы, туляремии, бруцеллеза, холеры); Staphylococcus aureus АТСС 25923 (для возбудителя сибирской язвы); Pseudomonas aeruginosa АТСС 27853 (для возбудителей сапа и мелиоидоза).
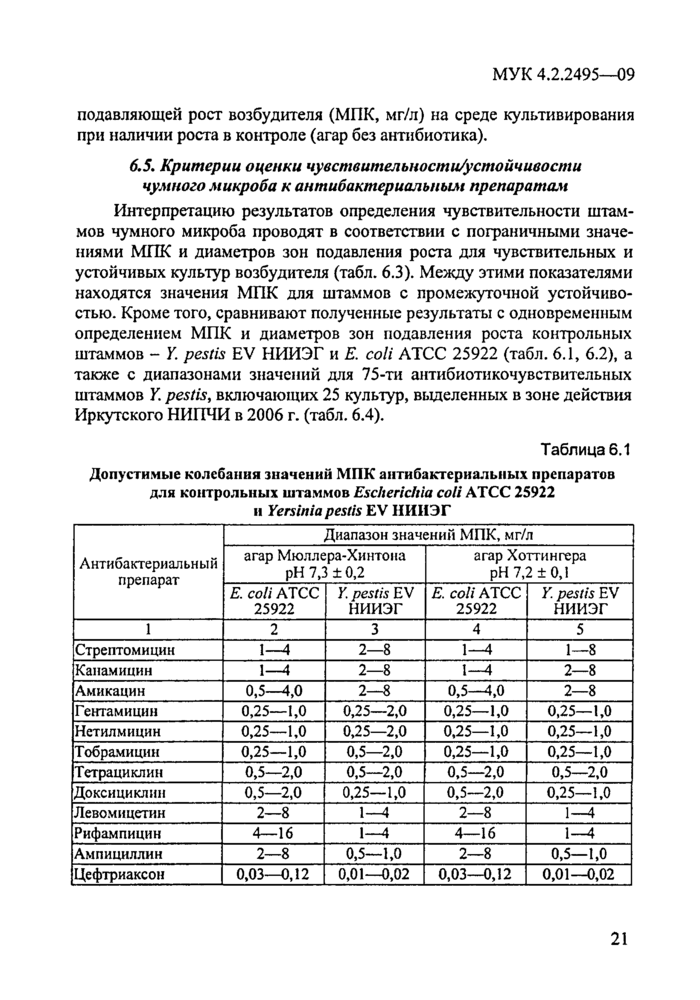
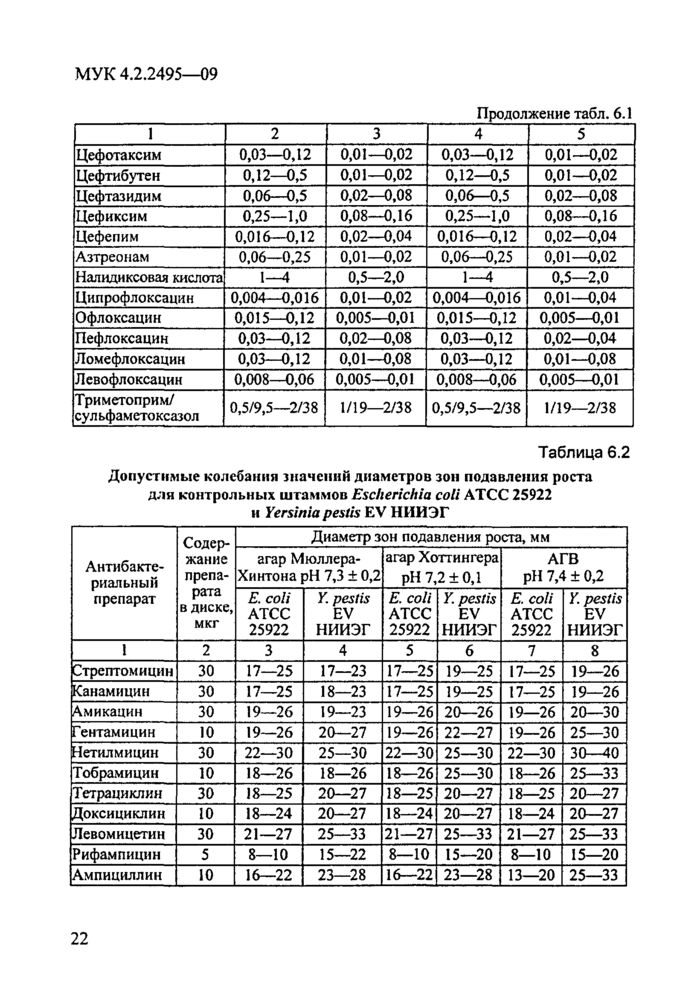
Допустимые колебания значений МПК АБП и диаметров зон инги-биции роста всех вышеперечисленных контрольных штаммов на используемых для каждого вида возбудителя питательных средах представлены в таблицах соответствующих разделов документа.
Для сохранения свойств и чистоты контрольные штаммы необходимо хранить в лиофилизированном состоянии. «Рабочие» культуры хранят в пробирках на скошенном агаре или в столбиках агара, оптимального для роста каждого вида микроорганизма, при 2—8 °С с еженедельным пересевом. Исключением является контрольный штамм Vibrio cholerae non Ol KM 162 (P-9741), который хранится в 0,3 %-м полужидком агаре при 18—20 °С. Перед использованием для контроля качества определения антибиотикограммы референтный штамм двукратно пересевается.
11
МУК 4.2.2495—09
53. Выбор питательных сред Для оценки чувствительности микроорганизмов к АБП используют питательные среды, разрешенные к применению в Российской Федерации, в соответствии с биологическими особенностями каждого вида изучаемого микроорганизма (прилож. 1). Стандартной средой является агар Мюллера-Хинтона (Muller-Hinton).
Каждую партию питательных сред проверяют с использованием контрольного штамма на ростовые качества для тестируемого микроорганизма (рост при высеве на чашки с агаром - не менее 30 % КОЕ), а также на соответствие рекомендуемого pH с помощью pH-метра. Последнее связано с изменением активности аминогликозидов, макролидов, тетрациклинов в зависимости от pH питательной среды.
Выбранную питательную среду промышленного производства готовят в колбах в строгом соответствии с инструкцией изготовителя, затем разливают в градуированные бутылки емкостью 250 мл и автоклавируют. Остуженный до 48—50 °С агар (при необходимости в него добавляют стерильные термолабильные добавки или растворы АБП) разливают в чашки Петри.
Агар разливают по 25 мл в чашки диаметром 100 мм и по 20 мл в чашки диаметром 90 мм с тем, чтобы толщина агара составляла (4 ± 0,5) мм. Чашки оставляют для застывания при комнатной температуре. Для приготовления чашек с агаром требуется горизонтальная поверхность. Чашки после подсушивания при комнатной темдературе лучше использовать немедленно, однако возможно их приготовление за 24 ч до использования при условии хранения при 4—8 °С. Допускается подсушивание при 37 °С в течение 15 мин перевернутых вверх дном чашек в термостате, предварительно обработанном 70°-м спиртом.
5.4. Требования к культуре, используемой для инокуляции Исследование на чувствительность культур микроорганизмов к АБП проводится одновременно с их индикацией и/или идентификацией.
Необходимо использовать только чистые культуры бактерий или (при проведении специфической индикации) материал из 2—3-х изолированных морфологически типичных колоний возбудителя в первичном посеве пробы клинического материала от больного при выраженной симптоматике инфекции (например, водянистый стул у больных с алгидной формой холеры обычно содержит чистую культуру V cholerae, так же как и пунктат из чумного бубона и т. д.).
МУК 4.2.2495—09
Суспензию микроорганизмов готовят из агаровой культуры, выращенной на неселективной питательной среде при соответствующей температуре (28, 37 °С), оптимальной для роста данного вида бактерий. Стандартизацию суспензии проводят по оптическому стандарту мутности (ОСО) ГИСК им. Л. А. Тарасевича на 5—10 ед., что соответствует п х 108—109 КОЕ/мл в зависимости от вида возбудителя. ОСО приведен в соответствие с международным стандартом мутности. Инокулюм следует использовать в течение 15 мин после приготовления.
5.5. Выбор антибактериальных препаратов
В соответствии с нормативной документацией средствами общей экстренной профилактики инфекции бактериальной природы (до определения вида возбудителя) являются доксициклин (тетрациклин), ци-профлоксацин (офлоксацин, пефлоксацин), рифампицин и тримето-прим/сульфамонометоксин (торговое название - сульфатон) или триме-топрим/сульфаметоксазол (бисептол, ко-тримоксазол и др.).
Специальная экстренная профилактика и этиотропная терапия инфекции проводится уже в соответствии с установленной антибиотико-граммой возбудителя, включающей данные о чувствительности к антибактериальным препаратам I и II групп.
К АБП I группы относят антибиотики, наиболее эффективные при данной инфекции, вызванной антибиотикочувствительными типичными штаммами возбудителя. Чувствительность к этим препаратам определяют в первую очередь для обоснования специальной экстренной профилактики и этиотропной терапии инфекции. В число таких АБП обычно включены и препараты, используемые для целей общей экстренной профилактики.
К дополнительным (II группа) АБП относят антибиотики, которые могут быть альтернативой препаратам I группы в случае регистрации к ним устойчивости, а также использоваться для получения антибиотико-грамм выделенных штаммов возбудителя в рамках эпидемиологического надзора за чувствительностью определенного вида микроорганизма.
При составлении наборов АБП в настоящем документе учтены закономерности перекрестной резистентности бактерий к различным представителям одной группы. Так, для определения чувствительности к фторхинолонам достаточно воспользоваться только ципрофлоксацином (или офлоксацином, или пефлоксацином и др.); к цефалоспоринам III поколения - цефтриаксоном (или цефотаксимом, или цефтазидимом).
13
МУК 4.2.2495—09
Партии АБП, используемые для осуществления общей, специальной экстренной профилактики и этиотропной терапии опасных инфекционных заболеваний, должны быть предварительно изучены на соответствие заявленной и фактической антибактериальной активности методом серийных разведений препаратов в плотной питательной среде (среда Мюллера-Хинтона) с использованием референс-штаммов.
5.6. Интерпретация результатов исследования
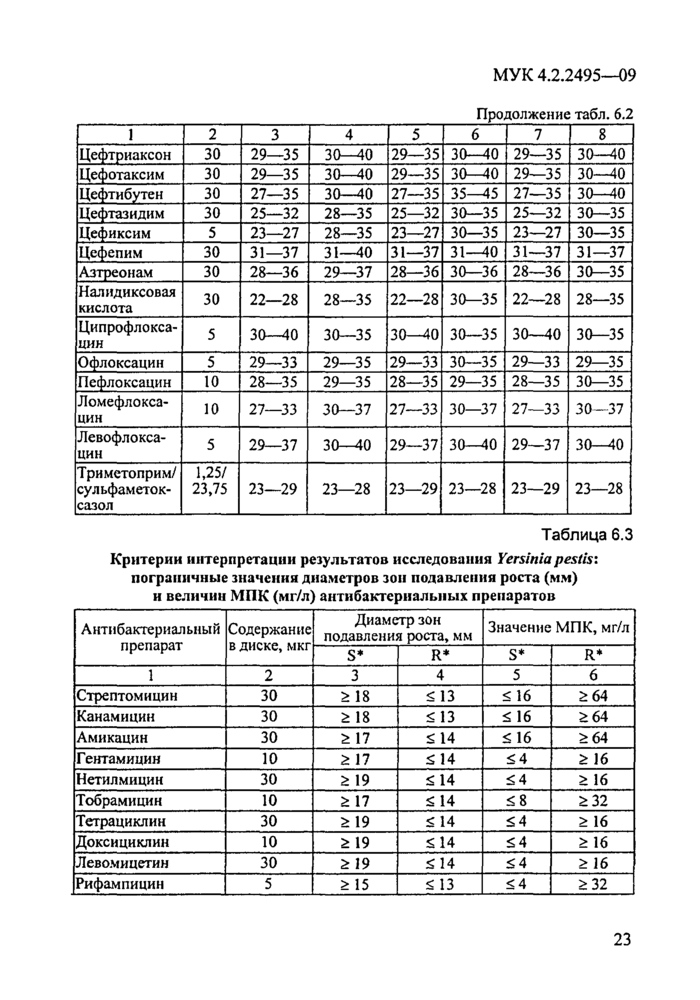
Интерпретация результатов оценки антибиотикочувствительности микроорганизма к АБП заключается в отнесении его к одной из трех категорий: чувствительный, промежуточный, устойчивый в соответствии с критериями, разработанными для данного вида бактерий. Интерпретация проводится путем сопоставления величин МПК и (или) диаметров зон ингибиции роста, полученных в результате исследования, с пограничными значениями этих параметров для чувствительных, промежуточных и устойчивых культур изучаемого вида возбудителя.
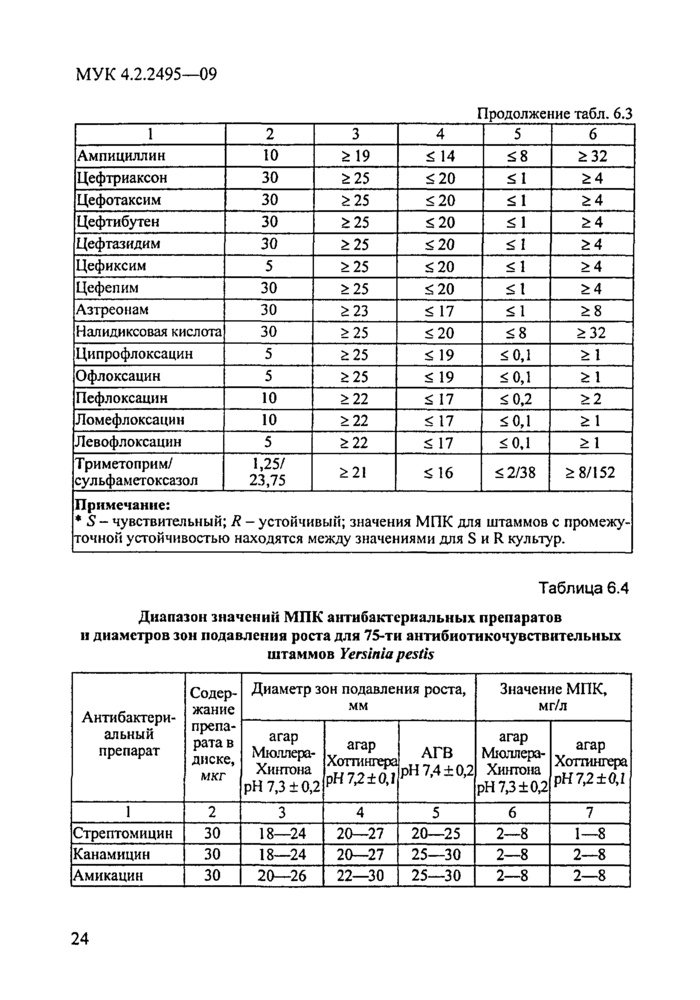
Приведенные в МУК 4.2.1890—04 критерии интерпретации результатов определения чувствительности микроорганизмов III—IV групп патогенности к АБП разработаны на основе микробиологических, фармакокинетических, фармакодинамических факторов и клинических наблюдений. В настоящем документе проведена адаптация этих критериев к интерпретации результатов определения антибиотикограмм возбудителей чумы, сибирской язвы, туляремии, холеры, бруцеллеза, сапа и мелиоидоза. Изменение пограничных значений МПК и диаметров зон ингибиции роста бактерий для некоторых АБП явилось результатом сравнительного изучения данных in vitro, эффективности in vivo (экспериментальные модели инфекций), диапазонов значений МПК и диаметров зон ингибиции роста для 20—75 штаммов каждого вида микроорганизма, а также клинических наблюдений в практике противочумных учреждений и анализа данных современной отечественной и зарубежной литературы.
Клинически ориентированные категории чувствительности и устойчивости бактерий к АБП не всегда коррелируют с микробиологическими, в связи с чем необходим бактериологический контроль эффективности этиотропной терапии инфекции у каждого пациента даже в случае улучшения симптоматики заболевания (через 2—3 сут. на фоне лечения).
МУК 4.2,2495—09
5.7. Метод серийных разведений в агаре
Важным этапом МСР является приготовление растворов АБП.
Растворы с высокими концентрациями препаратов (100000—10 000— 1 000 мг/л) являются основными и могут храниться при 2—8 °С в течение недели. Исключением являются растворы тетрациклинов, беталактамов, фуразолидона, сульфаниламидов, которые необходимо использовать ex tempore для внесения в питательные среды в необходимых концентрациях.
|
т АБ |
Для приготовления основных растворов используют субстанции АБП с известной активностью. При отсутствии субстанций в экстренных случаях допускается использование препаратов в виде мелкодисперсных порошков, инъекционных форм препаратов. АБП взвешивают на электронных лабораторных весах с точностью до 4-го знака. Объём растворителя должен соответствовать количеству активного вещества в навеске. Расчет навески АБП для приготовления основного раствора проводят по формуле:
т АБтеор -расчетная (теоретическая) навеска АПБ, мг;
С - необходимая концентрация АПБ, мкг/мл;
Умор, - объем растворителя для растворения теоретической навески, мл;
А - активность АПБ (количество активного вещества, содержащегося в субстанции), мкг/мг.
Взвесить точно расчетное количество порошка практически невозможно. Поэтому готовят близкую к расчетной навеску, а затем пересчитывают количество необходимого растворителя.
Vm
xF (лм)
практ.
-—---.где
тАБ^мг)
Кракп - объем растворителя для растворения практической навески, мл; т АБпракт, - полученная навеска АПБ, мг; т АБте0Р' - расчетная (теоретическая) навеска АПБ, мг;
Vmeop - объем растворителя для растворения теоретической навески, мл; Различия в растворимости АБП определяют необходимость использования растворителей (солюбилизаторов) в минимальном объеме и необходимого количества разбавителя (дистиллированная вода). Для растворения тетрациклинов, рифампицина, фуразолидона используют димексид, левомицетин растворяют в 96°-м спирте. Приготовление ос-
15
МУК 4.2.2495—09
новных растворов налидиксовой кислоты и фторхинолонов проводят в 72 от необходимого объема дистиллированной воды добавлением по капле 0,1 М КОН до полного растворения препаратов с последующим доведением растворителя до расчетного объема. Растворителем и разбавителем для других АБП служит дистиллированная вода.
Для измерения объёмов растворов антибиотиков используют калиброванные дозаторы и пипетки.
Рабочие растворы АБП готовят на дистиллированной воде в концентрациях, необходимых для внесения в расплавленный и остуженный (до 48—50 °С) агар (20 мл на одну чашку Петри) для создания в нём двукратно увеличивающихся концентраций (например: 1—2—4—8— 16—32 мг/л) препарата в соответствии с пограничными значениями МПК для чувствительных и устойчивых штаммов данного вида микроорганизма. В зависимости от необходимого количества чашек Петри с каждой из концентраций АБП используют мерные широкогорлые флаконы на 50—100 мл, в которые наливают агар в объёме 20—40 мл и т. д. и добавляют раствор АБП (начиная с наименьшей концентрации), интенсивно размешивают и выливают в чашки Петри, на которых указана концентрация АБП. Контролем служит агаровая чашка без АБП. После застывания агара в чашках и их подсушивания на дне чашки делают надписи: дата посева, вид возбудителя, номер исследуемых культур.
Испытуемые суспензии культур наносят на поверхность питательного агара без АПБ (контроль) и с АБП (начиная с наименьшей концентрации) каплями легким касанием пипетки (~ 0,005 мл) или с помощью штампа-репликатора (- 0,001 мл). Одновременно можно изучать до 25— 50 культур, обязательно включая контрольные референс-штаммы, что обеспечивает достоверность данных антибиотикограммы.
После полного впитывания капель суспензий в агар чашки переворачивают вверх дном и инкубируют при оптимальной для данного возбудителя температуре (28, 37 °С) в течение 18—48 ч. Учёт результатов проводят после появления роста тестируемых культур на агаре без АБП и при условии, что значения МПК для контрольных штаммов укладываются в рекомендуемый диапазон значений этого показателя для испытуемых АПБ (таблицы в соответствующих разделах). Минимальная подавляющая концентрация (МПК) - это концентрация АБП в агаре, которая полностью подавляет рост культуры. По значению МПК исследуемая культура может быть отнесена к чувствительной, промежуточной, устойчивой в соответствии с критериями для изучаемого вида возбудителя (таблицы в соответствующих разделах).
МУК 4.2.2495—09
5.8, Диско-диффузионный метод
Проверенный на пригодность с использованием эталонных антибиотикочувствительных штаммов питательный агар (приготовленный, расплавленный, остуженный, как указано ранее) разливают в чашки Петри, установленные на строго горизонтальной поверхности, в объеме 20 мл на чашку диаметром 90 мм, 25 мл - на чашку диаметром 100 мм, 60 мл - на чашку диаметром 150 мм. Толщина слоя агара должна составлять строго (4 ± 0,5) мм. Эти требования следует выполнять обязательно, т. к. зоны ингибиции роста зависят от глубины и равномерности агарового слоя.
Перед использованием свежеприготовленных чашек или после хранения в холодильнике (7—10 сут. в запаянных полиэтиленовых пакетах) их необходимо подсушить при 37 °С (в течение 15 мин).
При определении чувствительности культур микроорганизмов с помощью ДЦМ необходимо использовать только стандартизированные качественные диски производственного изготовления.
Каждую серию дисков с АПБ контролируют с помощью референс-штаммов на соответствие заявленным концентрациям на питательной среде, прошедшей контроль качества. Диски, дающие диаметры зон ингибиции роста большие, чем допустимый диапазон значений для рефе-ренс-культуры, выбраковываются, т. к. их использование может привести к отнесению антибиотикорезистентных штаммов к разряду чувствительных.
Проверенные на пригодность серии дисков с АПБ хранятся до истечения срока годности в герметичной упаковке при - 18 °С и ниже. Используемые в работе диски можно хранить в холодильнике (4—8 °С). Картриджи должны быть плотно упакованными, чтобы не допустить попадания в них влаги. Флаконы с дисками (картриджи) следует извлекать из холодильника за 1 ч до начала работы и открывать только по достижении ими комнатной температуры, предотвращая тем самым образование конденсата влаги на дисках после открывания картриджа.
Бактериальную суспензию необходимой концентрации наносят на агаровую чашку Петри в объеме 0,2—0,3 мл я распределяют равномерно по поверхности с помощью стерильного шпателя. Приоткрытые чашки подсушивают при комнатной температуре в течение 10—15 мин и затем наносят диски (не более 6 на чашку). Диски наносят стерильным пинцетом и слегка придавливают. Расстояние от диска до края чашки и между дисками должно составлять 15—20 мм.
17
МУК 4.2.2495—09
Чашки с посевом без дисков (контроль роста культуры) и с дисками инкубируют вверх дном 18—48 ч при температуре, оптимальной для роста изучаемого вида возбудителя (28, 37 °С). Параллельно с тестируемыми культурами необходимо проводить внутренний контроль качества исследования - определение чувствительности референс-штамма к используемым АПБ. Учет результатов проводится только при наличии сливного роста культуры на чашках без дисков и соответствия величин зон ингибиции роста контрольных штаммов значениям, приведенным в соответствующих таблицах. Измерение диаметров зон полного подавления видимого роста производят кронциркулем, штангенциркулем, с помощью линейки-лекало (с точностью до 1 мм) на чашках, помещенных кверху дном на темную матовую поверхность так, чтобы свет падал на них под углом 45°.
Появление колоний в зоне задержки роста микроорганизмов может свидетельствовать или о загрязнении культуры посторонней микрофлорой или о гетерогенности тестируемой культуры по признаку чувстви-тельности/устойчивости к данному антибиотику. И в одном, и в другом случае исследование необходимо повторить с изучением чувствительности к АБП культур из колоний (если это не загрязнение), выросших в пределах диаметра зоны ингибиции роста. Интерпретацию результатов исследования следует провести с использованием таблиц, в которых даны пограничные значения диаметров зон ингибиции роста исследуемого микроорганизма конкретным АБП (разделы 6, 7, 8,9» 10, 11).
В паспорт каждой выделенной культуры необходимо вносить не только значения МПК, диаметров зон задержки роста, но и интерпретацию результатов исследований: штамм чувствительный, промежуточный или устойчивый.
6. Определение чувствительности чумного микроба (Yersinia pestis) к антибактериальным препаратам
6J. Контрольные штаммы
Для стандартизации определения антибиотикограммы возбудителя чумы в качестве контрольных штаммов могут быть использованы:
1) вакцинный штамм чумного микроба - Yersinia pestis EV НИИЭГ, чувствительный к антибактериальным препаратам;
2) референс-штамм Escherichia coli АТСС 25922, рекомендованный для определения антибиотикочувствительности бактерий семейства Enterobacteriaceae9 к которому относится и возбудитель чумы.
МУК 4.2.2495—09
6. 2т Питательные среды
Для определения чувствительности чумного микроба к антибактериальным препаратам МСР и ДЦМ могут быть использованы:
1) агар Мюллера-Хинтона (Muller-Hinton) pH 7,3 ± 0,2;
2) агар Хоттингера pH 7,2 ± 0,1 (1,2—1,4 г/л аминного азота).
Для ДДМ дополнительно можно использовать агар Гивенталя-Ведьминой (АГВ) pH 7,4 ± 0,2.
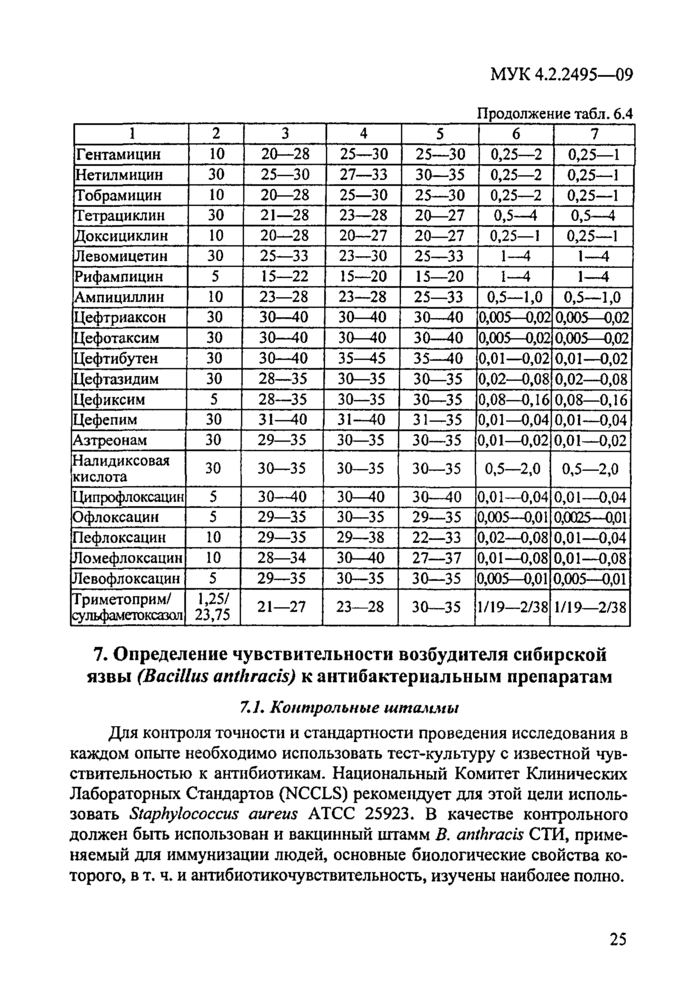
Каждая серия питательного агара перед использованием для определения антибиотикограммы возбудителя чумы должна быть проверена с использованием контрольных штаммов и АБП. Допустимые колебания значений МПК и диаметров зон ингибиции роста для контрольных штаммов представлены в табл. 6.1 и 6.2.
6.3. Антибактериальные препараты Для определения антибиотикограммы чумного микроба, выделенного в природном очаге чумы или от больного, используют антибактериальные препараты, рекомендованные МУ 3.4.1030—01 для экстренной профилактики и лечения этой инфекции.
Для МСР в плотной питательной среде выбирают серии двукратно увеличивающихся концентраций антибактериальных препаратов в соответствии с пограничными значениями МПК для чувствительных и устойчивых культур чумного микроба.
Препараты первого ряда:
Стрептомицин 4—8—16—32—64 мг/л Амикацин 4—8—16—32—64 мг/л Гентамицин 2—4—8—16 мг/л Доксициклин 2—А—8—16 мг/л
Ципрофлоксацин (или офлоксацин, пефлоксацин, ломефлоксацин, левофлоксацин) 0,06—0,125—0,25—0,5—1,0 мг/л
Цефтриаксон (или цефотаксим) 0,5—1—2—4 мг/л Рифампицин 2—4—8—16—32 мг/л
Триметоприм/сульфаметоксазол 1—2—4—8 мг/л (по триметоприму) Препараты второго ряда:
Канамицин 4—8—16—32—64 мг/л Нетилмицин 2—А—8—16 мг/л Тобрамицин 4—8—16—32 мг/л Тетрациклин 2—4—8—16 мг/л Ампициллин 4—8—16—32 мг/л
Цефтазидим (или цефтибутен, цефиксим, цефепим) 0,5—1—2—4 мг/л
19
ББК51.9
060
060 Определение чувствительности возбудителей опасных бактериальных инфекций (чума, сибирская язва, холера, туляремия, бруцеллез, сап, мелиоидоз) к антибактериальным препаратам: Методические указания.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010.—59 с.
ISBN 978—5—7508—0891—5
1. Разработаны ФГУЗ Ростовски й-на-Дону научно-исследовательский противочумный институт (И. В. Рыжко, Н. В. Павлович, Ю. М. Ломов,
А. И. Щербанюк, Р. И. Цураева, А. В. Тришина, М. В. Цимбалистова, И. Я. Черепахина, Л, М. Смоликова); ФГУЗ Иркутский научно-исследовательский противочумный институт (С. В. Балахонов, С. А. Белькова, Е. Г. Токмакова, Е. Г. Горячкина); ФГУЗ Волгоградский научно-исследовательский противочумный институт (В. И. Илюхин, Н. В. Андропова, Т. В. Семина,
Е. В. Калинкина, М. Н. Трушкина); ФГУЗ Ставропольский научно-исследовательский противочумный институт (Л. Ю. Аксенова, Н. П. Буравцева,
Е. И. Еременко, А. Г. Рязанова, Е. А. Цыганкова, Г. И. Лямкин, Л. В. Лапус-тина, Д. В. Русанова, С. В. Вилинская, С. И. Головнева); ФГУЗ Российский научно-исследовательский противочумный институт «Микроб» (С. А. Щербакова, Е. С. Казакова, И. Н. Шарова); ФГУЗ Противочумный центр Роспотребнадзора (В. Е. Безсмертный, С. М. Иванова, Г. В. Титов); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Е. Б. Ежлова, Н. Д. Пакскина).
2. Рекомендованы к утверждению Комиссией по санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 24 марта 2009 г. № 1).
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главным государственным санитарным врачом Российской Федерации Г. Г. Онищенко 1 апреля 2009 г,
4. Введены в действие с 1 июня 2009 г.
5. Введены взамен «Инструкции по определению чувствительности возбудителей опасных инфекционных заболеваний к антибиотикам и химиопрепаратам», утвержденной Минздравом СССР от 7 февраля 1989 г.
ББК51.9
€> Роспотребнадзор, 2010 О Федеральный центр гигиены н эпидемиологии Роспотребнадзора, 2010
Азтреонам 0,5—1—2—4—8 мг/л Налидиксовая кислота 4—8—16—32 мг/л Левомицетин 2—4—8—16 мг/л
Налидиксовая кислота не рекомендуется для экстренной профилактики и лечения чумы, однако устойчивость чумного микроба к этому препарату может сопровождаться снижением эффективности фторхино-лонов при сохранении к ним чувствительности in vitro.
С целью экономии времени и средств для проведения исследования МСР могут применяться штампы-репликаторы, позволяющие изучить антибиотикограммы 25—50-ти штаммов одновременно с введением в исследование контрольного антибиотикочувствительного штамма, что повышает достоверность получаемых результатов.
Для постановки ДДМ используют проверенные (на предварительно прошедшей контроль серии питательной среды) коммерческие диски с определенными концентрациями АБП (табл. 6.2).
6.4. Посевная доза, инокуляция, инкубация При определении чувствительности возбудителя чумы к антибактериальным препаратам с помощью ДДМ используют суспензию микробных клеток из суточной агаровой культуры в 0,85 % изотоническом растворе хлорида натрия, стандартизированную по отраслевому стандарту мутности ГИСК им. Л. А. Тарасевича на 5 ед. - 5 х 108 м. к. (~ 1,5 х 108 КОЕ/мл). Суспензию наносят на поверхность агара в объеме 0,2 мл(пх107 КОЕ), равномерно распределяют стерильным шпателем. Через 10—15 мин накладывают диски (не более шести на чашку диаметром 100 мм). Посевы инкубируют при 28 °С. Предварительный учет проводят через 24 ч, окончательный - через 48 ч. Результаты учитывают при появлении сливного роста на контрольных чашках (без дисков). Диаметры зон задержки роста культуры вокруг дисков, включая диаметр самого диска, измеряют с точностью до 1 мм штангенциркулем, кронциркулем или специальной линейкой-лекало.
Для МСР используют суспензию той же концентрации 5 х 108 м. к. (—1,5 х Ю8 КОЕ/мл), нанося небольшими каплями с помощью штампа-репликатора или касанием пипетки с тонким концом на чашки с питательной средой, содержащей различные концентрации антибактериальных препаратов, начиная с чашек, содержащих минимальное количество антибиотиков. Посевная доза - n х Ю5—106 КОЕ. Посевы инкубируют при температуре 28 °С. Учет через 36—48 ч. Чувствительность/устой-чивость культур определяют по минимальной концентрации препарата,
МУК 4.2.2495—09Содержание
1. Область применения...............................................................................................5
2. Нормативные и методические документы............................................................6
3. Общие сведения......................................................................................................7
4. Обоснование для исследования чувствительности всех выделенных
культур возбудителей ООИ к антибактериальным препаратам........................8
5. Методы определения чувствительности возбудителей ООИ к
антибактериальным препаратам............................................................................9
5.1. Общая характеристика методов.....................................................................9
5.2. Выбор контрольных штаммов......................................................................11
5.3. Выбор питательных сред..............................................................................12
5.4. Требования к культуре, используемой для инокуляции.............................12
5.5. Выбор антибактериальных препаратов.......................................................13
5.6. Интерпретация результатов исследования..................................................14
5.7. Метод серийных разведений в агаре............................................................15
5.8. Диско-диффузионный метод........................................................................17
6. Определение чувствительности чумного микроба (Yersiniapestis) к
антибактериальным препаратам..........................................................................18
6.1. Контрольные штаммы...................................................................................18
6.2. Питательные среды.......................................................................................19
6.3. Антибактериальные препараты....................................................................19
6.4. Посевная доза, инокуляция, инкубация.......................................................20
6.5. Критерии оценки чувствительности/устойчивости чумного микроба к
антибактериальным препаратам..........................................................................21
7. Определение чувствительности возбудителя сибирской язвы (Bacillus
anthracis) к антибактериальным препаратам......................................................25
7.1. Контрольные штаммы...................................................................................25
7.2. Питательные среды.......................................................................................26
7.3. Антибактериальные препараты....................................................................26
7.4. Посевная доза, инокуляция, инкубация.......................................................27
7.5. Критерии оценки чувствительности/устойчивости сибиреязвенного
микроба к антибактериальным препаратам.......................................................27
8. Определение чувствительности холерного вибриона (Vibrio cholerae) к
антибактериальным препаратам..........................................................................32
8.1. Контрольные штаммы...................................................................................32
8.2. Питательные среды.......................................................................................32
8.3. Антибактериальные препараты....................................................................32
8.4. Посевная доза, инокуляция, инкубация.......................................................34
8.5. Критерии оценки чувствительности/устойчивости холерного вибриона
к антибактериальным препаратам.......................................................................34
9. Определение чувствительности туляремииного микроба (Francisella
tularensis) к антибактериальным препаратам.....................................................39
3
9.1. Контрольные штаммы...................................................................................39
9.2. Питательные среды.......................................................................................39
9.3. Антибактериальные препараты....................................................................40
9.4. Посевная доза, инокуляция, инкубация.......................................................41
9.5. Критерии оценки чувствительности/устойчивости туляремийного
микроба к антибактериальным препаратам.......................................................41
10. Определение чувствительности бруцелл {Brucella spp.) к
антибактериальным препаратам..........................................................................45
10.1. Контрольные штаммы.................................................................................45
10.2. Питательные среды......................................................................................45
10.3. Антибактериальные препараты..................................................................46
10.4. Посевная доза, инокуляция, инкубация....................................................47
10.5. Критерии оценки чувствительности/устойчивости возбудителя
бруцеллеза к антибактериальным препаратам...................................................48
11. Определение чувствительности возбудителей сапа и мелиоидоза
{Burkholderia mallei u Burkholderiapseudomallei) к антибактериальным препаратам............................................................................................................51
11.1. Контрольные штаммы.................................................................................51
11.2. Питательные среды......................................................................................51
11.3. Антибактериальные препараты..................................................................52
11.4. Посевная доза, инокуляция, инкубация.....................................................53
11.5. Критерии оценки чувствительности/устойчивости возбудителей сапа и
мелиоидоза к антибактериальным препаратам..................................................54
Приложение. Питательные среды для определения чувствительности возбудителей особо опасных инфекций бактериальной природы к
антибактериальным препаратам..........................................................................58
Список сокращений..................................................................................................59
4
МУК 4.2.2495—09
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
1 апреля 2009 г.
Дата введения: 1 июня 2009 г.
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Определение чувствительности возбудителей опасных бактериальных инфекций (чума, сибирская язва, холера, туляремия, бруцеллез, сап, мелиоидоз) к антибактериальным препаратам
Методические указания МУК 4.2.2495—09
1. Область применения
В настоящих методических указаниях изложены стандартизированные методы определения чувствительности возбудителей особо опасных инфекций (ООН) бактериальной природы к антибактериальным препаратам (АБП) методом серийных разведений (МСР), дискодиффузионным методом (ДДМ) и критерии интерпретации результатов с учетом биологических особенностей каждого вида микроорганизма.
Методические указания предназначены для лабораторий, имеющих разрешение на работу с возбудителями опасных инфекционных болезней I—II и II—IV групп патогенности, противочумных станций, противочумных институтов и специализированных противоэпидемическшс бригад (СПЭБ) ФГУЗ противочумных институтов.
В лабораториях Центров индикации и диагностики возбудителей особо опасных инфекционных болезней, Референс-центров по мониторингу за возбудителями инфекционных болезней и Национальных центров верификации диагностической деятельности (в соответствии с приказом Роспотребнадзора от 17.03.08 № 88) выполняют исследования по
МУК 4.2.2495—09
определению антибиотикочувствительности/устойчивости микроорганизмов I—II групп патогенности с использованием метода серийных разведений и диско-диффузионного метода. В лабораториях ФГУЗ ЦГиЭ, СПЭБ, противочумных станций допускается применение только диско-диффузионного метода.
2* Нормативные и методические документы
1. Федеральный закон Российской Федерации «О санитарно-эпидемиологическом благополучии населения» от 30 марта 1999 г. № 52-ФЗ.
2. Международные медико-санитарные правила. ВОЗ, 2005.
3. СП 1.2.1285—03 «Безопасность работы с микроорганизмами I— II групп патогенности (опасности)».
4. СП 1.2.1318—03 «Порядок выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I—IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения и гельминтами».
5. СП 3.4.2318—08 «Санитарная охрана территории Российской Федерации».
6. МУ 3.4.1030—01 «Организация, обеспечение и оценка противоэпидемической готовности медицинских учреждений к проведению мероприятий в случае завоза или возникновения особо опасных инфекций, контагиозных вирусных геморрагических лихорадок, инфекционных болезней неясной этиологии, представляющих опасность для населения Российской Федерации и международного сообщения».
7. Приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 17.03.08 № 88 «О мерах по совершенствованию мониторинга за возбудителями инфекционных и паразитарных болезней».
8. Специфическая индикация патогенных биологических агентов: Практическое руководство. М., 2006.
9. СП 3.1.7.1380—03 «Профилактика чумы. Общие требования к эпидемиологическому надзору за чумой».
10. Приказ Министерства здравоохранения Российской Федерации, 2004 г., № 7 «Об организации и проведении мероприятий по профилактике чумы».
МУК 4.2.2495—09
11. СП 3.1.089—96 Профилактика и борьба с заразными болезнями, общими для человека и животных: Сборник санитарных и ветеринарных правил. «Сибирская язва».
12. СП 3.1.1086—02 «Профилактика холеры. Общие требования к эпидемиологическому надзору за холерой».
13. МУ 3.1.2007—05 «Эпидемиологический надзор за туляремией».
14. МУ 4.2.2218—07 «Лабораторная диагностика холеры».
15. МУ 3.1.7.1189—03 «Профилактика и лабораторная диагностика бруцеллеза у людей».
16. МУК 4.2.2413—08 «Лабораторная диагностика и обнаружение возбудителя сибирской язвы».
17. «Лабораторная диагностика, лечение и профилактика мелиоидоза. Методические рекомендации». Волгоград, 1994.
18. «Инструкция по определению чувствительности возбудителей опасных инфекционных заболеваний к антибиотикам и химиопрепаратам». М., 1990.
19. МУК 4.2.1890—04 «Определение чувствительности микроорганизмов к антибактериальным препаратам».
20. Приказ М3 РФ от 12.08.03 № 400 «О совершенствовании организационной работы специализированных противоэпидемических бригад противочумных учреждений».
21. Распоряжение Правительства РФ от 21.05.07 № 642-р «О модернизации специализированных противоэпидемических бригад».
3. Общие сведения
Антибиотикограмма возбудителей особо опасных инфекций бактериальной природы должна быть получена в течение срока идентификации культур, т. к. определяет выбор средств специальной экстренной профилактики и этиотропной терапии инфекции. Адекватность такого выбора зависит от стандартности и качества определения антибиотико-граммы, критериев её интерпретации, отработанных для определенного вида бактерий. Однако критерии оценки результатов определения чув-ствительности/устойчивости возбудителей особо опасных инфекций до настоящего времени предложены не были. Исследование чувствительности возбудителей ООИ к АБП должно максимально достоверно и в кратчайшие сроки обеспечить:
• выбор средств специальной экстренной профилактики и этиотропной терапии инфекции;
7
МУК 4.2.2495—09
• обоснование необходимости смены антибактериального препарата на основе бактериологического контроля эффективности лечения у отдельного больного;
• единые подходы к осуществлению наблюдения за распространением антибиотикорезистентности среди штаммов микроорганизмов-возбудителей ООИ;
• оценку антибактериальной активности партий АБП, используемых для экстренной профилактики и лечения инфекций, а также новых антибиотиков, перспективных для расширения арсенала средств, применяемых для этиотропной терапии ООИ.
4. Обоснование для исследования чувствительности всех выделенных культур возбудителей ООИ к антибактериальным препаратам
Антибиотикорезистентность возбудителей различных инфекционных заболеваний является насущной проблемой как медицинской науки, так и клинической медицины. Особую опасность представляет множественная лекарственная устойчивость бактерий, чрезвычайно быстро распространяющаяся с помощью мигрирующих генетических элементов, содержащих гены лекарственной устойчивости и имеющих специализированные механизмы их передачи среди широкого круга бактерий. Некоторые микроорганизмы легко мутируют, приобретая резистентность к ряду антибиотиков (стрептомицину, рифампицину, налидиксовой кислоте и др.).
Наличие антибиотикорезистентности обнаружено у природных штаммов чумного микроба. Все чаще встречаются сообщения о выделении стрептомициноустойчивых, тетрациклиноустойчивых вариантов возбудителя. Имеются факты регистрации резистентности к рифампицину, левомицетину и снижения чувствительности к гентамицину. От людей выделены культуры с плазмидами множественной лекарственной устойчивости.
Большинство природных изолятов сибиреязвенного микроба чувствительно к АБП, однако описаны случаи выделения от больных и из других источников штаммов, устойчивых к пенициллину, амоксицилли-ну, стрептомицину, тетрациклинам, рифампицину.
Серьезным осложнением течения 7-й пандемии холеры является нарастание устойчивости возбудителя к традиционно применяемым для лечения инфекции препаратам-тетрациклинам, левомицетину, тримето-приму/сульфаметоксазолу, фуразолидону, ампициллину и др. В настоя-
МУК 4.2.2495—09
щее время от больных выделяют культуры, имеющие от 3 до 10 маркеров резистентности, в т. ч. и к фторхинолонам (ципрофлоксацину, оф-локсацину и др.).
Природная устойчивость возбудителей бруцеллеза и туляремии к р-лактамным антибиотикам, цефапоспоринам и сниженная чувствительность к химиопрепаратам возбудителей сапа и мелиоидоза затрудняет выбор АБП и их комбинаций для этиотропной терапии этих инфекций.
Экспериментально доказана возможность получения штаммов чумного, сибиреязвенного, туляремийного микробов, устойчивых к АБП, что делает вероятным использование таких вариантов в целях биотерроризма.
В процессе лечения ООН антибактериальными препаратами спектр и степень антибиотикорезистентности возбудителей может меняться, что требует смены АБП или их комбинаций.
Вышеизложенное определяет необходимость изучения антибиоти-кограммы каждой выделенной культуры, постоянного эпидемиологического надзора за чувствительностью/устойчивостью выделяемых культур возбудителей ООИ.
Стандартизированное определение антибиотикограммы возбудителя и её правильная интерпретация являются основой адекватного выбора антибиотиков для целей экстренной профилактики и лечения ООИ.
5. Методы определения чувствительностивозбудителей ООИ к антибактериальным препаратам
5.7. Общая характеристика методов
Для определения чувствительности возбудителей ООИ к АБП используют метод серийных разведений препаратов в плотной питательной среде (МСР) и диско-диффузионный метод (ДДМ).
Мерой чувствительности бактерий при использовании МСР является минимальная концентрация (МПК) АБП, подавляющая видимый рост исследуемого микроорганизма.
В соответствии с МУК 4.2.1890—04 исследуемые микроорганизмы в результате изучения их антибиотикограмм относят к одной из трех категорий:
• чувствительный - рост и размножение бактерий подавляется при концентрациях АБП, создающихся в органах и тканях человека при рекомендуемых дозах и схемах применения. Лечение инфекции,
9