СТБ ISO 9308-1-2016
Качество воды. Подсчет количества кишечных палочек Escherichia coli и колиформных бактерий. Часть 1. Метод мембранной фильтрации для вод с низким содержанием бактериальной флоры
Купить СТБ ISO 9308-1-2016 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает метод для количественного учета Escherichia coli (E. coli) и колиформных бактерий. Стандарт в наибольшей степени применим к воде с низким содержанием бактерий, при анализе которой на хромогенном колиформном агаре (chromogenic coliform agar - CCA) появляется не более 100 колоний.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Сущность метода
5 Оборудование и стеклянная посуда
6 Питательные среды и реактивы
7 Отбор проб
8 Процедура
9 Представление результатов
10 Протокол испытаний
11 Контроль качества
Приложение А (справочное) Дополнительная микробиологическая информация о колиформных бактериях
Приложение В (обязательное) Состав и подготовка питательных сред и реактивов
Приложение С (справочное) Рабочие характеристики
Библиография
Приложение Д.А (справочное) Сведения о соответствии государственных стандартов ссылочным международным стандартам
| Дата введения | 01.06.2017 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Организации:
| 26.10.2016 | Утвержден | Госстандарт Республики Беларусь | 83 |
|---|---|---|---|
| Разработан | БелГИМ | ||
| Издан | БелГИСС | 2017 г. |
Water quality. Enumeration of Escherichia coli and coliform bacteria. Part 1. Membrane filtration method for waters with low bacterial background flora
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6
стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12

стр. 13
стр. 14

стр. 15
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РЕСПУБЛИКИ БЕЛАРУСЬ
КАЧЕСТВО ВОДЫ
Подсчет количества кишечных палочек Escherichia coli и колиформных бактерий Часть 1
Метод мембранной фильтрации для вод с низким содержанием бактериальной флоры
ЯКАСЦЬ ВАДЫ
Падлш колькасщ мшэчных папачак Escherichia coli i кал1формных бактэрый Частка 1
Метад мембраннай фшьтрацьм для вод з Hi3KiM змяшчэннем бактэрыяльнай флоры
(ISO 9308-1:2014, ЮТ)
Издание официальное
Г осстандарт Минск
(ЗБ
УДК 628.1.03:579.842.17(083.74)(476) МКС 07.100.20 КП 06 ЮТ
Ключевые слова: качество воды, подсчет Escherichia coli, подсчет колиформных бактерий, метод мембранной фильтрации
Предисловие
Цели, основные принципы, положения по государственному регулированию и управлению в области технического нормирования и стандартизации установлены Законом Республики Беларусь «О техническом нормировании и стандартизации».
1 ПОДГОТОВЛЕН республиканским унитарным предприятием «Белорусский государственный институт метрологии» (БелГИМ)
ВНЕСЕН техническим комитетом по стандартизации ТК BY 6 «Стандартизация в области метрологии»
2 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ постановлением Госстандарта Республики Беларусь от 26 октября 2016 г. № 83
3 Настоящий стандарт идентичен международному стандарту ISO 9308-1:2014 Water quality-Enumeration of Escherichia coli and coliform bacteria - Part 1: Membrane filtration method for waters with low bacterial background flora (Качество воды. Подсчет количества кишечных палочек Escherichia coli и колиформных бактерий. Часть 1. Метод мембранной фильтрации для воды с низким содержанием бактериальной флоры).
Международный стандарт разработан подкомитетом SC 4 «Микробиологические методы» технического комитета по стандартизации ISO/TC 147 «Качество воды» Международной организации по стандартизации (ISO).
Перевод с английского языка (ел).
Официальные экземпляры международного стандарта, на основе которого подготовлен настоящий государственный стандарт, и международных стандартов, на которые даны ссылки, имеются в Национальном фонде ТИПА.
В разделе «Нормативные ссылки» и тексте стандарта ссылки на международные стандарты актуализированы.
Сведения о соответствии государственных стандартов ссылочным международным стандартам приведены в дополнительном приложении Д.А.
Степень соответствия - идентичная (ЮТ)
4 ВВЕДЕН ВПЕРВЫЕ
© Госстандарт, 2017
Настоящий стандарт не может быть воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Госстандарта Республики Беларусь
Издан на русском языке
Вода
1000 мл
1В зависимости от гелеобразующей способности агара.
Суспендируют ингредиенты в воде при нагревании на кипящей водяной бане или в струе пара. При необходимости регулируют pH таким образом, чтобы после стерилизации в автоклаве оно составило 7,2 ±0,1 при температуре 25 °С. Стерилизуют в автоклаве в течение 15 мин при температуре (121 ± 3) °С. Остужают до температуры приблизительно 50 °С и разливают в чашки Петри на глубину минимум 4 мм. Если чашки не используются сразу же, допускается их хранение при температуре (5 ± 3) °С в темном месте при условии защиты от испарения в течение не более восьми недель.
Примечание - Для получения чистой культуры перед проведением теста на оксидазу допускается применение любого другого неселективного агара, если он не влияет на результаты теста.
8
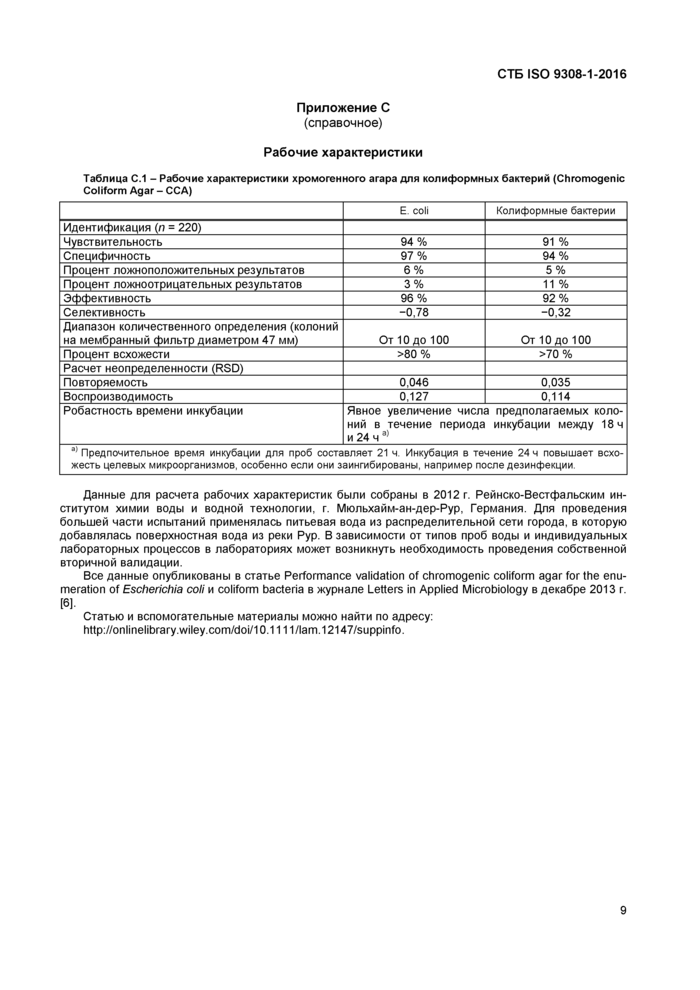
Приложение С
(справочное)
Рабочие характеристики
|
Таблица С.1 - Рабочие характеристики хромогенного агара для колиформных бактерий (Chromogenic Coliform Agar - CCA) | |||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
Данные для расчета рабочих характеристик были собраны в 2012 г. Рейнско-Вестфальским институтом химии воды и водной технологии, г. Мюльхайм-ан-дер-Рур, Германия. Для проведения большей части испытаний применялась питьевая вода из распределительной сети города, в которую добавлялась поверхностная вода из реки Рур. В зависимости от типов проб воды и индивидуальных лабораторных процессов в лабораториях может возникнуть необходимость проведения собственной вторичной валидации.
Все данные опубликованы в статье Performance validation of chromogenic coliform agar for the enumeration of Escherichia coli и coliform bacteria в журнале Letters in Applied Microbiology в декабре 2013 г. [6].
Статью и вспомогательные материалы можно найти по адресу: http://onlinelibrary.wiley.eom/doi/10.1111 /lam. 12147/suppinfo.
9
СТБ ISO 9308-1-2016Библиография
[1] ISO 7218:2007 Microbiology of food и animal feeding stuffs - General requirements и guid
ance for microbiological examinations
(Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям)
[2] BYAMUKAMA D., KANSIIME F., MACH R.L., FARNLEITNER А.Н. Determination of Escherichia coli Contamination with Chromocult Coliform Agar Showed a High Level of Discrimination Efficiency for Differing Fecal Pollution Levels in Tropical Waters of Kampala, Uganda. Appl. Environ. Microbiol. 2000, 66 pp. 864-868
(Исследование зараженности Escherichia coli с применением хромогенного агара Chromocult, предназначенного для культивирования колиформных бактерий, продемонстрировало высокую эффективность различения при определении уровней фекального загрязнения в тропических водах Кампалы, Уганда)
[3] GEISSLER К., MANAFI М., AMOROS I., ALONSO J.L. Quantitative determination of total conforms и Escherichia coli in marine waters with chromogenic и fluorogenic media. J. Appl. Microbiol. 2000, 88 pp. 280-285
(Количественное определение общего содержания колиформных бактерий и Escherichia coli в морских водах с использованием хромогенных и флуорогенных питательных сред)
[4] OSSMER R., SCHMIDT W., MENDE U. Chromocult Coliform Agar- Influence of Membrane Filter Quality on Performance. Poster presentation, 1999. Congreso de la Sociedad Espanola de Microbiologia, Granada, Spain (http://www.univie.ac.at/chromogenic/OSSMER.PDF) (Хромогенная агаровая среда Chromocult для колиформных бактерий. Влияние качества мембранных фильтров на эффективность применения. Стендовый доклад)
[5] USEPA: 40 CFR Part 141 (sec. 141.21) Federal Register/Vol. 67, No. 209, Tuesday October 29, 2002/Rules и Regulations
(Агентство по охране окружающей среды США. Раздел 40 Свода федеральных нормативных актов, часть 141 (пар. 141.21))
[6] LANGE, В., STRATHMANN, М., OSSMER, R. Performance validation of chromogenic coliform agar for the enumeration of Escherichia coli и coliform bacteria. Lett. Appl. Microbiol. 2013, 57 pp. 547-553 (http://onlinelibrary.wiley.eom/doi/10.1111/lam.12147/suppinfo)
(Валидация рабочих характеристик хромогенного агара при подсчете Escherichia coli и колиформных бактерий)
[7] http://www.wfcc.info/pdf/WDCM_Reference_Strain_Catalogue.pdf (viewed 03-01-2014)
10
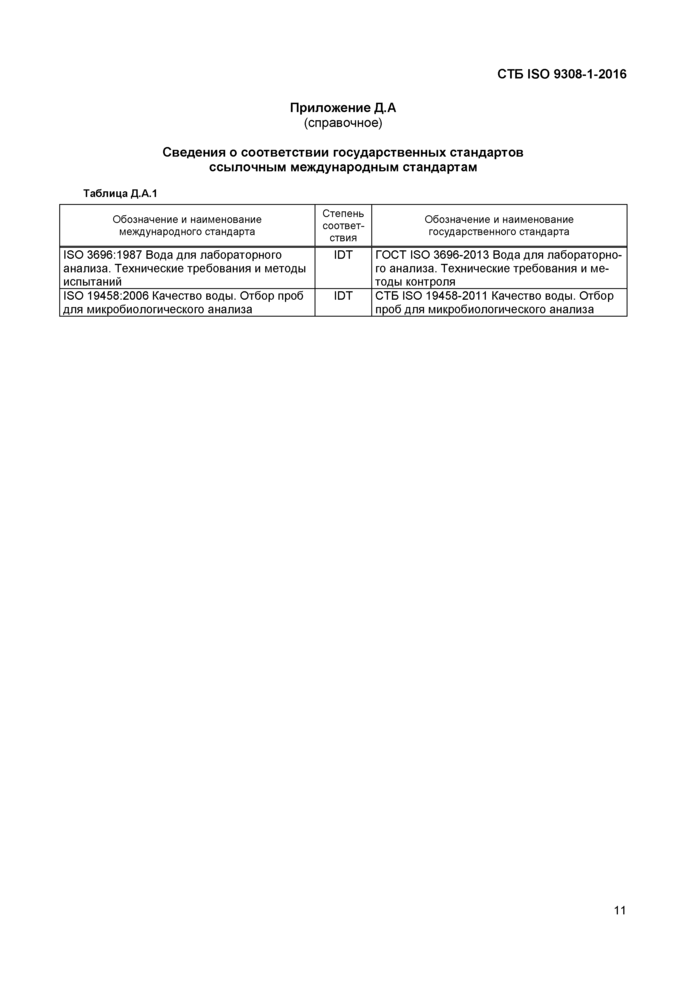
Приложение Д.А
(справочное)
Сведения о соответствии государственных стандартов ссылочным международным стандартам
|
Таблица Д.А.1 | |||||||||
|
11
Ответственный за выпуск Н. А. Баранов
Сдано в набор 24.01.2017. Подписано в печать 07.02.2017. Формат бумаги 60x84/8. Бумага офсетная. Гарнитура Arial. Печать ризографическая. Уел. печ. л. 1,86 Уч.-изд. л. 0,61 Тираж2экз. Заказ 337
Издатель и полиграфическое исполнение:
Научно-производственное республиканское унитарное предприятие «Белорусский государственный институт стандартизации и сертификации» (БелГИСС) Свидетельство о государственной регистрации издателя, изготовителя, распространителя печатных изданий
№ 1/303 от 22.04.2014 ул. Мележа, 3, коми. 406, 220113, Минск.
СТБ ISO 9308-1-2016Введение
Определение наличия и степени фекального загрязнения является важным фактором при оценке качества водоема и риска для здоровья человека, связанного с инфекционными заболеваниями.
Показателем такого загрязнения является наличие в пробах воды бактерий вида Escherichia coli (Е. coli), которые обычно присутствует в кишечнике человека и теплокровных животных. Результаты анализа на колиформные бактерии труднее поддаются интерпретации, поскольку некоторые коли-формные бактерии живут в почве и поверхностной пресной воде и не всегда имеют кишечное происхождение. Поэтому присутствие колиформных бактерий, хотя и не является доказательством фекального загрязнения, может указывать на нарушения в процессе очистки, хранения или распределения воды.
СТБ ISO 9308-1-2016
_ГОСУДАРСТВЕННЫЙ СТАНДАРТ РЕСПУБЛИКИ БЕЛАРУСЬ_
КАЧЕСТВО ВОДЫ
Подсчет количества кишечных палочек Escherichia coli и колиформных бактерий
Часть 1
Метод мембранной фильтрации для вод с низким содержанием бактериальной флоры
ЯКАСЦЬ ВАДЫ
Падлш колькасщ мшэчных палачак Escherichia coli i кал1формных бактэрый
Частка 1
Метад мембраннай фтьтрацьм для вод з Hi3KiM змяшчэннем бактэрыяльнай флоры
Water quality
Enumeration of Escherichia coli and coliform bacteria Part 1
Membrane filtration method for waters with low bacterial background flora
Дата введения 2017-06-01
ВНИМАНИЕ! Лица, применяющие настоящий стандарт, должны знать обычные методы работы лаборатории. Настоящий стандарт не рассматривает все вопросы безопасности, связанные с его использованием. Пользователь несет всю ответственность за принятие соответствующих мер безопасности и охрану здоровья, а также обеспечение соответствия всем национальным требованиям.
ВАЖНО! Необходимо, чтобы испытания, проводимые в соответствии с настоящим стандартом, выполнялись персоналом, прошедшим соответствующее обучение.
1 Область применения
Настоящий стандарт устанавливает метод для количественного учета Escherichia coli (Е. coli) и колиформных бактерий. Этот метод основан на мембранной фильтрации, последующем культивировании бактерий на хромогенной агаризованной среде и подсчете количества целевых микроорганизмов в пробе. В связи с низкой избирательностью дифференциальной агаризованной среды фоновый рост бактерий может помешать надежному количественному учету колиформных бактерий и Е. coli, например, в поверхностных водах или в воде из мелких колодцев. Данный метод не применим для этих типов воды.
Настоящий стандарт в наибольшей степени применим к воде с низким содержанием бактерий, при анализе которой на хромогенном колиформном агаре (chromogenic coliform agar - CCA) появляется не более 100 колоний. В эту категорию входит питьевая вода, дезинфицированная вода и вода, прошедшая процесс очистки.
Некоторые штаммы Е. Coli, не содержащие p-D-глюкуронидазу, например Escherichia coli 0157, не будут определяться как Е. coli. Поскольку они продуцируют p-D-галактозидазу, то будут проявляться как колиформные бактерии на данном хромогенном агаре.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные стандарты. Для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных ссылок применяют последнее издание ссылочного стандарта (включая все его изменения).
ISO 3696:1987 Вода для лабораторного анализа. Технические требования и методы испытаний
ISO 7704:1985 Качество воды. Оценка мембранных фильтров, используемых для микробиологического анализа
ISO 8199:2005 Качество воды. Общее руководство по подсчету микроорганизмов, выращенных методом посева на питательной среде
Издание официальное
ISO 11133:2014 Микробиология пищевых продуктов, кормов для животных и воды. Приготовление, производство, хранение и эксплуатационные испытания культуральных сред
ISO 19458:2006 Качество воды. Отбор проб для микробиологического анализа
3 Термины и определения
В настоящем стандарте применяют термины, установленные в Руководстве ISO/IEC 2, а также следующие термины с соответствующими определениями:
3.1 колиформные бактерии (coliform bacteria): Группа бактерии семейства Enterobacteriaceae, которые продуцируют p-D-галактозидазу.
3.2 Escherichia coli (Escherichia coli, Е. coli): Вид бактерий семейства Enterobacteriaceae, которые продуцируют p-D-галактозидазу и p-D-глюкуронидазу.
4 Сущность метода
Фильтрация анализируемой порции пробы через мембранный фильтр, задерживающий микроорганизмы, с последующим переносом фильтра в чашку Петри с хромогенным агаром.
Инкубация посевов в течение (21 ± 3) ч при температуре (36 ± 2) °С.
Подсчет колоний, дающих положительную реакцию на p-D-галактозидазу (от розового до красного), как предполагаемых колиформных бактерий, не являющихся Е. coli. Во избежание получения ложноположительных результатов, вызываемых оксидазаположительными бактериями рода Aeromonas spp, наличие предполагаемых колоний подтверждается проведением теста на оксидазу (оксидазаотрицательная реакция).
Подсчет колоний, дающих положительную реакцию на p-D-галактозидазу и p-D-глюкуронидазу (от темно-синего до фиолетового), как Е. coli.
Общее количество колиформных бактерий представляет собой сумму оксидазаотрицательных колоний от розового до красного цвета и всех колоний от темно-синего до фиолетового цвета.
5 Оборудование и стеклянная посуда
Используется обычное оборудование микробиологической лаборатории.
5.1 Устройство для паровой стерилизации (автоклав) в соответствии с инструкциями, приведенными в ISO 8199.
5.2 Инкубатор с регулируемой температурой (36 ± 2) °С.
5.3 pH-метр с точностью ±0,1 при температуре от 20 °С до 25 °С.
5.4 Оборудование для мембранной фильтрации.
5.5 Мембранные фильтры, состоящие из эфиров целлюлозы, обычно с диаметром 47-50 мм, с характеристиками фильтрации, эквивалентными номинальному диаметру пор 0,45 мкм, и предпочтительно с сеткой.
Фильтры не должны обладать свойствами, ингибирующими рост или способствующими росту бактерий, печатная краска сетки также не должна влиять на рост бактерий. Если фильтры не поставляются в стерильном виде, их стерилизуют в соответствии с инструкциями производителя. Каждую партию мембранных фильтров проверяют на пригодность для проведения испытаний согласно ISO 7704, так как применение фильтров разных производителей может привести к получению результатов разной всхожести и проявлению окраски разных цветов.
5.6 Пинцеты с закругленными концами для работы с мембранными фильтрами.
6 Питательные среды и реактивы
Для приготовления питательных сред и реактивов см. ISO 8199 и ISO 11133. Используют ингредиенты постоянного качества и реактивы ч. д. а. (см. примечание); следуют инструкциям, приведенным в приложении В. В качестве альтернативы используют коммерчески доступные среды и реактивы, состав которых соответствует приложению В. При этом строго придерживаются инструкций производителя.
Примечание - Допускается применение химических веществ иной чистоты, если будет продемонстрировано, что они дают воспроизводимые результаты.
СТБ ISO 9308-1-2016
Для приготовления питательных сред используют дистиллированную или деионизированную воду, не содержащую веществ, ингибирующих рост бактерий в условиях проведения испытания в соответствии с ISO 3696.
7 Отбор проб
Пробы отбирают и доставляют в лабораторию в соответствии с ISO 19458.
8 Процедура
8.1 Подготовка проб
При приготовлении пробы, фильтрации и посеве на среду для выделения следуют инструкциям, которые приводятся в ISO 8199. Пробы транспортируют и хранят при температуре (5 ± 3) °С в соответствии с ISO 19458. В исключительных случаях пробы до проведения анализа могут храниться при температуре (5 ± 3) °С до 24 ч. В данном случае время хранения необходимо указывать в протоколе испытаний.
8.2 Фильтрация
Фильтруют 100 мл анализируемой пробы или другие объемы (в зависимости от объема, в котором нормируется отсутствие данных микроорганизмов) с помощью мембранного фильтра (5.5). Минимальный объем для фильтрации составляет 10 мл пробы или ее разведений для обеспечения равномерного распределения бактерий на мембранном фильтре.
8.3 Инкубация и дифференцирование
После фильтрации (8.2) размещают фильтр на хромогенном агаре для выделения колиформных бактерий (Chromogenic Coliform Agar- CCA) (B.1), убедившись, что под фильтром не осталось пузырьков воздуха, и инкубируют при температуре (36 ± 2) °С в течение (21 ± 3) ч.
Мембранные фильтры осматривают и подсчитывают все колонии, дающие положительную реакцию на p-D-галактозидазу (от розового до красного), как предполагаемые колиформные бактерии, не являющиеся Е. coli.
Подсчитывают все колонии, дающие положительную реакцию на p-D-галактозидазу и p-D-глюкуронидазу (от темно-синего до фиолетового), как Е. coli.
Для подтверждения наличия предполагаемых колиформных бактерий, не являющихся Е. coli, проводят тест на оксидазу. Это испытание проводят предпочтительно для всех, но как минимум для 10 колоний от розового до красного цвета, как указано в ISO 8199. Для данного подтверждающего испытания могут быть использованы имеющиеся в продаже тесты на оксидазу 1).
Если не используется имеющийся в продаже тест на оксидазу, данное испытание проводят путем добавления двух-трех капель свежего реагента для теста на оксидазу (В.2) на фильтровальную бумагу в чашке Петри. Анализируемые колонии перемещают на приготовленную фильтровальную бумагу с помощью пластмассовой или платиновой петли. Положительная реакция на оксидазу проявляется в виде окрашивания в темно-синий цвет в течение 30 с. В случае колиформных бактерий такой реакции не наблюдается, так как они являются оксидазоотрицательными.
Если на мембранном фильтре выросло много колоний или если предполагаемая колония находится близко к другим колониям, может потребоваться пересев предполагаемых колоний, чтобы обеспечить проведение теста на оксидазу с чистыми культурами. Также получение чистой культуры необходимо, если предполагаемые колонии слишком малы для получения надежных результатов теста на оксидазу. При получении чистой кльтуры инкубация проводится на неселективном агаре (например, В.З) при температуре (36 ± 2) °С в течение (21 ± 3) ч.
11 Для оценки характеристик эффективности хромогенного колиформного агара (приложение С) было использовано испытание в Bactident®-OKcnfla3e. Bactident®- пример соответствующего продукта, доступного на рынке. Данная информация предоставляется для удобства пользователей настоящего стандарта и не представляет собой рекомендацию данных продуктов со стороны ISO.
3
9 Представление результатов
Исходя из количества подтвержденных колоний, подсчитанных на мембранном фильтре (8.3), рассчитывают количество Е. coli и колиформных бактерий на 100 мл пробы (или отфильтрованного объема) в соответствии с ISO 8199. Количество колиформных бактерий представляет собой сумму оксидазаотрицательных колоний от розового до красного цвета и всех колоний от темно-синего до фиолетового цвета. Е. coli представляет собой количество всех колоний от темно-синего до фиолетового цвета.
10 Протокол испытаний
Протокол испытаний должен содержать как минимум следующую информацию:
a) метод исследования, а также ссылку на настоящий стандарт;
b) всю информацию, необходимую для полной идентификации пробы;
c) результаты испытания, представленные в соответствии с разделом 9;
d) все особенности, наблюдавшиеся при проведении анализа, и все операции, не оговоренные в настоящем стандарте, которые могли повлиять на результаты испытания.
11 Контроль качества
11.1 Общие сведения
Лаборатория должна иметь четкую систему контроля качества, гарантирующую использование подходящего оборудования, реактивов и методов проведения испытаний. Применение положительного контроля, отрицательного контроля и холостых проб является частью испытания.
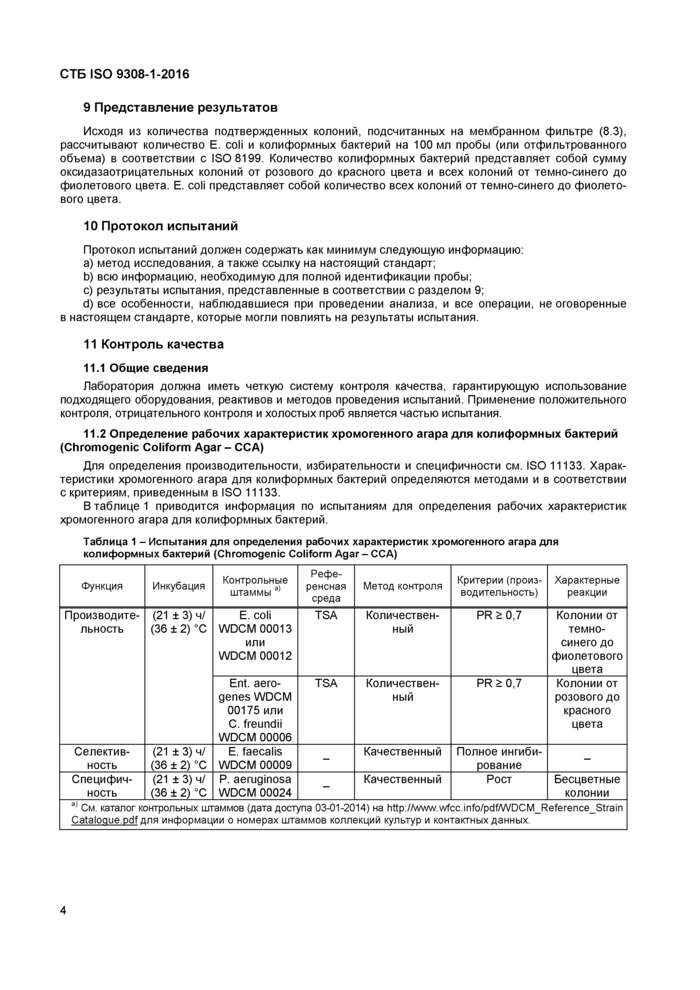
11.2 Определение рабочих характеристик хромогенного агара для колиформных бактерий (Chromogenic Coliform Agar - CCA)
Для определения производительности, избирательности и специфичности см. ISO 11133. Характеристики хромогенного агара для колиформных бактерий определяются методами и в соответствии с критериям, приведенным в ISO 11133.
В таблице 1 приводится информация по испытаниям для определения рабочих характеристик хромогенного агара для колиформных бактерий.
|
Таблица 1 - Испытания для определения рабочих характеристик хромогенного агара для колиформных бактерий (Chroniogenic Coliform Agar - CCA) | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
|
a) См. каталог контрольных штаммов (дата доступа 03-01-2014) на http://www.wfcc.info/pdf/WDCM_Reference_Strain Cataloque.pdf для информации о номерах штаммов коллекций культур и контактных данных. |
СТБ ISO 9308-1-2016
11.3 Определение рабочих характеристик теста на оксидазу
Примерами соответствующих контрольных штаммов являются Pseudomonas aeruginosa WDCM 00024 [7] (положительный контроль), Escherichia coli WDCM 00013 [7] или WDCM 00012 [7] (отрицательный контроль).
5
СТБ ISO 9308-1-2016Приложение А
(справочное)
Дополнительная микробиологическая информация о колиформных бактериях
Помимо способности продуцировать p-D-галактозидазу колиформные бактерии являются грамот-рицательными неспорообразующими палочками, оксидазаотрицательными, способными расти в аэробных и факультативно анаэробных условиях в присутствии солей желчных кислот (или других поверхностно-активных веществ, имеющих аналогичные ингибирующие рост свойства). Колиформные бактерии также обычно способны ферментировать лактозу с образованием кислоты и альдегида в течение 48 ч при температуре (36 ± 2) °С.
Помимо способности продуцировать p-D-глюкуронидазу бактерии вида Е. coli являются коли-формными бактериями, имеющими способность образовывать индол из триптофана в течение (21 ± 3) ч при температуре (44,0 ± 0,5) °С. Таким образом, в случае если принадлежность выделенных на хромогенном агаре колоний к бактериям вида Е. coli вызывает сомнение, необходимо проведение подтверждающего теста на индол. Бактерии вида Е. coli положительно реагируют на пробу с метиловым красным и могут декарбоксилировать L-глутаминовую кислоту, но не способны продуцировать ацетилметилкарбинол, использовать цитрат как единственный источник углерода и расти в бульоне с цианидом калия.
6
Приложение В
(обязательное)
Состав и подготовка питательных сред и реактивов В.1 Хромогенный агар для колиформных бактерий (Chromogenic Coliform Agar - CCA)
|
Ферментативный гидролизат казеина |
1,0 г |
|
Дрожжевой экстракт |
2,0 г |
|
Хлорид натрия |
5,0 г |
|
Дигидрофосфат натрия х 2Н20 |
2,2 г |
|
Гидрофосфат натрия |
2,7 г |
|
Пируват натрия |
1,0 г |
|
Сорбитол |
1,0 г |
|
Триптофан |
1,0 г |
|
Сурфактант этилоксилата вторичного спирта (CAS No. 68131-40-8)а> (например, тер-гитола ® 15-S-7 сурфактант)ь' |
0,15 г |
|
6-Хлоро-3-индоксил-(3-0-галактопиранозид (бета-Р-галактозид), (CAS No. 138182-21-5) |
0,2 г |
|
5-Бромо-4-хпоро-3-индоксил-р-0-глюкуроновая кислота, моногидрат соли циклогек-силаммония (соль Х-бета-С-глюкуронида СНХ) (CAS No. 114162-64-0) |
0,1 г |
|
Изопропил-Р-Р-тиогалактопиранозид (IPTG) (CAS No. 367-93-1) |
0,1 г |
|
Бактериологический агар (в форме порошка или хлопьев) |
9-18 гС) |
|
Вода |
1000 мл |
|
a) Номер CAS/регистрационный номер CAS является уникальным идентификатором Службы химических выборок (Chemical Abstracts Service - CAS) для химических элементов, составов, полимеров, биологических цепочек, смесей и сплавов. b) Tergitol®- пример соответствующего продукта, доступного на рынке. Данная информация предоставляется для удобства пользователей настоящего стандарта и не представляет собой утверждение данных продуктов со стороны ISO. c) В зависимости от гелеобразующей способности агара. | |
Суспендируют ингредиенты в воде при нагревании на кипящей водяной бане или в струе пара при частом помешивании до полного растворения (приблизительно 35 мин). При необходимости регулируют значение pH таким образом, чтобы после термической обработки оно составило 6,8 ±0,1 при температуре 25 °С. Не допускается стерилизация в автоклаве и перегревание. Разливают в чашки Петри слоем толщиной минимум 4 мм. Если чашки не используются сразу же, допускается их хранение в течение не более одного месяца при температуре (5 ± 3) °С в темном месте при условии защиты от испарения. Перед использованием чашек на них не должно быть видимой влаги. Если на чашках присутствует видимая влага, их сушат в течение минимального времени, необходимого для ее испарения.
| ||||
|
Этот реактив не является стабильным. Его готовят маленькими порциями непосредственно перед использованием и защищают от действия света. |
В.2 Реактив оксидазы
ПРЕДУПРЕЖДЕНИЕ! Тетраметил-р-фенилендиамин дигидрохлорид является канцерогенным веществом. Приготовление проводят в вытяжном шкафу, используя защитные перчатки и избегая контакта вещества с кожей.
В.З Триптон-соевый агар (Tryptone Soy Agar - TSA)
|
Триптон |
15,0 г |
|
Соевый пептон |
5,0 г |
|
Хлорид натрия |
5,0 г |
|
Агар (в форме порошка или хлопьев) |
15-25 г а> |