СТБ ИСО 6468-2003
Качество воды. Определение некоторых хлорорганических инсектицидов, полихлорированных бифенилов и хлорбензолов методом газовой хроматографии после экстракции жидкость-жидкость
Купить СТБ ИСО 6468-2003 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на метод определения некоторых хлорорганических инсектицидов, полихлорированных бифенилов и хлорбензолов (за исключением моно- и дихлорбензолов) в питьевой воде, а также грунтовых, поверхностных и сточных водах. Стандарт устанавливает пределы обнаружения в соответствии с определяемыми соединениями и типом водной матрицы для вод с низким содержанием органических веществ.
Стандарт идентичен международному стандарту ISO 6468:1996
Оглавление
1 Область применения
2 Нормативные ссылки
3 Основные положения
4 Реагенты и материалы
5 Аппаратура
6 Отбор и подготовка проб
7 Процедура
8 Калибровка
9 Идентификация и оценка результатов
10 Способ выражения результатов
11 Представление данных
12 Форма отчета проводимых испытаний
Приложение А Очистка экстракта от серы с помощью пирогенной меди
Приложение В Примеры газохроматографических условий и соответствующие хроматограммы
Приложение С
Приложение D
Приложение Е
Приложение F
Приложение G Очистка на макроколонке с силикагелем
Приложение Н
| Дата введения | 01.05.2004 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Завершение срока действия | 01.07.2020 |
| Актуализация | 01.01.2021 |
Организации:
| 31.10.2003 | Утвержден | Госстандарт Республики Беларусь | 44 |
|---|---|---|---|
| Разработан | БелГИМ | ||
| Издан | БелГИСС | 2004 г. |
Water quality. Determination of certain organochlorine insecticides, polychlorinated biphenyls and chlorobenzenes gas chromatographic method after liguid-liguid extraction
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:
стр. 1

стр. 2

стр. 3

стр. 4

стр. 5
стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
стр. 18

стр. 19

стр. 20
стр. 21

стр. 22
стр. 23
стр. 24
стр. 25
стр. 26
стр. 27
стр. 28
стр. 29
стр. 30
|
к СТБ ИСО 6468-2003 Качество воды. Определение некоторых хлорорганических инсектицидов, полихлорированных бифенилов и хлорбензолов методом газовой хроматографии после экстракции жидкость-жидкость | |||||||||
| |||||||||
|
(ИУ ТИПА № 2 2009) |
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РЕСПУБЛИКИ БЕЛАРУСЬ
КАЧЕСТВО ВОДЫ
Определение некоторых хлорорганических инсектицидов, полихлорированных бифенилов и хлорбензолов методом газовой хроматографии после экстракции жидкость-жидкость
ЯКАСЦЬ ВАДЫ
Вызначэнне некаторых хлораргашчных шсектыцыдау, пол1хларыраваных б1феншау i хлорбензолау метадам газавай храматаграфм пасля экстракцьм вадкасць-вадкасць
(ISO 6468:1996, ЮТ)
Издание официальное
Госстандарт
Минск
- безводный сульфат натрия добавляют (4.3) в колбу с экстрактом. Колбу встряхивают в течение 1 мин. Выдерживают 5 мин. после чего экстракт декантируют в аппарат для концентрирования. Сульфат натрия дополнительно промывают 10-20 мл растворителя (4.2). Промывочный расторитель собирают в сосуд для выпаривания.
- экстракт охлаждают до температуры минус 18 °С в течение 2 ч. Экстракционный растворитель отделяют от льда и переносят в сосуд для выпаривания. Лед дополнительно промывают 10 мл растворителя (4.2). Промывочный растворитель собирают в сосуд для выпаривания.
7.2.2 Экстракция с использованием магнитного или высокоскоростного смесителя и разделение в микросепараторе
В пробу (7.1) добавляют 20 - 30 мл экстракционного растворителя (4.2).
Пробу с растворителем перемешивают в закрытом сосуде с использованием магнитной мешалки и стержня перемешивания (5.4) в течение 10 мин со скоростью не менее 1000 об./мин (растворитель должен быть равномерно распределен в объеме воды). Позволяют фазам разделиться.
В случае использования высокоскоростного смесителя (5.4) перемешивание осуществляют в течение 2 мин в закрытом сосуде при температуре 4 °С. а затем позволяют фазам разделиться.
Собирают микросепаратор (5.5). Очищенную воду (4.1) подают в трубку до тех пор. пока органическая фаза не достигнет уровня, достаточного для отбора экстракта пипеткой. Экстракт обезвоживают в соответствии с 7.2.1.
7.3 Концентрирование экстракта
Объединенные и обезвоженные экстракты (7.2.1, 7.2.2) концентрируют в соответствии с 7.3.1 или
7.3.2 либо с использованием любой другой подходящей системы выпаривания (5.8). Необходимо избегать потерь легколетучих целевых компонентов.
7.3.1 Концентрирование с использованием аппарата Кудерна-Даниша
Пределы обнаружения, удовлетворяющие требованиям метода, получают посредством выпаривания экстракта до небольшого объема в аппарате Кудерна-Даниша (5.6) с микроколонкой Шнайдера (5.7) следующим образом:
- обезвоженный экстракт переносят в аппарат Кудерна-Даниша;
- добавляют два центра кипения (4 11) и выпаривают до (5 ± 1) мл на паровой бане. Экстракт концентрируют до объема не более 1 мл с использованием микроколонки Шнайдера или в потоке чистого инертного газа (например, азота), пропускаемого через экстракт, помещенный в нагретую водяную баню (с температурой не более 40 °С).
Примечание 9 - Дополнительные меры предосторожности не требуются, если экстракт выпаривают с использованием данного аппарата до конечного объема более 0.5 мл. Если требуется меньший конечный объем экстракта, рекомендуется использовать удерживающий агент (4 4) для предотвращения значительных потерь В качестве удерживающего агента можно использовать декан или додекан, так как они не дают отклика детектора электронного захвата К концентрируемому экстракту добавляют 0,1 мл раствора, содержащего 20 г/л декана либо додекана в гексане
7.3.2 Концентрирование с использованием роторного испарителя
Экстракт концентрируют с использованием роторного испарителя (5.8) в конической колбе или в конической колбе с ампульным расширением до объема не менее 0.6 мл при постоянном вакууме с остаточным давлением 34 кПа (340 мбар). Колбу для выпаривания аппарата Кудерна-Даниша (5.6) устанавливают между конической колбой с экстрактом и роторным испарителем.
Коническую колбу с экстрактом помещают в холодную водяную баню или для экстракционных растворителей с более высокой температурой кипения - в водяную баню, температура которой не превышает 50 °С. После концентрирования экстракт количественно переносят в мерную колбу объемом 1 мл. Тщательно промывают стенки конической колбы небольшим объемом растворителя (4.2). Промывочный растворитель переносят в мерную колбу с экстрактом и доводят до метки растворителем.
7.4 Газовая хроматография
На этой стадии проводят газохроматографический анализ без дальнейшей очистки для экстрактов проб чистой воды.
Если анализ предполагает стадию очистки, то дальнейшую подготовку пробы выполняют в соответствии с 7.5.
Устанавливают газовый хроматограф (5.1) с детектором электронного захвата и выбранной колонкой (5.2) в соответствии с инструкциями изготовителя, обеспечивают стабильность условий.
Экстракт (объем инжекции 1-10 мкл в зависимости от объема инжекции при проведении калибровки) вводят в газовый хроматограф и получают хроматограмму.
Полученную газовую хроматограмму сравнивают с хроматограммами стандартных растворов (раздел 8).
Проводят количественную и качественную оценку газовой хроматограммы (раздел 9).
Требования к измерениям, калибровке, оценке и используемым методам расчета описаны в разделе 8. В полученной газовой хроматограмме проверяют возможность наложения ликов, появляющееся в области времени удерживания целевых компонентов. В случае присутствия интерферирующих пиков следует применять один из методов очистки, указанных в 7.5. В ином случае проводят качественный и количественный анализ в соответствии с разделом 9.
7.5 Очистка и разделение
Применение процедуры, указанной в 7.2, может приводить к совместной экстракции относительно полярных и/или других нежелательных веществ, которые могут создать помехи в виде неизвестных пиков, накладывающихся на пики пестицидов.
Примечание 10 - Очистка экстрактов с использованием колоночной хроматографии позволяет удалить некоторые вещества Однако данный метод нельзя рассматривать в качестве метода абсолютной очистки экстрактов
Используют одну или обе приведенные процедуры:
- очистка на колонке с оксидом алюминия - оксидом алюминия/нитратом серебра для удаления полярных компонентов (7.5.1);
- очистка на колонке с силикагелем для отделения полихлорированных бифенилов от большинства инсектицидов.
Примечание 11 - Качество каждой группы колонок следует проверять с использованием стандартных растворов
7.5.1 Очистка на колонке с оксидом алюминия - оксидом алюминия/нитратом серебра
Очистку на колонке с оксидом алюминия - оксидом алюминия/нитратом серебра проводят в соответствии с 7.5.1.1 и 7.5.1.2. В присутствии остаточной интерференции применяют дополнительную процедуру, указанную в приложении А.
Примечание 12 - Некоторые соединения, например эндосульфан, могут остаться в колонке
7.5.1.1 Подготовка колонки
Экстракционный растворитель (4 2) объемом (15 ± 1) мл помещают в колонку (5.10). добавляют (1.0 ±0.2) г оксида алюминия/нитрата серебра (4.7) и позволяют постепенно осесть. Затем добавляют (2.0 ± 0,2) г оксида алюминия (4.6) и вновь позволяют постепенно осесть. Добавляют сульфат натрия (4.3) в количестве, достаточном для формирования слоя толщиной 5 мм в верхней части колонки. Колонку готовят непосредственно перед использованием.
7.5.1.2 Очистка
Колонку с оксидом алюминия - оксидом алюминия/нитратом серебра готовят в соответствии с 7.5.1.1. Отделяют излишек экстракционного растворителя (4.2). Когда уровень растворителя достигнет верхнего слоя колонки, добавляют сконцентрированный экстракт пробы (7.3). Емкость от экстракта промывают экстракционным растворителем (2 ± 0.5) мл. промывочный растворитель переносят в колонку. Затем через колонку пропускают (30 ± 1) мл экстракционного растворителя. Сбор и концентрирование экстракта проводят в соответствии с 7.3, затем выполняют газохроматографический анализ (7.4).
В процессе пропускания через колонку следует не допускать падения уровня растворителя (4.2) ниже поверхности слоя сорбента. Если колонка с оксидом алюминия потемнела по всей длине, необходимо подготовить новую колонку (7.5.1.1) и повторить процедуру очистки. Если потемнение происходит постоянно, можно использовать большие колонки, однако для элюирования требуется дополнительное количество растворителя.
7.5.2 Очистка на колонке с силикагелем
7.5.2.1 Подготовка колонки
Выбирают хроматографическую колонку (5.12). как показано на рисунке F.1 приложения F (первоначально без присоединенного резервуара для растворителя (рисунок Е 2). Нижний конец колонки временно перекрывают резиновой пробкой и заполняют колонку экстракционным растворителем (4.2). Слой из стекловаты (4.15) помещают на дно колонки.
Готовят суспензию силикагеля (4.8) массой 1 г в экстракционном растворителе (4.2).
Суспензию переносят в хроматографическую колонку с помощью пипетки.
Постоянным встряхиванием колонки позволяют силикагелю осесть для получения плотного слоя, иначе сульфат натрия, помещенный на силикагеле, проникнет внутрь слоя.
Снимают резиновую пробку.
Следующие стадии, включая стадии пункта 7.5.2.2. проводят непрерывно с того момента, как растворитель начнет выходить из колонки.
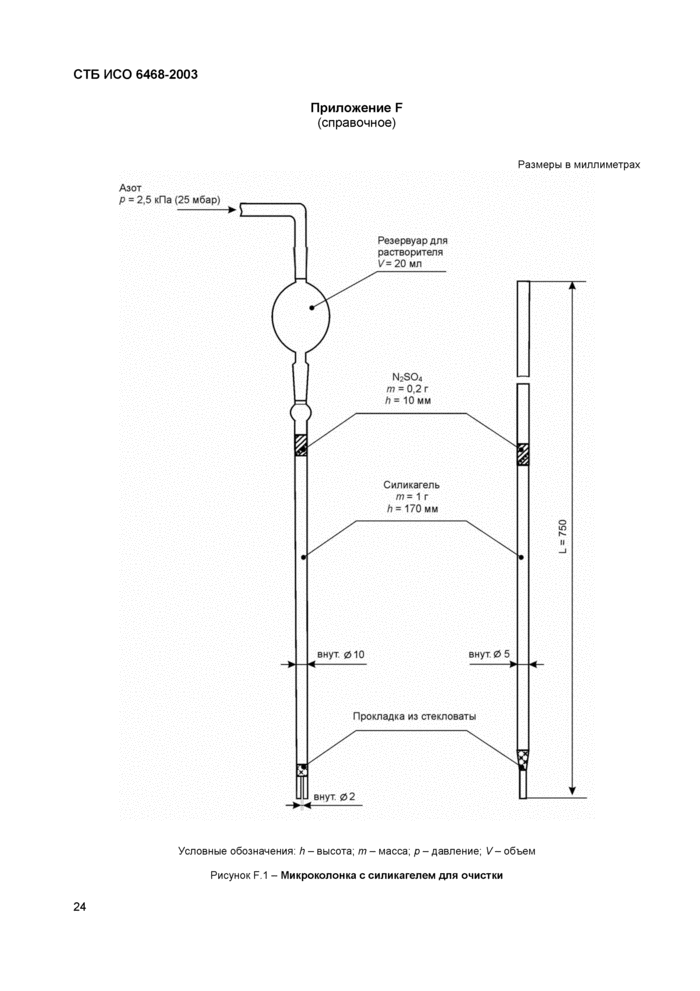
0.2 г сульфата натрия (4.3) помещают на слой силикагеля. К колонке присоединяют резервуар для растворителя и систему промывают 5 мл растворителя (4.2).
Как только весь растворитель перейдет в колонку, отсоединяют резервуар для растворителя и немедленно приступают к выполнению процедуры в соответствии с 7.5.2.2.
Примечание 13 - В качестве альтернативного варианта можно использовать сухие набивные и/или коммерчески доступные одноразовые колонки, если они удовлетворяют необходимым требованиям
7.5.2.2 Очистка и разделение
100 мкл экстракта переносят в колонку при помощи шприца объемом 100 мкл непосредственно перед тем. как верхний уровень растворителя достигнет слоя сульфата натрия.
Примечание 14 - Скорость потока через колонку должна составлять приблизительно 1 - 2 капли в секунду. Примечание 15 - В зависимости от концентрации хлорорганических соединений в пробе, рекомендуется, по крайней мере, 1/10 экстракта пробы подвергать очистке Это означает, что перед очисткой экстракт пробы необходимо сконцентрировать до объема не более 1 мл с использованием методов, указанных в 7 3.
Вновь присоединяют резервуар для растворителя (7.5.2.1) и добавляют 5 мл экстракционного растворителя (4.2).
Для ускорения процесса колоночной хроматографии присоединяют устройство подачи сжатого инертного газа (например, азота) с давлением около 2.5 кПа (25 мбар).
Первую фракцию растворителя собирают в градуированную пробирку Кудерна-Даниша.
Когда верхний уровень растворителя достигнет слоя сульфата натрия, добавляют дополнительное количество растворителя. После отсоединения устройства подачи сжатого инертного газа повторяют стадии в следующем порядке:
- вторая фракция: 2.5 мл растворителя (4.2);
- третья фракция: 2.5 мл растворителя;
- четвертая фракция: 8 мл растворителя;
- пятая фракция: 8 мл смеси растворитель/толуол (4.9) (95:5 об );
- шестая фракция: 16 мл шеей растворитель/толуол (90:10 об );
- седьмая фракция: 8 мл смеси растворитель/диэтиловый эфир (4.10) (99,5:0.5 об.).
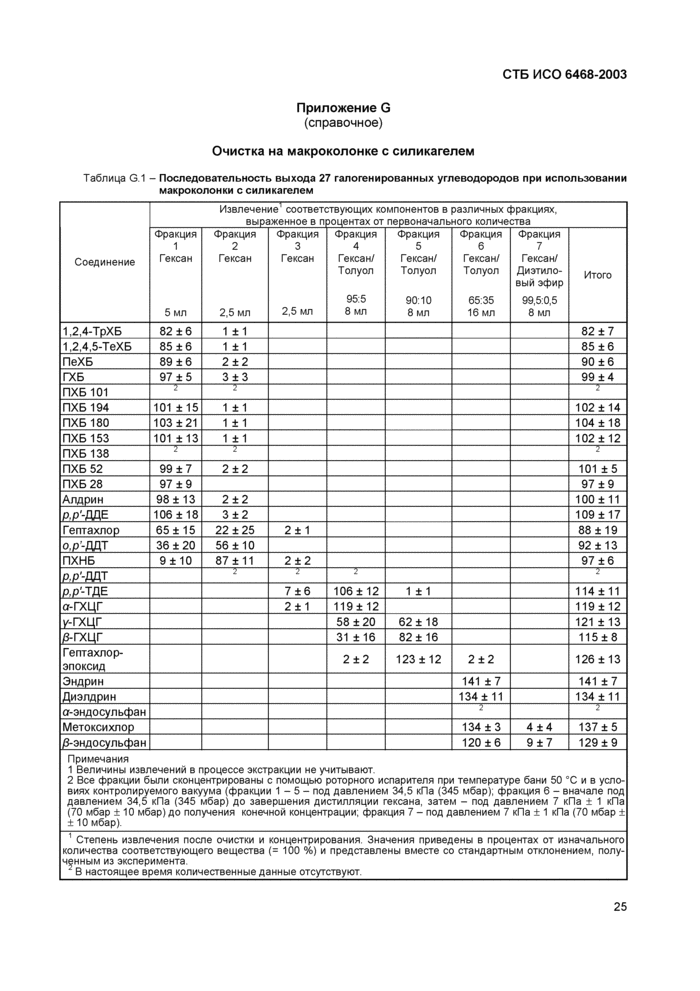
Примечание 16 - В таблице G 1 приложения G приведен пример, описывающий последовательность элюирования 27 соединений в макроколонке с силикагелем (5.11) после их извлечения с последующим концентрированием в роторном испарителе
Перед концентрированием фракции объединяют.
Концентрирование объединенных фракций проводят в соответствии с пунктом 7.3, после чего анализируют с помощью газового хроматографа (7.4).
7.6 Определение холостой пробы
Образец чистой воды (4.1) проходит все стадии предварительной обработки, экстракции, концентрирования, очистки, газохроматографического анализа вместе с реальными пробами.
Если значение холостой пробы выше ожидаемого, т. е. составляет более 10 % от минимального значения любого из целевых компонентов, то необходимо выполнить поэтапный анализ процедуры и устранить причину.
8 Калибровка
Степень извлечения определяют, используя следующие методы:
а) калибровку посредством прямого ввода стандартных растворов в растворителе (8.1).
Данный метод дает информацию о линейном рабочем диапазоне детектора, времени удерживания и относительных откликах целевых компонентов.
b) калибровку как полную процедуру (8.2) с использованием проб воды (предпочтительно того же типа, что и анализируемые пробы), к которым предварительно добавляют стандартный раствор, затем экстрагируют и. в случае необходимости, подвергают очистке.
Данные, полученные методом а), сравнивают сданными, полученными методом Ь). для расчета степени извлечения (8.3) каждого целевого компонента.
Ежедневно выполняют перекалибровку (8 4) с использованием стандартных растворов в растворителе в соответствии с методом а) либо с использованием водных экстрактов со стандартной добавкой в соответствии с методом Ь).
В таблице 2 приведено пояснение нижних индексов, используемых в уравнениях и в расшифровке символов после уравнений.
|
Таблица 2 - Пояснение нижних индексов, используемых в символах | ||||||||
|
8.1 Калибровка методом внешнего стандарта без проведения полной процедуры
В газовый хроматограф вводят рабочие стандартные растворы (4.14) объемом от 1 до 10 мкл.
Измеряют газохроматографические сигналы для каждого вещества (высоты пиков, площади пиков или единицы площади интегрирования), рассчитывают концентрации.
Для графического представления калибровочной кривой измеренные значения у* наносят на ось ординат, а соответствующие массовые концентрации р* вещества /- на ось абсцисс.
Объем инжекции при калибровке и измерении экстрактов проб должен быть одинаковым.
Ряд измеренных величин, полученных таким образом, используют для вычисления функции линейной регрессии:
Ут=т1хрт + Ь„ (1)
где ул~ зависимая переменная - измеренная величина отклика вещества /, которая зависит от р* (единицы измерений зависят от способа оценки, например величины площади); р* - независимая переменная - массовая концентрация вещества / (внешний стандарт) в калибровочном растворе, нанограмм на микролитр; т, - угол наклона калибровочной кривой вещества / (единицы измерений зависят от способа оценки, например величины площади х мкл/нг);
Ь, - отрезок калибровочной кривой на оси ординат (единицы измерений зависят от способа оценки, например величины площади). Как правило, этот отрезок очень мал В случае больших отрезков максимальной(ыми) концентрацией(ями) стандарта(ов) пренебрегают и производят пересчет функции линейной регрессии. Это должно уменьшить величину отрезка. В противном случае следует проверить газохроматографическую систему, а также способ оценки.
8.2 Калибровка как полная процедура с использованием метода внешнего стандарта
Для каждого компонента должен быть построен отдельный калибровочный график (через весь процесс полной процедуры), состоящий из. по крайней мере, пяти точек. В одной процедуре калибровки допускается анализировать несколько компонентов.
Для калибровки как полной процедуры готовят водные растворы добавлением в воду (4.1) целевых компонентов, определяемых в индивидуальном концентрационном диапазоне в пределах линейного динамического диапазона детектора, приведенного ниже.
8.2.1 Приготовление водных калибровочных растворов
В мерную колбу объемом 100 мл. содержащую около 90 мл растворителя, смешиваемого с водой (4.16). добавляют определенное количество стандартных растворов (4.12) каждого целевого компонента, погружая микрошприц (5.13) в растворитель.
После этого раствор доводят до метки тем же растворителем (4.16).
Плотно закрывают колбу стеклянной притертой пробкой и осторожно встряхивают раствор.
Рассчитывают концентрации каждого добавленного компонента.
Приготовленный таким образом раствор хранят при температуре 4 °С в темном месте в течение нескольких недель. Перед использованием раствор рекомендуется выдержать при комнатной температуре в течение, по крайней мере, 15 мин.
Готовят не менее пяти водных калибровочных растворов (в зависимости от компонента) в диапазоне 1 - 200 нг/л. добавляя в воду (4.1) разные объемы данного раствора.
Для измерений холостых проб в емкость с водой (4.1) добавляют такое же количество растворителя. как для приготовления водных калибровочных растворов.
Следует добавлять минимальное количество растворителя (< 1 мл/л воды) для минимизации любого влияния на равновесие разделения.
Водные растворы со стандартной добавкой готовят непосредственно в день использования.
8.2.2 Калибровочная кривая
Экстракцию и концентрирование водных калибровочных растворов проводят в соответствии с 7.2 и 7.3.
В газовый хроматограф вводят экстракт холостой пробы, а затем калибровочные растворы в порядке увеличения концентрации р„. Измеряют величины пиков у*, калибровочных образцов.
Функцию регрессии для каждого вещества рассчитывают с использованием пар значений у** и р*,
У^=ш^хр„ + Рч. (2)
где у*д— зависимая переменная - измеренная в процессе калибровки величина отклика вещества /', которая зависит от р^ (единицы измерений зависят от способа оценки, например величины площади);
р*, - независимая переменная - массовая концентрация вещества i в калибровочном растворе, микрограмм на литр;
- угол наклона калибровочной кривой вещества /, часто выражаемый как f, (единицы измерений зависят от способа оценки, например величины площади х л/мкг); bq - отрезок калибровочной кривой на оси ординат (единицы измерений зависят от способа оценки, например величины площади).
Данные функции наносят на график, где ординатой являются измеренные сигналы у*, вещества /, а абсциссой - массовые концентрации р*, вещества / в водном калибровочном растворе. При помощи калибровочной кривой определяют рабочий диапазон процедуры.
8.3 Определение извлечения
m,v.
"V'V
А =
(3)
т
С помощью процедуры калибровки (8.1 и 8.2) определяют величину извлечения А, вещества / по формуле
где А - величина извлечения вещества / (безразмерная); т, - определяют по 8.1;
- определяют по 8.2.2; f - коэффициент пересчета (/= 1000);
Fv - отношение объема растворителя, пошедшего на экстракцию, и объема пробы. Данный коэффициент рассчитывают с учетом объема пробы, объема экстракционного растври-теля. факторов разбавления (если необходимо), а также объемов инжекций, если они отличаются от применяемых в процессе калибровки. Используют следующую формулу
где 14 - объем экстракционного растворителя, мл;
V0 - объем пробы, мл.
Полученная таким образом величина извлечения является действительной только для данных экспериментальных условий.
Примечание 17 - Формула (3) действительна, если значения Ь, и Ь„ относительно небольшие, а также, если калибровка согласно формулам (1) и (2) расматривает одинаковый диапазон значений концентраций (в экстракте и в стандарте), например, сопоставимые значения у* и у„
Большая величина извлечения является показателем высокой прецизионности и точности аналитического результата. Изменение этой величины свидетельствует о возможных проблемах при экстракции и приготовлении стандартных растворов. Степень извлечения зависит от целевых компонентов и в большинстве случаев превышает 60 %. В противном случае процедуру следует проверять.
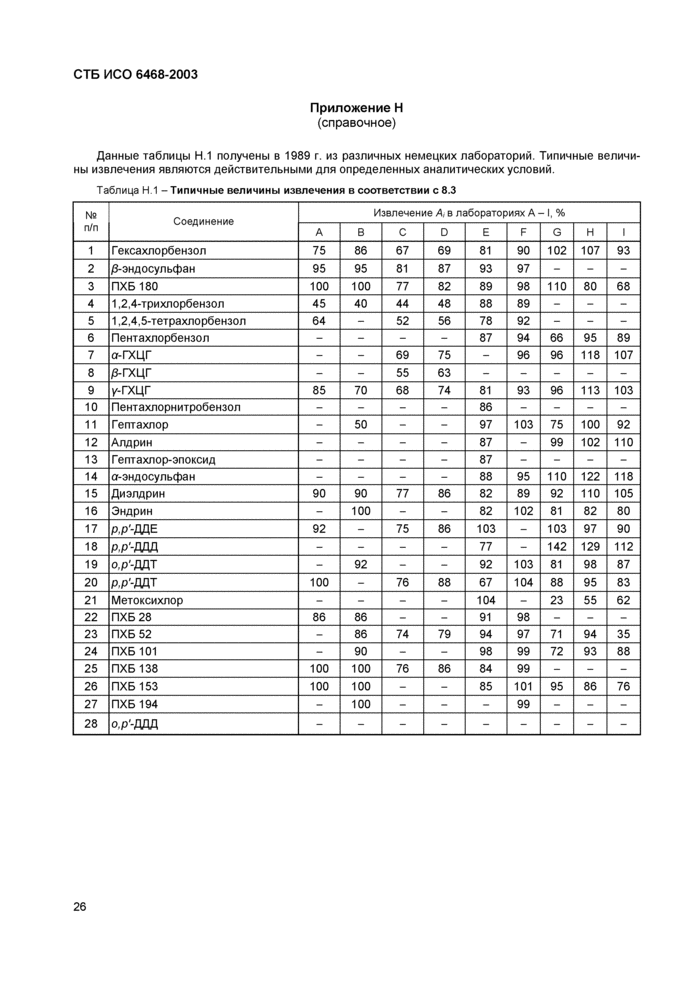
Величины извлечения, полученные различными лабораториями, приведены в таблице Н.1.
8.4 Перекалибровка
Для лерекалибровки необходимо работать в пределах ранее установленного линейного диапазона (8.1 или 8.2). Периодическую калибровку проводят регулярно, особенно при анализе загрязненных проб сточных вод либо промышленных загрязнений, так как такие типы матриц могут влиять на работу детектора и. следовательно, изменять линейный диапазон.
Для ежедневной лерекалибровки требуется ввод в газовый хроматограф как минимум двух стандартных растворов в растворителе (4.14) или двух экстрактов водных образцов со стандартной добавкой (8.2). Концентрация первого раствора должна составлять около 20 % выбранного линейного рабочего диапазона, а концентрация второго раствора - около 80 % данного диапазона.
Рассчитывают функцию регрессии.
Полученную таким образом функцию сравнивают с ранее построенной калибровочной кривой (8.1 или 8.2). Если значения находятся в пределах диапазона доверительных интервалов ранее построенной калибровочной кривой (8.1 или 8.2), то для расчета берут новые данные. В противном случае проверяют систему и строят новую калибровочную кривую.
9 Идентификация и оценка результатов
9.1 Идентификация индивидуальных соединений
Если в хроматограмме экстракта образца, приведшего разделение на отдельной капиллярной колонке, нет пика на соответствующем времени удерживания вещества, то считают, что это вещество не обнаружено.
Если при соответствующем времени удерживания вещества пик наблюдается, то присутствие данного вещества считают возможным. После этого необходимо подтверждение идентичности пика соответствующему веществу.
Повторяют процедуру сравнения с использованием капиллярной колонки (5.2) другой полярности.
Надежность идентификации увеличивается с увеличением разности в полярностях применяемых колонок. Если сравнительный анализ с использованием двух капиллярных колонок различных полярностей выявляет присутствие пиков на ожидаемом времени удерживания вещества, то идентификацию вещества оценивают как высоко вероятную.
Примечание 18 - При необходимости с целью дополнительного подтверждения используют масс-спектро-
метрию или химические испытания
9.2 Оценка результатов
9.2.1 Оценка с использованием (пере)калибровки в соответствии с 8.1
Массовую концентрацию р, вещества / в пробе воды рассчитывают по формуле, полученной после преобразования формулы (1) для массовой концентрации р,
и--. W/
т,
где р, - массовая концентрация вещества / в пробе воды (без учета извлечения), микрограмм на литр; у, - измеренная величина отклика вещества / в экстракте пробы воды (при условии, что применяют ту же процедуру, что при калибровке и измерениях), (единицы измерений зависят от способа оценки, например величины площади); т, - угол наклона калибровочной кривой (8.1 или 8.4) вещества / (единицы измерений зависят от способа оценки, например величины площади х л/мкг);
Ь,- отрезок исходной линии на оси ординат (единицы измерений зависят от способа оценки, например величины площади).
Если требуется учесть величину извлечения, то массовую концентрацию рл вещества / рассчитывают по формуле, полученной после преобразования формулы (1) для массовой концентрации рс.
у,-ь,
т х А
(6)
Р
к
где рс - массовая концентрация вещества / в пробе воды (с учетом извлечения), микрограмм на литр: у, - измеренная величина отклика вещества / в экстракте пробы воды (при условии, что применяют ту же процедуру, что при калибровке и измерениях), (единицы измерений зависят от способа оценки, например величины площади): т, - угол наклона калибровочной кривой (8.1 или 8.4) вещества /' (единицы измерений зависят от способа оценки, например, величины площади х л/мкг);
Ь,- отрезок исходной линии на оси ординат (единицы измерений зависят от способа оценки, например величины площади).
А, - величина извлечения для вещества / (безразмерная).
9.2.2 Оценка с использованием (лере)калибровки в соответствии с 8.2
Массовую концентрацию р„ вещества / в пробе воды рассчитывают по формуле, полученной после преобразования формулы (2) для массовой концентрации pv.
где pv - массовая концентрация вещества / в пробе воды (с учетом извлечения), микрограмм на литр; у* - измеренная величина отклика вещества / в экстракте пробы воды (при условии, что применяют ту же процедуру, что при калибровке и измерениях), (единицы измерений зависят от способа оценки, например величины площади); т,- угол наклона калибровочной кривой (8.1 или 8.4) вещества i (единицы измерений зависят от способа оценки, например величины площади х л/мкг); bq- отрезок исходной линии на оси ординат (единицы измерений зависят от способа оценки, например величины площади).
9.3 Интерпретация результатов
В описанной процедуре получают отдельные результаты для каждой используемой колонки. Окончательный количественный результат данных двух индивидуальных результатов вычисляют следующим образом:
- рассчитывают среднее арифметическое значение с учетом того, что разница между индивидуальными результатами должна составлять менее 10 % от меньшего результата;
- выбирают меньшее значение в случае большей разницы при условии, что меньшая величина не обусловлена утечкой в газохроматографической системе. Большая величина может являться результатом наложения пиков. Результат для отчета представляют как измеренную величину, полученную в результате разделения на одной колонке.
10 Способ выражения результатов
Массовые концентрации низколетучих галогенированных углеводородов выражают в микрограммах на литр:
- при массовых концентрациях менее 0.01 мкг/л с одной значимой цифрой;
- при массовых концентрациях более 0,01 мкг/л с двумя значимыми цифрами.
11 Представление данных
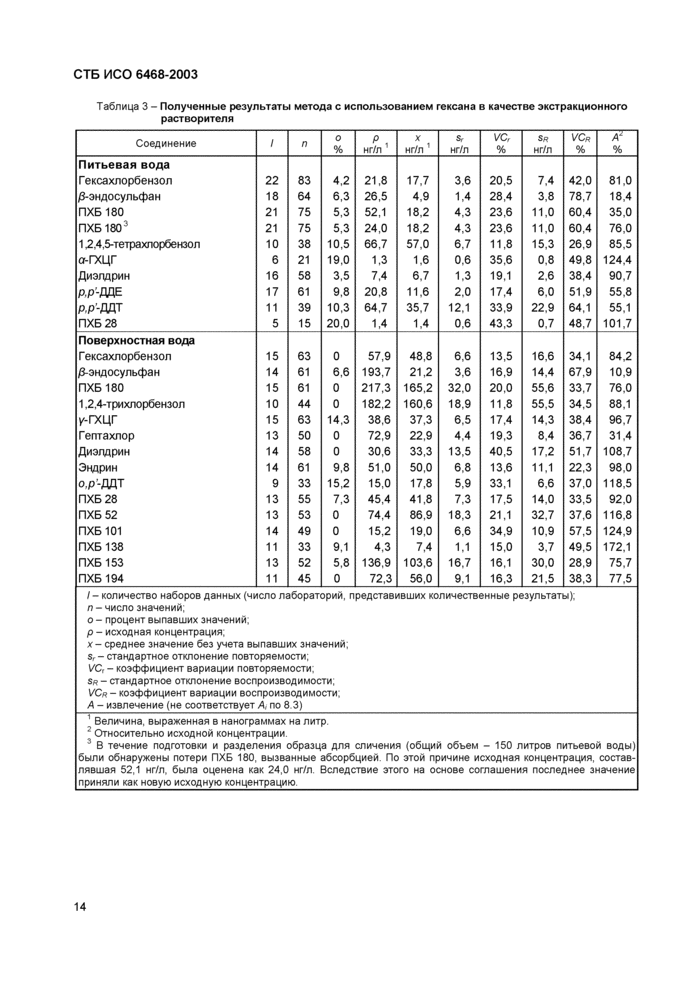
Данные межлабораторного сличительного анализа, организованного Германией с участием французских, голландских и английских лабораторий, приведены в таблице 3.
|
Таблица 3 - Полученные результаты метода с использованием гексана в качестве экстракционного растворителя | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
/-количество наборов данных (число лабораторий, представивших количественные результаты); л-число значений; о - процент выпавших значений, р - исходная концентрация,
х- среднее значение без учета выпавших значений,
Sr - стандартное отклонение повторяемости;
VC, - коэффициент вариации повторяемости,
Sr - стандартное отклонение воспроизводимости;
VCr - коэффициент вариации воспроизводимости,
А - извлечение (не соответствует А, по 8 3)_
[ Величина, выраженная в нанограммах на литр 2 Относительно исходной концентрации
' В течение подготовки и разделения образца для сличения (общий обьем - 150 литров питьевой воды) были обнаружены потери ПХБ 180, вызванные абсорбцией По этой причине исходная концентрация, составлявшая 52,1 нг/л, была оценена как 24,0 нг/л Вследствие этого на основе соглашения последнее значение приняли как новую исходную концентрацию_
12 Форма отчета проводимых испытаний
Отчет должен содержать следующую информацию:
a) ссылка на настоящий стандарт;
b) идентификация исходной пробы;
c) сведения о предварительной обработке пробы в случае, если таковая применялась;
d) сведения об используемом экстракционном растворителе, процедурах экстракции, концентрирования, очистки и разделения (посредством ссылок на соответствующие пункты настоящего стандарта);
e) сведения о процедуре оценки в соответствии с предписаниями в 9.2;
О способ выражения результатов в соответствии с требованиями раздела 10;
д) любые отклонения от данного метода, а также все обстоятельства, оказывающие влияние на результаты измерений.
Приложение А
(обязательное)
Очистка экстракта от серы с помощью пирогенной меди
А.1 Приготовление пирогенной меди
Предупреждение - Пирогенная медь легко воспламеняется при контакте с воздухом.
45 г сульфата меди (CuS04). 20 мл соляной кислоты (2 моль/л) и 480 мл воды помещают в стакан. Сульфат меди растворяют.
15 г порошка цинка помещают в другой стакан объемом 1 л. Добавляют 25 мл воды и одну каплю увлажняющего агента (на основе алкилсульфата натрия) или додецилсульфат натрия на шпателе.
Компоненты перемешивают в однородную суспензию с использованием магнитной мешалки.
Во время вращения магнитной мешалки раствор сульфата меди медленно добавляют по стеклянной палочке в однородную суспензию цинка.
Когда смесь станет красной и произойдет выделение водорода, перемешивание следует продолжать до тех пор. пока выделение газа значительно не уменьшится. Меди позволяют осесть, после чего воду декантируют.
Оставшиеся соли полностью вымывают дегазированной водой.
Для удаления воды в стакан добавляют три порции ацетона по 250 мл. содержимое встряхивают, позволяют меди осесть и жидкость декантируют.
Оставшийся ацетон удаляют, промывая медь гексаном.
Суспензию гексан/медь помещают в колбу Эрленмейера с притертой стеклянной пробкой, герметично закрывают. Хранят при температуре около 4 °С.
Через несколько месяцев эффективность действия смеси снижается, признаком чего является изменение цвета.
А.2 Применение
1 - 2 мл экстракта пробы помещают в центрифужную пробирку.
Добавляют около 100 мг меди (А.1), плотно закрывают и для перемешивания помещают на 10 мин в ультразвуковую ванну.
После этого центрифугируют в течение как минимум 5 мин при частоте вращения около 3500 об /мин.
Экстракт отделяют, медь промывают гексаном, промывочный растворитель добавляют к экстракту.
УДК 663.6:006.354(476) МКС 13 060 01 (КГС Н08) ЮТ
Ключевые слова: вода, качество, инсектициды хлорорганические. бифенилы полихлорированные, хлорбензолы. метод газовой хроматографии
Предисловие
1 ПОДГОТОВЛЕН Республиканским унитарным предприятием "Белорусский государственный институт метрологии" (БелГИМ)
ВНЕСЕН Министерством природных ресурсов и охраны окружающей среды
2 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ постановлением Госстандарта Республики Беларусь от 31 октября 2003 г. № 44
3 Настоящий стандарт идентичен международному стандарту ISO 6468:1996 "Water quality -Determination of certain organochiorine insecticides, polychlorinated biphenyls and chlorobenzenes -Gas chromatographic method after liguid-liguid extraction" (ИСО 6468:1996 "Качество воды. Определение некоторых хлорорганических инсектицидов, полихлорированных бифенилов и хлорбензолов. Метод газовой хроматографии после экстракции жидкость-жидкость").
Международный стандарт разработан Техническим комитетом ИСО/ТК 147 "Качество воды", подкомитетом ПК 2 "Физические, химические и биохимические методы".
Перевод с английского (еп).
Официальные экземпляры международных стандартов, на основе которого подготовлен настоящий государственный стандарт и на которые даны ссылки, имеются в БелГИСС.
Степень соответствия - идентичная (ЮТ)
4 ВВЕДЕН ВПЕРВЫЕ
Настоящий стандарт не может быть тиражирован и распространен без разрешения Госстандарта Республики Беларусь
Издан на русском языке
Приложение В
(справочное)
Примеры газохроматографических условий и соответствующие хроматограммы
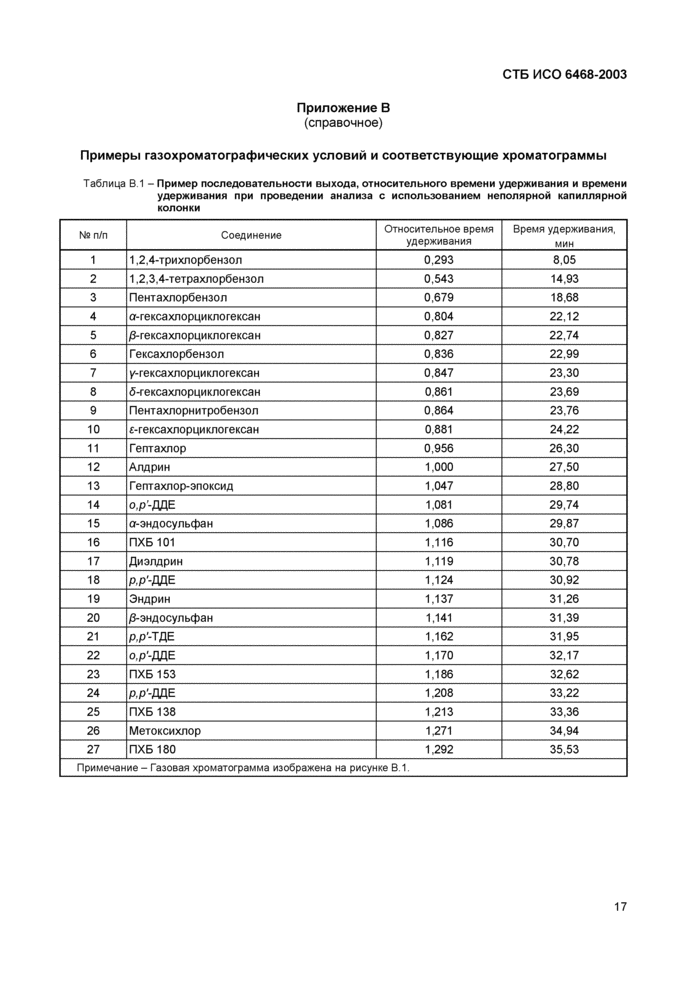
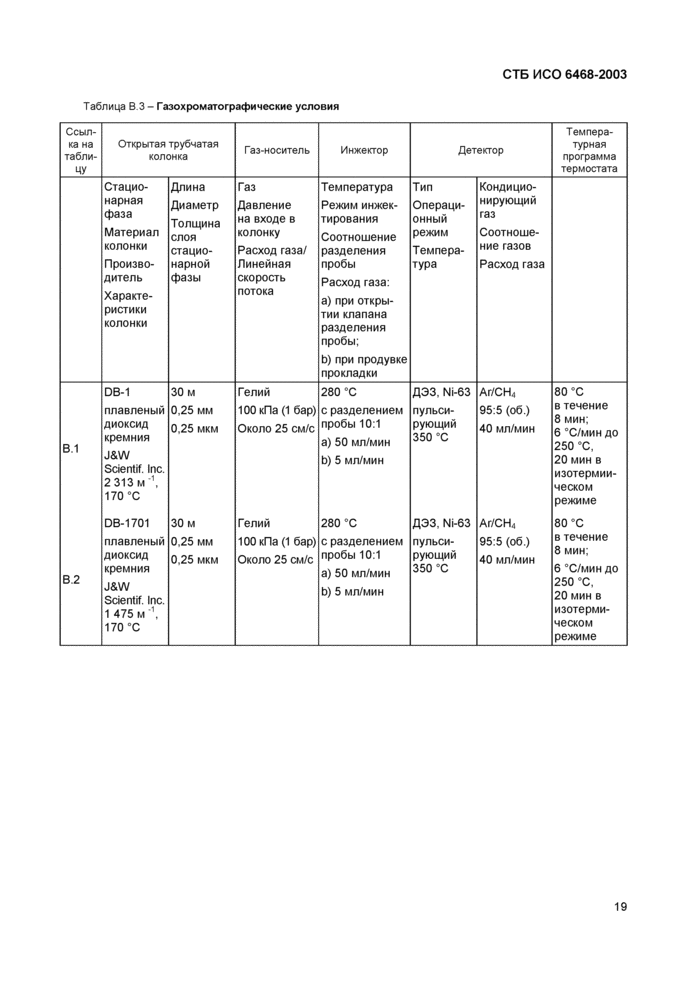
Таблица В.1 - Пример последовательности выхода, относительного времени удерживания и времени удерживания при проведении анализа с использованием неполярной капиллярной колонки
|
№ п/п |
Соединение |
Относительное время удерживания |
Время удерживания, мин |
|
1 |
1,2.4-трихлорбензол |
0.293 |
8,05 |
|
2 |
1,2.3,4-тетрахлорбензол |
0.543 |
14.93 |
|
3 |
Пентахлорбензол |
0,679 |
18.68 |
|
4 |
о-гексахлорциклогексан |
0,804 |
22,12 |
|
5 |
Д-гексахлорциклогексан |
0,827 |
22,74 |
|
6 |
Г ексахлорбензол |
0,836 |
22.99 |
|
7 |
у-гексахлорциклогексан |
0.847 |
23.30 |
|
8 |
б-г ексахлорци к логекса н |
0.861 |
23.69 |
|
9 |
Пентахлорнитробензол |
0,864 |
23,76 |
|
10 |
£-гексахлорциклогексан |
0,881 |
24,22 |
|
11 |
Гептахлор |
0,956 |
26,30 |
|
12 |
Алдрин |
1.000 |
27.50 |
|
13 |
Г ептахлор-эпоксид |
1.047 |
28.80 |
|
14 |
о.р’-ДДЕ |
1.081 |
29.74 |
|
15 |
о-эндосульфан |
1,086 |
29,87 |
|
16 |
ПХБ 101 |
1,116 |
30,70 |
|
17 |
Диэлдрин |
1,119 |
30,78 |
|
18 |
Р.Р’-ДДЕ |
1.124 |
30,92 |
|
19 |
Эндрин |
1.137 |
31,26 |
|
20 |
Д-эндосульфан |
1.141 |
31,39 |
|
21 |
р.р'-ТДЕ |
1,162 |
31,95 |
|
22 |
о,р-ДДЕ |
1,170 |
32,17 |
|
23 |
ПХБ 153 |
1,186 |
32,62 |
|
24 |
Р.Р'-ДДЕ |
1.208 |
33.22 |
|
25 |
ПХБ 138 |
1.213 |
33.36 |
|
26 |
Метоксихлор |
1271 |
34.94 |
|
27 |
ПХБ 180 |
1,292 |
35,53 |
|
Примечание - Газовая хроматограмма изображена на рисунке В 1. | |||
Содержание
1 Область применения............................................................................................................................1
2 Нормативные ссылки...........................................................................................................................2
3 Основные положения...........................................................................................................................2
4 Реагенты и материалы.........................................................................................................................3
5 Аппаратура............................................................................................................................................5
6 Отбор и подготовка проб.....................................................................................................................6
7 Процедура.............................................................................................................................................6
8 Калибровка.............................................................................................................................................9
9 Идентификация и оценка результатов.............................................................................................12
10 Способ выражения результатов........................................................................................................13
11 Представление данных......................................................................................................................13
12 Форма отчета проводимых испытаний.............................................................................................15
Приложение А Очистка экстракта от серы с помощью пирогенной меди..........................................16
Приложение В Примеры газохроматографических условий и
соответствующие хроматограммы...............................................................................17
Приложение С..........................................................................................................................................21
Приложение D..........................................................................................................................................22
Приложение Е..........................................................................................................................................23
Приложение F..........................................................................................................................................24
Приложение G Очистка на макроколонке с силикагелем....................................................................25
Приложение Н..........................................................................................................................................26
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РЕСПУБЛИКИ БЕЛАРУСЬ
КАЧЕСТВО ВОДЫ Определение некоторых хлорорганических инсектицидов, полихлорированных бифенилов и хлорбензолов методом газовой хроматографии после экстракции жидкость-жидкость
ЯКАСЦЬ ВАДЫ Вызначэнне некаторых хлораргажчных шсектыцыдау, пол1хларыраваных б1фежлау i хлорбензолау метадам газавай храматаграфМ пасля экстракцьм вадкасць-вадкасць
WATER QUALITY Determination of certain organochiorine insecticides, polychlorinated biphenyls and chlorobenzenes gas chromatographic method
after liguid-liguid extraction
Дата введения 2004-05-01
Меры предосторожности
Данный метод предполагает использование огнеопасных и токсичных органических растворителей. что требует строгого соблюдения предписываемых правил техники безопасности.
Детектор электронного захвата (ДЭЗ) содержит радионуклиды, поэтому необходимо соблюдать соответствующие меры предосторожности и выполнять установленные требования.
Галогенированные углеводороды и хлорорганические пестициды, используемые для приготовления калибровочных стандартных растворов, являются токсичными, ввиду чего необходимо строго соблюдать правила техники безопасности.
1 Область применения
Настоящий стандарт распространяется на метод определения некоторых хлорорганических инсектицидов (ХОИ). полихлорированных бифенилов (ПХБ) и хлорбензолов (за исключением моно- и дихлорбензолов) в питьевой воде, а также грунтовых, поверхностных и сточных водах.
Метод применяется для проб, содержащих до 0,05 г/л взвешенных частиц. В присутствии органических частиц, взвешенных частиц и коллоидов усиливается взаимовлияние и. следовательно, увеличиваются пределы обнаружения определяемых веществ.
Метод, установленный в настоящем стандарте, применяют только для некоторых полихлорированных бифенилов, но он не дает информацию об общем содержании бифенилов.
Настоящий стандарт устанавливает пределы обнаружения, приведенные в таблице 1 в соответствии с определяемыми соединениями и типом водной матрицы для вод с низким содержанием органических веществ.
Ввиду низких концентраций определяемых веществ, обычно присутствующих в воде, необходимо соблюдать меры предосторожности; для проб с концентрациями определяемых веществ ниже 10 нг/л требуется особый подход.
Издание официальное
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ИСО 5667-1:1980 Качество воды. Отбор проб. Часть 1. Руководство по составлению программ отбора проб
ИСО 5667-2:1991 Качество воды. Отбор проб. Часть 2. Руководство по составлению методик выборочного контроля
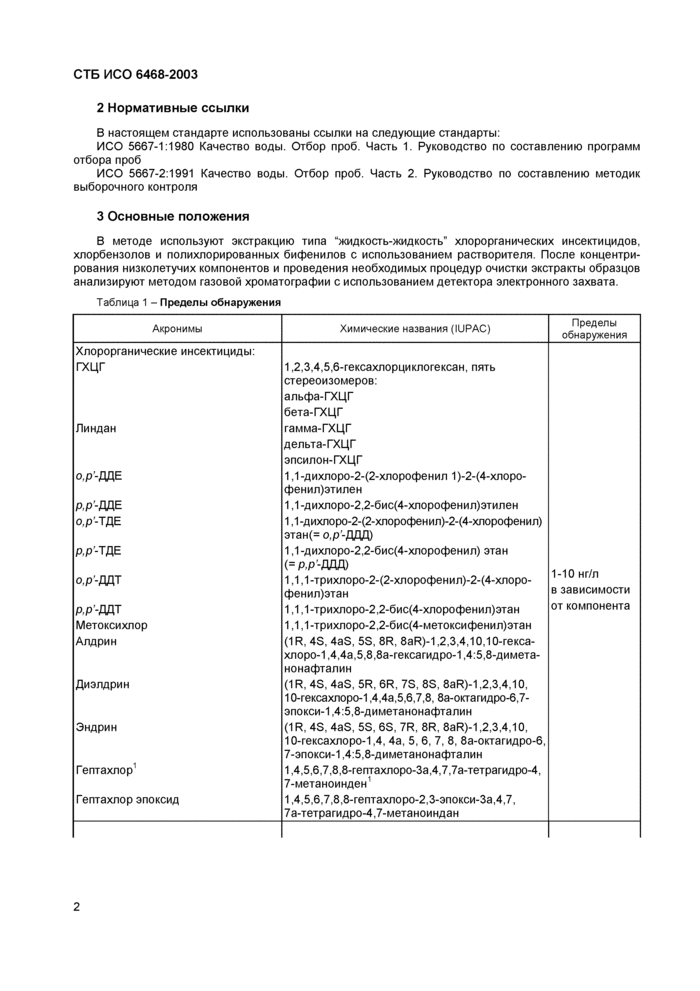
3 Основные положения
В методе используют экстракцию типа "жидкость-жидкость" хлорорганических инсектицидов, хлорбензолов и полихлорированных бифенилов с использованием растворителя. После концентрирования низколетучих компонентов и проведения необходимых процедур очистки экстракты образцов анализируют методом газовой хроматографии с использованием детектора электронного захвата.
|
Таблица 1 - Пределы обнаружения | |||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Окончание таблицы 1 | |||||||||||||||
| |||||||||||||||
Любое вещество, способное вызвать отклик детектора электронного захвата, имеющее такое же время удерживания как целевой компонент, создает интерференции. На практике большинство веществ, потенциально вызывающих взаимовлияние, удаляют в процессе экстракции и очистки.
Примечание 1 - В большинстве случаев, использование двух капиллярных колонок различной полярности является достаточным для хлорорганических соединений, определяемых в соответствии с настоящим стандартом Полученные результаты следует рассматривать как максимальные концентрации целевых компонентов, потенциально подверженных влиянию со стороны коэлюирующих веществ В ряде случаев необходима более точная идентификация
4 Реагенты и материалы
Все реагенты должны иметь достаточную степень очистки для того, чтобы не вызвать значительных интерферирующих пиков в газовых хроматограммах холостых проб. Чистота реагентов, используемых в процедуре, должна быть проверена посредством анализа холостых проб (7.6).
Примечание 2 - Возможно применение коммерческих растворителей пестицидной степени чистоты Использование подобной продукции рекомендуется только после проверки ее качества Качество растворителя проверяют выпариванием около 200 мл данного растворителя до 1 мл с последующим анализом концентрата с целью определения целевых компонентов Растворитель считают приемлемым для использования, если в хроматограмме не обнаруживают пиков целевых компонентов
4.1 Очищенная вода, полученная, например, посредством использования ионного обмена либо адсорбцией на углеродной колонке.
4.2 Экстракционный растворитель
Применяют гексан, летролейный эфир или гептан.
Примечание 3 - Можно использовать другие растворители, удовлетворяющие требованиям 8 3 (степень извлечения > 60 %).
4.3 Безводный сульфат натрия (Na2S04)
Порцию порошка сульфата натрия массой 250 - 300 г прокаливают при температуре (500 ± 20) °С в течение 4 ч ± 30 мин, охлаждают до 200 °С в муфельной печи, затем до температуры окружающей среды в эксикаторе, содержащем перхлорат магния или другой осушитель.
4.4 Декан (С.оН22) или додекан (С^Н») либо другой аналог, который не вызывает отклика детектора электронного захвата.
4.5 Сухой оксид алюминия
Порцию инертного оксида алюминия с размером частиц размером 50 - 200 мкм массой 500 г прокаливают при температуре (500 ± 20) вС в течение 4 ч ± 30 мин на кремниевой подставке в муфельной печи. Охлаждают до 200 X в муфельной печи, затем до температуры окружающей среды в эксикаторе. Хранят в герметичной стеклянной емкости.
4.6 Дезактивированный оксид алюминия
Взвешивают порцию сухого оксида алюминия (4.5) в закрытом стеклянном сосуде и добавляют (7 ± 0,2) % (мае.) воды (4.1). Плотно закрывают и перемешивают не менее 2 ч для получения однородной суспензии. Хранят в герметичной стеклянной емкости.
С момента нарушения герметичности время хранения составляет около одной недели. Затем производят повторную обработку (4.5 и 4.6).
4.7 Оксид алюминияУнитрата серебра
Растворяют (0,75 ± 0,01) г нитрата серебра в (0.75 ± 0,01) мл воды (4.1) с использованием микробюретки Добавляют (4,0 ± 0,2) мл ацетона, а затем (10 ± 0,2) г дезактивированного оксида аллюми-ния (4.6). Тщательно перемешивают посредством встряхивания в открытой конической колбе, защищенной от воздействия света. Позволяют ацетону испариться при комнатной температуре, предотвращая образование конденсата, например, с помощью подогрева сосуда в руке.
Хранят в темном месте и используют в течение 4 ч после приготовления.
4.8 Силикагель
Порцию силикагеля с размером частиц 63 - 200 мкм массой не более 500 г прокаливают при температуре (500 ± 30) °С в течение 14 ч. Охлаждают до 200 °С в муфельной печи, затем до температуры окружающей среды в герметичной емкости, помещеннной в эксикатор без осушителя. Материал используют в течение одной недели после приготовления. Дезактивируют силикагель посредством добавления 3 % (к*ас.) воды (4.1) к соответствующей навеске силикагеля. Перемешивают не менее 2 ч для получения однородной суспензии и хранят в герметичной стеклянной емкости.
Дезактивированный силикагель используют в течение 24 ч после приготовления.
4.9 Толуол
4.10 Диэтиловый эфир, не содержащий пероксиды
4.11 Центры кипения, промытые ацетоном
4.12 Стандартные растворы
Для приготовления стандартных растворов используют аттестованные стандартные образцы хлорор-ганических инсектицидов, хлорбензолов и полихлорированных бифенилов.
Примечание 4 - Для приготовления стандартных растворов в качестве растворителя используют ацетон,
пентан, гексан, диметилбенэол или изооктан
Сосуды, в которых хранят растворы, маркируют и взвешивают для того, чтобы учесть потери растворителя в процессе испарения. Растворы хранят в мерных копбах с притертыми стеклянными пробками в темном месте при температуре 4 °С. Перед использованием растворы доводят до температуры окружающей среды и в случае необходимости корректируют уровень растворителя.
Примечание 5 - Для получения необходимой концентрация стандартного раствора взвешивают 50 мг каждого
целевого компонента и растворяют в 100 мл растворителя Раствор сохраняет стабильность в течение 1 года
4.13 Промежуточные стандартные растворы
Стандартные промежуточные растворы готовят соответствующим разбавлением стандартного раствора (4.12) с использованием экстракционного растворителя (4.2).
Типичная концентрация - 10 мкг/мл.
Стандартные промежуточные растворы хранят в темном месте при температуре 4 °С. Данные растворы сохраняют стабильность в течение шести месяцев.
4.14 Рабочие стандартные растворы
Готовят не менее пяти различных концентраций с помощью соответствующих разбавлений стандартных промежуточных растворов (4.13) с использованием экстракционного растворителя (4.2).
Соответствующие концентрации выражают в нанограммах на миллилитр.
Рабочие стандартные растворы хранят в темном месте при температуре 4 °С. Данные растворы сохраняют стабильность в течение одного месяца.
4.15 Вата или стекловата, промытая экстракционным растворителем
4.16 Растворитель, смешиваемый с водой
Примечание 6 - Может использоваться ацетон, метанол либо диметилформамид
5 Аппаратура
5.1 Газовый хроматограф с детектором электронного захвата (ДЭЗ) и капиллярными колонками.
Данный прибор используют в соответствии с инструкциями изготовителя. Могут использоваться
способы ввода пробы как непосредственно в колонку, так и через стеклянный лайнер. Термостат должен обеспечивать работу в изотермическом режиме и в режиме программирования температуры.
5.2 Капиллярные колонки, стеклянные или кварцевые капилляры с внутренним диаметром менее 0,4 мм и длиной 25 - 60 м с нанесенной стационарной фазой, обеспечивающей разделение интересующих соединений.
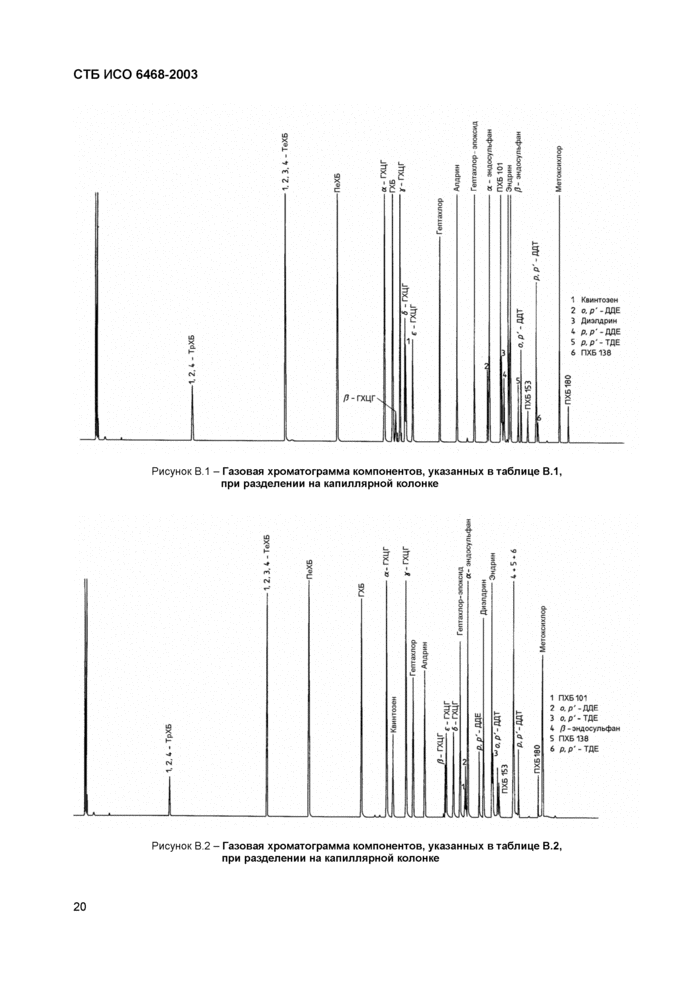
В приложении В представлены примеры газохроматографических условий разделения (таблицы В.1, В.2 и В.З) и соответствующие газовые хроматограммы (рисунки В.1 и В.2).
5.3 Делительные воронки с минимальным объемом 1 - 5 л со стеклянным краном, промытым гексаном, или лолитетрафторэтиленовым (ПТФЭ) краном.
5.4 Высокоскоростной смеситель и магнитная мешалка, покрытые политетрафторэтиленом (ПТФЭ) и промытые гексаном.
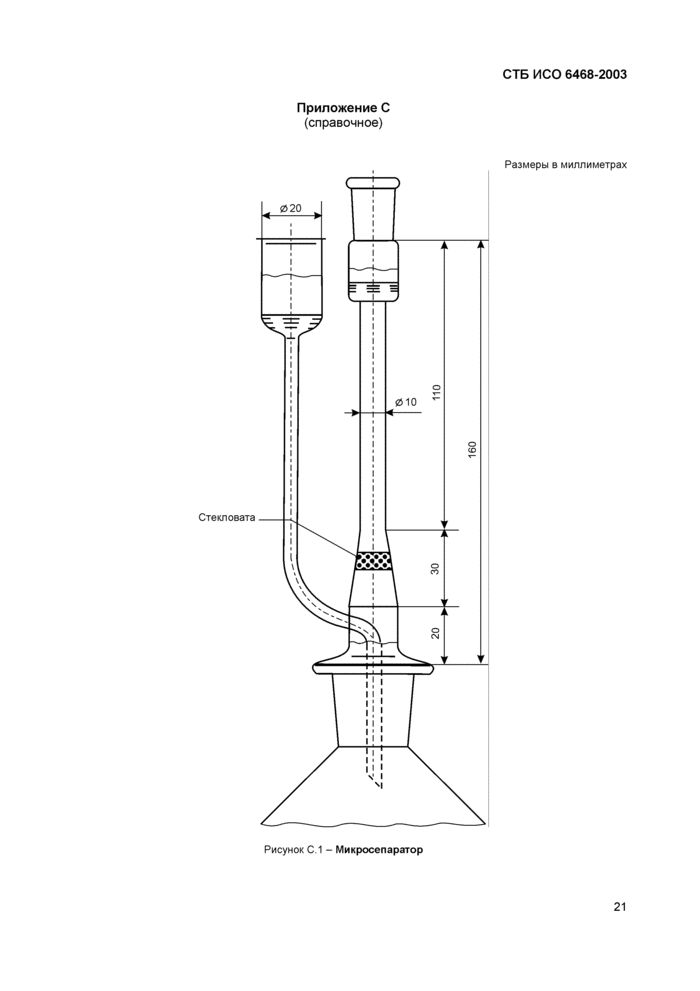
5.5 Микросепаратор (рисунок С.1).
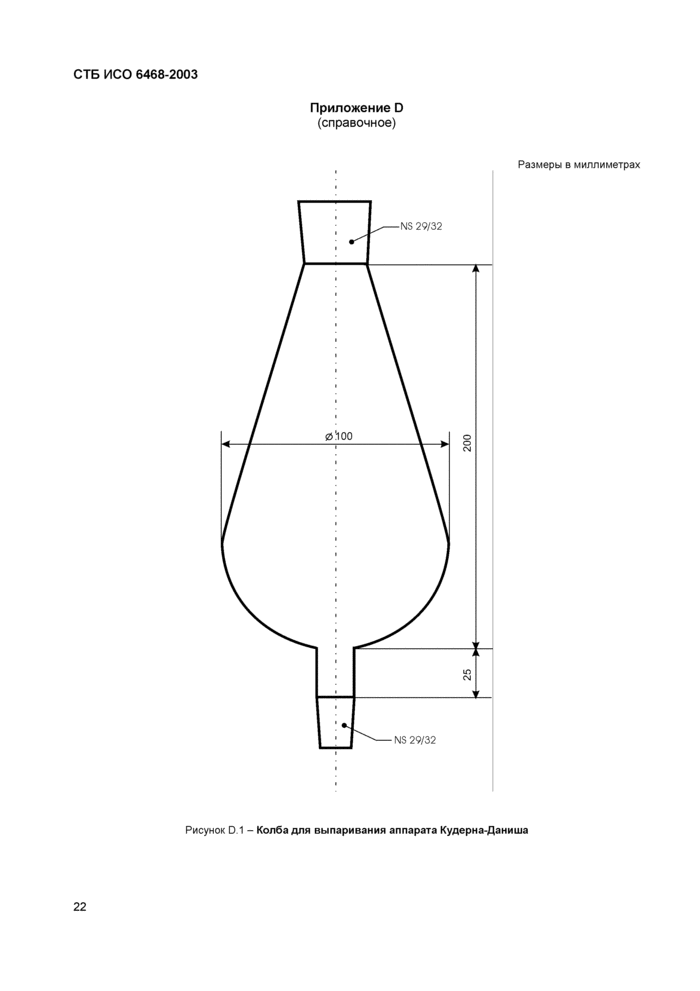
5.6 Аппарат Кудерна-Даниша (рисунок D.1).
5.7 Микроколонка Шнайдера.
5.8 Роторный испаритель или любая другая система выпаривания.
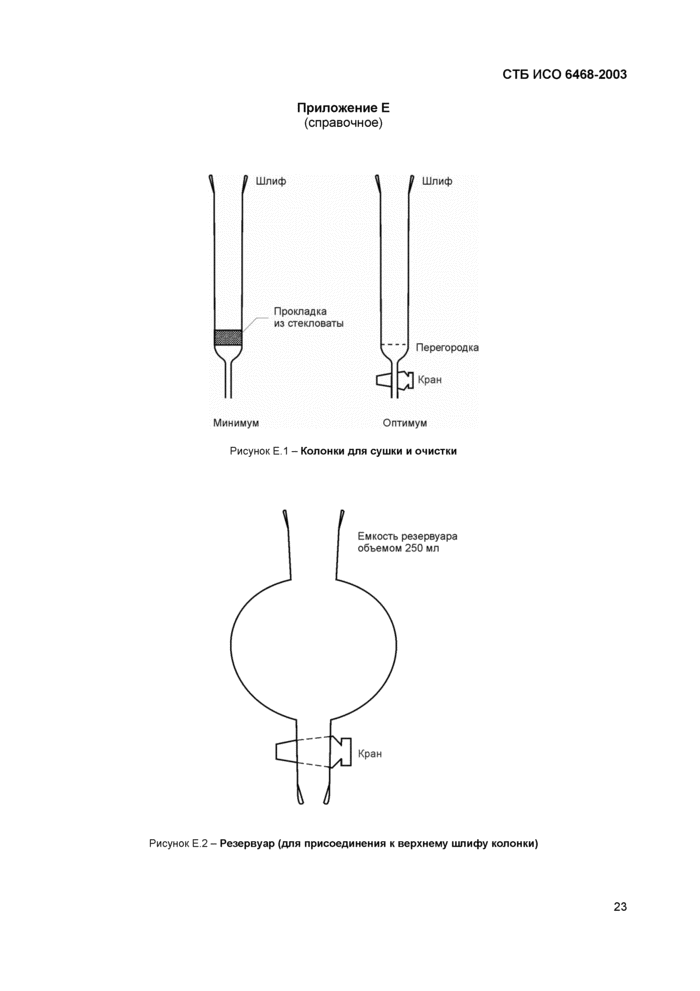
5.9 Колонка для обезвоживания экстракта, заполненная от 5 - 7 г сульфата натрия (4.3) высотой 7 - 10 см. Возможные размеры следующие: внутренний диаметр - 10 мм. длина - 250 мм (рисунок Е.1).
5.10 Колонка для очистки экстракта, заполненная оксидом аллюминия или оксидом аллюминия/нитратом серебра. Возможные размеры следующие: внутренний диаметр - 10 мм, длина - 250 мм (рисунок Е.1).
5.11 Макроколонка для очистки экстракта, заполненная силикагелем. Возможные размеры следующие: внутренний диаметр - 19 мм, длина - 400 мм (рисунок Е.1).
5.12 Микроколонка для очистки экстракта, заполненная силикагелем. Возможные размеры указаны на рисунке F1.
5.13 Микрошприцы.
5.14 Прочая стеклянная посуда
Лабораторную стеклянную посуду, за исключением калиброванной стеклянной посуды, моют специальным моющим средством (лабораторное моющее средство), затем обрабатывают смесью xpOM(VI)/ серная кислота или смесью пероксодисульфат/серная кислота, после чего промывают гексаном либо нагревают при 200 °С не менее 12 ч.
Эффективность обработки проверяют экспериментально посредством выборочного анализа холостых проб, для того чтобы убедиться в отсутствии интерферирующего загрязнения.
6 Отбор и подготовка проб
Отбор проб производят в соответствии с ИСО 5667-1 и ИСО 5667-2.
Отбор проб воды производят в емкости из темного стекла, предварительно обработанной в соответствии с 5.14 (использование пластиковых емкостей не допускается) с притертыми стеклянными пробками или закручивающимися крышками с прокладками из политетрафторэтилена (ПТФЭ), объемом 1 - 5 л. Емкости заполняют на 80 % - 90 %.
При отборе проб следует избегать интерферирующего загрязнения, а также не допускать потерь целевых компонентов. Это особенно важно при использовании пробоотборника с пластиковыми трубками. При необходимости проводят контрольные тесты для подтверждения отсутствия потерь целевых компонентов в результате адсорбции. Предпочтительно использовать стеклянное оборудование для проботбора или оборудование из нержавеющей стали.
Проверяют значение pH. В случае необходимости значение pH доводят до 5 - 7.5 непосредственно после отбора проб.
При необходимости определения эндосульфана производят отбор отдельной пробы с последующей консервацией кислотой (pH = 2) вплоть до начала экстракции.
Не допускается размещать пробы в непосредственной близости от концентрированных растворов инсектицидов, хлорбензолов или полихлорированных бифенилов. Пробы хранят в темном месте при 4 °С вплоть до начала экстракции.
Экстракцию проводят в кратчайшие сроки (предпочтительно в течение 24 ч) во избежание разложения компонентов после отбора пробы.
Низколетучие галогенированные углеводороды и хлорорганические инсектициды относительно стабильны при переводе их в органический растворитель. Поэтому допускается хранение выпаренных экстрактов в холодильнике при температуре 4X8 течение двух месяцев. Тем не менее, испарение растворителя может происходить даже в условиях охлаждения. Не следует допускать полного высыхания экстрактов, перед началом анализа необходимо довести объем растворителя до первоначального уровня.
7 Процедура
7.1 Предварительная обработка проб
Предварительная обработка проб не является обязательной.
Если емкость с пробой заполнена до краев, ее встряхивают и отделяют 30 - 100 мл пробы с целью получения свободного объема, достаточного для последующего добавления растворителя.
Объем жидкости для экстракции измеряют посредством взвешивания емкости с пробой до экстракции и пустой емкости после экстракции.
7.2 Экстракция и разделение
Для экстракции и разделения используют одну из двух нижеприведенных процедур:
- экстракцию в емкости с пробой и разделение в делительной воронке (7.2.1);
- экстракцию в емкости с пробой с использованием магнитной мешалки или высокоскоростного смесителя и разделение посредством микросепаратора (7.2.2).
Примечание 7 - В зависимости от используемого метода могут быть получены различные значения извлечения и воспроизводимости Результаты выбранного метода должны быть проверены в лаборатории (8 3).
Рекомендуется осуществлять экстракцию в емкости с пробой. Обычно используют около 1 л пробы.
7.2.1 Экстракция, осуществляемая посредством встряхивания емкости с пробой и разделения в делительной воронке
Добавляют 30 мл экстракционного растворителя (4.2) к пробе (7.1) и встряхивают не менее 10 мин.
Переносят в делительную воронку соответствующего объема (5.3) и позволяют фазам разделиться.
Отбирают нижнюю водную фазу в емкость для пробы. Экстракцию повторяют дважды с использованием 20 - 30 мл экстракционного растворителя (4.2).
Для обезвоживания экстракта используют одну из следующих процедур:
- экстракт пропускают через колонку (5.9), содержащую безводный сульфат натрия (4.3). предварительно промытый растворителем (4 2). Элюат собирают в сосуд для выпаривания.
Примечание 8 - Рекомендуется дополнительно промыть колонку 10 - 20 мл растворителя (4 2) с целью
получения лучшего извлечения Промывочный расторитель собирают в сосуд для выпаривания