СТ РК ИСО 18415-2009
Косметика. Микробиология. Обнаружение специфических и неспецифических микроорганизмов
Купить СТ РК ИСО 18415-2009 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает общие руководящие принципы для обнаружения и идентификации определенных микроорганизмов в
косметической продукции, и для обнаружения и идентификации других видов аэробных мезофильных неспецифических микроорганизмов в косметической продукции.
Стандарт идентичен международному стандарту ИСО 18415:2006
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Принцип
5 Растворители и культуральная среда
5.1 Общие положения
5.2 Растворитель суспензии микроорганизмов (раствор триптона хлорида натрия)
5.3 Культуральная среда
6 Приборы и стеклянная посуда
7 Штамм микроорганизма
8 Обработка косметических продуктов и лабораторных образцов
9 Процедура
9.1 Общие рекомендации
9.2 Приготовление исходной суспензии в среде обогащения
9.3 Инкубация исходной суспензии
9.4 Выделение специфических и неспецифических микроорганизмов
9.5 Процедура идентификации специфического микроорганизма: Pseudomonas aeruginosa
9.6 Процедура идентификации специфического микроорганизма: Escherichia coli
9.7 Процедура идентификации специфического микроорганизма: Staphylococcus aureus
9.8 Процедура идентификации специфического микроорганизма: Candida albicans
9.9 Процедура идентификации неспецифических микроорганизмов
10 Выражение результатов
10.1 Обнаружение специфических микроорганизмов
10.2 Обнаружение неспецифических микроорганизмов
10.3 Отсутствие микроорганизмов
11 Нейтрализация антибактериальных свойств продукта
11.1 Общие положения
11.2 Подготовка инокулята
11.3 Проверка достоверности метода обнаружения с помощью обогащения
12 Протокол испытаний
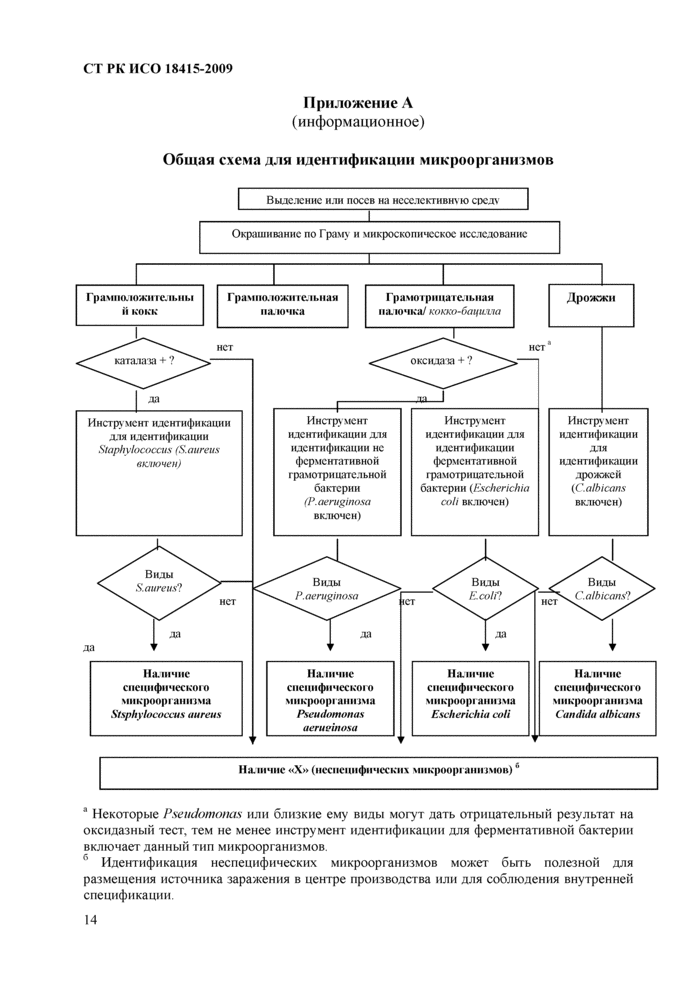
Приложение А (информационное) Общая схема для идентификации микроорганизмов
Приложение В (информационное) Другая среда
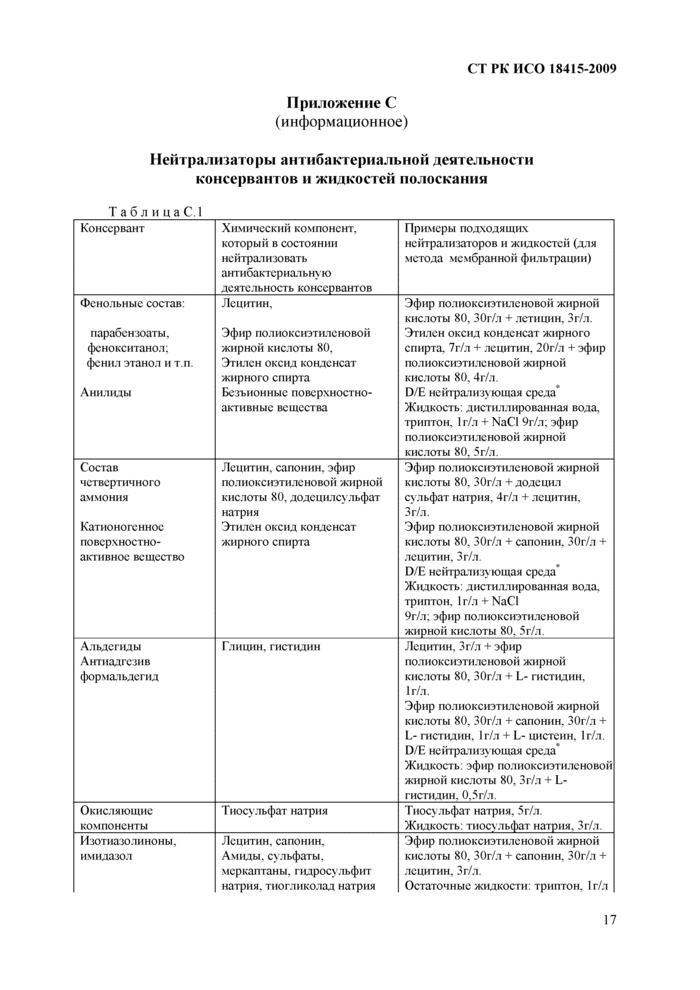
Приложение С (информационное) Нейтрализаторы антибактериальной деятельности консервантов и жидкостей полоскания
Библиография
| Дата введения | 01.07.2010 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Организации:
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
стр. 18

стр. 19

стр. 20
стр. 21

стр. 22

стр. 23

стр. 24

стр. 25
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РЕСПУБЛИКИ КАЗАХСТАН
КОСМЕТИКА
Микробиология
Обнаружение специфических и неспецифических .микроорганизмов
СТ РКИСО 18415-2009
ISO !Н415:2006 ('osmetic Microbiology -Detection of specified and tton-specified microorganisms, IDT
Издание официальное
Комитет по техническому регулированию и метрологии Министерства индустрии и торговли Республики Казахстан (Госстандарт)
Астана
Предисловие
1 ПОДГОТОВЛЕН И ВНЕСЕН Республиканским государственным предприятием «Казахстанский институт стандартизации и сертификации» Комитета по техническому регулированию и метрологии и Техническим комитетом по стандартизации № 72 «Нанотехнологии»
2 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Председателя Комитета по техническому регулированию и метрологии Министерства индустрии и торговли Республики Казахстан от 17 сентября 2009 года №471-од
3 Настоящий стандарт идентичен международному стандарту' ИСО 18415:2006 "Косметика. Микробиология. Обнаружение специфических и неспецифических микроорганизмов" ("Cosmetic - Microbiology - Detection of specified and non-specified microorganisms") с дополнительными требованиями, которые по тексту выделены курсивом.
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им государственные и (или) межгосударственные стандарты.
Степень соответствия - идентичная (IDT)
2014 год 5 лет
4 СРОК ПЕРВОЙ ПРОВЕРКИ ПЕРИОДИЧНОСТЬ ПРОВЕРКИ5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему Стандарту публикуется в указателе «Нормативные документы по стандартизации», а текст изменении в ежемесячных информационных указателях «Государственные стандарты». И случае пересмотра (отмены) или замены настоящего Стандарта соответствующая ти/юрмация будет опубликована в информационном указателе «Государственные стандарты»
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Комитета по техническому регулированию и метрологии Министерства индустрии и торговли Республики Казахстан
- Candida aureus АТСС 10231 (эквивалентные штаммы: IP6 48.72 или NCPF7 3179 или NBRC 1594 или КСТС 17205 или другие эквивалентные национальные штаммы).
Культура должна быть восстановлена согласно процедурам, предоставленным поставщиком эталонного штамма.
Штамм может храниться в лабораториях в соответствии с [5].
8 Обработка косметических продуктов и лабораторных образцов
В случае необходимости, образцы испытуемой продукции хранят при комнатной температуре. Продукты (3.1) и образцы (3.2) не используют в исследовании в охлажденном или замороженном виде и должны храниться в лаборатории.
Отбор образцов косметических продуктов необходимо осуществлять, как описано в CT РК ИСО 21148. Образцы необходимо исследовать, в соответствии с СТ РК ИСО 21148 и следующей процедурой.
9. Процедура
9.1 Общие рекомендации
Использовать стерильный материал, оборудование и методы стерильного приготовления образцов, исходной суспензии и растворителей. Промежуток времени между концом приготовления суспензии образца и ее введением в культуральную среду не должен превышать 45 мин, если это не упомянуто в утвержденных протоколах или документах.
9.2 Приготовление исходной суспензии в среде обогащении
9.2.1 Общие положения
Как минимум, 1,0 г или 1,0 мл тщательно перемешанного испытываемого продукта растворяют в, как минимум, 9 мл среды обогащения.
Фиксируют 5, точную массу или объем образца.
Метод должен быть проверен, для гарантии того, что состав (нейтрализаторы добавленны в конце) и объем среды удовлетворяют требованиям (см. 11.3).
ПРИМЕЧАНИЕ Фильтрация косметического продукта через мембрану, которую впоследствии погружают в среду обогащения, способствует нейтрализации антибактериальных свойств продукта (см. 11.3).
9.2.2 Водорастворимые продукты
Переместить S образец продукта в соответствующий контейнер, который содержит определенный объем ( 9,0 мл) среды.
* Institut Pasteur.
Национальная коллекция патогенных грибов
9.2.3 Гидрофобные продукты
Переместить S образец продукта в соответствующий контейнер, состоящий из определенного количества растворенного вещества (эфир полиоксиэтиленовой жирной кислоты 80).
Распределить образец в разбавленном веществе и добавить определенный объем ( 9,0 мл) среды.
9.2.4 Фильтрующиеся продукты
Необходимо использовать мембранный фильтр, имеющий номинальный размер пор не больше 0,45 мкм.
Переместить образец S на мембране в прибор фильтрации в соответствии с СТ РК ИСО 21148. Немедленно профильтровать и промыть мембрану определенными объемами воды и/или разбавителя.
Переместить и погрузить мембрану в пробирку или колбу соответствующего размера, которая содержит необходимый объем (9,0 мл) среды обогащения. Данная подготовка равнозначна исходной суспензии.
9.3 Инкубация исходной суспензии
Исходную суспензию, приготовленную в среде (см. 9.2), инкубируют при температуре (32,5 ± 2,5)°С в течение, как минимум, 20 ч.
9.4 Выделение специфических и неспеннфпческих микроорганизмов
С помощью стерильной петли, с аликвотой проинкубированной исходной суспензией проведите полосы на поверхности среды в чашках Петри (диаметр от 85 до 100 мм), которые содержат от 15,0 до 20,0 мл неселективной агаризованной среды. Если используются чашки Петри большого размера, объем агара соответственно увеличивается.
Следует перевернуть чашки Петри и после инкубировать при температуре (32,5 ± 2,5)°С в течение 48-72 ч. Процедура идентификации колоний описана ниже для Pseudomonas aeruginosa, Escherichia colli. Staphylococcus aureus и Candida albicans, а для других микроорганизмов описана в п. 9.9.
9.5 Процедура идентификации специфического микроорганизма: Pseudomonas aeruginosa
9.5.1 Окрашивание по Граму
Приступить к окрашиванию по Граму в соответствии с СТ РК ИСО 21148 части подозрительной колонии, хорошо отделенной от поверхности соево-казеинового гидролизного агара.
Микроскопия должна обнаружить грамотрицательные палочки.
9.5.2 Испытание оксидазой
Необходимо следовать процедуре в соответствии с СТ РК ИСО 21148.
Тест на оксидазу должен быть положительным.
9.5.3 Идентификационное испытание
Необходимо использовать подходящий протокол идентификации для неподвижной грамотрицательной палочки (т.е. стандартизованную и/или мини- биохимическую систему) со специализированной базой данных (или соответствущим каталогом), включающей типичные характеристики Pseudomonas aeruginosa.
При использовании инструментов идентификации, следовать инструкциям, данных поставщиком (посев, инкубация, чтение), и сравнивать конечный результат с базой данных. Название устанавливаемого микроорганизма должно быть Pseudomonas aeruginosa с соответствующим уровнем идентификации.
9.6 Процедура идентификации специфическою микроорганизма: Escherichia coll
9.6.1 Окрашивание по Г раму
Приступить к окрашиванию по Граму в соответствии с СТ РК ИСО 21148 части подозрительной91 колонии, хорошо отделенной от поверхности соево-казеинового агара.
Микроскопное наблюдение красителя Грама должно обнаружить
грамотрицательные палочки
9.6.2 Испытание оксидазой
Провести испытание в соответствии с СТ РК ИСО 21148. Тест должен быть отрицательным.
9.6.3 Идентификационное испытание
Необходимо использовать подходящий протокол идентификации для подвижной грамотрицательной палочки (т.е. стандартизованную и/или мини-биохимическую систему) со специализированной базой данных (или соответствующим каталогом), включающей типичные характеристики
Escherichia соИ.
При использовании инструментов идентификации, следовать инструкциям, данных поставщиком (посев, инкубация, чтение), и сравнить конечный
результат с базой данных. Название устанавливаемого микроорганизма должно быть Escherichia coli с соответствующим уровнем идентификации.
9.7 Процедура идентификации специфического микроорганизма: Staphylococcus aureus.
9.7.1 Окрашивание по Граму
Приступить к окрашиванию по Граму в соответствии с СТ РК ИСО 21148 части подозрительной10 колонии, хорошо отделенной от поверхности соево-казеинового агара.
Микроскопия должна обнаружить грамотрицательные палочки.
* Предположительно для Pseudomonas aeruginosa предназначены гладкие колонии, обычно
окрашенные зеленоватыми и желтоватыми пигментами.
* Предположительно для Escherichia coli предназначены гладкие колонии
9.7.2 Испытание каталазой
Провести испытание каталазой в соответствии с СТ РК ИСО 21148. Каталазный тест должен быть положительным.
9.7.3 Идентификационное испытание
Использовать подходящий протокол идентификации для грамположительного кокка (т.е. стандартизованную и/или миниатюрную биохимическую систему) со специализированной базой данных (или соответствующим каталогом), включающей типичные характеристики Staphylococcus aureus.
При использовании инструментов идентификации, следовать инструкциям, данных поставщиком (посев, инкубация, чтение), и сравнить конечный результат с базой данных. Название устанавливаемого микроорганизма должно быть Staphylococcus aureus с соответствующим уровнем конфиденциальности.
9.8 Процедура идентификации специфического микроорганизма: Candida albicans,.
9.8.1 Окрашивание по Граму
Приступить к окрашиванию по Граму в соответствии с СТ РК ИСО 21148 на части подозрительной" колонии, хорошо изолированной от неселективной агаровой среды.
Микроскопия должна обнаружить короткую овоидную или удлиненную клетку фиолетового цвета.
9.8.2 Идентификационное испытание
Использовать подходящиий протокол идентификации для дрожжей (т.е. стандартизованную и/или мини-биохимическую систему) со специализированной базой данных (или соответствующим каталогом), включающей типичные характеристики Candida albicans.
При использовании инструментов идентификации, следовать инструкциям, данных поставщиком (посев, инкубация, чтение), и сравнить конечный результат с базой данных. Название устанавливаемого микроорганизма должно быть Candida albicans с соответствующим уровнем идентификации.
9.9 Процедура идентификации неспецифических микроорганизмов
9.9.1 Окрашивание по Грамму
Окрашивать по Граму в соответствии с СТ РК ИСО 21148 на части колонии, хорошо изолированной от поверхности соево-казеинового систематизированного агара.
Указать морфологию и реакцию окрашивания по Граму, обнаруженную при микроскопном наблюдении.
Предположительно для Staphylococcus aureus предназначены гладкие колонии обычно, окрашенные желтыми пигментами
'1 Предположительно дли гладких колонии, обычно окрашенных белыми пигментами
9.9.2 Испытание оксидазой
Применяют при обнаружении грамотрицательной бациллы (палочки). Действуют в соответствии СТ РК ИСО 21148. Проводят оксидазный тест на части микробной колонии, хорошо изолированной от поверхности с прослойками соево-казеинового агара.
Отметить результат испытания.
9.9.3 Испытание каталазой
Применяют при обнаружении грамотринательного кокка. Действуют в соответствии с СТ РК ИСО 21148. Проводят каталазный тест на части микробной колонии, хорошо изолированной от поверхности соевоказеинового агара.
Отметить результат испытания.
9.9.4 Идентификационное испытание
Основываясь на результатах предварительных испытаний (см. 9.9.1, 9.9.2, 9.9.3), выбирают подходящий протокол идентификации (т.е.
стандартизованную и/или мини-биохимическую систему) со специализированной базой данных (или каталогом), включающей типичные характеристики подозрительных видов (см. схему в Приложении А)
При использовании инструментов идентификации, следуют инструкциям, данных поставщиком (посев, инкубация, чтение), и сравнивают конечный результат с базой данных. Записывают название устанавливаемого микроорганизма с соответствующим уровнем идентификации.
10 Выражение результатов
10.1 Обнаружение специфических микроорганизмов
Для каждого вида определенного микроорганизма, если идентификация колоний подтверждает наличие данного вида, результат выражается как: наличие (название вида) в образце, S.
Если идентификация колоний не подтверждает наличие данного вида, результаты выражаются, как указано в п. 10.2.
10.2 Обнаружение неспецнфнческпх микроорганизмов
Если наблюдается рост после обогащения и, если выделяются и распознаются колонии неспецифических микроорганизмов, выражают результаты, как: наличие (название вида и/или основные морфологические характеристики) в образце, S, и отсутствие специфических микроорганизмов.
10.3 Отсутствие микроорганизмов
Если нет роста после обогащения, и наблюдается изоляция, выразите результаты, как: отсутствие аэробных мезофильных организмов (включая специфические микроорганизмы) в образце, S.
11 Нейтра.ипаимя апi нбактериальных свойств продукта
11.1 Общие положения
Различные испытания, описанные ниже, показывают, что микроорганизмы могут расти в условиях исследования.
Штаммы (см. п. 7), используемые для демонстрации обоснованности данных свойств, обычно чувствительны к антибактериальным средствам.
11.2 Подготовка инокулята
До испытания инокулируют поверхность соево-казеиновой агаризованной среды (SCDA) или другой подходящей (неселсктивной. не нейтрализующей) среды. Инкубируют при температу ре (32,5 ± 2,5)°С от 18 до 24 ч. С помощью стерильной петли проводят полосы на поверхности культуры и ресуспсндируют в разбавителе, для того чтобы получить калиброванную суспензию около 1*108 CFU/мл для бактерий, и приблизительно 1*106 CFU/мл для дрожжей (используют спектрофотометр в соответствии с СТ РК ИСО 21148 (Приложение С).
Данную калиброванную суспензию и ее разбавители используют в течение 2 ч.
11.3 Проверка достоверности метода обнаружения с помощью обогащения
11.3.1 Принцип
Для каждого испытательного штамма, смешать нейтрализованный образец (исходная суспензия) с разбавленной калиброванной суспензией микроорганизмов, затем оставить смесь для инкубации. После инкубации сделать посев на поверхность неселективной агаровой среды. Из оставшейся части параллельно сделать посев на другую чашку', инку бировать (контрольный посев).
После инкубации, пластинки, подтверждающие достоверность, и управляющие пластинки проверяют на наличие микроорганизмов. Результаты интерпретируются.
11.3.2 Процедура
В пробирках разбавителя емкостью 9.0 мл подготовят раствор калиброванной суспензии таким образом, чтобы получить концентрации жизнеспособных микроорганизмов от 100 CFU/мл до 500 CFU/мл. Затем 1,0 мл суспензии перемещают в чашке Петри, в которые вливают от 15,0 до 20,0 мл полужидкой агаризованной среды и инкубируют в термостате при температу ре не более 48°С. Оставить для инку бации при температуре (32,5 ± 2,5)°С от 20 до 24 ч.
Следует подготовить в двойном экземпляре исходную суспензию в условиях, которые выбраны для испытания (как минимум, 1,0 г или 1.0 мл продукта на одно испытание, определенный объем обогащенной среды), в пробирке или колбе. При использовании метода мембранной фильтрации, фильтровать не менее, чем 2 образца, каждый в объеме, не менее 1,0 мл готового продукта и поместить каждую мембрану в пробирку или колбу, которая содержит среду обогащения в условиях, выбранных для испытания.
Поместить асептически 0,1 мл конечного раствора калиброванной суспензии микроорганизмов в одну пробирку или колбу (испытание на подтверждение достоверности). Смешать, затем оставить для инкубации пробирки или колбы
(испытание на подтверждение достоверности и положительный контроль) при температуре (32,5 ± 2,5)°С от 20 до 24 ч.
Изолировать каждую пробирку или колбу (испытание на подтверждение достоверности и положительный контроль). Каждую аликвоту при помощи стерильной петли нанести на поверхность агаризованной неселективной питательной среды в чашках Петри диаметром от 85 до 100 мм (от 15 до 20 мл на каждую чашку). Инкубировать чашки при температуре (32,5 ± 2,5)"С от 24 до 48 ч.
11.3.3 Интерпретация результатов подтверждения достоверности Подтвердить, что конечный раствор калиброванной суспензии бактерий или дрожжей содержит от 100 CFU/мл до 500CFU/mh.
Считают, что ингибирующие вещества присутствуют в образце12, если отсутствует рост микроорганизмов в тесте на подтверждение достоверности при одновременном наличии характерных колоний в положительном контроле.
При отсутствии роста характерных колоний в положительном контроле результаты теста на достоверность не учитывают.
При обнаружении ингибирующих веществ условия проведения испытания на подтверждение достоверности модифицируют путем увеличения объема среды обогащения. При этом количество продукта остается одинаковым. Или вносят соответствующее количество инактивированного агента в среду обогащения. Также возможно создание комбинированных условий, обеспечивающих надлежащий рост бактерий или дрожжей.
Если, несмотря на объединение инактивирующих агентов и значительное увеличение объема среды обогащения, все еще невозможно возвратить рост жизнеспособных микроорганизмов, как описано выше, указывают, что продукт вряд ли содержит рассматриваемые виды бактерий или дрожжей.
12 Протокол испытаний
Протокол испытаний должен включать следующее:
а) всю информацию, необходимую для полной идентификации продукта:
б) использованный метод;
в) полученные результаты;
г) все детали операций по подготовке исходной суспензии;
д) описание метода с использованными нейтрализаторами и средой;
е) проверка достоверности метода, даже если испытание выполнено отдельно;
ж) любые действия, которые не установлены в настоящем документе, или рассматриваемые в качестве оптимальных, вместе с деталями любых инцидентов, которые могут повлиять на результаты испытания.
*■ Характерные при знаки:
- для Staphylococcus aureus: культура, пигментированная в желтый;
-для Pseudomonas aeruginosa: от зеленоватой до желтоватой культуры;
-для Candida albicans: выпуклые, гладкие кремообразные колонии;
- для Escherichia coli: гладкие колонии.
Общая схема для илентификацни микроорганизмов
* Некоторые Pseudomonas или близкие ему виды могут дать отрицательный результат на оксидазиыи тест, тем не менее инструмент идентификации для ферментативной бактерии включает данный тип микроорганизмов
г> Идентификация неспецифических микроорганизмов может быть полезной для размещения источника заражения в центре производства или для соблюдения внутренней спецификации.
В 1.1.1 Состав:
Другая среда
В. 1 Другая обогатительная среда
В. 1.1 Модифицированная летиновая (letheen) среда [6]
- пептический гидролизат мяса 20,0 г;
- панкреатический гидролизат казеина 5.0 г;
- мясной экстракт 5.0 г;
- дрожжевой экстракт 2,0 г;
- лецитин 0.7 г;
- эфир полиоксиэтиленовой жирной кислоты 8 05,0 г;
- хлорид натрия 5.0 г;
- гидросульфит натрия 0,1 г;
- вода I 000 мл.
В. 1.1.2 Подготовка
Следует последовательно растворить компоненты эфир полиоксиэтиленовой жирной кислоты 80 и лецитин в кипящей воде до их полного растворения. Растворить другие компоненты путем смешивания при нагревании. Аккуратно мешать, избегая вспенивания. Расггредслить среду в подходящие контейнеры. Стерилизовать в автоклаве при температуре 121 "С в течение 15 мин. После стерилизации pH-уровень при комнатной темперагуре должен быть равен (7.2 ± 0.2).
В. 1.2.1 Состав:
- панкреатическая переварка казеина 20,0 г;
- соевый лецитин 5,0 г;
- эфир полиоксиэтиленовой жирной кислоты 20 40 мл;
- вода 960 мл. В. 1.2.2 Подготовка
В. 1.2 Жидкая среда казеина гидролизата сои лецитин эфир полиоксиэтиленовой жирной кислоты 20 (FCDI.P 20)
Растворить панкреатическу ю переварку казеина и соевый лецитин в 960 мл воды. Нагревать в термостате от 48'С до 50"С в течение 30 мин. до полного растворения. Добавить 40 мл эфир полиоксиэтиленовой жирной кислоты 20. Перемешать и распределить в соответствующие контейнеры. Стерилизовать в автоклаве при температуре 121 "С в течение 15 мин. После стерилизации рН-уровень при комнатной температуре должен быть равен (7.2 ± 0.2).
В. 1.3 Среда соевая-казеин-гидролизат-лецитин-эфнр полиоксиэтилено-вой жирной кислоты 80 (SCDLP 80 среда)
В. 1.3.1 Состав:
- казеиновый пептон 17,0 г;
- соевый пептон 3.0 г;
- хлорид натрия 5,0 г;
- вторичный кислый фосфат калия 2,5 г;
- глюкоза 2,5 г;
-лецитин 1,0 г;
- эфир полиоксиэтиленовой жирной кислоты 80 7,0 г;
- вода 1 000 мл.
В. 1.3.2 Подготовка
Растворить все компоненты или сухую полную среду в кипящей воде до их полного растворения. Распределить среду в соответствующие контейнеры. Стерилизовать в автоклаве при температуре 121°С в течение 15 мин. После стерилизации pH-уровень при комнатной температуре должен быть равен (7,2 ± 0,2).
В. 1.4. D/Е нейтрализующая среда (Dey/Engley нейтрализующая среда) [7]
В 1.4.1 Состав:
|
- глюкоза |
10,0 г; | |
|
- соевый лецитин |
7,0 г; | |
|
- пентагидрат тиосульфат натрия |
6,0 г; | |
|
- эфир полиоксиэтиленовой жирной кислоты 80 |
5,0 г; | |
|
- панкреатическая гидролизат казеина |
5,0 г; | |
|
- гидросульфит натрия |
2,5 г; | |
|
- дрожжевой экстракт |
2,5 г; | |
|
- тиогликолад натрия |
1,0 г; | |
|
- пурпурный бромкрезол |
0,02 г; | |
|
- вода |
1 000 мл. | |
|
В. 1.4.2 Подготовка |
Последовательно растворить компоненты в кипящей воде до их полного растворения. Распределить среду в соответствующие контейнеры. Стерили-зовать в автоклаве при температуре 121°С в течение 15 мин. После стерили-зации рН-уровень при комнатной температуре должен быть равен (7.6 ± 0.2).
В 2 Другая неселективная агаровая среда. Агар, добавленный в среду соевую казеиновую (агар, добавленный в SCD среду)
| ||||||||||||||||
|
Распределить среду в соответствующие контейнеры. Стерили-зовать в автоклаве при температуре 121°С в течение 15 мин.. После стерили-зации pH-уровень при комнатной температу ре должен быть равен (7,2 ± 0,2). |
Содержание
1 Область применения I
2 Нормативные ссылки 2
3 Термины и определения 2
4 Принцип 3
5 Растворители и культуральная среда 4
5.1 Общие положения 4
5.2 Растворитель суспензии микроорганизмов (раствор 4
триптона хлорида натрия)
5.3 Культу ральная среда 5
6 Приборы и стеклянная посуда 6
7 Штамм микроорганизма 6
8 Обработка косметических продуктов и лабораторных образцов
9 Процедура 7
9.1 Общие рекомендации 7
9.2 Приготовление исходной суспензии в среде обогащения
9.3 Инкубация исходной суспензии 8
9.4 Выделение специфических и неспецифических
микроорганизмов 8
9.5 Процедура идентификации специфического
микроорганизма: Pseudomonas aeruginosa 8
9.6 Процедура идентификации специфического
микроорганизма: Escherichia coli 9
9.7 Процедура идентификации специфического
микроорганизма: Staphylococcus aureus 9
9.8 Процедура идентификации специфического
микроорганизма: Candida albicans 10
I(ейтралшаторы антиоакгернальном деятельности консервантов и жидкостей полоскания
|
Таблица С. 1 | ||||||||||||||||||
|
9.9 Процедура идентификации неспецифических
микроорганизмов 10
10 Выражение результатов II
10.1 Обнаружение специфических микроорганизмов 11
10.2 Обнаружение неспецифических микроорганизмов II
10.3 Отсутствие микроорганизмов II
11 Нейтрализация антибактериальных свойств продукта 12
11.1 Общие положения 12
11.2 Подготовка инокулята 12
11.3 Проверка достоверности метода обнаружения с помощью
обогащения 12
12 Протокол испытаний 13
Приложение А (информационное) Общая схема для идентификации микроорганизмов 14
Приложение В (информационное) Другая среда 15
Приложение С (информационное) Нейтрализаторы антибактериальной деятельности консервантов и жидкостей полоскания 17
Библиография 19
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РЕСПУБЛИКИ КАЗАХСТАН
КОСМЕТИКА
Микробиология Обнаружение специфических и неснеипфических микроорганизмов
Дата введения 2010-07-01
1 Область применения
Настоящий стандарт устанавливает общие руководящие принципы для обнаружения и идентификации определенных микроорганизмов в косметической продукции, и для обнаружения и идентификации других видов аэробных мезофильных неспецифических микроорганизмов в косметической продукции.
Рассматриваемые микроорганизмы, как установлено в настоящем стандарте, могут отличаться в зависимости от страны в соответствии с национальными правилами и регламентами. Многие из них необходимо рассматривать, как определенные микроорганизмы, включающие одну или более следующих разновидностей: Pseudomonas aeruginosa, Escherichia coli. Staphylococcus aureus и Candida albicans.
Для того чтобы гарантировать качество продукта и безопасность для потребителей, рекомендуется выполнить соответствующий микробиологический анализ риска, чтобы определить типы косметических продуктов, к которым настоящий стандарт применим. Продукты, которые представлены, имеют низкий микробиологический риск, включая низкое содержание воды, спирта, высокий pH-фактор и т.д.
Настоящий стандарт устанавливает метод, который основан на обнаружении роста микробов в неселективной жидкой среде (среде обогащения), удобной для выявления бактериального заражения, последующим выделением колоний микроорганизмов в неселективной агаровой среде. Другие методы зависят от уровня необходимого обнаружения.
Настоящий стандарт устанавливает процедуры для идентификации Pseudomonas aeruginosa, Escherichia coli. Staphylococcus aureus, и Candida albicans. Другие микроорганизмы, выращенные в условиях, описанных в настоящем стандарте, определяют, используя соответствующие испытания, согласно общей схеме (см. Приложение А). В этом случае возможно использование других стандартов.
Издание официальное
Из-за большого разнообразия косметических продуктов в данной области применения, описанный метод может не соответствовать некоторым продуктам (определенные гидрофобные продукты). Другие методы, представленные здесь (автоматизированный), можно использовать, если доказуема их эквивалентность или метод официально утвержден.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные документы:
СТ РК 1.9-2007 Государственная система технического регулирования Республики Казахстан. Порядок применения .международных, региональных и национальных стандартов иностранных государств, других нормативных документов по стандартизации в Республике Казахстан.
СТ РК ИСО 21148:2008 Косметика. Микробиология. Общие указания по микробиологическому контролю.
3 Термины и определения
В настоящем стандарте применяются следующие термины с соответствующими определениями:
3.1 Продукт (product): Часть идентифицированного косметического продукта, переданного в лабораторию для испытания.
3.2 Образец (sample): Часть продукта (как минимум 1,0 г или 1,0 мл), которая используется в испытании для приготовления исходной суспензии.
3.3 Исходная суспензия (initial suspension): Суспензия (или раствор) образца в определенном объеме соответствующей среды обогащения.
3.4 Разведение образца (sample dilution): Разбавление исходной суспензии
3.5 Аэробные мезофильные микроорганизмы (aerobic mesophilic microorganisms). Мезофильные бактерии или дрожжи, выращиваемые аэробно, в условиях, определенных настоящим международным стандартом.
ПРИМЕЧАНИЕ При описанных условиях могут быть обнаружены другие типы микроорганизмов (плесень).
3.6 Микроорганизмы, введенные в спецификацию (specified microorganisms): Аэробные мезофильные бактерии или дрожжи, которые являются нежелательными в косметическом продукте, потому что могут
вызвать инфекцию кожи или глаз, или могут быть признаны как индикаторы нарушений требований гигиены в производственном процессе.
3.6.1 Pseudomonas aeruginosa: Грамотрицательная палочка (бацилла), подвижная; образует пигментированные гладкие колонии (окрашенные в коричневый или зеленоватый цвета).
ПРИМЕЧАНИЕ 1 Главные особенности идентификации - положительная оксндаза, рост на селективной цетавлоновой агаровой среде, производство диффузных флуоресцентных пигментов и растворимых феназиновых пигментов (пиоцнанин) в подходящей среде.
ПРИМЕЧАНИЕ 2 Pseudomonas aeruginosa может быть выделена из большого количества источников, особенно из воды, и высокую патогенность и и имеет способность влиять на физико-химические свойства косметической формулы.
3.6.2 Escherichia coli: Грамотрицательная палочка (бацилла), подвижная, образует гладкие колонии.
ПРИМЕЧАНИЕ 1 Главные особенности идентификации - положительная каталаза, отрицательная оксндаза, ферментация лактозы, производство индола, рост на селективной среде, содержащей соли жёлчи с характерными колониями
ПРИМЕЧАНИЕ 2 Escherichia coli выделяют из влажных мест (воздух, вода, почва). Это индикатор фекального загрязнения.
3.6.3 Staphylococcus aureus: Грамотрицательный кокк,
преимущественно агрегированный в пучки, в виде виноградных гроздей, образует гладкие колонии обычно окрашенные в желтый цвет.
ПРИМЕЧАНИЕ 1 Главные особенности идентификации - рост в специальной селективной среде, положительная каталаза, положительная коагулаза.
ПРИМЕЧАНИЕ 2 Staphylococcus aureus - это оппортунистическая патогенная бактерия у людей, которая также может присутствовать на коже здоровых людей без всякой причины, видимой болезни. Этот микроорганизм нежелателен в косметическом продукте.
3.6.4 Candida albicans: Дрожжи, которые формируют бело-бежевые, кремообразные и выпуклые колонии на поверхности неселективной агаровой среды.
ПРИМЕЧАНИЕ Главные особенности идентификации - производство проростковой трубочки н/или лжегрибницы и хламидоспоры, когда испытание совершают по методу, определенному в настоящем стандарте
3.7 Неспецнфические микроорганизмы (non-specified microorganisms): Аэробные мезофильные бактерии или дрожжи,
обнаруженные в косметической продукции, не обозначенные в п. 3.6.
3.9 Среда обогащения (enrichment broth): Неселективная жидкая среда, содержащая подходящие нейтрализаторы и/или диспергирующие вещества, утвержденные для испытуемой продукции.
4 Принцип
Первый шаг процедуры - совершить обогащение, используя неселективную среду для обогащения, для увеличения числа
микроорганизмов, без риска подавления селективными ингредиентами, которые представлены в селективной/дифференцирующей среде роста.
Второй шаг испытания (выделение) проводится на селективной среде, и сопровождается идентификационными тестами.
При этом нейтрализуют возможное подавление роста микроорганизмов, содержащихся в образце, что сделает возможным обнаружение
жизнеспособных микроорганизмов [1]. Во всех случаях и при любой методологии, нейтрализация антибактериальных свойств продукта должна быть проверена и утверждена [2], [3], [4].
5 Растворители и культуральная среда
5.1 Общие положения
Общие спецификации - по СТ РК ИСО 21148. Если косметический продукт имеет водную основу - применяется дистиллированная или очищенная вода.
Среда обогащения используется для разбавления образца и для увеличения исходной микрофлоры. Она может содержать нейтрализаторы, если испытатуемый образец имеет антибактериальные свойства. Эффективность нейтрализации должна быть показана (см. Раздел 11). Информация относительно подходящего нейтрализатора приведена в Приложении С.
Следующая среда обогащения (п. 5.3.2.1) или любая другая, указанная в Приложении В, подходит для проверки наличия специфических и неспецифических микроорганизмов, в соответствии с настоящим стандартом, при условии, что она соответствует Разделу 11.
Другие растворители и культуральная среда могут использоваться, если показано, что они подходят для использования.
5.2 Растворитель суспензии микроорганизмов (раствор трнптона хлорида натрия)
5.2.1 Общие положения
Растворитель, использованный для подготовки суспензии бактерий и дрожжей, также используется для процедуры проверки достоверности (см. Раздел 11).
5.2.2 Состав:
- триптон, панкреатический гидролизат казеина 1,0 г;
- хлорид натрия 8,5 г;
- вода 1 ООО мл.
5.2.3 Подготовка
Растворить компоненты в воде путем смешивания при нагревании. Распределить в соответствующие контейнеры. Стерилизовать в автоклаве при температуре 121°С в течение 15 мин. После стерилизации, рН-фактор при комнатной температуре должен составлять (7,0 ± 0,2).
5.3 Культуральная среда
5.3.1 Общие положения
Культуральная среда может быть подготовлена из сухой культу ральной среды согласно инструкциям производителя.
ПРИМЕЧАНИЕ Готовую к применению среду используют, если ее состав и/или ростовые свойства сопоставимы с требованиями, которые даны в настоящем стандарте
5.3.2 Обогатительная среда
5.3.2.1 Среда для ускоренного роста микроорганизмов LT 100
5.3.2.1.1 Общие положения
Данная среда состоит из ингредиентов:
- диспергирующее вещество: октоксинол 9.
5.3.2.1.2 Состав:
- панкреатический гидролизат казеина 15,0 г;
- папаический гидролизат соевой муки 5,0 г;
- L-цистин 0,7 г;
- хлорид натрия 4,0 г;
- сульфид натрия 0,2 г;
- глюкоза 5,5 г;
- яичный лецитин 1,0 г;
- эфир полиоксиэтиленовой жирной кислоты 80 5,0 г;
- октоксинол 9 1,0 г;
- вода 1 000 мл.
5.3.2.1.3 Подготовка
- которые нейтрализуют ингибиторы, присутствующие в образце: лецитин и эфир полиоксиэтиленовой жирной кислоты 80,
Последовательно растворить компоненты эфира полиоксиэтиленовой жирной кислоты 80, октоксинол 9 и яичный лецитин в кипящей воде до их полного растворения. Растворить другие компоненты путем смешивания при нагревании. Распределить среду в подходящие контейнеры. Стерилизовать в автоклаве при температу ре 121°С в течение 15 мин. После стерилизации рН-фактор при комнатной температуре должен составлять (7,0 ± 0,2).
5.3.2.2 Другие среды для обогощения
Другие среды для обогащения могут использоваться в соответствии с
Приложением В.
5.3.3 Неселективная агаровая среда
5.3.3.1 Общие положения
Данная среда используется для обнаружения и выделения специфических и неспецифических микроорганизмов, представленных в исходной суспензии после обогащения, и для приготовления прививочного материала, используемого в процедуре проверки достоверности.
5.3.3.2 Соево-казеин гидролизатная агаровая среда (SCDA) или триптический соевый агар (TSA)
5.3.3.2.1 Состав:
- панкреатический гидролизат казеина 15,0 г;
- папаическая система соевой продукции 5,0 г;
- хлорид натрия 5,0 г;
-агар 15,0 г;
- вода I 000 мл.
5.3.3.2.2 Подготовка
Растворить компоненты или сухую готовую среду в воде, путем смешивания при нагревании. Распределить среду в соответствующие контейнеры. Стерилизовать в автоклаве при температуре 121°С в течение 15 мин. После стерилизации и охлаждения pH-фактор должен составлять (7,3 ± 0,2) когда измеряют при комнатной температуре.
5.3.3.3 Другие неселективные агаровые среды
Разрешается использовать другие неселективные, не нейтрализующие агаровые среды (см. Приложение В).
6 Приборы и стеклянная посуда
Необходимо использовать лабораторное оборудование, приборы и стеклянную посуду в соответствии с СТ РК ИСО 21148.
7 Штамм микроорганизма
Для проверки достоверности условий испытания необходимо использовать следующие три определенных микроорганизма (два вида, представляющих грамотрицательную и грамположительную бактерию, и дрожжи):
- Pseudomonas aeruginosa АТСС 90271 ( CIP 82.118 или NCIMB 8626, или
NBRC 13275, или КСТС 2513, или другие эквивалентные национальные
штаммы).
Альтернативой грамотрицательному штамму может быть: Escherichia coli, АТСС 8739 (эквивалентные штаммы: CIP 53.126 или NCIMB 8545 или NBRC 3972 или КСТС 2571 или другие эквивалентные национальные штаммы).
- Staphylococcus aureus АТСС1 6538 (эквивалентные штаммы: CIP2 4.83 или NCIMB3 9518, или NBRC3 13276 или КСТС5 1916 или другие эквивалентные национальные штаммы);
Совокупность культур американского тнгы (Американская национальная коллекция штаммов). ' Коллекция штаммов dc Г Inst iiui Pasteur.
' Национальная коллекция промышленных и морских бактерий.
4 Национальный биологический ресурсный центр.
* Корейская коллекция типовых культур.