МИНИСТЕРСТВО ПРИРОДНЫХ РЕСУРСОВ И ЭКОЛОГИИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральная служба по гидрометеорологии и мониторингу окружающей среды (Росгидромет)
Р
РЕКОМЕНДАЦИИ 52.24.809-
2014
МЕТОДЫ ОЦЕНКИ ТОКСИЧЕСКОГО ВЛИЯНИЯ ФИТОЦЕНОЗОВ ПЛАНКТОНА НА ФОРМИРОВАНИЕ КАЧЕСТВА ПОВЕРХНОСТНЫХ ВОД СУШИ
Ростов-на-Дону
2014
Предисловие
1 РАЗРАБОТАНЫ Федеральным государственным бюджетным учреждением «Гидрохимический институт» (ФГБУ «ГХИ»)
2 РАЗРАБОТЧИКИ Т.А. Хоружая, д-р биол. наук; Н А. Мартышева, Е.Б. Юрасова
3 СОГЛАСОВАНЫ с Федеральным государственным бюджетным учреждением «Научно-производственное объединение «Тайфун» (ФГБУ «НПО «Тайфун») 27.02.2014 и Управлением мониторинга загрязнения окружающей среды (УМЗА) Росгидромета 04.03.2014
4 УТВЕРЖДЕНЫ Заместителем Руководителя Росгидромета 05.03.2014
ВВЕДЕНЫ В ДЕЙСТВИЕ приказом Росгидромета № 204 от 23.04.2014
5 ЗАРЕГИСТРИРОВАНЫ ФГБУ «НПО «Тайфун» от 24.03.2014 за номером Р 52.24.809-2014
6 ВВЕДЕНЫ ВПЕРВЫЕ
7 СРОК ПЕРВОЙ ПРОВЕРКИ 2019 год
© Росгидромет, ФГБУ «ГХИ», 2014
P 52.24.809-2014
- оценка токсичности природных фитоценозов по результатам биотестирования и верификация цветения по результатам биоиндикации.
6.2 Перед проведением работ составляют программу отбора проб, готовят посуду, оборудование, реактивы и вспомогательные материалы для отбора, анализа проб в соответствии с [2], место хранения проб, а также рабочие места для их анализа в лаборатории.
6.3 Все работы должны исключать попадание токсичных, органических и каких-либо других веществ из окружающей среды в испытуемые пробы воды или биомассы водорослей.
6.4 Пробы воды, фитопланктона и биомассы водорослей отбирают на приплотинных участках водохранилищ, небольших водоемах в период цветения, которое, прежде всего, выявляют визуально - по изменению цвета воды и «пятнам» цветения. Интенсивность цветения затем определяют в лаборатории путем биоиндикации по фитопланктону по одному из значений:
- общей биомассы водорослей;
- биомассы синезеленых водорослей.
Обычно интенсивное цветение воды водоемов в Северном полушарии наблюдается в летне-осенний период.
6.5 При отборе пробы составляют характеристику пробы в соответствии с формой приложения Б. На бутыль с пробой наклеивают водостойкую этикетку с номером пробы, местом, датой и временем ее отбора. Можно написать эти данные несмываемым водой маркером. В лаборатории регистрируют число емкостей и номера протокола отбора каждой пробы.
6.6 Работы по биотестированию и биоиндикации проводят в лаборатории. Биотестирование проводят в помещениях, в воздухе которого не должно быть токсичных паров, газов и пыли. Температура воздуха в помещении должна быть от 18 °С до 25 °С, в люминостате для биотестирования на водорослях - от 22 °С до 25 °С. Атмосферное давление должно быть в пределах от 84 до 106 кПа (от 630 до 800 мм рт. ст.). Освещение в люминостате, или эквивалентном приспособлении с лампами дневного света для водорослей должно составлять от 3000 до 10000 лк. Освещение помещения для выполнения работ по биоиндикации - естественное или искусственное, не ограничено особыми требованиями.
7
7 Подготовка к выполнению измерений
7.1 Подготовка посуды для отбора, хранения проб и проведения биотестирования
Для отбора проб воды или биомассы водорослей используют посуду из полиэтилена или политетрафторэтана. Для отбора проб нельзя использовать посуду с хромовым покрытием.
Желательно, чтобы посуда из полиэтилена и стекла для отбора проб и биотестирования была химически чистой. Для этого ее промывают раствором азотной кислоты с массовой долей 10 %. Стенки посуды осторожно смачивают этим раствором, после чего на 3 ч посуду оставляют, затем ее тщательно промывают водопроводной водой, нейтрализуют раствором пищевой соды и промывают четыре раза дистиллированной водой. При сильном загрязнении посуды, а также новую посуду промывают водой, заполняют раствором азотной кислоты с массовой долей 10 % и выдерживают не менее суток, затем тщательно промывают раствором соды, водопроводной и, не менее четырех раз, дистиллированной водой.
Для мытья посуды не следует пользоваться хромовой смесью (смесь бихромата калия и серной кислоты), синтетическими поверхностно-активными веществами и органическими растворителями.
Всю грязную посуду (за исключением мерной), использованную при отборе проб, в процессе пробоподготовки и проведения
биотестирования рекомендуется стерилизовать кипячением в течение одного часа или помещением (за исключением мерной) в сушильный шкаф при температуре 160 °С в течение одного часа.
Чистую посуду для биотестирования хранят с закрытыми стеклянными притертыми пробками или завинчивающимися крышками в защищенных от пыли ящиках лабораторного стола или на закрытых полках, стеллажах и т.п.
7.2 Отбор, транспортировка и хранение проб
Пробы для биотестирования и биоиндикации отбирают одновременно.
Отбор проб проводят согласно ГОСТ Р 51592 и ГОСТ 17.1.5.05 с использованием устройств в соответствии с требованиями ГОСТ 17.1.5.04. Методы отбора, транспортировки, хранения, подготовки к выполнению биотестирования должны обеспечить неизменность состава проб в интервале времени между отбором проб и их анализом.
Пробы отбирают вручную специальными приспособлениями или с применением автоматических пробоотборников, которые должны быть изготовлены из нетоксичного материала.
Для отбора проб воды с глубины от 0,5 м и более используют бутыль с привязанной пробкой, которую помещают в футляр, или пробоотборник
8
P 52.24.809-2014
с грузом. Футляр снабжен петлей, к которой привязывают веревку с размеченными отрезками, указывающими глубину погружения. На требуемой глубине, с помощью, привязанной к пробке веревки, выдергивают пробку из горла бутыли. После заполнения бутыли водой (на поверхности воды не появляются пузырьки воздуха) ее поднимают на поверхность.
При отборе проб измеряют температуру воды и записывают результаты в соответствии с приложением Б. Используют термометры с ценой деления 0,5 °С. Для определения температуры на месте взятия пробы 1 дм3 воды наливают в склянку, нижнюю часть термометра погружают в воду и через 5 мин отсчитывают показания, держа термометр вместе со склянкой на уровне глаз. Точность определения составляет (±0,5) °С.
Пробы желательно поместить в емкость с забортной водой, которую меняют каждые 2 ч или погрузить в воду за борт в прочной сетке, чтобы поддерживать постоянную природную температуру.
Для биотестирования отбирают не менее 5000 см3 природной воды (из них для биотестирования на дафниях - 600 см3, для
биотестирования на водорослях - 300 см , для биотестирования на рыбах - 3000 см3). Пробы биомассы отбирают из «пятен» цветения планктонной сетью (всего две пробы) путем пропускания через нее по 10 дм3 воды, и помещают в сосуды с притертыми пробками.
Отбираемый объем должен быть в два раза больше объема, требуемого для приготовления разбавлений и хранения оставшегося объема пробы до конца биотестирования.
Не допускается консервирование проб, предназначенных для биотестирования.
Пробы для биотестирования помещают в банки или флаконы, предварительно дважды ополаскивая их отбираемой водой, заполняя их до краев и закрыв так, чтобы не было пузырьков воздуха под пробками или полиэтиленовыми крышками. Пробы упаковывают в деревянные ящики для переноски проб и прокладывают бумагой или ветошью и помещают в холодильник при температуре 4 °С.
Биотестирование проводят не позднее 6 ч после их отбора, а в случае невозможности проведения анализа в течение этого срока пробы воды охлаждают до температуры от 2 °С до 4 °С и хранят в темноте не более 24 ч после отбора.
Все процедуры отбора, консервирования и хранения проб для биоиндикации по фитопланктону выполняют в соответствии с традиционными методами согласно [3].
8 Требования к квалификации операторов
К выполнению измерений и обработке их результатов допускают лиц с высшим профессиональным образованием или со средним
9
профессиональным образованием, имеющие стаж работы в лаборатории не менее трех лет, владеющих техникой биоиндикации и биотестирования.
9 Биоиндикация
9.1 Биоиндикацию фитопланктона проводят в лаборатории в целях:
- верификации интенсивности цветения воды водоема и получения данных о доминировании синезеленых водорослей в сообществе фитопланктона, определения относительного содержания (доли в общей численности) их «токсичных» видов, что необходимо для контроля приемлемости результатов оценки токсического влияния фитоценозов на формирование качества воды;
- определения изменений численности водорослей в ходе биотестирования.
Общая схема проведения работ с пробами приведена на рисунке 1.
9.2 Подготовка проб для биоиндикации по фитопланктону.
Отобранный объем пробы воды (500 см3) фильтруют через
мембранные фильтры с диаметром пор 1,2 мкм (например, «Владипор»), при этом фильтр перед применением промывают и кипятят в дистиллированной воде в течение 20 мин. Осадок клеток с фильтра количественно переносят в небольшие флаконы, используя для смывания осадка полученный фильтрат, консервируют формалином и проводят гидробиологический анализ фитопланктона в соответствии с [3].
Определяют и регистрируют показатели:
- общая численность водорослей;
- общая биомасса водорослей;
- численность синезеленых водорослей;
- биомасса синезеленых водорослей;
- доля видов синезеленых в общей численности водорослей;
- доля синезеленых в общей биомассе водорослей;
- видовой состава синезеленых и доля «токсичных» видов в общей численности и биомассе водорослей.
9.3.Оценка интенсивности цветения воды
Интенсивность цветения воды определяют по данным анализа проб фитопланктона по одному из значений:
- общей биомассы водорослей;
- биомассы синезеленых водорослей.
Оценку интенсивности цветения проводят согласно следующим значениям общей биомассы фитопланктона и биомассы синезеленых водорослей:
ю
P 52.24.809-2014
|
1 Отбор проб |
|
|
Рисунок 1 - Общая схема проведения работ с пробами |
- биомасса от 10,0 до 99,9 мг/дм3 соответствует интенсивному цветению;
- биомасса более 100 мг/ дм3 соответствует гиперцветению.
11
9.4 Оценка доминирования синезеленых водорослей.
Оценку делают по данным о доле синезеленых в общей численности водорослей или в общей биомассе фитопланктона. Синезеленые водоросли считают доминирующими, если они составляют в общей численности или биомассе 40 % и более.
9.5 Запись результатов
Результаты анализа фитопланктона записывают в соответствии с формой приложения В.
10 Биотестирование токсичности воды
10.1 Общие положения
Для биотестирования проб воды используют биотесты:
- на ракообразных (дафниях);
- на зеленых водорослях;
- рыбах гуппи Poecilia reticulata Peters (Cyprinodontiformes,Pisces) согласно рекомендациям P 52.24.566.
Перед постановкой биотестов тест-объекты калибруют по чувствительности к бихромату калия согласно ГОСТ Р 54496 или Р 52.24.566.
Общая схема проведения работ с пробами приведена на рисунке 1.
Вода, используемая для биотестирования, должна иметь характеристики интенсивности цветения по 9.3.
10.2 Биотестирование проб воды на дафниях
10.2.1 Для выполнения биотестирования проб воды на дафниях отобранный объем пробы (600 см3) фильтруют через мембранные фильтры с диаметром пор 1,2 мкм (например, «Владипор»), при этом фильтр перед применением промывают и кипятят в дистиллированной воде от 20 до 30 мин. Фильтрат используют для биотестирования.
10.2.2 Биотестирование проводят на дафниях Daphnia magna Straus (Cladocera, Crustacea) согласно рекомендациям P 52.24.566 (подраздел 6.1).
10.2.3 по результатам биотестирования рассчитывают изменения гибели в анализируемой пробе относительно контрольной в процентах согласно Р 52.24.566 (подраздел 6.1), используя формулу 6.2.
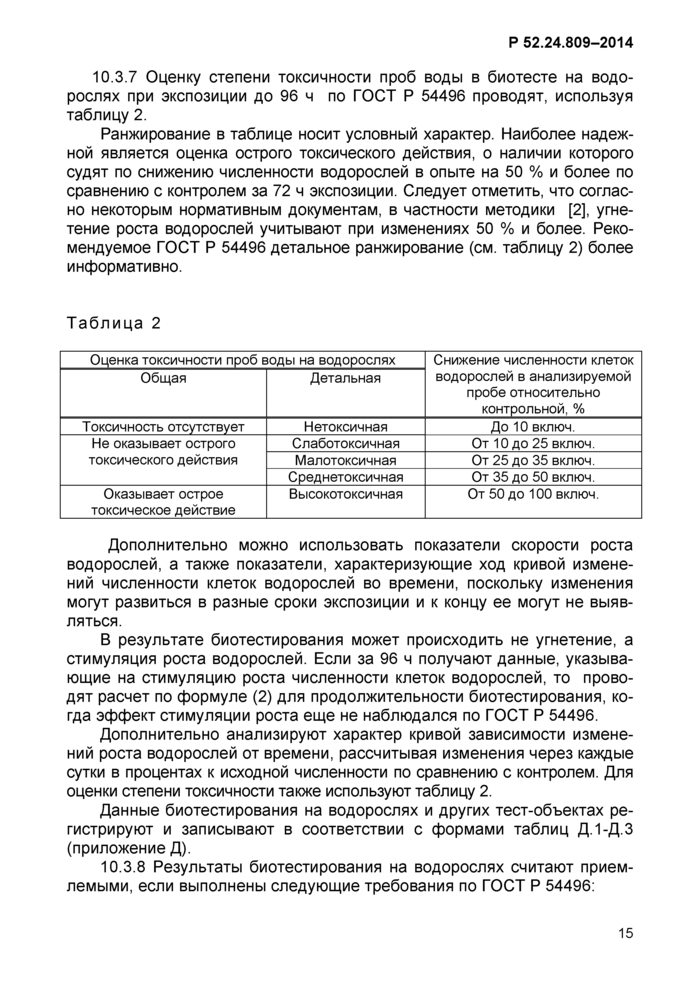
10.2.4 Оценку степени токсичности проб воды в биотесте на дафниях при экспозиции до 96 ч проводят, используя таблицу 1.
P 52.24.809-2014
Содержание
1 Область применения..................................................................................1
2 Нормативные ссылки..................................................................................1
3 Термины, определения и сокращения......................................................2
4 Общие положения.......................................................................................5
5 Принцип оценки токсического влияния фитоценозов
на формирование качества ПВС..............................................................6
6 Требования, порядок и условия выполнения работ по оценке
токсического влияния фитоценозов планктона на формирование качества ПВС..............................................................................................6
7 Подготовка к выполнению измерений.......................................................8
7.1 Подготовка посуды для отбора, хранения проб и проведения
биотестирования.................................................................................8
7.2 Отбор, транспортировка и хранение проб.......................................8
8 Требования к квалификации операторов..................................................9
9 Биоиндикация............................................................................................10
10 Биотестирование токсичности воды......................................................11
10.1 Общие положения.........................................................................12
10.2 Биотестирование проб воды на дафниях....................................12
10.3 Биотестирование проб воды на водорослях...............................13
10.4 Биотестирование на рыбах...........................................................16
11 Биотестирование проб биомассы водорослей.....................................16
11.1 Принцип метода.............................................................................16
11.2 Отбор, подготовка проб и проведение биотестирования..........16
11.3 Приготовление разбавлений фильтрата биомассы водорослей.....19
11.4 Пример выполнения работ с биомассой водорослей.................19
12 Оценка токсического влияния фитоценоза на формирование
качества ПВС..........................................................................................20
Приложение А (справочное) Синезеленые водоросли и их токсины.......23
Приложение Б (обязательное) Форма записи характеристик пробы
природной воды и условий отбора.......................................25
Приложение В (обязательное) Форма записи результатов
биоиндикации по фитопланктону..........................................26
Приложение Г (справочное) Содержание культуры водорослей в
лабораторных условиях.........................................................27
Приложение Д (обязательное) Форма записи данных
биотестирования....................................................................28
Приложение Е (обязательное) Форма заключения о влиянии
фитоценоза на качество воды...............................................30
Приложение Ж (рекомендуемое) Пример выполнения работ по оценке токсического влияния фитоценозов
планктона на формирование качества ПВС........................31
Библиография..............................................................................................37
III
Введение
Одной из проблем, создающих трудности рационального использования водных ресурсов является эвтрофирование - повышение биологической продуктивности водных объектов в результате накопления в воде биогенных веществ: соединений азота, фосфора, кремния, железа и некоторых микроэлементов. Следствием эвтрофирования является цветение - массовое развитие фитопланктона, чаще всего с преобладанием синезеленых водорослей. Оно приводит к ухудшению качества воды и представляет опасность для функционирования водной экосистемы. Масштабы эвтрофирования растут, и оно приобретает глобальный характер. Если глобальное потепление климата станет реальностью, то ситуация с эвтрофированием ухудшится. Многочисленные попытки борьбы с цветением и разработки мер по улучшению качества воды эвтрофных водоемов, особенно крупных водохранилищ, пока не увенчались успехом.
Негативные влияния цветения синезеленых водорослей и их токсинов на пресноводные экосистемы, гидробионтов разных трофических уровней, а также на млекопитающих и человека достаточно хорошо документированы, хотя разногласия в оценке влияния все же весьма существенны. Особенно важна оценка влияния природных популяций и фитоценозов на качество воды, разработка упрощенных методов такой оценки, не требующих дорогостоящей и трудно реализуемой на сети наблюдений за уровнем загрязнения окружающей среды Росгидромета идентификации токсинов. В то же время наличие в планктонном фитоценозе видов, известных как «токсичные», еще не доказывает факт образования ими токсинов.
В этой связи использование методологии биотестирования интегральной токсичности без идентификации альготоксинов представляется в настоящее время наиболее приемлемым решением задачи при условии установления (верификации) путем биоиндикации интенсивного цветения воды водоема и преобладания синезеленых водорослей. Установление токсичности водной среды в случае интенсивного цветения водоема (при доминировании синезеленых в сообществе фитопланктона) может быть с большой вероятностью отнесено к токсическому влиянию водорослей данного фитоценоза. Наиболее пригодными для оценки влияния фитоценозов на формирование качества воды являются методы биотестирования на водорослях (сценедесмусе и хлорелле), ракообразных (дафниях) и аквариумных рыбах (гуппи). Эти тест-объекты чувствительны к токсинам различной химической природы, апробированы на природной воде многих водоемов. Методы удобны по простоте выполнения, выращиванию культур в лабораторных условиях, не требуют значительных материальных затрат, но при этом надежны, обеспечены метрологическими характеристиками и позволяют получить достоверные результаты.
Рекомендации разработаны с целью усовершенствования и актуализации нормативно-методического обеспечения мониторинга поверхностных водных объектов в Росгидромете. Рекомендации дополняют используемые на сети наблюдений биологические методы оценки качества воды новым подходом, направленным на решение актуальных задач токсического загрязнения водных объектов.
IV
РЕКОМЕНДАЦИИ
МЕТОДЫ ОЦЕНКИ ТОКСИЧЕСКОГО ВЛИЯНИЯ ФИТОЦЕНОЗОВ ПЛАНКТОНА НА ФОРМИРОВАНИЕ КАЧЕСТВА ПОВЕРХНОСТНЫХ ВОД СУШИ
Дата введения - 2014-12-01 Срок действия до 2019-12-31
1 Область применения
Настоящие рекомендации устанавливают методы оценки токсического влияния фитоценозов планктона на формирование качества поверхностных вод суши (ПВС) путем выявления токсичности проб воды и биомассы водорослей цветущего водоема при биотестировании в лабораторных условиях.
Настоящие рекомендации предусматривают использование токсикологических методов (далее - биотестирования) и гидробиологических методов (далее - биоиндикация).
Настоящие рекомендации предназначены для применения на государственной наблюдательной сети, осуществляющей организацию и проведение наблюдений за состоянием поверхностных вод суши. Рекомендации также могут использоваться специалистами в области мониторинга пресноводных экосистем других ведомств.
2 Нормативные ссылки
В настоящих рекомендациях использованы ссылки на следующие нормативные документы:
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб ГОСТ Р 54496-2011 (ИСО 8692:2004) Вода. Определение токсичности с использованием зеленых пресноводных одноклеточных водорослей
Р 52.24.566-94 Методы токсикологической оценки загрязнения пресноводных экосистем
Р 52.24.734-2010 Организация и проведение наблюдений за состоянием и изменением качества поверхностных вод в чрезвычайных ситуациях
1
РД 52.24.309-2011 Организация и проведение режимных наблюдений за состоянием и загрязнением поверхностных вод суши
3 Термины, определения и сокращения
3.1 В настоящих рекомендациях применены следующие термины с соответствующими определениями:
|
3.1.2 |
|
|
3.1.8 гидробионты: Все живые организмы, животные и растительные, развивающиеся и существующие в воде и донных отложениях водоемов и водотоков [1]. |
3.1.1 альготоксины: токсины водорослей.
3.1.9 гидробиологические показатели качества воды: Показатели качества воды, определяемые по состоянию гидробионтов [1].
|
3.1.10 |
|
|
3.1.17 острое токсическое действие (острая токсичность): Отклик организма на токсическое воздействие, который проявляется за относительно короткий период времени (от нескольких минут до нескольких суток). |
3.1.20 __
поверхностные воды: Воды, находящиеся на поверхности суши в
виде различных водных объектов.
[ГОСТ 19179-73, статья 7]_
3.1.21 пресные воды: Природные воды с минерализацией до 1 %о[1].
3.1.22 результат биотестирования: Конечный вывод о токсичности водной среды, установленной при биотестировании.
3.1.23 _
скорость роста: Увеличение плотности (численности) клеток водорослей в единицу времени.
[с учетом ГОСТ Р 54496-2011. статья 3.2]_
3.1.24 сообщество организмов: Совокупность взаимосвязанных и взаимозависимых видов организмов в пределах естественно ограниченного жизненного пространства.
3.1.25 створ пункта наблюдений: Условное поперечное сечение водоема или водотока, в котором производят комплекс работ для получения данных о показателях качества воды [1].
3.1.26 тест-объект: Организм, который используют при биотестировании (водоросли, дафнии и т.д.). (Р 52.24.566)
3.1.27 токсичность воды: Свойство воды вызывать развитие патологического процесса или гибель тест-объектов. (Р 52.24.566)
3.1.28 «токсичные» виды водорослей: Виды синезеленых водорослей, образующие в ходе жизнедеятельности токсины.
Примечание - Наиболее распространены «токсичные» виды водорослей: Microcystis aeruginosa. Aphanizomenon flos-aquae. Anabaena flos-aquae, Oscillatoria limnetica и другие.
3.1.29 токсичные загрязняющие вещества: Вещества, обладающие свойством токсичности.
3.1.30 фитоценоз: Сообщество растений в экосистеме водного объекта.
3.1.31 фоновый створ: Створ, расположенный выше аварийного сброса на расстоянии, исключающем влияние этого сброса (Р 52.24.734).
3.1.32 _
цветение вод: Массовое развитие фитопланктона, вызывающее
изменение окраски воды.
[ГОСТ 17.1.1.01-77, статья 49]_
3.1.33 численность водорослей: Количество клеток в единице объема питательной среды или анализируемой пробы.
3.1.34 _
эвтрофирование вод: Повышение биологической продуктивности
водных объектов в результате накопления в воде биогенных элементов. [ГОСТ 17.1.1.01 -77, статья 48]_
P 52.24.809-2014
3.1.35 экосистема: Сообщество живых организмов и среда их обитания, которые функционируют совместно (обмен веществ и энергии происходит во взаимной связи).
3.1.36 экспозиция: Время воздействия на тест-объект при биотестировании. (Р 52.24.566)
3.1.37 _
эффективная кратность разбавления; ЭКР: Степень разбавления
пробы питательной средой при подготовке анализируемой пробы, которая приводит к х %-ному снижению плотности клеток водорослей относительно контрольной пробы.
Примечание - ЭКР анализируемой пробы, при которой выживаемость дафний изменяется относительно контрольной пробы не более 10 % за 72 ч тестирования называется безвредно кратностью разбавления
[с учетом ГОСТ Р 54496 - 2011, статья 3.8]_
3.2 В настоящих рекомендациях применены следующие сокращения:
- ВЗ - высокое загрязнение;
- ГСН - государственная служба наблюдений за состоянием окружающей среды;
- ОТД - острое токсическое действие;
- ПВС - поверхностные воды суши;
- ПДК - предельно допустимая концентрация;
- ЭВЗ - экстремально высокое загрязнение;
-pH - водородный показатель реакции среды (отрицательный десятичный логарифм концентрации ионов водорода).
4 Общие положения
Наблюдения за токсичностью воды с использованием приемов и методов биотестирования в наблюдательной сети за уровнем загрязнения ПВС Росгидромета предусмотрены РД 52.24.309 (подпункт 5.3.1.4), однако они проводятся лишь в единичных случаях. Тем не менее проблема токсичности природных вод водоемов и водотоков, обуславливающая ухудшение качества воды, становится все более актуальной, особенно для водохранилищ.
Водохранилища и их приплотинные участки подвергаются значительным антропогенным нагрузкам, причем вследствие загрязнения биогенными элементами идет процесс эвтрофирования, интенсивно развиваются водоросли, наблюдается цветение воды. При этом в фитоценозах часто преобладают «токсичные» виды синезеленых водорослей - они образуют в ходе жизнедеятельности токсины. Наиболее опасным следствием эвтрофирования и цветения является токсическое загрязнение (токсификация) водоемов, прежде всего водохранилищ, токсинами синезеленых. Эти токсины имеют различную химическую природу, и химическое определение их затруднено из-за
5
недостаточной изученности, многообразия, отсутствия или малой доступности стандартных образцов для анализа (см. приложение А).
С помощью предлагаемых рекомендаций можно оценить токсическое влияние природных фитоценозов на формирование качества воды с помощью приемов и методик биотестирования и биоиндикации.
Биотестирование токсичности основано на регистрации реакций тест-объектов при помещении их в испытуемую пробу. В качестве тест-объектов обычно используют лабораторные культуры водорослей, ракообразных (дафний, цериодафний), коловраток, парамеций, хирономид, рыб.
Методы биотестирования, будучи биологическими, по смыслу близки к методам химического анализа: как и химические методы, они отражают свойства отобранной пробы и характеризуют воздействие этой пробы на водные организмы.
5 Принцип оценки токсического влияния фитоценозов на формирование качества ПВС
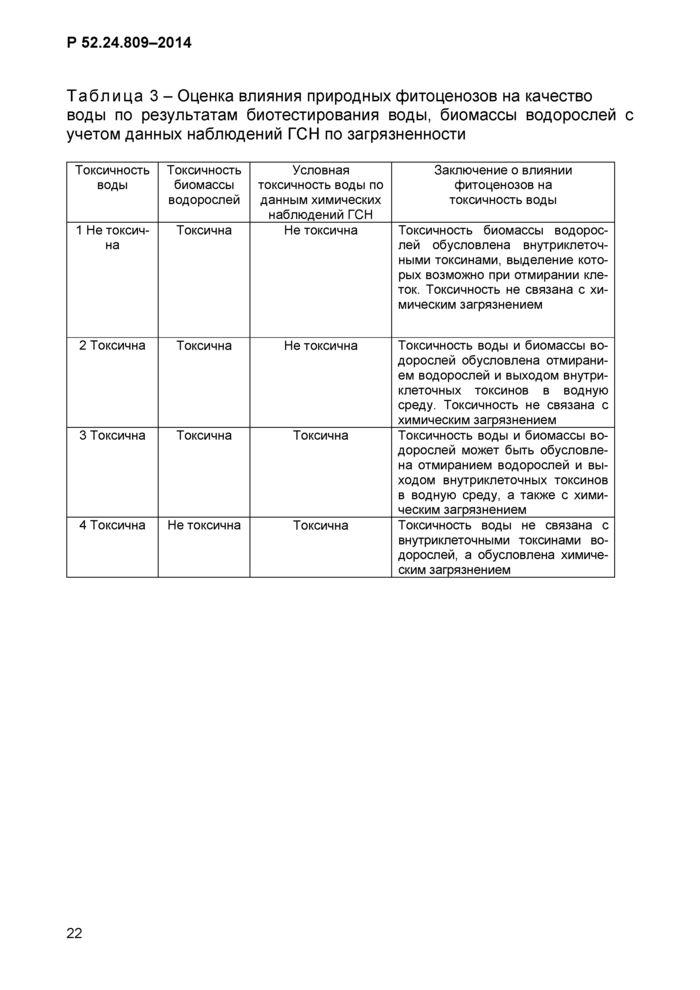
5.1 Токсическое влияние природных фитоценозов на формирование качества ПВС устанавливают по наличию токсичности проб воды и проб биомассы водорослей водоема при интенсивном цветении и доминировании синезеленых водорослей при биотестировании на гидробионтах, охватывающих основные трофические уровни водной экосистемы с учетом содержания загрязняющих веществ по данным наблюдений ГСН.
5.2 Объектами биотестирования токсичности служат пробы воды интенсивно цветущего водоема и пробы биомассы водорослей из «пятен» цветения.
Интенсивность цветения и роль синезеленых устанавливают путем биоиндикации фитоценозов.
Для биотестирования используют один биотест или набор биотестов: водоросли, ракообразные и рыбы.
6 Требования, порядок и условия выполнения работ по оценке токсического влияния фитоценозов планктона на формирование качества ПВС
6.1 В состав работ входит:
- отбор проб воды и биомассы водорослей для биотестирования, а также проб фитопланктона для биоиндикации;
- биотестирование проб воды и биомассы водорослей;
- биоиндикация по фитопланктону для установления степени цветения и роли синезеленых в фитоценозе;
6