МИНИСТЕРСТВО ПРИРОДНЫХ РЕСУРСОВ И ЭКОЛОГИИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральная служба по гидрометеорологии и мониторингу окружающей среды (Росгидромет)
Р
РЕКОМЕНДАЦИИ 52.24.808 -
2014
ОЦЕНКА ТОКСИЧНОСТИ ПОВЕРХНОСТНЫХ ВОД СУШИ МЕТОДОМ БИОТЕСТИРОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ХЛОРОФИЛЛА а
Ростов-на-Дону
2014
Предисловие
1 РАЗРАБОТАНЫ Федеральным государственным бюджетным учреждением «Гидрохимический институт» (ФГБУ «ГХИ»)
2 РАЗРАБОТЧИКИ Е.Н. Бакаева, д-р биол. наук, Н А. Игнатова, канд. биол. наук, Г.Г. Черникова
3 СОГЛАСОВАНЫ с ФГБУ «НПО «Тайфун» 29.01.2014
УМЗА Росгидромета 04.03.2014
4 УТВЕРЖДЕНЫ Заместителем Руководителя Росгидромета 05.03.2014
ВВЕДЕНЫ В ДЕЙСТВИЕ приказом Росгидромета № 204 от 23.04.2014
5 ЗАРЕГИСТРИРОВАНЫ ФГБУ «НПО «Тайфун» за номером Р 52.24.808-2014 от 24.03.2014
6 ВВЕДЕНЫ ВПЕРВЫЕ
7 СРОК ПЕРВОЙ ПРОВЕРКИ 2019 год
© Росгидромет, ФГБУ «ГХИ», 2014
II
P 52.24.808-2014
годности культуры к биотестированию является величина LC50 в диапазоне концентраций от 0,4 до 0,9 мг/дм3 калия двухромовокислого за 96 ч экспозиции, т.е. в пределах таких диапазонов концентраций эталонных токсикантов происходит гибель 50 % клеток микроводорослей.
В исходную (маточную) культуру микроводорослей вносят 0,1 см3 каждого питательного солевого раствора в соответствии с таблицей Д.1 (приложение Д) для пресноводных и с таблицей Д.2 (приложение Д) -для солоноватоводных микроводорослей.
9.3 Проведение биотестирования
9.3.1 Биотестирование проводят в нестерильных условиях при оптимальной температуре (20±2) °С и освещении от 2000 до 3000 лк с естественной сменой дня и ночи в помещениях без вредных испарений.
9.3.2 Испытываемую воду предварительно фильтруют через мельничный газ № 70 - № 74 для удаления природного зоопланктона.
9.3.3 В 3 колбы вместимостью 500 см3 добавляют по 250 см3 испытываемой воды, в 3 контрольные колбы вместимостью 500 см3 добавляют 250 см3 выбранный контроль.
9.3.4 В каждую колбу пипеткой вносят от 0,5 до 1,0 см3 сконцентрированной исходной (маточной) культуры микроводорослей.
9.3.5 Колбы закрывают ватно-марлевыми пробками, содержимое тщательно перемешивают и в каэдой колбе определяют исходную численность клеток N0, которая должна составлять от 250 до 300 тыс. кл./см3.
9.3.6 Колбы располагают в помещении при естественном освещении (избегая прямых солнечных лучей).
9.3.7 Для определения острой токсичности через 24 ч в каждой
колбе:
- подсчитывают численность клеток для установления прироста микроводорослей;
- отбирают 100 см3 среды для определения концентрации хлорофилла а.
9.3.8 В случае отсутствия острой токсичности через 96 ч для установления хронической токсичности в каждой колбе проводят действия по 9.3.7.
9.3.9 В течение эксперимента ежедневно тщательно перемешивают содержимое колб.
9.4 Определение концентрации хлорофилла а
Определение и расчет концентраций хлорофилла а, а также исходной концентрации хлорофилла а, проводят либо в ацетоновых вытяжках по ГОСТ 17.1.04.02 или [2], либо в этанольной вытяжке по ISO 10260:1992 или РД 52.24.784.
Наилучшее экстрагирование хлорофилла а происходит при использовании этанола.
7
9.5 Определение коэффициента прироста микроводорослей
9.5.1 Подсчет численности клеток микроводорослей осуществляют в камере Горяева, Фукс-Розенталя, т е. в любой камере, предназначенной для подсчета форменных элементов крови. Объем камеры Горяева представляет собой сетку из 25 маленьких квадратов, составляющих объем 0,0001 см3. Микроводоросли помещают под стекло в камеру, просчитывают 25 маленьких квадратов, полученную сумму умножают на 104и получают число клеток в 1 см3 суспензии.
При подсчете клеток в камере необходимо соблюдать следующие правила:
- взятую в пипетку каплю очень быстро наносят на поверхность сетки камеры, пока клетки микроводорослей не успели осесть в нижней части пипетки;
- нанесенную на поверхность сетки каплю быстро накрывают покровным стеклом и притирают во избежание оседания клеток из капли, большей по объему, чем капля в камере после притирания стекла;
- просчитывают клетки в трех камерах и берут среднее значение.
9.5.2 Коэффициент прироста численности клеток микроводорослей в контрольной и опытной сериях К, отн. ед., рассчитывают по формуле
K = Nt/N0, (1)
где N, - численность клеток микроводорослей в контроле или в испытываемой воде через учитываемый промежуток времени, тыс. кл/см3;
N0- исходная численность клеток микроводорослей, тыс. кл/ см3.
9.5.3 Для каждой из трех повторностей рассчитывают свой коэффициент прироста численности клеток микроводорослей. Значение коэффициента прироста численности клеток микроводорослей для каждой серии (опытной и контрольной) представляет собой среднее арифметическое из значений трех полученных коэффициентов.
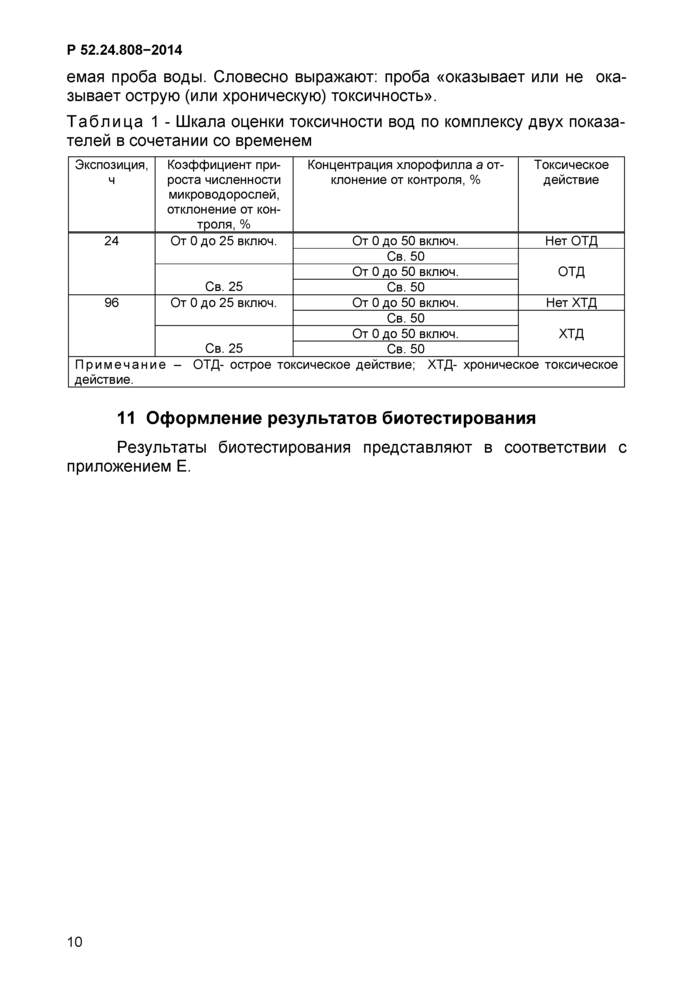
10 Оценка токсичности проб воды по двум тест-показателям (концентрация хлорофилла а и коэффициент прироста микроводорослей)
Первоначально рассчитывают отклонения значений коэффициента прироста микроводорослей опытных вариантов от контроля. В случае отклонения коэффициента прироста численности микроводорослей на 50 % и более концентрацию хлорофилла а не определяют.
10.1 Расчет отклонений значений коэффициента прироста численности микроводорослей
10.1.1 Отклонение коэффициента прироста численности клеток микроводорослей Кпр, %, рассчитывают по формуле
8
P 52.24.808-2014
КпР=[(Коп-Кко^)/Кконх] 100 %, (2)
где Коп - коэффициент прироста численности клеток микроводорослей в испытываемой воде;
Кконт - коэффициент прироста численности клеток микроводорослей в контроле.
10.1.2 Значения отклонений прироста численности микроводорослей в сериях с испытываемой водой от контроля могут иметь знаки плюс или минус.
Отклонение значений в сторону увеличения свидетельствует о наличии стимулирующего эффекта испытываемой воды на автотрофные тест-объекты, что косвенно свидетельствует о наличии органических веществ в водном объекте.
Отклонение значений в сторону уменьшения свидетельствует об угнетающем действии на автотрофные тест-объекты.
10.2 Расчет отклонений значений концентрации хлорофилла а
10.2.1 Отклонение полученных значений концентраций хлорофилла а от контроля Кхл, %, рассчитывают по формуле
Кхп=[(Хол-Хко^)/ХКо„т]Ю0, (3)
где Хоп - концентрация хлорофилла а микроводорослей в испытываемой воде;
Х*онт - концентрация хлорофилла а микроводорослей в контроле.
10.2.2 Значения отклонений концентраций хлорофилла а в опытных сериях от контроля могут иметь знаки плюс или минус.
Отклонение значений в сторону увеличения свидетельствует о наличии стимулирующего эффекта испытываемой воды на автотрофные тест-объекты, что косвенно свидетельствует о наличии органических веществ в водном объекте.
Отклонение значений в сторону уменьшения свидетельствует об угнетающем действии на автотрофные тест-объекты.
10.3 Оценка токсичности
Оценку токсичности испытываемой пробы воды проводят по комплексу двух показателей (концентрация хлорофилла а и коэффициент прироста численности клеток микроводорослей) в зависимости от экспозиции согласно шкале (таблица 1). Оценивают токсичность проб воды по характеру токсического действия, которое оказывает испытыва-
9
P 52.24.808-2014
емая проба воды. Словесно выражают: проба «оказывает или не оказывает острую (или хроническую) токсичность».
|
Таблица 1 - Шкала оценки токсичности вод по комплексу двух показателей в сочетании со временем |
|
Экспозиция,
ч |
Коэффициент прироста численности микроводорослей, отклонение от контроля. % |
Концентрация хлорофилла а отклонение от контроля. % |
Токсическое
действие |
|
24 |
От 0 до 25 включ. |
От 0 до 50 включ. |
Нет ОТД |
|
Св. 50 |
ОТД |
|
Св. 25 |
От 0 до 50 включ. |
|
Св. 50 |
|
96 |
От 0 до 25 включ. |
От 0 до 50 включ |
Нет ХТД |
|
Св. 50 |
ХТД |
|
Св. 25 |
От 0 до 50 включ |
|
Св. 50 |
|
Примечание - ОТД- острое токсическое действие: ХТД- хроническое токсическое действие. |
|
11 Оформление результатов биотестирования
Результаты биотестирования представляют в соответствии с приложением Е.
ю
P 52.24.808-2014
Приложение A
(справочное)
Характеристики пресноводных зеленых и сине-зеленых микроводорослевых тест-объектов
А. 1 Характеристика тест-объекта Scenedesmus obliquus (Тигр.) Kutz
Chlorophyta
Euchlorophyceae
Chlorococcales
Scenedesmaceae
Scenedesmoideae
Scenedesmus Mayen
S. obliquus (Тигр.) Kutz
А. 1.1 Систематическое положение
Отдел Класс Порядок Семейство Подсемейство Род Вид
А. 1.2 Местообитание Scenedesmus obliquus - широко распространённый в пресных поверхностных водах вид зеленых водорослей. Встречается главным образом в планктоне.
А. 1.3 Морфология, биология
Данный вид относится к ценобиальным организмам. Ценобии -организмы имеющие вид плоских пластинок и состоящие из 2, 4, реже 8 и 16 клеток. Клетки удлиненно-овальные, с закругленными концами. Оболочка гладкая. Размеры клеток 7-45 х 2,5-16,0 мкм.
Размножается автоспорами. Автоспоры в материнской оболочке располагаются пучком, после освобождения разворачиваются в виде пластинки. В условиях культуры иногда вместо ценобиев образуются отдельные клетки.
А.1.4 Содержание в лабораторных условиях Колбы для культивирования водорослей желательно стерилизовать сухим паром в течение 1 ч при 180 °С. Культуру водорослей вносят для посева в стеклянную колбу с питательной средой в количестве, дающем светло-зеленое окрашивание. Рецепт (состав) питательных сред приведен в приложении Е. Колбы закрывают стерильными ватномарлевыми пробками или колпачками из пергаментной бумаги. Водоросли культивируют в плоскодонных колбах или аквариумах при круглосуточном освещении лампами дневного света мощностью 240 Вт/м2, размещенными на расстоянии от 30 до 40 см от поверхности культуры. Водоросли можно выращивать при естественном освещении, защищая
11
P 52.24.808-2014
от прямых солнечных лучей. Культуру водорослей периодически перемешивают, встряхивая 3-5 раз в сутки. Оптимальная температура для выращивания водорослей 18-23 °С. Подкормку водорослей производят через каждые 10-14 дней. Пересеивать культуру водорослей можно через 2-4 недели.
А.2 Характеристика тест-объекта Chlorella vulgaris Beijer
Chlorophyta
Euchlorophyceae
Chlorococcales
Chlorellaceae
Chlorelloideae
Chlorella Beijer
Chlorella vulgaris Beijer
А.2.1 Систематическое положение
Отдел Класс Порядок Семейство Подсемейство Род Вид
А.2.2 Местообитание Chlorella vulgaris - широко распространенный вид зеленых водорослей, обитающих в различных биотопах пресноводных экосистем.
А.2.3 Морфология, биология
Chlorella vulgaris относится к одноклеточным водорослям. Клетки шаровидные, с тонкой оболочкой, без слизи. Хроматофор чашевидный, с пиреноидом. Размножается автоспорами, которые образуются по 4-8, реже по 16 штук, и освобождаются через разрыв в материнской оболочке. Диаметр клеток от 4,2 до10,5 мкм.
А.2.4 Содержание в лабораторных условиях Содержание в лабораторных условиях аналогично А.1.4.
A.3 Характеристика тест-объекта Synechocystis aquatilis Sauv
Отдел
Класс
Порядок
Семейство
Род
Вид
A.3.1 Систематическое положение
Cyanophyta
Chroococceae
Chroococcales
Coccobactreaceae
Synechocystis
Synechocystis aquatilis Sauv
12
P 52.24.808-2014
Содержание
1 Область применения................................................................................1
2 Нормативные ссылки................................................................................1
3 Термины и определения...........................................................................2
4 Требования к средствам измерений, вспомогательным
устройствам, материалам, реактивам....................................................3
4.1 Средства измерений, вспомогательные устройства........................3
4.2 Реактивы и материалы.......................................................................3
5 Общие положения.....................................................................................4
6 Требования безопасности, охраны окружающей среды........................5
7 Требования к квалификации операторов................................................5
8 Отбор, хранение и подготовка проб поверхностных вод суши для
биотестирования......................................................................................5
9 Биотест по концентрации хлорофилла а................................................5
9.1 Принцип биотеста...............................................................................5
9.2 Подготовка культуры микроводорослей к биотестированию............6
9.3 Проведение биотестирования...........................................................7
9.4 Определение концентрации хлорофилла а......................................7
9.5 Определение коэффициента прироста микроводорослей.............8
10 Оценка токсичности проб воды по двум тест-показателям
(концентрация хлорофилла а и коэффициент прироста микроводорослей)....................................................................................8
10.1 Расчет отклонений значений коэффициента прироста
численности микроводорослей........................................................8
10.2 Расчет отклонений значений концентрации хлорофилла а.........9
10.3 Оценка токсичности..........................................................................9
11 Оформление результатов биотестирования.....................................10
Приложение А (справочное) Характеристики пресноводных зеленых
и сине-зеленых микроводорослевых тест-объектов........11
Приложение Б (справочное) Характеристика солоноватоводных зеленых и морских диатомовых микроводорослевых
тест-объектов.......................................................................14
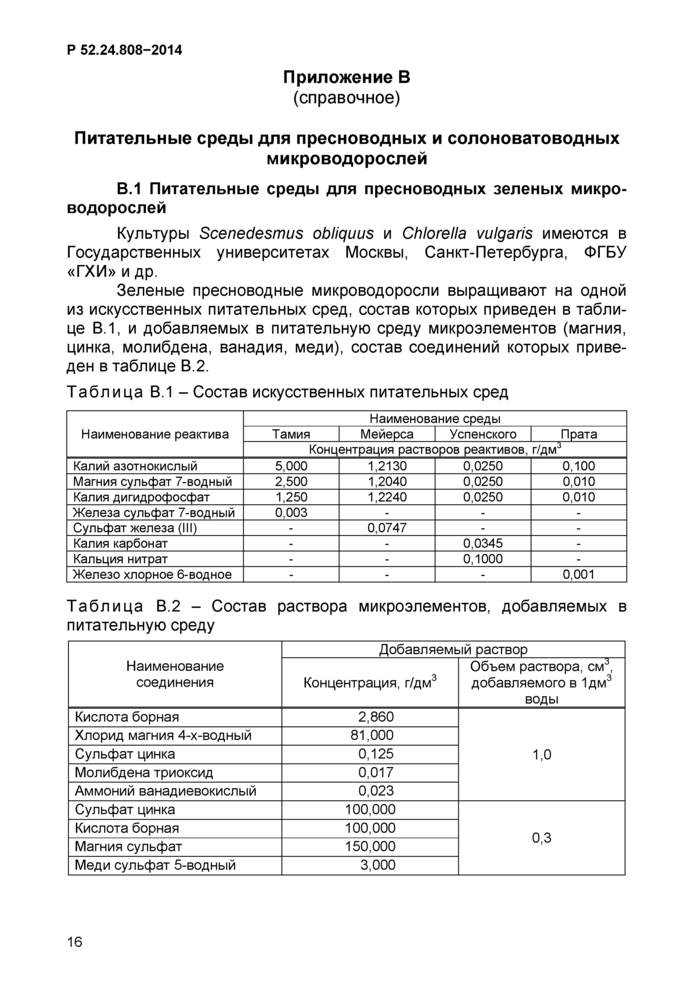
Приложение В (справочное) Питательные среды для пресноводных и
солоноватоводных микроводорослей................................16
Приложение Г (справочное) Значение фитопланктона в водной
экосистеме и общая характеристика пигментов................18
Приложение Д (справочное) Характеристика хлорофилла а.................20
Приложение Е (обязательное) Представление результатов оценки
токсичности поверхностных вод.........................................21
Библиография............................................................................................22
III
Введение
Фитопланктон играет в водных экосистемах самую важную роль, поскольку является поставщиком первичной продукции. Наличие и количество пигментов, в частности хлорофилла а, его концентрация служит показателем состояния фитопланктона и позволяет судить и о трофности водного объекта, и о его токсичности, т.е. о качестве вод. Токсичность и троф-ность являются слагаемыми качества воды, определяемого биологическими методами — биоиндикацией и биотестированием.
Устойчивая взаимосвязь распределения хлорофилла а с гидрохимическими, гидрологическими и гидробиологическими характеристиками конкретной акватории подтверждает его широкие информационные возможности. К настоящему времени разработаны методики определения концентраций хлорофилла а с помощью разных растворителей. Абсолютные значения массовых концентраций хлорофилла а, получаемых этими методиками существенно отличаются. В этанольных вытяжках абсолютные цифры массовых концентраций хлорофилла а выше, поскольку происходит более полное экстрагирование пигмента. Кроме того безопасность для оператора и окружающей среды при использовании этанольных экстрактов значительно выше.
Содержание хлорофилла а является одной из основных функциональных характеристик природного фитопланктона пресных и солоноватых вод. В связи с этим необходимо использование экологически соответствующих тест-объектов. В данных рекомендациях изложена характеристика тест-объектов из числа микроводорослей различной систематической принадлежности: Chlorophyta - зеленые, Cyanophyta -сине-зеленые, Bacillariophyta - диатомовые, и экологических особенностей (пресноводные, солоновато-водные и морские). Приведены прописи соответствующих питательных сред и способы поддержания маточных культур микроводорослей.
Концентрация хлорофилла а - очень чувствительный, быстро меняющийся физиологический показатель. В то время как о стабильности популяции и прогнозе её развития можно судить только по показателю размножения. Поэтому наиболее адекватной оценкой токсичности вод служит комплекс этих показателей. В данных рекомендациях приведена шкала оценки токсичности поверхностных вод, разработанная на основе комплекса двух показателей в сочетании с экспозицией биотеста.
Использование данной методики позволяет повысить результативность исследований по наблюдению за качеством поверхностных вод суши и обеспечить экологическую безопасность исследований.
РЕКОМЕНДАЦИИ
ОЦЕНКА ТОКСИЧНОСТИ ПОВЕРХНОСТНЫХ ВОД СУШИ МЕТОДОМ БИОТЕСТИРОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ХЛОРОФИЛЛА а
Дата введения - 2014-12-01 Срок действия - до 2019-12-02
1 Область применения
Настоящие рекомендации устанавливают методику биотестирования с использованием хлорофилла а и требования к порядку проведения и оценке токсичности поверхностных вод суши в составе системы мониторинга поверхностных вод суши (далее - методика).
Методика предназначена для лабораторий, осуществляющих наблюдения за эколого-токсикологическим состоянием поверхностных вод суши в рамках государственной службы наблюдений за состоянием окружающей природной среды.
Рекомендации предназначены для использования подразделениями министерств, осуществляющих природоохранную деятельность, а также для проведения научно-исследовательских экотоксикологических и экологических работ.
2 Нормативные ссылки
В настоящих рекомендациях использованы ссылки на следующие нормативные документы:
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
ГОСТ 17.1.04.02-90 Вода. Методика спектрофотометрического определения хлорофилла а
ISO 10260:1992 Качество воды. Измерение биохимических параметров. Спектрофотометрический метод определения концентрации хлорофилла а
Р 52.24.566-94 Методы токсикологической оценки загрязнения пресноводных экосистем
РД 52.24.662-2004 Оценка токсического загрязнения природных вод и донных отложений пресноводных экосистем методами биотестирования с использованием коловраток
РД 52.24.784-2013 Массовая концентрация хлорофилла а. Методика измерений спектрофотометрическим методом с экстракцией этанолом
Примечание — Ссылки на остальные нормативные документы приведены в разделе 4.
1
3 Термины и определения
В настоящих рекомендациях использованы следующие термины и определения:_
3.1 биотестирование (биологическое тестирование воды):
Оценка качества воды по ответным реакциям водных организмов, являющихся тест-объектами
[ГОСТ 27065-86, статья 39].
3.2 биотест: Совокупность приемов получения информации о
токсичности воды (донных отложений) для гидробионтов на основе ре-гистрации реакций тест-объекта (Р 52.24.566)._
3.3 водный объект: Сосредоточение природных вод на поверхности суши, либо в горных породах, имеющее характерные формы распространения и черты режима
[ГОСТ 19179-73]_
3.4 критерий токсичности: Значение показателя токсичности, на основании которого судят о наличии токсического действия.
3.5 острое токсическое действие (острая токсичность): Воздействие, вызывающее быструю ответную реакцию тест-объекта.
Примечание - острую токсичность чаще всего определяют по тест-реакции «гибель» или «выживаемость» в условиях кратковременного биотестирования При использовании коловраток и других организмов микрозоопланктона длительность воздействия составляет 6- 24 ч (Р 52.24.662)._
3.6 поверхностные воды; ПВС: Воды, находящиеся на поверхности суши в виде различных водных объектов
[ ГОСТ 19179-73,статья 7 1. _
3.7 проба воды: Количество воды, предназначенное для исследования (Р 52.24.566).
3.8 результат биотестирования: Конечный вывод о токсичности водной среды, сделанный в ходе биотестирования (Р 52.24.662).
3.9 тест-объект: Организм, который используют при биотестировании (водоросли, дафнии и т.д.) (Р 52.24.566).
3.10 тест-показатель: Показатель жизнедеятельности (поведенческие реакции, размножение, выживаемость и т.д.) тест-объекта, используемый для определения токсичности ПВС.
3.11 токсичность воды: Свойство воды вызывать развитие патологического процесса или гибель тест-объектов (Р 52.24.566).
3.12 условно чистый участок водного объекта: Обычно это фоновый створ ( Р 52.24.566).
3.13 фоновый створ: Створ, расположенный на расстоянии не менее 1 км выше источника загрязнения [1].
3.14 хроническое токсическое действие (хроническая токсичность): Воздействие, вызывающее ответную реакцию тест-объекта, проявляющуюся в течение относительно длительного периода времени.
P 52.24.808-2014
Примечание - хроническую токсичность измеряют по тест-реакциям «выживаемость», «плодовитость», «изменение роста» и другим реакциям при длительном биотестировании (Р 52.24.566).
3.15 экспозиция: Период, в течение которого организм находится под воздействием исследуемого фактора, в частности химического вещества.
Примечание - в зависимости от экспозиции различают острую или хроническую токсичность.
3.16 эталонный токсикант: Токсическое вещество, используемое для калибровки биотеста или тест-объекта (Р 52.24.566).
4 Требования к средствам измерений, вспомогательным устройствам, материалам, реактивам4.1 Средства измерений, вспомогательные устройства
4.1.1 Микроскоп любого типа по ГОСТ 8074-82.
4.1.2 Устройство фильтрующее с воронками типа Зейтца под фильтры диаметром 35 мм.
4.1.3 Камера Горяева по ТУ 64-1-816-77.
4.1.4 Пипетки градуированные по ГОСТ 29230-91.
4.1.5 Колба мерная исполнения 2, по ГОСТ 1770-74 вместимостью 250 см1 - 6 шт.
4.1.6 Газ мельничный № 70- № 74.
4.1.7 Насос вакуумный ручной.
4.1.8 Стаканы вместимостью 600 см1 по ГОСТ 25336-82.
4.2 Реактивы и материалы
4.2.1 Калий двухромово-кислый по ГОСТ 4220-75.
4.2.2 Питательная среда для микроводорослей.
4.2.3 Вода дистиллированная по ГОСТ 6709-72.
4.2.4 Фильтры мембранные «Владипор МФАС-ОС-2», 0,35 мм по ТУ 6-55-221-1-29-89 или другого типа, равноценного по характеристикам.
4.2.5 Культура одноклеточных пресноводных зеленых микроводорослей родов Scenedesmus или Chlorella или сине-зеленых Syne-chocystis и морских микроводорослей родов Dunaliella, Phaeodactilum.
Примечание — Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных с квалификацией не ниже указанной в 4.2.
P 52.24.808-2014
5 Общие положения
5.1 Методику биотестирования по концентрации хлорофилла а применяют при использовании в биотестировании автотрофных тест-объектов, в частности:
- для оценки токсичности поверхностных вод суши используют тест-объекты из числа пресноводных зеленых Scenedesmus obliquus (Тигр.) Kutz, Chlorella vulgaris Beijer и сине-зеленых Synechocystis sp. микроводорослей;
- для оценки токсичности водоемов различной солености и зон смешения речных и морских вод используют тест-объекты из числа солоновато-водных микроводорослей Dunaliella salirta Teod. и Phaeodactilum tricornutum;
- для оценки как острой, так и хронической токсичности.
5.2 Тест-показатель «концентрация хлорофилла а» используют в комплексе с тест-показателем «коэффициент прироста микроводорослей» в зависимости от экспозиции.
5.3 Длительность биотестирования (продолжительность экспозиции) зависит от цели исследования:
- острую токсичность определяют за 24 ч.
- хроническую токсичность - за 96 ч.
5.4 Биотестирование ПВС проводят в режимных наблюдениях и для решения оперативных задач с целью проверки соответствия качества вод отдельных проб установленным нормам.
В режимных наблюдениях на основе систематических данных биотестирования оценивают токсическое состояние водных объектов или их участков.
В ходе решения оперативных задач оценивают токсичность отдельных проб воды с целью выяснения чрезвычайных экологических ситуаций.
5.5 В принятом на сегодняшний день перечне нормирования показателей качества вод указано: вода контрольного створа (фоновый створ) не должна оказывать хронической токсичности и тем более острой на тест-объекты, используемые для биотестирования.
5.6 В ходе биотестирования ПВС устанавливают отсутствие или наличие токсичности (острой, хронической) испытываемой пробы для тест-объектов, без идентификации загрязняющих веществ и их количественных характеристик.
5.7 Контролем служит вода из контрольного (фонового) условно чистого участка водного объекта или дехлорированная водопроводная вода региона исследования, используемая для содержания маточных культур тест-объектов.
5.8 Биотестирование проводят в трехкратной повторности.
4
P 52.24.808-2014
6 Требования безопасности, охраны окружающей среды
При выполнении работ следует соблюдать общие требования к технике безопасности работ на водных объектах и в химических лабораториях.
Особых требований по экологической безопасности нет.
7 Требования к квалификации операторов
К выполнению экспериментальных работ методами биотестирования допускают лиц, имеющих биологическое, экологическое образование и знакомых с основами водной токсикологии и методами полевых и лабораторных гидробиологических исследований.
8 Отбор, хранение и подготовка проб поверхностных вод суши для биотестирования
8.1 Пробы ПВС отбирают с учетом требований ГОСТ Р 51592 и Р 52.24.566. Объем пробы должен быть не менее 500 см3.
8.2 Сосуды должны быть из материала, не содержащего токсичных примесей (полиэтиленовые емкости для пищевых продуктов, стеклянные баллоны и бутыли). Сосуды необходимо маркировать.
8.3 Перед заполнением сосудов воду фильтруют через мельничный газ № 70-№ 74 (для удаления природного планктона) и несколько раз ополаскивают сосуд. Заполняют водой полностью.
8.4 Анализ проб воды по определению токсичности проводят не позднее 6 ч после отбора проб. В случае невозможности проведения исследований в срок, указанный в 5.3, пробы охлаждают до 4 °С или замораживают согласно ГОСТ Р 51592 и хранят до 30 сут. Консервирование проб химическими веществами не допускается.
8.5 Перед биотестированием измеряют концентрацию кислорода, значения pH (с целью дифференцирования токсического воздействия каких-либо загрязняющих веществ и измеренных значений pH и кислорода, если эти параметры не обеспечивают нормальной жизнедеятельности гидробионтов).
9 Биотест по концентрации хлорофилла а
9.1 Принцип биотеста
9.1.1 Метод основан на определении изменения концентрации хлорофилла а под влиянием испытываемой воды, отобранной из водоемов, водотоков и зон смешения морских и пресных вод, на лабораторные культуры микроводорослей экологически соответствующих тест-объектов: пресноводных зеленых Scenedesmus obliquus, Chlorella vul-
5
P 52.24.808-2014
garis, сине-зеленых Synechocystis aquatilis или морских зеленых Dunal-iella salina и диатомовых Phaeodactilum tricornutum.
Влияние испытываемой воды оценивают по отклонению значений концентрации хлорофилла а при экспозиции в испытываемой воде по сравнению с контролем.
Показателем содержания хлорофилла а служит концентрация хлорофилла а, мкг/л, в культуре микроводорослей. Показателем интенсивности размножения - коэффициент прироста численности клеток микроводорослей.
Острую и хроническую токсичность пробы ПВО (поскольку пересев на новую воду невозможен) устанавливают в ходе одного биотеста (непрерывное биотестирование) в зависимости от времени проявления токсического эффекта. Острую токсичность устанавливают за время экспозиции 24 ч (за это время появляется 6-8 поколений микроводорослей), хроническую - за 96 ч.
Критерием токсичности является отклонение концентрации хлорофилла а на 50% от контроля. Отклонение в сторону уменьшения, равное - 50% и более, свидетельствует об угнетающем действии испытываемой воды на микроводоросли. Отклонение значений в сторону увеличения, равное +50% и более, косвенно свидетельствует о наличии в испытываемой воде веществ, стимулирующих рост микроводорослей, например, фосфора или органических веществ.
При установлении острой токсичности по 10.3 биотестирование прекращают.
При отсутствии острой токсичности биотестирование продолжают, чтобы установить возможную хроническую токсичность (длительное биотестирование, 96 ч).
9.1.2 Характеристики используемых видов микроводорослей, условия их поддержания, состав питательных сред приведены в приложениях А, Б, В, значение фитопланктона в водной экосистеме и характеристика пигментов - в приложении Г, характеристика хлорофилла а и методы его определения - в приложении Д.
9.2 Подготовка культуры микроводорослей к биотестированию
Для эксперимента используют культуру микроводорослей, находящуюся в стадии экспоненциального роста. Перед биотестированием ее концентрируют, фильтруя через мембранный фильтр. С фильтра водоросли смывают профильтрованной водой в емкость вместимостью 500 см3. Клетки водорослей можно сконцентрировать путем отстаивания культуры водорослей. Численность клеток в суспензии, которую используют в эксперименте, должна составлять от 5 до 10 млн. кл./ см3
Перед экспериментом проверяют чувствительность культуры микроводорослей воздействием эталонного токсиканта. В качестве эталонного токсиканта используют калий двухромовокислый. Критерием при-
6
1