Методические рекомендации 1744-77
Методы экспериментального исследования по установлению порогов действия промышленных ядов на генеративную функцию с целью гигиенического нормирования
Купить Методические рекомендации 1744-77 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
I. Исследование гонадотропного действия промышленных ядов
А. Изучение состояния сперматогенеза и функционального состояния сперматозоидов
1. Макроскопическое исследование семенников
2. Микроскопическое исследование семенников. Морфологические показатели состояния сперматогенного эпителия
3. Определение количества нуклеиновых кислот в семенниках (биохимические и гистохимические методы)
4. Функциональное состояние сперматозоидов (физиологические, морфологические и биохимические методы)
Б. Методы оценки функционального состояния яичников у экспериментальных животных
1. Исследование эстрального цикла
2. Относительный вес яичников и количественная оценка микроструктуры яичника
3. Определение активности гонадотропной функции гипофиза
В. Исследование оплодотворяющей способности или способности к зачатию
II. Исследование эмбриотропного действия ядов
III. Исследование мутагенного действия
А. Прямая генетическая оценка на потомстве млекопитающих
Б. Цитогенетические исследования
Заключение
Словарь терминов
Список литературы
Приложение 1. Схема изучения эмбриотропного действия
Приложение 2. Схема изучения мутагенного действия промышленных ядов
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 10.07.1977 | Утвержден | Заместитель Главного государственного санитарного врача СССР | 1744-77 |
|---|---|---|---|
| Разработан | НИИ гигиены труда и профзаболеваний АМН СССР |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7
стр. 8
стр. 9
стр. 10

стр. 11
стр. 12

стр. 13

стр. 14
стр. 15
стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28
стр. 29

стр. 30
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР ГЛАВНОЕ САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОЕ УПРАВЛЕНИЕ
«УТВЕРЖДАЮ» Заместитель Главного Государственного санитарного врача СССР
А. И. Зайченко
10 июля 1977 г.
№ 1744-77
МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ ПО УСТАНОВЛЕНИЮ ПОРОГОВ ДЕЙСТВИЯ ПРОМЫШЛЕННЫХ ЯДОВ НА ГЕНЕРАТИВНУЮ ФУНКЦИЮ С ЦЕЛЬЮ ГИГИЕНИЧЕСКОГО НОРМИРОВАНИЯ
Методические рекомендации
Москва
1978 г.
Составители: И. В. Саноцкий — докт. мед. наук, профессор
В. Н- Фоменко — канд. мед. наук Л. С. Сальникова — канд. биол. наук Е. М. Чиркова — канд. мед. наук Г. А. Пашкова — канд. мед. наук Э. Е Стрекалова — канд. биол. наук Л- Д. Катосова — канд. биол. наук
2
ции Г. И. Егоровой, (1966). Используют суспензию сперматозоидов, полученную при продольном разрезании придатка семенника крысы и дозированном (2 минуты) (перемешива-нии его в физиологическом растворе (2 мл) на часовом стекле отрезком трубки (но не стеклянная палочка). Температура раствора 22—23° Для наблюдения за длительностью движения сперматозоидов кашля суспензии наносится на предметное стекло с лунками, которое помещается во влажную камеру (чашка Петри, закрытая обыкновенным стеклом). Последнюю ставят на обогреваемый столик (либо электронагревание, либо 'присоединение медной трубки на медной площадке с отверстием к водяному ультратермостату) при t—24° и отмечают время полного (прекращения движения сперматозоидов. Возможно применение микроскопа с термостатом МБИ-12;
б) для определения относительного количества живых сперматозоидов на предметное стекло наносят 1 каплю суспензии и 1 каплю 0,5%' водного раствора эозина, после смешивания в течение 1—2 секунд приготовляют мазок, который немедленно микроскопируют; подсчет проводят на 200 сперматозоидов. Окрашиваются только мертвые сперматозоиды;
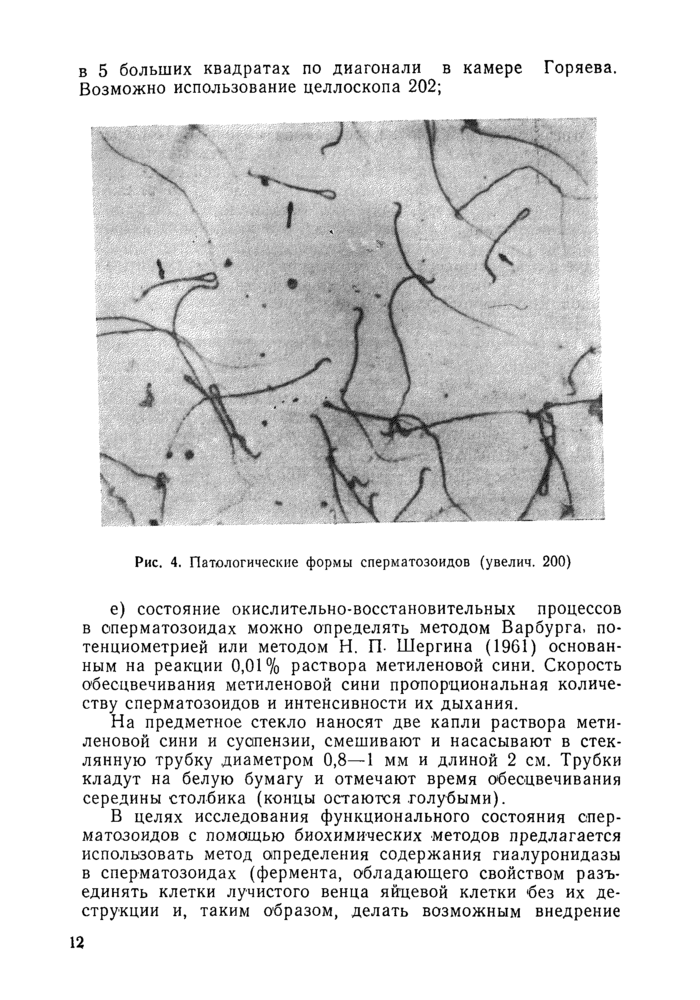
в) для подсчета относительного количества (патологических форм (деформация, удвоение, набухание или сморщивание как головки, так и шейного и хвостового отрезков сперматозоидов и др.) (приготовляют мазки: одну каплю суспензии наносят на предметное стекло, подсушивают на воздухе и окрашивают красителем — щелочным раствором метилового фиолетового (рис. 4). Просчитывают 200 сперматозоидов;
г) для определения жизнеспособности сперматозоидов исследуют их резистентность в отношении химических растворов, соответствующих физиологическим условиям.
При изучении кислотной резистентности к взвеси сперматозоидов постепенно добавляют 0,1N раствор соляной кислоты, одновременно определяя pH среды и подвижность one матозоидов. Величина pH в момент прекращения движения сперматозоидов свидетельствует об их максимальной кислотной резистентности. Регистрацию pH на pH-метре ЛПУ-01 или приборе Astrup (Micro.
Осмотическую резистентность исследуют при добавлении к суспензии сперматозоидов 2,8—5,6% растворов хлористого натрия. Фиксируют минимальную концентрацию хлористого натрия, вызывающую прекращение движение сперматозоидов;
д) концентрацию сперматозоидов определяют путем набора суспензии в меланжер для лейкоцитов и подсчета
И
в 5 больших квадратах по диагонали в камере Горяева. Возможно использование целлоскопа 202;
|
Рис. 4. Патологические формы сперматозоидов (увелич. 200) |
е) состояние окислительно-восстановительных процессов в сперматозоидах можно определять методом Варбурга, по-тенциометрией или методом Н. П- Шергина (1961) основанным на реакции 0,01% раствора метиленовой сини. Скорость обесцвечивания метиленовой сини пропорциональная количеству сперматозоидов и интенсивности их дыхания.
На предметное стекло наносят две капли раствора метиленовой сини и суспензии, смешивают и насасывают в стеклянную трубку диаметром 0,8—1 мм и длиной 2 см. Трубки кладут на белую бумагу и отмечают время обесцвечивания середины столбика (концы остаются .голубыми).
В целях исследования функционального состояния сперматозоидов с помощью биохимических методов предлагается использовать метод определения содержания гиалуронидазы в сперматозоидах (фермента, обладающего свойством разъединять клетки лучистого венца яйцевой клетки без их деструкции и, таким образом, делать возможным внедрение
12
сперматозоидов). Обычно используют вискозиметрический или турбометричеокий методы.
Следует указать, что решающим для проникновения сперматозоидов в яйцевую клетку является число попавших к яйцевой клетке сперматозоидов и образовавшаяся вокруг нее концентрация гиалуронидазы.
Б. МЕТОДЫ ОЦЕНКИ ФУНКЦИОНАЛЬНОГО
состояния яичников
У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ
Исследование функционального состояния яичников при действии химических соединений проводится в эксперименте на самках белых крыс весом 180—200 г- Преимущественное использование белых крыс обусловлено тем, что у крыс имеется кратковременный, хорошо изученный 'половой цикл, крысы относятся к опонтанно-овулирующим животным и обеспечивают возможность 'быстро получить массовый материал.
Для оценки возможности поражения функции и микроструктуры яичников лабораторных животных проводят испытание химических соединений на уровнях порога хронического действия (по показателям общего токсического эффекта) с установлением порога специфического действия.
В эксперимент отбираются только те животные, которые имеют нормальный эстральный цикл. Установление характера астрального цикла проводится до опыта примерно в течение 2-х недель и является обязательным-
При изучении функционального состояния яичников применился следующие методы:
1. Исследование астрального цикла.
2. Относительный вес яичников и количественная оценка микроструктуры яичника.
3. Определение активности гонадотропной функции гипофиза.
1. Исследование астрального цикла
Эстральный цикл у животных изучается путем анализа вагинальных мазков, которые осторожно берутся с помощью смоченного в физиологическом растворе ватного тампона, приготовленного на тонкой стеклянной палочке или спичке (можно использовать для этих целей глазные пипетки) и наносятся в капле физиологического раствора на предметное стекло. Мазки можно расшифровывать в живой капле без предварительной окраски. Удобнее /проводить расшифровку кольпоцитограмм животных после окраски. Мазки могут быть
окрашены любым способом: гематоксилин-эозином или 1 % водноопиртовым раствором метиленового синего.
Определение стадий астрального цикла проводится по соотношению элементов в вагинальном мазке:
|
Таблица 2 | ||||||||||||||||
| ||||||||||||||||
Учитывая продолжительность астрального цикла, длительность отдельных фаз цикла, а также ритмичность чередования фаз цикла-
Продолжительность астрального цикла у белых крыс в норме колеблется от 4 до 6 дней; фазы эструс — до 1 дня; проэструс — до 12 часов; диэструс— до 2 дней; метаэструс — 6 часов.
Вагинальные мазки исследуются ежедневно в одни и те же часы с учетом правила «одного часа», при хроническом воздействии яда — в течение 2 циклов каждого месяца и .подострой интоксикации — по ‘2 цикла с 10-дневным перерывом. Необходимо начинать исследование с первого дня воздействия вещества с целью уловить начальные изменения в течение астрального цикла, которые могут в дальнейшем проявиться только к концу хронического опыта или даже в период восстановления.
Длительность взятия мазка обусловлена тем, что этот срок достаточен для характеристики астрального цикла белых крыс и, кроме того, исключает возможность развития вагинитов.
2. Относительный вес яичников и количественная оценка микроструктуры яичника
По окончании опыта животные забиваются путем дека-питации или перерыва спинного мозга в шейном отделе, извлекаются яичники, которые тщательно выделяются из окружающей ткани, взвешиваются на торзионных или аналитических весах. После чего определяется отношение веса обоих яичников к весу тела.
14
При этом все животные забиваются в одной стадии, рекомендуется проводить забой в стадии эструс или проэстр\с Последнее необходимо ввиду дальнейшего подсчета структурно-функциональных элементов в яичнике и оценки активности гонадотропной функции гипофиза.
Следует отметить, что правый и левый яичники по количественному и качественному составу структурных компонентов мало отличаются друг от друга, ввиду чего подсчет структурных элементов производится в одном яичнике.
Яичник фиксируется в жидкости Карнуа ib течение 1,5 часов в холодильнике, далее проводятся через серию спиртов и смеси спирта с хлороформом (по общепринятой методике), после чего заливается в парафин. Приготавливаются серийные срезы яичников по типу топографических (через весь орган), толщиной в 6 микрон.
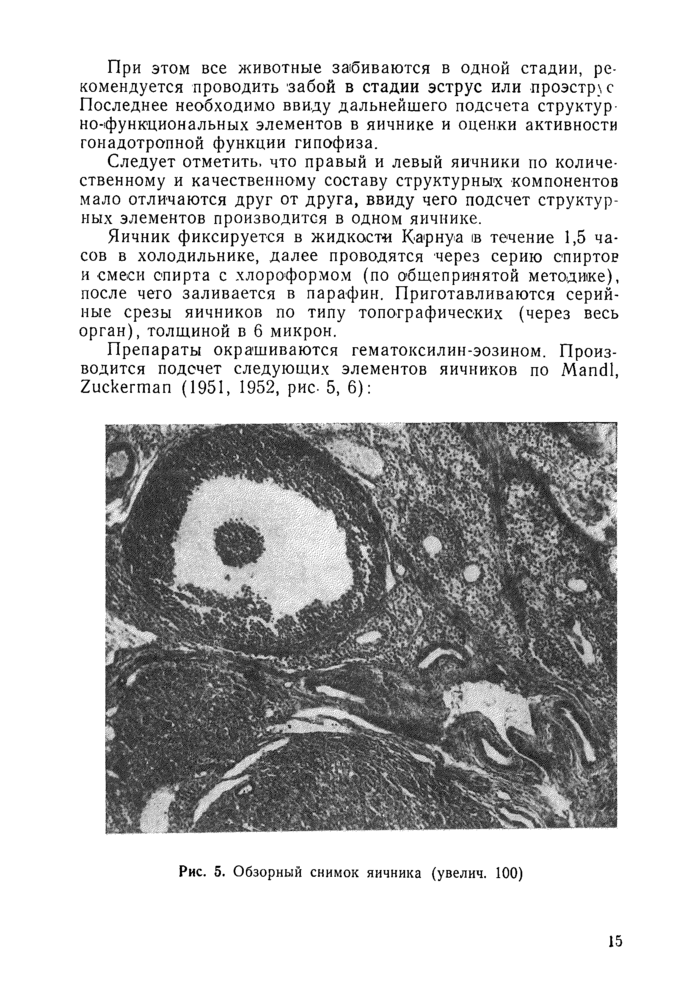
Препараты окрашиваются гематоксилин-эозином. Производится подсчет следующих элементов яичников по Mandl, Zuckerman (1951, 1952, рис- 5, 6):
|
Рис. 5. Обзорный снимок яичника (увелич. 100) |
15
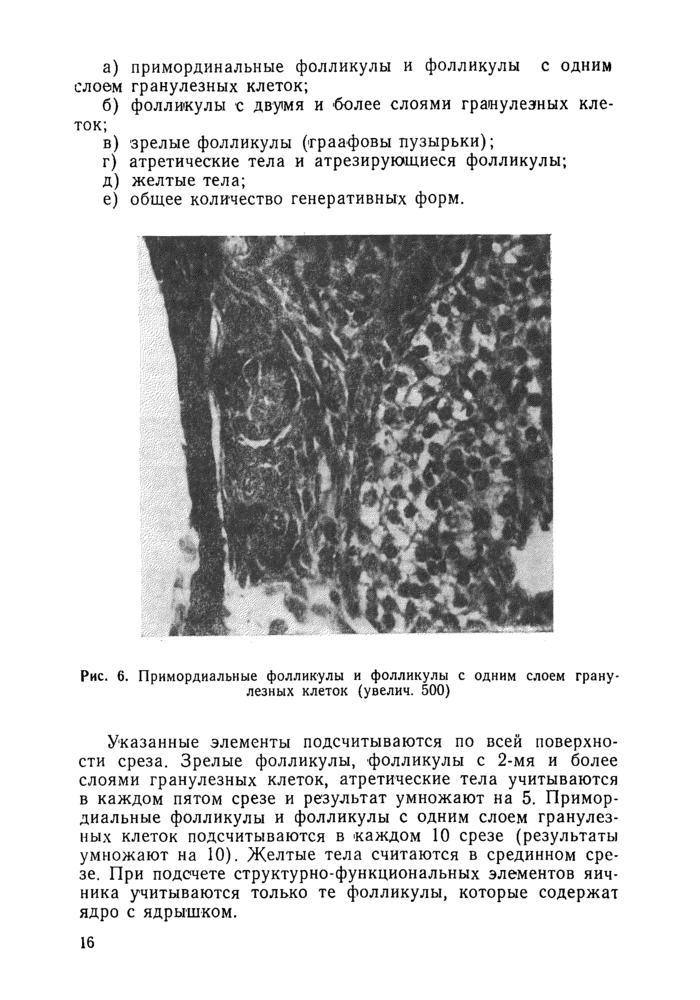
а) примординальные фолликулы и фолликулы с одним слоем гранулезных клеток;
б) фолликулы с двумя и более слоями гранулезных клеток;
в) зрелые фолликулы (траафовы пузырьки);
г) атретические тела и атрезирующиеся фолликулы;
д) желтые тела;
е) общее количество генеративных форм.
|
Рис. 6. Примордиальные фолликулы и фолликулы с одним слоем гранулезных клеток (увелич. 500) |
Указанные элементы подсчитываются по всей поверхности среза. Зрелые фолликулы, фолликулы с 2-мя и более слоями гранулезных клеток, атретические тела учитываются в каждом пятом срезе и результат умножают на 5. Примордиальные фолликулы и фолликулы с одним слоем гранулезных клеток подсчитываются в каждом 10 срезе (результаты умножают на 10). Желтые тела считаются в срединном срезе. При подсчете структурно-функциональных элементов яичника учитываются только те фолликулы, которые содержат ядро с ядрышком.
16
Весь полученный материал подвергается статистической обработке по классическому методу с 'применением критерия Стьюдена-Фишера для сравенения средних величин.
3. Определение активности гонадотропной функции гипофиза
Все процессы развития фолликулов в яичнике, а также характер астрального цикла находятся под регулирующим влиянием гипоталамо-гипофизарных областей. Исходя из ги-поталамо-типофизарной регуляции полового цикла, определение активности гонадотропной функции гипофиза составляет необходимый элемент при оценке функционалнього состояния яичников. Определение активности гонадотропной функции гипофиза проводится по тесту на самках инфантильных мышей -весом 3,5—4,0 г.
Выделенные гипофизы после взвешивания растираются в фарфоровой ступке (раздельно гипофизы от крыс каждой группы) и разводятся в физиологическом стерильном растворе, количество которого в мл соответствует количеству гипофизов. При этом количество инфантильных мышей-ре-ципиентов должно быть на 1 меньше, т. е. если гипофизов получено от 10 крыс, то эмульсию гипофизарную вводят только 9 мышам — реципиентам- Введение гипофизарной эмульсии осуществляют 2 раза в день, в течение 3-х дней, под кожу спинки. На -5-ые сутки мыши-реципиенты забиваются и определяются следующие показатели:
а) открытие половой щели;
б) вес яичников, матки и относительный вес яичников и матки;
в) наличие блютпунктов в яичниках.
Вес яичников и матки определяется на аналитических весах, после тщательного выделения названных органов из окружающих тканей с помощью микроскопа МБС-2.
Увеличение относительного веса матки и яичников самок инфантильных мышей-реципиентов, а также наличие блют-пунктов свидетелсьтвует о раннем половом созревании мышей под влиянием введенной гипофизарной эмульсии крыс.
■Сравнение проводится с двойным контролем: с мышами-реципиентами, получившими эмульсию гипофизов от контрольных крыс и с мышами, не получившими гипофизарной эмульсии.
В. ИССЛЕДОВАНИЕ ОПЛОДОТВОРЯЮЩЕЙ
СПОСОБНОСТИ ИЛИ СПОСОБНОСТИ К ЗАЧАТИЮ
Интегральной оценкой воздействия промышленного яда на половую функцию является проверка оплодотворяющей
17
способности лабораторных животных (самцов) или способности к зачатию (самок).
Указанные исследования предпочтительно проводить после хронической интоксикации, так как различные генерации семяродного эпителия неодинаково чувствительны к воздействию химического агента, в связи с чем, только повторное воздействие изучаемого соединения на все стадии сперматогенеза позволит выявить патологию.
Период сперматогенеза составляет 35 дней у мышей, 48 дней у крыс, кроме того следует учитывать время необходимое для прохождения сперматозоидов через придаток семенника, которое составляет от одной до трех недель. (ВОЗ, 1967).
Самцы (или самки) тотчас после окончания хронической затравки спариваются с интактными самками, имеющими нормальный астральный цикл (или соответственно со здоровыми самцами) в соотношении 1 : 2. Такая техника подсадки обеспечивает наибольшее количество спариваний. Желательно подсаживать самок в стадии течки. Во время спаривания и всего срока беременности самки не подвергаются воздействию изучаемого соединения.
Началом беременности считают день определения во влагалищном мазке сперматозоидов или наличие влагалищной пробки.
Количество забеременевших самок в группе является основным показателем оплодотворяющей способности самцов или способности к зачатию у самок. Статистическая достоверность различий между результатами опыта и контроля определяется методом х2-
На 17—21 день беременности часть самок забивают. Анализ эмбрионального материала можно проводить по показателям, приведенным для изучения эмбриотропного действия ядов (см. далее). Другую половину беременных самок оставляют до родов. Исследование полученного потомства ведут до 2-х месячного возраста с отъемом от матери на 28 день.
Эффект может быть обусловлен как нарушением систем и функций непосредственно в организме потомства, так и дефектами вскармливания или нарушением материнского инстинкта в случае воздействия ядов на самок. Для дифференцирования причин рекомендуется пересадка потомства от подопытных самок к контрольным. Эта пересадка должна осуществляться с осторожностью. Сосунки должны быть погружены на время в подстилку той клетки, куда они подсаживаются, чтобы отбить запах самки, иначе они могут быть съедены приемной матерью.
18
II. ИССЛЕДОВАНИЕ ЭМБРИОТРОПНОГО ДЕЙСТВИЯ ЯДОВ
При изучении эмбриотропного действия химических веществ большое значение имеет продолжительность воздействия; сроки беременности, на которые приходится это действие; уровни воздействия; выбор экспериментальных животных.
Для промышленной токсикологии, учитывая реальные условия воздействия яда на производстве, практический интерес представляет чувствительность эмбриона:
а) в течение всей беременности;
б) в первый триместр беременности;
в) в отдельные дни беременности (в основном, в период органогенеза).
Следует напомнить, что сроки узловых этапов эмбриогенеза весьма различны для человека и животных. В таблице 3 приведено сравнение сроков узловых .периодов эмбриогенеза у человека и у лабораторных животных (крыса, мышь, золотистый хомячок).
Таблица 3
Сроки формирования некоторых органов и систем для человека и для наиболее широко используемых в эксперименте животных (крыса, мышь, золотистый хомячок)
(Y. Robson, F. Sullivan, 1968, Th. Shepard, 1973)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1 1 |
2 1 |
3 1 |
4 1 |
5 |
|
Формирование зрительных нервов |
49 |
17 |
_ |
_ |
|
Формирование век |
56 |
15 |
— |
— |
|
Срастание век |
70 |
18 |
— |
— |
|
Формирование слуховых плакод |
24 |
11 |
— |
— |
|
Отсоединение слуховых пузырьков |
28 |
13 |
— |
— |
|
Формирование лабиринта |
49 |
15 |
— |
— |
|
Сердечно-сосудистая система | ||||
|
Первые сердечные толчки |
22 |
10 |
— |
8 |
|
Срастание сердечной трубки |
23 |
11 |
— | |
|
Формирование интравентрикулярной | ||||
|
перегородки |
49 |
17 |
— |
— |
|
Дыхательная система | ||||
|
1-я бронхиальная дуга |
20 |
10 |
8,3 |
7,7 |
|
3-я бронхиальная дуга |
26 |
11,5 |
9 |
8,25 |
|
Зачатки легкого |
28 |
12 |
9,6 |
9 |
Скелет
|
Начало формирования скелета из мезенхимы в основании черепа, по- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
20
МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ ПО УСТАНОВЛЕНИЮ ПОРОГОВ ДЕЙСТВИЯ ПРОМЫШЛЕННЫХ ЯДОВ НА ГЕНЕРАТИВНУЮ ФУНКЦИЮ
С ЦЕЛЬЮ ГИГИЕНИЧЕСКОГО НОРМИРОВАНИЯ
Возможность развития отдаленных последствий при контакте с разнообразными химическими соединениями все больше привлекает внимание медицинской общественности. Особое место при этом занимают разнообразные нарушения репродуктивной функции. При работе с 'многочисленными химическими веществами отмечены нарушения овариально-менструальной функции, ослабление половой потенции мужчин, бесплодие мужчин и женщин, нарушение беременности и, наконец, поражения плода и серьезные дефекты рожденного потомства от видимых уродов до обнаруживаемого позже снижения умственного развития. Указанные изменения обычно связаны с вторичными явлениями, возникающими при выраженной интоксикации, однако, в ряде случаев они могут быть также обусловлены специфическим гонадотропным, эм-бриотропным и генетическим действием ядов, которое обнаруживается при воздействии меньших доз и концентраций, чем те, которые вызывают общие признаки отравления.
Анализ данных литературы и опыт работы лаборатории токсикологии Института гигиены труда и профзаболеваний АМН СССР показывает, что наличие специфического гонадотропного действия яда часто сочетается с мутагенными свойствами, последние в свою очередь сочетаются с эмбрио-тропным эффектом. Это обстоятелсьтво помогает установить основные классы соединений, возможно обладающие способностью вызывать отдаленные последствия. В настоящее время такая классификация известна для мутагенов. Указанные классификации условны и не всегда строго придерживаются химической природы соединения, однако, для практических целей они удобны.
Ниже приводится подобная условная классификация (табл. !)•
3
I 2 | 3 | 4 | 5
|
25 |
11—12 |
9,5 |
9 |
|
26 |
12 |
11 |
— |
|
35 |
12 |
— |
— |
|
40 |
13,5 |
— |
11 |
|
43 |
17 |
— |
— |
Мезонефрос
Мезонефрический проток Дифференциация метанефроса Появление мюллерова протока Появение уроректальной перегородки
Предлагается схема экспериментального исследования специфического эмбриотропного действия ядов (приложение 1).
Фармакологи изучают тератогенную активность лекарств с применением больших доз, превосходящих часто терапевтические.
При гигиеническом нормировании химических соединений использование больших доз и концентраций нецелесообразно: во-первых, большие дозы и концентрации химических продуктов могут вызвать общую интоксикацию и возникшие нарушения в развитии плода не дадут возможности судить о специфике действия химического вещества; во-вторых, проведение эксперимента с использованием больших доз и концентраций, а затем постепенное снижение их очень усложняет, удорожает работу и 'приводит к большой потере времени. Поэтому исследования специфического эмбриотропного действия целесообразно начинать при воздействии веществ в пороговых концентрациях (преимущественно на уровне Limch)*
Для практических рекомендаций необходимо определить следующие параметры:
1- Порог общего (интегрального) действия на материнский организм.
2. Порог действия на эмбриогенез.
3. Специфичность эмбриотропного действия.
Меру специфичности определяем по зоне специфического действия:
|
Zsp |
Lim ^im integr spec |
По мнению группы экспертов ВОЗ, при изучении тератогенной активности химических веществ необходимо проводить эксперимент на трех видах млекопитающих: на эмбрионах крыс, мышей и кроликов (ВОЗ, 1968). У крыс спонтанные уродства обычно полностью отсутствуют. Для мышей характерна высокая частота спонтанных пороков развития. Если опыты на крысах выявили тератогенные свойства химического препарата, дополнительные исследования на мы-
21
Основные группы химических мутагенов
Представители
Название группы
1. Эфиры сульфокислот
2. Эфиры серной кислоты
3. Эфиры фосфорной кислоты 4- Эфиры хлорметиловые
5. Галоидные алкиды
6. Хлорэтплсульфиды
7. 2-Хлорэтиламины
8. Эпоксиды
9. Этиленимины и этиленпмнды
10. Нитро- и П'итрозосоединения
11. Адельгиды
12. Лактоны
13. Диазосоединення
14. Перекиси
15. Гидроксиламины
16. Антиметаболиты
(в том числе структурные аналоги нуклеиновых кислот)
17. Соли некоторых металлов переменной валентности
18. Акридиновые красители
эфиры ароматических и алифатических сульфоновых кислот, сульфонаты диэтилсульфат . триэтплфосфат метоксидиметнлхлорид йодистый метил пзолропплбромид ипрпты
2-хлор-н-пропиламин Ди-2-хлорэтиламнн окись этилена диэпоксибутан триэтиленимин этиленимин морфолин азотистая кислота нитрозоампны нптрозоамиды формальдегид ^-пропнолактон диазоэтан третбутнлперацетат гпдроксиламин азагуаиин азасернн уретан марганца алюминия
профлавин, акридиновый оранжевый
Наиболее достоверные данные о реальной опасности химических факторов в плане развития отдаленных последствий могли бы быть получены при наблюдении над генеративной функцией и развитием потомства лиц, контактирующих с промышленными ядами. Однако, такие исследования на практике затруднительны в связи с многочисленностью факторов, воздействующих на рабочего на производстве и в быту, а результаты оказались бы несвоевременными, учитывая профилактическое направление отечественной гигиены. Поэтому весьма актуальным является вопрос о возможности экспериментального изучения указанного действия.
4
Отсутствие единых 'подходов и рекомендованных методов для проведения экспериментальной работы в указанной области приводит к тому, что подобные наблюдения или вообще не включаются в программу токсикологических исследований или шроводятся при случайно выбранных уровнях воздействия с (Привлечением малопоказательных или неадекватных методов. Так, например, в ‘последнее в'ремя накопился материал, показывающий, что исследования химического мутагенеза на классическом генетическом объекте Drosophila melanogaster практиковавшиеся в ряде токсикологических исследований, являются весьма ориентировочным показателем генетической опасности яда для человека-
В связи с изложенным, на основании обобщения опыта работы лаборатории токсикологии Института гигиены труда и профзаболеваний АМН СССР считаем .возможным рекомендовать основные положения, которые могут быть использованы в токсикологических исследованиях при изучении возможности возникновения отдаленных последствий воздействия профессиональных ядов.
Если общая генетика, тератология, онкология изучают воздействие химического агента обычно в больших дозах и концентрациях, часто на уровне сублетальных, то практической задачей профессиональной токсикологии является определение порогов вредного действия ядов на генетический аппарат половых и соматических клеток, на плод и потомство при низких уровнях воздействия, что позволяет выявить избирательность соответствующих эффектов в условиях производства. Таким образом, рекомендуется проведение соответствующих исследований на уровне Limac (при изучении специфического действия — ниже Limac ) и Lim^ установленных по показателям общего токсического действия. В случае, если но окончании хронического опыта на уровне Limch отмечаются признаки изменения генеративной функции, необходимо поставить еще один токсикологический эксперимент с меньшей (не менее, чем в 10 раз) концентрацией яда в целях выявления минимального или порогового эффекта, а также подпороговой концентрации.
Оценка влияния химических соединений на генеративную функцию проводится в модельных опытах на теплокровных лабораторных животных разных видов. Отсутствие каких-либо сведений о наличии видов животных с такой же как у человека или близкой к ней чувствительностью к химическим агентам, обладающих мутагенным, эмбриотропным и гонадотропным эффектом, затрудняет выбор. Целесообразно использовать для изучения влияния промышленных ядов на
5
репродуктивную функцию прежде всего спонтанно овулирующих животных,—белых крыс, мышей, а также возможно, кошек и кроликов- Для (получения достоверных данных очень важным является соблюдение условий содержания лабораторных животных и (прежде всего достаточное обеспечение ежедневного рациона токоферолом (ом. «^Временные методические указания к постановке экспериментальных исследований для обоснования предельно допустимых концентраций вредных веществ в воздухе .производственных (помещений»), т. е. круглогодовая подкормка проросшим овсом.
Последствия поражения 1половых желез могут проявиться в нарушении оплодотворяющей способности или способности к зачатию, в нарушении внутриутробного развития плода (гибель, остановка развития на разных стадиях эмбриогенеза, врожденные уродства и др.), а также в (последующих поколениях — ие всегда — 1-м, а может (быть 2-м, 3-м или 4-м. Необходимо учитывать и соматические мутации, ведущие к нарушению генетического гомеостаза, а также указывающие на возможную бластомогенную активность химического соединения.
Только количественная оценка опасности химических соединений и установление порогов вредного действия в реальных условиях может явиться надежной основой для .построения системы профилактических мероприятий.
Ниже приводятся методы, позволяющие выявить избирательное гонадотропное, эмбриотропное и цитогенетическое действие промышленных ядов в эксперименте, установив их минимально эффективные количества.
1. Исследование гонадотропного действия промышленных
ядов
Изучение гонадотропного действия новых химических веществ в эксперименте на лабораторных животных необходимо начинать на уровне Limac , определенного по интегральным показателям, и далее снижать дозы или концентрации яда для выявления специфичности этого эффекта и его порогов при остром и хроническом воздействии.
Для оценки гонадотропного эффекта химического агента обычно используют патоморфологические методы. Однако качественные гистологические методы позволяют выявить лишь грубую патологию и недостаточно чувствительны для установления порогов гонадотропного эффекта. В связи с указанным для целей токсикологии целесообразно применять методы, позволяющие количественно определить нарушения, возникающие в гонадах подопытных животных.
А ИЗУЧЕНИЕ СОСТОЯНИЯ СПЕРМАТОГЕНЕЗА И ФУНКЦИОНАЛЬНОГО состояния СПЕРМАТОЗОИДОВ
Исследование гонадотропного действия химических соединений проводят в эксперименте на половозрелых белых крысах— самцах весом 180—200 г. В группу рекомендуется включать не менее 10 животных. С целью определения специфичности действия вещества на гонады определяют порог однократного действия (Limac ) по перечисленным ниже показателям в сравнении с «показателями общетоксического действия. Исследования гонад проводят у животных, забитых декапитацией через 24 часа после однократной 4-х часовой экспозиции. Для оценки возможности поражения гонад при длительном действии малых концентраций промышленных ядов регистрируют их состояние после 4-х месячного воздействия на уровне порога хронического действия (по показателям общетоксического действия).
При изучении гонадотропного действия химических веществ применяют следующие методы:
1. Макроскопическое исследование семенников
а) наружный осмотр с целью выявления патологических отклонений (кровенаполнение, воспалительные изменения, атрофия, и т. д.);
б) вес обоих семенников и отношение веса семенников к весу тела;
в) размеры семенников (длина и объем).
2. Микроскопическое исследование семенников.
Морфологические показатели состояния сперматогенного
эпителия
Семенники фиксируют «в 10% формалине или жидкости Карнуа,, заливают в парафин, режут тонкие срезы (6—7ц), окрашивают гематоксклин-эозином.
Морфологическую оценку состояния семяродного эпителия (рис- 1), стадии развития которого классифицировали по Chermont, Leblond, Messier (1959) проводят по следующим количественным показателям:
а) индекс сперматогенеза подсчитывают по 4-х бальной системе Fogg и Cowing, (1951), фиксируют в канальце наличие сперматогоний, оперматоцидов I или II порядка (быстрая смена фаз), оперматид и сперматозоидов, затем вычисляют
уд
индекс сперматогенеза ^— , где А число стадий в каждом канальце, 100 — число подсчитанных канальцев.
7
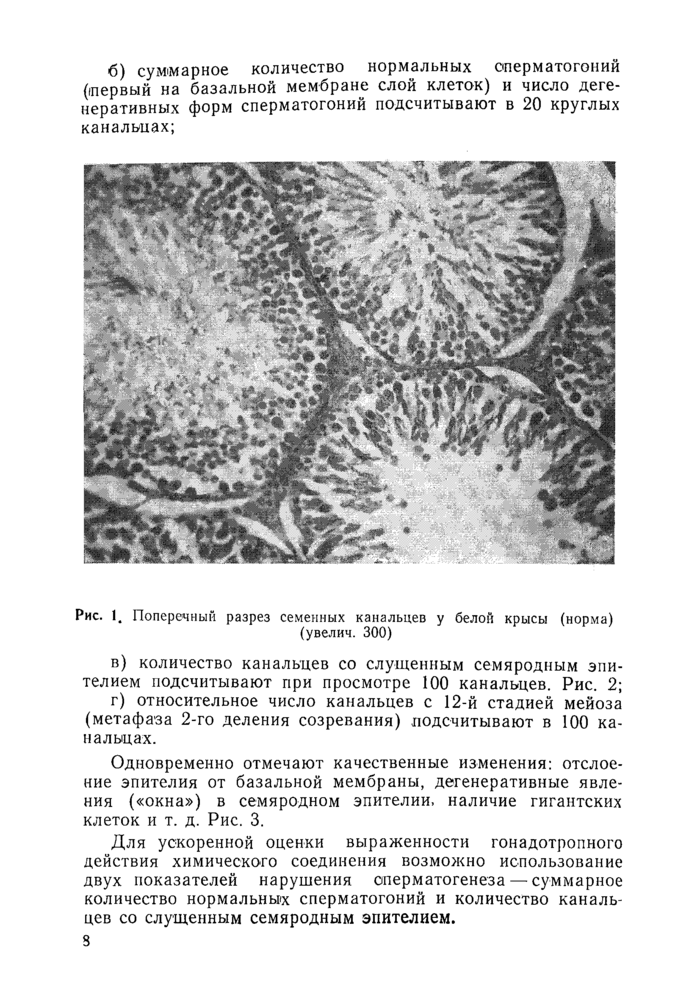
6) суммарное количество нормальных оперматогоний (первый на базальной мембране слой клеток) и число дегенеративных форм сперматогоний подсчитывают в 20 круглых канальцах;
|
' :.Л ;:ф: |
|
Рис. 1. Поперечный разрез семенных канальцев у белой крысы (норма) (увелич. 300) |
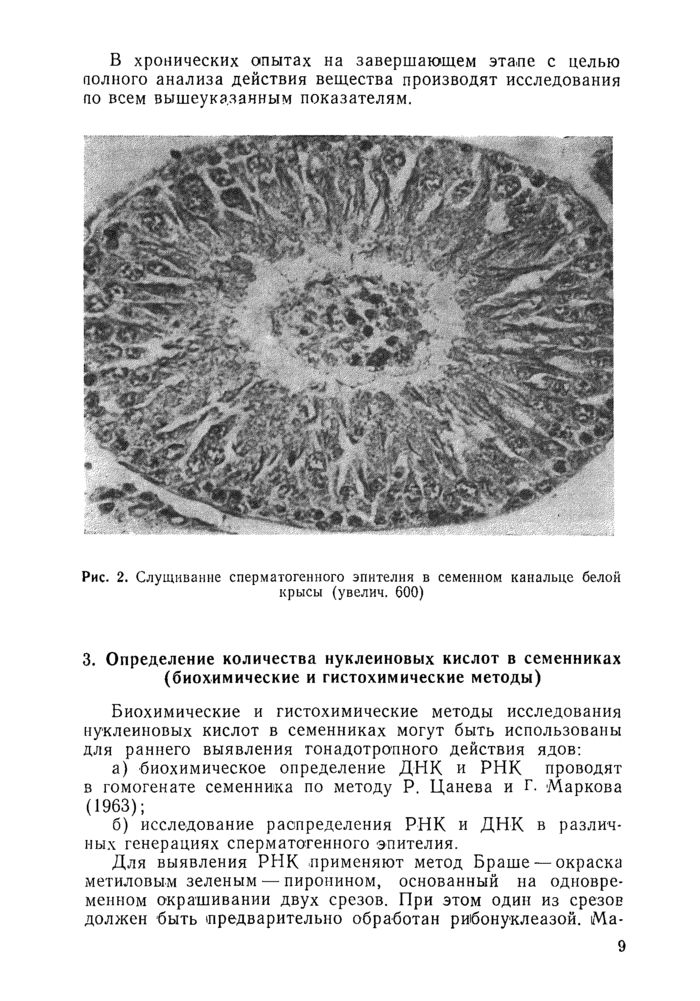
в) количество канальцев со служенным семяродным эпителием подсчитывают при просмотре 100 канальцев. Рис. 2;
г) относительное число канальцев с 12-й стадией мейоза (метафаза 2-го деления созревания) подсчитывают в 100 канальцах.
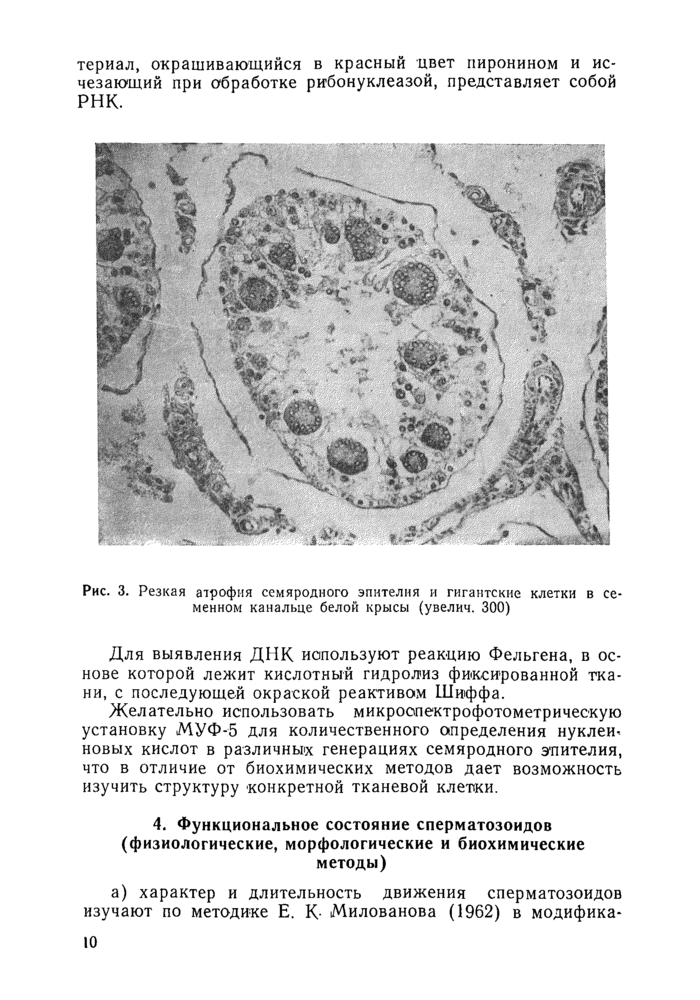
Одновременно отмечают качественные изменения: отслоение эпителия от базальной мембраны, дегенеративные явления («окна») в семяродном эпителии, наличие гигантских клеток и т. д. Рис. 3.
Для ускоренной оценки выраженности гонадотропного действия химического соединения возможно использование двух показателей нарушения сперматогенеза — суммарное количество нормальных сперматогоний и количество канальцев со слущенным семяродным эпителием.
3
В хронических опытах на завершающем этане с целью полного анализа действия вещества производят исследования по всем вышеуказанным показателям.
|
.*■ У .'.у f .. Ч >■ " -a fe. . ; ■; ■■■ -"■■ ^ ж:;:-. & ■ т.. ■;:■*% V.. . .■ > ■ ' >.■ ■ . ■ . .=- ■ ■ .■ ^ ■, - < ■ - .. -Г - ' У У У Г'У - '1У7У '.УШУУМ ■ -■ ; v>-\ - ' ч- ' |
Ч-УУУ&У 'УУ
■ V
■ ч.......V#‘.
■
■:' ■;'■■■.'■ -■■ s£y*i'7;-'. . -.р-
■■■?■'* '■■■;■. ууу *&■■■?■ -
'ГЪ уу У ^ ч; ч:*' У х У ■
г/ f ■■ .!■ ,ч,-......-■■IV - '■■■■•■ ■-■■■■
"■> '..Ъ
ф:
^щ
мидии
У., У
. У ■ у
УУ',.0
<■ ■ •* 4;«
: •« -г.
4^'-■«*
*х*-\ У ' “'"■■■*. . ; * ■ -. ■■•;■ ■> ■■ ч>.* ■ ' h
v**b.*^ ^ i *■
У’; Ш'. У £'У. ■, / У ь.
* ' -. '; .■■* ■■ *.м» ■ ■ -' ;■, '
Рис. 2. Слущиваные сперматогенного эпителия в семенном канальце белой
крысы (увелич. 600)
3. Определение количества нуклеиновых кислот в семенниках (биохимические и гистохимические методы)
Биохимические и гистохимические методы исследования нуклеиновых кислот в семенниках могут быть использованы для раннего выявления гонадотропного действия ядов:
а) биохимическое определение ДНК и РНК проводят в гомогенате семенника по методу Р. Цанева и Г. Маркова (1963);
б) исследование распределения РНК и ДНК в различных генерациях сперматогенного эпителия.
Для выявления РНК применяют метод Браше — окраска метиловым зеленым — пиронином, основанный на одновременном окрашивании двух срезов. При этом один из срезов должен быть предварительно обработан рибонуклеазой. Ма-
9
териал, окрашивающийся в красный цвет пиронином и исчезающий при обработке рибонуклеазой, представляет собой РНК.
|
Рис. 3. Резкая атрофия семяродного эпителия и гигантские клетки в семенном канальце белой крысы (увелич. 300) |
Для выявления ДНК используют реакцию Фельгена, в основе которой лежит кислотный гидролиз фиксированной ткани, с последующей окраской реактивам Шиффа.
Желательно использовать микроопектрофотометрическую установку МУФ-5 для количественного определения нуклеиновых кислот в различных генерациях семяродного эпителия, что в отличие от биохимических методов дает возможность изучить структуру конкретной тканевой клетки.
4. Функциональное состояние сперматозоидов (физиологические, морфологические и биохимические методы)
а) характер и длительность движения сперматозоидов изучают по методике Е. К- Милованова (1962) в модифика-
10