МУК 4.1/4.2.588-96
Методы контроля медицинских иммунобиологических препаратов, вводимых людям
Купить МУК 4.1/4.2.588-96 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания предназначены для работников предприятий, осуществляющих контроль качества вакцин, анатоксинов, сывороток, иммуноглобулинов, аллергенов, зубиотиков и других иммунобиологических препаратов, вводимых людям. Все положения документа распространяются на предприятия, производящие МИБП, независимо от их ведомственной принадлежности и формы собственности.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Общие положения
4 Термины и определения
4.1. Биологические термины и определения
4.2. Химическиетермины и определения
5 Определение электрофоретической чистоты и молекулярных масс генно-инженерныж препаратов
Проведение электрофореза
Окрашивание геля
Высушивание геля
Денсометрия окрашенного геля
Определение молекулярных масс генно-инженерных белков
Оценка результатов электрофореза
6 Контроль содержания примесей клеточных ДНК в биотехнологических препаратах
7 Испытание на стерильность
7.1. Правила отбора образцов препарата для испытания на стерильность
7.2. Определение антимикробного действия МИБП
7.3. Техника проведения контроля стерильности
7.4. Схема контроля стерильности
7.5. Учет результатов контроля стерильности
7.6. Требования, предъявляемые к боксам
7.7. Требования к качеству тиоглеколевой среды
7.8. Определение нейтрализующих свойств
7.9. Учет результатов контроля
Приложение. Пример проведения определения
1 Тиоглеколевая среда
2 Бульон Хоттингера
3 Агар Хоттингера
4 Среда Романова
5 Среда Тароцци
6 Раствор для разведения культуры ( "разводящая" жидкость)
7 Среда для получения спор
8 Испытание на токсичность
9 Испытание на пирогенность
10 Определемяе эндотоксина в тесте с лизатом амебоцитов
11 Испытание на отсутствие посторонних агентов
12 Контроль качества герметизации ампул и флаконов с медицинскими иммунобиологическими препаратами
13 Определение остаточного кислорода в ампулах и флаконах с МИБП, герметизированных после заполнения защитным газом
14 Определение белкового азота с реактивом Несслера
15 Определение общего азота с реактивом Несслера
16 Определение белка с биуретовым реактивом
17 Определение белка по методу Лоури
18 Определение аминного азота формольным титрованием
19 Определение сахаров с антроновым реактивом
20 Определение О-ацетильных групп
21 Определение фосфора
22 Определение нуклеиновых кислот по методу Спирина
23 Определение однородности сывороточных препаратов методом электрофореза на пленках из ацетата целлюлозы
24 Определение антигенного состава сывороточных препаратов методом иммуноэлектрофореза
25 Определение агрегатов и фрагментов в препаратах иммуноглобулина методом гель-фильтрации
26 Определение агрегатов в препаратах иммуноглобулина с применением полиэтиленгликоля
27 Определение молекулярных параметров полисахаридов
28 Определение степени расщепления белковых препаратов по наличию низкомолекулярных фракций, неосаждаемых трихлоруксусной кислотой
29 Определение примеси протеолитических ферментов в иммуноглобулинах
30 Определение содержания бычьего сывороточного альбумина методом ракетного иммуноэлектрофореза
31 Определение фенола
32 Определение формальдегида
33 Определение мертиолята
34 Определение гидроксиламина
35 Определение остаточного спирта
36 Определение остаточного риванола
37 Определение натрия хлорида
38 Определение ионов алюминия
39 Определение сульфат-ионов
40 Определение ионов аммония
41 Определение гликокола
42 Определение показателя дисперсности сорбента и сорбированных препаратов
43 Определение потери в массе при высушивании
44 Определение точности розлива в лиофолизированных преператах
45 Определение прозрачности и цветности
46 Определение рН
47 Определение равномерности розлива сорбированных препаратов
Приложение. Буферные растворы
48 Методика контроля жидких инъекционных МИБП на механические включения
49 Методика контроля на механические включения сухих МИБП для парентерального введения, применяемых в виде раствора
| Дата введения | 31.10.1996 |
|---|---|
| Добавлен в базу | 01.01.2021 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 31.10.1996 | Утвержден | Заместитель Главного Государственного санитарного врача Российской Федерации | |
|---|---|---|---|
| Издан | ИНТЕРСЭН | 2006 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10
стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21
стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
Федеральная служба по надзору в сфере защиты нрав потребителей и благополучия человека
ПРОТИВОЭПИДЕМИЧЕСКИЕМЕРОПРИЯТИЯ
Сборник официальных документов
Том II
Редакторы и составители:
Академик РАМН, профессор Г.Г. Онищенко Академик РАМН, профессор Б.Л. Черкасский
Москва
«ИНТЕРСЭНь
2006
ББК51.9 УДК 614.4 (083)
1183
П83 Протинеэпидемические мероприятия. Том 2 Санитарные правила и методические документы, в 2 томах. /Редакторы и составители: Г.Г. Онищенко, БЛ. Черкасский. -М.: «ИНТЕРСЭН*. 2006.-е. 1184
ISBN 5-89834-093-9 ISBN 5-89834 095-5
Сборник содержит основные действующие на территории Российской Федерации правила и методические документы, регламентирующие деятельность по борьбе и профилактике инфекционных (паразитарных) болезней, предназначен для работников службы Роспотребнадзора, а также представляет интерес для специалистов многих других ведомств и областей знания.
ББК51.9
ISBN 5-89834-093-9
Формат 70x100/16
Набор, верстка Антипина НА Подписано в печать 10.01.06
Тираж 1000
Печ. л. 74
Зак. 2762
Qiih hiihu • ОАО «МожаЯсжиЯ полиграфическая шбшт.
!43200, г. Можайск, уя. Мяр». 93.
О «ИНТЕРСЭН», 2006
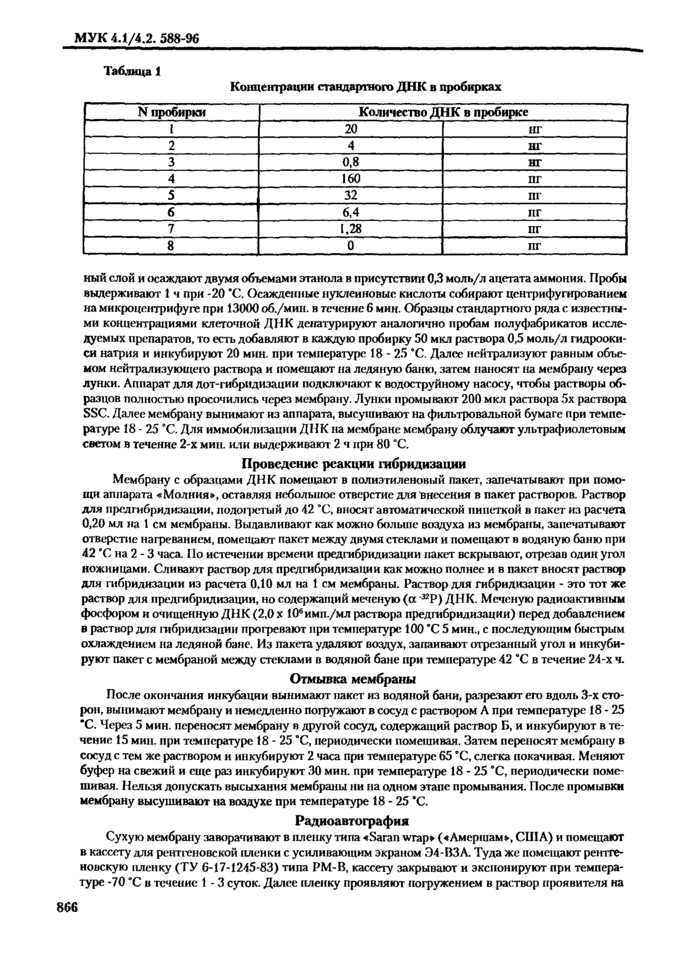
Концентрации стандартного ДНК в пробирках
|
Таблица 1 | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
ный слой и осаждают двумя объемами этанола в присутствии 0,3 моль/л ацетата аммония. Пробы выдерживают 1 ч при -20 *С. Осажденные нуклеиновые кислоты собирают центрифугированием на микроцентрифуге при 13000 об./мин. в течение 6 мин. Образцы стандартного ряда с известными концентрациями клеточной ДНК денатурируют аналогично пробам полуфабрикатов исследуемых препаратов, то есть добавляют в каждую пробирку 50 мкл раствора 0,5 моль/л гидроокиси натрия и инкубируют 20 мин. при температуре 18 - 25 *С. Далее нейтрализуют равным объемом нейтрализующего раствора и помещают на ледяную баню, затем наносят на мембрану через лунки. Аппарат для лот-гибридизации подключают к водоструйному насосу, чтобы растворы образцов полностью просочились через мембрану. Лунки промывают 200 мкл раствора 5х раствора SSC. Далее мембрану вынимают из аппарата, высушивают на фильтровальной бумаге при температуре 18 - 25 *С. Для иммобилизации ДНК на мембране мембрану облучают ультрафиолетовым светом в течение 2-х мин. или выдерживают 2 ч при 80 *С.
Проведение реакции гибридизации
Мембрану с образцами ДНК помещают в полиэтиленовый пакет, запечатывают при помощи аппарата «Молния», оставляя небольшое отверстие для внесения в пакет растворов. Раствор для прелгибридизации, подогретый до 42 ‘С, вносят автоматической пипеткой в пакет из расчета 0,20 мл на 1 см мембраны. Выдавливают как можно больше воздуха из мембраны, запечатывают отверстие нагреванием, помещают пакет между двумя стеклами и помещают в водяную баню при 42 *С на 2 - 3 часа. По истечении времени предгибридизации пакет вскрывают, отрезав один угол ножницами. Сливают раствор для предгибридизации как можно полнее и в пакет вносят раствор для гибридизации из расчета 0,10 мл на 1 см мембраны. Раствор для гибридизации - это тот же раствор для прелгибридизации, но содержащий меченую (а МР) ДНК. Меченую радиоактивным фосфором и очищенную ДНК (2,0 х 10*имп./мл раствора предгибридизации) перед добавлением в раствор для тбридизации прогревают при температуре 100 *С 5 мин., с последующим быстрым охлаждением на ледяной бане. Из пакета удаляют воздух, запаивают отрезанный угол и инкубируют пакет с мембраной между стеклами в водяной бане при температуре 42 *С в течение 24-х ч.
Отмывка мембраны
После окончания инкубации вынимают пакет из водяной бани, разрезают его вдоль 3-х сторон, вынимают мембрану и немедленно погружают в сосуд с раствором А при температуре 18-25 *С. Через 5 мин. переносят мембрану в другой сосуд, содержащий раствор Б, и инкубируют в течение 15 мни. при температуре 18 - 25 *С, периодически помешивая. Затем переносят мембрану в сосуд с тем же раствором и инкубируют 2 часа при температуре 65 *С, слегка покачивая. Меняют буфер на свежий и еще раз инкубируют 30 мин. при температуре 18 - 25 *С, периодически помешивая. Нельзя допускать высыхания мембраны ни на одном этапе промывания. После промывки мембрану высушивают на воздухе при температуре 18 - 25 *С.
Радиоавтография
Сухую мембрану заворачивают в пленку типа «Saran wrap» («Амершам», США) и помещают в кассету для рентгеновской пленки с усиливающим экраном Э4-ВЗА. Туда же помещают рентгеновскую пленку (ТУ 6-17-1245-83) типа РМ-В, кассету закрывают и экспонируют при температуре -70 *С в течение 1 - 3 суток. Далее кленку проявляют погружением в раствор н|х>якителм ка
5-6 мни. (в темноте). Затем пленку промывают холодной водопроводной водой и погружают в раствор фиксатора на 10 мин., после чет промывают холодной водой и высушивают.
Оценка результатов
На местах нанесения ряда известных разведений очищенных клеточных ДНК и на местах нанесения ДНК из образцов исследуемых препаратов (если она в них присутствует) на рентгеновской пленке появляются темные пятна. Количество примеси ДНК в образцах препаратов определяют визуально или при помощи денситометра путем сравнения интенсивности потемнения пятен в месте нанесения исследуемых проб с калибровочным рядом известных количеств клеточных ДНК.
В соответствии с требованиями ВОЗ и национальными руководящими документами количество примесей клеточных ДНК в биотехнологических препаратах должно быть менее 100 нкг на дозу. Для препаратов, предназначенных для многократного введения людям, содержание примеси клеточных ДНК должно быть менее 10 пкг на доту.
Примечания.
I. Приготовление pacmeojxxt
1. Буферный раствор mpuc-UCl концентрации 1 моль/л, pH 8,0.
121.1 г т]тс(т$тксиметил)а.тв{аметана помещают в градуированный химический стакан, прибавляют 700,0 мл деионизованной воды, перемешивают до полного растворения. Доводят pH до 8,0 раствором НО концентрации 1 моль/л. Доводят объем до 1000 мл деионшюванной водой и фильтруют через стеклянный фильтр GF/B. Раствор хранят в течение месяца при 4 - 6 'С.
2. Буферный раствор трис-НО концентрации 1 моль/л, pH 7/2.
121.1 г трис(гидроксиметил)аминометана помещают в градуированный химический стакан, прибавляют 700,0 мл деионизованной воды и перемешивают до полного растворения. Доводят pH до 7/2 раствором НС1 концентрации 1 моль/л. Доводят объем до 1000,0мл деионизованной водой и фильтруют через стеклянный фильтр GF/B. Раствор хранят в течение месяца при 4 - 6 'С.
3. Раствор динатриевой соли ЭДТА (трилон-Б) концентрации ОД моль/л, pH 8,0.
18,6 г ЭДТА динатриевой соли помещают в градуированный химический стакан, прибавляют 70,0мл деионизованной воды, добавляют 45%-ный раствор гидроокиси натрия до полною раство рения. Доводят pH до 8,045% -ным раствором гидроокиси натрия (NaOH). Доводят объем до 100,0 мл деионизованной водой, фильтруют через стекяяютй фильтр GF/B. Раствор хранят в течение месяца при 4 - 6 *С.
4. Буферный раствор ТЕ.
1.0 мл раствора mpuc HCl концентрации 1 моль/л, pH 8,0, вносят в градуированный химический стакан, прибавляют ОД мл буферного раствора трилона-Б концентрации 0,5 моль/л, pH 8,0, и доводят деионшюванной водой до 100,0 мл. Раствор хранят в течение месяца при 4 ~ 6 *С.
5. 10% -ный раствор SDS.
50.0 г додецилсульфата натрия помещают в г/юдуированный химический стакан, прибавляют 300,0мл деионизоваююй воды и перемешивают до полного раство/гения. Доводят объем до 500,0 мл деионизованной водой. Раствор xjxmxm при 18 • 25 'С.
6. Раствор ацетата аммония концентрации 5 моль/л.
38,5 г ацетата аммония помещают в градуированный химический стакан, прибавляют 70,0 мл деионизованной воды и перемешивают до полного растворения. Доводят объем до 100,0 мл деи-оншкмшнмой водой и фильтруют через стеклянный фильтр GF/B. Раствор хргтмт при 4 - 6 *С.
7. Раствор водонасыщенного фенола.
100.0 мл расплавлеююгп фенола наливают в емкость и прибавляют 100,0 мл буферного раствора mpuc-HCl концентрации 1 моль/л, pH 8,0. Содержимое емкости перемешивают стеклянной палочкой. Раствор хранят при 4 - 6'С в течение 1 - 2-х мес.
8. Раствор РНК-азы 1.
0,01 г РНК-азы 1 помещают в пробирку для микропроб и растворяют в 1,0 мл деионизованной воды. Раствор хранят при -20 'С.
9. Раствор NaOH концентрации 5 моль/л.
20.0 г гидроокиси натрия помещают в градуированный химический стакан, прибавляют 70Д мл деионизованной воды и перемешивают до полного растворения. Доводят объем до 100Д мл деионизованной водой. Раствор хранят при 18 - 25 *С.
10. Раствор MgCl2 концентрации 1 моль/л.
20.0 г магния хлористого шестиводного помещают в градуированный химический стакан, прибавляют 70.0 мл деионизованной воды и перемешивают до полного растворения. Доводят объем до
100.0 мл деионизованной водой. Плотность раствора ро - 1JD75- Раствор фильтруют через стеклянный фильтр GF/B. Раствор хранят при 4 - 6’С в течение 1 - 2-х мес.
11. Раствор ДНК-азы 1.
0,001 г ДНК-азы 1 помещают в щюбирку для микропроб и pacmeoj/яют в 0,1 мл 10%-ного раствора SDS. прибавляют 0,4 мл деионизованной воды и 0,5 мл глицерина. Содержимое пробирки перемешивают и хранят при -20 *С’.
12. Раствор деэоксирибонуклеозидтрифосфатов концентрации 0,001 моль/л.
2,9 мг дезоксиаденозинтрифосфата, 3,1 тимидинтрифосфата и 3,0 мг дезохсигуанидинтри -фосфата помещают в пробирку и растворяют в 5,0 мл деионизованной воды. Раствор разливают по 0,5 мл в пробирки для микропроб и хранят п/т 20 *С в течение шести месяцев.
13. Буферный раствор для ник-трансляции.
1,5 мг бычьего сывороточного альбумина (БСА) помещают в пробирку, прибавляют 5ft мл раствора трис-llCl концентрации 1 моль/л, pH 7/2, 1,0 мл раствора MgCl2 концентрации 1 моль/л и доводят ргизпвор до 10 мл деиониюванной водой. Раствор хранят в течение 6-ти месяцев при -20 ’С.
14. Приготтюление сефадекси С-25.
В химический стакан наливают 80,0 мл раствора ТЕ и медленно прибавляют 5ft г сефадекса G-25- Оставляют на ночь при 18 - 25 *С. Хранят суспензию при 4'С.
15.20х раствор SSC (лимоннокислый натрий с натрием хлористым) концентрации 3 моль/я.
173.0 г натрия хлористого и 88/2 г лимоннокислого натрия помещают в градуированный хими ■ четкий стакан, прибавляют 700.0 мл деионизованной воды и перемешивают до полного растворе -ния. Доводят объем до 1000,0 м.% деионизованной водой. Раствор фильтруют через стеклянный фильтр GF/B. Хранят /юствор при 18 - 25 *С в течение 2-х месяцев.
16. 5х раствор SSC (лимоннокислый натрий с натрием хлористый) концентрации 0,6 маль/л.
5.0 мл 20х раствора SSC вносят в градуировггнный химический стакан и доводят объем до 20,0 мл деионизованной водой. Раствор хранят при 18 -25’С в течение недели.
17. Нейтрализующий раствор.
0,87 г хлорида натрия помещают в градуированную мерную пробирку, прибавляют 5,0мл раствора трис-НСI концентрации 1 моль/л. pH 8,0, и прибавляют 0,42 мл концентрированной НС!. Доводят объем до 10 мл деионизованной водой, фи.1ьт//уют через стеклянный фильтр GF/B и хранят при 18 - 25 *С в течение месяца.
18. Очистка форм анида.
5.0 г смешанной катиоианионионообменной смолы помещают в градуироваи>1ый химический стакан и мьчшшют 50.0 мл формлмида, перемешивггют магнитной меишякой 30 - 40мин. при 18 - 25 ‘С. Чистый формамш) отделяют от смолы червч стекловаяокниапый фильтр GF/B. Хранят раствор при -20 *С.
19. Раствор денатурированной спермы лосося.
400,0мг ДНК спермы лосося помещают в емкость, прибавляют 20,0 мл деионшюваниой воды и перемешивают до полного растворения. Затем кипятят раствор ДНК в течение 10 мин. на водяной бане, разливают по 1,0 мл в пробирки для микропроб и хранят при -20 *С в течение 2-х месяцев.
20. Раствор Денхарда 100х.
1.0 г фикола, 1,0 г поливинилпиролидона, 1,0 г БСА помещают в градуированный химический стакан, прибавляют 30,0 мл деионшюваниой воды и перемешивают до полного /юстворения. Доводят объем до 50,0 мл деионизованной водой. Раствор фильтруют через стеклянный фильтр GF/B и хранят при -20 *С в течение 2-х месяцев.
21. Раствор для предгибридизации.
В градущюванный химический стакан вносят 25,0 мл раствора формамида, 0,75 мл раствора денатурированной ДНК спермы лосося, 2,5 мл 10% -ною раствора SDS. 12.5 мл 20х раствора SSC,
2,5 мл 100х растно]>а Денхарда и доводят объем до 50,0 мл деионизованной водой. Раствор фильтруют и хранят при 20 ’С в течение месяца.
22. Раствор для гибридизации.
Это тот же раствор для предгибридизации, но содержащий меченую а” Р ДНК. Моченную радиоактивным фосфором и очищенную ДНК (2,0 х 10s имп./мл) перед добавлением в раствор для гибридизации прогревают при 100 *С 5 мин. и быстро охлаждают на ледяной бане.
Раствор готовят перед использованием.
23. Раствор для отмывки мембраны.
Раствор А (2х раствор SSC с 0,5% -ным jxicmeopoM SDS).
В градуированный химический стакан помещают 50,0мл 20храствора SSC, 25,0мл 10%-ного раствора SDS и доводят объем до 500,0 мл деионизованной водой. Раствор готовят перед использованием.
Раствор Б (ОДх jtacmeop SSC с 0,1%-ным раатнщюм SDS).
В градуированный химический стакан помещают 5,0 мл 20храствора SSC, 10,0мл 10%-ного раствора SDS и доводят объем до 1000,0 мл деионизованной водой. Раствор готовят перед использованием.
24. Раствор проявителя.
К 700,0 мл деионизованной воды (температура воды 60 *С), 2J2 г метола, 8,8 г гидрохинона,
72,0 г безводного сульфита натрия, 48,0 г карбоната натрия и 4,0 г бромистого калия по очереди помещают в градуированный химичехжий стакан и по очереди растворяют. Доводят объем до 1000,0 мл деионизованной водой. Xjunuan раствор при 18 25 'С в темной посуде.
25. Раствор фиксатора.
160.0 г тиосульфата натрия, 40,0 г хлористого аммония помещают в градуированный химический стакан, прибавляют 730,0мл деионизованной воды (температура воды 60 ’С) и перемешивают до полного растворения. Доводят объем до 1000,0мл деионизованной водой и хранят при 18 -25 *С в темной посуде.
26. 10% -ный раствор ТХУ.
10.0 г тприхлоруксусной кислоты помещают в градуированный химический стакан, прибавляют 70,0 мл деионизованной воды и перемешивают до полного растворения. Доводят объем до 100,0 мл деионизованной водой. Раствор хранят при 4 - 6 'С.
27. Сцинтилляционный раствор.
4.0 г РР() (2,5 дифенилоксазола), 02 г РОРОР (1,4-ди(2-(5-феншижахзолил)6ензина)) помещают в /padyuj/ованныйхимический стакан, прибавляют 730,0мл толуола, перемешивают до полного растворения стеклянной палочкой. Доводят объем до 1000,0 мл толуолом. Хранят раствор при 18 - 25 ‘С в темной посуде.
При отборе проб используют автоматические пипетки с соответствующими диапазонами объемов:
от 1 мклдо 10 мкл;
от 5 мкл до 40 мкл;
от 40 мкл до 200 мкл;
от 200мкл до 1000лот;
от 1 мл до 5 мл.
7. Испытание на стерильность
Испытание на стерильность проводят с применением «Сухой питательной среды для контроля стерильности (тиогликолевой)» отечественного производства. Возможен выпуск варианта среды без тиогликолята натрия в составе сухого вещества. В этом случае тиогликолят натрия или тиогликолевую кислоту добавляют ex tempore. Вместо коммерческой тиоглико-левой среды может быть использована тиогликолевая среда индивидуального приготовления.
Контроль стерильности МИБП проводят путем поэтапного исследования образцов готового препарата в полуфабрикате и готовой серии препарата.
Готовым препаратом в полуфабрикате считают препарат, находящийся в одной производственной емкости (или разлитый в бутылки из этой емкости), из которой производят розлив в ампулы или флаконы.
Примечание.
Контроль полуфабриката на более ранних стадиях должен осуществляться в соответствии с технологическими регламентами.
7.1. Правила отбора образцов препарата для испытания на стерильность
Образец для контроля - это количество препарата, необходимое для первичного посева на питательную среду по представленной ниже схеме (не менее 2 мл). В том случае, если емкости (ампулы или флаконы) содержат меньший объем препарата, то образец составляют из смеси содержимого нескольких емкостей.
7.1.1. Отбор образцов готового препарата в полуфабрикате
Объем выемки готового препарата в полуфабрикате для испытания на стерильность должен быть достаточным, чтобы обеспечить достоверность результатов контроля, но не менее 10 мл. Перед отбором выемки содержимое производственной емкости, в которой находится полуфабрикат, тщательно перемешивают. Взятая проба должна быть посеяна в виде 5-ти или более образцов по схеме 7.4 и с учетом антимикробного действия п. 7.2.
7.1.2. Отбор образцов препарата в процессе розлива
В процессе розлива препарата для испытания на стерильность берут не менее чем по одному образцу в начале, середине и в конце розлива. Для контроля Moiyr быть взяты пробы, отобранные в процессе розлива в отдельные лабораторные емкости (пробирки, флаконы) или герметизированные емкости, в которые осуп1гствляется розлив препарата.
Примечание.
При ]юзливе njtenapamoe, которые в дальнейшем подвергаются лиофильному высушиванию, необходимо оставлять до окончания контроля стерильности высушенной продукции утроенное количество образцов (не менее 9-ти) ргилитого жидкою препарата в герметизированном виде. Эти образцы могут быть исследованы о случае пророста образцов высушенного препарата для выяснения причин контаминации.
7.1.3. Отбор образцов готового препарата
При контроле стерильности готового (разлитого, высушенного) препарата количество кои-т|юлируемых емкостей (ампул или флаконов) определяется с учетом общего количества емкостей в серии. Для определения минимальной) числа емкостей, необходимого для контроля стерильности, следует произвести расчет по (]юрмуле:
п = 0,4tJn, где
п - необходимое для контроля число емкостей, не менее 10-ти и нс более 40;
N * число емкостей в серии.
Принимая во внимание, что за образец для контроля принято количество препарата, необходимое для первичного посева на питательную среду (не менее 2 мл), число контролируемых емкостей и число засеваемых образцов может ис совпадать. В случаях, когда объем препарата в каждой емкости равен или превышает 2 мл, число контролируемых емкостей и число засеваемых образцов будет одинаковым или количество образцов будет превышать число емкостей, взятых для испытания. При меньшем объеме розлива (менее 2 мл в емкости) число засеваемых образцов будет меньше, чем число контролируемых емкостей, за счет объединения нескольких емкостей в один образец.
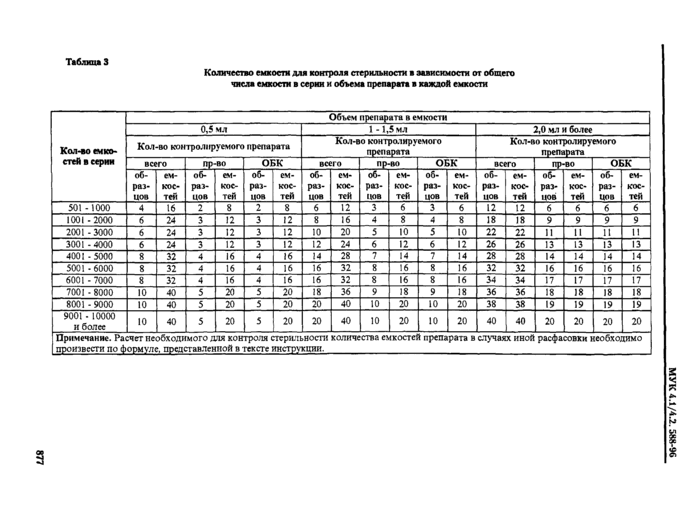
Для удобства расчетов предлагаются таблицы 1 и 2, позволяющие определить число емкостей и образцов, необходимое для испытания на стерильность с учетом объема серии и количества препарата в каждой емкости.
Примечания.
1. Число емкостей, необходимое для контроля стерильности на предприятии, представляет собой суммарное число емкостей, контролируемых на разных этапах, - не менее п/2 в производственном отделении и не менее п/2 в ОБК.
2. Если серия включает в себя менее 500емкостей, количество контролируемых емкостей должно быть не менее 10-ти.
3. При необходимости, с учетом особенностей технологического изготовления отдельных видов препаратов и особенностей фасовки, в соответствующей технической документации могут быть регламенти/юваны дополнительные требования в отношении необходимого количества контролируемых емкостей, обеспечивающие надежность контроля стерильности препарата.
Количество испытуемого препарата, необходимое для посева, в зависимости от объема содержимого емкостей, состовляющнх серию
|
Таблица 2 | ||||||||||||||||||
|
4. При отбраковке разлитого препарата из-за несоответствия физических свойств требова ниям НТД (помутнение, появление хлопьев) отбракованные ампулы или флаконы должны быть переданы в ОБК для выяснения характера помутнений и, при необходимости, проведения контроля стерильности.
Количество емкостей, отправленное в ГИСК им. Л.А. Тарасовича, должно соответствовать общему количеству, контролируемому в производственном отделе и в ОБК, с учетом величины серии и объема препарата, разлитого в ампулы или флаконы.
72. Определение антимикробного действия МИБП
Во избежание неправильной оценки испытания на стерильность необходимо определить для каждого наименования МИЫ1 (в том числе и для их полуфабрикатов), обладает ли он антимикробным действием.
Для этого в каждые две пробирки с 20 мл тиогликолевой среды вносят по 1,0 мл исследуемого препарата и добавляют но 0,1 мл микробной взвеси соответствующего тест-штамма в разведении 1000 клсток/мл. ('-одержимое пробирок осторожно перемешивают до равномерного распределения препарата в питательной среде. Посевы со штаммами для определения антимикробного действия инкубируют при температуре от 30 до 35 *С в течение 48 часов, а для определения антигрибкового действия от 20 до 25 *С в течение 72-х часов. В контрольные образцы вместо исследуемого препарата вносят аналогичное количество физиологического раствора и соответствующие тест-штаммы.
Для проверки антимикробного действия МИБП используют тест-микроорганизмы: Staphylococcus aureus АТСС 6538 Р; Bacillus subtilis. АТСС 6633; Escherichia coli АТСС 25922, a для противогрибкового действия - Candida albicans АТСС 885-653.
При отсутствии антимикробного действия МИБП в опытных и контрольных пробирках должен наблюдаться рост перечисленных гсст-микроорганизмов в указанные сроки. При наличии антимикробного действия возможно торможение роста одного или нескольких тест-штаммов, при сохранении их роста в контрольных образцах.
При выявлении антимикробного действия препарат разводят, изменяя соотношение объемов посевного материала и питательной среды. Первоначально увеличивают объем питательной среды до 250 мл. Если при этом сохраняется антимикробное действие МИЫ1. уменьшают объем посевного материала до 0,5 мл в каждой из 2-х пробирок (флаконов). Экспериментально установленное соотношение объемов питательной среды и посевного материала, обеспечивающее нейтрализацию антимикробного действия препарата, должно соблюдаться при испытании его на стерильность методом прямого посева.
R случае неэффективности разведения МИБП используют метод мембранной фильтрации.
7.3. Техника проведения контроля стерильности
Перед внесением в бокс ампулы (флаконы) с препаратами должны быть проверены на герметичность путем тщательного просмотра, а препараты, высушенные под вакуумом, должны быть проверены на вакуум. После этого ампулы (флаконы) обрабатывают методом погружения в 3%-ный раствор перекиси водорода нс менее чем на 2 мин.
Лица, проводящие контроль стерильности, непосредственно перед работой в боксе тщательно моют руки с мылом при помощи щетки. В прсдбокснике обувь меняют на специальную боксо-
вую, надевают стерильный халат, колпак или косынку и 4-слойную марлевую повязку (маску), которая должна закрывать нос и рот. При работе в боксе движения, разговоры, перемещения должны быть максимально ограничены.
В начале и в конце посева образцов каждой серии проводится обработка рук 70* спиртом, а поверхности рабочего стола 96* спиртом с последующим прожиганием (при посеве, насчитывающем более 30 емкостей одной серии, подобная обработка проводится также и в середине посева этой серии).
Перед вскрытием ампул или флаконов оттянутый конец ампулы или горлышко флакона смачивают 96* спиртом и обжигают в пламени горелки.
Исследуемый препарат набирают стерильной пипеткой при помощи ножной или ручной груши, предварительно автоклавированной. Перед забором препарата пустая пинетка проводится через пламя горелки, но не прокаливается. Посев каждого образца препарата производят отдельной стерильной пипеткой на внутреннюю стенку пробирки у раздела сред (необходимо избегать вдувания воздуха в питательную среду). Использованные пипетки, ампулы и флаконы от препаратов помещают в 3%-ный раствор перекиси водорода и оставляют на 24 часа, после чего производится их дальнейшая обработка.
Примечания.
1. Запрещается щюкалинать ампулы и пастеровские пипетки в пламени горелки.
2. Запрещается производить посев пипеткой без груши (ртом).
Пе]>ел посевом жидких препаратов содержимое ампул или флаконов необходимо встряхивать (т.к. микробы-контаминанты могут осесть на дно).
Образцы сухих препаратов предварительно растворяют тиогликолевой средой или стерильным растворителем (изотонический раствор хлорида натрия, дистиллированная вода и т.п.) в объеме, предусмотренном технической документацией, и после растворения засевают на питательную среду. Стерильность используемого растворителя проверяют путем ею посева (по 1 мл) на 2 пробирки, содержащие по 20 мл тиогликолевой среды. Пробирки выдерживают при температуре 30 - 35 *С и 20 - 22 *С соответственно 14 суг. одновременно с опытными пробирками. Посев растворителя для контроля стерильности производят до начала работы и после се окончания. Если при посеве сухих препаратов используют несколько флаконов растворителя, стерильность каждого должна быть проверена анало(ичным способом.
Примечание.
Растворение препаратов тиогликолевой средой не используют для метода мембранной фильтрации.
7.4. Схема контроля стерильности
7.4.1. Метод прямого посева
Контролируемый на стерильность образец засевают пинеткой но 1 мл на две пробирки, содержащие по 20,0 мл тиогликолевой среды, одну из которых инкубируют при температуре от 30 до 35 *С для выявления аэробных и анаэробных микроорганизмов, а другую - при температуре от 20 до 25 *С для выявления грибов и бактерий с оптимумом роста в данном температурном режиме. Продолжительность инкубации посевов составляет не менее 14 сут. В течение всего срока проводится их периодический просмотр.
Для препаратов, вызывающих помутнение питательной среды (препараты, содержащие сорбенты, микробную массу, мозговую ткань и т.п.), посев производят по указанной выше схеме, но на 5 - 7 сутки из каждой пробирки производят пересев приблизительно по 0,5 мл на две пробирки, содержащие по 10,0 мл тиогликолевой среды. Все пробирки выдерживают после пересева при соответствующих температурах до окончания инкубации (14 сут.) со дня первичного посева.
Примечание.
При необходимости, с учетом особенностей технологии изготовления отдельных видов пре-паратое, в соответствующей технической документации могут быть регламентированы дополнительные экспериментально обоснованные требования в отношении срока и режима инкубации.
7.4.2. Метод мембранной фильтрации
При определении стерильности М И БП. обладающих выраженным антимикробным действием, и МИБП, разлитых в емкости более 100 мл. используют метод мембранной фильтрации.
Аппаратура
В работе используют любую, подходящую для этих целей фильтрационную систему, состоящую из закрытою резервуара и приемника, между которыми помещают закрепленную надлежащим образом мембрану, а также насоса, обеспечивающею фильтрацию жидкости.
Фильтрационные системы делятся на два типа в одних мембрану после завершения процедуры фильтрации асептически извлекают, делят пополам и погружают в две емкости со 100 мл тиогликолсвой среды для последующей инкубации при температурах от 30 до 35 *С и от 20 до 25 *С (тип I); в других - мембраны закреплены в двух резервуарах, куда после фильтрации помещают по 100 мл тиогликолсвой среды, для последующей инкубации в этих же емкостях при соответствующих температурах (тип II). Установки второю типа могут быть многоразового использования (их стерилизуют в собранном виде, вместе с мембраной, насыщенным па|юм при избыточном давлении (0,11 +/- 0,02) МПа/(1,1 +/- 0,2) кге/кв. см и температуре (121 +/-1) *С в течение 18 -20 мин.) или одноразовые стерильные системы (например, стеритесты фирмы Millipore для Steritest Compact System). Используют мембраны с размером пор 0,47 мкм, диаметром 47 мм, скорость прохождения потока 55 - 75 мл/мин. при давлении 933 кПа (70 см рт. ст.).
Примечание.
При содержании в МИНИ масел фильтр стерилизуют отдельно. тщательно просушивают и с соблюдением асептики помещают о фильтродержателъ или используют одноразовые стеритесты.
Методика испытания
Используют то количество емкостей или то количество готового препарата в полуфабрикате, которые требуются для проведения испытания стерильности (п. 7.1.1 и п. 7.1.3). Если содержимое емкости более 2 мл. но менее 500 мл, - фильтруется весь объем препарата. Для емкостей более 500 мл фильтруют только 500 мл из всего объема.
Фильтрование отобранных образцов проводят в асептических условиях. Фильтрационную систему целесообразно устанавливать в настольных ламинальных боксах. Обработку препаратов перед внесением в бокс проводят в соответствии с п. 73.
Испытуемый препарат растворяют, если это необходимо, соответствующим растворителем или 03%-ным раствором натрия хлорида, а затем объединяют либо непосредственно н резервуаре для установок I типа, либо в отдельной стерильной емкости, с последующим разделением объема препарата на две половины для фильтрации в 2-х резервуарах для установок II типа. Если емкости больших объемов, то фильтрацию можно проводить без предварительного объединения, разделив их содержимое приблизительно поровну между двумя резервуарами, если нс предусмотрено автоматического разделения, как, например, в установке Steritest Compact System («Millipore»). Для препаратов, представляющих собой вязкую жидкого, или суспензию, нс поддающихся быстрой фильтрации, используют разведение достаточным количеством жидкости 1 для увеличения скорости фильтрации. При фильтрации препаратов, обладающих антимик|к>бным действием, в конце процедуры фильтр промывают 3 порциями но 100 мл жидкости 1. Если препарат содержит лецитин или масла, вместо жидкости 1 используют жидкость 2 (Приложение).
Для контроля стерильности условий, в которых проводятся испытания, необходимо фильтровать растворитель без испытуемого МИБП, с последующим воспроизведением всех вышеописанных операций.
Тиогликолевую среду с помещенными в нее фильтрами выдерживают при температурах от 30 до 35 *С и от 20 до 25 *С в течение 7 сут. при ежедневном осмотре.
73. Учет результатов контроля стерильности
Посевы периодически просматривают в рассеянном свете и по окончании периода инкубации. Наличие роста микроорганизмов оценивается визуально по выявлению мутности, осадка, хлопьев и других микроскопических изменений. Выявленный рост микрсюртанизмон необходимо подтвердить микроскопированием мазков, окрашенных по Граму. В протоколах испытания отмечается: при какой температуре выявлен рост, его характер, морфологические признаки обнаруженных мик|хк>рганмзмов, окраска но Граму.
Испытуемый препарат считают удовлетворяющим требованиям испытания на стерильность при отсутствии роста мик|юортанизмов во всех образцах. При обнаружении роста хотя бы в одной пробирке (колбе,флаконе) его подтверждают микроскопированием и повторяют испытание на стерильность на том же количестве образцов, что и в первый раз. При отсутствии роста микроорганкз-
мов при повторном посеве испытуемый препарат считают удовлетворяющим требованиям испытания на стерилыюсть. В случае роста микроорганизмов при повторном посеве, морфолошчески сходных с выявленными при первичном посеве, испытуемый препарат считают нестерильным.
Для готовою препарата в полуфабрикате допускается только одно повторное испытание на стерильность. В случае обнаружения роста при испытании на стерилыюсть готового препарата в полуфабрикате при повторении теста, независимо от характера микрофлоры, его бракуют.
Для готового препарата возможно проведение испытания на стерильность и третий раз на удвоенном количестве образцов, если в первый и во второй раз выявлен рост различных по морфологии микроорганизмов. При отсутствии роста микроорганизмов после инкубации н третьем испытании готовый препарат считают удовлетворяющим требованиям испытания на стерильность. При наличии роста хотя бы в одной пробирке (колбе, флаконе) испытуемый препарат считают нестерильным.
Результаты контроля исследуемых препаратов pei-истрируются в специальных производственных журналах.
7.6. Требования, предъявляемые к боксам
Испытание на стерильность МИ СП должно проводиться квалифицированным персоналом в специальных, предназначенных только для данного вида работ, боксах с обеспечением строгих правил асептики.
Боксы представляют собой изолированные застекленные камеры достаточной площади и кубатуры для проведения в них бактериологических исследований. Боксы должны быть хорошо освещены и обеспечены вентиляцией. Оптимальным является оборудование боксов приточно-вытяжной вентиляцией с подачей стерильного кондиционированного воздуха и с преобладанием притока (не менее 1,27 мм води ст.). Скорость потока воздуха - 20 объемов в час.
Внутреннее устройство боксов должно обеспечивать легкость и надежность поддержания чистоты и возможность лелпк]к*кционной обработки. С этой целью газовые и водопроводные трубы, а также электропроводку размещают вне бокса или в толще сто стен. Отопительные батареи устанавливают гладкими без ребер, что препятствует осаждению пыли. Стены бокса на высоту нс менее полутора метров от пола облицовывают метлахской плиткой, или, как и потолок, окрашивают в светлые тона масляной краской. Полы покрывают линолеумом, метлахской плиткой или пластиком. Такая отделка поверхностей позволяет использовать при уборке помещения дезинфицирующие растворы. В боксе должно находиться минимальное количество мебели - стол и табуреты. Запрещается размещение в боксах и предбоксниках водопроводных кранов и раковин, так как они являются источником грибковой микрофлоры.
Работу рекомендуется проводить в настольных ламинарных боксах с подачей стерильного воздуха в рабочую зону, что пговоляет проводить исследования в условиях, исключающих возможность загрязнения испытуемого препарата
Примечание.
В боксах, предназначенных для проведения контроля стерильности МИБП, работа с лсивыми микробными культурами не допускается.
К боксу должен прилегать предбоксник, отделенный от него стеклянной перегородкой с дверью и передаточными окнами, - помещение, куда вносятся подготовленные для посевов препараты, питательные среды, пипетки и биксы со стерильной одеждой для работы. В предбокснике персонал переодевается в стерильную одежду и специальную обувь для боксов.
К прсдбокснику должна примыкать комната, где хранятся питательные среды, необходимые для работы, стерильная посуда В этой комнате проводят всю вспомогательную работу (деконтаминация емкостей с МИБП, штативов для питательных сред, маркировка пробирок и т.п.).
Ежедневно бокс и предбоксник подвергаются тщательной уборке и деконтаминации путем протирания ветошью, смоченной в 3%-ной перекиси водорода с 0,5% сульфанола или порошка «Лотос». При приготовлении раствора воду добавляют в пергидроль, а затем моющее средство. Этот |«створ используют после приготовления.
Для приготовления 10 л раствора берут следующие количества препаратов: 1200 мл пергидроля, 50 г моющего средства и 8750 мл воды при температуре от 40 до 50 'С. Для простоты приготовления используют вымеренную по объему ингредиентов посуду. Норма расхода дезинфицирующего раствора - 70 - 100 мл/кв. м.
Готовят раствор и обрабатывают бокс и предбоксиик с соблюдением правил техники безопасности при работе с агрессивными веществами.
При отсутствии возможности использовать дезинфицирующий раствор производят обработку горячим (50 - 60 *С) мыльносоловым раствором (1% раствора соды или стирального порошка и 0,5% нашатырного спирта) с последующим протиранием стен, полов, мебели одним из следующих дезинфицирующих растворов:
• 2%-ный раствор хлорамина;
- 3%-ный раствор фенола;
- раствор антисентола
Для приготовления антисептола берут 2 раствора: 50%-ный раствор хлорной извести и 5%-ный раствор кальцинированной соды. Перед употреблением растворы сливают в равных объемах и разбавляют в 50 раз водой. Работу с антисептолом производят в резиновых перчатках.
Для обеззараживания боксов и предбоксникон применяют бактерицидные ламны БУВ, установленные из расчета: 1 лампа БУВ-30 на 12 куб. м объема воздуха или 2 - 2,5 ватта мощности на кв. м поверхности (числа в названиях ламп обозначают их мощность я ваттах). Лампы размешают на потолках или стенах на уровне 1,5 м от пола. Облучение бокса производят до начала работы в течение 1Д - 2 ч. Во время работы лампы должны быть выключены. Необходимо учитывать время эксплуатации ламп и, по окончании гарантийного срока, заменять лампы новыми, если даже они продолжают «светить*.
В боксах, оборудованных принудительной вентиляцией и ламинарными настольными боксами, работа должна начинаться не ранее чем через 30 мин. после их включения. Эго минимальное время, необходимое для замены воздуха стерильным, удаления пыли поднявшимся потоком воздуха и установления стационарного потока воздуха.
Ежедневно в начале и в конце работы контролируют бактериальную чистоту воздуха в боксе и в предбокснике, используя метод седиментации. Для этого чашки Петри с питательным агаром и средой Сабуро помещают открытыми на 15 мин. в нескольких точках (например, рабочий пол, ламинарный бокс и вблизи вентиляции). Затем выдерживают в термостате 48 ч чашки с питательным агаром при температуре от 30 до 35 *С и 72 ч чашки со средой Сабуро при температуре от 20 до 25 *С. При появлении роста колоний делают мазки, окрашенные по Граму, микроскопируюг их и отмечают характер микрофлоры в специальных журналах.
Допустимым считается рост не более 3-х колоний микробов сапрофитов на одной чашке. Рост большего числа колоний указывает на повышенную бактериальную загрязненность воздуха в боксе. В этих случаях необходимо произвести дополнительную дезинфицирующую уборку бокса и нредбоксника, а также проанализировать случай увеличения бактериальной контаминации и наметить мероприятия по ее устранению. В случаях появления колоний грибов, помимо дезинфекции, обращают особое внимание на снижение влажности о боксе и предбокснике путем просушивания их электронагревательными приборами. При проявлении спорообразующих мик[ю-организмов, а также грибов при уборке помещения увеличивают концентрацию перекиси водорода до 6%.
У лиц, работающих в боксе, периодически проверяют степень бактериальной обгемсменности рук после мьггья. Эту проверку проводят следующим образом: пальцами рук прикасаются к поверхности плотной питательной среды в чашке Петри и делают несколько круговых движений, «засеянные* чашки помещаются в термостат при температуре 30 - 35 *С на 48 ч для питательного агара и при температуре 20 - 25 *С на 72 ч для среды Сабуро. Появление более 3-х колоний на одной чашке Петри указывает на недостаточную чистоту рук для поведения асеггтической работы.
Результаты проверки контаминации воздуха бокса и предбоксника, бактериальной обсемс-ненности рук работников должны быть зафиксированы в специальных журналах.
Постоянно следуег обращать внимание на надежность стерилизации используемых для работы инструментов, лабораторной посулы, дистиллированной воды и различных растворов. Должен быть налажен надежный контроль указанных MaTqmanoR, а также тщательный контроль стерильности используемых питательных сред.
УТВЕРЖДАЮ Первый заместитель Председателя Госкомсанэниднадюра России, Заместитель Главного пк:ударешенного санитарного врача Российской Федерации
С.В. Семенов
31 октября 1996 года
Дата введения с момента утверждения
4. методы КОНТРОЛЯ. МЕДИЦИНСКИЕ ИММУНОБИОЛОГИЧЕСКИЕ ПРЕПАРАТЫМЕТОДЫ КОНТРОЛЯ МЕДИЦИНСКИХ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ, ВВОДИМЫХ ЛЮДЯМTESTING OF INJECTABLE MEDICAL IMMUNOBIOLOGICAL PREPARATIONSМетодические указания МУК 4.1/4.2.588-96
TESTING OF INJECTABLE MEDICAL IMMUNOBIOLOGICAL PREPARATIONSМетодические указания МУК 4.1/4.2.588-96
1. Область применения
Настоящие Методические указания предназначены для работников предприятий, осуществляющих контроль качества вакцин, анатоксинов, сыво|к>ток, иммуноглобулинов,аллергенов,эуби-отиков и других иммунобиологических препаратов, вводимых людям.
Все положения настоящего документа распространяются на предприятия, производящие МИЬП, независимо от их ведомственной принадлежности и формы собственности.
2. Нормативные ссылки
2.1. Вакцинопрофилактика СП 3.1.1.95.
2.2. Приказ Министерства здравоохранения СССР от 13.01.83 N 31.
2.3. Производство и контроль медицинских иммунобиологических препаратов для обеспечения их качества.
3. Общие положения
3.1. Целью введения настоящих Методических указаний является регламентация методов контроля медицинских иммунобиологических препаратов на их соответствие требованиям нормативной технической документации и, прежде всего. Фармакопейной статьи (Временной фармакопейной статьи).
3.2. Задачей проведения общих методов контроля является преимущественно установление безопасности МИВ11, вводимых людям.
3.3. Методические указания содержат описание общих методов контроля МИБП, вводимых людям. Особенности контроля качества МИЫ1, не охватываемые настоящим документом, описаны в нормативно-технической документации на эти препараты.
4. Термины и определения
4.1. Биологические термины и определения
Приложение
Жидкость 1
пептона ферментативного 1 г
воды дистиллированной до 1000 мл
pH после стерилизации 7,1 +/' 0*2
Жидкость 2
пептона ферментативного 5 г
твина-80 10 г
воды дистиллированной до 1000 мл
pH после стерилизации 7,1 +/' 0*2
Жидкости разливают в колбы или флаконы по 100 мл и стерилизуют так же, как питательные среды.
4.1.1. Медицинские иммунобиологические препараты, вводимые людям, - вакцины, анатоксины, иммуноглобулины, сыворотки, аллергены, эубиотики и другие лекарственные средства, предназначенные для иммунопрофилактики, иммунотерапии и иммунодиагностики инфекционных заболеваний и аллергических состояний.
4.1.2. Качество МИБП - совокупность свойств продукции, обусловливающих ее способность удовлетворять определенные потребности в соответствии с се назначением.
4.1.3. Готовая серия препарата - совокупность емкостей, полученных из одного готового к розливу полуфабриката, разлитых из одной емкости.
42. Химические термины и определения
4.2.1. Концентрация. Концентрация растворов в весобъемных процентах. Например, для приготовления 10%-ного раствора следует брать 10 г вещества и растворителя для получения 100 мл раствора.
4.2.2. Точная навеска. Взвешивание на аналитических весах с точностью до 0,0002 г. Если не указано: «точная навеска», то навеску берут с точностью до 0,01 г.
4.2.3. Постоянная масса. Разница в массе между последовательными взвешиваниями, не превышающая 0,0005 г.
4.2.4. Растворитель - дистиллированная вода, если нет других указаний.
4.2.5. Оценка результатов. Расчет результатов на основании 2-х параллельных определений.
4.2.6. Квалификация реактивов. Для анализа используют реактивы квалификации х.ч. и ч.да.
4.2.7. Моющее (редство. Хромовая смесь для обработки посуды (5%-ный раствор калия дихромата в концентрированной серной кислоте).
4.2.8. Контрольный опыт. Определение, проводимое с теми же количествами реактивов в тех же условиях, но без испытуемого препарата. Вместо испытуемого препарата используется растворитель.
4.2.9. Хранение jxicmeopoe. Хранение растворов реактивов при температуре 18 - 20 *С в течение б мес., если нет изменений их физических свойств.
4.2.10. Спирт - зтнловый ректификованный, содержащий %% спирта (по массе).
5. Определение электрофоретической чистоты и молекулярных масс геино-кнжеиерных препаратов
Метод используется для анализа генно-инженерных продуктов, а также некоторых высоко-очищенных биотехнологических препаратов, предназначенных для введения людям.
Для определения чистоты, гомогенности и молекулярной массы генно-инженерных продуктов применяют метод вертикального электрофореза в полиакриламидном «еле (ПЛАТ) с додецилсульфатом натрия (SDS) в редуцирующих и нерсдуцирующих условиях с последующей окраской геля как Кумасси ярко-голубым R-250, так и нитратом серебра. Образование комплекса SDS с белком устраняет различия между белками, связанные с их зарядом, и переводит молекулы белков в ко1к)>ормацию, при которой радиус Стокса является функцией молекулярной массы белка. При соблюдении этих условий подвижность белков отражает их молекулярные массы.
Испытания проводят на полуфабрикате препарата (очищенного продукта) до добавления каких-либо стабилизаторов, наполнителей, консервантов и других компонентов, входящих в состав лекарственной формы.
Электрофорез проводят в редуцирующих (в присутствии бета-мерка птоэтанола) и нередуцирующих (в отсутствии бета-мер кал тоэтанола) условиях. Определение молекулярных масс генно-инженерных белков проводят при окрашивании Кумасси ярко-голубым К-250 с нагрузкой на лунку 10 мкг, а определение чистоты - при нагрузке 40 мкг.
Параллельно, для оценки содержания примесей как белковой, так и небелковой природы, проводят электрофорез в редуцирующих условиях при окрашивании нитратом серебра с нагрузкой на лунку 2 - 5 мкг белка.
Методика определения. Полимеризацию геля ведут в ячейке, образованной стеклами и прокладками, определяющими размер и толщину геля. Сборку ячейки проводят в соответствии с инструкцией по работе с конкретным типом прибора для вертикальною электрофореза. Описание метода проводится на примере аппарата «Протеан 11» фирмы «Био-Рал», США. Для данного прибора размеры стекол ячейки составляют: внешнее стекло - 22 х 20 см, внутреннее стекло - 20 х 20 см. Размеры прокладок: длина - 20 см, ширина - 18 см, толщина - 0,75 - 1,0 мм. При наличии приборов с другими характеристиками необходимо внести соответствующие коррективы в постановку испытаний.
Проведение электрофореза
Нижнюю камеру аппа|>ата для злек-цюфорсзл заполняют электродным буферным раствором и вставляют в нее электрофоретическую ячейку с гелем. Верхний |>езервуар заполняют электродным буферным раствором, удаляют из лунок пузырьки воздуха. Нод слой буферного раствора в лунку вносят исследуемые образцы. Электрофорез проводят при температуре 10 - 14 *С в режиме постоянного тока. При прохождении фронта красителя через концентрирующий гель сила тока составляет 10 - 12,5 мА на 1 кв. см сечения геля (20 - 25 мА/гель). После вхождения фронта красителя в нижний разделяющий слой на 5 - 7 мм силу тока увеличивают до 20 мА на 1 кв. см сечения геля (40 мА/гель). После продвижения красителя на 14 см от нижнего края концентрирующего геля ток отключают, отделяют гель от стекол ячейки и переносят в кювету для окрашивания. Для того чтобы можно было выявить присутствие в исследуемом образце агрегатов и других компонентов, нс входящих в гель, концентрирующий гель полностью не обрезают. оставляя ОД - 10 мм. В случае необходимости можно обрезать часть нижнего геля по фронту красителя. Нанесение образцов на гель проводят в следующем порядке. В лунки 1 и 10 вносят соответствующий (с бета-меркаптоэтанолом или без) буфер для приготовления образцов, разбавленный деионизованной водой в 4 раза. В лунки 2 и 9 вносят по 7 мкл смеси стандартных белков, например фирмы «Фармация», Швеция. В остальные лунки вносят исследуемые образцы. При окрашивании Кумасси ярко-голубым К-250 вносят попарно такие объемы образца, чтобы количество белка в них составляло соответственно 10 и 40 мкг. При окрашивании геля нитратом серебра, в зависимости от препарата, в лунки вносят 2 - 5 мкг белка. Параллельно в одну из лунок вносят 0,002 - 0,01 мкг белка (в зависимости от чувствительности выявления минимальных количеств белка в данных условиях).
Окрашивание геля
1. Окрашивание Кумасси ярко-голубым R-250. Гель фиксируют 1 ч в фиксирующем растворе, после чего окрашивают в течение 16 ч. Затем окрашивающий раствор сливают, гель 2 3 раза споласкивают обесцвечивающим раствором и помещают в аппарат для обесцвечивания, заполненный обесцвечивающим раствором. Обесцвечивание проводят в течение 15 мин. при напряжении 24 О. Гель вынимакп из аппарата для обесцвечивания и споласкивают раствором для обесцвечивания и деионизованной водой.
2. Окрашивание нитратом серебра. Окрашивание 1еля нитратом серебра проводят с использованием коммерческой) набора реагентов (фирмы «Био Рад», США. или других) согласно прилагаемой инструкции. Следует обратить внимание на время выдерживания геля в проявляющем растворе. Окрашивание прекращают в момент проявления полосы в лунке с минимальным количеством препарата (например, 0,005 мкг).
Высушивание геля
В кювету наливают 0,5 л раствора для высушивания геля, помещают лист целлофановой диализной мембраны, например фирмы «Фармация», Швеция. На нем размещают гель и сверху накрывают вторым листом целлофановой диализной мембраны. Кювету закрывают крышкой и помещают па качалку. При покачивании гель выдерживают 20 30 минут. Стекло смачивают раствором для высушивания геля и на него плотно, без пузырьков воздуха, натягивают смоченный лист целлофановой диализной мембраны, на нее помещают гель. Сверху плотно, без пузырьков воздуха прикрывают вторым смоченным листом целлофановой диализной мембраны. Закрепляют и оставляют на столе при комнатной температуре не менее чем на 18 - 20 ч. Высушенный гель снимают со стекла вместе с целлофановой диализной мембраной и аккуратно обрезают. Гель готов для п|х)всдсния лснситомстрни и оценки результатов.
Денситометрия окрашенного геля
Проводится денситометром фирмы ЛКБ, Швеция, или другим не меньшей чувствительности. Денситометрию проводят в соответствии с инструкцией по эксплуатации данного прибора от верхнего края нижнего разделяющего геля по пути пробега белков в дайной лунке. В зависимости от конструкции аппарата может проводиться ленентометрия влажного и высушенного геля. Для учета фона геля может денситометрироваться дорожка с нанесенным буферным раствором для образцов, разбавленным деионизованной водой в 4 раза (в нашем примере дорожки 1 и 10). Площадь интегрирования самого большого зарегистрированного пика является нижним пределом для денситометрии анализируемых образцов. Однако при этом на дорожках с буферным раствором нс должны обнаруживаться окрашенные полосы.
Определение молекулярных масс генно-инженерных белков
Молекулярные массы мономеров и олигомеров исследуемою продукта определяют на элек-трофо|>еграмме, полученной после окрашивания Кумасси ярко-голубым К-250 в редуцирующих условиях при нагрузке на лунку 10 мкг белка. Для этого измеряют расстояние от верхнею края нижнею разделяющего геля до белковых зон стандартных белков (дорожки 2 и 9) - величина Кбелка. Таким же образом определяют расстояние пробега красителя (величина RrraimapT) Для каждого стандартного белка определяют коэффициент подвижности (Ra) по формуле:
*.=
Строят график зависимости Ra стандартного белка от логарифма молекулярной массы стандартного белка Затем определяют Ra для каждой белковой зоны исследуемого образца и по калибровочному (рафику определяют логарифмы молекулярной массы, из которых рассчитывают молекулярную массу соответствующих белков.
Оценка результатов электрофореза
После завершения электрофореза исследуемые образцы нс должны содержать неидентифи-цированных продуктов или их агрегатов в лунках гребенки геля или на границе при вхождении в гель. Для количественной оценки процента содержания целевою белка, его олигомеров, фрагментов и примесей проводят сками|ювание геля при помощи денситометра. Содержание iviiiio-инженерного продукта в редуцирующих условиях при окрашивании Кумасси ярко-голубым R-250 должно быть не менее 95%. Требования к другим параметрам (относительное содержание мономеров, олигомеров, фрагментов, белковых и небелковых примесей, чистота и картина дорожки на элсктрофоре(рамме в нередуцирующих условиях и при окрашивании нитратом серебра) определяются характеристиками и назначением конкретных исследуемых препаратов и указываются в частных ({(армакопейных статьях.
Примечания.
I. Приготовление нижнего разделяющего геля
1. Для приготовления 15%-ного геля в химический стакан, емкостью 100 мл, наливают 25мл 30%-ного раствора акриламида/бисакриламида, 12,5 мл буферного раствора трис-HCl концентрации 1,5 моль/л, pH 8.8, 11,75 мл деионизованной воды и 500 мкл 10%-ного раствора SDS. Полученный раствор дегазируют 15 мин. под вакуумом о колбе Бунзена. К дегазированному раствору прибавляют 250 мкл 10% -нога раствора ПСА и 25 мкл TEMED, перемешивают и заливают в электрофоретическую ячейку.
2. Для приготовления 12% -наго геля в химический стакан, емкостью 100 мл, наливают 20 мл 30%-ного раствора акриламида/бисакриламида, 12,5 мл буферного раствора трис-HCl концентрации 1,5 моль/л, pH 8,8, 16,75 мл деионизованной воды и 500 мкл 10%-ного распиюра SDS. Полученный ра<тпвор дегазируют 15 мин. под вакуумом в колбе Бунзена. К дегазированному раствору добавляют 250мкл 10% -ного раствора ПСА и 25 мкл TEMED, перемешивают и -заливают в электрофоретическую ячейку.
Мениск раствора в ячейке должен находиться на расстоянии 3 - 4 см от верхнего края внутреннего стекла. На раствор в ячейке наслаивают 1,0 мл деионизованной воды так, чтобы гель и
вода не перемешивались. Полимеризация геля происходит о течение 30 - 40 мин. при температуре 18 - 20 *С. Сначала граница между гелем и водой размывается, а затем становится резкой. Это является моментом окончания полимеризации.
II. Приготовление верхнего копцептрщщющего геля
После окончания полимеризации нижнего разделяющего геля воду сливают, поверхность геля тщательно подсушивают с помощью фильт]Ювгсхьной бумаги и заливают в ячейку 4%-ный раствор верхнего концентрирующего геля. Для его приготовления в химический стакан, вместимостью 50 мл, наливают 13 мл 30% -ного раствора акриламида/бисакриламида, 23мл раствора трис-НСУ концентрации 0,5 моль/л, pH 6,8, 6,1 мл деионизованной воды и 100 мкл 10%-ного раствора SDS. Раствор дегазируют под вакуумом в колбе Бунзена 15 мин. К дегазированному раствору добавляют 50 мкл 10% -ного раствора ПСА, 10 мкл ТЕМЕ!), перемешивают и заливают в электрофоретическую ячейку. После этого в ячейку вставляют гребенку с необходимым (например, десятью) количеством зубьев и толщиной, равной толщине прокладки. Полимеризация геля происходит в течение 30-40 мин. при температуре 18 - 20 ’С. После завершения полимеризации гребенку удаляют и промывают образовавшиеся лунки 1 раз деионшюванной водой и 10 раз электродным буферным раствором.
III. Приготовление растворов
1. Электродный буферный j>acmeop (5х) pH 83-
45.0 г трис(гид}Юксимстил)аминометана, 216,0 г глицина, 15,0 г SDS помещают в г]юдуиро-ванный стакан, прибавляют 2000,0 мл деионизованной воды, перемешивают до полного растворения, доводят объем деионизованной водой до 3000,0 мл, фильтруют, измеряют pH, который дал-жен быть в пределах 83- Доводить pH раствора кислотой или щелочью до необходимого значения не допускается.
2. Электродный буферный раствор pH 8,3.
К 600,0 мл электродного 6уфе]того раствора (5х) прибавляют 2400,0 мл деионизованной воды и перемешивают.
3. 30% -ный раствор акриламида/бисакриламида.
29,20 г акриламида и 0,80 г бисакриламида помещают в градуированный химический стакан и прибавляют 80,0 мл деиониюванной воды, перемешивают до полного растворения, доводят объем до 100,0 мл деионизованной водой. Раствор фильтруют и хранят в темной посуде при 4 - 6 *С не более месяца.
4. Буферный раствор трис HCI концентрации 1,5 моль/л, pH 8,8.
54,450 г трис(гидроксиметия)аминометана помещают в градуированный химический стакан, прибавляют 150,0 мл деионизоваююй воды, перемешивают до полного растворения. Доводят pH до 8,8 jtacmeopoM HCI концентрации 1 моль/л. Доводят объем до 300,0 деионизованной водой. Раствор фильтруют и хранят в течение месяца при 4 - 6 *С.
5. Буферный раствор трис-НСУ концентрации 0,5 моль/л, pH 6,8.
6.0 г трис(гидроксиметия)аминометана помещают в градуированный химический стакан, прибавляют 60,0 мл деионизованной воды, пе]>емешивают до полного растворения. Доводят pH до 6,8 раствором HCI концентрации 1 моль/л. Доводят объем до 100,0 мл деионизованной водой. Раствор фшьтруют и хранят в течение месяца при 4 - 6 *С.
6. 10%-ный jMcmeop SDS.
10.0 г додецилсульфата натрия помещают в градуированный химический стакан, прибавляют 80,0 мл деионизованной воды и тщательно перемешивают до полного }>астворения. Доводят объем до 100,0 мл деионизованной водой. Х]юнят при температуре 18 - 25 *С.
7. 10%-ный раствор ПСА.
100.0 мг аммония персульфата растворяют в 1,0 мл деионизованной воды. Используется только свежеприготовленный раствор.
8. 0,5%-ный бромфеноловый синий.
ОД5 г бромфенолового синего разводят в 50,0 мл деионизованной воды до полного растворения. Раствор хранят при темпе\)атуре. 18 - 25 *С.
9. Раствор для п/шготовления образцов при проведении электрофореза в нсредуцирующих условиях.
В химический стакан помещают 4J2 мл деионизованной воды, 1,0 мл бу^юрного раствора трис-
IICI концентрации 0,5 моль/л, pH 6,8,0,8 мл глицерина, 1,6 мл 10% -ного раствора SDS, 0,4 мл 0,5% -наго раствора бромфенолового синего. Раствор тщательно перемешивают и хранят при температуре 18-25’С.
10. Раствор для приготовления образцов при проведении электрофореза в редуцирующих условиях.
В химический стакан помещают 3.8мл деионизованной в<хУы, 1,0 мл буферного раствора трис-НС1 концентрации 0,5 моль/л, pH 6JB, 0,8 мл глицерина, 1,6 мл 10% -ного раствора SDS, 0,4 мл бета-меркаптоэтанола, 0,4 мл 0,5% -ного раствора бромфенолового синего. Раствор тщательно перемешивают и хранят при температуре 18 - 25 *С.
11. Образец исследуемого препарата смешивают в соотношении 3:1 с раствором для проведения электрофореза в нередуцирующих условиях или с раство]ЮМ для проведения электрофореза в редуцирующих условиях. Смесь прогревают в кипящей водяной бане в течение 5 или 10 мин. (в зависимости от исследуемого белка) и охлаждают до температуры 18 - 25 *С.
12. Приготовление раствсум стандартных белков для электрофореза.
Смесь стандартных белков для электрофореза (< Фармация», Швеция, или подобные другие) с соответствующим для данного исследования диапазоном молекулярных масс (например, от 14400 до 94000) растворяют в 100 мкл разбавленного в 4 раза раствора для приготовления образцов при проведении элекпуюфореэа в редуцирующих условиях или в 100 мкч разбавленного в 4 раза раствора для приготовления образцов для проведения электрофореза в нередуцирующих условиях. Раствор щхиревают в кипящей водяной бане в течение 5 мин. и охлаждают до температуры 18 - 25 *С. Разливают аликвоты и хранят при -20 ‘С.
13. Фиксирующий раствор.
В химический стакан наливают 250,0 мл этилового спирта. 100,0 мл ледяной уксусной кислоты, добавляют деионизованной воды до объема 1000,0 мл. Хранят при meMnejMimype 18 - 25 *С.
14. ()к]юшивающий раствор.
1,0 г Кумасси ярко-голубого R-250 помещают в химический стакан, доводят до объема 250,0 мл этиловым спиртом, перемешивают не менее 3.5 часа до полного растворил красителя, добавляют 100,0мл ледяной уксусной кислоты и доводят объем деионизованной водой до 1000,0мл. Хранят при meMnejMimype 18 - 25 *С'.
15- Обесцвечивающий раствор.
В химический стакан наливают 250,0 мл этилового спирта. 100,0 мл ледяной уксусной кислоты и доводят объем деионизованной водой до 1000 мч.
16. Раствор для высушивания геля.
В химический стакан наливают 150,0 мл этилового спирта, 50,0 мл глицерина, гщ>емешивают и доводят объем деионизованной водой до 500,0 мл. Хранят при температуре 18-25 *С.
17. При отборе проб и растворов используют автоматические пипетки с соответствующими диатсюнами объемов:
-от 1 мкл до 10 мкл;
- от 5 мкл до 40 мкл;
- от 40 мкл до 200 мкл;
- от 200 мкл до 1000мкл;
•от 1 мл до 5 мл.
б. Контроль содержания примесей клеточных ДНК в биотехнологических препаратах
Настоящему испытанию подлежат генно-инженерные препараты, моноклональные антитела и биотехнологические продукты, подучаемые на персвинаемых клеточных линиях, предназначенные для введения людям. В частных фармакопейных статьях на отдельные препараты, учитывая их специфические характеристики и особенности производства, возможно внесение соответствующих изменений при проведении данного контроля.
Испытание проводят на полуфабрикате препарата (очищенного продукта) до добавления каких-либо стабилизаторов, наполнителей, консервантов и других компонентов, которые могут входить в состав конечной лечебной формы.
Выделение ДНК из клеток штамма продуцента
1 г биомассы клеток штамма продуцента суспендируют в 20 мл буфера ТЕ, добавляют 10%-ный раствор додецилсульфата натрия (SDS) до конечной концентрации 1 %, лизируют в течение 15 мин., перемешивая. К полученному лизату добавляют равный объем смеси фенол-хлороформ (1:1). Смесь встряхивают в течение 15 мин., центрифугируют при 5000 об./мин. в течение 5 мин., собирают верхний слой (без интерфалы) и повторяют экстракцию фенол-хлорос}юрмом еще дважды. Собирают верхний слой, добавляют раствор 5 моль/л ацетата аммония до конечной концентрации 0,25 моль/л и 2 - 2,5 объема охлажденного до 20 *С этилового спирта. Полученную смесь оставляют на 1 час при -20 *С (можно оставить на ночь - 14 16 часов), затем центрифугируют при 5000 об./ мни. в течение 5 мин. Этиловый спирт сливают, осадок подсушивают на воздухе и растворяют в 1,5 мл буфера ТЕ. К раствору ДНК добавляют раствор РНК-азы (10 мг/мл) до конечной концентрации 50 мкг/мл. Смесь выдерживают при периодическом помешивании в течение одного часа при 37 *С, после чего к ней добавляют сухую лиофилизированиую протеиназу К до конечной концентрации 100 мкг/мл. Смесь инкубируют, периодически помешивая, в течение 30 мин. при 37 *С, затем денротеинизируют равным объемом смеси фенол-хлороформ (1:1) и далее равным объемом хлороформа. К водной фазе добавляют раствор 5 моль/л ацетата аммония до конечной концентрации 0,25 моль/л и 2 объема охлажденного до -20 *С этилового спирта. Выпавший осадок Д11К собирают центрифугированием, промывают в 70%-ном растворе этанола, подсушивают при комнатной температуре до удаления остатков этанола и растворяют в 2 мл буфера ТЕ.
Измерение концентрации ДНК Концентрацию ДНК определяют спектрофотометрически при длине волны 256 нм в кювете с толщиной слоя 1 см. 30 мкл раствора ДНК разводят буфером ТЕ до 3,0 мл, помещают в кювету спектрофотометра и определяют оптическую плотность раствора. В качестве контроля используют буфер ТЕ. Концентрацию полученного раствора ДН К (СЛ11К, мкг/мл) вычисляют по формуле:
СДНК-АхЭхР,
где:
А - оптическая плотность раствора при длине волны 256 нм;
Э - 50 мкг/мл (при такой концентрации оптическая плотность раствора ДНК при 256 нм равна одной оптической единице);
Р - кратность разведения исследуемого раствора, в данном случае равная 100.
Пример расчета: в результате спектрофотометрического анализа раствора ДНК установлено, что оптическая плотность раствора при 256 нм составляет 0,2 оптической единицы. Тогда:
СДНК = 0,2 х 50 х 100 - 1000 мкг/мл (1 мг/мл).
Критерием чистоты препарата ДНК является соотношение значений оптической плотности раствора ДНК при длинах воли 256 и 280 нм. Для чистых препаратов ДНК указанное соотношение выше 1,7. Например, светопоглощение исследуемого разведенного раствора ДНК при 280 нм равно 0,11 оптической единицы. Тогда соотношение 256/280 равно 0,20/0,11 - 1,81.
Полученный препарат очищенной клеточной ДНК в дальнейшем используют для приготовления меченой ДНК-зонда и построения калибровочного графика.
Получение меченой ДНК
В пробирку для микропроб вносят 2,0 МБк a Р-деэоксиаденоэинтрифосфата (удельная радиоактивность 8- 12 х 107МБк/ммоль).
Затем пробирку помещают в ледяную баню и вносят следующие компоненты реакции: 5 мкл буфера для ник-трансляции, 1 мкг ДНК клеток штамма-продуцента, 1 мкл |>аствора деэоксици-тидинтрифосфата, тимидиитрифосфата и деэоксигуанозинтрифосфата в концентрации 1 моль/л и деионизованную воду до 45 мкл. Раствор ДНК-азы 1 (1 мг/мл) {доводят деионизованной водой в 10000 раз и 0,5 мкл полученного раствора вносят в реакционную смесь. Далее добавляют 15 од. Л НК-полимеразы 1 E.coli и смесь тщательно перемешивают. Реакционную смесь инкубируют в
течение 2-х часов при температуре 15 *С. Реакцию останавливаю! добавлением в реакционную смесь 2 мкл раствора ЭДТА концентрации ОД моль/л.
Определение удельной радиоактивности меченой ДНК На 2 нитроцеллюлозных фильтра диаметром 2 см наносят по 1 мкл реакционной смеси. Один фильтр дважды отмывают в 20 мл холодного 10%-ного раствора трихлоруксусной кислоты в течение 5 мин., далее 2 мин. в 10 мл этанола и высушивают при комнатной температуре. Оба фильтра помещают в сцинтилляционные флаконы для определения радиоактивности, наливают во флаконы по 4 мл толуолового сци1ггилляционного раствора и определяют на счетчике количество импульсов в минуту. По полученным данным определяют процент включения метки, рассчитывают общую радиоактивность в 50 мкл реакционной смеси и, соответственно, удельную радиоактивность ДНК, т.е. количество импульсов в минуту на 1 мкг ДНК Удельная радиоактивность ДНК должна быть не менее 2,0 х 10* имп./мин. Для реакции гибридизации необходимо взять (2 +/- ОД) х 10е имп./мин. на 1 мл гибрид изац ион ной смеси.
Очистка меченой ДНК
Предварительно готовят суспензию сефадекса G-25. Носик наконечника автоматической пипетки, вместимостью 1,0 мл, закрывают небольшим кусочком стекловаты и заполняют суспензией сефадекса. В полиэтиленовую центрифужную пробирку помещают пробирку для микропроб типа «Эппендорф», вместимостью 1,5 мл, а в нее наконечник пипетки с сефадсксом. Пробирку центрифугируют при 18000 об./мин. в течение 2,5 мин. Сефадекс в наконечнике elite раз промывают буфером ТЕ, содержащим 20 мкг/мл денатурированной ДНК спермы лосося. Жидкость из эппсндорфовской пробирки удал я кп-, в наконечник на гель наносят реакционную смесь с меченой ДНК и опять центрифугируют в том же режиме. Не включившиеся в ДНК меченые и немеченые нуклсозидтрифосфаты остаются в геле, меченая ДНК собирается на дне пробирки в объеме 50 мкл.
Иммобилизация ДНК на мембране
К полуфабрикату исследуемого препарата, объемом ОД мл, добавляют 1 мкл раствора ДНК спермы лосося концентрации 20 мг/мл, затем дважды проводят дспротсинизацию |ханным объемом смеси фенол-хлороформ (1:1), собирают водный слой после центрифугирования в течение 5 мин. при 5000 об./мин. и осаждают двумя объемами этанола в присутствии ацетата аммония в конечной концентрации ОД моль/л. Пробы выдерживают 1 ч при температуре -20 *С (можно оставить на ночь - 14 - 16 часов). Осажденные нуклеиновые кислоты собирают центрифугированием при 13000 об./мин. в микроцентрифупе в течение 6 мин. Супернатант осторожно сливают, в пробирки с осадками нуклеиновых кислот добавляют 50 мкл ОД моль/л раствора гидроокиси натрия и выдерживают 20 мин. при температуре 18 - 25 *С. Пробы нейтрализуют на холоду равным объемом (50 мкл) нейтрализующего раствора и помещают в ледяную баню. Далее на нижнюю часть аппарата для дот-гибридизации кладут смоченную дистиллщх)ванной водой фильтровальную бумагу, на нее помещают мембрану Hybond-N («Амершам») и прижимают верхней частью аппарата, снабженной специальными зажимами. Верхняя часть аппарата для дот-гибридизации представляет собой пластину (132 х 100 х 18) с лунками. Исследуемые образцы вносят в лунки А (1 - 12) и в следующие ряды в зависимости от количества исследуемых проб.
Параллельно, рядом с исследуемыми образцами, наносят ряд известных разведений очищенной клеточной ДНК в концентрации от 20 иг до 0 пкг. Разведения готовят с помощью буфера ТЕ, содержащего ДНК-носитель (20 мкг/мл ДНК спермы лосося) следующим обраюм. В 8 пробирок для микропроб добавляют по 100 мкл буфера ТЕ, содержащего 20 мкг/мл ДНК носителя. Раствор ДНК штамма-продуцента разводят до концентрации 100 мкг/мл и 5 мкл этого раствора ДНК разводят до 500 мкл раствором ТЕ с 20 мкг/мл ДНК-носителя. Таким образом получают раствор с концентрацией 1000 нг/мл. 25 мкл этого раствора (25 иг) добавляют в первую пробирку, тщательно перемешивают, отбирают 25 мкл полученного pact вора (5 иг) и переносят во вторую пробирку, тщательно перемешивают и отбирают 1/5 часть раствора (25 мкл, содержащие 1 иг ДНК) и переносят в третьих пробирку, тщательно перемешивают. Таким образом разводят до восьмой пробирки. В восьмую пробирку ДНК не добавляют. В табл. 1 представлены концентрации стандартного ряда ДНК в 1 - 8 пробирках.
Содержимое каждой пробирки стандартного ряда ДНК обрабатывают равным объемом смеси фенол-хлороформ (1:1), центрифугируют при 5000 об./мин. в течение 5 мин., собирают вод-