МУ 3.5.2596-10
Методы изучения и оценки туберкулоидной активности дезинфицирующих средств
Купить МУ 3.5.2596-10 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания предназначены для организаций независимо от их организационно-правовой формы и формы собственности, осуществляющих разработку, изучение, производство, испытание, государственную регистрацию, сертификацию, применение, а также осуществляющих надзор и производственный контроль за производством и применением дезинфицирующих средств (ДС) и их субстанций (действующих веществ - ДВ), обладающих туберкулоидной активностью.
Оглавление
1. Область применения
2. Общие положения
3. Тест-микроорганизмы для изучения и оценки туберкулоидной активности дезинфицирующих средств и их субстанций
4. Обеспечение стандартности условий проведения исследований туберкулоидной активности дезинфицирующих средств и их субстанций
5. Методы исследований и оценки туберкулоидной активности дезинфицирующих средств и их субстанций in vitro
6. Методы изучения туберкулоидной эффективности дезинфицирующих средств, предназначенных для обеззараживания объектов внешней среды
7. Методы исследования и оценки туберкулоидной активности дезинфицирующих средств в практических условиях
8. Нормативные ссылки
Приложение 1. Характеристика тест-микроорганизмов по морфологическим, культуральным и биохимическим свойствам
Приложение 2. Методики приготовления питательных сред для культивирования тест-миобактерий, предназначенных для изучения и оценки туберкулоидной активности дезинфицирующих средств и их субстанций
Приложение 3. Материалы и оборудование, необходимые для проведения испытаний
| Дата введения | 29.03.2010 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
Организации:
| 29.03.2010 | Утвержден | Главный государственный санитарный врач Российской Федерации | |
|---|---|---|---|
| Разработан | Роспотребнадзор | ||
| Разработан | ФГУН НИИ дезинфектологии Роспотребнадзора | ||
| Разработан | ФГУ Уральский НИИ фтизиопульмонологии | ||
| Издан | Роспотребнадзор | 2010 г. |
- Федеральный закон 52-ФЗ О санитарно-эпидемиологическом благополучии населения
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
- ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
- ГОСТ 177-88 Водорода перекись. Технические условия
- ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия
- ГОСТ 22280-76 Реактивы. Натрий лимоннокислый 5,5-водный. Технические условия
- ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
- ГОСТ 4523-77 Реактивы. Магний сернокислый 7-водный. Технические условия
- ГОСТ 6259-75 Реактивы. Глицерин. Технические условия
- ГОСТ 8.423-81 Государственная система обеспечения единства измерений. Секундомеры механические. Методы и средства поверки
- ГОСТ 215-73 Термометры ртутные стеклянные лабораторные. Технические условия
- СП 1.3.2322-08 Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней
- ГОСТ 20292-74 Приборы мерные лабораторные стеклянные. Бюретки, пипетки. Технические условия
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
стр. 20

стр. 21
стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
Государственное санитарно-эпидемиологическое нормирование _Российской Федерации_
3.5. ДЕЗИНФЕКТОЛОГИЯ
Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств
Методические указания МУ 3.5.2596—10
Издание официальное
Москва * 2010
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
3.5. ДЕЗИНФЕКТОЛОГИЯ
Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств
Методические указания МУ 3.5.2596—10
Для получения культуры штамма тест-микобактерий ампулу с лио-филизированной музейной культурой этого штамма вскрывают в асептических условиях следующим образом: ватным тампоном, смоченным 70 % этиловым спиртом, обрабатывают поверхность ампулы, затем нагревают ее запаянный конец в пламени горелки до образования на ампуле трещины, К накаленному концу ампулы прикладывают ватную пробку, смоченную стерильной водой. После этого ударом металлического инструмента (скальпель, пинцет) по трещине откалывают конец ампулы. Стерильной пастеровской пипеткой в ампулу вливают 1,0 мл стерильной дистиллированной воды и оставляют в течение 30 мин при комнатной температуре для растворения лиофилизата и получения суспензии. Суспензию, приготовленную из музейной тест-культуры, рассевают по 0,1 мл в пробирки со скошенной питательной средой Левенштейна-Йенсена или «Новая» (всего 10 пробирок). Посевы инкубируют в термостате при 37 °С в течение 5—7 суток.
С выросшими на питательных средах культурами М. terrae далее работают следующим образом:
• полученную биомассу снимают платиновой лопаточкой или стеклянной палочкой с поверхности питательной среды Левенштейна-Йенсена или «Новая» со всех пробирок;
• помещают в пробирку с 10 мл бульона Миддлбрука 7Н9 с 10 % ADC ростовой добавкой и гомогенизируют;
• доводят объем полученной суспензии до 100 мл бульоном Миддлбрука 7Н9 и по 0,5 мл суспензии вносят в микропробирки;
• подписывают на каждой пробирке наименование штамма и дату;
• замораживают при -70 °С и оставляют в таком состоянии для длительного хранения.
Это самый эффективный способ длительного (десятилетиями) хранения культур с обеспечением сохранения биологических свойств тест-микобактерий. При отсутствии такой возможности суспензию в микропробирках замораживают в бытовом холодильнике при -20 °С. Срок хранения культуры в таких условиях - не более 5 лет.
Данная методика получения и хранения исходной рабочей культуры тест-микобактерий позволяет длительный период времени проводить испытания ДС с максимальным обеспечением стандартности свойств тест-микобактерий, в т. ч. по устойчивости к различным факторам, поскольку исключает необходимость многократного пересева, приводящего, как известно, к изменению биологических свойств микроорганизмов.
МУ 3.5.2596—10
Полученная и хранящаяся таким образом культура тест-микобактерий используется для получения агаровой культуры тест-микобактерий (первый пассаж) и приготовления из нее рабочей суспензии тест-микобактерий, используемой для проведения испытаний ДС.
3.3. Приготовление рабочей суспензии тест-микобактерий, используемой в эксперименте при испытании дезинфицирующих средств, и контроль ее качества
Для получения первого пассажа культуры тест-штамма микобактерий, используемой при оценке ДС, необходимое для исследования количество хранящихся при температуре -70 или -20 °С микропробирок (2 штуки на 1 исследование) с данным штаммом микобактерий размораживают при комнатной температуре, переносят по 0,1 мл содержимого в пробирки со скошенной питательной средой Левенштейна-Йенсена или «Новая» и инкубируют в термостате при 37 °С в течение 14 суток. Выросшую на плотной питательной среде в пробирках культуру используют для приготовления рабочей суспензии тест-микобактерий данного штамма.
Одна или несколько пробирок может быть использована для получения второго пассажа культуры тест-микобактерий этого штамма. Для этого культуру первого пассажа в пробирке снимают платиновой лопаточкой или стеклянной палочкой с плотной питательной среды, помещают в толстостенную стеклянную пробирку и тщательно растирают, постепенно добавляя по каплям стерильную дистиллированную воду. Полученную суспензию рассевают на плотную питательную среду тем же способом, который использовался для получения первого пассажа.
Культуры тест-микроорганизмов подвергают контролю их качества. В частности, непосредственно перед использованием культур для исследовательских целей необходимо убедиться в том, что тест-штаммы, выросшие на питательной среде, не загрязнены посторонней микрофлорой. Для оценки роста культур микобактерий тест-штаммов визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды. Проводят микроскопию мазка выросших культур методом окраски по Циль-Нильсену (М. terrae представляют собой короткие прямые палочки малиновокрасного цвета, располагающиеся в мазке параллельно друг другу» наподобие частокола. Размер клеток микобактерий 0,2—0,6 х 1—10 мкм).
Рабочую суспензию культуры тест-микобактерий готовят из тест-штамма первого и/или второго пассажей, выросших на плотной питательной среде. Дальнейшее субкультивирование недопустимо!
Для приготовления рабочей суспензии культуру микобактерий снимают платиновой лопаточкой или стеклянной палочкой с плотной питательной среды и помещают в толстостенную стеклянную пробирку. Микробную биомассу тщательно гомогенизируют, постепенно добавляя по каплям стерильную дистиллированную воду. Густую исходную бактериальную суспензию оставляют на 15 мин для осаждения негомогени-зированных конгломератов и частиц. Полученную надосадочную жидкость отбирают пастеровской пипеткой, переносят в стерильную пробирку, диаметр которой соответствует диаметру пробирки с оптическим стандартом мутности (ФГУН «Государственный научно-исследовательский институт стандартизации и контроля медицинских биологических препаратов им. Л. А. Тарасевича» Роспотребнадзора), и стандартизуют по оптическому стандарту мутности № 10 (он соответствует 1 ■ 109 микробных тел в I мл), добавляя стерильную дистиллированную воду.
Суспензия, содержащая такое количество живых микробов, при контаминации ею батистовых тест-объектов, тест-поверхностей и т. п. обеспечивает требуемые (порядка 1 * 105-1 • 106 КОЕ/см“2) уровни их обсеменения живыми клетками тест-микроба.
Однако в связи с тем, что микобактерии могут отмирать в результате хранения или по иным причинам, а мертвые микроорганизмы, присутствующие в суспензии, будут, как и живые, давать помутнение суспензии необходимо осуществлять бактериологический контроль фактического количества живых клеток в приготовленной суспензии, чтобы при необходимости внести коррективы и обеспечить требуемые уровни контаминации тест-объектов жизнеспособными микобактериями.
3.4. Определение биологической концентрации тест-микроба в рабочей суспензии
Из суспензии, приготовленной по оптическому стандарту мутности № 10 (109 КОЕ * мл”1), делают, как показано на рис. 1, разведения с 10-крат-ным шагом до 103 микробных клеток в 1 мл (посев 0,1 мл суспензии из этого разведения на плотную питательную среду позволяет провести достаточно точный подсчет выросших на среде колоний микобактерий, количество которых будет находиться в пределах 100 ед.).
МУ 3.5.2596—10
|
Разведения готовят следующим образом: 1 мл 1 мл 1 мл 1 мл 1 мл Пробирки с плотной питательной средой 0,1 |
|
Суспензия по 1 2 3 4 5 6 Пробирки с 9 мл стандарту мутности № разведения стерильной дистиллированной №>10 (КГ КОЕ/мл) воды Рис. 1. Проведение эксперимента по контролю количества живых микобактерий в рабочей суспензии тест-микобактерий, используемой для оценки туберкулоцидной активности ДС |
Первое разведение соответствует 10s КОЕ/мл, а шестое -103 КОЕ/мл. Из этого разведения производят посев по 0,1 мл на 5 пробирок со средой Левенштейна-Йенсена или «Новая», инкубируют в термостате при 37 °С в течение 5—7 суток. Подсчитывают количество выросших колоний на среде в пробирке, рассчитывают среднее значение из 5 и делают пересчет количества жизнеспособных клеток в исходной суспензии, учитывая коэффициент разведения. Количество жизнеспособных клеток в рабочей суспензии должно быть 109 КОЕ/мл.
Посев суспензии в пробирки со скошенной плотной питательной средой позволяет существенно экономить расход среды и избежать пересыхания и растрескивания среды, наблюдаемых при использовании чашек Петри с плотной питательной средой.
Расчет количества жизнеспособных бактериальных клеток в приготовленной исходной суспензии осуществляют по следующей формуле:
X = А • 107, где
X - количество жизнеспособных бактериальных клеток в 1 мл приготовленной суспензии;
А - среднее количество колонии образующих единиц (КОЕ), выросших на 5 чашках Петри;
13
I О7 - коэффициент пересчета, учитывающий степень разведения суспензии (106) и объем, использованный для посева (0,1 мл).
Например, получен рост микобактерий в 1-й пробе - 70 КОЕ, во 2-й - 130 КОЕ, в 3-й - 99 КОЕ, в 4-й - 115 КОЕ, в 5-й - 97 КОЕ, тогда среднее количество колонии образующих единиц (КОЕ), выросших на 5 пробирках, будет равно:
А ~ (70 + 130 + 99+115 + 97): 5 - 102
X = 102 * 107 = 109 микробных тел в 1 мл, что соответствует оптическому стандарту мутности №10(1 млрд микробных тел (109) в 1 мл).
3.5, Методики определения устойчивости тест-микобактерий
3.5.1. Определение устойчивости тест-микобактерий к воздействию температуры
В стерильный стеклянный стакан объемом 100 мл наливают 50 мл стерильной дистиллированной воды и помещают в водяную баню. Рядом с ним в водяной бане помещают стеклянный стакан объемом 100 мл с 50 мл дистиллированной воды и с помещенным в нее термометром, позволяющим измерять температуру до 100 °С. Включают водяную баню, доводят температуру воды в стакане до 60 °С и поддерживают эту температуру на протяжении всего эксперимента.
В стерильные пробирки разливают по 5 мл стерильной дистиллированной воды комнатной температуры (количество пробирок соответствует количеству отбираемых в опыте проб). Исходя из количества проб, готовят пробирки со скошенной плотной питательной средой Левенштейна-Йенсена или «Новая». Готовят и контаминируют тест-микроорганизмами батистовые тест-объекты (п. 5.2). Если в опытах используют ранее приготовленные и хранящиеся в холодильнике кон-таминированные микобактериями тест-объекты, то их заранее извлекают из холодильника, чтобы они приобрели комнатную температуру (18—20 °С).
Отсчитывают в чашке Петри необходимое для опыта количество батистовых тест-объектов (по 2 на каждую экспозицию), контаминиро-ванных тест-микобактериями, захватывают тест-объекты стерильным пинцетом все сразу и опускают их в стакан со стерильной дистиллированной водой, нагретой в водяной бане до 60 °С. Легким покачиванием емкости добиваются полного смачивания тест-объектов. В момент смачивания всех тест-объектов отмечают время.
МУ 3.5.2596—10
Через каждые 15 мин стерильным пинцетом извлекают по 2 тест-объекта и опускают их в пробирку с 5 мл стерильной дистиллированной воды при температуре (20 ± 2) °С для нейтрализации действия температурного фактора. Через 5 мин каждый тест-объект помещают на поверхность скошенной в пробирке плотной питательной среды.
Для контроля два контаминированных тест-микобактерией тест-объекта погружают в стерильную дистиллированную воду при температуре (20 ± 2) °С на максимальный срок экспозиции, затем (как и опытные тест-объекты) их помещают на поверхность скошенной в пробирке плотной питательной среды.
Посевы опытные и контрольные ставят в термостат при температуре 37 °С; наличие роста тест-культур проверяют через 10—14 суток.
Опыт повторяют не менее 3 раз. Тест-микобактерии должны быть устойчивы к нагреванию при 60 °С не менее 1 ч.
3.5.2. Определение устойчивости тест-микобактерий к эталонным дезинфицирующим средствам
Для определения устойчивости микобактерий в качестве эталонных ДС используют монохлорамин Б, глутаровый альдегид и перекись водорода медицинскую.
Методом йодометрического титрования определяют процент активного хлора в монохлорамине Б. В опытах используют препарат, содержащий 26,0—28,0 % активного хлора, растворяя который в дистиллированной воде в соотношении 1 :20 готовят рабочий раствор (5,0 % по препарату).
Глутаровый альдегид (зарегистрированный в России как субстанция) разводят дистиллированной водой до концентрации рабочего раствора 0,5 % (по глутаровому альдегиду).
Массовую долю перекиси водорода медицинской определяют методом перманганатометрического титрования в соответствии с ГОСТ 177-88. Готовят 4,0 %-й раствор (по перекиси водорода).
Предварительно готовят и разливают в пробирки по 5 мл стерильный раствор нейтрализатора (1,0 %-й раствор тиосульфата натрия); стерильную питьевую воду; пробирки со скошенной плотной питательной средой Левенштейна-Йенсена или «Новая». Готовят и контаминируют тест-микобактериями батистовые тест-объекты (п. 5.2). Если в опытах используют ранее приготовленные и хранящиеся в холодильнике конта-минированные тест-микробом тест-объекты, то их заранее извлекают из
15
холодильника, чтобы они приобрели комнатную температуру (18—
20 °С).
Перед постановкой опыта контролируют содержание ДВ в рабочем растворе ДС.
При проведении экспериментов в стеклянную емкость объемом 50—100 мл пипеткой наливают требуемый объем раствора эталонного ДС из расчета 0,5 мл на каждый тест-объект и помещают в водяную баню с температурой 20 °С на весь период опыта. Отсчитывают в чашке Петри необходимое для опыта количество батистовых тест-объектов (по 2 на каждую экспозицию), контаминированных тест-микобактериями, захватывают стерильным пинцетом тест-объекты все сразу и опускают их в емкость с раствором ДС; легким покачиванием емкости добиваются полного смачивания тест-объектов. В момент смачивания всех тест-объектов отмечают время.
Через каждые 30 мин стерильным пинцетом извлекают по 2 тест-объекта из раствора ДС и опускают их в пробирку с 5 мл 1,0 % стерильного раствора тиосульфата натрия для нейтрализации остаточного действия ДС. Пробирку с нейтрализатором и тестами не подвергают встряхиванию. Через 5—10 мин тест-объекты переносят в пробирку с 5 мл стерильной питьевой воды. Еще через 10—15 мин каждый тест-объект помещают на поверхность скошенной в пробирке плотной питательной среды.
Для контроля два контаминированных тест-микобактериями тест-объекта погружают в стерильную воду (вместо раствора ДС) на максимальный срок экспозиции, затем (как и опытные тест-объекты) их переносят в раствор нейтрализатора (тиосульфат натрия) и помещают на поверхность скошенной в пробирке плотной питательной среды.
Посевы опытные и контрольные ставят в термостат при температуре 37 °С; наличие роста тест-культур проверяют через 10—14 суток.
Опыт повторяют не менее 3 раз. Тест-микобактерии должны быть устойчивы к 5,0 %-му раствору монохлорамина не менее 2 ч; к 0,5 %-му раствору глутарового альдегида - не менее 60 мин; к 4,0 %-му раствору перекиси водорода - не менее 60 мин.
В процессе испытаний контролируют температуру раствора ДС в опыте, исходный и остаточный уровень контаминации тест-микобакте-риями тест-объекта (КОЕ на см2), время выдержки тест-объектов в испытуемом дезинфицирующем растворе.
МУ 3.5.2596—10
4. Обеспечение стандартности условий проведения исследований туберкулоцидной активности дезинфицирующих средств и их субстанций
Для обеспечения стандартности условий постановки экспериментов необходимо провести химико-аналитический контроль исследуемых ДС и их субстанций. До проведения исследования туберкулоццдной активности ДС и их субстанций необходимо ознакомиться с рецептурой средства и техническими условиями на отечественные или спецификацией на зарубежные средства, провести химико-аналитические исследования по определению концентрации действующих веществ в средствах и определить соответствие рецептуры и других показателей, регламентированным вышеуказанными документами. При этом используют химико-аналитические методы контроля и применяют условия хранения и меры безопасности при работе со средством, предложенные производителем.
Так как для дезинфекции при туберкулезе применяют средства, обладающие действием, убивающим микобактерии, а не задерживающим их рост, при определении туберкулоцидной активности и эффективности ДС необходимо разграничить туберкулоцидное действие препарата от туберкулостатического. Для этого применяют нейтрализаторы, исключающие остаточное бактерицидное действие.
Для нейтрализации антимикробного действия дезинфицирующих средств из различных химических групп применяют следующие нейтрализаторы [2]:
• для средств из группы окислителей (хлор-, йод-, перекисьсодержащие средства; средства, содержащие надуксусную кислоту, озон) -0,5—1,0 %-е растворы тиосульфата натрия;
• для альдегид- и фенолсодержащих средств - универсальный нейтрализатор, содержащий 3 % твина-80, 3 % сапонина, 0,1 % гистидина и 0,1 % цистеина;
• для катионных поверхностно-активных веществ - 0,1—1,0 %-е растворы сульфонола или 0,5—1,0 %-е растворы сульфонола с 10 % обезжиренным молоком;
• для композиционных средств - универсальный нейтрализатор, например, содержащий 3 % твина-80, 3 % сапонина, 0,1 % гистидина и 0,1 % цистеина. Универсальным нейтрализатором является также нейтрализующий бульон по Ди-Ингли (фирма-производитель «HIMEDIA»). В его состав входят такие ингредиенты, как гидролизат казеина, дрож-
17
жевой экстракт, глюкоза, натрия тиосульфат, натрия тиогликолят, натрия бисульфит, лецитин, Твин-80 и др.
Растворы нейтрализаторов готовят в асептических условиях, применяя для этого только стерильную дистиллированную воду.
При невозможности соблюдения асептических условий приготовления нейтрализаторов допускается стерилизация готовых растворов автоклавированием при 1,1 атм. (121 °С) в течение 15 мин.
Температура растворов нейтрализаторов должна быть 20 °С независимо от температуры окружающей среды.
Готовые растворы должны использоваться в день приготовления. Допускается хранение готовых растворов при температуре 4 °С в течение 48 ч.
Контроль полноты нейтрализации остаточного действия испытываемого ДС.
Несмотря на существующие рекомендации по применению нейтрализаторов для различных действующих веществ (ДВ), многие современные ДС содержат несколько ДВ и другие вспомогательные вещества, обладающие бактериостатическим действием, и существующие (рекомендуемые) нейтрализаторы мо1ут не обеспечивать эффективную нейтрализацию остаточного действия ДС в пробе. В этой связи результаты оценки эффективности ДС могут быть необъективными.
Поэтому каждый случай проведения испытания ДС должен предварительно сопровождаться экспериментальным контролем эффективности нейтрализации остаточного действия ДС на микробную клетку.
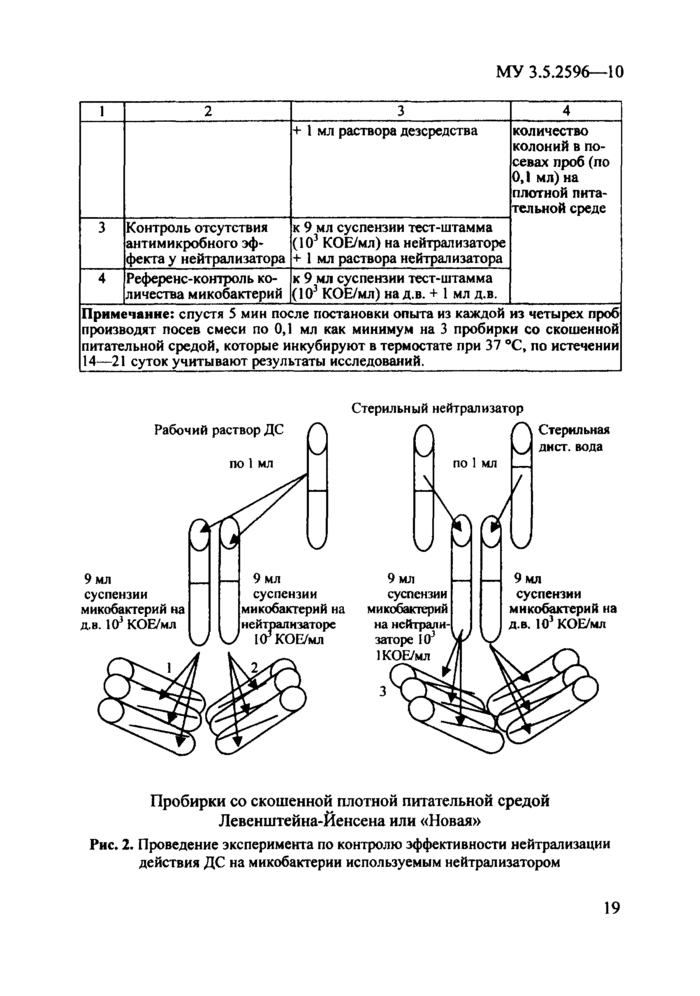
Для контроля эффективности нейтрализатора и полноты нейтрализации ДС используют суспензионный метод, предусматривающий проведение исследования, основные операции которого и их назначение приведены в табл. 2 и на рис. 2.
Таблица 2
|
Назначение операций эксперимента по оценке эффективности нейтрализации остаточного действия ДС | ||||||||||||||||
|
МУ 3.5.2596—10
| ||||||||||||||
|
Примечание: спустя 5 мин после постановки опыта из каждой из четырех проб производят посев смеси по 0,1 мл как минимум на 3 пробирки со скошенной питательной средой, которые инкубируют в термостате при 37 °С, по истечении 14—21 суток учитывают результаты исследований._ |
Стерильный нейтрализатор
|
Рабочий раствор ДС по 1 мл |
Г\
\
ПО 1 мл
г\
Стерильная лист, вода
"W
/
|
9мл суспензии микобактерий на д.в. 103 КОЕ/мл 9 мл суспензии микобактерий на нейтрализаторе 10* КОЕ/мл |
\J
9 мл
суспензии микобактерий на нейтрализаторе I03 1 КОЕ/мл
9мл
суспензии микобактерий на
|
д.в. 1<Г КОЕ/мл |
Пробирки со скошенной плотной питательной средой Левенштейна-Йенсена или «Новая»
Рис. 2. Проведение эксперимента по контролю эффективности нейтрализации действия ДС на микобактерии используемым нейтрализатором
19
ББК51.9
M54
M54 Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств: Методические указания.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010,-54 с.
ISBN 978—5—7508—0882—3
1. Разработаны ФГУН «НИИ дезинфектологии» Роспотребнадзора (Л. С. Федорова, И. М. Цвирова); ФГУ «Уральский НИИ фтизиопульмоно-логии» Росмедтехнологий (В. В. Канищев, Н. И. Еремеева. М. А. Кравченко, Д. В. Вахрушева); Роспотребнадзором (Л. С. Бойко).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию Роспотребнадзора (протокол № 3 от 03.12.09).
3. Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации, Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Г. Г. Онищенко 20.03,10.
4. Введены впервые.
ББК51.9
ISBN 978—5—7508—0882—3
© Роспотребнадзор, 2010 © Федеральный центр гигиены и
эпидемиологии Роспотребнадзора, 2010
5. Методы исследований и оценки туберкулоцидной активности дезинфицирующих средств и их субстанций
in vitro
5.1. Суспензионный метод
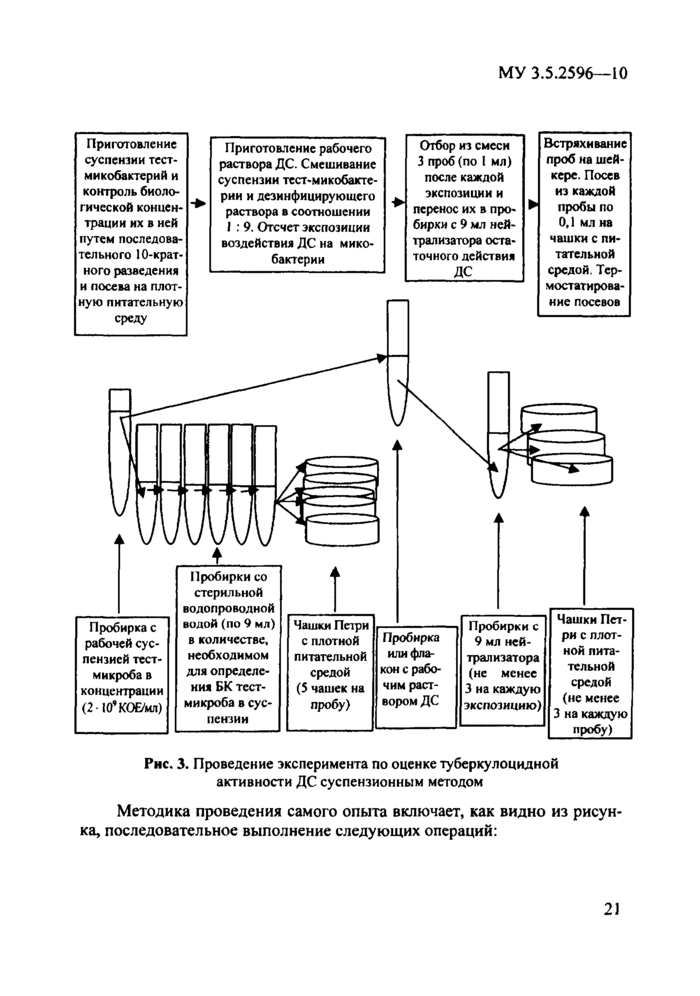
Суспензионный метод оценки туберкулоцидной активности ДС и их субстанций используют для получения первичной информации о концентрационных и временных параметрах эффективного (отсутствие жизнеспособных микобактерий) туберкулоцидного действия ДС. Мето-дология выполнения эксперимента по оценке туберкулоцидной активности ДС суспензионным методом приведена на рис. 3.
Как видно из рис. 3, для проведения опыта по оценке туберкуло-цидных свойств дезинфицирующего средства суспензионным методом необходимо приготовить:
• рабочую суспензию штамма тест-микобактерий с концентрацией не менее 1 * 109 КОЕ/мл (это обеспечивает возможность создания в смеси дезинфектанта с суспензией (обоснованной и применяемой для этого метода оценки ДС) концентрации микроорганизмов порядка 1 ♦ 108 КОЕ/мл;
• пробирки со стерильной дистиллированной водой для проведения контроля реальной биологической концентрации (БК) тест-микроорганизма в суспензии, используемой в опыте;
• пробирки или флакон с раствором ДС в испытываемой концентрации в количестве, необходимом для обеспечения отбора всех проб;
• необходимое количество пробирок (в зависимости от количества проб, отбираемых для определения времени, обеспечивающего полную гибель тест-микроба), содержащих по 9 мл нейтрализатора, проверенного предварительно на эффективность нейтрализации остаточного действия испытываемого ДС (п. 5);
• чашки Петри со стерильной плотной питательной средой или пробирки со скошенной стерильной плотной питательной средой в количестве, необходимом для посева пробы контроля исходной суспензии и проб контроля эффективности действия ДС на тест-микроб.
20
МУ 3.5.2596—10
Содержание
1. Область применения...............................................................................................5
2. Общие положения...................................................................................................5
3. Тест-микроорганизмы для изучения и оценки туберкулоцидной
активности дезинфицирующих средств и их субстанций..................................8
3.1. Требования к тест-микроорганизмам............................................................9
3.2. Получение и хранение исходной рабочей культуры
тест-микобактерий..........................................................................................9
3.3. Приготовление рабочей суспензии тест-микобактерий,
используемой в эксперименте при испытании дезинфицирующих средств, и контроль ее качества..................................................................11
3.4. Определение биологической концентрации тест-микроба
в рабочей суспензии.....................................................................................12
3.5. Методики определения устойчивости тест-микобактерий.......................14
3.5.1. Определение устойчивости тест-микобактерий
к воздействию температуры...............................................................14
3.5.2 Определение устойчивости тест-микобактерий
к эталонным дезинфицирующим средствам.....................................15
4. Обеспечение стандартности условий проведения исследований туберкулоцидной активности дезинфицирующих средств
и их субстанций....................................................................................................17
5. Методы исследований и оценки туберкулоцидной активности
дезинфицирующих средств и их субстанций in vitro........................................20
5.1. Суспензионный метод..................................................................................20
5.2. Метод батистовых тест-объектов................................................................23
5.3. Методы изучения факторов, влияющих на туберкулоцидную
активность дезинфицирующих средств и их субстанций.........................27
6. Методы изучения туберкулоцидной эффективности дезинфицирующих средств, предназначенных для обеззараживания
объектов внешней среды.........................................................................................28
6.1. Исследование туберкулоцидной эффективности дезинфицирующих
средств, предназначенных для обеззараживания поверхностей помещений, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов.........................29
6.2. Обеззараживание предметов ухода за больными и игрушек
из различных материалов (кроме мягких)..................................................31
6.3. Обеззараживание посуды столовой, лабораторной и из-под
выделений.....................................................................................................33
3
6.4. Исследование туберкулоцидной эффективности дезинфицирующих
средств, предназначенных для обеззараживания изделий медицинского назначения (ИМИ), включая эндоскопы...........................34
6.4.1. Исследование туберкулоцидной эффективности дезинфицирующих средств, предназначенных для обеззараживания ИМИ
из различных материалов (кроме эндоскопов).................................34
6.4.2. Исследование туберкулоцидной эффективности дезинфицирующих средств, предназначенных
для обеззараживания эндоскопов......................................................36
6.4.3. Исследование туберкулоцидной эффективности дезинфицирующих средств для дезинфекции высокого
уровня (ДВУ) эндоскопов...................................................................37
6.5, Исследование туберкулоцидной эффективности
дезинфицирующих средств, предназначенных для обеззараживания белья, одежды, спецодежды и других объектов из ткани.........................38
6 6. Исследование туберкулоцидной эффективности камерного
метода обеззараживания..............................................................................40
6.7. Исследование туберкулоцидной эффективности дезинфицирующих
средств при обеззараживании рук в резиновых перчатках.......................40
6.8. Исследование туберкулоцидной эффективности
дезинфицирующих средств, предназначенных для обеззараживания выделений (моча, кал, мокрота) и крови....................................................41
6.9. Исследование туберкулоцидной эффективности дезинфицирующих средств, предназначенных для обеззараживания медицинских
отходов..........................................................................................................44
6.10. Методы определения туберкулоцидной активности
дезинфицирующих средств при обеззараживании воздуха......................45
7. Методы исследования и оценки туберкулоцидной активности
дезинфицирующих средств в практических условиях......................................46
8. Нормативные ссылки............................................................................................47
Приложение 1. Характеристика тест-микроорганизмов по
морфологическим, культуральным и биохимическим
свойствам.......................................................................................48
Приложение 2. Методики приготовления питательных сред для
культивирования тест-микобактерий, предназначенных для изучения и оценки туберкулоцидной активности
дезинфицирующих средств и их субстанций...............................49
Приложение 3. Материалы и оборудование, необходимые для
проведения испытаний..................................................................53
4
МУ 3.5.2596—10
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
29 марта 2010 г.
Дата введения: с момента утверждения
3.5. ДЕЗИНФЕКТОЛОГИЯ
Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств
Методические указания _МУ 3.5.2596—10_
1. Область применения
Настоящие методические указания предназначены для организаций независимо от их организационно-правовой формы и формы собственности, осуществляющих разработку, изучение, производство, испытание, государственную регистрацию, сертификацию, применение, а также осуществляющих надзор и производственный контроль за производством и применением дезинфицирующих средств (ДС) и их субстанций (действующих веществ - ДВ), обладающих туберкулоцидной активностью.
2. Общие положения
Федеральный закон от 30 марта 1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии» [1] регламентирует проведение неспецифической профилактики инфекционных заболеваний. В комплекс неспецифических профилактических мероприятий входит дезинфекция объектов окружающей среды с использованием различных дезинфицирующих средств (ДС), вызывающих гибель тех или иных видов болезнетворных микроорганизмов при регламентированных параметрах технологии их применения (режимах обработки).
ДС, обладающие туберкулоцидной активностью, необходимы для обеззараживания различных объектов, контаминированных возбудите-
5
МУ 3.5.2596—10
лем туберкулеза, отличающимся от всех других вегетативных форм болезнетворных бактерий более высокой устойчивостью к различным неблагоприятным факторам, в т. ч. к дезинфицирующим средствам.
Эпидемиологическая ситуация по туберкулезу в мире в настоящее время остается напряженной, кроме того, она усугубляется появлением и распространением суперустойчивых к химическим противотуберкулезным веществам форм возбудителя. Такие микобактерии зачастую характеризуются более высокой сохраняемостью во внешней среде, что приводит к возникновению внутрибольничных вспышек нозокомиального туберкулеза. Кроме того, все чаще стали регистрироваться случаи заболеваний, вызванных нетуберкулезными видами микобактерий (НТМБ), которые обладают естественной резистентностью к воздействию негативных факторов окружающей среды. НТМБ являются возбудителями микобактериозов человека и наиболее опасны для больных с иммунодефицитными состояниями, т. к. существенно сокращают сроки их жизни.
В такой неблагоприятной эпидемической ситуации по туберкулезу и микобактериозам возрастает роль неспецифических противоэпидемических мероприятий, среди которых ведущую роль занимает химическая дезинфекция, направленная на уничтожение возбудителей на объектах внешней среды, имеющих значение в передаче инфекции.
Как известно, успех проведения химической дезинфекции напрямую зависит от соблюдения рекомендаций инструкций по применению дезинфицирующих средств, правильного выбора эффективного режима (концентрация, экспозиция, способ обработки). Помимо этого, дезинфекционные мероприятия будут эффективны лишь в том случае, когда режимы дезинфекции отработаны на адекватном по устойчивости к реальным возбудителям тест-микроорганизме.
В нашей стране для разработки туберкулоцидных режимов применения ДС используют сапрофитный штамм Mycobacterium Bs который изначально был предложен как тест-микроорганизм для оценки качества проведения камерной дезинфекции в очагах туберкулеза, поскольку обладал естественной резинстентностью к температурному фактору (2, 3]. Более того, результаты исследований по сравнительной оценке устойчивости микобактерий к химическим веществам, проведенные в 50—60 гг. прошлого столетия, свидетельствуют о меньшей устойчивости Mycobacterium В5 по сравнению с вирулентными штаммами микобактерий. Обоснованных экспериментальных данных по выбору Mycobacterium В$
6
МУ 3.5.2596—10
для оценки туберкулоцидной активности химических средств дезинфекции в открытой литературе не найдено.
За рубежом для разработки туберкулоцидных режимов применения ДС используют такие штаммы как М Теггае и М avium [4]. Насколько чувствительность к ДС всех перечисленных тест-микобактерий адекватна реальным возбудителям туберкулеза и микобактериозов сказать трудно, поскольку такие сведения в литературе отсутствуют.
В связи с вышесказанным представлялось актуальной задачей для дезинфектологии и фтизиатрической практики проведение экспериментов по сравнительной оценке чувствительности тест-микобактерий к воздействию ДС разных химических групп. Исследования, проведенные в НИИД и на базе лаборатории микробиологии и ПЦР диагностики Уральского НИИ фтизиопульмонологии (г. Екатеринбург), показали, что Mycobacterium В$ является самым чувствительным к воздействию большинства ДС видом микобактерий. Наиболее устойчивыми оказались А/. Теггае, М. A vium-intracellular а и М. tuberculosis с множественной лекарственной устойчивостью.
Тест-микроорганизм М. Теггае является наиболее подходящей моделью для изучения и оценки туберкулоцидной активности ДС, поскольку в наибольшей степени соответствует устойчивости патогенных микобактерий.
На основании этих данных, а также учитывая, что сапрофитные микроорганизмы более удобны и безопасны в работе, чем патогенные виды микобактерий, наиболее адекватной моделью для тестирования химических ДС является М. Теггае. При оценке туберкулоцидной эффективности физических (температурных) методов дезинфекции в качестве тест-микроорганизмов рекомендуется использовать Mycobacterium By Данные методические указания регламентируют методы и технологию изучения, а также оценки туберкулоцидной активности субстанций для производства ДС, туберкулоцидной активности и эффективности химических, физических и комбинированных ДС при обеззараживании различных объектов, контаминированных наиболее устойчивым видом микобактерий с учетом максимально возможного уровня контаминации объектов возбудителем туберкулеза в практических условиях.
Исследования туберкулоцидной активности субстанций, ДС и эффективности режимов применения ДС включают:
• выбор и подготовку культур тест-микроорганизмов для изучения туберкулоцидной активности ДС и субстанций;
7
МУ 3.5.2596—10
• обеспечение стандартности условий проведения исследований туберкулоцидной активности ДС и субстанций;
• методы исследований и оценки результатов туберкулоцидной активности ДС и субстанций in vitro (суспензионный метод, метод батистовых тест-объектов);
• методы исследований туберкулоцидной эффективности ДС с использованием искусственно контаминированных тест-микобактериями различных тесг-объектов с целью разработки режимов обеззараживания тех или иных объектов в отношении возбудителя туберкулеза (поверхностей в помещениях, транспорта, санитарно-технического оборудования, мебели, посуды, белья, одежды, предметов ухода за больными, медицинских приборов, инструментов и других изделий медицинского назначения ит. д.);
• методы исследований туберкулоцидной эффективности ДС в практических условиях.
3. Тест-микроорганизмы для изучения и оценки туберкулоцидной активности дезинфицирующих средств и их субстанций
К применению в отечественной медицинской практике для дезинфекции при туберкулезе предлагаются различные ДС как отечественного, так и зарубежного производства, имеющие туберкулоцидные режимы, разработанные с использованием наиболее устойчивых тест-микроорганизмов, что должно гарантировать их эффективность в отношении возбудителя.
Исследование и оценку туберкулоцидной и микобактерицидной (в отношении непатогенных микобактерий) активности ДС, предлагаемых для применения на территории России, проводят, используя в качестве тест-м икроорганизмов:
• агаровую культуру Mycobacterium В5 для оценки эффективности и разработки туберкулоцидных режимов камерного обеззараживания различных объектов;
• агаровую культуру Mycobacterium terrae (DSM 43227) для оценки активности ДС и разработки режимов их применения при обеззараживании в отношении возбудителя туберкулеза и микобактериозов;
• агаровую культуру Mycobacterium tuberculosis для подтверждения эффективности разработанных режимов применения ДС в отношении возбудителей туберкулеза и микобактериозов в практических условиях.
МУ 3.5.2596—10
3.1. Требования к тест-микроорганизмам
Тест-микобактерии должны иметь типичные морфологические, культуральные, биохимические, тинкториальные и ферментативные свойства, присущие данному штамму (прилож. 1), и обладать стандартной устойчивостью к эталонным ДС и температуре. Культура Mycobacterium В5 должна быть устойчива к температуре 60 °С в течение 60 мин. Показатели устойчивости к химическим дезинфицирующим средствам, которым должна соответствовать культура Mycobacterium terrae приведены в табл. 1.
|
Таблица 1 Устойчивость Mycobacterium terrae к эталонным дезинфицирующим агентам и средствам | ||||||||||||
|
Тест-микобактерии М, terrae могут быть приобретены в виде сухой культуры в ампулах (после лиофильной сушки) в Немецком музее микроорганизмов и клеточных культур (Deutcshe Sammhmg von Mikroorga-nismen und Zellkulturen GmbH) под № DSM 43227. Тест-микобактерии штамма B5 могут быть приобретены в коллекции Музея микроорганизмов ФГУН Научно-исследовательского института дезинфектологии (ФГУН НИИД) Роспотребнадзора.
3.2. Получение и хранение исходной рабочей культуры тест-микобактерий
Для выращивания культур тест-микобактерий используют плотные питательные среды. Перечень и методика приготовления питательных сред для культивирования тест-микобактерий, предназначенных для изучения и оценки туберкулоцидной активности ДС и их субстанций, приведены в прилож. 2. В отличие от питательных сред, рекомендуемых в стандарте NEN-EN 14476, использование приведенных в приложении питательных сред позволяет получать результат оценки туберкулоцидной активности ДС не на 21, а на 10—14 сутки.
9