МУ 3.5.2435-09
Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств
Купить МУ 3.5.2435-09 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания устанавливают общие требования к методологии и оценке спороцидной активности дезинфицирующих средств (ДС), стерилизующих средств (СС) и их субстанций (действующих веществ - ДВ), эффективности ДС при обеззараживании различных объектов внешней среды и СС при стерилизации изделий медицинского назначения и предназначены для организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также могут быть использованы другими организациями.
Оглавление
1. Область применения
2. Общие положения
3. Тест-микроорганизмы для изучения спороцидной активности ДС, СС и субстанций
4. Обеспечение стандартности условий проведения исследований спороцидной активности ДС, СС и их субстанций
5. Методы исследований и оценки результатов спороцидной активности ДС, СС и их субстанций in vitro
6. Методы исследования спороцидной эффективности ДС, предназначенных для обеззараживания объектов внешней среды, контаминированных тест-микроорганизмами в споровой форме
7. Методы исследования и оценки спороцидной активности ДС при использовании в качестве тест-микроорганизма вирулентных штаммов В. anthracis
8. Методы исследования и оценки спороцидной эффективности СС, предназначенных для стерилизации ИМН, включая эндоскопы
9. Метод исследования и оценки спороцидной эффективности СС, предназначенных для ДВУ эндоскопов
10. Оценка результатов исследования спороцидной активности и эффективности дезинфицирующих, стерилизующих средств и их субстанций
11. Нормативные ссылки
12. Библиографические данные
Приложение 1. Характеристика тест-микроорганизмов по морфологическим, культуральным, биохимическим свойствам, присущим данному виду
Приложение 2. Методика приготовления питательных сред для культивирования тест-микроорганизмов, предназначенных для изучения и оценки спороцидной активности ДС, СС и их субстанций
Приложение 3. Материалы и оборудование, необходимые для проведения исследований суспензии спор тест-микроорганизмов
| Дата введения | 20.01.2009 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
Организации:
- Федеральный закон 52-ФЗ О санитарно-эпидемиологическом благополучии населения
- Постановление 554 Об утверждении Положения о государственной санитарно-эпидемиологической службе Российской Федерации и Положения о государственном санитарно-эпидемиологическом нормировании
- Федеральный закон 7-ФЗ Об охране окружающей среды
- СП 3.5.1378-03 Санитарно-эпидемиологические требования к организации и осуществлению дезинфекционной деятельности
- МУ 287-113 Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения
- ОСТ 42-21-2-85 Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы
- СП 1.3.2322-08 Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7
стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23
стр. 24

стр. 25
стр. 26

стр. 27

стр. 28
стр. 29

стр. 30
Государственное санитарно-эпидемиологическое нормирование Российской Федерации
3.5. ДЕЗИНФЕКТОЛОГИЯ
Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств
Методические указания МУ 3.5.2435-09
Издание официальное
Москва
2009
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
3.5. ДЕЗИНФЕКТОЛОГИЯ
Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств
Методические указания МУ 3.5.2435-09
На поверхность питательной среды в каждый флакон (матрац), в зависимости от их вместимости (250/500 мл), вносят суспензию, смытую с 1—2 пробирок с посевами. Взвесь покачиванием флакона (матраца) равномерно распределяют по поверхности среды, закрывают ватно-марлевыми пробками и бумажными колпачками и инкубируют при температуре (55 ± 1) ‘С (G. stearothermo-philus) или (37 ± 1) 'С (В. licheniformis) в течение 10—12 сут. в наклонном положении (под углом 45 °С) агаром вверх. Для создания достаточной влажности в термостат, работающий при температуре (55 ± 1) °С, помещают открытые емкости с водой (до 2 л на термостат вместимостью 80 л).
Тест-микроорганизмы В. cereus, В. subtilis и В. anthracis для получения споровой формы засевают на скошенный пшеничный агар или агар Хоттингера с аминным азотом 120 мг % и выращивают при температуре (37 ± 1) “С двое суток в термостате, а затем еще 7—12 суток при температуре (20 ± 1) 'С в темном месте. На 7 и 9 сут. культуры проверяют на интенсивность спорообразования. Для этого выборочно из 2—3 флаконов (матрацев) культуру забирают петлей с верхнего, среднего и нижнего участков агара; все три пробы растирают вместе на одном предметном стекле, распределяя тонким слоем. Мазок фиксируют над пламенем горелки, окрашивают по Граму или генцианвиолетом (по Синеву). Окрашенные препараты промывают питьевой водой, подсушивают и микроско-пируют с иммерсионной системой — споры имеют вид неокрашенных пустот, находящихся внутри клеток.
При работе с В. anthracis для фиксации мазков используют 90°-й этиловый спирт или смесь Никифорова (равное количество спирта и эфира), время фиксации 30 мин. Затем мазок окрашивают при нагревании 1—2 мин карболовым фуксином Циля, промывают водой и обесцвечивают, погружая в 2 %-й раствор азотной кислоты в спирте или в 1 %-й раствор серной кислоты, так чтобы на препарате не было видно следов красителя. После этого мазок промывают водой и докрашивают водным раствором метиленового синего. Допустима окраска по Ожешко. При окраске В. anthracis карболовым фуксином споры окрашиваются в красный цвет.
Исследуют 10 полей зрения, подсчитывают количество спор, выражая в процентах. Достаточным количеством считают не менее 90 % спор в поле зрения от общего числа клеток.
После завершения спорообразования культуру осторожно при помощи шпателя (из проволоки) или стерильных стеклянных бус смывают с поверхности агара 5—10 мл стерильной дистиллированной воды (в зависимости от вместимости флакона) и сливают в емкости (пробирки, флаконы), которые закрывают стерильными резиновыми пробками.
МУ 3.5.2435—09
Для оценки качества полученной споровой суспензии тест-микроорганизма и принятия решения о возможности использования ее по назначению, из флакона (после тщательного перемешивания путем встряхивания) стерильно отбирают в пробирку 10 мл суспензии и определяют соответствие требованиям по биологической концентрации (БК) спор в суспензии и их устойчивости к эталонным физическим и химическим агентам, представленным в табл.1.
3.3. Определение биологической концентрации тест-микроорганизма е споровой суспензии
Определение выполняют методом последовательных десятикратных разведений суспензии тест-микроорганизма в стерильной дистиллированной воде с последующим высевом суспензии в чашки Петри с плотной питательной средой (агар Хотгингера, СПА, МПА). После определенного времени инкубации при соответствующей температуре проводят подсчет выросших колониеобразующих единиц (КОЕ) и определяют количество жизнеспособных спор в одном мл суспензии.
Для проведения испытания необходимы материалы и оборудование, приведенные в прилож. 3.
При выполнении испытания соблюдают следующие условия:
• используют дозаторы пипеточные не менее 2-го класса точности;
• в процессе выполнения опыта соблюдают асептические условия;
• контролируют температуру термостата и срок инкубации посевов.
До проведения испытания выполняют следующие подготовительные операции:
• расплавляют на кипящей водной бане плотную питательную среду (агар) и охлаждают ее до температуры (45 ± 5) °С;
• охлажденную питательную среду разливают по (25 ± 5) см3 в стерильные чашки Петри в пламени спиртовки (газовой горелки) и оставляют чашки на горизонтальной поверхности, пока не застынет агар;
• при необходимости подсушивают чашки с плотной питательной средой в термостате крышками вниз;
• разливают в стерильные пробирки с ватно-марлевыми пробками по 4,5 см3 стерильной дистиллированной воды.
В работе используют только кондиционные партии питательных сред, для чего предварительно проверяют их качество путем высева эталонной культуры соответствующего штамма. Для кон-
11
диционной среды число выросших тест-микроорганизмов от их общего количества должно составлять не менее 50 %.
При определении БК тест-микроорганизма в исходной суспензии спор агаровой культуры, последнюю разводят стерильной дистиллированной водой до концентрации, соответствующей по бактериальному стандарту мутности 1 млрд микробных тел в 1 мл. Затем стерильной пипеткой отбирают 0,5 мл суспензии спор и переносят в пробирку, содержащую 4,5 мл стерильной дистиллированной воды. Полученное разведение (10~') тщательно встряхивают. Аналогично, меняя пипетку, делают все последующие разведения до необходимого (10-*), теоретически соответствующего концентрации I • 103 спор в 1 мл. Из двух последовательных десятикратных разведений исходной суспензии производят высев по 0,1 мл на поверхность трех чашек Петри с агаром (агар Хоттингера, СПА, МПА). Чашки Петри инкубируют при температуре (55 ± 1) °С или (37 ± 1) °С в зависимости от вида культуры в течение 24—48 ч, после чего определяют число КОЕ. Количество жизнеспособных спор в исходной суспензии определяют как среднее арифметической число КОЕ с учетом разведения исходной суспензии и объема пробы для посева.
Пример расчетов. Предположим, что при посеве натри чашки Петри с агаром суспензии в разведении 1 : 100 000 подсчитано 140, 110 и 134 КОЕ. Аналогичные высевы из разведений 1 : 1 000 000 привели к образованию 12, 14 и 16 КОЕ.
Вычисляем общее число КОЕ, найденных во всех трех чашках Петри соответствующих разведений:
1:100 000 140 +110+134 = 38,4;
1:1000 000 12+14+ 16 = 42.
Среднее число КОЕ на чашках составит для разведения:
1:100 000 384:3 = 128;
1:1000 000 42 : 3=14.
Из расчета посевной дозы (0,1 мл на каждую чашку) вычисляем число жизнеспособных спор в 1 мл исходной суспензии с учетом разведений, далее находим среднее арифметическое числа КОЕ:
128- 10- 10s = 12,8- 10’,
14 - 10- 10* =14,0 • Ю7.
Таким образом, число жизнеспособных спор в исходной суспензии составит:
(12,8 + 14,0)- 107: 2-13,4- 107 = 1,32 10*спор/мл.
Или при посеве из одного последнего разведения по 0,! мл на 5 чашек Петри расчет концентрации жизнеспособных микроорганизмов в 1 мл суспензии препарата осуществляют по формуле:
МУ 3.5.2435-09
БК = х * р • 2, где
БК ~ концентрация жизнеспособных спор тест-микроорганизма, КОЕ • мл; х - суммарное количество колоний, выросших на пяти чашках, КОЕ; р - разведения;
2 - коэффициент, приводящий измерение объема посеянной суспензии к 1 мл.
Например: общее количество колоний на 5 чашках Петри составило 540 КОЕ, тогда количество жизнеспособных спор в исходной суспензии равно:
БК = 540 * 2 ■ 106 = 1080 ■ 106= 1,08 ■ 109спор/мл.
Герметично закрытые стерильной пробкой флаконы (пробирки) с исходной суспензией спор хранят в холодильнике при температуре (6 ± 2) °С до 6 мес., если споры тест-микроорганизма соответствуют вышеуказанным требованиям (табл. 1). Для снижения негативного влияния на суспензию спор перепада температуры, неизбежного при извлечении флакона из холодильника для отбора части суспензии, необходимой для проведения исследования ДС, СС и их субстанций, суспензию спор тест-микроорганизма из флакона целесообразно расфасовывать в пробирки и использовать их по мере необходимости.
Чистоту культуры тест-микроорганизма на всех этапах культивирования контролируют путем посева ее на чашки Петри с агаром Хоттингера, СПА, МПА.
Сибиреязвенную живую сухую вакцину (СТИ-1) при изучении спороцидной активности и эффективности используют в виде суспензии, содержащей 10s— 109спор/мл, приготовленной разбавлением содержимого одной ампулы в 10 мл стерильной питьевой воды.
ЗА. Методики определения устойчивости спор тест-микроорганизмов к эталонным ДС
ЗА. 1. Определение устойчивости спор к текучему пару, водяному насыщенному пару под избыточным давлением, сухому горячему воздуху
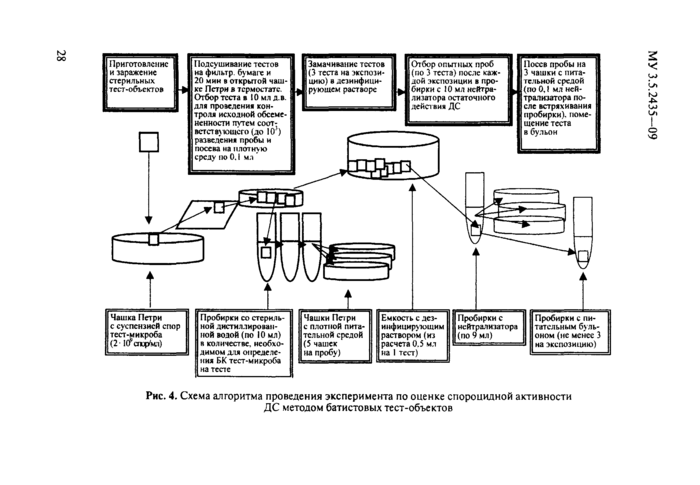
Устойчивость к действию текучего пара спор В. cereus, В. subdlis, В. anthracis, сибиреязвенной вакцины СТИ-1 определяют в аппарате Ойль-Мюллера, используя батистовые тест-объекты, контаминиро-ванные вышеуказанными тест-микроорганизмами, с последующим посевом тест-объектов в жидкую питательную среду.
МУ 3.5.2435—09
Аппарат Ойль-Мюллера может быть заменен устройством, доступным для изготовления практически в любой лаборатории, где необходимо провести такое исследование. Для этого берется стеклянная колба объемом 1—2 л с широким удлиненным горлом. Корковую пробку под него срезают на Уз по длине для обеспечения выхода пара. Это отверстие используется и для проведения измерения термометром температуры пара в месте размещения батистовых тест-объектов. Через трубку пропускают проволоку, имеющую на конце припаянную (или укрепленную другим способом) перпендикулярно к ней металлическую сеточку диаметром 3—3,5 см из нержавеющей стали, предназначенную для размещения батистовых тест-объектов, контаминированных спорами тест-микроорганизма.
Проволоку в пробке устанавливают так, чтобы сеточка находилась в месте перехода конуса колбы в горло. Это обеспечивает прохождение через сеточку практически всего объема выделяемого кипящей в колбе водой пара. Уровень воды должен находиться от сеточки на расстоянии 5—6 см.
В процессе испытаний контролируют следующие показатели:
• температуру текучего пара;
• исходную и остаточную контаминацию батистовых тест-объектов;
• время действия пара на контаминированные тест-объекты в аппарате Ойль-Мюллера (колбе).
Исследования проводят следующим образом: в колбу наливают дистиллированную воду и нагревают ее до кипения. При достижении температуры 100 °С на термометре, находящемся под воздействием текучего пара, на предварительно простерилизованную автоклавированием вместе с пробкой или обожженную в пламени сеточку помещают 2 батистовых тест-объекта (I х 0,5 см), контаминированных спорами тест-микроорганизма (методику приготовления тест-объектов см. в п. 5.2). Тест-объекты размещают так, чтобы исключался контакт их со стенкой горла колбы при введении сеточки в колбу. Держась за пробку, сеточку с тест-объектами вносят в зону действия текучего пара и включают секундомер. По истечении 2 мин воздействия пара, держась за пробку, сеточку с тест-объектами извлекают из колбы, а тест-объекты сразу помещают (засевают) в две пробирки со стерильным питательным бульоном. Обжигают сеточку и кладут на нее 2 новых тест-объекта. Аналогично вышеописанному вносят их в зону действия пара на 2 мин, затем также извлекают и помещают в пробирки со стерильным питательным бульоном. Так операцию повторяют, увеличивая экспозицию на 1 мин до Юмин. Посевы инкубируют при (37 ± 1) °Свте-
МУ 3.5.2435-09
|
Рис. 1. Принципиальная схема устройства аппарата Ойль-Мюллера в модификации Л. А. Блиновой |
чение 7 сут. Предварительный учет результатов проводят через 48 ч инкубирования, окончательный - на 7 сут. Из проросших пробирок с бульоном делают посев петлей на твердую среду для идентификации выросших тест-микроорганизмов.
При использовании аппарата Ойль-Мюллера необходимо не допускать случайного прикосновения к горлышку колбы сначала до обеззараживания тест-объекгов, затем - после обеззараживания. Этих погрешностей, искажающих результаты опыта, можно избежать при использовании аппарата Ойль-Мюллера в модификации Л. А. Блиновой (рис. 1). В емкости для текучего пара имеется четыре отверстия.
Первое отверстие (1) размещается вверху и предназначено для термометра, второе (2) справа в
торце - для внесения зараженных тест-объектов, третье (3) - на лицевой стороне - для изъятия обеззараженных тест-объектов и четвертое (4) - слева в торце для выхода пара. При пользовании таким аппаратом тест-объекты накалывают на иглу, закрепленную в пробке, которую вставляют в отверстие 2. Отверстие 3 во время экспозиции закрыто стерильной пробкой. По окончании экспозиции его открывают и через него извлекают обожженным пинцетом снятые с иглы тест-объекты, которые сразу засевают в бульон.
Применяемый в аппарате термометр должен иметь шкалу с делениями на десятые доли градуса. Определение устойчивости спор бацилл к текучему пару проводят при атмосферном давлении близком к 760 мм рт. ст. Учет этого фактора важен, поскольку существенно может влиять на результаты оценки. Так, при атмосферном давлении 745 мм рт. ст. температура текучего пара составляет 99,4 °С и резистентность при этой температуре В. cereus равна 6—7 мин, а при давлении 765 мм рт. ст. температура пара - 100,8 °С резистентность не превышает 3—4 мин.
Споры тест-микроорганизмов должны иметь устойчивость к текучему пару температурой 100 'С не менее 7—9 мин.
15
МУ 3.5.2435—09
Устойчивость тест-микроорганизма G. stearothermophilus к водяному насыщенному пару под избыточным давлением.
В качестве тест-носителя применяют флаконы из нейтрального стекла, контаминированные суспензией спор тест-микроорганизма (/. stearothermophilus.
Предварительно флаконы тщательно моют и стерилизуют паровым или воздушным методом. Из исходной суспензии спор готовят рабочую суспензию для контаминации тест-носителей.
Стерильные тест-носители контаминируют из расчета (1—5) ■ 106 тест-микроорганизма G. stearothermophilus, что достигается внесением в каждый носитель с помощью дозатора пипеточ-ного 0,02 мл суспензии спор с содержанием от 5 * 107 до 2,5 ■ 10*спор/мл.
Контаминированные тест-носители высушивают в термостате при температуре (37 ± 1) °С в течение 24 ч и закладывают в бумажные пакеты, разрешенные к применению в качестве стерилизационных упаковочных материалов в Российской Федерации.
Устойчивость спор тест-микроорганизма G. stearothermophilus к водяному насыщенному пару под избыточным давлением определяют в паровом стерилизаторе объемом 75 дм3 с гравитационным способом предварительного удаления воздуха из стерилизационной камеры.
Упакованные тест-носители помещают в стерилизационной коробке в незагруженную камеру парового стерилизатора. После набора давления в водопаровой камере (1,1 ±0,1) кгс/см2 проводят вытеснение воздуха паром из камеры парового стерилизатора (продувка парового стерилизатора) в течение 10 мин (при открытом спускном кране и давлении в стерилизационной камере от 0,1 до 0,2 кгс/см2). После продувки доводят давление пара в стерилизационной камере до 1,1 ±0,1 кгс/см2 (121 ± 1) °С и через 5 мин (время выживания спор тест-микроорганизма) с момента установления давления спускают пар. Для уменьшения времени воздействия пара до и после периода испытуемого воздействия (время воздействия при температуре (121 ± 1) °С) подъем давления проводят максимум в течение 8 мин, спуск — в течение 3 мин. Контроль температуры осуществляют максимальными термометрами (СП-82).
Аналогичное исследование проводят с 15-минутным временем воздействия (время гибели спор тест-микроорганизма). При каждом из указанных периодов воздействия экспонируют не менее 10 тест-носителей. По окончании времени выдержки тест-носите-ли вынимают из стерилизатора. Во флаконы вносят 1 мл питательной среды (бульон Хоттингера, МПБ, СПБ, цветная питательная среда с индикатором бромкрезоловым пурпуровым), закрывают стерильными резиновыми пробками (N 7,5) и инкубируют при
МУ 3.5.2435-09
температуре (55 ± 1) “С в течение 7 сут. при использовании питательного бульона (бульон Хоттингера, СПБ, МПБ) или в течение 48 ч при использовании цветной питательной среды с индикатором бромкрезоловым пурпуровым.
Учет результатов проводят путем визуального осмотра. Отсутствие помутнения/изменения цвета питательной среды с индикатором указывает на гибель спор. При наличии роста микроорганизмов проводят сравнение последних с тест-микроорганизмом.
В качестве контроля используют тест-носители, которые не подвергали действию стерилизующего средства. Посевы контрольных тест-носителей и питательную среду, а также инкубирование посевов осуществляют аналогично опытным тест-носителям, которые подвергали действию стерилизующего средства.
Время гибели спор G. stearothermopkilus при действии водяного насыщенного пара под избыточным давлением (1,1 ±0,1) кгс/см2, температуре (121 ± 1) °С должно быть не менее 15 мин.
Устойчивость спор В. licheniformis к сухому горячему воздуху определяют в воздушном стерилизаторе объемом 80 дм3 с принудительной циркуляцией и скоростью движения воздуха более 1 м/с, которые обеспечивают допустимые предельные отклонения от номинального значения температуры.
В качестве тест-носителя применяют флаконы из нейтрального стекла, контаминированные спорами тест-микроорганизма В. licheniformis. Предварительно флаконы тщательно моют и стерилизуют паровым или воздушным методом. Из исходной суспензии спор готовят рабочую суспензию для контаминации тест-носителей из расчета (1—5) • 10‘ спор в носителе.
Стерильные тест-носители контаминируют рабочей суспензией спор тест-микроорганизма В. licheniformis, что достигается внесением в каждый тест-носитель с помощью дозатора пипеточного 0,02 мл суспензии спор в дистиллированной воде с содержанием от 5,0 • 107 до 2,5 • Ю'спор/мл.
Контаминированные тест-носители высушивают в термостате при температуре (37 ± 1) “С в течение 24 ч и закладывают в бумажные или полимерные пакеты, разрешенные к применению в качестве стерилизационных упаковочных материалов в Российской Федерации.
Упакованные тест-носители помещают на полку воздушного стерилизатора, предварительно прогретого до 140 °С. Стерилизатор закрывают и после достижения температуры (160 ± 3) °С начинают отсчет времени выдержки. Через 4 мин (время выживания спор тест-микроорганизма) аппарат отключают. Контроль температуры осуществляют по наружному термометру.
17
Аналогичное исследование проводят с 30-минутным временем испытуемого воздействия (время гибели спор тест-микроорга-низма). При каждом из указанных периодов испытуемого воздействия экспонируют не менее 10 тест-носителей*
По окончании времени выдержки тест-носители вынимают из стерилизатора. Во флаконы вносят 1 мл питательной среды (бульон Хоттингера, МПБ, СПБ, цветная питательная среда с индикатором бромтимоловым синим) и закрывают стерильными резиновыми пробками (N 7,5) и инкубируют при температуре (37 ± I) °С в течение 7 сут. при использовании питательного бульона (бульон Хоттингера, СПБ, МПБ) или в течение 48 ч при использовании цветной питательной среды с индикатором бромтимоловым синим.
Учет результатов опытов и контроля проводят также как при определении устойчивости спор к водяному насыщенному пару под давлением.
Время гибели спор тест-микроорганизма В. Ucheniformis при действии сухого горячего воздуха при температуре (160±3)°С должно быть не менее 30 мин.
ЗА. 2. Определение устойчивости спор к хлорамину, перекиси водорода, глутаровому альдегиду
Устойчивость к хлорамину, перекиси водорода, глутаровому альдегиду у спор В. cereus, В. subtilis, В. anthracis, живой сухой сибиреязвенной вакцины СТИ-1 определяют методом погружения батистовых тест-объектов, контаминированных споровой суспензией указанных культур (п. 6.2) в 10 %-й раствор хлорамина, 6 %-й раствор перекиси водорода, 2,5 %-й раствор глутарового альдегида с последующей нейтрализацией действующих веществ и посевом в жидкую питательную среду.
В процессе испытаний контролируют концентрацию действующего вещества в рабочем растворе ДС, температуру его в опыте, исходный и остаточный уровень контаминации спорами тест-объ-екта КОЕ, время выдержки тест-объектов в испытуемом дезинфицирующем растворе.
Определения устойчивости спор к хлорамину. Йодометрическим методом определяют процент активного хлора в хлорамине. В опытах используют препарат, содержащий 26—28 % активного хлора, растворяя который в воде готовят 10 %-й (по препарату) рабочий раствор. Готовят и разливают в пробирки по 5 мл стерильный раствор нейтрализатора (2 %-й раствор тиосульфата натрия), стерильную питьевую воду, питательный бульон (МПБ). Готовят и контаминируют тест-микроорганизмом батистовые тест-объекты (п. 5.2). Если в опытах используют ранее приготовленные и хранящиеся в холодильнике контаминированные спорами тест-микро-
МУ 3.5.2435—09
организма тест-объекты, то их заранее извлекают из холодильника, чтобы они приобрели комнатную температуру (18—20 °С).
При проведении экспериментов в стеклянную емкость объемом 50—100 мл пипеткой наливают требуемый объем 10 %-го раствора хлорамина, из расчета 0,5 мл на каждый тест-объект и помещают в водяную баню с температурой 20 вС на весь период опыта. Отсчитывают в чашке Петри необходимое для опыта количество кон-таминированных спорами тест-микроорганизмов батистовых тест-объектов (по 2 на каждую экспозицию), захватывают их стерильным пинцетом все сразу и опускают в емкость с раствором хлорамина; легким покачиванием емкости добиваются полного их смачивания. В момент смачивания всех тест-объектов отмечают время.
Через каждый час стерильной петлей извлекают по 2 тест-объекта из раствора хлорамина и опускают их в пробирку с 5 мл 2 %-го стерильного раствора тиосульфата натрия для нейтрализации остаточного действия хлорамина. Через 5—10 мин тест-объекты переносят во вторую пробирку с 5 мл стерильной питьевой воды, а через 10—15 мин каждый тест-объект помещают в 5 мл питательного бульона.
Для контроля два контаминированных спорами тест-микроорганизма тест-объекта погружают в стерильную воду (вместо раствора хлорамина) на максимальный срок экспозиции, затем (как и опытные тест-объекты) их переносят последовательно в раствор нейтрализатора (тиосульфат натрия), стерильную питьевую воду и сеят в жидкий питательный бульон в пробирках. Полноту нейтрализации активного хлора контролируют путем погружения некон-таминированных тест-объектов в раствор 10 % хлорамина на максимальную экспозицию, затем в раствор тиосульфата натрия, промывают в воде и помещают в бульон, куда вносят 0,1 мл суспензии, содержащей 20—30 жизнеспособных спор тест-микроорганизма. Рост культуры в бульоне свидетельствует об эффективной нейтрализации действия хлорамина.
Посевы опытные и контрольные ставят в термостат при температуре (37 ± 1) °С; наличие роста тест-микроорганизма проверяют через 48 ч. Из пробирок с ростом делают посев петлей на твердую питательную среду для идентификации тест-микроорганизмов. Окончательный учет результатов проводят через 7 сут.
Опыт повторяют не менее 3 раз. Споры тест-микроорганиз-мов: В. cereus (шт. 96), В. subtilis (шт. 7), В. anthracis (шт. 81/1 и 27), живой сибиреязвенной вакцины СТИ-1 должны быть устойчивы к 10 %-му раствору хлорамина не менее 360 мин.
Определение устойчивости спор к перекиси водорода. Иодомет-рическим методом определяют концентрацию перекиси водорода в средстве «Перекись водорода медицинская». В опытах использу-
19
ББК 51.9 М54
М54 Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств: Методические указания. —М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009.—75 с.
ISBN 978—5—7508—0838—0
1. Разработаны: ФГУН «НИИ дезинфекгалогии» Роспотребнадзора, кафедрой дезинфекгологии ММА им. И. М. Сеченова (М. Г. Шандала, Н. Ф. Соколова, И. М. Абрамова, Л. С. Федорова, А. П. Степнов); Филиалом ФГУ 48 ЦНИИ МО России - Центром военно-технических проблем биологической защиты (В. В. Канищев); ВНИИ железнодорожной гигиены (В. А. Полякова); Испытательным лабораторным центром «Московский городской центр дезинфекции» (Ю. Г. Сучков, Р. Л. Гугерман); ФГУЗ «Волгоградский научно-исследовательский противочумный институт» Роспотребнадзора (В. Н. Андрус); Роспотребнадзором (Л. С. Бойко).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 3 июля 2008 г. № 2 ).
3. Утверждены и введены в действие постановлением Главного государственного санитарного врача Российской Федерации Г. Г. Онищенко 20 января 2009 г.
4. Введены впервые.
ББК 51.9
© Роспотребнадзор, 2009 © Федеральный центр гигиены
и эпидемиологии Роспотребнадзора, 2009
ют средство, содержащее не менее 30 % перекиси водорода, из которого путем разведения стерильной питьевой водой готовят раствор для исследований, содержащий 6 % перекиси водорода. Для нейтрализации перекиси водорода используют стерильный
2.5 %-й раствор тиосульфата натрия. Подготовку и определение устойчивости спор тест-микроорганизмов к 6 %-му раствору перекиси водорода проводят по такой же методике, как и к хлорамину, только в качестве нейтрализатора используют 2,5 %-й раствор тиосульфата натрия. Учитывая, что споры тест-микроорганизмов должны быть устойчивы к воздействию 6 %-го раствора перекиси водорода в течении не менее 60 мин, испытание осуществляют в течение 90 мин с отбором проб (по 2 теста) через каждые 15 мин (обычно берут по 2 тест-объекта на 6 экспозиций). Аналогично, как и при определении устойчивости спор к хлорамину, проводят посевы, учет результатов и контроль.
Споры тест-микроорганизмов: A cereus (шт. 96), A subtilis (шт. 7), В. anthracis (шт. 81/1 и 27), живой сибиреязвенной вакцины СТИ-1 должны быть устойчивы к 6 %-му раствору перекиси водорода не менее 60 мин.
Определение устойчивости спор A subtilis (шт. 7) к 2,5 %-му раствору глутарового альдегида. Определяют концентрацию глутарово-го альдегида в исходном (концентрированном) растворе глутарового альдегида. В экспериментах используют средство, содержащее не менее 20 % глутарового альдегида. Раствор для исследований, содержащий 2,5 % глутарового альдегида, готовят путем разведения исходного раствора стерильной питьевой водой с последующим доведением pH приготовленного раствора до значений 7,5. Подготовку и определение устойчивости спор A subtilis (шт. 7) к
2.5 %-му раствору глутарового альдегида проводят по такой же методике, как и к хлорамину, используя батистовые тест-объекты, контаминированные этим тест-микроорганизмом, только в качестве нейтрализатора используют или стерильный 1 %-й раствор бисульфита натрия или стерильный универсальный нейтрализатор, содержащий Твин 80(3 %), сапонин (0,1 %), гистидин (0,1 %), цистеин (0,1 %). Учитывая, что споры некоторых тест-микроорга-низмов должны быть устойчивы к воздействию 2,5 %-го раствора глутарового альдегида не менее чем в течение 3 ч, испытание осуществляют в течение 6 ч с отбором проб (по 2 тест-объекта) через каждые 30 мин. Посевы, учет результатов и постановку контроля осуществляют аналогично определению устойчивости спор к хлорамину.
Споры тест-микроорганизма A subtilis, (шт. 7) должны быть устойчивы к 2,5 %-му раствору глутарового альдегида не менее 3 ч.
МУ 3.5.2435—09
Содержание
1. Область применения..................................................................... 4
2. Общие положения......................................................................... 4
3. Тест-микроорганизмы для изучения спороцидной активности
ДС, СС и субстанций..................................................................... 6
4. Обеспечение стандартности условий проведения исследований
спороцидной активности ДС, СС и их субстанций..................... 21
5. Методы исследований и оценки результатов спороцидной активности ДС, СС и их субстанций in vitro............................ 24
6. Методы исследования спороцидной эффективности ДС,
предназначенных для обеззараживания объектов внешней среды, контаминированных тест-микроорганизмами в споровой форме.................................................................................. 33
7. Методы исследования и оценки спороцидной активности ДС
при использовании в качестве тест-микроорганизма вирулентных штаммов В. anthracis............................................................... 53
8. Методы исследования и оценки спороцидной эффективности
СС, предназначенных для стерилизации ИМН, включая эндоскопы.......................................................................................... 55
9. Метод исследования и оценки спороцидной эффективности
СС, предназначенных для ДВУ эндоскопов................................ 60
10. Оценка результатов исследования спороцидной активности и эффективности дезинфицирующих, стерилизующих средств и
их субстанций................................................................................ 62
11. Нормативные ссылки.................................................................... 63
12. Библиографические данные.......................................................... 64
Приложение 1. Характеристика тест-микроорганизмов по морфологическим, культуральным, биохимическим свойствам, присущим данному виду............................... 67
Приложение 2. Методика приготовления питательных сред для культивирования тест-микроорганизмов, предназначенных для изучения и оценки спороцидной активности ДС, СС и их субстанций...................... 71
Приложение 3. Материалы и оборудование, необходимые для проведения исследований суспензии спор тест-микроорганизмов..................................................... 74
3
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
20 января 2009 г.
Дата введения: с момента утверждения 3.5. ДЕЗИНФЕКТОЛОГИЯ
Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средствМетодические указания МУ 3.5.2435-091. Область применения
1. Область применения
1.1. Настоящие методические указания устанавливают общие требования к методологии и оценке спороцидной активности дезинфицирующих средств (ДС), стерилизующих средств (СС) и их субстанций (действующих веществ — ДВ), эффективности ДС при обеззараживании различных объектов внешней среды и СС при стерилизации изделий медицинского назначения.
1.2. Настоящие методические указания предназначены для организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также могут быть использованы другими организациями.
1.3. Методические указания разработаны на основе Федерального закона «О санитарно-эпидемиологическом благополучии населения» [1], Федерального закона «Об охране окружающей среды» [2], «Положения о государственном санитарно-эпидемиологическом нормировании» [3], нормативно-методических документов, регламентирующих изучение и критерии оценки активности ДС, СС, а также активности их субстанций.
2. Общие положения
Федеральный закон «О санитарно-эпидемиологическом благополучии населения» [I] и Федеральный закон «Об охране окружающей среды» [2] регламентируют проведение специфической и неспецифической профилактики инфекционных заболеваний.
МУ 3.5.2435-09
В комплекс неспецифических профилактических мероприятий входят дезинфекция и стерилизация [4, 5] с использованием ДС и СС, обладающих спороцидной активностью, т. е. убивающих споры микроорганизмов при регламентированных параметрах технологии (режимах обработки) [6].
ДС, обладающие спороцидной активностью, необходимы для обеззараживания различных объектов при сибирской язве, газовой гангрене, столбняке, дезинфекции высокого уровня (ДВУ) эндоскопов; стерилизующие средства — для стерилизации изделий медицинского назначения (ИМН), включая эндоскопы, и для ДВУ эндоскопов [7—11].
Данные методические указания регламентируют методологию и технологию изучения и оценки спороцидной активности субстанций для производства ДС и СС, спороцидной активности и эффективности химических и физических ДС для обеззараживания различных объектов, а также СС для стерилизации ИМН, обсемененных наиболее устойчивыми микроорганизмами в споровой форме с учетом максимально возможного уровня контаминации ими объектов [10].
Исследования спороцидной активности субстанций, ДС, СС и эффективности режимов их применения включают:
• выбор и подготовку тест-микроорганизмов в споровой форме для изучения спороцидной активности ДС, СС и их субстанций;
* обеспечение стандартности условий проведения исследований спороцидной активности ДС, СС и их субстанций;
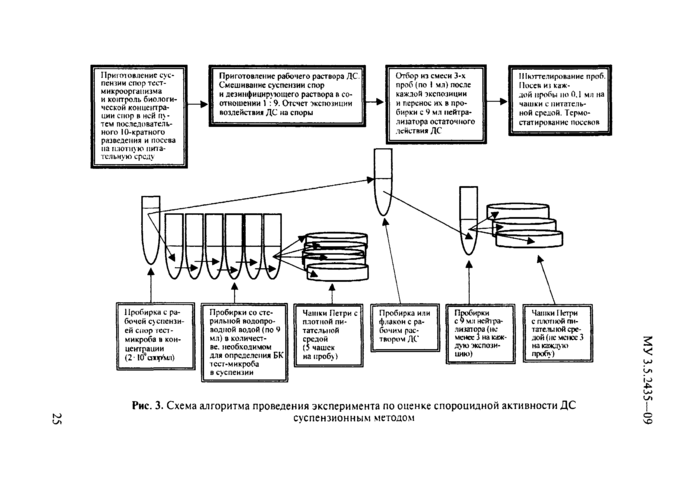
• методы исследований и оценку результатов спороцидной активности ДС, СС и их субстанций in vitrv (суспензионный метод, метод батистовых тест-объекгов) и спектра спороцидной активности;
* методы исследований и оценку спороцидной эффективности ДС при разработке режимов обеззараживания объектов внешней среды, контаминированных тест-микроорганизмами в споровой форме;
* методы исследований спороцидной эффективности СС при разработке режимов стерилизации ИМН, включая эндоскопы;
• методы исследований спороцидной активности СС, предназначенных для ДВУ эндоскопов.
Для применения спороцидных ДС в очагах искусственного происхождения (биотерроризм) разработанные режимы (дезин-фектологические технологии) должны корректироваться в специальных лабораториях, изучающих возможные споровые биологические рецептуры и связанные с этим специфические особенности дезинфекции в очагах заражения.
Организации, проводящие исследования спороцидной активности и эффективности химических ДС, СС и их субстанций, в от-
четной документации, представляемой для регистрации и сертификации средств, должны представлять конкретные результаты оценки стандартности использованных в исследованиях спор тест-микроорганизмов, а также эффективности нейтрализации ДВ использованного нейтрализатора.
3. Тест-микроорганизмы для изучения и оценки спороцидной активности ДС, СС и их субстанций
При изучении спороцидной активности ДС и их субстанций в качестве тест-микроорганизмов используют:
• Bacillus cereus, шт. 96;
• Bacillus subtilis, шт. 7;
• сибиреязвенная живая сухая вакцина СТИ-1 для людей;
• Bacillusanthracis, шт. 81/1 (рХОП, рХ02+), или шт. 27 (рХ01\ рХ02+).
При изучении спороцидной активности СС и их субстанций в качестве тест-микроорганизмов используют:
• Bacillus cereus, шт. 96;
• Bacillus subtilis, шт. 7;
• Bacilluslicheniformis, шт. G BKM В-171 ID;
• Geobacillis stearothermophUis, шт. BKM B-718.
Тест-микроорганизмы выбирают в зависимости от действующего вещества (ДВ) и от назначения спороцидного ДС, СС и его субстанции.
3.1. Требования к тест-микроорганизмам
Тест-микроорганизмы должны иметь типичные морфологические, культуральные, биохимические свойства, присущие данному виду (прилож. 1), и обладать стандартной устойчивостью к эталонным ДС и СС [ 10]: хлорамину 10 %, перекиси водорода 6 %, глутаро-вому альдегиду 2,5 % (pH 7,2), сухому горячему воздуху при (160 + 3) °С, водяному текучему пару при 100 'С, водяному насыщенному пару под избыточным давлением при (121 ± 1) °С.
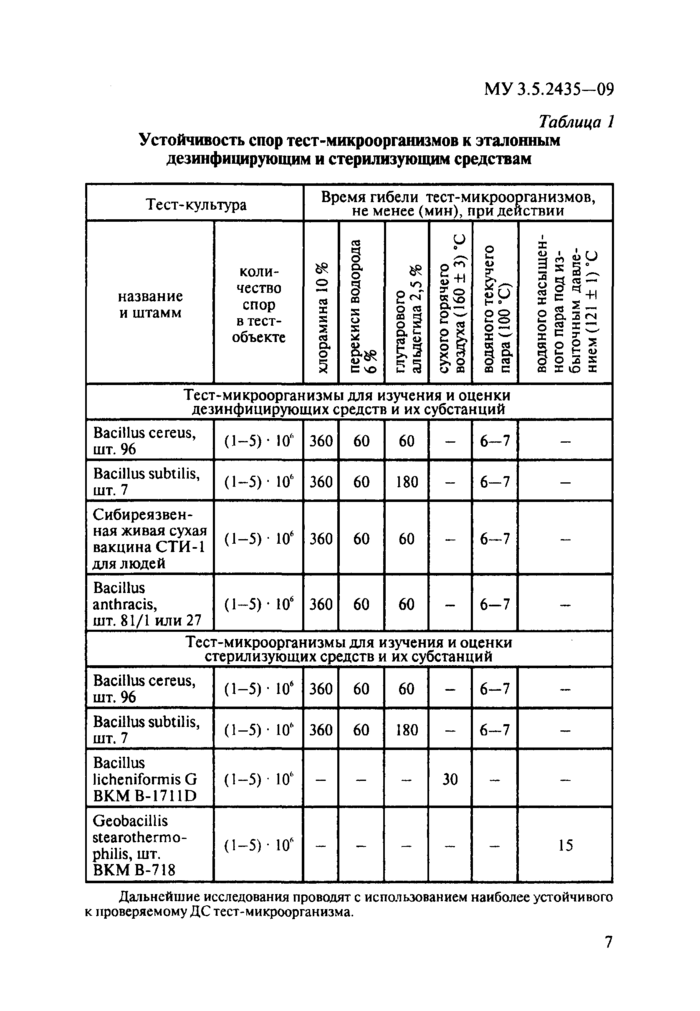
Показатели устойчивости тест-микроорганизмов к вышеперечисленным средствам приведены в табл. 1.
Музейные штаммы тест-микроорганизмов хранят в холодильнике при температуре (6 ± 2) °С в виде сухой культуры в ампулах (после лиофильной сушки) не более двух лет [13].
Тест-микроорганизмы, не обладающие указанной устойчивостью, подлежат замене.
Спороцидную активность ДС, СС и их субстанций определяют, используя тест-микроорганизмы в споровой форме [12].
6
МУ 3.5.2435-09
Устойчивость спор тест-микроорганизмов к эталонным дезинфицирующим и стерилизующим средствам
|
Таблица 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Дальнейшие исследования проводят с использованием наиболее устойчивого к проверяемому ДС тест-микроорганизма. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Методика приготовления суспензии спор тест -микроорганизмов
Для получения тест-микроорганизмов в споровой форме их выращивают на питательных средах, приведенных в табл. 2.
Питательные среды д ля выращивания тест-микроорганизмов в споровой форме
|
Таблица 2 | ||||||||||||||||
|
Перечень компонентов и методика приготовления питательных сред для культивирования тест-микроорганизмов, предназначенных для изучения и оценки спороцидной активности ДС, СС и их субстанций, приведены в прилож. 2.
Процесс приготовления суспензии спор тест-микроорганизма, используемого при исследовании и оценке спороцидной активности ДС, СС и их субстанций, включает три последовательных этапа:
• получение бульонной культуры из музейной лиофилизиро-ванной или агаровой культуры тест-микроорганизма;
• получение споровой агаровой культуры тест-микроорганизма;
• приготовление суспензии спор тест-микроорганизма и оценка соответствия ее требованиям.
При использовании лиофилизированной споровой культуры ампулы с этой культурой вскрывают в асептических условиях следующим образом: тампоном ваты, смоченным этиловым спиртом, обрабатывают поверхность ампулы, затем нагревают ее запаянный конец над пламенем. К накаленному концу ампулы прикладывают ватную пробку, смоченную стерильной водой, чтобы на ампуле образовалась трещина. Металлическим инструментом (скальпель,
МУ 3.5.2435—09
пинцет) откалывают по трещине конец ампулы. После этого стерильной пастеровской пипеткой в ампулу вливают 0,2 мл стерильной питьевой воды и оставляют на 30 мин при комнатной температуре. Для получения суспензии спор содержимое ампулы перемешивают с помощью стерильной бактериологической петли.
Полученную таким образом в ампуле суспензию спор тест-микроорганизма отсасывают стерильной пастеровской пипеткой и переносят по 1—2 капли в две пробирки с 5 мл питательного бульона (бульон Хоттингера, сухой питательный бульон - СПБ, мясо-пептонный бульон МПБ), содержащего 0,5 % глюкозы.
При работе с возбудителем сибирской язвы для приготовления суспензии спор ампулы с высушенными культурами вскрывают в помещении музея (коллекции) живых культур. Манипуляции проводят в боксе биологической безопасности. При этом оттянутый конец ампулы нагревают над пламенем газовой горелки; затем влажным концом стерильного ватного тампона прикасаются к нагретой части, в результате чего появляются трещины. Конец ампулы накрывают трехслойной марлевой салфеткой, смоченной дезинфицирующим раствором и хорошо отжатой, и обламывают пинцетом.
После вскрытия ампула остается накрытой той же салфеткой в течение 1—2 мин. Затем салфетку осторожно снимают и вместе с остатками стекла погружают в дезинфицирующий раствор. Вскрытую ампулу накрывают стерильным марлевым тампоном на 1—2 мин. Затем в ампулу вносят 0,2 мл стерильной питьевой воды для приготовления суспензии спор, которую далее высевают в жидкие питательные среды, как указано выше.
Посевы G. stearothermophilis инкубируют при температуре (55 ± 1) “С, а А се reus, A subtilis, A anthracis и A licheniformis - при температуре (37 ± 1) °С в течение 24—48 ч.
Бульонные культуры тест-микроорганизмов бактериологической петлей или пастеровской пипеткой (по 1—2 капли) пересевают в пробирки на скошенную питательную среду (сухой питательный агар — СПА, мясо-пептонный агар — МПА). Посевы инкубируют в течение 24—48 ч, как указано выше.
Для получения спор культур A licheniformis, (?. stearothermophilis в пробирки с посевом необходимого для проведения исследования тест-микроорганизма добавляют 5 мл стерильной дистиллированной воды и смывают культутру, выросшую на твердой питательной среде. Полученную взвесь переносят во флаконы или емкости до 250/500 мл, содержащие соответственно 100/200 мл соответствующего для данного тест-микроорганизма скошенной твердой (агаровой) питательной среды (табл. 2).
9