МУ 2.3.2.3388-16
Медико-биологическая оценка безопасности генно-инженерно-модифицированных организмов растительного происхождения с комбинированными признаками
Купить МУ 2.3.2.3388-16 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания устанавливают требования к проведению оценки безопасности ГМО с комбинированными признаками.
Требования, изложенные в Методических указаниях, применяются на этапе государственной регистрации ГМО с комбинированными признаками, впервые поступающих на продовольственный рынок Российской Федерации.
Методические указания разработаны с целью обеспечения единой, научно обоснованной системы оценки безопасности ГМО с комбинированными признаками и учитывают новые методические подходы, как используемые в России, так и рекомендованные международными организациями.
Оглавление
I. Общие положения и область применения
II. Проведение оценки безопасности ГМО с комбинированными признаками
III. Экспертный анализ и оценка данных, характеризующих ГМО с комбинированными признаками
IV. Методы обнаружения, идентификации и количественного определения ГМО с комбинированными признаками в пищевых продуктах
V. Медико-генетическая оценка ГМО с комбинированными признаками
VI. Оценка функционально-технологических свойств ГМО с комбинированными признаками
VII. Медико-биологическая оценка безопасности ГМО с комбинированными признаками
Список литературы
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 05.05.2017 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15
стр. 16
стр. 17

стр. 18
стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
Государственное санитарно-эпидемиологическое нормирование _Российской Федерации_
2.3.2. ГИГИЕНА. ГИГИЕНА ПИТАНИЯ. ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ И ПИЩЕВЫЕ ПРОДУКТЫ
Медико-биологическая оценка безопасности генно-инженерно-модифицированных организмов растительного происхождения с комбинированными признаками
Методические указания МУ 2.3.2.3388—16
Издание официальное
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
2.3.2. ГИГИЕНА. ГИГИЕНА ПИТАНИЯ. ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ И ПИЩЕВЫЕ ПРОДУКТЫ
Медико-биологическая оценка безопасности генно-инженерно-модифицированных организмов растительного происхождения с комбинированными признаками
Методические указания МУ 2.3.2.3388—16
• результаты оценки безопасности нативного продукта (данные 90-дневных исследований на грызунах, данные исследований на молодых быстро растущих животных (цыплятах-бройлерах, ягнятах и др.) в случае, если такие исследования проводились;
• результаты других токсикологических исследований.
3.4. Анализ результатов аллергологических исследований проводится на основании сведений, представленных заявителем или представленных на этапе регистрации исходных ГМ-линий (для ГМО, полученных гибридизационным методом, в случае, если все исходные ГМ-линии имеют свидетельства о государственной регистрации на территории Таможенного Союза), включающих:
• результаты оценки аллергенных свойств белков, определяющих проявление заданных признаков ГМО (сравнение с известными аллергенами с использованием баз данных, содержащих информацию о трехмерной структуре и функции известных аллергенов и родственных им белков); определение потенциальной аллергенности белков в иммуно-химических исследованиях in vitro с использованием IgE, выделенных из сыворотки крови пациентов, страдающих аллергией; определение устойчивости к воздействию протеолитических ферментов (пепсина и др.); скрининговые исследования с использованием сывороток крови пациентов, страдающих аллергией; дополнительные исследования (в том числе in vivo);
• результаты аллергологических исследований нативного продукта (сравнение набора аллергенов исследуемого ГМО с набором аллергенов его традиционного аналога и др.) в случае, если такие исследования проводились;
• результаты других аллергологических исследований.
3.5. Анализ результатов других исследований (в случае, если такие исследования были выполнены) проводится на основании сведений, представленных заявителем, или представленных на этапе регистрации исходных ГМ-линий, включая результаты применения новейших аналитических методов, таких как профильные технологии и др.
3.6. Анализ результатов пострегистрационного мониторинга, осуществляемого в странах, где ГМО был зарегистрирован ранее, проводится в случае, если в процессе мониторинга были получены данные о незаданных эффектах генетической модификации.
3.7. Анализ научных данных о ГМО с комбинированными признаками, представленных в научной литературе за весь период его использования; анализ научных данных об исходных ГМ-линиях за период, прошедший после их первичной регистрации.
МУ 2.3.2.3388—16
IV. Методы обнаружения, идентификации и количественного определения ГМО с комбинированными признаками в пищевых продуктах
4.1. Основным методом, используемым для обнаружения, идентификации и количественного определения ГМО, является полимеразная цепная реакция (ПЦР) и ее модификации. Также для обнаружения ГМО в пищевых продуктах и продовольственном сырье, не подвергавшихся технологической переработке, могут быть использованы иммунологические методы детекции специфичных для ГМО белков.
4.2. Экспертная оценка методов идентификации ГМО с комбинированными признаками направлена на подтверждение их адекватности инструментальной и методической базе, используемой в учреждениях Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека для контроля за обращением ГМО и маркировкой пищевых продуктов, содержащих ГМО.
4.3. Экспертная оценка методов обнаружения, идентификации и количественного определения ГМО с комбинированными признаками в пищевых продуктах проводится на основании сведений, представленных заявителем, включающих:
• метод идентификации одного или нескольких трансформационных событий (событие-специфичные тест-системы);
• метод количественного определения одного или нескольких трансформационных событий (событие-специфичныс тест-системы);
• протоколы проведения анализов;
• описание праймеров, ДНК-зондов и других необходимых реактивов;
• стандартные образцы состава и свойств.
4.4. Экспертная оценка методов обнаружения, идентификации и количественного определения ГМО, полученных гибридизационным методом (если все исходные ГМ-линии имеют свидетельства о государственной регистрации на территории Таможенного Союза) производится только в случае, если методы обнаружения, идентификации и количественного определения зарегистрированных исходных ГМ-линий с момента их регистрации были модифицированы, усовершенствованы или разработаны вновь.
4.4.1. Идентификация ГМО с комбинированными признаками, полученных гибридизационным методом, сложна по сравнению с идентификацией ГМО, полученных молекулярным и трансформационным методами, поскольку вставки рекомбинантной ДНК и их локализация в геноме гибридизационного события идентичны исходным ГМ-линиям.
Результаты ПЦР-анализа таких ГМО укажут на присутствие в образце родительских линий ГМО, как если бы образец содержал их смесь, что делает возможной идентификацию ГМО, полученных гибридизацион-ным методом, только на основании экспертизы документации.
V. Медико-генетическая оценка ГМО с комбинированными признаками
5.1. Медико-генетическая оценка ГМО с комбинированными признаками включает проверку присутствия всех заявленных генетических конструкций методом ПЦР.
5.2. Медико-генетические исследования проводятся на основании сведений, представленных заявителем, включающих:
• описание молекулярной структуры всех заявленных генетических конструкций (нуклеотидная последовательность);
• метод идентификации и количественного определения одного или нескольких трансформационных событий;
• протокол проведения анализа;
• описание праймеров, ДНК-зондов и других необходимых реактивов;
• стандартные образцы состава и свойств.
5.3. Заключение о результатах медико-генетической оценки ГМО с комбинированными признаками оформляется в виде отчета в соответствии с требованиями Межгосударственного стандарта ГОСТ 7.32-2001.
VI. Оценка функциопалыю-технологических свойств ГМО с комбинированными признаками
6.1. Перечень и объем исследований по разделу VI определяются экспертными (учеными) советами соответствующих аккредитованных испытательных центров Российской Федерации на основании анализа представленных материалов, индивидуально для каждого вида исследуемых продуктов.
6.2. Проводится сравнение функционально-технологических свойств ГМО со свойствами его традиционного аналога. Для ГМО, полученного гибридизационным методом, проводится сравнение его функциональнотехнологических свойств со свойствами традиционных аналогов исходных ГМ-линий.
6.3. Изучаемые функционально-технологические свойства (в соответствии со стандартами на конкретный вид исследуемых продуктов):
• сравнительная органолептическая оценка;
• сравнительная характеристика реологических свойств исследуемого продукта и/или его отдельных фракций;
МУ 2.3.2.3388—16
• сравнительная оценка физико-химических свойств исследуемого продукта и/или его отдельных фракций.
6.4. Заключение о результатах оценки функционально-технологических свойств ГМО с комбинированными признаками оформляется в виде отчета в соответствии с требованиями Межгосударственного стандарта ГОСТ 7.32-2001.
VII. Медико-биологическая оценка безопасности ГМО с комбинированными признаками
7.1. Перечень и объем исследований по разделу VII определяются экспертными (учеными) советами соответствующих аккредитованных испытательных центров Российской Федерации на основании анализа представленных материалов.
7.2. Гигиенические исследования ГМО с комбинированными признаками включают определение показателей качества и безопасности:
7.2.1. Перечень показателей безопасности формируется на основании требований Технических регламентов Таможенного Союза (ТР ТС 021/2011 «О безопасности пищевой продукции» и/или соответствующих Технических регламентов, устанавливающих обязательные требования к отдельным видам пищевой продукции).
Изучаемые показатели:
• содержание токсичных элементов;
• содержание микотоксинов;
• содержание пестицидов;
• содержание радионуклидов;
• содержание вредных примесей;
• микробиологические показатели;
• другие показатели (в случае необходимости).
7.2.2. Перечень показателей качества формируется на основании свойств соответствующего растительного организма, а также анализа представленных заявителем материалов. В случае если заявителем представлены исчерпывающие данные по оценке композиционной эквивалентности ГМО (содержание белка, аминокислотный состав, содержание жира, жирнокислотный состав, углеводный состав, содержание витаминов, макро- и микроэлементов, специфических компонентов, биологически активных веществ, антинутриентов и других веществ, характерных для растений данного вида), исследования могут быть ограничены определением влажности, золы, содержания белка, жира, углеводов, пищевых волокон.
7.2.3. В случае если генетическая модификация направлена на изменение химического состава ГМО с комбинированными признаками, должны быть проведены исследования, подтверждающие заявленные изменения.
7.3. Изучение репродуктивной токсичности и токсичности ГМО с комбинированными признаками проводится в эксперименте на крысах линии Вистар. Токсикологические исследования включают изучение репродуктивной функции крыс поколения F0, пре- и постнатальное развитие потомства поколения F|, а также оценку физиолого-биохимических показателей крыс поколения Fo (на основании данных о динамике массы тела, об абсолютной и относительной массе внутренних органов; данных гематологических, морфологических и биохимических исследований, состояния антиоксидантного статуса и функционального состояния систем, осуществляющих защиту организма от воздействия токсичных соединений экзо- и эндогенного происхождения).
7.3.1. Схема проведения эксперимента.
|
Вид животных |
Крысы линии Вистар |
|
Пол |
Самцы, самки |
|
Возраст |
25—30 дней |
|
Исходная масса тела |
70—80 г |
|
Количество животных в группе в начале эксперимента |
Не менее 80 особей в каждой группе: 55 25 S Все животные должны быть выбраны из пометов со сходной численностью и выживаемостью потомства. При невозможности такой стандартизации количество животных в группах должно быть увеличено не менее чем в 2 раза: НО 50 S |
|
Распределение по группам |
Животных делят на 2 группы: группа «контроль» получает рацион с включением традиционного аналога исследуемого ГМО; группа «опыт» получает рацион с включением исследуемого ГМО |
|
Рацион |
Пищевая и биологическая ценность рациона полностью удовлетворяет физиологические потребности животных |
|
Карантин |
Не менее 7 дней |
|
Условия содержания |
Животные получают свободный доступ к корму и воде; содержатся в отапливаемом, вентилируемом помещении |
|
Отбор материала для гематологических, биохимических, морфологических исследований |
У самцов поколения F0 не ранее чем на 100-й день эксперимента. Количество животных, взятых на исследование, должно составлять не менее 20 на группу |
МУ 2.3.2.3388—16
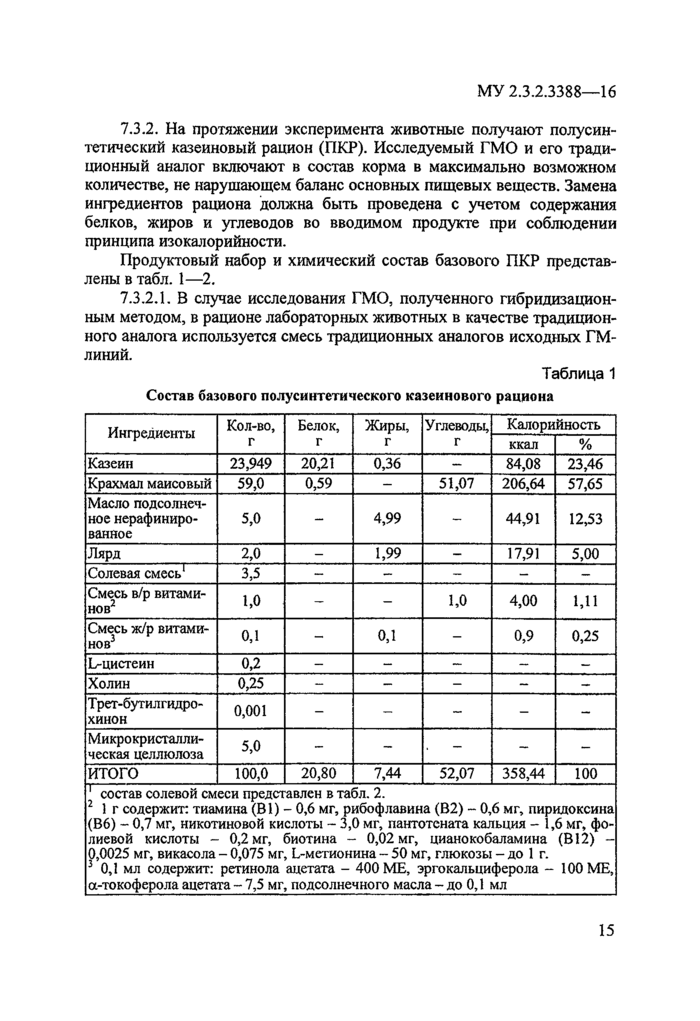
7.3.2. На протяжении эксперимента животные получают полусин-тетический казеиновый рацион (ПКР). Исследуемый ГМО и его традиционный аналог включают в состав корма в максимально возможном количестве, не нарушающем баланс основных пищевых веществ. Замена ингредиентов рациона должна быть проведена с учетом содержания белков, жиров и углеводов во вводимом продукте при соблюдении принципа изокалорийности.
Продуктовый набор и химический состав базового ПКР представлены в табл. 1—2.
7.3.2Л. В случае исследования ГМО, полученного гибридизацион-ным методом, в рационе лабораторных животных в качестве традиционного аналога используется смесь традиционных аналогов исходных ГМ-линий.
Таблица 1
|
Состав базового полусинтетического казеинового рациона | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
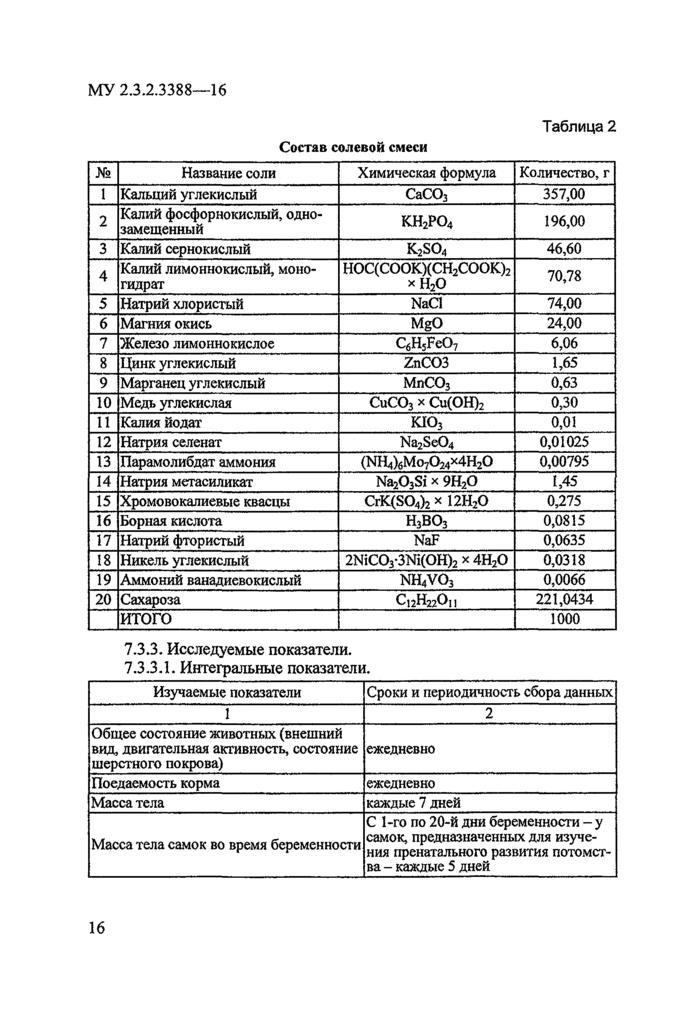
1 состав солевой смеси представлен в табл. 2. 2 1 г содержит: тиамина (В 1) - 0,6 мг, рибофлавина (В2) - 0,6 мг, пиридоксина (В6) - 0,7 мг, никотиновой кислоты - 3,0 мг, пантотсната кальция - 1,6 мг, фолиевой кислоты - 0,2 мг, биотина - 0,02 мг, цианокобаламина (В 12) -0,0025 мг, викасола - 0,075 мг, L-метионина - 50 мг, глюкозы - до 1 г. 3 0,1 мл содержит: ретинола ацетата - 400 ME, эргокальциферола - 100 ME, g-токоферола ацетата - 7,5 мг, подсолнечного масла - до 0,1 мл_ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
15
ББК51.23
M42
M42 Медико-биологическая оценка безопасности ген
но-инженерно-модифицированных организмов растительного происхождения с комбинированными признаками: Методические указания.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2016.—30 с.
ISBN 978—5—7508—1501—2
1. Разработаны ФГБУН «ФИЦ питания и биотехнологии» (Н. В. Тыш-ко, Э. О. Садыкова, А. К. Голомидова, И. В. Гмошинский, А. А. Кочеткова,
В. А. Саркисян, В. А. Тутельян); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (А. Ю. Попова,
И. В. Брагина); Российской академией наук (Г. Г. Онищенко); Институтом биоинженерии, ФГУ «ФИЦ Биотехнологии» РАН (К. Г. Скрябин,
И. В. Яковлева, Б. Б. Кузнецов); МГУ им. М. В. Ломоносова (М. П. Кирпичников).
2. Утверждены руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главным государственным санитарным врачом Российской Федерации А. Ю. Поповой 3 августа 2016 г.
3. Введены впервые.
ББК 51.23
ISBN 978—5—7508—1501—2
© Роспотребнадзор, 2016 © Федеральный центр гигиены и
эпидемиологии Роспотребнадзора, 2016
МУ 2.3.2.3388—16
Содержание
L Общие положения и область применения.........................................................5
II. Проведение оценки безопасности ГМО с комбинированными
признаками..........................................................................................................5
III. Экспертный анализ и оценка данных, характеризующих ГМО
с комбинированными признаками.....................................................................7
IV. Методы обнаружения, идентификации и количественного
определения ГМО с комбинированными признаками в пищевых продуктах...........................................................................................................11
V. Медико-генетическая оценка ГМО с комбинированными признаками.......12
VI. Оценка функционально-технологических свойств ГМО
с комбинированными признаками...................................................................12
VII. Медико-биологическая оценка безопасности ГМО
с комбинированными признаками...................................................................13
Список литературы...................................................................................................28
3
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главный государственный санитарный врач Российской Федерации
А. Ю. Попова
26 июля 2016 г.
2.3.2. ГИГИЕНА. ГИГИЕНА ПИТАНИЯ. ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ И ПИЩЕВЫЕ ПРОДУКТЫ
Медико-биологическая оценка безопасности генно-инженерно-модифицированных организмов растительного происхождения с комбинированными признаками
Методические указания _МУ 23.23388—16_
Появление генно-инженерно-модифицированных организмов растительного происхождения (ГМО) второго поколения, в том числе ГМО с комбинированными признаками, привело к необходимости формирования новых подходов к оценке безопасности и процедуры государственной регистрации таких ГМО в Российской Федерации. Анализ мирового опыта в данной области свидетельствует о необходимости дифференцирования набора исследований в зависимости от метода получения ГМО с комбинированными признаками: 1-й метод - «трансформационный» - новый ген (гены) методом генной инженерии вводят в геном уже существующего и зарегистрированного ранее ГМО; 2-й метод - «молекулярный» - геном растения-донора методом генной инженерии трансформируют с помощью вектора, содержащего два или более генов, отвечающих за новые признаки, или с помощью множественных векторов; 3-й метод - «гибридизационный» - два уже существующих ГМО используют в качестве родительских форм для получения гибрида методами традиционной селекции. Линии, полученные с помощью трансформационного и молекулярного методов, считаются новыми ГМО и подлежат регистрационным испытаниям в полном объеме. Линии, полученные с помощью гибридизации, рассматриваются в разных юрисдикциях по-разному: в США, Канаде, Австралии и Новой Зеландии - как
МУ 2.3.2.3388—16
продукт обычной селекции, не требующий регистрации при условии, что исходные ГМ-линии уже зарегистрированы; в странах Европейского Союза требуется регистрация каждого нового ГМО, полученного с использованием уже зарегистрированных родительских ГМ линий, однако, с точки зрения безопасности рассматриваются только возможные эффекты взаимодействия двух белков (генов), обеспечивающих проявление новых признаков. При регистрации ГМО с комбинированными признаками, полученных гибридизацией трех и более родительских линий (ГМО высокого порядка), автоматически считаются зарегистрированными все возможные комбинации, сформировавшиеся в результате генетической сегрегации таких ГМО (расщепления признаков в поколениях F1 и выше, в соответствии с законами Менделя). Например, при регистрации ГМО, полученного гибридизацией шести родительских линий, должны быть зарегистрированы все 63 возможных гибрида поколения F1, содержащие рекомбинантную ДНК. Подобный подход применяется в Европейском Союзе, Аргентине, Бразилии, Филиппинах, Парагвае, Уругвае и Японии.
На основании анализа отечественного и международного опыта были разработаны требования к оценке безопасности ГМО с комбинированными признаками, соответствующие принципам регулирования использования ГМО для пищевых целей.
I. Общие положения и область применения
1.1. Методические указания устанавливают требования к проведению оценки безопасности ГМО с комбинированными признаками.
1.2. Требования, изложенные в настоящих Методических указаниях, применяются на этапе государственной регистрации ГМО с комбинированными признаками, впервые поступающих на продовольственный рынок Российской Федерации.
1.3. Методические указания разработаны с целью обеспечения единой, научно обоснованной системы оценки безопасности ГМО с комбинированными признаками и учитывают новые методические подходы, как используемые в России, так и рекомендованные международными организациями.
И. Проведение оценки безопасности ГМО с комбинированными признаками
2.1. Перечень и объем исследований при оценке безопасности ГМО с комбинированными признаками определяются с учетом следующих факторов:
5
• метода получения ГМО (трансформационный метод, молекулярный метод, гибридизационный метод);
• наличия государственной регистрации исходных ГМ-линий на территории Таможенного Союза - для ГМО, полученных гибридизаци-онным методом.
2.2. В случае если ГМО с комбинированными признаками получен трансформационным или молекулярным методом, оценка его безопасности проводится в соответствии с разделами Ш—VII данных Методических указаний и включает в себя следующие этапы:
• экспертный анализ и оценку данных, представленных заявителем, содержащих сравнение химического состава ГМО и его традиционного аналога (композиционная эквивалентность), результаты токсикологических, аллергологических и других исследований, результаты пострегистрационного мониторинга в стране-заявителе и других странах;
• экспертную оценку методов обнаружения, идентификации и количественного определения ГМО;
• медико-генетическую оценку ГМО;
• оценку функционально-технологических свойств ГМО;
• медико-биологическую оценку безопасности ГМО.
2.3. В случае если ГМО с комбинированными признаками получен гибридизационным методом и исходные ГМ-линии имеют свидетельства о государственной регистрации на территории Таможенного Союза, оценка его безопасности проводится в соответствии с разделами П1—IV данных Методических указаний и включает в себя следующие этапы:
• экспертный анализ и оценку данных, представленных заявителем или представленных на этапе регистрации исходных ГМ-линий (для ГМО, полученных гибридизационным методом, в случае, если все исходные ГМ-линии имеют свидетельства о государственной регистрации на территории Таможенного Союза), включающих: сравнение химического состава исходных ГМ-линий с химическим составом их традиционных аналогов (композиционная эквивалентность), результаты токсикологических, аллергологических и других исследований, результаты пострегистрационного мониторинга, осуществляемого в странах, где ГМО с комбинированными признаками был зарегистрирован ранее, в случае, если в процессе мониторинга были получены данные о незаданных эффектах генетической модификации;
• экспертная оценка методов обнаружения, идентификации и количественного определения ГМО;
6
МУ 2.3.2.3388—16
• подтверждение соответствия показателей качества и безопасности ГМО (содержание токсичных элементов, микотоксинов, радионуклидов, пестицидов и др.) требованиям Технических регламентов Таможенного Союза (ТР ТС 02ШОП «О безопасности пищевой продукции» и/или соответствующих Технических регламентов, устанавливающих обязательные требования к отдельным видам пищевой продукции);
• заключение о результатах оценки безопасности ГМО с комбинированными признаками, оформленное в виде отчета в соответствии с требованиями Межгосударственного стандарта ГОСТ 7.32-2001. При формировании отчета должны быть соблюдены требования к конфиденциальности информации, предоставленной на этапе регистрации исходных ГМ-линий.
2.4. Регистрация ГМО с комбинированными признаками, полученного методом гибридизации трех и более линий, уже зарегистрированных на территории Таможенного союза, означает регистрацию и всех возможных комбинаций этих линий, сформировавшихся в результате генетической сегрегации (расщепления признаков в поколениях F1 и выше, в соответствии с законами Менделя).
2.5. В случае если ГМО с комбинированными признаками получен гибридизационным методом и одна или несколько исходных ГМ-линий не имеют свидетельства о государственной регистрации на территории Таможенного Союза, оценка безопасности такого ГМО проводится в полном объеме, в соответствии с п. 2.2 данных Методических указаний.
2.6. Для проведения исследований, предусмотренных п. 2.2 и 2.3 настоящих Методических указаний, заявитель представляет в аккредитованную лабораторию образцы ГМО и их традиционных аналогов в количестве, достаточном для выполнения полного объема исследований.
IIL Экспертный анализ и оценка данных, характеризующих ГМО с комбинированными признаками
3.1. Общая характеристика ГМО с комбинированными признаками включает экспертный анализ данных, представленных заявителем или представленных на этапе регистрации исходных ГМ-линий (для ГМО, полученных гибридизационным методом, в случае, если все исходные ГМ-линии имеют свидетельства о государственной регистрации на территории Таможенного Союза), включающих:
• информацию, позволяющую идентифицировать ГМО (вид, сорт, событие, исходные ГМ-линии, характеристика отличий от немодифици-рованного организма);
7
• информацию об исходном организме (таксономическая характеристика, описание способа размножения и распространения, данные о токсических, аллергенных и других неблагоприятных свойствах);
• информацию об организмах-донорах вносимых генов (таксономическая характеристика, история использования);
• информацию о методах генетических модификаций и способах получения ГМО и исходных ГМ-линий (описание методов модификаций, структур векторов, структур вставок);
• информацию о ГМО и исходных ГМ-линиях (описание свойств, приобретенных растениями в результате модификаций, описание структур встроенных генетических конструкций и мест их локализации, характеристику экспрессии встроенных генов (экспрессия в процессе онтогенеза растения, экспрессия в структурных компонентах растения идр.);
• информацию о потенциально возможном взаимодействии встроенных генетических элементов и белков-продуктов генов (при наличии такой информации), а также результатах их взаимодействия.
3.1.1. Для ГМО, полученных молекулярным, трансформационным или гибридизационным (если одна или несколько исходных ГМ-линий не имеют свидетельства о государственной регистрации на территории Таможенного Союза) методами, дополнительно должны быть проанализированы данные о генетической и фенотипической стабильности (должны быть представлены данные, полученные в результате исследований нескольких поколений ГМО).
3.2. Оценка композиционной эквивалентности проводится на основании информации о результатах сравнения химического состава ГМО с химическим составом его традиционного аналога, представленной заявителем. Для ГМО, полученных гибридизационным методом (если все исходные ГМ-линии имеют свидетельства о государственной регистрации на территории Таможенного Союза), оценка композиционной эквивалентности производится на основании информации о результатах сравнения химического состава исходных ГМ-линий с химическим составом их традиционных аналогов, представленной на этапе регистрации исходных ГМ-линий.
3.2.1. Оценка композиционной эквивалентности проводится по следующим параметрам:
• содержание белка;
• аминокислотный состав;
• содержание жира;
МУ 2.3.2.3388—16
• жирнокислотный состав;
• содержание углеводов;
• содержание макро- и микроэлементов;
• содержание биологически активных веществ;
• содержание аллергенов, характерных для исходного вида (сорта);
• содержание антропогенных и природных контаминантов (токсичных элементов, микотоксинов, пестицидов, радионуклидов, вредных примесей и др.);
• содержание антинутриентов и других веществ, характерных для растительных организмов исходного вида (сорта).
3.2.2. Перечень показателей варьируется в зависимости от свойств изучаемого растительного организма.
3.2.3. Оценка композиционной эквивалентности ГМО и его традиционного аналога проводится с учетом биологических колебаний значений показателей, характерных для растений данного вида, и справочных данных о химическом составе исходного вида (сорта) растения.
3.2.4. В случае если целью генетической модификации является изменение нутриентного состава растения или его частей (листьев, плодов и др.), этот фактор необходимо учитывать при оценке композиционной эквивалентности.
3.3. Анализ результатов токсикологических исследований проводится на основании сведений, представленных заявителем или представленных на этапе регистрации исходных ГМ-линий (для ГМО, полученных гибридизационным методом, в случае, если все исходные ГМ-линии имеют свидетельства о государственной регистрации на территории Таможенного Союза), включающих:
• результаты оценки безопасности белков, определяющих проявление заданных признаков ГМО (молекулярная и биохимическая характеристика белков; наличие или отсутствие гомологии с токсинами белковой природы, а также с белками, обладающими фармакологической или иной биологической активностью (при использовании баз данных PIR, EMBL, SwissProt, GenBank и др.); изучение стабильности белков при обработке, хранении, технологической переработке; влияние температуры и pH, возможные модификации и/или образование стабильных белковых фрагментов в результате различных воздействий; устойчивость белков к обработке протеолитическими ферментами в эксперименте in vitro; исследования острой пероральной токсичности белков в эксперименте на грызунах и др.);
9