МУ 2.3.2.2306-07
Медико-биологическая оценка безопасности генно-инженерно-модифицированных организмов растительного происхождения
Купить МУ 2.3.2.2306-07 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания устанавливают требования к проведению оценки безопасности генно-инженерно-модифицированных организмов растительного происхождения.
Зарегистрированы в Минюсте РФ 06.02.2008 г., регистрационный номер 11117.
Оглавление
1 Общие положения и область применения
2 Экспертный анализ и оценка данных, характеризующих заявленные генно-инженерно-модифицированные организмы
3 Методы обнаружения, идентификации и количественного определения генно-инженерно-модифицированных организмов в пищевых продуктах
4 Медико-генетическая оценка инженерно-модифицированных организмов
5 Оценка функционально-технологических свойств генно-инженерно-модифицированных организмов
6 Медико-биологическая оценка безопасности генно-инженерно-модифицированных организмов
Список литературы
| Дата введения | 30.11.2007 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
Организации:
| 30.11.2007 | Утвержден | Главный государственный санитарный врач Российской Федерации | 80 |
|---|---|---|---|
| Разработан | Московский государственный университет прикладной биотехнологии | ||
| Разработан | Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека | ||
| Разработан | ГОУ ВПО ММА им. И.М. Сеченова | ||
| Разработан | ГУ НИИ питания РАМН | ||
| Разработан | ГУ НИИ вакцин и сывороток им. И.И. Мечникова РАМН | ||
| Издан | Роспотребнадзор | 2008 г. | |
| Разработан | Центр Биоинженерия РАН |
- Федеральный закон 52-ФЗ О санитарно-эпидемиологическом благополучии населения
- МУК 2.3.2.970-00 Медико-биологическая оценка пищевой продукции, полученной из генетически модифицированных источников
- СанПиН 2.3.2.1078-01 Гигиенические требования безопасности и пищевой ценности пищевых продуктов
- МУК 4.2.2304-07 Методы идентификации и количественного определения генно-инженерно-модифицированных организмов растительного происхождения
- Федеральный закон 29-ФЗ О качестве и безопасности пищевых продуктов
- МУК 4.2.2305-07 Определение генетически модифицированных микроорганизмов и микроорганизмов, имеющих генетически модифицированные аналоги, в пищевых продуктах методами полимеразной цепной реакции (ПЦР) в реальном времени и ПЦР с электрофоретической детекцией
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24
стр. 25

стр. 26

стр. 27
стр. 28

стр. 29

стр. 30
Страница 1
2.3.2. ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ И ПИЩЕВЫЕ ПРОДУКТЫ
Медико-биологическая оценка безопасности генно-инженерно-модифицированных организмов растительного происхождения
Методические указания МУ 2.3.2.2306—07
Страница 2
МУ 2.3.2.2306—07
1. Разработаны: Государственным учреждением НИИ питания Российской академии медицинских наук (В. Л. Тутельян. И. Н. Аксюк.
A. В. Васильев. М. М. Г. Гаппаров. И. В. Гмошинский. В. М. Жминченко. Л. В. Кравченко. R. К. Мазо, R. II. Сапрыкин, К. IO. Сорокина, II. R. Тыш-ко, С. А. Хотимченко); Государственным учреждением НИИ вакцин и сывороток им. И. И. Мечникова Российской академии медицинских наук (В. Ф. Семенов, М. R. Врицина, II. С. Захарова); Федеральной службой но надзору в с<|»срс защиты прав потребителей и благополучия человека (Г. Г. Онищенко. Л. II. Гульченко, Г. К. Иванов); Государственным образовательным учреждением высшего профессионального образования Московской медицинской академией им. И. М. Сеченова Федерального агентства по здравоохранению и социальному развитию (Б. П. Суханов); Центром «Биоинженерия» Российской академии наук (К. Г. Скрябин.
B. В. Кузнецов); Государегвенным образовательным учреждением высшего профессионального образования Московским государственным университетом прикладной биотехнологии Министерства образования и науки Российской Федерации (И. А. Рогов, II. R. Гурова. R. R. Сучков).
2. Утверждены постановлением Главного государственного санитарного врача Российской Федерации Г. Г. Онищенко 30.11.2007 № ХО.
3. Rведены в действие с 30.11.2007.
4. Зарегистрированы в Министерстве юстиции Российской Федерации 06 февраля 2008 г., репарационный номер 11117.
5. Введены взамен МУК 2.3.2.970—00 «Медико-биологическая оценка пищевой продукции, полученной из генетически модифицированных источников».
2
Страница 3
МУ 2.3.2.2306—07
УТВЕРЖДЕНО Постановлением Главного государственного санитарного врача Российской Федерации от 30 ноября 2007 г. № 80
2.3.2 ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ И ПИЩЕВЫЕ ПРОДУКТЫ
Медико-биологическая оценка безопасности
генно-инженерно-модифицированных организмов растительного происхождения
Методические указания _МУ 2.3.2.2306—07_
1. Общие положения и область применения
1.1. Методические указания устанавливают требования к проведению оценки безопасности генно-инженерно-модифицированных организмов растительного происхождения (ГМО).
1.2. Требования, изложенные в настоящих методических указаниях, применяются на этапе государственной регистрации ГМО. впервые поступающих на продовольственный рынок Российской Федерации.
1.3. Методические указания разработаны с целью обеспечения единой, научно обоснованной системы оценки безопасности ГМО, и учитывают новые методические подходы как разработанные в России, так и рекомендованные международными организациями (ВОЗ, ФЛО и др.) [24,30,31,37,46.47].
2. Экспертный анализ и оценка данных, характеризующих заявленные генно-инженерно-модифицированные организмы
2.1 Общая характеристика ГМО включает анализ информации, представленной заявителем:
• позволяющей идентифицировать ГМО (вид, сорт, трансформационное событие);
• об исходном родительском организме (таксономическая характеристика, описание способа размножения и распространения; данные о токсических. аллергенных и других неблагоприятных свойствах);
• об органнзмах-донорах вносимых генов (таксономическая характеристика, история использования);
3
Страница 4
• о методе генетической модификации (описание метода модификации, структуры вектора, структуры вставки);
• о ГМО (описание свойств, приобретенных растением в результате модификации, описание структуры генетической конструкции (внесенной или удаленной) и места ее локализации, характеристику экспрессии встроенных генов (экспрессия в процессе онтогенеза растения, интенсивность экспрессии в структурных компонентах растения и др.), характеристику различий с родительским организмом (способ размножения, способность к перекрестному опылению, устойчивость к стрессовым воздействиям и др.), характеристику генетической и фенотипической стабильности (должны быть представлены данные, полученные в результате исследований нескольких поколений ГМО), характеристику способности к переносу генов в другие организмы (растения, микроорганизмы).
2.2 Оценка композиционной эквивалентности проводится на основании сведений, представленных заявителем, о результатах сравнения химического состава ГМО с химическим составом его традиционного аналога по следующим параметрам:
• содержание белка;
• аминокислотный состав;
• содержание жира;
• жирно-кислотный состав;
• углеводный состав;
• содержание витаминов;
• содержание макро- и микроэлементов;
• содержание биологически активных веществ;
• содержание аллергенов;
• содержание антропогенных и природных контаминантов (токсичных элементов, микотоксинов, пестицидов, радионуклидов, вредных примесей и др.);
• содержание анти нутриентов и других веществ, характерных для растительных организмов данного вида.
Перечень показателей варьируется в зависимости от свойств изучаемого растительного организма.
2.3 Оценка композиционной эквивалентности ГМО и его традиционного аналога проводится с учетом биологических колебаний значений показателей, характерных для растений данного вида.
2 4. Анализ результатов токсикологических исследований проводится на основании сведений, представленных заявителем, включающих:
• результаты оценки безопасности одного или нескольких белков, определяющих проявление заданных признаков у ГМО (молекулярная и
4
Страница 5
МУ 2.3.2.2306—07
биохимическая характеристика белка; наличие или отсутствие гомологии с токсинами белковой природы, а также с белками, обладающими фармакологической или иной биологической активностью (при использовании баз данных PIR, EMBL, SwissProt, GenBank и др.); изучение стабильности белка при обработке, хранении, технологической переработке; влияние температуры и pH. возможные модификации и/илн образование стабильных белковых фрагментов в результате различных воздействий; устойчивость белка к обработке протеолитическими ферментами в эксперименте in vitro, исследования острой пероральной токсичности белка в эксперименте на грызунах и др.);
• результаты оценки безопасности нативного продукта (данные 90-дневных исследований на грызунах, данные исследований на молодых быстро растущих животных (цыплятах-бройлерах, ягнятах и др.) - в случае, если такие исследования проводились;
• результаты других токсикологических исследований.
2.5 Анализ результатов аллергологических исследований проводится на основании сведений, представленных заявителем, включающих:
• результаты оценки аллергенных свойств одного или нескольких белков, определяющих проявление заданных признаков у ГМО (сравнение с известными аллергенами с использованием баз данных, содержащих информацию о трехмерной структуре и функции известных аллергенов и родственных им белков); определение потенциальной аллергенности белка в иммунохимических исследованиях in vitro с использованием IgE, выделенных из сыворотки крови пациентов, страдающих аллергией; определение устойчивости к воздействию протеолитических ферментов (пепсина); скрининговые исследования с использованием сывороток крови пациентов, страдающих аллергией; дополнительные исследования (вт. ч. in vivo),
• результаты аллергологических исследований нативного продукта (сравнение набора аллергенов исследуемого ГМО с набором аллергенов его традиционного аналога и др.) должны быть проведены в случае, если имеются данные об аллергенных свойствах органнзма-донора.
2.6. Анализ результатов других исследований (в случае, если такие исследования были выполнены) проводится на основании сведений, представленных заявителем, включающих результаты:
• определения пищевой ценности (так как заданные и незаданные эффекты генетической модификации могут являться причиной изменения баланса макро- и микронутриентов, и, следовательно, вести к изменению пищевой ценности продукта);
• применения новейших аналитических методов, таких как профильные технологии и др.
5
Страница 6
2.7 Анализ результатов пострешстраннойного мониторинга в стране-заявителе и других странах, осуществляемого с целью выявления незаданных эффектов генетической модификации, которые не могли быть обнаружены на стадии регистрационных исследований, проводится на основании сведений, представленных заявителем.
3. Методы обнаружения, идентификации и количественного определения генно-инженерно-модифицированных организмов в пищевых продуктах
3.1 Экспертная оценка методов идентификации ГМО направлена на подтверждение их адекватности инструментальной и методической базе, используемой в учреждениях Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека для контроля за обращением ГМО и маркировкой пищевых продуктов, содержащих ГМО.
3.2 Экспертная оценка методов обнаружения, идентификации и количественного определения ГМО в пищевых продуктах проводится на основании сведений, представленных заявителем, включающих:
• метод идентификации одного или нескольких трансформационных событий;
• метод количественного определения одного или нескольких трансформационных событий;
• протоколы проведения анализов;
• описание праймеров;
• стандартные образцы состава и свойств.
4. Медико-генетическая оценка генно-инженерно-модифицированных организмов
4.1. Медико-генетическая оценка ГМО включает проверку присутствия одной или нескольких синтетических генетических конструкций методом полимеразной цепной реакции (ПЦР).
4.2. Медико-генетические исследования проводятся на основании сведений, представленных заявителем, включающих:
• описание молекулярной структуры одной или нескольких синтетических генетических конструкций (нуклеотидная последовательность);
• метод идентификации и количественного определения одного или нескольких трансформационных событий;
• протокол проведения анализа;
• описание праймеров;
• стандартные образцы состава и свойств.
6
Страница 7
МУ 2.3.2.2306—07
5. Опенка функционально-технологических свойств гснно-ннжснсрно-молифпцированных организмов
5.1. Перечень и объем исследовании по разделу 5 определяются экспертными (учеными) советами соответствующих аккредитованных испытательных центров Российской Федерации на основании анализа представленных материалов.
5.2. Изучаемые функциональные свойства:
• pH водной суспензии;
• растворимость;
• реологические свойства водных дисперсий;
• водоудерживающая и жироудерживающая способность;
• критическая концентрация гелеобразования;
• эмульсионная стабильность и др.
Исследования проводят в соответствии с [4, 5. 18, 25]
6. Медико-биологическая опенка безопасности генно-
инженерно-модифицированных организмов
6.1. Перечень и объем исследований по разделу 6 определяются экспертными (учеными) советами соответствующих аккредитованных испытательных центров Российской Федерации на основании анализа представленных материалов.
6.2. Гигиенические исследования ГМО включают определение показателей качества и безопасности
6.2.1. Перечень показателей безопасности определяется на основании требований СанПиН 2.3.2.1078—01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов» для соответствующей группы продуктов.
Изучаемые показатели:
• содержание токсичных элементов;
• содержание микотоксинов;
• содержание пестицидов;
• содержание радионуклидов;
• содержание вредных примесей;
• микробиологические показатели;
• другие показатели (в случае необходимости).
6.2.2 Перечень показателей качества определяется на основании свойств соответствующего растительного организма, а также анализа представленных заявителем материалов. В случае если заявителем пред-
Страница 8
ставлены исчерпывающие данные по оценке композиционной эквивалентности ГМО (содержание белка, аминокислотный состав, содержание жира, жирно-кислотный состав, углеводный состав, содержание витаминов, макро- и микроэлементов, специфических компонентов, биологически активных веществ, анти нутриентов и других веществ, характерных для растений данного вида), исследования могут быть ограничены определением влажности, золы, содержания белка, жира, углеводов, пищевых волокон.
6.2.3. В случае если генетическая модификация направлена на изменение химического состава ГМО, должны быть проведены исследования. подтверждающие заявленные изменения.
6.3. Токсикологические исследования ГМО проводятся в эксперименте на лабораторных животных.
6.3.1. Схема проведения эксперимента
Вид животных
Крысы линии Внстар
Пол
Самцы
Возраст
40—50 дней
Исходная масса тела
70—80 г
Количество животных в группе в начале эксперимента
Не менее 50 особей в каждой группе
Распределение по группам
Животных делят на 2 группы: группа «контроль» получает рацион с включением традиционного аналога исследуемого ГМО;
группа «опыт» получает рацион с включением исследуемого ГМО
Рацион
Пищевая и биологическая ценность рациона полностью удовлетворяет физиологические потребности животных
Карантин
11с менее 7 дней
Условия содержания
Животные получают свободный досту п к корму и воде; содержатся в отапливаемом, вентилируемом помещении
I Тродолжительность эксперимента
180 дней
Забор материала для гематологических. биохимических, морфологических исследований
На 30-й и 180-й дни эксперимента
Количество животных, взятых на исследование
Не менее 10/группу
6.3.2. На протяжении эксперимента животные получают полусин-тетический казеиновый рацион (Г1КР). Исследуемый ГМО и его тради-
Страница 9
МУ 2.3.2.2306—07
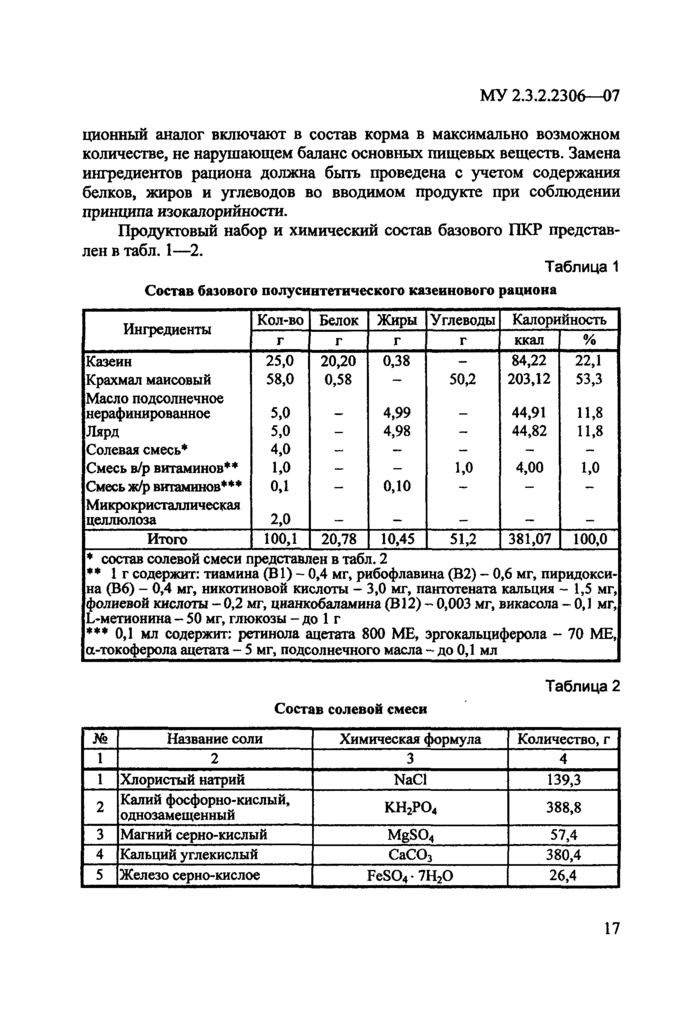
ционный аналог включают в состав корма в максимально возможном количестве, не нарушающем баланс основных пищевых веществ. Замена ингредиентов рациона должна быть проведена с учетом содержания белков, жиров и углеводов во вводимом продукте при соблюдении принципа изокалорийности.
Продуктовый набор и химический состав базового ПКР представлен в табл. 1—2.
Таблица 1
Состав Пазового полусннгсгичсского казеинового рациона
Ингредиенты
Кол-во
Белок
Жиры
Углеводы
Калорийность
г
г
г
г
ккал
%
Казеин
25,0
20,20
0,38
-
84,22
22,1
Крахмал маисовый
58.0
0,58
-
50,2
203,12
53,3
Масло подсолнечное нерафинированное
5.0
4,99
44.91
11,8
Лярд
5.0
-
4,98
-
44.82
11,8
Солевая смесь*
4.0
-
-
-
-
-
Смесь в/p витаминов**
1,0
-
-
1.0
4,00
1.0
Смесь ж/p витаминов***
0.1
-
0,10
-
-
-
Микрокристаллическая
целлюлоза
2,0
_
_
_
_
_
Итого
100,1
20,78
10,45
51,2
381,07
100,0
• состав солевой смеси представлен в табл. 2
** 1 г содержит: тиамина (В 1) - 0,4 мг. рибофлавина (В2) - 0,6 мг. пнридокси-на (В6) - 0.4 мг. никотиновой кислоты - 3.0 мг. пантотената кальция - 1.5 мг. фолиевой кислоты - 0,2 мг, цнанкобаламнна (В12) - 0,003 мг. викасола - 0,1 мг, L-метионнна - 50 мг, глюкозы - до I г
••* 0.1 мл содержит: ретинола ацетата 800 ME, эргокальциферола - 70 ME, g-токоферола ацетата - 5 мг. подсолнечного масла - до 0.1 мл_
Состав соленой смеси
Таблица 2
№
Название соли
Химическая формула
Количеств*), г
1
2
3
4
1
Хлористый натрий
NaCI
139,3
2
Калий фосфорно-кислый, однозамещенный
КН2Р04
388.8
3
Магний серно-кислый
MgS04
57,4
4
Кальций углекислый
СаСОз
380.4
5
Железо серно-кислое
FeS04 7Н20
26,4
Страница 10
Продолжение табл. 2
1
2
3
4
6
Калий йодистый
К1
0.77
7
Марганец серно-кислый
MnS04 7Н20
4,55
8
Цинк серно-кислый
ZnS04 • 7Н:0
0,53
9
Медь серно-кислая
C11SO4 5Н20
0,48
10
Кобальт хлористый
СоС12 6Н20
0,024
11
Натрий фтористый
NaF
0,50
12
Алюмокалиевые квасцы
K2S04Al2(S04b 24Н20
0,11
Итого
1000
6.3.3. Исследуемые показатели:
6.3.3.1. Интегральные показатели
Изучаемые показатели
Периодичность сбора данных
Общее состояние животных (внешний вид, двигательная активность, состояние шерстного покрова)
Каждые 2 дня
Поедаем ость корма
Ежедневно
Масса тела
Каждые 7 дней
Масса внутренних органов (головной мозг, сердце, селезенка, легкие, тимус, гипофиз, печень, почки, надпочечники, семенники)
На 30-й и 180-й дни эксперимента
6.3.3.2. Гематологические показатели
Изучаемые показатели [ 17, 45]
Периодичность сбора данных
- концентрация гемоглобина:
- гематокрит;
- общее количество эритроцитов;
- средний объем эритроцита (СОЭ);
- среднее содержание гемоглобина в эритроците (ССЭ);
- средняя концентрация гемоглобина в эритроците (СКЭ);
- общее количество тромбоцитов;
- общее количество лейкоцитов;
- дифференцированный подсчет лейкоцитов (нейтрофилы, лимфоциты, эозинофилы. моноциты, базофилы)
На 30-й и 180-й дни эксперимента
6.3.3.3. Биохимические показатели
6.3.3.3.I. Общий биохимический анализ крови.
Страница 11
Материал для исследований: сыворотка крови.
Изучаемые показатели (17, 45]
1 [сриодичность сбора данных
- аланинаминотрансфераза (ЛЛТ):
- асиартатамипотрапсфсраза (ACT);
- желчные кислоты;
- фосфатаза щелочная;
- билирубин общий;
- билирубин прямой;
- белок общий;
- альбумин;
- глобулин;
- креатинин;
- глюкоза;
- альфа-амилаза;
- липаза;
- л актатдеги дроге паза:
- общие липиды;
- триглицериды:
- холестерин;
- холинэстераза;
- мочевина;
- хлориды;
- натрий;
- фосфор;
- калий
6.3.3.3.2. Общин анализ мочи. Материал для исследований: моча.
На 30-й и 180-й дни эксперимента
Изучаемые показатели (17, 45]
Периодичность сбора данных
- суточный диурез:
- цвет и прозрачность;
- относительная плотность; -pH;
- белок;
- глюкоза;
- креатинин
На 30-й и 180-й дни эксперимента
1
Страница 12
6.3 3 3.3. Системные биомаркеры
6.З.З.З.З.1. Система антиоксидантной защиты.
Изучаемые показатели
Периодичность сбора данных
Активности ферментов антиоксидантной защити Материи7 для исследований: эритроциты [15, 16, 35, 36, 39, 42]
- глутатнонредуктаза;
- глутатион пероксндата;
- супероксиддисмутаза;
- каталаза
('одержание продуктов перекисного окисления липидов. Материю для исаедований: кровь, печень [10, 32, 34]
- малоновый лиальдегнд
На 30-й и 180-й дни эксперимента
6.3.3.3.3.2. Система ферментов метаболизма ксенобиотиков. Материал для исследований: печень.
Изучаемые показатели
Периодичность сбора данных
Активность ферментов 1-й и 2-й фазы метаболизма ксенобиотиков [28, 29, 33, 38, 43]
- общее содержание цитохрома Р-450;
- 7-этоксирезоруфин-О-деэтилаза;
- 7-пентокснрезоруфин-О-деэтилаза;
- UDP-глюкуронозилтрансфераза;
- глутатионтраисфсраза
6.3.3.3.3.3. Система регу ляции апоптоза.
1) Стабильность мембран лизосом.
Материал для исследований: печень.
На 30-й и 180-й дни эксперимента
Изучаемые показатели
Периодичность сбора данных
Общая и неседиментируемая активность ферментов лизосом [6]
- р-галактозидаза;
- р-глюкуронидаза:
- арнлеульфатазы А и В
На 30-й и 180-й дни эксперимента
12
2) Другие методы.
Страница 13
МУ 2.3.2.2306—07
6.3.3.4. Морфологические исследования
Исследуемые органы
Методы исследований (1. 7, 9, 12—14,19—22, 27]
- кожа;
- головной мозг;
- сердце;
- аорта;
- селезенка;
- легкие;
- лимфатические узлы;
- тимус;
- щитовидная железа;
- гипофиз;
- ЖКТ: желудок, гонкая и толстая кишки;
- печень;
- поджелудочная железа:
- почки;
- семенники
На 30-й и 180-й дни эксперимента (плановый забор)
1. Макроскопические исследования
2. Микроскопические исследования:
а) обзорные гистологические исследования
3. Морфометрический анализ
Вскрытие погибших в течение эксперимента животных (внетаиовый забор)
1. Макроскопические исследования
2. Микроскопические исследования (перечень исследуемых органов может быть сокращен до минимально необходимого для усгановлсния причины смерти):
а) обзорные гистологические исследования
Дополнительные исследования
1. Микроскопические исследования:
а) гистохимические исследования;
б) иммуногистохимические исследования клеточных популяций и их производных.
2. Электронно-микроскопические исследования
6.4 Иммунологические исследования ГМО проводятся в эксперименте на мышах линий СВА и С57В1/6 и включают изучение его иммуномодул нрующих и сенсибилизирующих свойств по четырем тестам:
1) действие на гуморальное звено иммунитета - в тесте определения уровня гемагглютининов к эритроцитам барана;
2) действие на клеточное звено иммунитета - в реакции гиперчувствительности замедленного типа (ГЗТ) к эритроцитам барана;
3) действие как сенсибилизирующего агента - в тесте чувствительности к гистамину;
4) действие на естественную резистентность мышей к Salmonella typhimurium (сальмонеллы мышиного тифа).
В табл. 3 представлены сравнительные характеристики мышей линий СВА и C57BI/6.
Таблица 3
Характеристики мышей линий СВА и С57В1/6
Действующий фактор
Линия мышей
СВА
C57BI/6
Эритроциты барана
высокочувствительны
ннзкочувствнтсльны
Гистамин
нс чувствительны
чувствительны
Salmonella lyphim и пит
нс чувствительны
чувствительны
13
Страница 14
6.4.1. Схема проведения эксперимента
Вид животных
Мыши линий СВА и C57BI/6
Пол
Самцы
Возраст
1 [оловозрслмс
Исходная масса тела
18—20 г
Распределение но фуннам
Животных каждой линии делят на 2 группы: фунна «контроль» получает рацион с включением фадиционного аналога исследуемого ГМО: фуппа «опыт» получает рацион с включением исследуемого ГМО
Рацион*
Пищевая и биологическая ценность рациона полное гыо удовлетворяет физиологические потребности животных
Карантин
не менее 7 дней
Условия содержания
Животные получают свободный доступ к корму и воде; содержатся в отапливаемом, вентилируемом помещении
* состав базового рациона приведен в н. 6.3.2
Исследования начинают через 21 день с момента перевода мышей на экспериментальные рационы. В течение эксперимента ведутся наблюдения за поедаемостью корма и общим состоянием животных.
6.4.2. Исследуемые показатели
1) Действие ГМО на гуморальное звено иммунитета.
Через 21 день эксперимента мышам контрольной (не менее 20 животных) и опытной (не менее 20 животных) групп обеих линий внутри-брюшннно вводят 0,5 мл эритроцитов барана (20 млн клеток/мл). Забор крови для исследований проводится на 7-й, 14-й и 21-й день после введения эритроцитов барана. Сыворотку' крови титруют в реакции гемаг-глютинации общепринятым методом [11]. Полученные данные обрабатывают методами вариационной статистики с использованием t-критерия Стьюдента. Результаты приводятся в виде А/ ± т, где А/ - выборочное среднее измеряемых величин, т - стандартная ошибка.
2) Действие ГМО на клеточное звено иммунитета.
Через 21 день эксперимента мышам контрольной (не менее 15 животных) и опытной (не менее 15 животных) групп обеих линий подкожно в межлопаточную область вводят 0,5 мл эритроцитов барана (2 млн клеток/мл). Через пять дней всем мышам в подушечку одной задней лапы вводят разрешающую дозу эритроцитов барана - 0,02 мл (1 млрд клеток/мышь); в контрлатеральную лапу - 0,02 мл 0,95 %-го раствора хлорида натрия. Местную воспалительную реакцию оценивают
Страница 15
МУ 2.3.2.2306—07
через 18—20 ч путем определения массы опытной и контрольной лапок. Интенсивность местной реакции определяют по индексу реакции (ИР) [8]
3) Действие ГМО как сенсибилизирующего агента к гистамину.
Через 21 день эксперимента мышам контрольной (не менее 15 животных) и опытной (не менее 15 животных) групп обеих линий внутрн-брюшинно вводят гистамин гидрохлорид (2,5 мг/мышь в 0.5 мл физиологического раствора). Реакцию учитывают через 24 ч по проценту гибели мышей [40].
4) Действие ГМО на естественную резистентность мышей к S. lyphimiirinm изучают на модели внутри брюшинного заражения мышей десятикратно отличающимися дозами S. lyphimnrium штамм 415. Через 21 день эксперимента мышей контрольной (не менее 30 животных) и опытной (не менее 30 животных) групп обеих линий заражают тремя дозами культуры: 1 000, 100, 10 микробных клеток/мышь. После заражения за животными наблюдают в течение 21 дня. Вычисляют ЛД50, а также процент гибели животных по каждой дозе, затем проводят сравнительный анализ результатов[2].
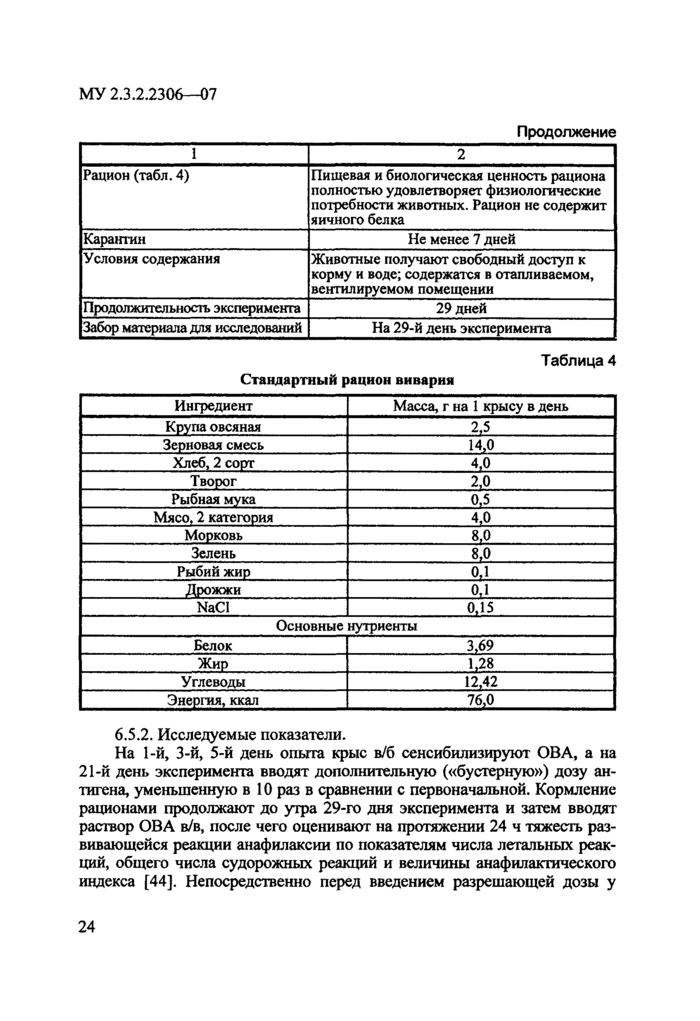
6.5. Аллергологическне исследования ГМО проводятся в эксперименте на лабораторных животных: потенциальную аллергенность оценивают, определяя тяжесть протекания системной анафилаксии и уровня циркулирующих сенсибилизирующих антител (субклассов IgGi + lgG4) у крыс, получающих в составе рациона исследуемый ГМО (группа «опыт») и его традиционный аналог (группа «контроль»). Метод основан на количественной сравнительной оценке тяжести реакции системной анафилаксии, возникающей при внутрибрюшннной (в^б) сенсибилизации взрослых крыс пищевым антигеном - овальбумином куриного яйца (ОВА) - с последующим внутривенным (в^в) введением сенсибилизированным животным разрешающей дозы того же белка [41].
6.5.1. Схема проведения эксперимента
Вид животных
Крысы линии Вистар
1
2
11оя
Самцы
Возраст
11оловозрелые
Исходная масса тела
150—180 г
Количество животных в группе в начале эксперимента
Нс менее 25 особей в каждой фунпс
Распределение по группам
Животных делят на 2 группы: группа «контроль» но;гучаег рацион с включением традиционного аналога исследуемого ГМ(); группа «опыт» получает рацион с включением исследуемого ГМО
Страница 16
Продолжение
1
2
Рацион (табл. 4)
Нишевая и биологическая ценность рациона полностью удовлетворяет физиологические потребности животных Рацион не содержит яичного белка
Карантин
11с менее 7 дней
Условия содержания
Животные получают свободный доступ к корму и воде; содержатся в отапливаемом, вентилируемом помещении
11родолжитслыюсть эксперимента
29 дней
Забор материала для исследовании
11а 29-й день эксперимента
Таблица 4
Стандартный рацион вивария
Ингредиент
Масса, г на 1 крысу в день
Крупа овсяная
2.5
Зерновая смесь
14,0
Хлеб, 2 сорт
4.0
Творог
2,0
Рыбная мука
0.5
Мясо. 2 категория
4,0
Морковь
8.0
Зелень
8.0
Рыбий жир
0,1
Дрожжи
0.1
NaCI
0,15
Основные нутриенты
Белок
3.69
Жир
1.28
Углеводы
12,42
Энергия, ккал
76,0
6.5.2. Исследуемые показатели
На 1-й, 3-й, 5-й день опыта крыс в/б сенсибилизируют ОВА, а на 21-й день эксперимента вводят дополнительную («бустерную») дозу антигена, уменьшенную в 10 раз в сравнении с первоначальной. Кормление рационами продолжают до утра 29-го дня эксперимента и затем вводят раствор ОВА в/в, после чего оценивают на протяжении 24 ч тяжесть развивающейся реакции анафилаксии по показателям числа летальных реакций, общего числа судорожных реакций и величины анафилактического индекса [44]. Непосредственно перед введением разрешающей дозы у
Страница 17
МУ 2.3.2.2306—07
крыс отбирают 0,1—0,2 мл крови из хвостовой вены для определения уровня специфических антител.
Иммуноферментное определение уровней циркулирующих специфических антител к ОВА проводят согласно [3]. Статистическую обработку результатов проводят согласно U-критерию Фишера для долевых показателей, непараметрическим критериям хи-квадрат и Мана-Уитни с использованием пакетов программ Excel и SPSS 11.5.
6.6. Геиотоксикологические исследования ГМО проводятся в эксперименте на лабораторных животных. Оценка потенциальной генотоксич-ности ГМО включает выявление повреждений ДНК и выявление мутагенной активности в эксперименте in vivo. Метод выявления мутагенной активности основан на учете хромосомных аберраций в метафазных клетках пролиферирующих тканей [26]. Регистрация повреждений ДНК предусматривает оценку целостности структуры ДНК методом щелочного гель-электрофореза изолированных клеток (метод ДНК-комет) [23].
6.6.1. Схема проведения эксперимента
Вид животных
Мыши линии С57В1/6
Пол
Самцы
Возраст
Половозрелые
Исходная масса тела
18—20 г
Количество животных в группе в начале эксперимента
Не менее 15 особей в каждой группе
Распределение по группам
Животных делят на 2 группы: группа «контроль» получает рацион с включением традиционного аналога исследуемого ГМО: группа «опыт» получает рацион с включением исследуемого ГМО
Рацион*
Пищевая и биологическая ценность рациона полностью удовлетворяет физиолошчсскис потребности животных
Карантин
Не менее 7 дней
Условия содержания
Животные получают свободный доступ к корму и воде; содержатся в отапливаемом, вентилируемом помещении.
Продолжительность эксперимента
30 дней
Забор материала для исследовании
На 30-й день эксперимента
* состав базового рациона приведен в и. 6.3.2
6.6.2. Исследуемые показатели:
1) в основе метода выявления мутагенной активности лежит регистрация видимых структурных нарушений хромосом в клетках костного мозга на стадии метафазы. Анализируют 100 метафаз от каждого живот-
Страница 18
ного. Учитывают число одиночных и парных фрагментов, хроматндных и хромосомных обменов, ахроматических пробелов (гепов) и разрывов по центромере, число клеток с множественными повреждениями и клеток с полной деструкцией хромосом. Оценку результатов цитогенетического анализа проводят путем сопоставления долей клеток с хромосомными аберрациями в контрольной и опытной группах;
2) регистрация повреждений ДНК предусматривает оценку' целостности структуры ДНК методом щелочного гель-электрофореза изолированных клеток (метод ДНК-комет). Метод основан на регистрации различной подвижности ДНК и возможных фрагментов ДНК лизированных клеток, заключенных в агарозный гель, в постоянном электрическом поле. При этом ДНК мигрирует к аноду, формируя электрофоретический след, напоминающий «хвост кометы», параметры которого зависят от степени поврежденности исследуемой ДНК. Общая схема метода включает получение гель-слайдов (подложки), получение микропрепаратов, лизис, щелочную денатурацию, электрофорез, не^грализа-цию/фиксацию, окрашивание и микроскопический анализ.
Микроскопический анализ проводят на эпифлуоресцентном микроскопе с соответствующими для конкретного красителя фильтрами при увеличении 200х—400х. На каждый микропрепарат анализируют не менее 100 «ДНК-комет». Анализ «ДНК-комет» может проводиться визуально или с помощью программно-аппаратного комплекса.
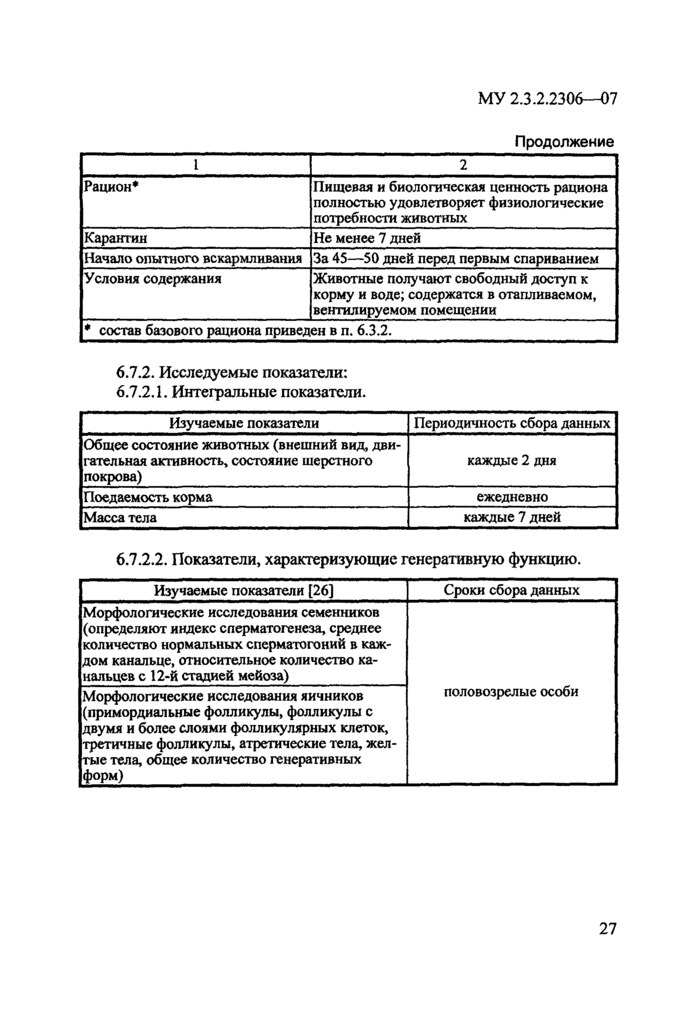
6.7. Исследования репродуктивной токсичности ГМО проводятся в эксперименте на лабораторных животных и включают:
1) изучение влияния на генеративную функцию;
2) изучение эмбриотоксического и тератогенного действий, регистрируемых в пренатальном и постнатальном периодах развития.
6.7.1. Схема проведения эксперимента
Вид животных
Крысы линии Вистар
1
2
Пол
Самцы, самки
Возраст
40—50 дней
Исходная масса тела
70—80 г
Количество животных в группе в
не менее 50 особей в каждой группе 30
начале эксперимента
20 S
Распределение по группам
Животных делят на 2 группы: группа «контроль» получает рацион с включением традиционного аналога исследуемого ГМО;
группа «опыт» получает рацион с включением исследуемого ГМО
Страница 19
МУ 2.3.2.2306—07
Продолжение
1
2
Рацион*
I Ьнцевая и биологическая ценность рациона полностью удовлетворяет физиологические потребности животных
Карантин
Не менее 7 дней
Начало опытного вскармливания
За 45—50 дней перед первым спариванием
Условия содержания
Животные получают свободный доступ к корму и воде: содержатся в отапливаемом, вентилируемом помещении
* состав базового рациона приведен в п. 6.3.2.
6.7.2. Исследуемые показатели: 6.7.2.1. Интегральные показатели
Изучаемые показатели
Периодичность сбора данных
Общее состояние животных (внешний вид, двигательная активность, состояние шерстного покрова)
каждые 2 дня
1 [осдасмос гь корма
ежедневно
Масса тела
каждые 7 дней
6.7.2.2. Показатели, характеризующие генеративную функцию.
Изучаемые показатели (26)
Сроки сбора данных
Морфологические исследования семенников (определяют индекс сперматогенеза, среднее количество нормальных спсрматогоний в каждом канальце, относительное количество канальцев с 12-й стадиен мейоза)
половозрелые особи
Морфологические исследования яичников (примордиальные фолликулы, фолликулы с двумя и более слоями фолликулярных клеток, третичные фолликулы, атретические тела, желтые тела, общее количество генеративных форм)
19
Страница 20
6.7.2.3. Показатели, характеризующие пренатальное
извитие потомства
Изучаемые показателя [26]
Сроки сбора данных
1 Забой и вскрытие нс мснсс 7 беременных самок на группу
19—20-й день беременности
2. Визуальное исследование матки, плаценты, плодов: выявление живых и мертвых плодов, подсчет количества желтых тел, мест имплантации, количество резорбций по правому и левому poiy матки (с последующим вычислением пред- и постимплантационной эмбриональной смертности)
3. Анализ эмбрионального материала (нс мснсс 5 плодов от каждой крысы)
6.7.2.4. Показатели, характеризующие постнатальное развитие потомства
Изучаемые показатели [26]
Сроки сбора данных
1. Контроль рождения потомства
20—22-й дни беременности
2. Учет величины помета в день родов, подсчет количества живых и мертвых крысят, подсчет особей разного пола, установление внешних уродств, измерение массы тела, определение краниокаудаль-ного размера
1 -й день жизни
3. Учет показателей физиологического развития крысят: срок отлипания ушных раковин, появление первичного волосяного покрова, прорезывание резцов, открытие глаз, опускание семенников, открытие влагалища; выживаемость потомства
1—30 дни жизни
4. Измерение массы тела и роста крысят
1.4. 7,14, 21 и 25 дни жизни
6.7.3. Отчет по результатам исследований репродуктивной токсичности ГМО должен включать цифровые данные в форме таблиц, содержащих основные сведения, необходимые для суждения о наличии или отсутствии у исследуемого ГМО неблагоприятного действия на внутриутробное развитие и процессы репродукции.
Список литературы
1 Автандилов Г.Г. Медицинская морфометрия. Руководство. М.: Медицина, 1990. 384 с.
2. Ведомости Фармакологического комитета. 1999. № I. С. 31—36.
3. Гмошинский И.В., Кржсчковская В.В., Пятницкий Н.Н. //Вопросы питания. 1994. № 1—2. С. 30—33.
4 Гурова Н.В., Попело И.А., Сучков В.В. //Мясная индустрия. 1999. Т. 1.С. 23—25.
5. Гурова Н.В., Токаев Э.С., Гуров А.Н. Метод определения эмульсионных свойств белков. М.: Сб.АгроНИИТЭИ Мясомолпром, 1994
20