МР 4.2.0160-19
Определение чувствительности основных возбудителей гнойных бактериальных менингитов (менингококк, пневмококк, гемофильная палочка) к антибактериальным препаратам диффузным методом Е-тестов
Купить МР 4.2.0160-19 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические рекомендации предназначены для специалистов органов и организаций Роспотребнадзора, а также могут быть использованы специалистами лабораторий, осуществляющих диагностические, мониторинговые и научные исследования, связанные с возбудителями гнойных бактериальных менингитов.
Оглавление
I. Область применения
II. Общие положения
III. Приготовление питательных сред
Выбор питательных сред
Приготовление питательной среды МХБК и МХЛК
Приготовление стандарта мутности 0,5 по МакФарланду
Приготовление бульона Мюллера — Хинтона
Приготовление питательной среды для постановки чувствительности Haemophilus influenzae к АБП (HТМ)
IV. Метод Е-тестов
Обоснование для исследования чувствительности выделенных культур возбудителей ГБМ к антибактериальным препаратам методом Е-тестов
Интерпретация результатов исследования
Выбор контрольных штаммов
Выполнение Е-теста
Критерии оценки чувствительности/устойчивости
V. Определение чувствительности менингококка (Neisseria meningitidis) к антибактериальным препаратам методом Е-тестов
VI. Определение чувствительности пневмококка (Streptococcus pneumoniae) к антибактериальным препаратам методом Е-тестов
VII. Определение чувствительности гемофильной палочки (Наеmophilus influenzae) к антибактериальным препаратам методом Е-тестов
Нормативные и методические документы
Библиографические ссылки
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2021 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| Разработан | Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека |
- Федеральный закон 52-ФЗ О санитарно-эпидемиологическом благополучии населения
- МУК 4.2.1887-04 Лабораторная диагностика менингококковой инфекции и гнойных бактериальных менингитов
- СП 1.3.2322-08 Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней
- МУК 4.2.1890-04 Определение чувствительности микроорганизмов к антибактериальным препаратам
- Приказ 1116 О совершенствовании системы мониторинга, лабораторной диагностики инфекционных и паразитарных болезней и индикации ПБА в Российской Федерации
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6
стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24
Г осу дарственное санитарно-эпидемиологическое нормирование _Российской Федерации_
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Определение чувствительности основных возбудителей гнойных бактериальных менингитов (менингококк, пневмококк, гемофильная палочка) к антибактериальным препаратам диффузным методом Е-тестов
Методические рекомендации МР 4.2.0160—19
Издание официальное
Москва • 2020
Федеральная служба по нал юру в сфере зашиты прав потребителей и благополучия человека
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Определение чувствительности основных возбудителей гнойных бактериальных менингитов (менингококк, пневмококк, гемофильная палочка) к антибактериальным препаратам диффузным методом Е-тестов
Методические рекомендации МР 4.2.0160—19
Приготовленную суспензию необходимо разлить в герметично закрывающиеся пробирки такого же диаметра, как и используемые для приготовления бактериальной суспензии.
Закрыть пробирки герметично.
Хранить приготовленный стандарт необходимо в темноте при комнатной температуре.
Непосредственно перед использованием приготовленный стандарт необходимо тщательно встряхивать на вортексе.
Стандарт мутности необходимо обновлять или проверять его оптическую плотность после 6 месяцев хранения.
Приготовление бульона Мюллера - Хинтона
3.9. К 750 мл деионизированной Н20 добавить: 3,0 г говяжьего экстракта, 17,5 г кислотного гидролизата казеина (казаминовые кислоты), 1,5 г растворимого крахмала.
- довести конечный объем до 1 литра;
- установить pH на уровне 7,3;
-автоклавировать бульон для стерилизации при 121 °С в течение 20 минут.
Приготовление питательной среды для постановки чувствительности Haemophilus influenzae к АБП (НТМ)
3.10. АМХ, используемый для получения НТМ. не должен содержать тимидина для получения достоверных результатов при проверке на предмет чувствительности к котримоксазолу.
Порядок приготовления среды:
- приготовить свежий базовый раствор гем и на. растворив 50 мг порошка гемина в 100 мл 0.01 моль/л NaOH, подогревая и помешивая до полного растворения порошка;
- приготовить базовый раствор р-НАД, растворив 50 мг р-НАД в 10 мл дистиллированной воды. Простерилизовать раствор посредством фильтрации:
- приготовить АМХ из доступной обезвоженной основы, следуя инструкциям производителя, добавив 5 г дрожжевого экстракта и 30 мл базового раствора гемина к 1 л агара;
- после автоклавирования охладить питательную среду до 45— 50°С на водяной бане;
- добавить 3 мл базового раствора Р-НАД;
- немедленно разлить в чашки Петри (толщина агара составляет 4 мм i 0,5 мм. что соответствует 25 мл среды на круглую чашку Петри диаметром 90 мм; 31 мл на круглую чашку Петри диаметром 100 мм;
71 мл на круглую чашку Петри диаметром 150 мм; 40 мл на квадратную чашку Петри размером 100 х 100 мм; 57,6 мл на квадратную чашку Петри размером 120 х 120 мм);
- дать питательной среде затвердеть, а конденсату подсохнуть; pH должен составлять 7,2—7,4;
- поместить чашки в стерильные пластиковые пакеты и хранить до использования при температуре 4 °С.
3.11. Контроль качества:
- вырастить штамм Н.'influenzae, используемый для контроля качества, в течение 18—24 часов на шоколадном агаре при 35—37 °С в присутствии -5 % С02 (или в сосуде со свечой);
- приготовить умеренно густую клеточную суспензию (сопоставимую со стандартом мутности 1 по шкале МакФарланда) из ночной культуры, выращенной на чашке с шоколадным агаром, в подходящем бульоне (триптиказо-соевый, с сердечной вытяжкой или пептонный) и интенсивно перемешать ее на вортексе;
- инокулировать чашку с НТМ 10 мкл клеточной суспензии, используя стерильную бактериологическую петлю, и произвести посев штрихом для выделения микроорганизма:
- рассмотреть чашку с НТМ для выявления колоний со специфической морфологией;
- в качестве теста на стерильность инкубировать неинокулирован-ную чашку в течение 48 часов при 35—37 °С в присутствии ~5% С02 (или в сосуде со свечой);
- критерии прохождения теста: колонии Н. influenzae на чашке с НТМ должны быть крупными, округлыми, гладкими, выпуклыми, бес-цветными/серыми, непрозрачными, не изменяющими цвет питательной среды;
- после 48 часов инкубирования чашка, использовавшаяся в тесте на стерильность, должна оставаться чистой. Если чашка не стерильна, повторить тест на стерильность с другой партией чашек с НТМ. После прохождения теста на стерильность, использовать чашки этой партии.
IV. Метод Е- гес гов
Обоснование для исследования чувствительности выделенных культур возбудителей ГБМ к антибактериальным препаратам методом Е-тестов
4.1. Антибнотикорезистентность возбудителей различных инфекционных заболеваний является насущной проблемой медицинской науки и клинической медицины. Особую опасность представляет множественная лекарственная устойчивость бактерий, чрезвычайно быстро рас-
пространяющаяся с помощью мигрирующих генетических элементов, содержащих гены лекарственной устойчивости и имеющих специализированные механизмы их передачи среди широкого круга бактерий. Некоторые микроорганизмы легко мутируют, приобретая резистентность к ряду антибиотиков.
4.2. Стандартизированное определение антибиотикограммы возбудителя и её правильная интерпретация являются основой адекватного выбора АБП для целей экстренной профилактики и лечения ГБМ, а также основой наблюдения за динамикой распространения антибиотикоре-зистентности среди штаммов микроорганизмов-возбудителей ГБМ.
Современные методы тестирования антимикробной чувствительности основываются или на количественном методе серийных разведений, или на качественном методе диффузии. В основе метода разведения лежит принцип двукратных серийных разведений антибиотиков в бульоне или питательном агаре. Эти методы определяют значение МИК отдельно взятого антибиотика в рг/мл, при котором рост определенной бактерии будет подавлен при заданных экспериментальных условиях. Их использование в повседневной практике микробиологических лабораторий применяется все реже из-за значительной трудоемкости.
Доступность для практических лабораторий диско-диффузионного метода определения чувствительности к АБП затрудняет определение чувствительности штаммов менингококка из-за сложности интерпретации результатов этого метода. Диско-диффузионный метод ограничивает возможность изучения чувствительности пневмококка к АБП пенициллинового ряда. Оксациллиновый диск используют лишь как скрининг для выявления пенициллинустойчивых штаммов. Методом дисков штамм гемофильной палочки можно отнести к чувствительным, промежуточным или устойчивым, а количественный метод предоставляет более подробную информацию о МИК АБП.
4.3. Методика Е-теста комбинирует метод разведений и принципы диффузии при определении чувствительности, являясь количественным методом определения антимикробной чувствительности грамотрица-тельных и грамположительных аэробных и анаэробных бактерий, в том числе прихотливых Neisseria, Streptococcus и Haemophilus. Система состоит из стандартного градиента АБП, который используется для определения МИК. выраженной в pr/мл, посредством культивирования на питательном агаре в течение 18—24 часов. Используя стандартный, стабильный и постоянный градиент концентрации АБП, с помощью Е-теста можно получить более точные и воспроизводимые значения МИК, чем
результаты, полученные при традиционном методе, основанном на прерывистом двукратном серийном разведении.
| ||||||||||
|
2Ь . .19 .12Ь 094 064 047 032 023 016- |
а
а
Экспоненциальный
антимикробный
градиент
И
b
Стрип Е-теста представляет собой тонкую, инертную, непористую пластиковую тест-полоску (рис. 1). На одну сторону тест-полоски (А) нанесена шкала МИК в цг/мл и двух- или трехбуквенный код вверху для обозначения наименования антибиотика. На другой стороне тест-полоски (В) зафиксирован стандартный экспоненциальный градиент антибиотика в сухом и стабилизированном виде с максимальной концентрацией в точке а и минимальной в точке b (рис. 1).
Рис. I. Конфигурация градиента Е-теста
Градиент покрывает непрерывный диапазон концентрации в пределах 15 двукратных разведений традиционного метода МИК. Когда тест-полоска с градиентом накладывается на поверхность засеянного агара, подготовленный градиент АБП сразу и эффективно попадает с несущей пластиковой поверхности в агаровую матрицу. Стабильный, постоянный экспоненциальный градиент концентраций АБП формируется непосредственно под тест-полоской. После инкубации, в результате которой бактериальный рост становится видимым, вдоль тест-полоски можно увидеть симметричный эллипс ингибирования. В месте пересечения заост-
ренного конца эллипса с тест-полоской считываются значения МИК в рг/мл.
Интерпретация результатов исследования
4.4. Интерпретация результатов оценки антибиотикочувствитель-ности микроорганизма к АБП заключается в отнесении его к одной из трех категорий1: чувствительный, промежуточный, устойчивый, - в соответствии с критериями, разработанными для данного вида бактерий. Интерпретация проводится путем сопоставления величин МИК, полученных в результате исследования, с пограничными значениями этих параметров для чувствительных, промежуточных и устойчивых культур изучаемого вида возбудителя.
В настоящее время теоретически наиболее обоснованным представляется комплекс подходов к оценке чувствительности и интерпретации результатов, предлагаемый Европейским комитетом по определению чувствительности к антимикробным препаратам (European Committee on Antimicrobial Susceptibility Testing, далее - EUCAST). Метод последовательных микроразведений в повседневной практике микробиологических лабораторий не применяется из-за значительной трудоемкости. Относительно этого метода «калибруются» как наиболее распространенный в практике диско-диффузионный метод, так и различные коммерческие методы. Результаты оценки антибнотикочувстви-тельности бактерий, полученные с помощью референтного метода, используют для обоснования микробиологических и клинических критериев чувствительности. Для определения клинической чувствительно-сти/устойчивости EUCAST предлагает следующие категории:
- микроорганизм оценивается как чувствительный к АБП, если уровень активности последнего позволяет предположить высокую вероятность эффективности терапии:
- микроорганизм оценивается как умереннорезистентный, если уровень активности АБП позволяет предположить высокую вероятность эффективности терапии, но только в случае использования более высоких (по сравнению с обычными) доз или для лечения инфекций в локусах, где создаются высокие концентрации антибиотика;
-микроорганизм оценивается как резистентный (устойчивый) к АБП. если уровень активности последнего позволяет предположить высокий риск неэффективности терапии.
Выбор контрольных штаммов
4.5. Для обеспечения достоверности и точности результатов, полученных при испытаниях на чувствительность, очень важно, чтобы в лаборатории была установлена система КК. Цели КК состоят в том, чтобы проверить повторяемость и точность используемого теста на восприимчивость, эффективность реагентов, использованных в тестах, и производительность лаборантов, выполняющих тесты и считывающих результаты. EUCAST рекомендует штаммы, которые должны использоваться в качестве КК для тестов на антимикробную чувствительность. Контрольные штаммы могут быть получены из коллекций типовых культур или коммерческих источников. Контрольные штаммы необходимо хранить в условиях, обеспечивающих их жизнеспособность и стабильность фенотипа. Наиболее удобный метод - хранение в среде с добавлением глицерина при температуре -70 °С. Неприхотливые микроорганизмы могут храниться при -20 °С. Каждый контрольный штамм должен храниться в двух экземплярах (пробирках): один для регулярного использования, а второй как резервный. Каждую неделю следует субкультивировать штамм из пробирки, предназначенной для регулярного использования, на соответствующей неселективной среде. После контроля чистоты культу ры этот рассев должен использоваться ежедневно для подготовки субкультуры контрольного штамма. Привередтивые микроорганизмы, жизнеспособность которых не сохраняется при хранении на чашках в течение 5—6 дней, следует пересевать ежедневно, но не более чем в течение одной недели. Для субкультивирования контрольного штамма необходимо использовать несколько колоний, чтобы избежать селекции мутантных вариантов. Необходимо проверить соответствие полученных значений допустимым диапазонам значений. Результаты КК периодически будут выходить за пределы нормы. Если МИК, полученные контрольными штаммами, находятся за пределами ожидаемых диапазонов, следует рассмотреть следующие возможные источники ошибки:
- на результат теста влияют изменения среды, размера инокулята или фазы роста, времени инкубации, температуры и других факторов окружающей среды. Используемая среда может быть источником ошибки, если она не соответствует рекомендациям EUCAST. Например, агар, содержащий чрезмерное количество тимидина или тимина, может обратить вспять ингибирующее действие сульфаниламидов и триметоприма-сульфаметоксазола, в результате чего зоны подавления роста будут меньше или менее различимы;
- если глубина агара в чашке неравномерна, то есть больше или меньше 3—4 мм в пределах одной чашки (это может повлиять на скорость диффузии АБП или активность препаратов);
-если pH тестируемой среды не находится между 7,2 и 7,4 (это может повлиять на скорость диффузии АБП или активность препаратов);
- если инокулят не является чистой культурой или не содержит концентрацию бактерий, которая приближается к стандарту' мутности 0,5 по МакФарленду (это повлияет на результаты теста). Например, резистентный организм может оказаться восприимчивым, если в инокуляте используется слишком мало бактерий;
- следует использовать только культуры в фазе роста, то есть культуры, выращенные в течение 20—24 часов.
Если результат за пределами допустимого диапазона вызван очевидной причиной, то следует задокументировать причину и повторить тест. Если нет очевидной причины для результата вне диапазона, требуются немедленные корректирующие действия. Необходимо проверить комбинацию «АБП/микроорганизм» вне допустимого диапазона в день, когда наблюдается ошибка, и провести мониторинг в течение пяти последовательных дней тестирования, документируя все результаты. Если результаты испытаний за 5 дней находятся в допустимых пределах, никаких дополнительных корректирующих действий не требуется. Если какой-либо из пяти результатов остается вне диапазона, требуются дополнительные корректирующие действия. Если немедленные корректирующие действия не решают проблему, то необходимо изучить другие распространенные источники ошибок, чтобы убедиться, что:
- результаты были измерены и расшифрованы верно;
- стандарт мутности в зоне срока годности, хранился должным образом, соответствовал рабочим характеристикам требования, и был надлежащим образом смешан перед использованием;
- все использованные материалы, включая диски и градиентные тест-полоски, в зоне срока годности и использованы при надлежащей температуре;
- в инкубаторе была необходимая температура и атмосфера;
- контрольный штамм не изменился и не был загрязнен:
-суспензии инокулята были приготовлены и отрегулированы;
- инокулят использовали в течение 15 минут после приготовления;
- инокулят для теста готовили с чашки, инкубированной в течение необходимого периода времени, но не более 24 часов.
Для внутреннего КК определения антибиотикограммы рекомендуется использовать эталонные референс-штаммы Escherichia coli АТСС (American type culture collection, Американская коллекция типовых культур) 25922 и Streptococcus pneumoniae АТСС 49619, Haemophilus influenzae АТСС 49766. Допустимые колебания значений МГ1К АБП контрольных штаммов оцениваются в соответствии с рекомендациями2.
Для сохранения свойств и чистоты контрольные штаммы необходимо хранить в лиофилизированном или замороженном состоянии. «Рабочие» культуры хранят в пробирках на скошенном агаре или в столбиках агара, оптимального для роста каждого вида микроорганизма, при 2—8 °С, с еженедельным пересевом. Перед использованием для контроля качества определения антибиотикограммы референтный штамм двукратно пересевается.
Выполнение Е-теста
4.6. Испытуемые изоляты следует пересевать на чашку с шоколадным агаром и инкубировать в атмосфере с повышенным содержанием С02 (5% СО, в С02-инкубаторе или эксикаторе) при температуре (35 ± 2) °С в течение 20—24 часов до испытания. Если микроорганизм был заморожен, его следует пересевать дважды после извлечения из морозильника, прежде чем приступить к проверке чувствительности.
Используя стерильный ватный аппликатор необходимо снять с поверхности среды от одной до четырех морфологически идентичных изолированных колоний. Погрузить аппликатор в пробирку, содержащую физиологический раствор/бульон Мюллера - Хинтона для суспензиро-вания. Прижать аппликатор к внутренней стенки пробирки, чтобы удалить лишнюю жидкость. Извлечь аппликатор. Закрыть пробирку' и перемешать для образования суспензии, стараясь не образовывать пены или пузырьков. Отрегулировать уровень мутности инокулята до 0.5 по шкале МакФарланда. Если мутность инокулята больше, чем стандарт, разбавить его средой для суспензирования. Суспензию использовать в течение 15 минут.
Погрузить стерильный ватный аппликатор в отрегулированный инокулят. Удалить лишнюю жидкость, прижав кончик аппликатора к внутренней части пробирки. Инокулировать всю поверхность среды для определения чувствительности к АБП три раза одним и тем же аппликатором инокулята, поворачивая чашку на 60 градусов после каждой ино-
куляции, чтобы обеспечить равномерное распределение инокулята и рост скоплений бактерий.
|
Рис. 2 b. Образец для 2 тест-полосок в 90-мм чашке |
Согреть до комнатной температуры (25 °С) градиентные полоски, которые будут использоваться в серии испытании. Для тестирования градиентной полоски можно использовать 150-миллиметровой или 90-миллиметровой чашки Петри в зависимости от количества тест-полосок с АБП. Две разные градиентные полосы могут быть размещены в противоположных направлениях градиента на 90-миллиметровой чашке (рис. 2Ь). На 150-миллиметровой чашке можно использовать до шести градиентных полос (рис. 2а). При возникновении перекрытия зон подавления роста исследование необходимо повторить.
Рис. 2а.
Образец для 6 тест-полосок в 150-мм чашке
Рис. 2а, 2Ь. Размещение тесг-полосок на чашках Петри
Дать инокулят>' высохнуть на поверхности среды (это должно занять около 5—10 минут). Перед продолжением необходимо убедиться, что чашка полностью сухая.
Когда поверхность инокулированной чашки подсохла и градиентные полоски согрелись при комнатной температуре, поместить градиентные полоски на агар с помощью обеззараженного пинцета. Убедиться, что напечатанные значения МИК обращены вверх (то есть, что нижняя поверхность полоски, содержащей антимикробный градиент, находится в контакте с агаром). После нанесения важно не перемещать полоски антимикробного градиента, так как антибиотик диффундирует в агар сразу после контакта. Поместить полоски с антимикробным градиентом, которые не будут использоваться в этой серии испытаний, в морозильник при -20 °С (некоторые полоски можно хранить при 4 °С).
Инкубировать чашки необходимо в перевернутом положении в атмосфере с 5% С02 в течение (18 ± 2) часов при (35 ± 1)°С. Допускается использовать эксикатор со свечой, если С02-инкубатор недоступен. Поскольку N. meningitidis активно растет во влажной атмосфере, можно добавить емкость со стерильной водой на дно инкубатора или добавить стерильную влажну ю марлевую салфетку в эксикатор со свечой.
После инкубации на чашке вокруг полоски сформируется эллипс бактериального роста, и тест можно будет прочитать. Результаты КК должны быть рассмотрены до прочтения и интерпретации МИК.
Критерии оценки чувствмтельности/устойчивости
4.7. Учет МИК отмечается в той точке, где зона подавления пересекает шкалу МИК на полосе. Необходимо использовать наклонный свет, чтобы изучить конечную точку. При необходимости можно использовать увеличительное стекло. Конечные показатели МИК в методе Е-тестов четко выражены, но возможно увидеть различные картины роста-ингибирования (см. инструкцию производителя Е-тестов). Градации на полоске соответствуют стандартным 2-кратным концентрациям разбавления для метода серийных разведений. Если точка МИК лежит между двумя стандартными значениями, необходимо выбрать значение с большей концентрацией АБП.
Интерпретируемые контрольные точки для N. meningitidis, S. pneumoniae, Н. influenzae оцениваются в соответствии с рекомендациями3.
V. Определение чувствительности менингококка (Neisseria meningitidis) к антибактериальным препаратам методом Е-тестов
5.1. N. meningitidis до сих пор остается чувствительным ко многим АБП. Штаммы со сниженной восприимчивостью к пенициллину распространены во многих регионах мира. Диско-диффузионный метод для определения чувствительности менингококка к АБП не используется в связи со сложностью интерпретации результатов. Исследование проводится с использованием метода, определяющего МИК АБП.
При тестировании изолятов N. meningitidis методом Е-тестов в качестве среды используют МХКБ. В качестве основы суспензии для нанесения на среду МХКБ используют бульон Мюллера - Хинтона.
ББК 52.81 0-63
0-63 Определение чувствительности основных возбудителей гнойных бактериальных менингитов (менингококк, пневмококк, гемофильная палочка) к антибактериальным препаратам диффузным методом Е-тестов: Методические рекомендации.—М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2020.—22 с.
ISBN 978-5-7508-1731-3
1. Разработаны Федеральной службой но надзору в сфере зашиты прав потребителей и благополучия человека: ФБУН ЦНИИ эпидемиологии Росногребналзора (И. С. Королева. М. Л. Королева, Г\ В. Ьслошиц-кий, М. И. Грицай).
2. У гверждены руководителем Федеральной службы по надзору в сфере зашиты прав потребителей и благополучия человека. Главным государственным санитарным врачом Российской Федерации А. Ю. Поповой 18 декабря 2019 г.
3. Введены впервые.
ББК 52.81
ISBN 978-5-7508-1731-3
€> Роспотребнадзор, 2020
Контроль качества проводят с Escherichia coli АТСС 25922 в соответствие с рекомендациям4. Результаты интерпретируют в соответствии с рекомендациями5.
VI. Определение чувствительности пневмококка (Streptococcuspneumoniae) к антибактериальным препаратамметодом Е-тестов
6.1. Диско-диффузионный метод показывает, является ли S. pneumoniae восприимчивым или устойчивым к АБГ1. Однако тестирования с использованием диска оксациллина (антибиотика семейства пеницилли-нов) не достаточно для проведения различия между полной и промежуточной резистентностью. При тестировании изолятов .9. pneumoniae методом Е-тестов используют МХЛК и 20 мг/л р-НАД. В качестве основы суспензии для нанесения на среду МХЛК используют бульон Мюллера -Хинтона.
Контроль качества проводят с Streptococcus pneumoniae АТСС 49619 в соответствии с рекомендациями6. Результаты интерпретируют в соответствии с рекомендациями7.
VII. Определение чувствительности гемофильной палочки (Haemophilus influenzae) к антибактериальным препаратам методом Е-тестов
7.1. Диско-диффузионный метод предоставит информацию о том, является ли штамм восприимчивым, промежуточным или устойчивым, но метод Е-тестов предоставит более подробную информацию о МИК АБП.
При тестировании изолятов Н. influenzae методом Е-тестов используют среду для определения чувствительности Н. influenzae к АБП (НТМ) или агар МХЛК с 20 мг/л Р-НАД. В качестве основы суспензии для нанесения на среду МХЛК используют НТМ бульон или физиологический раствор.
Контроль качества проводят с Haemophilus influenzae АТСС 49766 в соответствии с рекомендациями8. Результаты интерпретируют в соответствии с рекомендациями4.
Содержание
I. Область применения...............................................................................................4
II. Общие положения..................................................................................................4
III. Приготовление питательных сред.......................................................................6
IV. Метод Е-тестов...................................................................................................11
V. Определение чувствительности менингококка (Neisseria meningitidis)
к антибактериальным препаратам методом Е-тестов.....................................19
VI. Определение чувствительности пневмококка (Streptococcus
pneumoniae) к антибактериальным препаратам методом Е-тестов...............20
VII. Определение чувствительности гемофильной палочки (Haemophilus
influenzae) к антибактериальным препаратам методом Е-тестов..................20
11ормативные и методические документы..............................................................21
Библиографические ссылки.....................................................................................21
УТВЕРЖДАЮ Ру ководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главный государственный санитарный врач Российской Федерации
А. Ю. Попова
18 декабря 2019 г.
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Определение чувствительности основных возбудителей гнойных бактериальных менингитов (менингококк, пневмококк, гемофильная палочка) к антибактериальным препаратам диффу зным методом Е-тестов
Методические рекомендации МР 4.2.0160—19
I. Область применения
1.1. Методические рекомендации (далее - МР) определяют порядок организации и проведения определения чувствительности основных возбудителей гнойных бактериальных менингитов (далее - ГБМ) (менингококк, пневмококк и гемофильная пазочка) к антибактериальным препаратам (далее - АБП) методом Е-тестов.
1.2. МР предназначены для специалистов органов и организаций Роспотребнадзора, а также могут быть использованы специалистами лабораторий, осуществляющих диагностические, мониторинговые и научные исследования, связанные с возбудителями ГБМ.
II. Общие положения
2.1. Возбудитель менингококковой инфекции (Neisseria meningitidis, N. meningitidis) остается чувствительным ко многим АБП. классически используемым при лечении и с целью химиопрофилактики. С 1985 года, после долгого периода широкого использования, в ряде стран отмечено снижение чувствительности к пенициллину, основанное на изменениях в пснициллин-связывающих белках [1J. Описано несколько штаммов N. meningitidis с высокой степенью резистентности к пеницил-
лину, вызванной продукцией фермента бета-лактамазы [2]. Периодически отмечается резистентность к рифампицину, что может являться следствием химиопрофилактики [ I ]. Менингококковая инфекция - это тяжелое и быстро прогрессирующее заболевание. Многие страны проводят мониторинг тенденций устойчивости N. meningitidis к АБП. Для сравнения данных между лабораториями, в том числе и лабораториями разных стран, важно использовать стандартизованные протоколы определения чувствительности. Европейской группой мониторинга за менингококками (The European Monitoring Group of Meningococci, EMGM) в 1999 году принято заключение о необходимости применять стандартную методологию для определения минимальной ингибирующей концентрации (МИК) у штаммов N. meningitidis, особенно фокусируясь на методах серийных разведений и Е-тестов, которые наиболее часто применяются в странах Европы. В исследовании, проведенном в Испанской референс-лаборатории, изучающей Neisseria (Spanish Reference Laboratory for Neisseria, SRLN). для постановки метода Е-тестов отмечено преимущество высокопитательных сред [3].
2.2. Пневмококк (Streptococcus pneumoniae, S. pneumoniae) является ведущей причиной бактериальной пневмонии, сепсиса и менингита по всему миру. В глобальном масштабе растет распространенность резистентных к АБП штаммов пневмококка [4]. В 60—70-х годах XX века чувствительность пневмококка к пенициллину и тетрациклину считалась неизменной. В 70-е годы устойчивые штаммы обнаруживались, но редко, и возможность их распространения рассматривалась как крайне маловероятная. В 90-х годах клиницисты и микробиологи столкнулись с растущим вызовом устойчивых к АБП пневмококков, которые начали повсеместно распространяться в течение 80-х годов [5]. Сообщения о снижении уровней чувствительности пневмококка к АБП, особенно в последние несколько лет, существуют во многих странах мира. Отмечена циркуляция полирезистентных штаммов пневмококка, т. е. устойчивых к трем и более АБП разных классов штаммов.
2.3. Менингит и сепсис - самые значимые инвазивные формы ге-мофильной инфекции. Возбудителем гемофильной инфекции является гемофильная палочка (Haemophilus influenzae, Н. influenzae). До недавнего времени амоксициллин и ампициллин являлись самыми эффективными средствами лечения гемофильной инфекции [6]. Впервые о появлении ампициллин-резистентных штаммов сообщено в 1972 году и с тех пор у Н. influenzae развилась резистентность к нескольким АБП [7, 8].
2.4. Диско-диффузионный метод ограничивает возможность изучения ангибиотикочувствительности N. meningitidis и S. pneumoniae из-за сложности в интерпретации результатов, а использование в повседнев-
ной практике методов серийных разведений применяется все реже из-за их значительной трудоемкости. МР позволяют организовать и провести определение чувствительности основных возбудителей ГЬМ к АБП методом Е-тестов. комбинирующим принципы разведений и диффузии.
III. Приготовление питательных сред
Выбор питательных сред
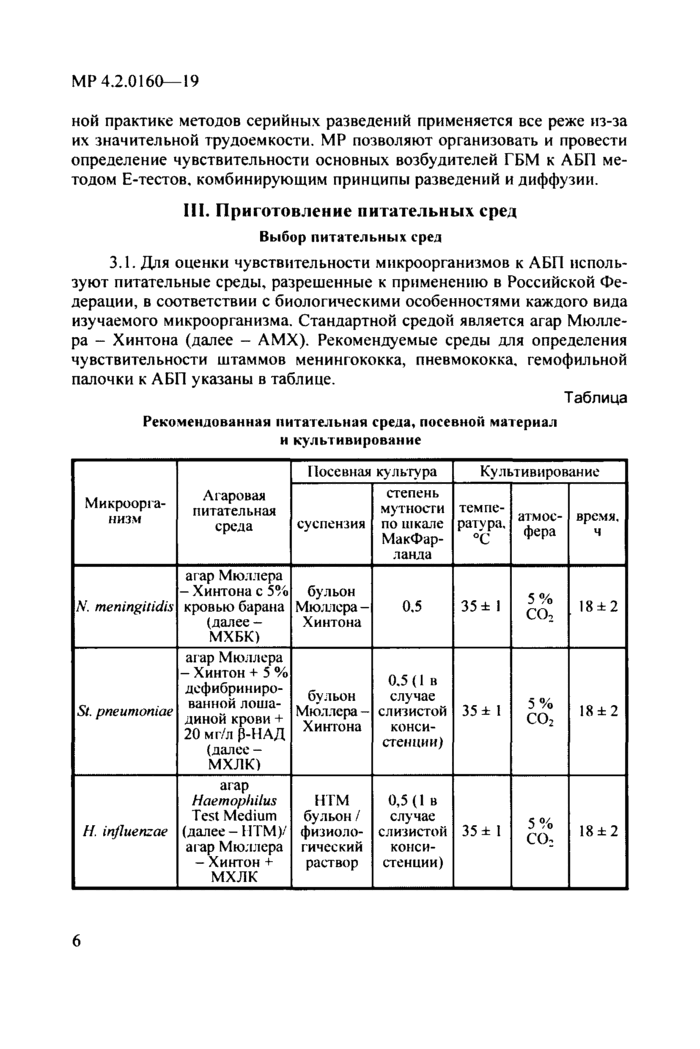
3.1. Для оценки чувствительности микроорганизмов к АБП используют питательные среды, разрешенные к применению в Российской Федерации, в соответствии с биологическими особенностями каждого вида изучаемого микроорганизма. Стандартной средой является агар Мюллера - Хинтона (далее - АМХ). Рекомендуемые среды для определения чувствительности штаммов менингококка, пневмококка, гемофильной палочки к АБП указаны в таблице.
Таблица
|
Рекомендованная питательная среда, посевной материал и культивирование | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Каждую партию питательных сред проверяют с использованием контрольного штамма на ростовые качества для тестируемого микроорганизма (рост при высеве на чашки с агаром - не менее 30 % КОЕ), а также на соответствие рекомендуемому pH с помощью pH-метра. Последнее связано с изменением активности аминогликозидов, макролидов. тетрациклинов в зависимости от pH питательной среды.
Выбранную питательную среду промышленного производства готовят в колбах в строгом соответствии с инструкцией изготовителя, затем разливают в градуированные бутылки емкостью 250 мл и автоклавируют. Остуженный до 48—50 °С агар (при необходимости в него добавляют стерильные термолабильные добавки или растворы АБП) разливают в чашки Петри.
Агар разливают по 25 мл среды на круглую чашку Петри диаметром 90 мм (31 мл на круглую чашку Петри диаметром 100 мм; 71 мл на круглую чашку Петри диаметром 150 мм; 40 мл на квадратную чашку Петри размером 100 х 100 мм; 57,6 мл на квадратную чашку Петри размером 120x120 мм), чтобы толщина агара составляла (4 ±0,5) мм. Чашки оставляют для застывания при комнатной температуре. Для приготовления чашек с агаром требуется горизонтальная поверхность. Чашки после подсушивания при комнатной температуре лучше использовать немедленно, однако возможно их приготовление за 24 ч до использования при условии хранения при 4—8 °С. Допускается подсушивание при 37 °С в течение 15 мин перевернутых вверх дном чашек в термостате, предварительно обработанном 70° спиртом.
3.2. Каждая партия питательной среды должна быть протестирована с использованием надлежащих стандартных штаммов на предмет стерильности, способности поддерживать рост целевого(-ых) микроор-ганизма(-ов) и/или способности обеспечивать нужные биохимические реакции. Рекомендуется ведение журнала контроля качества (далее -КК) для всех питательных сред, приготовленных в лаборатории или полученных из коммерческих источников, с фиксацией, в т. ч. дат приготовления или приобретения и результатов КК. Регистрации подлежат любые необычные характеристики среды, такие как цвет, структура или медленный рост стандартных штаммов. Все агаризованные среды должны готовиться с соблюдением стерильности. После разлива чашки следует подержать при комнатной температуре (25 °С) несколько часов для предотвращения избыточной конденсации пара на крышках. Для оптимального роста микроорганизма(-ов) чашки должны быть помешены в стерильный пластиковый пакет и до использования храниться в перевернутом состоянии при 4 °С. Все жидкие питательные среды до ис-
пользования следует хранить в надлежащих емкостях при температуре 4 °С.
3.3. Процедура подсушивания, условия и длительность хранения чашек с агаром, приготовленным в лаборатории, должны быть определены программой внутрилабораторного контроля качества. Чашки с агаром должны храниться в соответствии с инструкцией производителя. Чашки с агаром, которые хранятся в закрытых контейнерах или пластиковых пакетах, иногда требуется подсушить перед использованием, так как при высокой влажности поверхности среды возможно формирование нечеткого края зоны подавления роста.
Приготовление питательной среды МХЬК и МХЛК
3.4. Необходимые реагенты:
- готовая сухая питательная среда АМХ;
- механически дефибринированная лошадиная кровь (для МХЛК) или кровь барана (для МХБК);
- р-никотинамидадениндинуклеотид (далее - р-НАД), чистота > 98 %.
3.5. Приготовление основного раствора р-НАД:
- растворить р-НАД в стерильной деионизированной воде до концентрации 20 мг/мл;
-для стерилизации пропустить полученный раствор через мембранный фильтр (размер пор 0,2 мкм);
-основной раствор необходимо разделить на аликвоты и хранить при -20 °С, размораживая по мере необходимости. Не допускается повторное замораживание и использование раствора.
3.6. Приготовление чашек Петри с МХБК и МХЛК:
- приготовить и проавтоклавировать АМХ по инструкции изготовителя;
- охладить среду до 42—45 °С;
- стерильно добавить 50 мл механически дефибринированной лошадиной крови или крови барана и 1 мл основного раствора р-НАД на 1 литр приготовленной среды, интенсивно перемешать;
- немедленно разлить в чашки Петри (толщина агара составляла 4 мм i 0,5 мм, что соответствует 25 мл среды на круглую чашку Петри диаметром 90 мм; 31 мл на круглую чашку Петри диаметром 100 мм; 71 мл на круглую чашку Петри диаметром 150 мм; 40 мл на квадратную чашку Петри размером 100 х 100 мм; 57,6 мл на квадратную чашку Петри размером 120 х 120 мм);
- не допускается передвигать чашки Петри до полного застывания среды;
-поверхность агара перед использованием должна быть сухой. Не допускается пересушивать агар.
3.7. Контроль качества МХБК и МХЛК:
- проверить, что толщина агара составляет 4мм± 0,5 мм;
- проверить, что среда обеспечивает надлежащий'рост контрольного микроорганизма того же вида, для определения чувствительности которого она предназначается;
- с помощью поверхностно-активного электрода следует убедиться в том, что pH среды находится в пределах 7,2—7,4;
- необходимо проверить соответствие диаметров зон подавления роста контрольных штаммов допустимым диапазонам для всех исследуемых комбинаций «микроорганизм - антибиотик»;
- вырастить штаммы S. pneumoniae/N. meningitidis, используемые для контроля качества, в течение 18—24 часов на чашке с МХЛК/МХБК при 35—37 °С в присутствии ~5 % С02 (или в сосуде со свечой);
- в качестве теста на стерильность инкубируйте неинокулирован-ную чашку в течение 48 часов при 35—37 °С в присутствии 5 % С02 (или в сосуде со свечой);
- критерии прохождения теста: колонии S. pneumoniae должны быть мелкими, серыми/серо-зелеными. окруженными отчетливым зеленым ореолом (альфа-гемолиз). Колонии N. meningitidis должны быть крупными, округлыми, гладкими, влажными, блестящими, выпуклыми, серыми, с отчетливым краем;
- после 48 часов инкубирования чашка, использовавшаяся в тесте на стерильность, должна оставаться чистой. Если чашка не стерильна, повторить тест на стерильность с другой партией чашек с МХЛК/МХБК. После прохождения теста на стерильность использовать чашки этой партии.
Приготовление стандарта мутности 0,5 по МакФарланду
3.8. Добавить 0,5 мл раствора ВаС12 с концентрацией 0,048 моль/л (1,175 % раствор ВаС12 х 2Н20) к 99,5 мл раствора H2S04 с концентрацией 0,18 моль/л (0.36 N) (1 % v/v) и тщательно перемешать до получения гомогенной суспензии.
Правильность приготовления суспензии необходимо проверить на спектрофотометре. Поглощение при использовании кюветы 1 см должно составить 0,08—0,13 при длине волны 625 нм.
1
МУК 4.2.1890—04 «Определение чувствительности микрооргашпмов к антибактериальным препаратам»
2
Таблицы 1.8, 1.12, 1.13 пункта 3.10.1 клинических рекомендаций «Определение чувствительности микроорганизмов к антимикробным препаратам», всрсия-2018-03 (далее - клинические рекомендации, версия-2018-03).
3
' Таблицы 2.10. 2.12. 2.15 раздела 2 клинических рскоменлаиий. версия-2018-03
4
Таблица 1.8 пу нкта 3.10.1 клинических рекомендаций, всрсия-2018-03.
5
Таблица 2.15 раздела 2 клинических рекомендаций, версия-2018-03.
6
Таблица 1.12 пункта 3.10.1 клинических рекомендаций, версия-2018-03.
7
Таблица 2.10 раздела 2 клинических рекомендаций, вереия-2018-03.
8
'‘Таблица 1.13 пункта 3.10.1 клинических рекомендаций, всрсия-2018-03. ’Таблица 2.12 раздела 2 клинических рекомендаций, версия-2018-03.