МП 209-082-2019
Государственная система обеспечения единства измерений. Приборы для проведения полимеразной цепной реакции MIC. Методика поверки
Купить МП 209-082-2019 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методика распространяется на приборы для проведения полимеразной цепной реакции "МIС", которые предназначены для измерений массовой доли фрагментов целевой дезоксирибонуклеиновой кислоты (ДНК) - конечного продукта полимеразной цепной реакции (ПЦР) - в ДНК исследуемого образца
Оглавление
1 Операции поверки
2 Средства поверки
3 Требования к квалификации поверителей
4 Требования безопасности
5 Условия поверки и подготовка к ней
6 Подготовка к поверке
7 Проведение поверки
8 Оформление результатов поверки
Приложение А. Протокол поверки
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2021 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 17.06.2019 | Утвержден | ФГУП ВНИИМ им. Д.И. Менделеева |
|---|---|---|
| Разработан | ФГУП ВНИИМ им. Д. И. Менделеева |
- ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
- ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
- ГОСТ 12.1.019-79 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
- МУ 1.3.2569-09 Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3
стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12

стр. 13

стр. 14
стр. 15
Федеральное государственное унитарное предприятие «Всероссийский научно-исследовательский институт метрологии имени Д.И. Менделеева»
|
УТВЕРЖДАЮ |
ФГУП «ВНИИМ им. Д.И. Менделеева»
Государственная система обеспечения единства измерений
Приборы для проведения полимеразной цепной реакции MIC
Методика поверки МП 209-082-2019
В.И. Суворов Разработчик: Инженер I категории
JT
:Л. Рунов
г. Санкт-Петербург 2019 г.
Настоящая методика распространяется на приборы для проведения полимеразной цепной реакции «М1С», которые предназначены для измерений массовой доли фрагментов целевой дезоксирибонуклеиновой кислоты (ДНК) - конечного продукта полимеразной цепной реакции (ПЦР) - в ДНК исследуемого образца.
Приборы подлежат первичной и периодической поверке.
Интервал между поверками - 1 год.
1. Операции поверки
Объем и последовательность операций поверки указаны в таблице 1.
|
Таблица 1 | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
|
При получении отрицательных результатов при проведении той или иной операции дальнейшая поверка прекращается. | ||||||||||||||||||||||||||
2. Средства поверки
2.1 При проведении поверки применяются средства измерений и оборудование, представленное в таблице 2.
|
Таблица 2 | ||||||||||
| ||||||||||
|
{.'•wM-ill |
7.4.3.12 На боковой панели слева во складке «Samples» обозначить расположение образцов и задать имя, тип образца. В соответствующем красителю столбце задать концентрацию калибраторов. Объединить образцы в группы, задать тип и концентрации для построения калибровочных прямых в соответствии с таблицей 5. Для калибровочных образцов Cl - С4 указать тип «Standart» указать концентрацию в соответствии с таблицей
н
3. Для этого необходимо нажать иконку (Toggle between single and multiplex
LI
standarts). На панели инструментов нажать иконку «Save» для сохранения
параметров на жестком диске компьютера.
|
Таблица 5. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
7.4.3.13 Для запуска ПЦР на панели инструментов сверху в правом углу нажать на иконку прибора. В выпадающем меню выбрать «Start Run». В появившемся окне нажать кнопку «Start»
|
MKIrfil |
tr“
* док В «и
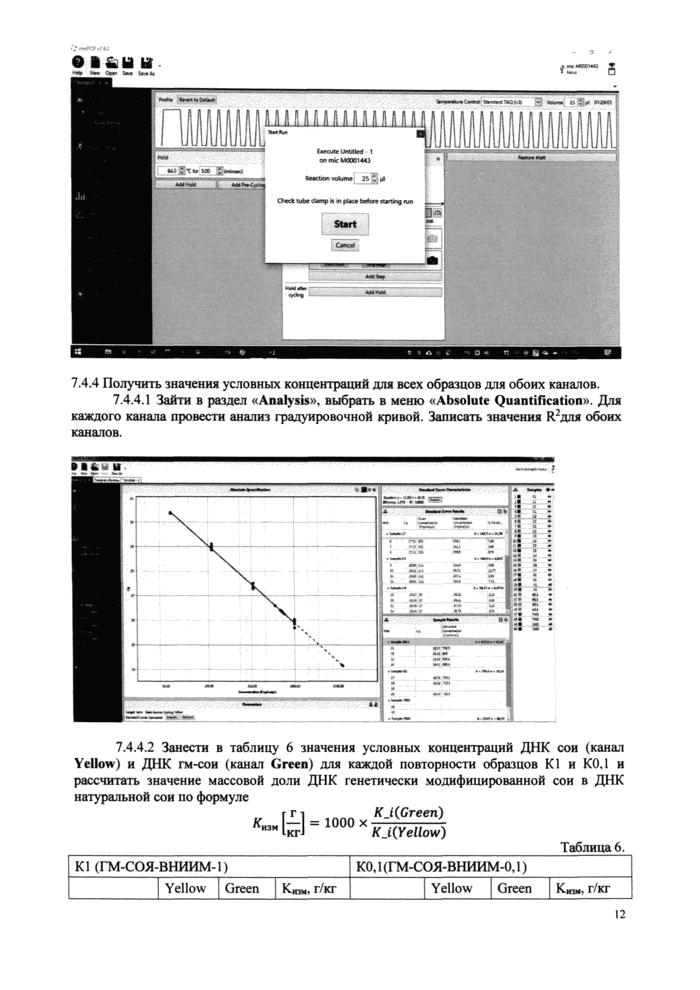
7.4.4 Получить значения условных концентраций для всех образцов для обоих каналов.
7.4.4.1 Зайти в раздел «Analysis», выбрать в меню «Absolute Quantification». Для каждого канала провести анализ градуировочной кривой. Записать значения Я2для обоих каналов.
K_i(Green)
K_i(Yellow)
|
1000 х |
7.4.4.2 Занести в таблицу 6 значения условных концентраций ДНК сои (канат Yellow) и ДНК гм-сои (канал Green) для каждой повторности образцов К1 и КОЛ и рассчитать значение массовой доли ДНК генетически модифицированной сои в ДНК натуральной сои по формуле
|
Таблица 6. | ||||
|
|
К1, |
K0,li | ||||||
|
К12 |
ко,ь | ||||||
|
К1 з |
К0,1з | ||||||
|
KU |
кол 4 | ||||||
|
кь | |||||||
|
К1б | |||||||
|
КЬ | |||||||
|
кь | |||||||
|
кь | |||||||
|
К 1,0 | |||||||
|
Kill | |||||||
|
К112 | |||||||
7.4.5 Рассчитать среднее значение массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в ГСО «ГМ-СОЯ-ВНИИМ-1» и в ГСО «ГМ-СОЯ-ВНИИМ-0,1»
7.4.6 Рассчитать значение относительной погрешности измерений массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в ГСО «ГМ-СОЯ-ВНИИМ-1» по формуле
8 = Кш*)х 100%<
Kcncu- паспортное значение массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в ГСО «ГМ-СОЯ-ВНИИМ-1». Результат вычисления заносится в протокол.
7.4.7 Рассчитать значение относительного СКО случайной составляющей погрешности результата измерения значения массовой доли ДНК генетически модифицированной сои в ГСО «ГМ-СОЯ-ВНИИМ-1» по формуле
|
5 = |
£ (К1 ,-К1«- • -I_ |
)2
И
11
X 100%
Результат вычисления заносится в протокол.
7.4.8 Результат построения градуировочных графиков считается положительным (п. 7.4.4.1), если значения коэффициентов корреляции R2 составляют не менее 0,95.
7.4.9 Прибор считается прошедшим поверку по п. 7.4.6, если относительная погрешность определения массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в образце ГМ-СОЯ-ВНИИМ-1 не превышает ±25 %.
7.4.10 Прибор считается прошедшим поверку по п. 7.4.7, если относительное СКО случайной составляющей погрешности определения массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в образце ГМ-СОЯ-ВНИИМ-1 не превышает 15 %.
7.4.11 Прибор считается прошедшим поверку по п. 7.4.4.2. если полученное среднее значение содержания ГМ-сои в образце ГМ-СОЯ-ВНИИМ-0,1 лежит в пределах от 0.5 г/кг до 5 г/кг.
7.4.12 Проверка диапазона измерения при использовании ГСО 9866-2011 состава ДНК сои (КОМПЛЕКТ ГМ-СОЯ-ВНИИМ) проводится одновременно с определением погрешности прибора. Линейность градуировочного графика свидетельствует о корректной работе
прибора в диапазоне измерений от 1 г/кг до 50 г/кг массовой доли ГМ ДНК к ДНК натуральной сои.
7.4.13 Прибор считается полностью прошедшим испытания, при удовлетворении всех требований, изложенных в п.п. 7.4.8-7.4.12.
8. Оформление результатов поверки
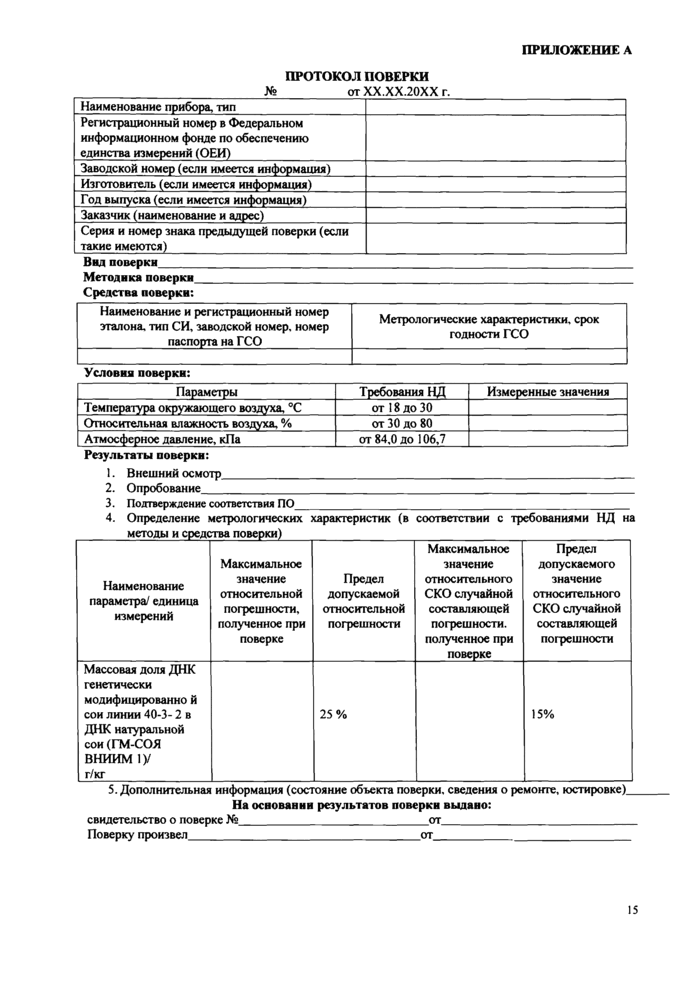
8.1. При проведении поверки составляется протокол результатов измерений по форме Приложения А.
|
Рисунок 1 - Обозначение места нанесения знака поверки |
8.2. Результаты поверки считаются положительными, если прибор удовлетворяет всем требованиям настоящей методики. Положительные результаты поверки оформляются путем выдачи свидетельства о поверке установленной формы. Знак поверки рекомендуется наносить на свидетельство о поверке или на прибор в соответствие с рисунком 1.
8.3. Результаты считаются отрицательными, если при проведении поверки установлено несоответствие поверяемого анализатора, хотя бы одному из требований настоящей методики. Отрицательные результаты поверки оформляются путем выдачи извещения о непригодности с указанием причин непригодности.
|
ПРОТОКОЛ ПОВЕРКИ №__от ХХ.ХХ.20ХХ г. | ||||||||||||||
| ||||||||||||||
|
Вид поверки_ Методика поверки Средства поверки: |
| ||||
|
Условна поверки: |
| ||||||||||||
|
Результаты поверки: 1. Внешний осмотр_ 2. Опробование_ 3. Подтверждение соответствия ПО_ 4. Определение метрологических характеристик (в соответствии с требованиями НД на |
|
методы и средства поверки) | ||||||||||
| ||||||||||
|
5. Дополнительная информация (состояние объекта поверки, сведения о ремонте, юстировке). На основании результатов поверки выдано: свидетельство о поверке №_от_ Поверку произвел_от__ |
|
Дозатор механический 1 -канальный с варьируемым объемом дозирования Техно ДПОП 1-20-200 фирмы АО 'ТЕРМО ФИШЕР САЙЕНТИФИК" |
Рег.№ 43129-15 Диапазон объёма дозирования (20,0...200,0) мкл |
|
Дозатор механический 1-канальный с варьируемым объемом дозирования Техно ДПОП 1-100-1000 фирмы АО "ТЕРМО ФИШЕР САЙЕНТИФИК" |
Рег.№ 43129-15 Диапазон объёма дозирования (100,0... 1000,0) мкл |
|
Набор для проведения полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) «АмплиКвант ГМ соя-FL» |
в составе: ПЦР-смесь-1-FRT ГМ соя. ПЦР-буфер-Flu, Полимераза (TaqF), ПКО ГМ соя 1 %, ТЕ-буфер, ОКО |
|
Центрифуга-вортскс Микроспин FV-2400, производства Biosan |
2800 об/мин. без крышки, с двумя роторами, синий корпус, 12/24 места |
|
ПЦР-бокс Biosan DNA/RNA UV-cleaner UVT/T-M-AR |
- |
|
Вода деионизованная |
ИСО 3694-77 (ОСТ 11.029.003) |
|
Пробирки 1,5 мл, типа Эппендорф |
1,5 мл |
|
Пробирки 0,6 мл. типа Эппендорф |
0,6 мл |
|
Пробирки для проведения ПЦР MIC-Tubes и крышки к ним |
0,2 мл, поставляются в стрипах по 4 штуки |
2.2 Допускается применять средства, не приведенные в перечне, но обеспечивающие определение метрологических характеристик с требуемой точностью.
2.3 Все средства поверки должны иметь действующие свидетельства о поверке, все ГСО должны иметь действующие паспорта.
3. Требования к квалификации поверителей
- К работе с СО допускается персонал, прошедший специальный инструктаж и имеющий опыт проведения ПЦР. Для получения данных по поверке допускается участие операторов, обслуживающих прибор (под контролем поверителя).
4. Требования безопасности
4.1. Требования безопасности должны соответствовать рекомендациям, изложенным в руководстве по эксплуатации на прибор.
4.2. При выполнении поверки соблюдают правила техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007-76, требования электробезопасности по ГОСТ 12.1.019-79 и пожаробезопасности по ГОСТ 12.1.004-91.
4.3. По окончании амплификации отработанные пробирки утилизировать в соответствии с рекомендациями по организации ПЦР лаборатории, согласно МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности».
5. Условия поверки и подготовка к ней
При проведении поверки должны быть соблюдены следующие условия:
• температура окружающего воздуха: от 18 до 30 °С
• относительная влажность воздуха: от 20 % до 80 %
• отклонение напряжения питания от номинального значения (220 ± 22) В
6. Подготовка к поверке
6.1 Подготовить устройство к работе в соответствии с технической документацией фирмы-изготовителя.
6.2 Подготовить наборы реагентов в соответствии с их инструкциями по применению. Подготовить пробирку (1,5 мл и более) для приготовления реакционной смеси.
6.3 Подготовить и подписать 4 микропробирки (0,5 мл) для приготовления градуировочных растворов (Cl, С2, СЗ, С4).
6.4 Подготовить 36 микропробирок (9 стрипов) для проведения ПЦР.
6.5 Подготовить охлаждаемый штатив или ледяную баню: во время проведения манипуляций СО и реактивы должны находиться при температуре не выше +4 °С, при проведении разбавления вода и образцы СО должны иметь одинаковую температуру!
6.5 Приготовить реакционную смесь.
6.5.1 Разморозить 4 пробирки с ПЦР-смесью-1-FRT ГМ соя (1 пробирка рассчитана на постановку 10 реакций). Перемешать на центрифуге-вортексе и сбросить капли с помощью кратковременного центрифугирования.
6.5.2 Для проведения 36 реакций смешать в отдельной пробирке 370 мкл ПЦР-смеси-1 - FRT ГМ соя, 185 мкл ПЦР-буфера-Flu, 18,5 мкл полимеразы (TaqF) и 192 мкл деионизованной воды.
6.5.3 Перемешать смесь на вортексе, осадить кратковременным центрифугированием и внести по 20 мкл в соответствующие микропробирки подготовленные по п. 6.4 используя пипеточные дозаторы.
6.6 Приготовить градуировочные растворы.
Для приготовления градуировочных растворов используется ГСО «ГМ-СОЯ-ВПИИМ-5» и его последовательные разведения в деионизированной воде. Для построения градуировочных кривых используются следующие градуировочные растворы:
Таблица 3
| ||||||||||||||||||||||
|
* В зависимости от используемого набора для ПЦР | ||||||||||||||||||||||
6.6.1 Разморозить пробирку ГСО 9866-2011 «ГМ-СОЯ-ВНИИМ-5», выдержать при температуре от 0 °С до + 4 °С до полной разморозки, тщательно перемешать на центрифуге-вортексе не менее 5 секунд и центрифугировать в течение нескольких секунд для сброса капель.
6.6.2 Перенести 48 мкл раствора ГСО из пробирки «ГМ-СОЯ-ВНИИМ-5» в пробирку Cl (по п. 6.3.).
6.6.3 В пробирке С2 (по п. 6.3) смешать 16 мкл ГСО «ГМ-СОЯ-ВНИИМ-5» и 32 мкл деионизованной воды, полученный раствор перемешать на центрифуге-вортексе не менее 5 секунд и центрифугировать в течение нескольких секунд для сброса капель.
6.6.4 В пробирке СЗ (по п. 6.3) смешать 16 мкл раствора из пробирки С2 и 32 мкл деионизованной воды, полученный раствор перемешать на центрифуге-вортексе не менее 5 секунд и центрифугировать в течение нескольких
секунд для сброса капель.
6.6.5 В пробирке С4 (по п. 6.3) смешать 16 мкл раствора из пробирки СЗ и 32 мкл деионизованной воды, полученный раствор перемешать на центрифуге-вортексе не менее 5 секунд и центрифугировать в течение нескольких секунд для сброса капель.
Примечание. Данные объемы указаны исходя из 4-кратного дублирования для каждого из 4-х реакционных растворов.
6.7 Подготовить положительный контроль, отрицательный контроль и контрольные образцы.
6.7.1 Разморозить пробирку положительного контрольного образца (ПКО) из набора «Соя GTS 40-3-2 количество», выдержать при температуре от 0 °С до + 4 °С до полной разморозки, тщательно перемешать на центрифуге-вортексе не менее 5 секунд и центрифугировать в течение нескольких секунд для сброса капель.
6.7.2 Разморозить пробирку отрицательного контрольного образца (ОКО) из набора «Соя GTS 40-3-2 количество», выдержать при температуре от 0 °С до + 4 °С до полной разморозки, тщательно перемешать на центрифуге-вортексе не менее 5 секунд и центрифугировать в течение нескольких секунд для сброса капель.
6.7.3 Разморозить пробирку ГСО 9866-2011 «ГМ-СОЯ-ВНИИМ-1» (К1, исследуемый образец), выдержать при температуре от 0 °С до + 4 °С до полной разморозки, тщательно перемешать на центрифуге-вортексе не менее 5 секунд и центрифугировать в течение нескольких секунд для сброса капель.
6.7.4 Разморозить пробирку ГСО 9866-2011 «ГМ-СОЯ-ВНИИМ-0,1» (К0,1, исследуемый образец), выдержать при температуре от 0 °С до + 4 °С до полной разморозки, тщательно перемешать на центрифуге-вортексе не менее 5 секунд и центрифугировать в течение нескольких секунд для сброса капель.
7. Проведение поверки
7.1 Внешний осмотр
При внешнем осмотре устанавливают:
• соответствие комплектности модулей требованиям технической
документации;
• четкость маркировки;
• исправность механизмов и крепежных деталей.
Устройство считается выдержавшим внешний осмотр, если он соответствует
перечисленным выше требованиям. Устройство с механическими повреждениями к поверке не допускаются.
7.2 Опробование
В соответствии с указаниями Руководства по эксплуатации включить прибор. Результаты проверки общей работоспособности прибора считаются положительными, если при нажатии кнопки включения на задней панели прибора раздается звуковой сигнал и индикатор горит синим. В случае иной подсветки индикатора (зелёный или красный) поверку прибора проводить нельзя.
7.3 Подтверждение соответствия программного обеспечения.
Операция «Подтверждение соответствия программного обеспечения» состоит в определении номера версии автономного программного обеспечения.
Автономное программное обеспечение запускается при нажатии на иконку «micPCR» на рабочем столе управляющего компьютера (устройство должно быть включено).
Просмотр версии автономного ПО «micPCR» для устройств «М1С» происходит следующим образом: запустить программу «micPCR» пользователем с правами Администратора, нажать на кнопку «Help»
Затем в выпадающем меню войти в пункт «about micPCR», далее откроется всплывающий баннер с информацией о версии программы.
Просмотр версии прошивки доступен только при подключенном приборе, в меню Прибор -> Свойства (Properties).
Устройство считается прошедшим поверку, если номер версии совпадает с номером версии или выше номера версии, указанного в описании типа.
7.4 Определение метрологических характеристик.
7.4.1. В каждую анализируемую пробирку внести 20 мкл реакционного раствора и по 5 мкл образца калибровочного раствора отрицательного контроля в соответствии с Таблицей 4.
|
Таблица 4. | |||||||||||||||||||||||||||
|
7.4.2. Закрыть пробирки крышками и поместить их в ротор прибора в следующей последовательности: С1 - 4 шт., С2 - 4 шт., СЗ - 4 шт., С4 - 4 шт., К1 - 12 шт., КО. 1 - 4 шт., ПКО - 2 шт.. ОКО - 2 шт. Закрыть прибор.
7.4.3. Запрограммировать прибор для выполнения соответствующей программы амплификации и детектирования флуоресцентного сигнала и провести ПЦР-реакцию в режиме реального времени:
7.4.3.1 В левом верхнем углу нажать на иконку «New» выбрать «Assay»
7.4.3.2 В появившемся окне на боковой панели слева выбрать «Information»
|
- о к вини —■ z w- с— 1мк а |
|
7.4.3.3 В форме «Chemistry Туре» выбрать «Dual Hybridisation Probes» |
|
7 тшРСЯ W Д4 . 9 X |
7.4.3.4 В поле «Targets» задать имя канала «Yellow» и в выпадающем меню выбрать используемый краситель «НЕХ™», далее задать имя канала «Green» /«Orange»* и в выпадающем меню выбрать используемый краситель «ROX™» /«FAM™»*
*В зависимости от используемого набора для ПЦР
|
О iku ut ««* Им Op*» 1м WA. |
5
tr“
|
7.4.3.5 Набоковой панели слева выбрать вкладку «Profile» |
7.4.3.6 В появившемся окне задать циклограмму со следующими* параметрами: «Hold» 95°С for 15:00 min «Cycling» 45 cycles
95°C for 10 s
59°C for 60 s + установить получение данных нажав иконку камеры • В зависимости от используемого набора для ГГЦР
7.4.3.7 На панели инструментов нажать иконку «Save» параметров циклограммы на жестком диске компьютера.
для сохранения
вшьы ш
5
7.4.3.8 Во всплывающем окне задать расположение и имя файла
|
♦ .> - «Л • taw » 6 rw« Клл* » |
7.4.3.9 На панели инструментов нажать иконку «New» и выбрать в выпадающем меню «Run»
в ■ & у в
Г
Г
Hdp ИД Open ,!.е Save As % Run И Run from Template
МД Assay C Project
|
- D * |
7.4.3.10 В появившемся окне добавить сохранению циклограмму на боковой панели слева нажать на иконку «+» рядом с вкладкой «Assays»
7.4.3.11 В выпадающем меню выбрать «Browse...» и выбрать файл ранее сохранённой циклограммы