Инструкция 629-66
Инструкция по микробиологической диагностике кишечных заболеваний, вызванных шигеллами, салмонеллами и энтеропатогенными кишечными палочками
Купить Инструкция 629-66 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
I. Общие сведения
II. Микробиологическая диагностика
1. Материал для исследования
2. Ход исследования испражнений, мочи, дуоденального содержимого, трупного материала
3. Исследования крови для ранней диагностики брюшного тифа, паратифов А и В и других салмонеллезных заболеваний
4. Сроки выдачи и формулировка ответов
5. Затруднительные случаи идентификации выделенных культур
6. Фаготипирование брюшнотифозных бактерий
7. Фаготипирование паратифозных В бактерий (S. paratyphi B)
III. Серологическая диагностика кишечных заболеваний салмонеллезной этиологии
1. Реакция агглютинации (Видаля) при брюшном тифе, паратифах и прочих салмонеллезах
2. Реакция пассивной Vi-гемагглютинации (ViРПГА)
IV. Дополнительные исследования
1. Применение сред с антибиотиками для выделения шигелл
2. Серологическая диагностика дизентерии
3. Серологическая диагностика при колиэнтеритах
4. Реакция нарастания титра фага (РНФ)
Приложение 1. Применение салмонеллезного О-бактериофага
Приложение 2. Рецептура рекомендуемых консервирующих смесей, питательных сред и индикаторов
Приложение 3. Перечень диагностических препаратов, выпускаемых научно-исследовательскими институтами вакцин и сывороток и институтами эпидемиологии и микробиологии для диагностики кишечных инфекций
Приложение 4. Таблицы биохимических и серологических свойств бактерий семейства кишечных
Приложение 5. Схема хода исследования испражнений, мочи, трупного материала на шигеллы и салмонеллы
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5
стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ИНСТРУКЦИЯ
ПО МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКЕ КИШЕЧНЫХ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ШИГЕЛЛАМИ, САЛМОНЕЛЛАМИ И ЭНТЕРОПАТОГЕННЫМИ КИШЕЧНЫМИ ПАЛОЧКАМИ
ИНСТРУКЦИЯ
ПО МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКЕ КИШЕЧНЫХ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ШИГЕЛЛАМИ, САЛМОНЕЛЛАМИ И ЭНТЕРОПАТОГЕННЫМИ КИШЕЧНЫМИ ПАЛОЧКАМИ
Под общей редакцией Ю. И. ЛИТИНСКОГО н М. А. СМИРНОВОЙ МУТУШЕВОИ
ИЗДАТЕЛЬСТВО МЕДИЦИНА
МОСКВА 1967
мя порциями желчи (А п В или А, В, С). Можно посеять и каждую порцию отдельно, и их смесь.
Дуоденальное содержимое имеет характерное зеленовато-желтое окрашивание, и для него свойственна щелочная реакция, поэтому до посева в пробах проверяют реакцию лакмусовой бумажкой. Если обнаружена кислая реакция и материал представляет собой белую жидкость с хлопьевидным осадком, что характерно для желудочного сока, то такой материал исследованию не подлежит.
Собранный материал необходимо доставлять в лабораторию без промедлений. Лишь в исключительных случаях допускается хранение материала не более суток в холодильнике при температуре 4-2, 4-4°.
При транспортировке материала надо следить, чтобы жидкость в пробирках не смачивала ватные пробки, и предохранять собранный материал от замерзания.
2. Ход исследования испражнений, мочи,
дуоденального содержимого, трупного материала
Первый день исследования (посев материала на элективные среды). При любых показаниях к исследованию посев испражнений производят на чашку с плотной дифференциально-диагностической средой Пло-скнрева и в селенитовую среду обогащения, которая значительно увеличивает выссваемость салмопелл и ши-гелл.
В зависимости от показаний к обследованию при отсутствии селенитовой среды для посева испражнений можно применять следующие среды:
а) при кишечных заболеваниях неясной этиологии, при обследованиях на иосительство и с профилактической целью посев делают на чашки со средами Плоски-рева, Левина (или Асель—Либермана) и на среду обогащения Мюллера с последующим высевом на висмут-сульфита га р;
б) у больных с подтвержденной этнологией заболевания (дизентерия, брюшной тиф, ларатифы, прочие салмонеллезы), а также в очагах заболеваний с известным возбудителем можно проводить исследование целенаправленно — на шигеллы или на салмонеллы. В первом случае посев производят на одну чашку со сре-
дой Плоскирева и па одну — со средой Левина или Асель — Либсрмана; во втором случае — на чашки с теми же средами, а также обязательно на среду обогащения Мюллера или Кауфмана с последующим высевом на внсмут-сульфитагар. (О приготовлении сред обогащения см. Приложение 2).
С целью выявления энтеропатогенных кишечных палочек у детей до 2 лет с дисфункцией кишечника и в окружении их делают дополнительный посев на чашку со средой Эндо или Асель—Либермаиа.
Посев мочи1, желчи и трупного материала производят па те же среды.
Если испражнения доставлены в консерванте или среде обогащения, каплю взвеси испражнений наносят палочкой, вмонтированной в пробирку, пастеровской пипеткой или петлей па поверхность питательной среды у края чашки, тщательно растирают стерильным стеклянным пли алюминиевым шпателем на небольшой площадке. а затем, оторвав шпатель от питательной среды, не прожигая его, делают посев по остальной поверхности среды.
При сборе испражнений ректальной трубкой после перемешивания ее содержимого с консервирующей жидкостью можно сделать ею же высев на чашку, после чего тщательно растереть материал шпателем.
Испражнения, доставленные без консерванта, суспендируют в физиологическом растворе в соотношении I : 10 и сеют, как указано выше. При наличии слизистых и гнойных примесей их следует влючать в посевной материал.
Дуоденальное содержимое (желчь) засевают на чашку с плотной средой и во флаконы с бульоном в соотношении 1:10, после чего исходный материал оставляют в термостате. В течение последующих 3 дней делают высевы на плотные среды как из бульона, так и из пробирки с дуоденальным содержимым, которые в течение этого времени содержат в термостате при температуре 37°.
Кусочки паренхиматозных органов трупа растирают в стерильной фарфоровой ступке с физиологическим
раствором (1:5—1:10), после чего производят посев на плотные среды и среды обогащения-
На каждую чашку следует брать новую порцию любого посевного материала и в таком количестве, чтобы получить рост изолированных колоний.
Учитывая, что такие элективные среды, как среда Плоскирева и внсмут-сульфитная, подавляют рост кишечных сапрофитов, целесообразно увеличить количество посевного материала на этих средах в 3—5 раз по сравнению со средами Эндо и Левина.
Непременным условием для получения изолированных колоний является отсутствие конденсата на поверхности питательной среды, что достигается розливом охлажденной до температуры 50° среды и ее подсушиванием. Готовить среду лучше накануне.
Для высокоэлективных сред (Плоскирева, висмут-сульфитной и др.) можно пользоваться крышками из картона, вырезанными на 0,5 см шире диаметра чашки. Картон впитывает пары жидкости и устраняет их конденсацию на поверхности питательной среды. В этом случае среду готовят в день посева. Картонные крышки стерилизуют отдельно от чашек.
При посеве испражнений в среды обогащения соблюдают соотношение посевного материала и среды 1:5. Засеянные чашки, пробирки со средами обогащения и др. помещают в термостат при температуре 37° на 18—20 часов.
Учитывая возможность неудачи первичного посева (отсутствие роста или сплошной рост), исследуемый материал хранят в холодильнике до следующего дня.
Второй день исследования. Через 18—20 часов производят просмотр посевов на чашках и отбор подозрительных колоний, а также высев из сред обогащения па плотные питательные среды.
Для отбора подозрительных колоний посевы па чашках со средами Плоскирева и Левина рассматривают простым глазом или с помощью лупы в проходящем дневном или искусственном свете; посевы на чашках с висмут-сульфитным агаром рассматривают в падающем свете.
Патогенные кишечные бактерии на всех средах растут в виде круглых колоний с ровными краями диаметром 1—2 мм. На средах с эозином и метиленовым синим
(Левина), среде Эндо, среде Асель — Либермаиа колонии шигелл и салмонелл бесцветные, прозрачные (реже слегка мутноватые), нежные. Колонии палочек Зонне более плотные, иногда белесоватые. На среде Плоски-рева у всех патогенных микробов колонии также бесцветные, по более плотные и меньших размеров. На всех перечисленных средах шигеллы Зонне могут образовывать крупные, мутноватые колонии с изрезанными краями (так называемая плоская форма). На висмут-суль-фитном агаре салмопеллы тифа и паратифов вырастают, как правило, в виде черных или серовато-зеленых колоний с черным центром. Почти все салмопеллы изменяют цвет этой среды так, что па месте снятой колонии остается черный след. Просмотр чашек с висмут-сульфитным агаром производят через 24 и 48 часов после посева.
Колонии, подозрительные в отношении принадлежности к шнгеллам или салмоиеллам, пересевают в пробирки с комбинированными средами: средой Ресселя или «скошенным столбиком с мочевиной». На комбинированной среде посев делают сначала штрихом по скошенной поверхности, а затем уколом в глубину столбика. С каждой чашки снимают не менее 3 подозрительных колоний. Пробирки с посевами инкубируют в термостате при температуре 37° до следующего дня.
Если па чашках подозрительные колонии отсутствуют, а посев па среды обогащения не производили, может быть дан отрицательный ответ. Если материал был посеян в среду обогащения, ответ выдают после учета результатов дополнительного высева. Высев из селенитовой среды обогащения производят па чашку со средой Плоскпрева, а из сред Мюллера и Кауфмана — на чашку с висмут-сульфитным агаром.
Из посева желчи на бульон и исходной желчи, содержащихся в термостате, делают первый высев на чашки с висмут-сульфитным агаром и средой Плоски-рева.
При исследовании на наличие энтеропатогенных кишечных палочек производят пробную агглютинации на стекле подозрительных колоний со среды Эндо или Асель — Либермаиа. Посевы рассматривают в падающем или проходящем свете. Колонии энтеропатогенных кишечных палочек большей частью малинового цвета с фиолетовым оттенком, реже розовые, как правило, не
имеют металлического блеска. В случае роста однотипных колоний 10 из них испытывают в реакции агглютинации на стекле с комплексными сыворотками против наиболее распространенных серотипов (ОИ1В4, 055В5, 02GB6 н т. д.)
В пробной агглютинации испытывают только часть колонии для того, чтобы в случае положительной реакции можно было выделить культуру из остальной части колонии для ее дальнейшей идентификации.
Если на чашке вырастает несколько видов колоний (типичные, с металлическим блеском и без такового, разного размера), то в пробной агглютинации испытывают все виды колоний.
Колонии, давшие положительную реакцию агглютинации с одной из сывороток, высевают на скошенный агар. Если микробы из всех отобранных колоний не агглютинировались, дается отрицательный ответ. При наличии бесцветных, прозрачных колоний, подозрительных на принадлежность к шнгеллам и салмомеллам, их отсевают для дальнейшего изучения.
Если в результате прямого посева испражнений при исследовании как па шигеллы и салмонеллы, так и на патогенные эшернхии не выросло вообще ни одной колонии, необходимо произвести повторный высев, увеличив порцию засеваемого материала. При повторном отсутствии роста следует получить новый материал для анализа.
Третий день исследования. Через 48 часов производят идентификацию культур, высеянных накануне па среду Ресселя или «скошенный столбик», по ферментации лактозы, глюкозы и мочевины, а также по серологическим свойствам в реакции агглютинации на стекле с адсорбированными специфическими сыворотками. Предварительно следует убедиться в чистоте культуры, выросшей
1 Смеси сывороток к энтеропатогелпым кишечным палочкам, наиболее часто вызывающим острые кишечные заболевания у маленьких детей, выпускают производственные отделы институтов. Смеси можно приготовить и в лаборатории из неадсорбированных сывороток. Их составляют не более чем из 5 типовых сывороток; при этом разведение каждой сыворотки не должно быть больше 1 : 10. Например, в смесь из 5 сывороток берут по J мл сыворотки и 5 мл физиологического раствора. При И-титре не выше 1 :200 следует делать разведение не более 1 : 5.
И
на среде Росселя или «скошенном столбике с мочевиной». При сомнении в чистоте культуры производят рассев се на чашки со слабо щелочным питательным агаром; при росте через 18—24 часа однородных колоний можно считать выделенную культуру чистой, при неоднородном росте все виды колонии отсевают на среду Ресселя или «скошенный столбик с мочевиной».
На этих средах в случае ферментации глюкозы реакция среды становится кислой и цвет индикатора в столбике изменяется. Если при расщеплении глюкозы, помимо кислоты, образуется газ, в среде появляются пузырьки. При ферментации лактозы изменяется цвет индикатора в скошенной части среды. При расщеплении мочевины увеличивается щелочность сред и цвет соответствующего индикатора меняется.
Если культуры, высеянные на «короткий» пестрый ряд, сбраживают лактозу и глюкозу с образованием газа, они принадлежат к разновидностям кишечной палочки. Если культуры расщепляют мочевину, они относятся к роду протеев. В этих случаях, если не был произведем посев в среду обогащения, дают отрицательный ответ.
Культуры, не расщепляющие лактозу и мочевину, но ферментирующие глюкозу, подвергают дальнейшему изучению. Исследуют морфологию выделенного микроба в мазке, окрашенном по Граму. Все бактерии семейства кишечных являются грамотрицательнымн палочками.
Культуры, ферментирующие глюкозу без газообразования, подозрительны как относящиеся к дизентерийным или брюшнотифозным.
Палочки, ферментирующие глюкозу с образованием газа, т. е. дающие в среде пузырьки, могут принадлежать к роду салмоиелл.
Все подозрительные культуры пересевают на пестрый ряд состоящий из полужидких или жидких с поплавками сред с маннитом и сахарозой, а также на бульон для определения образования индола и сероводорода. С этой целью под пробку в пробирке с бульоном помещают две индикаторные бумажки (способ приготовления индикаторных бумажек см. в Приложении №2). При наличии индола соответствующая бумажка краснеет, при выделении сероводорода — другая чернеет. Бульон можно заменить 1% пептонной водой.
Если посев был произведен на полужидкие среды с углеводами, они могут быть использованы для определения подвижности культуры. При употреблении жидких сред с поплавками для определения подвижности в пестрый ряд включают пробирку с полужидким агаром (0,2%).
Серологическая идентификация культур, ферментирующих глюкозу без газообразования. Ее производят путем постановки реакции агглютинации па стекле с адсорбированными сыворотками.
Реакцию ставят следующим образом: на обезжиренное предметное стекло наносят 3—4 капли различных сывороток. Петлю исследуемой культуры вносят в сыворотку и тщательно размешивают ее путем растирания круговыми движениями петли. После каждой сыворотки петлю прожигают на огне. Положительная реакция иа стекле должна наступить в течение I—3 минут.
В соответствии с частотой выделения разных видов возбудителей в целях экономии труда, времени н диагностических препаратов сыворотки для постановки реакции применяют в определенной последовательности.
Сначала испытывают культуру в реакции с агглютинирующей адсорбированной поливалентной сывороткой Флекснера, Ныокестл, Зопис2-
При наличии отрицательного результата культуру проверяют с адсорбированными брюшнотифозными сыворотками (9, Vi, d).
Если культура не агглютинируется О-сывороткой (9), но агглютинируется Vi-сывороткой, О-агглютииа-бильность может быть восстановлена путем разрушения Vi-антигсна, расположенного на поверхности клетки и препятствующего реакции агглютинации с О-сывороткой. Разрушение Vi-антнгена достигается путем нагревания культуры в водяной бане в течение часа при температуре 56°. Для агглютинации с О- и Vi -сыворотками культуру следует брать с косяка среды Ресселя или «скошенного столбика», а для агглютинации с Н-сыворот-кой (d) — из конденсационной воды.
В случае положительной реакции агглютинации на стекле с адсорбированными брюшнотифозными сыворотками серологическая идентификация культуры может считаться законченной.
При отсутствии агглютинации с этими сыворотками применяют другие агглютинирующие адсорбированные поливалентные сыворотки к шигеллам Бойда, Григорьева—Шига и Штуцера—Шмитца, Лардж—Сакса (3, 4, 5, 6, 7) и провизорных типов (8, 9, 10) 3.
При положительном результате реакции агглютинации на стекле с одной из поливалентных сывороток продолжают серологическую идентификацию культуры, для чего ее испытывают с адсорбированными сыворотками, входящими в состав поливалентной.
Например, если получена положительная реакция с поливалентной сывороткой Флекснера, Ньюксстл, Зонне, культуру испытывают раздельно с поливалентной агглютинирующей адсорбированной сывороткой Флекснера и с адсорбированными сыворотками Ньюкестл и Зонне.
Для шигелл, не имеющих подразделения на серологические типы, в случае положительной реакции с соответствующей моновалентной адсорбированной сывороткой серологическая идентификация может считаться законченной (Зонне, Ньюкестл, Штуцера—Шмитца, Г рпгорьева—Шига).
При положительной реакции с поливалентными сыворотками Флекснера, Бойда, Лардж—Сакса и провизорных типов производят серологическое типированне согласно новой отечественной классификации дизентерийных бактерий (см. табл. 7):
а) для культур Флекснера с помощью типовых (I, II, III, IV, V) и групповых (3, 4; б; 7, 8) сывороток;
б) для культур Бойда с помощью типовых (с 1 по 15) сывороток;
в) для культур Лардж—Сакса с помощью типовых (с 3 по 7) сывороток;
г) для культур провизорных типов с помощью типовых (с 8 по 10) сывороток.
Серологическая идентификация культур, ферментирующих глюкозу с образованием газа. Серологическую идентификацию газообразующих культур начинают с испытания их в реакции агглютинации на стекле с агглютинирующими адсорбированными поливалентными салмонеллезными О-сыворотками: групп А, В, С, Д, Е и редких групп.
При получении отрицательного результата следует проверить культуру в реакции агглютинации на стекле с адсорбированной сывороткой Нькжестл (рецептор VI)
При положительной реакции с одной из поливалентных салмоиеллезных сывороток ставят реакцию раздельно с каждой из 0-сывороток, входящих в поливалентную, для определения, к какой из групп по схеме Кауфмана—Уайта принадлежит выделенная культура.
Например, при положительной реакции агглютинации с поливалентной сывороткой групп А, В, С, D, Е культуры агглютинируют последовательно с моиорецел-торными салмонеллезными О-сыворотками (2, 4, 7, 8, 9,3,10).
После установления принадлежности к группе (А, В, С, D, Е или другой) испытывают культуру с адсорбированными монорецепторнымп Н-сывороткамн против Н-антигенов специфической фазы салмоиелл, входящих в данную группу. При этом Н-сыворотки применяют в порядке, соответствующем распространению видов сал-монелл в данной местности. После определения специфической (1-й) фазы Н-антигена испытывают культуру в реакции на стекле с сыворотками против неспецифической (2-й) фазы Н-антигена и таким образом устанавливают антигенную формулу выделенной культуры (см. Приложение 4. табл. 9).
Реакцию агглютинации с адсорбированными (моно-рецепторными) сыворотками ставят на стекле по методике, описанной выше. При наличии соответствующего антигена агглютинация салмоиелл монорецепторными сыворотками наступает в течение 1—2 минут. 4
Для агглютинации с 0-сыворотками культуру следует брать с верхней части скошенного агара, для агглютинации с Н-сыворотками — из конденсационной воды, где расположены наиболее подвижные особи.
В лаборатории нельзя готовить самостоятельно смеси из отдельных монорецепторных О- и Н-сывороток, так как они не подлежат разведению. Можно готовить смеси из неадсорбированных сывороток к представителям разных салмонелл (например, из сывороток к сал-монеллам паратифа A, typhi murium, cholerae suis, new-port, enteritidis, anatum. В этом случае берут по 1 части сывороток и добавляют 19 частей физиологического раствора, чтобы получить разведение каждой сыворотки 1 :25. Эту смесь можно применять взамен адсорбированной поливалентной сыворотки групп А, В, С, D, Е.
Серологическая идентификация энтеропатогенных эшерихий. Культуры, выделенные с чашек со средой Эндо или Асель — Либермана, вновь испытывают в реакции агглютинации на стекле со смесыо агглютинирующих ОВ-колисывороток.
Если культура, выросшая па скошенном агаре, не агглютинируется смесыо ОВ-сывороток, выдается отрицательный ответ.
Культуры, дающие положительную реакцию в смеси сывороток, испытывают далее с каждой из типовых сывороток, входящих в данную смесь. Типовые сыворотки разводят физиологическим раствором в соотношении 1:5— 1 : 10. При положительном результате агглютинация наступает быстро и носит крупнохлопчатый характер.
Если культура агглютинируется всеми или несколькими сыворотками, входящими в смесь, выдается отрицательный ответ.
При положительном результате с одной из сывороток и при отсутствии агглютинации в физиологическом растворе хлористого натрия ставят развернутую реакцию агглютинации в пробирках, начиная с разведения 1:50 и до титра сыворотки, указанного на ампуле, со взвесью живой культуры для определения титра В-антигена и с гретой (1 час при температуре 100°)—для определения О-антигена. Для приготовления взвеси культуру смывают физиологическим раствором с поверхности скошенного агара, после чего часть ее, отлитую в отдельную
Центральный научно-исследовательский институт эпядемиоло-гии Министерства здравоохранения СССР
Ю. И. Литинский, М. А. Смирнова-Мутушева*
В. А. Килсссо
Московский институт эпидемиологии и микробиологии Министерства здравоохранения РСФСР
Р. В. Элштейн-Литвак, Ф. Л. Вильшанская,
М. О. Биргер, Н. А. Краскина
Ленинградский институт эпидемиологии и микробиологии имени Пастера Министерства здравоохранении РСФСР
Э. М. Новгородская
Государственный контрольный институт медицинских биологических препаратов имени Тарасевича Министерства здравоохранения СССР
Е. Д. Равич-Биргер
Московский научно-исследовательский институт вакцин и сывороток имени Мечникова Министерства здравоохранения СССР
И. В. Голубева, В. А. Альтгаузен-Рагинская,
Н. А. Хоменко
Седьмая инфекционная клиническая больница Москвы
Е. Г. Мельник
Главное санитарно-эпидемиологически управление Министерства здравоохранения СССР
Ю. П. Мусихина
5—3—5
заказное издание
пробирку, прогревают в водяной бане при температуре 100° в течение часа. Методика разведения сыворотки аналогична тон, которая описана для постановки реакции Видаля (см. стр. 41).
Одновременно производят посев той же культуры на среду Ресселя с лактозой и глюкозой, на среды с маннитом и сахарозой и на бульон (или 1% пептонную воду) для обнаружения индола. Пробирки с посевами и штативы с реакцией агглютинации ставят в термостат на 18— 20 часов.
Независимо от положительного или отрицательного результата серологического исследования все выделенные культуры и их дубликаты должны храниться в лаборатории вплоть до выдачи окончательного ответа.
Кроме серологической идентификации выделенных культур, на 3-й день исследования производят просмотр чашек с посевами из сред обогащения.
Подозрительные колонии отсевают на среду Ресселя или «скошенный столбик с мочевиной».
В случае применения селенитовой среды обогащения при отсутствии подозрительных колоний на чашке со средой Плоскирева (если результат первичного посева был также отрицательным) может быть выдан окончательный отрицательный ответ.
Чашки с виемут-сульфитпым агаром, применявшимся для высева из среды Мюллера, независимо от результатов их просмотра оставляют в термостате еще на 24 часа. На 3-й день также просматривают чашки с первым высевом дуоденального содержимого из флаконов с бульоном. Подозрительные колонии пересевают на среду Ресселя или «скошенный столбик с мочевиной».
Независимо от наличия или отсутствия подозрительных колоний производят второй высев на чашки из флаконов с посевом дуоденального содержимого.
Кроме перечисленных выше обязательных методов, в случае необходимости на 3-й день могут быть произведены также некоторые дополнительные виды исследования: посевы для определения фаголизабнльности выделенного микроба и его чувствительности к антибиотикам.
Определение чувствительности дизентерийных культур к поливалентному дизентерийному бактериофагу и брюшнотифозных культур к брюшнотифозному фагу
Утверждено Начальником Главного санитарно-эпидемиологического управления Минздрава СССР
П. ЛЯРСКИМ 11 мая 1966 г.
№ 629—6G
I. ОБЩИЕ СВЕДЕНИЯ
Острые кишечные заболевания бактериальной природы обычно вызываются патогенными бактериями семейства кишечных: салмонсллами ( в том числе салмонел-ламп тифа, паратифа А, паратифа В), шигеллами, эшерихиями (энтеронатогенные кишечные палочки). Во всех случаях наиболее достоверным методом для подтверждения диагноза является выделение возбудителя, поэтому при всех подобных заболеваниях применяется бактериологический метод исследования.
В связи с тем что высев этиологического агента не всегда удается, значительную помощь в диагностике кишечных заболеваний оказывают серологические исследования.
Исследования для обнаружения патогенных кишечных микробов производятся с целью:
а) диагностики острого и хронического заболевания;
б) выявления бактерионосительства у реконвалес-центов перед выпиской из больницы;
в) выявления источника заболевания;
г) выявления бактерионосителей среди работников пищевых объектов, детских и лечебных учреждений, а также других лиц, приравненных к упомянутым группам.
Получение положительного результата при любом исследовании должно быть правильно истолковано в зависимости от совокупности обстоятельств: наличия заболевания у самого обследуемого или в его окружении, симптомов этого заболевания, характера материала, доставленного для исследования, профилактических или диагностических целей исследования и т. д.
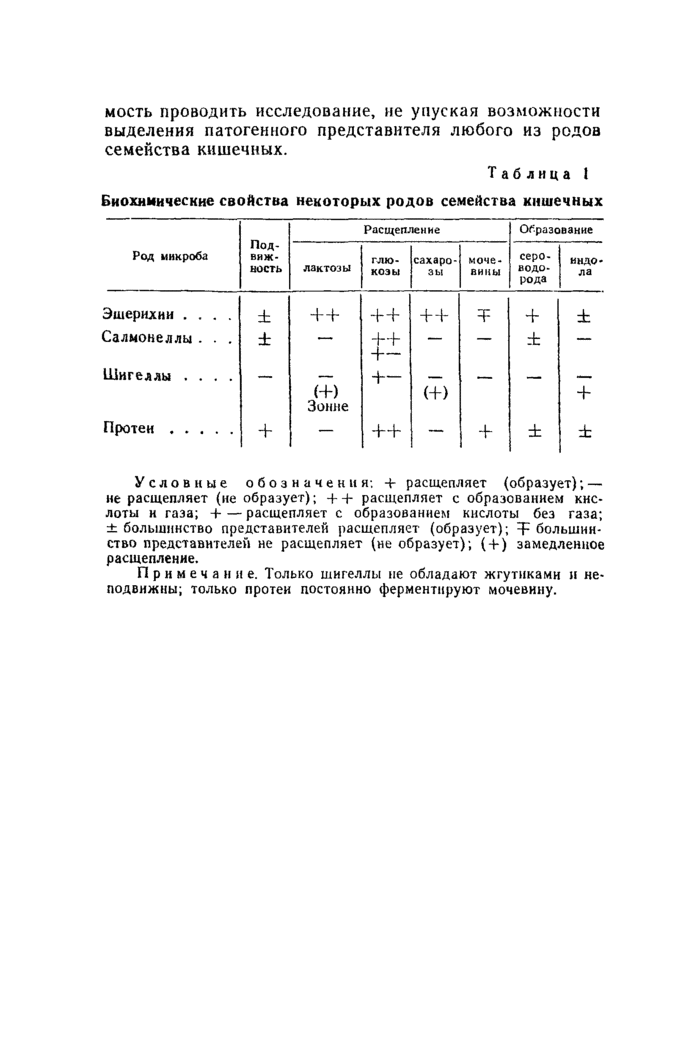
Первоначальное представление о принадлежности микроба к семейству кишечных возникает на основании изучения его формы (палочки) и отношения к окраске по Граму (грамотрицательиые). Однако все микробы семейства кишечных морфологически подобны, в связи с чем микроскопические признаки не являются дифференциальными. Основные различия между отдельными представителями этого семейства заключаются в разном метаболизме и антигенной структуре. Отсюда следует, что идентификация патогенных кишечных бактерий построена на определении их ферментативной и серологической характеристики.
Первичное выделение проводят па питательных средах с лактозой, позволяющих выявить разное отношение микробов к этому углеводу. Отсутствие, способности ферментировать лактозу в первые сутки является одним из кардинальных дифференциальных признаков для патогенных микробов семейства кишечных (за исключением энтеропатогеиных кишечных палочек). Дальнейшая идентификация основывается на способности расщеплять углеводы, мочевину и образовывать летучие продукты метаболизма (индол, сероводород). Идентификация заканчивается реакцией агглютинации с видовыми, типовыми и групповыми диагностическими сыворотками; она позволяет определить антигенную формулу изучаемой культуры, специфичную для рода, вида, подвида и типа.
Основные биохимические признаки некоторых родов семейства кишечных бактерий представлены d табл. 1.
Основными возбудителями острых кишечных инфекций, возникающих в виде спорадических заболеваний или эпидемических вспышек, являются шигеллы и сал-монеллы тифа и паратифов А и В. Прочие салмонеллы чаще служат причиной пищевых токсикоиифекций, эпидемиология которых носит иной характер. Эптеропато-генные кишечные палочки являются, как правило, возбудителями колиэнтеритов у маленьких детей. Нередко имеют место смешанные инфекции или возникновение заболеваний, вызванных одним кишечным микробом на фоне носительства другого.
Полиэтиологичность кишечных заболеваний, сходная клиническая симптоматика при разных возбудителях и наличие стертых форм заболеваний диктуют необходн-
мость проводить исследование, не упуская возможности выделения патогенного представителя любого из родов семейства кишечных.
Таблица I
|
Биохимические свойства некоторых родов семейства кишечных | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Условные обозначения: + расщепляет (образует); — не расщепляет (не образует); + + расщепляет с образованием кислоты н газа; + — расщепляет с образованием кислоты без газа; ± большинство представителей расщепляет (образует); 4- большинство представителей не расщепляет (не образует); (Ч-) замедленное расщепление.
Примечание. Только шигеллы не обладают жгутиками и неподвижны; только протеи постоянно ферментируют мочевину.
И. МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА 1. Материал для исследования
Основным материалом для исследования служат испражнения. При заболеваниях, протекающих по типу пищевых токсиконнфекцпн, весьма целесообразно также исследование рвотных масс и промывных вод желудка. Кроме того, материалом для выделения бактерий являются кровь, моча, желчь, органы трупа и в некоторых случаях пуиктат костного мозга, соскоб розеол и т. д.
При остром кишечном заболевании выделение из фекалий возбудителя — шигелл, салмоиелл и эитеропа* тогеииых кишечных палочек — удается тем чаще, чем раньше от начала заболевания производят исследование; особенно важно его провести до начала лечения антибиотиками
Появление у больного повторно некоторых, даже слабо выраженных, клинических симптомов (повышение температуры до 37°, незначительное ухудшение характера стула, его учащение и другие «мнкроснмнто-мы»), как правило, сопровождается увеличением концентрации возбудителя в испражнениях.
Многократное бактериологическое исследование, производимое по обоснованным клиническим показаниям, увеличивает возможность обнаружения микробов, т. е. улучшает диагностику, уточняет сроки бактериовы-делеипя и выписки, что весьма важно для своевременного и правильного лечения и проведения соответствующих противоэпидемических мероприятий.
1 В больничных условиях материал дли мерного нсслсдоцапии следует забирать в приемном покое.
При брюшном тифе и парлтифах выделение возбудителей из фекалий и мочи является наиболее успешным с конца 2-й недели заболевания. При отрицательных результатах проводят повторные исследования с промежутками в 3—G дней.
На 1—2-й педеле заболевания брюшным тифом или паратнфами возбудителя легче всего выделить из крови (гемокультура). При исследовании на бактерионосительство дополнительным материалом для исследования служит желчь (дуоденальное содержимое).
Бактериологическое исследование органов трупа нужно производить как можно быстрее после смерти. В случае смерти от острых кишечных заболеваний исследованию подлежат: содержимое толстых и тонких кишок, отрезки кишечника, кусочки печени, селезенки, желчь, кровь, костный мозг, мезентериальные железы.
Материал для посева доставляют в стерильной посуде (пробирки, баночки и стаканчики), снабженной бумажной наклейкой, где указывается фамилия обследуемого и наименование исследуемого материала. К материалу, направленному в лабораторию на исследование, должен быть приложен препроводительный документ, в котором излагаются следующие данные: наименование учреждения, направляющего материал, фамилия, имя, возраст обследуемого, адрес, место работы, должность (если материал взят у ребенка, то указывают, посещает ли он детское учреждение и какое), дата заболевания, диагноз или другие показания к анализу, дата и время сбора материала, фамилия и должность лица, собиравшего материал.
Сбор испражнений для исследования. Наиболее полноценным материалом для исследования являются испражнения после дефекации. При естественной дефекации сбор производят с судна, горшка, пеленки стерильным деревянным шпателем или стерильной стеклянной палочкой, вмонтированными в ватную пробку пробирки. При наличии в испражнениях слизи или гноя их необходимо включать в посевной материал.
Судна и горшки после использования следует дезинфицировать осветленным раствором хлорной извести (но не лизолом или карболовой кислотой), а затем многократно и тщательно промывать горячей водой для
того, чтобы на них не оставалось следов дезинфицирующих веществ.
Испражнения можно собирать также непосредственно из прямой кишки с помощью ректальной трубки (трубка Цимана). Стеклянная ректальная трубка имеет диаметр от 5 мм (для детей) до 10 мм (для взрослых) и длину около 150 мм; нижний конец ее запаян наглухо, как в пробирке, и на расстоянии 15—20 мм от него имеются два отверстия с оплавленными краями, расположенные с двух сторон (одно несколько ниже другого). Открытый конец трубки закрывают ватой, трубку через ватную или ватно-марлевую пробку опускают в пробирку и в таком виде стерилизуют. Такие трубки вводят в прямую кишку на 8—10 см. Собирая материал ректальной трубкой, надо добиваться получения достаточного для посева количества кала.
При профилактическом обследовании здоровых людей на носнтельство салмонелл исследуемым лицам необходимо давать предварительно (за 2—3 часа) 25—30 г сернокислой магнезии, которая является желчегонным и слабительным Сбор испражнений производят на стерильные эмалированные тарелки, Можно использовать также тазы, лотки, картонные тарелки, картонные стаканчики (при массовых обследованиях) или ректальные трубки после дефекации.
Больным и реконвалесцентЯм давать слабительное не рекомендуется. В этих случаях не следует также пользоваться ректальной трубкой для взятия материала.
Материал для исследования, как правило, не рекомендуется собирать в период применения антибиотиков.
При невозможности немедленного посева собранные порции испражнений или ректальную трубку с материалом помещают в пробирки с консервирующим раствором. В качестве консерванта лучше всего применять глицериновую смесь. Удовлетворительный результат дает также буферный раствор фосфорнокислых солей (pH 8,0). В пробирку наливают 5 мл консерванта; количество помещенных в него испражнений должно составлять около Уз объема консерванта (приготовление консервирующих растворов см. в Приложении 2).
1 При отсутствии сернокислой магнезии можно давать глауберову соль в половинной дозе.
Сбор мочи. Мочу (20—30 мл) собирают в стерильную посуду, перед посевом ее центрифугируют и осадок засевают на среды обогащения и плотные дифференциальные среды.
Взятие крови. Для бактериологической диагностики брюшного тифа и паратифов на 1-й неделе заболевания берут 5—10 мл крови стерильным шприцем из локтевой вены и засевают в соотношении 1:10 в одну из сред обогащения: желчную среду Раппопорт или бульон с 10—20% бычьей желчи (см. Приложение 2). Посев крови производят у постели больного с соблюдением правил асептики.
Хотя легче выделить культуру из крови в течение 1—2-й недели заболевания, ее можно высеять на протяжении всего лихорадочного периода и во время рецидивов, увеличивая количество засеваемой крови до 15— 20 мл. Соотношение объемов засеваемой крови и питательной среды должно сохраняться и в этом случае.
При отсутствии желчи кровь можно засевать по способу Клодницкого и Самсонова в 80—100 мл стерильной дистиллированной или водопроводной воды.
При получении для исследования уже свернувшейся крови часть сыворотки отсасывают н используют для реакции Видаля, а сгусток после измельчения может быть посеян на желчные среды.
Взятие желчи (дуоденального содержимого). Пробы содержимого двенадцатиперстной кишки берут при помощи дуоденального зонда. Зондирование производят в лечебном учреждении или на бактерионосительском пункте. (Возможность применения этого метода исследования клиницист должен решать в каждом случае строго индивидуально.)
Зонд вводят обследуемому натощак. Через 15 минут после того как из зонда выделится первая порция дуоденального сока, в двенадцатиперстную кишку через зонд вводят 50 мл 30% стерильного раствора сернокис* лой магнезии. Этот раздражитель вызывает опорожнение желчного пузыря.
Необходимо собрать в отдельные стерильные пробирки порцию А из двенадцатиперстной кишки, порцию В из желчного пузыря и порцию С из желчных протоков. В лабораторию доставляют пробирки с двумя или тре-
1
При посеве мочи в селенитовую среду обогащения последнюю берут в двойной концентрации и разводят пополам засеваемой мочой (ем. Приложение 2).
2
Поливалентные сыворотки готовят производствсчшые отделы институтов. Приготовление в лаборатории смеси из адсорбированных сывороток не допускается, так как они не подлежат разведению.
3
Необходимо учесть, что кроме салмонеллы брюшного тифа, встречаются очень редко варианты салмонелл. не образующие газа при ферментации углеводов. Поэтому культуры, не агглютинирующиеся всеми перечисленными сыворотками, следует испытывать с салмонеллезными поливалентными сыворотками.
4
Среди дизентерий пых культур Ныокестл иногда встречаются газообразующис варианты, поэтому культуры грамотрицательных газообразующих палочек надо испытывать сывороткой Ныокестл.