Изменение №4 к ГОСТ 25047-87
Купить Изменение №4 к ГОСТ 25047-87 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1
стр. 2

стр. 3

стр. 4

стр. 5
стр. 6
стр. 7
стр. 8
стр. 9

стр. 10
Страница1
II ЗДРАВООХРАНЕНИЕ
МКС 11.040.20 Группа Р22
Изменение № 4 ГОСТ 25047-87 Устройства комплектные эксфузион-иые, инфузионные и трансфузионные однократного применения. Технические условия
Принято Межгосударственным советом по стандартизации, метрологии и сертификации (протокол № 17 от 22.06.2000)
Зарегистрировано Бюро по стандартам МГС № 4032
|
За принятие изменения проголосовали: | ||||||||||||||||||||||||||||
|
Первая страница стандарта. Графа «Дата введения». Исключить слова: «Дата введения в части пп. 1.3.17, 1.3.18 — 01.01.91».
Вводную часть после третьего абзаца изложить в новой редакции: «Обязательные требования к качеству продукции, работы (процесса), услуг изложены в пп. 1.2.3, 1.3.2, 1.3.4, 1.3.5, 1.3.6, 1.3.7, 1.3.8, 1.3.9, 1.3.10, 1.3.11, 1.3.12, 1.3.13 (в части стерильности), 1.3.14, 1.3.17, 1.3.18, 1.4».
Пункт 1.2.2. Первый абзац изложить в новой редакции:
(Продолжение см. с. 6)
5
Страница2
(Продолжение изменения № 4 к ГОСТ 25047-87)
«В зависимости от назначения и конструктивных особенностей устройства в пределах каждого типа подразделяют на виды, указанные на черт. 1 — 12 приложения 1 и в табл. Ь;
таблицу 1 дополнить обозначениями устройств — П Р 21—05, ПР 23-05 (после ПР 11-01); ПК 21-05 (после ПК 21-01), ПК 23-05 (после ПК 22—02) и соответствующими данными:
|
Обозначение вида устройства |
Наименование вида устройства |
Условия применения |
Номер чертежа приложения 1 |
|
ПР 21-05 |
Устройство для вливания кровезаменителей и инфузионных растворов |
Переливание из бутылки, полужссткая капельница |
10 |
|
ПР 23-05 |
Устройство для вливания кровезаменителей и инфузионных растворов |
Переливание из бутылки или полимерного контейнера, полужссткая капельница, полимерная игла к бутылке или контейнеру имеет каналы для прохода воздуха и жидкости |
12 |
|
ПК 21-05 |
Устройство для переливания крови, кровезаменителей и инфузионных растворов |
Переливание из бутылки, полужссткая капельница |
9 |
|
ПК 23-05 |
Устройство для переливания крови, кровезаменителей и инфузионных растворов |
Переливание из бутылки или полимерного контейнера, полужссткая капельница, полимерная игла к бутылке или контейнеру имеет каналы для прохода воздуха и жидкости |
11 |
Пункт 1.2.3 изложить в новой редакции:
«1.2.3. Основные размеры устройств должны соответствовать указанным на черт. 1 — 12 приложения 1. Чертежи не определяют конструкцию устройств».
Пункт 1.3.1. Исключить аббревиатуру: СССР.
Пункт 1.3.2 изложить в новой редакции:
«1.3.2. Трубки и капельница должны быть изготовлены из материалов,
(Продолжение см. с. 7)
6
Страница3
(Продолжение изменения № 4 к ГОСТ 25047’—87)
позволяющих видеть невооруженным глазом пузырьки воздуха, уровень жидкости и последовательность каплепадения».
Пункт 1.3.5. Второй абзац изложить в новой редакции:
«Допускается не более 3 механических частиц».
Пункты 1.3.7, 1.3.13 изложить в новой редакции:
«1.3.7. Соединения трубок специальных игл диаметром 1,5 или 1,2 мм с головками должны выдерживать нагрузку при растяжении не менее 50 Н, соединения трубок специальных игл диаметром 0,8 мм — не менее 45 Н, а соединения всех других деталей устройства, кроме соединения инъекционной иглы с головкой типа «Рекорд» или «Луер», должны выдерживать нагрузку при растяжении не менее 20 Н после стерилизации.
1.3.13. Инъекционная игла диаметром 1,5 или 1,2 мм должна быть в индивидуальной таре, стерильна, иметь силиконовое покрытие. Допускается применять инъекционную иглу диаметром 0,8 мм для устройств типа ПР».
Пункты 1.3.15, 1.3.16, 3.11, 3.12, 3.13. Заменить ссылку: ГОСТ 20790-82 на ГОСТ 20790-93.
Пункт 1.4.1 изложить в новой редакции (таблицу 2 исключить):
«1.4.1. В состав комплекта каждого эксфузионного, инфузионного и трансфузионного устройства должны входить:
основная часть;
воздуховод (для устройств с металлическими одноканальными иглами):
инъекционная игла (для инфузионных и трансфузионных устройств) в индивидуальной таре, вложенная в основную тару устройства, или без индивидуальной тары, вложенная в потребительскую тару устройства;
потребительская тара.
Основная часть, воздуховод и инъекционная игла должны быть вложены в потребительскую /основную тару. Потребительская/ основная тара должна быть заварена.
Примечание. Допускается устройства инфузионные и трансфузи-онные в потребительской таре комплектовать иглами инъекционными в индивидуальной таре в равных количествах и вкладывать в основную тару».
Пункты 1.5.1, 1.5.2. Примечание исключить.
Пункты 1.5.1, 1.5.4. Исключить слова: «наименование министерства».
Пункты 1.5.2, 1.5.5. Исключить слова: «марка «Медэкспорт», «Экспортер В/О «Медэкспорт»; заменить слова: «Сделано в СССР» на «Сделано в
_».
страна-изготовитель
Пункты 1.5.4, 1.5.5. Знак сноски и сноску исключить.
Пункт 1.5.6 изложить в новой редакции:
(Продолжение см. с. 8)
7
Страница4
(Продолжение изменения № 4 к ГОСТ 25047-87)
«1.5.6. Транспортная маркировка — по ГОСТ 14192-96 с указанием на каждом транспортном ящике массы брутто и манипуляционных знаков, соответствующих надписям: «Хрупкое. Осторожно», «Беречь от влаги».
Пункт 1.6.1. Заменить ссылку: ГОСТ 13511-84 на ГОСТ 13511-91.
Пункт 2.1. Заменить слова: «и периодическим испытаниям» на «периодическим и сертификационным испытаниям».
Пункты 2.8—2.10 изложить в новой редакции:
«2.8. Испытания на соответствие требованиям п. 1.3.10 (в части стерильности и токсичности) и п. 1.3.13 (в части стерильности) проводят при приемосдаточных и периодических испытаниях в соответствии с порядком проведения контроля стерильности стерилизованных медицинских изделий на предприятиях, «Методическими указаниями по контролю стерильности изделий медицинского назначения, стерилизованных радиационным методом» и «Методикой контроля токсичности медицинских изделий однократного применения, стерилизованных радиационным или газовым методом» или «Методикой контроля токсичности стерильных систем комплектных эксфузионных, трансфузионных и инфу-зионных однократного применения», утвержденными Минздравом.
Объемы выборки для контроля стерильности и токсичности определяют по вышеуказанным методикам.
2.9. Испытания на соответствие п. 1.3.10 (в части пирогенности) проводят при приемосдаточных и периодических испытаниях (один раз в год).
Объем выборки для контроля пирогенности определяют по «Методике контроля пирогенности систем комплектных эксфузионных, трансфу-зионных и инфузионных однократного применения» или «Методике контроля пирогенности медицинских изделий однократного применения, стерилизованных радиационным или газовым методом», утвержденных Минздравом.
2.10. Периодические испытания проводят на одной партии устройств один раз в год на соответствие требованиям настоящего стандарта, кроме пп. 1.3.15-1.3.19.
Испытания на соответствие требованиям п. 1.3.19 проводят один раз в три года.
Испытания на соответствие требованиям пп. 1.3.15—1.3.18 проводят только на образцах из установочной серии, а также при изменении конструкции, материалов и (или) технологии изготовления, которые могут привести к снижению устойчивости изделий по контролируемым показателям».
Пункт 2.12. Последний абзац изложить в новой редакции:
«Испытания по п. 1.3.19, кроме испытаний на стерильность, токсичность и пирогснность (пп. 1.3.10 и 1.3.13), проводят на 13 устройствах в
(Продолжение ем. с. 9)
8
Страница5
(Продолжение изменения № 4 к ГОСТ 25047-87)
соответствии с нормативными документами. Объем выборки для испытаний по пп. 1.3.10 и 1.3.13 (в части стерильности) определяют в соответствии с пп. 2.8 и 2.9».
Раздел 2 дополнить пунктом — 2.15:
«2.15. Сертификационные испытания на соответствие требованиям пп. 1.5.1; 1.3.11; 1.4; 1.2.3; 1.3.2; 1.3.12; 1.3.13 (в части стерильности игл) и 1.3.14 проводят на 10 устройствах в указанной последовательности.
Сертификационные испытания на соответствие требованиям пп. 1.3.4 и 1.3.5 проводят на 5 устройствах; на соответствие требованиям пп. 1.3.6; 1.3.7; 1.3.8; 1.3.9; 1.3.17 и 1.3.18 — на 30 устройствах (на 5 устройствах по каждому виду испытаний соответственно). Допускается проводить различные испытания на одних и тех же образцах, если это не влияет на результат.
Сертификационные испытания на соответствие токсикологической и биологической безопасности (п. 1.3.10) проводят по методикам, утвержденным Минздравом».
Пункт 3.6. Заменить ссылку: ГОСТ 7762-74 на ГОСТ 28840-90.
Пункт 3.8 изложить в новой редакции:
«3.8. Проверка стерильности, пирогенности и токсичности (пп. 1.3.10, 1.3.13).
Стерильность устройств проверяют в соответствии с порядком проведения контроля стерильности стерилизованных медицинских изделий на предприятиях и «Методическими указаниями по контролю стерильности изделий медицинского назначения, стерилизованных радиационным методом», утвержденными Минздравом.
Пирогснность устройств проверяют в соответствии с «Методикой контроля пирогенности систем комплектных эксфузионных, трансфузион-ных и инфузионных однократного применения» или «Методикой контроля пирогенности медицинских изделий однократного применения, стерилизованных радиационным или газовым методом», утвержденных Минздравом.
Токсичность устройств проверяют в соответствии с «Методикой контроля токсичности стерильных систем комплектных эксфузионных, транс-фузионных и инфузионных однократного применения» или «Методикой контроля токсичности медицинских изделий однократного применения, стерилизованных радиационным или газовым методом», утвержденных Минздравом».
Пункт 3.16. Заменить слова: «по ГОСТ 23256-86» на «по нормативным документам».
Приложение I. Чертежи 1—8. Заменить размер: 0 3 min на 0 2,7 min;
чертежи 2—8. Заменить размер: 40 min на 38*;
дополнить чертежами — 9—12:
(Продолжение см. с. 10)
9
Страница6
(Продолжение изменения № 4 к ГОСТ 25047-87)
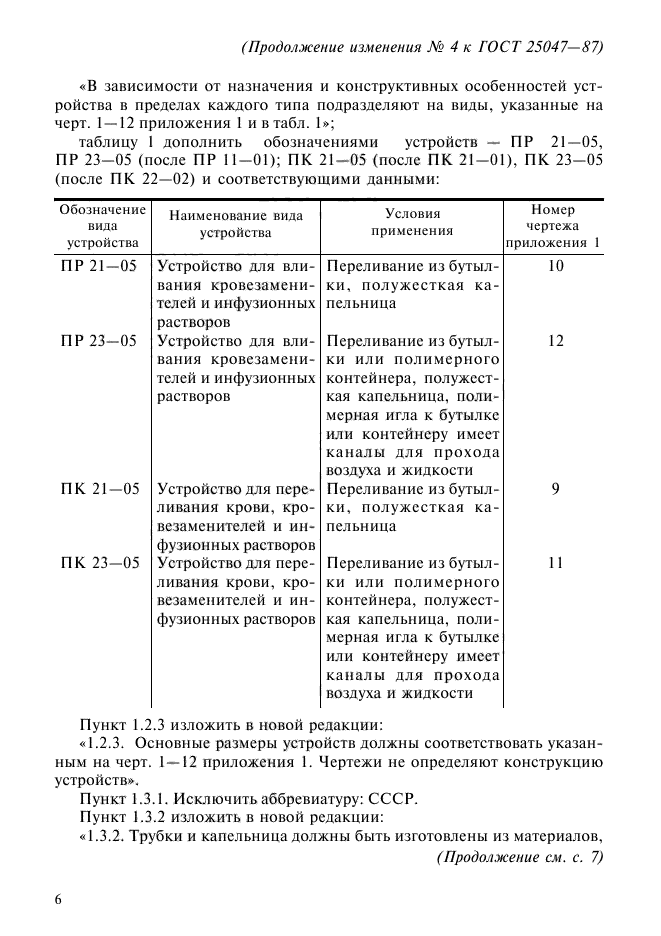
Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 21—05
Основная часть ВмВухоМ
|
Вариант |
* Размеры для справок
! — игла для емкости (с боковым отверстием); 2, 12 — колпачок; 3 — трубка; 4 — капельница; 5 — узел фильтрующий; 6 — зажим; 7 — узел инъекционный; 8 — головка с конусом «Рекорд» или «Луер»; 9 — игла с конусом «Рекорд» или «Луер»; 10 — игла воздуховода (с боковым отверстием); Н — фильтр; 13 — игла инъекционная в индивидуальной таре
Черт. 9 (Продолжение см. с. 11)
10
Страница7
(Продолжение изменения № 4 к ГОСТ 25047-87)
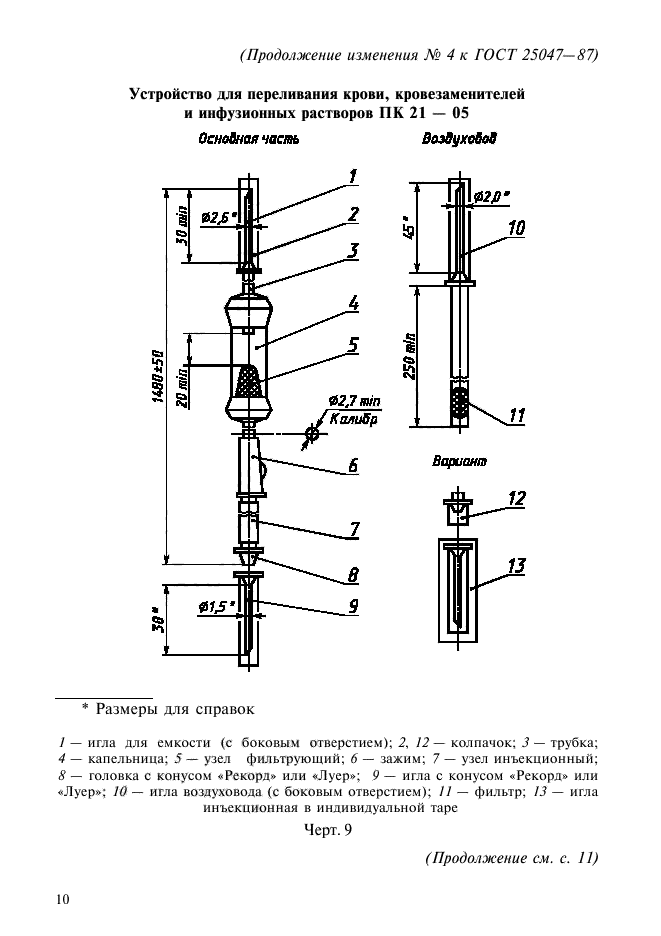
Устройство для вливания кровезаменителей и инфузионных растворов ПР 21 — 05
|
ВозДцхобоВ 5 fiiWg- 10 Вариант |
Основная часть
I
S
02,7 дня VКалибр
Т
* Размеры для справок
/ — игла для емкости (с боковым отверстием); 2, 12 — колпачок; 3 — трубка; 4 — капельница; 5 — узел фильтрующий; 6 — зажим; 7 — узел инъекционный; 8 — головка с конусом «Рекорд» или «Луер»; 9 — игла инъекционная с конусом «Рекорд» или «Луер»; 10 — игла воздуховода (с боковым отверстием); 11 — фильтр; 13 — игла инъекционная в индивидуальной таре
Черт. 10
(Продолжение см. с. 12)
11
Страница8
(Продолжение изменения № 4 к ГОСТ 25047-87)
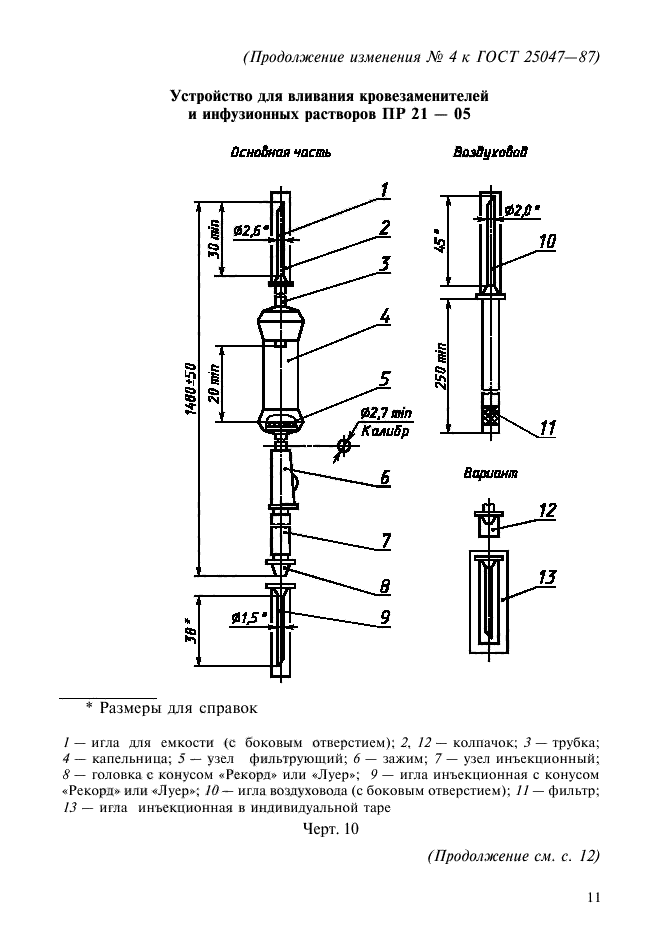
Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 23 — 05
Оснобная часть Вариант
1 — игла совмещенная; 2, 10— колпачок; 3 — капельница; 4 — узел фильтрующий; 5, 12 — трубка; 6 — зажим; 7— игла инъекционная в индивидуальной таре; 8— узел инъекционный; 9— головка с конусом «Луер»; П, 15 — фильтр;
13, 14 —головка с заглушкой
Черт. II
(Продолжение см. с. 13)
12
Страница9
(Продолжение изменения № 4 к ГОСТ 25047-87)
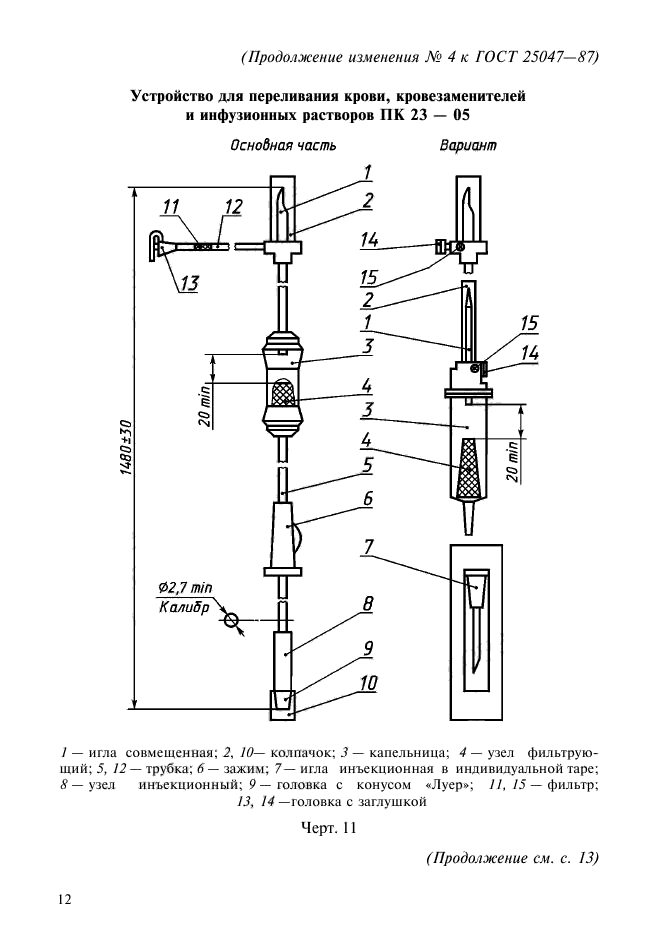
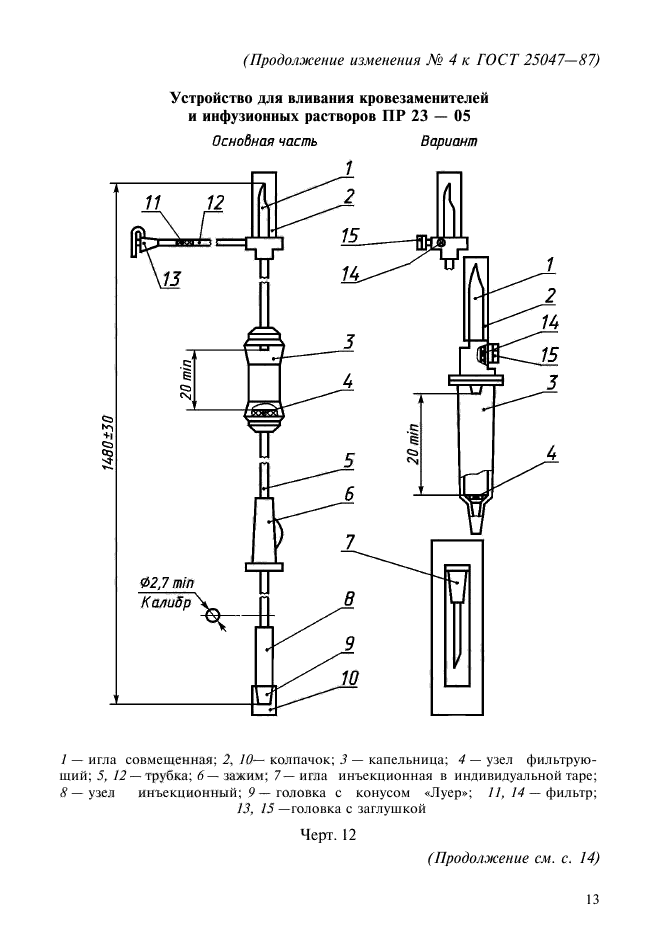
Устройство для вливания кровезаменителей и инфузионных растворов ПР 23 — 05
Основная часть Вариант
I — игла совмещенная; 2, 10— колпачок; 3 — капельница; 4 — узел фильтрующий; 5, 12— трубка; 6— зажим; 7— игла инъекционная в индивидуальной таре; 8 — узел инъекционный; 9 — головка с конусом «Луер»; 11,14 — фильтр;
13, 15 —головка с заглушкой
Черт. 12 (Продолжение см. с. 14)
13
Страница10
(Продолжение изменения № 4 к ГОСТ 25047-87)
Приложение 2. Таблицу дополнить кодами ОКП для новых обозначений ПР 21-05 и ПР 23-05 (после ПР 11-01); ПК 21-05 (после ПК 21-01) и ПК 23-05 (после ПК 22-02):
| |||||||||||||||||||||||||||||||||||||||||||||||||||
|
(ИУС № 7 2002 г.) |
14