ГСССД 268-2012
Таблицы стандартных справочных данных. Критические температуры и критические давления индивидуальных веществ
Купить ГСССД 268-2012 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
В документе приведены стандартные справочные данные о критической температуре и критическом давлении ряда веществ, главным образом термически нестабильных.
Оглавление
Введение
Основная частъ
Заключение
Литература
Приложение. Содержание основного вещества в образцах при измерениях критических свойств
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2018 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Строительство
Организации:
| 05.07.2012 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 9 |
|---|---|---|---|
| Разработан | ФГУП СТАНДАРТИНФОРМ | ||
| Издан | Издательство стандартов | 2012 г. |
Tables of Standard Reference Data. The Critical Temperatures and Pressures of Individual Substance
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15
стр. 16
стр. 17
стр. 18
стр. 19
стр. 20
стр. 21
стр. 22
стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ГОСУДАРСТВЕННАЯ СЛУЖБА СТАНДАРТНЫХ СПРАВОЧНЫХ ДАННЫХ
(ГСССД)
|
Галкин Ws 2012 г. |
Разр<£шаде нддепонирование директора ‘йРТИНФОРМ’
УДК 536.411
ТАБЛИЦЫ СТАНДАРТНЫХ СПРАВОЧНЫХ ДАННЫХ
КРИТИЧЕСКИЕ ТЕМПЕРАТУРЫ И КРИТИЧЕСКИЕ ДАВЛЕНИЯ ИНДИВИДУАЛЬНЫХ ВЕЩЕСТВ
ГСССД 268-2012
Москва - 2012
РАЗРАБОТА11Б1 ФГУП XT АНД АРТИНФОРМ” (ПНС-2011, тема 3.17.180-4.003.11) с участием специалистов Института теплофизики УрС) РАН (д-р физ.-мат. наук Е. Д. Никитин, д-р физ.-мат. наук П. А. Павлов, канд. физ.-мат. наук А. П. Попов).
ОДОБРЕНЫ экспертной комиссией в составе:
д-ра физ.-мат. наук В.Г. Мартынеца, д-ра хим. наук С.В. Левановой, д-ра физ.-мат. наук И.Г. Коршунова, канд. техн. наук П.В. Попова.
ПОДГОТОВЛЕНЫ к утверждению Российским научно-техническим центром информации по стандартизации, метрологии и оценке соответствия (ФГУП XT АНДАРТИНФОРМ”)
УТВЕРЖДЕНЫ Федеральным агентством по техническому регулированию и метрологии 5 июля 2012 г. (протокол Jfe 9)
2
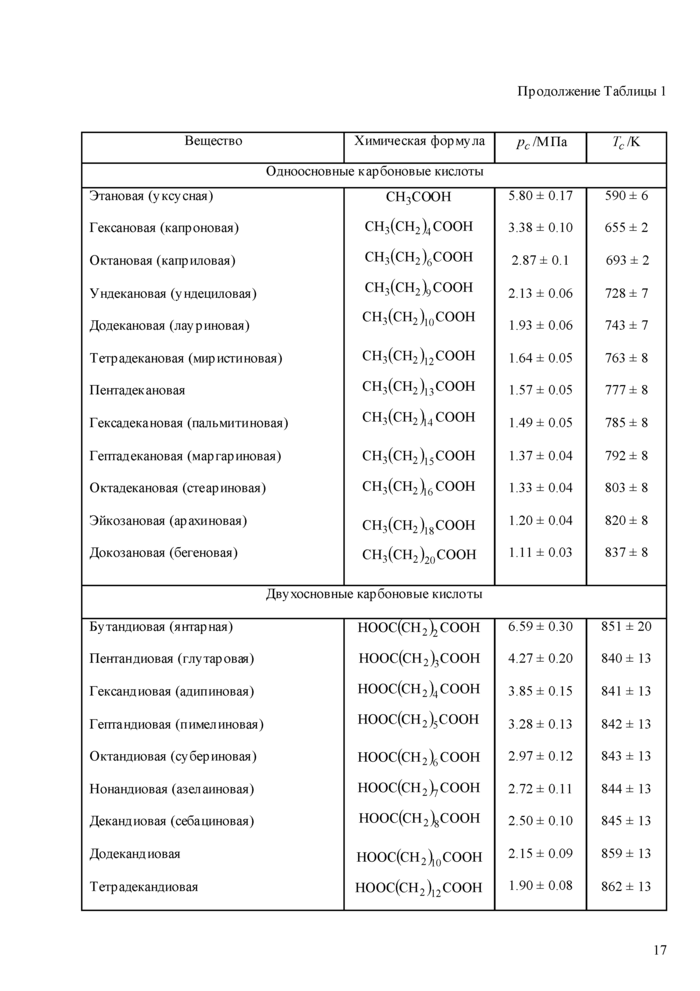
Для этановой, гексановой и октановой кислот имеются экспериметыльные данные, собранные в обзоре[9]. Критические параметры этих кислот приведены в Табл 1 с учетов всех имеющихся данных.
Двухосновные карбоновые кислоты. С большой вероятностью все двухосновные карбоновые кислоты с линейным строением алкильного радикала нестабильны в критической точке. По крайней мере, по данным Deijissa AG [21] термическое разложение додекандповой кислоты начинается при температурах порядка 500 К. тогда как кригическне температуры исследованных нами кислот лежат в диапазоне (851-862) К [22].
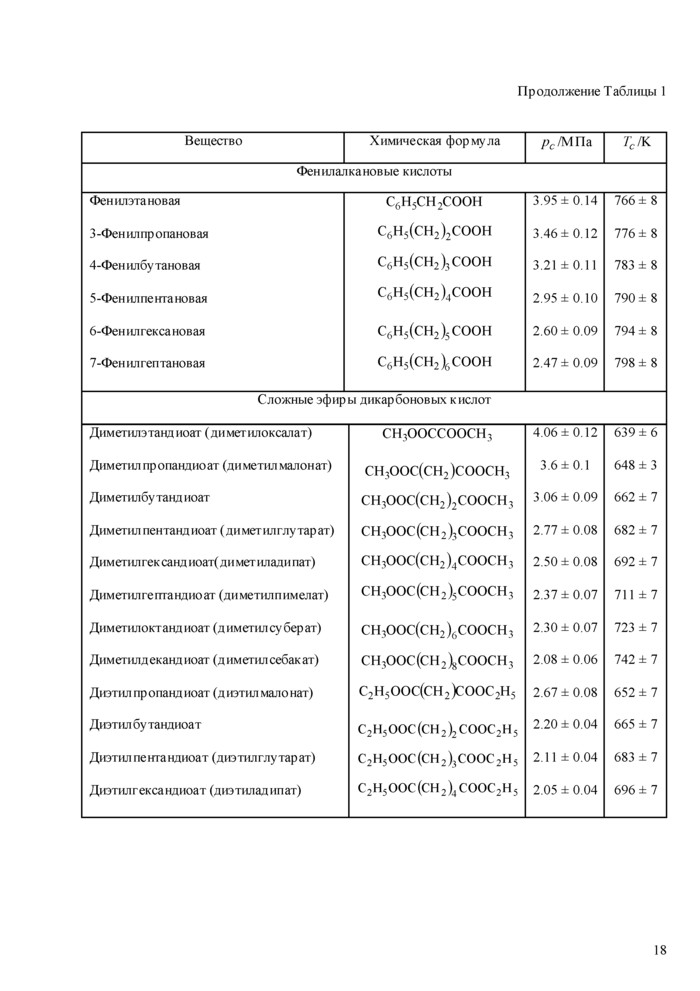
Фенилялкановые кислоты, исследованные нами, нестабильны при околокригических температурах. Результаты измерений критических констант фенилалкановых кислот опубликованы в нашей работе [23]
Сложные эфиры дикарбоновых кислот. Термическая стабильность эфиров дикар боновых кислот сравшггельно невысока Но данным Штерна и Кэя диметнлоксалат начинает разлагаться уже при температуре 473 К [24] Критическая температура исследованных нами диметиловых и днэтиловых эфиров дикарбоновых кислот изменяется от 639 К до 696 К [25,26], поэтому с большой долей уверенности можно утверждать, что все эти соединения нестабильны в критической точке Из исследованных нами диметиловых эфиров дикарбоновых кислот данные других авторов имеются только для диметил оксалата [9,24.27,28] и днметилмалоната [29]. Однако в опытах Регно [27] и Вегера[28] без сомнения происходило сильное разложение днметилоксалата В опытах Штерна и Кэя [24] влияние разложения на полученные результаты было менее значительным, но полностью исключить фактор разложение им, по-видимому, нс удалось Поэтому в Табл. 1 приведены критические параметры диметил оксалата, полученные с помощью методики ГСССД МЭ 163-2010. Данные работы [29] для днметилмалоната учтены при составлении Табл. 1. Приняты во вниманиетакже результаты измерения критической температуры диэтилбутандноата. полученные Рэдисом [9].
11
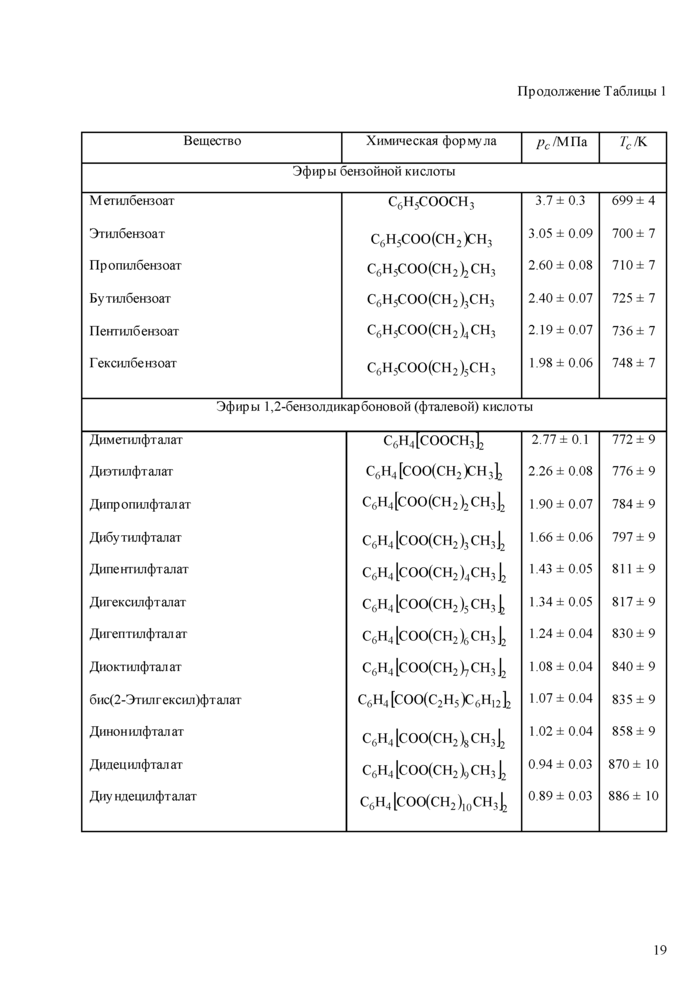
Бензоаты. Все исследованные нами эфиры бензойной кислоты (бензоаты) нестабильны в критической точке. Скорость разложения мет ил бензоата при критической температуре еще сравжггельно невелика, что позволило Стилу и соавторам [30] измерить критическую температуру этого соединения при скорости нагрева 0.333 К/с. Однако уже для этилбснзоага они не смогли провести необходимые измерения. Результаты измерений критической температуры и кртического давления бензоатов с помощью методики ГСССД МЭ 163-2010 были опубликованы в работе [31]. Данные Стила и соавторов [30] учтены при составлении Табл. 1.
Фгалаты. Критическая температура исследованных фталатов (772 К-886К) знач1ггельно превосходит температуру, гри которой начинается их термическое разложение (525-575) К [32]. Экспериментальные данные о критических параметрах фталатов опубликованы в нашей работе [33]
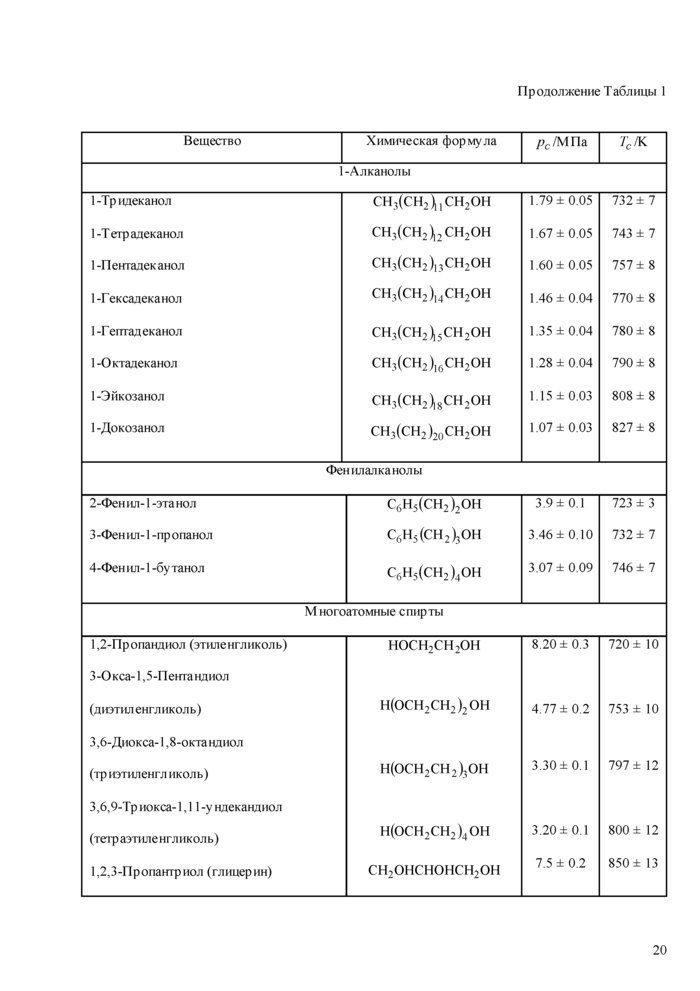
1-Алканолы нестабильны в кр1гтнчсской точке, начиная с 1-пентанола. Результаты измерений критической температуры и критического давления 1-алканолов с помощью методики ГСССД МЭ 163-2010 были опубликованы в работе [34].
Фенилалканолы. Известно, что фенилметанол и 2-фен ил-1-этанол нестабильны в критической точке [35, 36]. Можно ожидать, что более тяжелые фенилалканолы. имеющие более высокую критическую температуру, также разлагаются при околокр»пических температурах Результаты измерений кр1гтическнх параметров фенилалканолов с использованием методики ГСССД МЭ 163-2010 огубликованы в нашей работе [37]. В статье [35] приведены критическая температура и критическое давление 2-фенил-1-этанола Эти данные у чтены при составлении Табл. 1.
Многоатомные спирты. Сильные водородные связи между молекулами многоатомных спиртов приводят к тому, что эти соединения имеют высокие критические температуры, которые значтггельно превышают предел стабильности указанных веществ Предтринимались многочисленные попытки измерить критические свойства многоатомных спиртов [9]. однако
12
они не всегда были успешными из-за сильного разложения этих соединении при околокригических температурах. Результаты измерении критической температуры и кр»ггического давления многоатомных спиртов с использованием методики ГСССД МЭ 163-2010 опубликованы в работах [38, 39]. При составлении Табл. 1 мы учитывали данные других авторов, собранные в обзоре [9].
/(-Алкил бензолы. В гомологическом ря^ //-ал к ил бензолов С$Н5(СН2)ПН
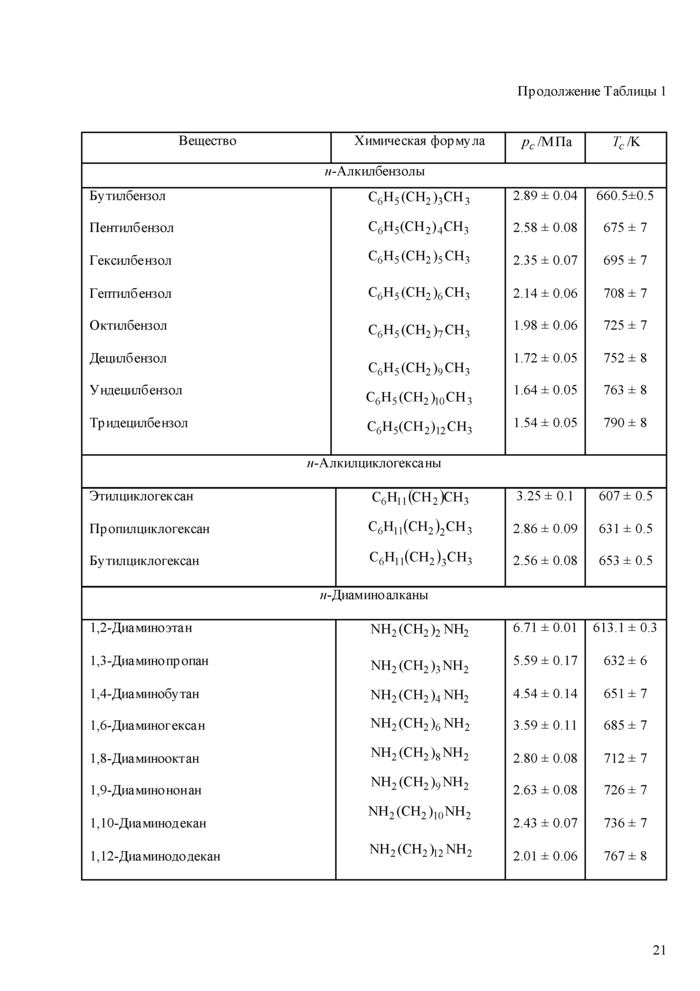
стабильными в критической точке являются четыре первых соединения от бензола (//= 0) до пропипбензола (//= 3). Критические свойства этих веществ хорошо щучены [5]. Более тяжелые гомологи термически нестабильны [40]. Критические параметры бензола, толуола и этилбензола были измерены нами с целью проверки применимости методики ГСССД МЭ 163-2010 к гомологическому ря^ //-алкилбензолов Измеренные нами значения критических параметров хорошо согласуются с данными других авторов (см Приложение, Табл 3). Бутилбетол разлагается сравшгтельно медленно при околокрщических температурах, его крщические свойства щмсрялись разными исследователями [5]. Крщические константы бутнлбензола приведенные в Табл. 1, основаны на данных из обзора [5] и результатах наших измерений. Критические параметры более тяжелых алкилбензолов [41 ] получены с помощью методики ГСССД МЭ 163-2010.
//-Алкилцнклогексаны. Термическая стабильность циклогексанов в жидкой фазе мало исследована В целом, цнклоатканы менее устойчивы, чем их ациклические аналоги Однако циклогексан является полностью ненапряженным соединением и, скорее всего, циклогексан и мет ил циклогексан стабильны в критической точке. Крщические свойства этих двух соединений многократно измерялись разными авторами. Подборку результатов измерений можно найти в обзоре [7]. Позднее критическая температура нескольких //-аткнлциклогексанов была тмерена Мортоном и соавторами [42] Нами с помощью методики ГСССД МЭ 163-2010 измерены критическая температура и крщическое давление н-аткилцнклогексанов от циклогексана до бутилцнклогексана [43] Крщические свойства этил-, пропил- и бутил циклогексанов, приведенные в Табл. 1, есть результат усреднения данных работ [42] и [43].
13
//-Диаминоалканы. В гомологическом ряду //-диаминоалканов 1,2-д мамино этан и все последующие члены ряда являются тер монсстаб ильным и [44] Результаты измерений критических параметров //-диаминоалканов с использованием методики ГСССД МЭ 163-2010 опубликованы в работе [45] Ранее критические свойства были измерены только для 1.2-д иамнноэ тана [11,44]. Таблица 1 составлена с учетом этих измерений.
Тетраалк'ок'снсиланы. Алкокснсиланы, молекулы которых содержат группы SiOCHj
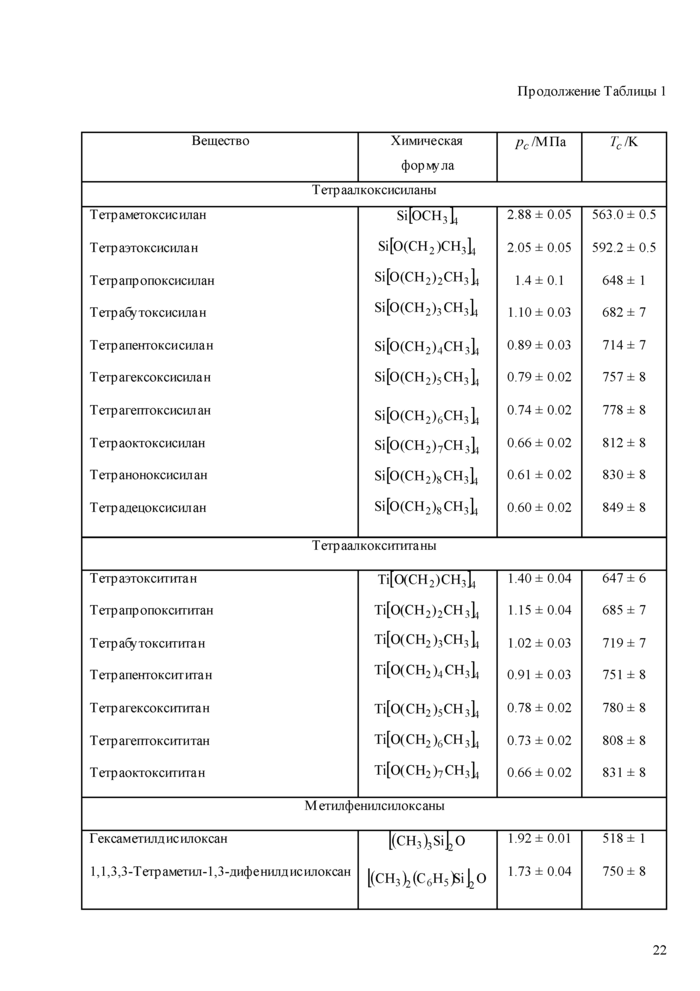
или SiOCjHs, разлагаются при температу рах выше 475 К, и термическая стабильность алкоксисиланов уменьшается с увеличением длины алкильной цепочки [46]. В соответствии с нашими измерениями кр»ггичсская температу ра исследованных тетраалкокснснланов лежит в диапазоне от 558 К до 849 К [47] Поэтому можно предполож1гть, что все исследованные нами теграалкоксиспланы подвержены разложению при околокр1ггнческнх температурах Ранее Ватерсон и Янг измерили критическую температуру и критическое давление тетраметоксн-, тетраэтоксн- и тетраиропоксисиланов [48]. Анализ всех имеющихся экспериментальных данных о критических свойствах тетраалкокснснланов. проведенный в работах [13, 47], нашел отражение в соответствующей части Табл. 1.
Тетраалкокситнтаны не обладают высокой термической стабильностью. Например, термическое разложение тетрабутнлокс1гт»ггана /иблюдалось уже при температурах 523 К [49] и 553 К [50]. Критические температуры исследованных нами тетраалкокситнганов значительно выше - от 647 К до 882 К [51]. Разумно предположить, что все эти соединения нестабильны в критической точке. Критические свойства тетраалкоксититанов. насколько нам 1гзвестно, ранее не шмерялись
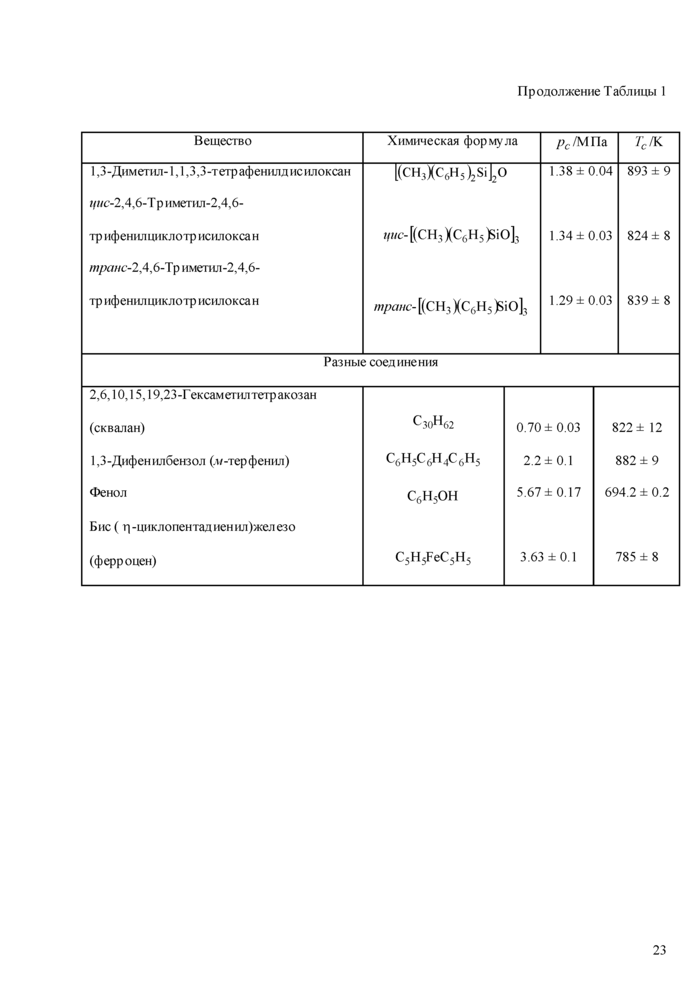
Мс1н.|фсн111С11лок'саны. Из этой группы веществ, ранее исследовались критические свойства гекса метил дне ил океана [13], кр>ггические параметры остальных соединений получены только с помощью методики ГСССД МЭ 163-2010 [52].
Разные соединения. Критические параметры ск вал а на измерялись нами с помощью методики ГСССД МЭ 163-2010 [53] и Фониидерхаузерном и соавторами методом потока [54] В работе [53] нами показано, что результаты измерений, приведенные в статье [54], вероятно искажены разложением сквалана в процессе опытов Поэтому в Табл 1 приведены критические свойства сквала на в соответствии с работой [53]. Критические константы .и-терфенила, полученные нами [17], близки к результатам Рейтера, но значительно отличаются от данных Манделя и Эвбанка [5]. Скорее всего, последние авторы использовали недостаточно чистые образцы, поэтому- при составлении Табл I данные Манделя и Эвбанка не учитывались. Критические свойства фенола измеряются с 1899 г., однако из-за его разложения при околокр1ггнческих температурах полученные данные достаточно противоречивы. Подборка
14
результатов измерении приведена в обзоре [9]. Результаты измерений критических параметров фенола с помощью методики ГСССД МЭ 163-2010 ог^бликованы в работе [37] Критическая температура фенола, измеренная нами, хорошо согласуется с данными Рэдиса[55] и Амброуза [56]. Критическое давление фенола, сообщенное Херцем и Нойкирхом [57] и Дслануа[58], в обоих случаях представляется завышенным из-за вероятного разложения фенола в процессе >пмерений. Поэтому в Табл 1 критическая температура дана в соответствии с обзором [9], а критическое давление - в соответствии с нашими измерениями [37].
15
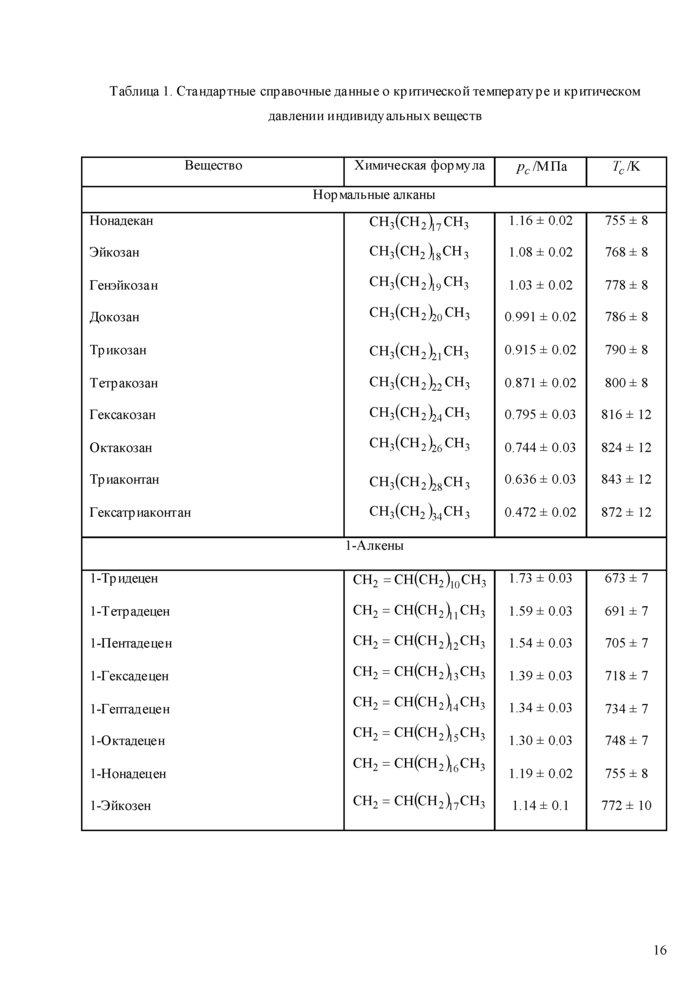
Таблица I Стандартные справочные да иные о критической температуре и критическом давлении индивидуальных веществ
|
Вещество |
Химическая формула |
у?с/МПа |
7С/К |
|
1 lop мальные алканы | |||
|
Нонадекан |
СН,(СН2),7СН, |
1.16 ±0.02 |
755 ± 8 |
|
Эйкозан |
СН3(СН2)|8СН3 |
1 08 ± 0.02 |
768 ± 8 |
|
Генэнкозан |
СН3(СН2^9СН3 |
1.03 ±0.02 |
778 ± 8 |
|
Докозан |
сн3(сн2^0сн3 |
0.991 ± 0.02 |
786 ± 8 |
|
Трикозан |
СН,(СН2^,СН, |
0.915 ±0.02 |
790 ± 8 |
|
Тетракозан |
CHjfCHj^CHj |
0.871 ±0.02 |
800 ± 8 |
|
Г сксакозан |
CHjfCHj^CHj |
0.795 ± 0.03 |
816 ± 12 |
|
Октакозан |
CHjfCHj^CHj |
0.744 ± 0.03 |
824 ± 12 |
|
Триакокган |
CHjfCHj^CHj |
0.636 ± 0.03 |
843 ± 12 |
|
Гексатрнаконтан |
сн,(сн2)з,сн, |
0.472 ± 0.02 |
872 ± 12 |
|
1-Алкены | |||
|
1-Трндецен |
сн2 =СН(СН2)|0СН, |
1.73 ±0.03 |
673 ± 7 |
|
1-Тетрадецен |
CH2 = CH(CH2)|1CHj |
1.59 ±0.03 |
691 ± 7 |
|
1-Пекгадецен |
сн2 = сн(сн2)|2сн, |
1.54 ±0.03 |
705 ±7 |
|
1-Гексадецен |
CH2 = CH(CH2)i3CH, |
1.39 ±0.03 |
718 ± 7 |
|
1-Гегтгадецен |
сн2 = сн(сн2^4сн3 |
1.34 ±0.03 |
734 ± 7 |
|
1-Октадецен |
сн2 = сн(сн2)|5сн3 |
1.30 ±0.03 |
748 ±7 |
|
1-Нонадецен |
СН2 = СН(СН2)|6СН3 |
1.19 ±0.02 |
755 ± 8 |
|
1-Энкозен |
сн2 = сн(сн2)|7сн3 |
1.14 ±0.1 |
772 ± 10 |
ГОСУДАРСТВЕННАЯ СЛУЖБА СТАНДАРТНЫХ СПРАВОЧНЫХ ДАННЫХ
ГСССД 268- 2012
Таблицы стандартных справочных данных
Критическая температура и критическое давление индивидуальных веществ
GSSSD 268 -2012
Tables of Standard Reference Data
The Critical Temperatures and Pressures of Individual Substances
ДЕПОНИРОВАННАЯ РУКОПИСЬ
УДК 536.411
Таблицы стандартных справочных данных ГСССД 268 -2012.
Критическая температура и критическое давление индивидуальных веществ / Е.Д. Никитин, П.А. Павлов, А.П. Попов. Росс, научно-техн. центр информации по стандартизации, метрологии и оценке соответствия. М., 2012. - 27 с. Библиогр. 58 назв. Рус. 3 назв. Деп. в ФГУП “СТАНДАРТ И НФОРМ" 05. 07. 2012 г., № 873 -2012 кк
Авторы:
Приведены стандартные справочные данные о критической температуре и критическом давлении ряда веществ, главным образом термически нестабильных.
Е. Д. Никитин П. А. Павлов А. П. Попов
4
СОДЕРЖАНИЕ
Введение .................................................................................... 6
Основная часть ............................................................................ 7
Заключение ................................................................................. 24
Литература .................................................................................. 25
Приложение ................................................................................. 31
5
ВВЕДЕНИЕ
Критические параметры - критическая температура, кр>ггичсское давление, критическая плотность - являются одними из важнейших физико-химических характеристик чистого вещества Критическая точка определяет верхнюю границу существования двухфазной области. Критические константы используются во многих корреляциях в качестве параметров приведения. Информация о критических параметрах дает возможность построить уравнение состояния вещества рассчитать с приемлемой точностью по теории термодинамического подобия его теплофизические свойства надежно экстраполировать в область высоких температур результаты низкотемпературных измерений поверхностного натяжения, давления и плотности насыщенного пара Изложенные соображения позволили Томасу Даубсрту постав1пъ критические свойства на первое место в предложенной им иерархии теплофизических свойств вещества [ 1 ].
Измерения критических параметров чистых веществ ведутся уже почти 200 лет с момента открытия в 1822 г. бароном де ла Туром кр»ггической точки жидкость-пар (2) Однако число веществ, для которых критические константы определены экспериментально сравнительно невелико. Оценки различных экспертов разнятся, т.к. базы данных нередко содержат не только экспериментальные данные, но и результаты различных оценок и расчетов В серии обзоров, подготовленных комиссией ИЮПАК по термодинамике и опубликованных в 1995-2009 гг., в которые включены только результаты измерений, критическая температура приведена для 810 веществ, критическое давление - для 605 соединений, а кр1гтическая плотность - для 466 веществ [3-13]. Таким образом, получение надежных экспериментальных данных о критических свойствах индивид)' альных веществ является актуальной задачей
В последние годы кр1гтические параметры стали использоваться для характеристики как
обычных, стабильных соединений, так и соединений термонестабильных, т. е веществ,
термическое разложение которых начинается при температурах, меньших критической В
упомянутых выше обзорах [3-13] и других многочисленных работах под критической точкой
6
термонестабильного соединения понимают гипотетическую критическую точку, которую данное вещество имело бы в отсу тствие разложения. Именно это определение критической точки нестабильного соединения будет использоваться нами в настоящей работе
Измерение критических свойств нестабильных соединений предполагает применение специальных методик. Главное требование к таким методикам - малое время нахождения образца исследуемого соединения при высоких температурах. Разработанная нами «Методика экспериментального определения критической температуры и критического давления индивидуальных веществ ГСССД МЭ 163-2010» [14] предназначена в первую очередь для измерения критических параметров термонестабильных соединений, хотя она подходит и для стабильных веществ
ОСНОВНАЯ ЧАСТЬ
Методика измерения критической температуры и критического давления
веществ, которая использовалась в настоящей работе, детально изложена в рукописи [ 14],
поэтому приведем только предельно краткое описание этой методики Исследуемая жидкость
заполняет фторопластовый стаканчик с тонкими стенками, которые служат для передачи
давления. Давление снаружи стаканчика создается прессом и измеряется манометром Внутри
стаканчика наход1ггся измерительный зонд - платиновая проволока диаметром 0.02 мм и
длиной (1-3) см. Зонд служит одновременно нагревателем и термометром сопротивления На
зонд подаются одиночные прямоугольные импульсы напряжения от генератора; во время
импульса происходит нагрев зонда протекающим током. Напряжение импульса подбирается
таким образом, что к концу' импульса зонд и слой жидкости вокруг него нагреваются до
температуры достижимого перегрева; пронсходт- вскипание жидкости Время от начала
импульса нагрева до момента вскипания составляет от 0.01 до I мс. В момент вскипания резко
изменяются условия теплоотдачи от зонда в жидкость, что приводит к возникновению
возмущения температуры зонда Момент вскипания и амплнгуда температурного возмущения
7
фиксируется электронной аппаратурой. Температура зонда в момент вскипания определяется по его сопротивлению. В результате измеряется температура, при которой начинается вскипание жидкости при заданном давлении (температура достижимого перегрева жидкости). В опытах измеряется зависимость температуры достижимого перегрева от давления - линия достижимого перегрева При увеличении давления линия достижимого перегрева заканчивасгся в критической точке.
С ростом давления свойства жидкости и пара сближаются, и амплитуда температурного возмущения падает Давление, при котором амплитуда отрицательного температурного
возмущения снижается до уровня чувсгвигельности установки (10 ' К), принимается равным измеренному значению критического давления р"*, а температура вскипания при этом давлении - измеренному значению критической температуры I'”1. Опыты с хорошо
исследованными жидкостями показали, что величины р1" и Г™ всегда меньше истинных
значений критического давления рс и критической температуры Тс. Разработан метод
введения поправок к измеренным значениям критических параметров
Для низкомолекулярных неассоциированных соединений погрешность тмерения критического давления составляет 3 %, а погрешность тмерения критической температуры -1 %. Для веществ с водородными связями и высоким ацентрическим фактором (со > 1) - 4 % и 1.5 %, соответственно
Большая часть образцов исследованных веществ была приобретена у фирм Aldrich. Sigma. Fluka, Alfa Aesar и других. Образцы некоторых соединений были си тезированы в Инсппуте органического синтеза УрО РАН (НОС) под руководством д.хн ЮГ. Ятлука; образцы метилфенилсилоксанов были предоставлены М А. Сипя тиной, ЕЕ. Степановой и II В Ивановым из Московской государственной академии тонкой химической технологии им М В Ломоносова (М ИТХТ); образцы диэтиловых эфиров днкарбоновых кислот были предоставлены ЕЛ. Красных из Самарского государственного технического универапета (СГТУ). Большое
внимание уделялось чистоте используемых образцов. До и после проведения опытов по измерению критических свойств чистота образцов определялась методами газовой хроматографии (ГХ), жидкостной хроматографии (ЖХ) и ядер но го магнитного резонанса (ЯМР). Использовались хроматографы Shimadzu GS-HA, Мerck-Hitachi и ЯМР-спектрометр Bruker DRX 400 Соответствующие измерения проводились в Институте органического синтеза УрО РАН Для подавляющего числа образцов содержание основного вещества было выше 99 % и мало менялось в процессе измерения критических свойств Чистота образцов исследованных соединений приведена в Приложении (Табл. 2).
Измерения кртической температуры и критического давления с помощью методики ГСССД МЭ 163-2010 проводились как для стабильных, так и для нестабильных веществ Большинство исследованных соединений являлись термически нестабильными Для стабильных соединений погрешность измерения критических параметров предложенным авторами методом больше, чем погрешность измерения традиционными методами, включающими длительное термостатирование [3] Поэтому критические свойства стабильных веществ измерялись лишь с целью проверки гр имени мост и разработанного метода к конкретному' гомологическому' ря^ и оценки реальной погрешности измерений В Таблице 3 (см Приложение) полученные значения критических свойств сравниваются с литературными данными для стабильных и нестабильных соединений Для стабильных веществ литературные данные взяты, в основном, из обзоров [4. 5. 7. 9] и представляют собой результат усреднения наиболее надежных экспериментальных данных, полученных различными авторами с использованием различных методик. Для нестабильных соединений данных о критических свойствах гораздо меньше из-за высокой сложности соответствующих измерений. Таблица 3 показывает, что результаты, полученные с помощью методики ГСССД МЭ 163-2010, в пределах погрешности измерений совпадают сданными других авторов. Это свидетельствует о высокой надежности разработанного нами метода измерений критических свойств веществ.
В Таблице 1 приведены стандартные справочные о критической температуре и критическом давлении только нестабильных соединении Для подавляющего числа веществ эти данные получены единственным методом - с помощью методики ГСССД МЭ 163-2010, т к. другие известные методики измерения критических параметров термонестабильных соединений нс позволяют провести необходимые измерения из-за сильного разложения этих веществ в процессе измерений Для сравнительно небольшого числа соединений имеются экспериментальные данные, полученные другими методами Результаты этих экспериментов учитывались при разработке Табл. 1.
Справочные данные в Табл. 1 сгруппированы по гомологическим рядам или соединениям с близкой структурой Названия веществ приведены, в основном, в соответствии с номенклатурой ИЮПАК; используются также и тривиальные названия Рассмотрим отдельные гомологические ряды
Нормальные алканы. Алканы от метана до //-декана включительно стабильны в критической точке. Все более тяжелые //-алканы нестабильны [4]. Результаты измерений кр»гтнческих параметров //-алканов гриведены в наших работах[16, 17] Полученные в этих работах данные отличаются незначительно В Таблице! кртт/ческие свойства алканов даны в соответствии с работой [17]. т.к. она является более поздней, и в ней учитываются результаты предыдущей работы
1-Алкены. Наличие двойной связи в молекулах 1-алкенов снижает их термическую стабильность Только пять первых 1-алкенов стабильны в критической точке; 1-геиген и более тяжелые алкены являются нестабильными [8]. Результаты измерения критических свойств I-азкенов с помощью методики ГСССД МЭ 163-2010 были опубликованы в работе [18].
Одноосновные карбоновые кислоты. В гомологическом ряду одноосновных карбоновых кислот с нормальным строением алкильного радикала все соединения являются нестабильными в критической точке [19]. Критическая температура и критическое давление этих соединений, измеренные предложенным авторами методом, опубликованы в работе [20].
10