ГОСТ Р ИСО/ТС 10993-20-2009
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 20. Принципы и методы исследования иммунотоксичности медицинских изделий
Представляет обзор иммунотоксикологии с особым рассмотрением потенциальной иммунотоксичности медицинских изделий. Она дает указания по методам исследования иммунотоксичности различных видов медицинских изделий. Стандарт основан на нескольких публикациях, написанных различными группами иммунотоксикологов за последние десятилетия, когда произошло развитие иммунотоксикологии как отдельной дисциплины в рамках токсикологии.
Идентичен ISO/TS 10993-20:2006
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Оценка риска и управление риском
5 Идентификация опасности
6 Методы оценки иммунотоксичности
6.1 Общие положения
6.2 Воспаление
6.3 Иммуносупрессия
6.4 Иммуностимуляция
6.5 Гиперчувствительность
6.6 Аутоиммунность
7 Экстраполяция данных доклинических испытаний
Приложение А (справочное) Накопленный опыт
Приложение В (справочное) Практика применения медицинских изделий в клинике
Приложение С (справочное) Блок-схема исследования иммунотоксичности
Приложение D (справочное) Сведения о соответствии национальных стандартов Российской Федерации ссылочным международным стандартам
Библиография
22 страницы
| Дата введения | 01.09.2010 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.01.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 02.12.2009 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 536-ст |
|---|---|---|---|
| Разработан | АНО ИМБИИТ | ||
| Издан | Стандартинформ | 2010 г. |
Medical devices. Biological evaluation of medical devices. Part 20. Principles and methods for immunotoxicology testing of medical devices
ГОСТ Р ИСО 14971-2006Изделия медицинские. Применение менеджмента риска к медицинским изделиям. Заменен на ГОСТ Р ИСО 14971-2009.- ГОСТ Р ИСО 10993-1-2009 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
- ГОСТ Р ИСО 10993-2-2009 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 2. Требования к обращению с животными
- ГОСТ Р ИСО 10993-11-2009 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
- ГОСТ Р ИСО 10993-10-2009 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследования раздражающего и сенсибилизирующего действия
ГОСТ Р ИСО 10993-6-2009Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации. Заменен на ГОСТ Р ИСО 10993.6-2009.- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7
стр. 8

стр. 9

стр. 10
стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17
стр. 18

стр. 19

стр. 20

стр. 21

стр. 22
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
<Ш)
АЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ГОСТ Р ИСО/ТС10993-20-2009
2009
ИЗДЕЛИЯ МЕДИЦИНСКИЕОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 20
Принципы и методы исследования иммунотоксичности медицинских изделий
ISO/TS 10993-20:2006 Biological evaluation of medical devices — Part 20: Principles and methods for immunotoxicology testing of medical devices (IDT)
Издание официальное
ГОСТ Р ИСО/ТС 10993-20—2009
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «Институт медико-биологических исследований и технологий» (АНО «ИМБИИТ»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 422 «Оценка биологического действия медицинских изделий»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 2 декабря 2009 г. № 536-ст
4 Настоящий стандарт идентичен международному стандарту ИСО/ТС 10993-20:2006 «Оценка биологического действия медицинских изделий. Часть 20. Принципы и методы исследования иммуно-токсического действия медицинских изделий» (ISO/TS 10993-20:2006 «Biological evaluation of medical devices — Part 20: Principles and methods for immunotoxicology testing of medical devices»).
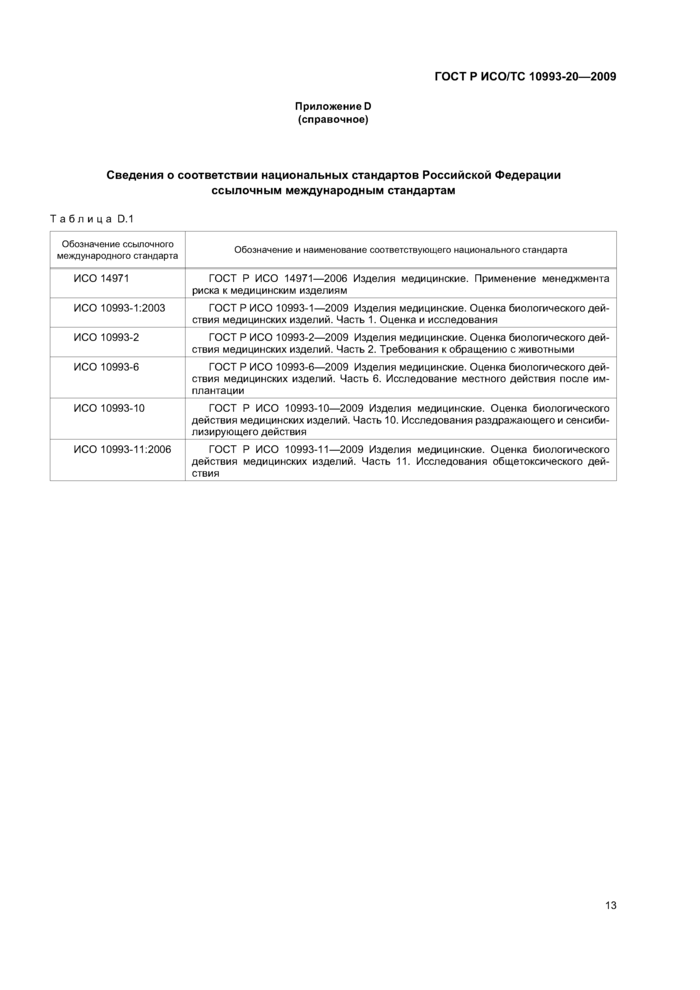
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении D
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — вежемв-сячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответслюу-ющая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ.2010
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ Р ИСОГГС 10993-20—2009
Содержание
1 Область применения...................................................1
2 Нормативные ссылки..................................................1
3 Термины и определения................................................1
4 Оценка риска и управление риском..........................................2
5 Идентификация опасности...............................................2
6 Методы оценки иммунотоксичности.........................................4
6.1 Общие положения..................................................4
6.2 Воспаление......................................................5
6.3 Иммуносупрессия..................................................5
6.4 Иммуностимуляция.................................................7
6.5 Гиперчувствительность..............................................7
6.6 Аутоиммунность...................................................7
7 Экстраполяция данных доклинических испытаний................................7
Приложение А (справочное) Накопленный опыт...................................8
Приложение В (справочное) Практика применения медицинских изделий в клинике...........11
Приложение С (справочное) Блок-схема исследования иммунотоксичности................12
Приложение D (справочное) Сведения о соответствии национальных стандартов Российской
Федерации ссылочным международным стандартам.....................13
Библиография........................................................14
III
Введение
Соблюдение положений стандартов серии ИСО 10993 «Оценка биологического действия медицинских изделий» позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление единообразных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией их по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие соответствующую подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты серии ИСО 10993 являются руководящими документами для прогнозирования и исследования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых изделий.
В серию ИСО 10993 входят следующие части под общим названием «Оценка биологического действия медицинских изделий»:
Часть 1 — Оценка и исследования;
Часть 2 — Требования к обращению с животными;
Часть 3 — Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
Часть 4 — Исследование изделий, взаимодействующих с кровью;
Часть 5 — Исследование на цитотоксичность; методы in vitro;
Часть 6 — Исследование местного действия после имплантации;
Часть 7 — Остаточное содержание этиленоксида после стерилизации;
Часть 9 — Основные принципы идентификации и количественного определения потенциальных продуктов деградации;
Часть 10 — Исследования раздражающего и сенсибилизирующего действия;
Часть 11 — Исследование общетоксического действия;
Часть 12 — Приготовление проб и стандартные образцы;
Часть 13 — Идентификация и количественное определение продуктов деградации полимерных медицинских изделий;
Часть 14 — Идентификация и количественное определение продуктов деградации изделий из керамики;
Часть 15 — Идентификация и количественное определение продуктов деградации изделий из металлов и сплавов;
Часть 16 — Моделирование и исследование токсикокинетики продуктов деградации и вымывания;
Часть 17 — Установление пороговых значений для вымываемых веществ;
Часть 18 — Исследование химических свойств материалов;
Часть 19 — Исследование физико-химических, морфологических и топографических свойств материалов;
Часть 20 — Принципы и методы исследования иммунотоксического действия медицинских изделий.
В последние годы все больше внимания уделялось потенциальной возможности медицинских изделий вызывать изменения в иммунной системе. Руководство по обращению с негативным влиянием медицинских изделий на иммунную систему стало необходимым. При отсутствии стандартизированных исследований настоящий стандарт предоставляет общую схему подхода к оценке иммунотоксичности.
Целью настоящего стандарта является;
- обобщение опыта в области иммунотоксикологии на настоящий момент, включая информацию о методах оценки иммунотоксичности и их точность прогнозирования;
- определение проблем и опыт их разрешения.
Был проведен обширный обзор литературы, в основном с помощью Medline, по клиническим признакам иммунных изменений, вызванных медицинскими изделиями. Ключевыми словами исследований являлись;
ГОСТ Р ИСОГГС 10993-20—2009
- иммуносупрессия;
- иммуностимуляция;
- гиперчувствительность;
- хроническое воспаление:
- аутоиммунность.
Эти ключевые слова связаны со следующими материалами:
- пластики и другие полимеры;
- металлы;
- керамика, стекло и композиты;
- биологические материалы.
Примечание — См. также таблицу 1 о возможностях взаимодействия материалов с иммунной системой.
V
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 20
Принципы и методы исследования иммунотоксичности медицинских изделий
Medical devices. Biological evaluation of medical devices.
Part 20. Principles and methods for immunotoxicology testing of medical devices
Дата введения — 2010—09—01
1 Область применения
Настоящий стандарт представляет обзор иммунотоксикологии с особым рассмотрением потенциальной иммунотоксичности медицинских изделий. Он дает указания по методам исследования иммунотоксичности различных видов медицинских изделий.
Настоящий стандарт основан на нескольких публикациях, написанных различными группами иммунотоксикологов за последние десятилетия, когда произошло развитие иммунотоксикологии как отдельной дисциплины в рамках токсикологии.
Опыт знаний по иммунотоксичности на настоящий момент описывается в приложении А Обобщение клинического опыта иммунотоксикологии, связанной с медицинскими изделиями, приведено в приложении В.
Примечание — См. библиографию. [11J.
2 Нормативные ссылки
Следующие документы необходимы для применения настоящего стандарта. При датированной ссылке применяют только указанное издание. При ссылке без даты применяют последнее издание указанного документа. включая все поправки.
ИСО 10993-1 Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ИСО 10993-2 Оценка биологического действия медицинских изделий. Часть 2. Требования к обращению с животными
ИСО 10993-6 Оценка биологического действия медицинских изделий. Часть 6. Исследование местного действия после имплантации
ИСО 10993-10 Оценка биологического действия медицинских изделий. Часть 10. Исследования раздражающего и сенсибилизирующего действия
ИСО 10993-11 Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
ИСО 14971 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 иммунотоксикология: Изучение негативного влияния на здоровье, вызванного, прямо или косвенно, взаимодействием ксенобиотиков с иммунной системой.
Издание официальное
3.2 медицинское изделие: Любой прибор, аппарат, приспособление, материал или другое изделие. включая программное обеспечение, используемое изолированно или в комбинации, которое предназначено изготовителем для применения, главным образом, в целях:
- диагностики, профилактики, наблюдения, лечения или облегчения болезни:
- диагностики, наблюдения, лечения, облегчения или компенсации повреждения органов или физического недостатка:
- исследования, замены или изменения анатомии или физиологического процесса;
- контрацепции
и которое не является фармакологическим, иммунологическим или метаболическим средством, но может быть дополнено такими средствами.
Примечания
1 Изделия не являются лекарствами, и оценка их биологического действия требует другого подхода. При дополнении медицинского изделия фармакологическим средством, количество егоне должно превышать суточной дозы.
2 Термин «медицинское изделие» включает в себя изделия стоматологического назначения.
3.3 ксенобиотик: Субстанция, инородная человеческому телу или живым организмам.
3.4 иммуногенный: Способный стимулировать клетки иммунной системы для иммунного ответа на специфический антиген.
4 Оценка риска и управление риском
Оценка риска включает в себя идентификацию опасности, исследование ответной реакции в зависимости от дозы и оценку продолжительности воздействия, которые вместе позволяют охарактеризовать риск. Управление риском должно применяться, основываясь на управлении риском.
Ввиду сложности прогнозирования иммунотоксичности новых веществ и материалов необходимо сконцентрировать усилия и внимание на оценке и контроле риска, связанного с известными иммуноток-сическими веществами, содержащимися в медицинских изделиях. Управление риском медицинских изделий должно осуществляться в соответствии с ИСО 14971. Вначале необходимо определить возможные иммунотоксические опасности веществ, содержащихся в медицинском изделии, путем обширного изучения научной литературы. Примером таких факторов опасности является развитие анафилактического шока в результате содержания хлоргексидина в лекарственных препаратах и протеинов в латексной резине. Затем необходимо рассмотреть процедуры контроля и снижения риска в целом, а также различные возможные действия, направленные на дальнейшее сокращение остающихся факторов риска, такие как обозначение противопоказаний на этикетке, отзыв продукции, изменение дизайна и ограничения в использовании или применении.
5 Идентификация опасности
Иммунологические факторы опасности должны быть определены оценкой воздействия материалов медицинского изделия для идентификации наличия потенциально иммунотоксичных агентов. Существует множество источников информации по иммунологическим факторам опасности. Таковые включают, в том числе:
- характеристику материала:
- характеристику осадка;
- характеристику вымываемых материалов;
- характеристику лекарственных препаратов и других субстанций, добавляемых к медицинскому изделию:
- характеристику длительности и пути воздействия;
- наблюдения, сделанные при прошлом воздействии веществ, лекарственных препаратов или материалов;
- исследования на токсичность.
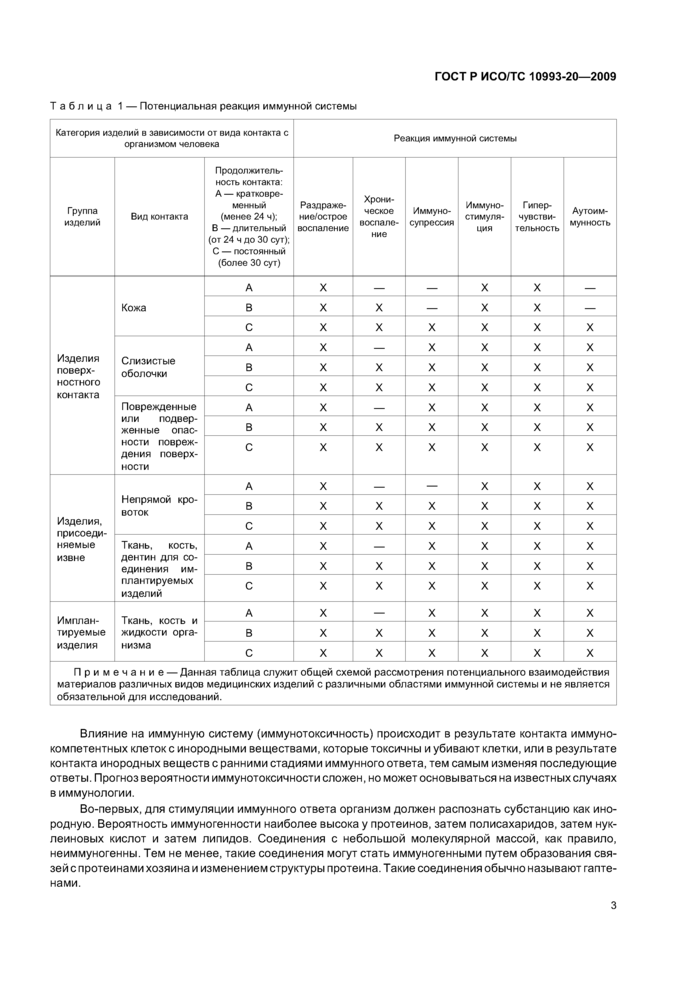
Большинство иммунологических реакций, идентифицированных на данный момент, связаны с добавками или материалами. Таким образом, для таких веществ оценка воздействия важна для определения иммунологического фактора риска. В таблице 1 приведены детали потенциальных последствий для различных материалов медицинских изделий различных видов.
|
ГОСТ Р ИСОГГС 10993-20—2009 Таблица 1 — Потенциальная реакция иммунной системы | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Примечани е — Данная таблица служит общей схемой рассмотрения потенциального взаимодействия материалов различных видов медицинских изделий с различными областями иммунной системы и не является обязательной для исследований. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Влияние на иммунную систему (иммунотоксичность) происходит в результате контакта иммуно-компетентных клеток с инородными веществами, которые токсичны и убивают клетки, или в результате контакта инородных веществ с ранними стадиями иммунного ответа, тем самым изменяя последующие ответы. Прогноз вероятности иммунотоксичности сложен, но может основываться на известных случаях в иммунологии.
Во-первых, для стимуляции иммунного ответа организм должен распознать субстанцию как инородную. Вероятность иммуногенности наиболее высока у протеинов, затем полисахаридов, затем нуклеиновых кислот и затем липидов. Соединения с небольшой молекулярной массой, как правило, неиммуногенны. Тем не менее, такие соединения могут стать иммуногенными путем образования связей с протеинами хозяина и изменением структуры протеина. Такие соединения обычно называют гапте-нами.
3
Возможно, что в полимерных, керамических и металлических материалах могут присутствовать продукты вымывания, изнашивания или деградации, которые образуют связи с протеинами организма. Известно, что материалы биологического происхождения, такие как коллагены, протеины природного латекса, альбумины и животные ткани, могут стимулировать иммунный ответ, и необходимо принять меры, чтобы сделать эти материалы не иммуногенными. Для того, чтобы крупные соединения (размерами более 1000000 дальтон) стали иммуногенными, они должны быть раздроблены и введены как более мелкие соединения.
Вышеуказанные соединения являются примерами веществ и материалов с возможным иммуногенным потенциалом, и. таким образом, должны быть приняты во внимание из-за их негативного влияния на иммунную систему.
Контакт с телом: любой контакт с телом, приведенный в ИС0 10993-1. способен привести к нежелательному иммунному ответу (иммунотоксичности). Кожа и слизистые оболочки особо подвержены развитию реакций типа I (гиперчувствительность немедленного типа) и типа IV (гиперчувствительность замедленного типа). При других видах контакта вероятны системные ответы, включая реакции типов I и IV.
Длительность контакта: обычно чем продолжительнее контакт материала с телом, тем выше вероятность формирования иммуногенных субстанций. Тем не менее, некоторые вещества действуют быстро. и иммунные ответы в результате контакта материалов с телом в течение менее 24 ч могут быть иммуногенными.
6 Методы оценки иммунотоксичности
6.1 Общие положения
Исследования на иммунотоксичность могут проводиться с использованием проб in vivo и in vitro. В отличие от исследований на иммунотоксичность in vivo возможности для исследований in vitro ограничены. так как в моделях отсутствует сложность целостной иммунной системы. Ценность методов in vitro при экстраполяции экспериментальных данных на человека (путем прояснения механизмов токсичности) еще более ограничена тем. что они еще недостаточно разработаны и стандартизированы. Тем не менее, они могут быть полезны для изучения механизма иммунотоксичности.
Центром внимания иммунотоксикологии является обнаружение и оценка нежелательных эффектов соединений путем исследований на грызунах. При рассмотрении исследований на животных необходимо определить и внедрить все разумные и практически доступные варианты замены, сокращения и улучшения для соблюдения положений ИСО 10993-2. Хотя существуют утвержденные лабораторные исследования, во многих случаях биологическая значимость и способность прогнозирования исследований иммунотоксичности требуют серьезного рассмотрения. Возможность влияния на иммунную систему может проявляться изменениями в массе лимфоидного органа или гистологически, изменениями в общем или дифференциальном числе лейкоцитов периферической крови, понижением клеточности лимфоидных тканей, повышением подверженности инфицирования условно-патогенными организмами или неоплазией. Основной задачей иммунотоксикологии, таким образом, является определение таких изменений и оценка их значимости для здоровья человека.
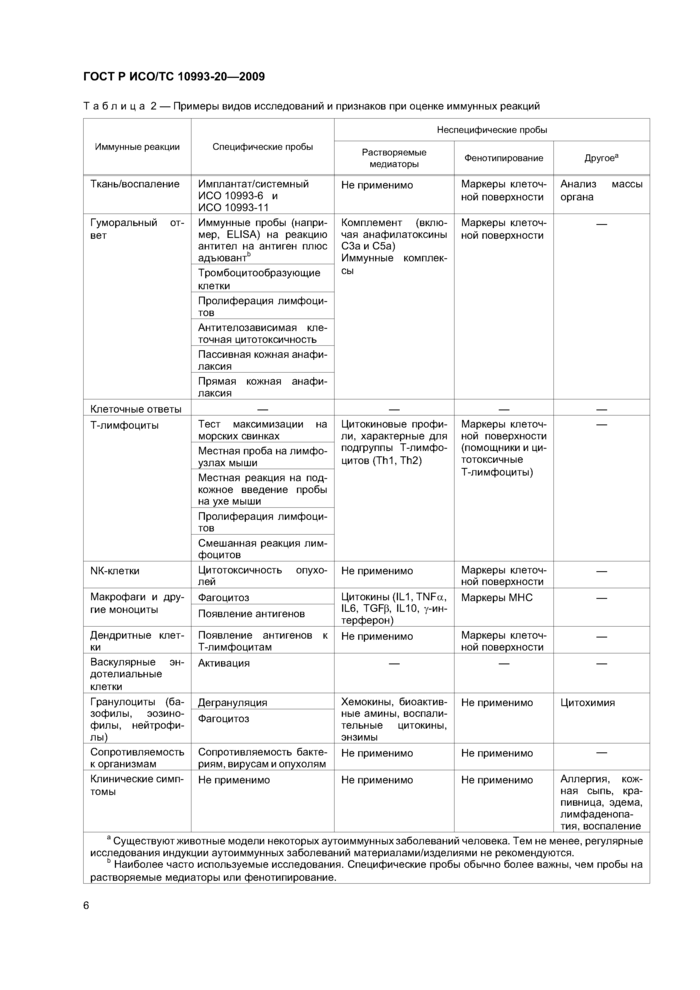
В контексте иммунотоксичности различают пробы двух видов: неспецифические и специфические. Неспецифические пробы носят описательный характер, измеряя, морфологически или количественно, изменения в объеме лимфоидной ткани, числе лимфоидных клеток и уровнях иммуноглобулинов или в других индикаторах иммунной функции. В отличие от этого, специфические пробы определяют активность клеток и/или органов, например, пролиферативные ответы лимфоцитов на митогены или специфические антигены, цитотоксичную активность и формацию специфичных антител (например, при ответе на эритроциты барана).
Новым направлением в этой области является применение «-омики» (разговорное название узкой области специализации в биологии) для обнаружения изменений в выражении генов, задействованных в иммунных функциях.
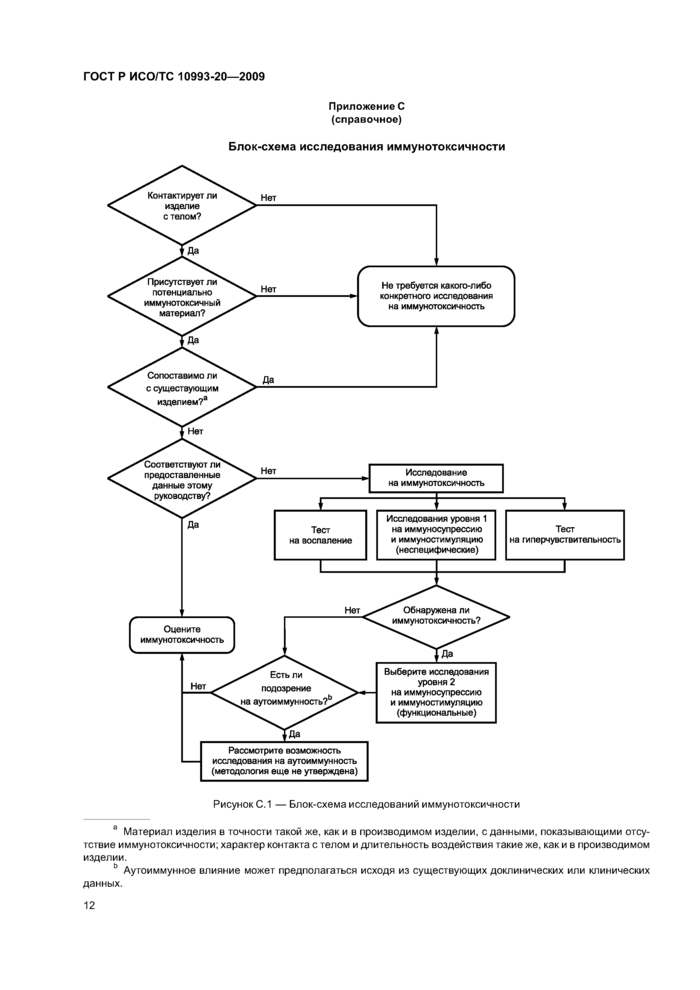
Оценка иммунотоксических факторов должна планироваться в соответствии с блок-схемой, приведенной в приложении С. Примеры видов исследований и признаков иммунных ответов приведены в таблице 2.
4
ГОСТ Р ИСО/ТС 10993-20—2009
Несмотря на то. что существуют конкретные материалы с известной или вероятной иммунотоксичностью. исследования иммунотоксичности, связанной с иммуносупрессией или иммуностимуляцией, должны первоначально ограничиваться определениями, проводимыми на стадии исследований общей токсичности. Дальнейшему исследованию должны подвергаться только агенты с выявленными признаками источников иммуносупрессии или иммуностимуляции. Подострые исследования полезны для получения общих признаков потенциальной иммуносупрессии или иммуностимуляции. Если они применяются. их выполнение должно проводиться в соответствии с ИСО 10993-11.
6.2 Воспаление
Агенты могут взаимодействовать с компонентами любой составляющей иммунной системы, то есть с гранулоцитами. макрофагами и клетками других видов, способными вырабатывать и выделять медиаторы воспаления. Необходимо отметить, что после имплантации инородного тела довольно распространен местный воспалительный ответ. Длительность и степень ответа определяют, является ли это негативным эффектом. Гистопатология места инъекции или имплантации агента является наиболее прямым и адекватным методом оценки степени индукции воспаления после воздействия агентов. Поражение тканей с преобладанием лимфоцитов является хроническим воспалением, связанным с иммунотоксичностью. в то время как реакция на инородное тело заключается в наличии макрофагов и гигантских клеток инородных тел в области контакта ткани и материала. Первичные исследования местного воспаления описаны в ИСО 10993-6. Другие подходящие исследования включают в себя пробы с сывороткой на С-реактивный протеин и белок острой фазы.
6.3 Иммуносупрессия
Для определения иммуносупрессии требуется многоуровневый подход, отражающий сложность иммунной системы и разнообразие ее функций и компонентов. Данный многоуровневый подход состоит из первого уровня исследования иммуносупрессии с использованием неспецифических проб, за которым следует второй уровень, включающий специфические пробы. Такой многоуровневый подход не является наиболее рациональным, так как специфические пробы более чувствительны, чем неспецифические. Менее чувствительные индикаторы применяются на первом уровне, а более чувствительные — на втором, не потому, что это наилучший способ оценки иммунной системы, а потому, что такой подход снижает необходимость использования дополнительных экспериментальных животных.
На первом уровне признаками иммуносупрессии являются индуцированные изменения, например. в массе иммунных органов, числе клеток и/или клеточных популяциях и в иммуноглобулинах.
Затем, на втором уровне, возможно применение более специфичных иммунных функциональных проб, таких как определение влияния агента на активность NK-клеток и/или иммунную функцию в период активной иммунизации, например, определение выработки антител, специфичных к антигенам после сенсибилизации. Отдельные руководства включают в себя некоторые из этих определений уже на первом уровне (ответ антител на Т-зависимые антигены, такие как эритроциты барана).
Реальные последствия иммуносупрессии, вероятно, лучше всего определяются путем оценки воздействия на сопротивляемость инфекции на бактериальных, вирусных и/или паразитических животных моделях и/или воздействия на сопротивляемость опухолям. Важность проб таких видов в том, что они рассматривают иммунную систему как законченную и функциональную целостность. Тем не менее, так какоценить все подходящие с точки зрения иммунологии параметры в рамках одного исследования токсичности или иммуносупрессии не является возможным, необходимо определить наиболее важные параметры прогнозирования и выбрать практический подход для оценки иммуносупрессии для конкретного агента.
Так как общее недомогание человека также влияет на иммунную систему, наличие иммуносупрессии признается при обнаружении иммунных изменений при уровне дозы, не вызывающем явной общей токсичности. Таким образом, исследование иммуносупрессии лучше проводить в рамках исследования общей токсичности, так как такое исследование использует диапазон различных доз агента и оценивает все основные системы органов.
Для обнаружения общей токсичности химических веществ после подострого воздействия недавно было принято OECD 407. (1), включающее несколько иммунотоксикологических параметров для определения иммунотоксического эффекта исследуемого состава.
5