ГОСТ Р 58706-2019
Продукция пищевая специализированная. Определение токсинов T-2 и HT-2 в зерновых и пищевой продукции для питания детей раннего возраста на зерновой основе методом ВЭЖХ-МС/МС после твердофазной очистки
Купить ГОСТ Р 58706-2019 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает метод определения токсинов T-2 и HT-2 посредством высокоэффективной жидкостной хроматографии (ВЭЖХ, HPLC) в сочетании с тандемной масс-спектрометрией (МС/МС) после очистки методом твердофазной экстракции (ТФЭ, SPE) в зерновых и пищевой продукции для питания детей раннего возраста на зерновой основе.
Метод валидирован для определения токсина HT-2 в овсяной муке с концентрацией 9,3 и 28,1 мкг/кг, в овсяных хлопьях с концентрацией 16,5 и 21,4 мкг/кг и в сухих завтраках (с содержанием овсяных хлопьев) с концентрацией 8,1 мкг/кг и для токсина T-2 в овсяной муке с концентрацией от 4,4 до 8,3 мкг/кг, в овсяных хлопьях с концентрацией от 4,9 до 6,6 мкг/кг, а также для сухих завтраков (с содержанием овсяных хлопьев) с концентрацией 3,5 мкг/кг.
Лабораторные исследования показали, что этот метод также применим к сильно разбухающим продуктам (овсяная каша на основе сухих зерновых культур и модифицированный крахмал). Однако эти продукты не были проверены в ходе валидации данного метода.
Данный метод допускается применять к побочным продуктам переработки овса с более высокой концентрацией токсинов T-2 и HT-2. В этом случае следует учитывать этапы разбавления.
Этот метод допускается применять к зерну и зерновым продуктам на основе пшеницы, ячменя и риса для питания детей раннего возраста. В этом случае необходимо проверить метод на всех продуктах в лабораторных условиях (внутренняя валидация). В ходе межлабораторных испытаний проверяется диапазон от 10 до 100 мкг/кг. Предварительные исследования показали, что этот метод охватывает весь диапазон концентраций, несмотря на то, что данный способ был применен только в диапазоне от 3 до 28,1 мкг/кг.
Стандарт разработан с учетом основных нормативных положений стандарта DIN EN 16923:2017, NEQ
Оглавление
1 Область применения
2 Нормативные ссылки
3 Сущность метода
4 Реактивы
5 Средства измерения
6 Проведение испытания
7 Обработка результатов
8 Точность
9 Протокол испытаний
Приложение А (обязательное) Примерные условия для подходящих систем ВЭЖХ-МС/МС
Приложение Б (справочное) Примерные хроматограммы (API 4000TM)
Приложение В (справочное) Точность данных
| Дата введения | 01.06.2020 |
|---|---|
| Добавлен в базу | 01.01.2021 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 29.11.2019 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1314-ст |
|---|---|---|---|
| Разработан | ФГУП СТАНДАРТИНФОРМ | ||
| Издан | Стандартинформ | 2020 г. |
Foods for special dietary uses. Determination of T-2 and HT-2 toxins in cereals and cereal based products for infant and young children by HPLC-MS/MS after SPE-cleanup
- ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
- ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
- ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
- ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
- ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ Р ИСО 5725-1-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения
- ГОСТ Р ИСО 5725-2-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 2. Основной метод определения повторяемости и воспроизводимости стандартного метода измерений
- ГОСТ Р ИСО 5725-3-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 3. Промежуточные показатели прецизионности стандартного метода измерений
- ГОСТ Р ИСО 5725-4-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 4. Основные методы определения правильности стандартного метода измерений
- ГОСТ Р ИСО 5725-5-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 5. Альтернативные методы определения прецизионности стандартного метода измерений
- ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
- ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
- ГОСТ 28311-89 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
- ГОСТ 6995-77 Реактивы. Метанол-яд. Технические условия
- ГОСТ Р 52501-2005 Вода для лабораторного анализа. Технические условия
- ГОСТ OIML R 76-1-2011 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
- ГОСТ ISO 7886-1-2011 Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования
- Федеральный закон 162-ФЗ О стандартизации в Российской Федерации
- ГОСТ 33303-2015 Продукты пищевые. Методы отбора проб для определения микотоксинов
- ГОСТ 12.1.019-2017 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7
стр. 8

стр. 9

стр. 10
стр. 11

стр. 12

стр. 13
стр. 14
стр. 15
стр. 16
стр. 17
стр. 18
стр. 19
стр. 20
стр. 21

стр. 22

стр. 23
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ГОСТР
58706—
2019
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ПРОДУКЦИЯ ПИЩЕВАЯ СПЕЦИАЛИЗИРОВАННАЯ
Определение токсинов Т-2 и НТ-2 в зерновых и пищевой продукции для питания детей раннего возраста на зерновой основе методом ВЭЖХ-МС/МС после твердофазной очистки
Издание официальное
Москва
Стандартинформ
2020
Предисловие
1 РАЗРАБОТАН Федеральным государственным унитарным предприятием «Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия» (ФГУП «СТАН-ДАРТИНФОРМ»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 036 «Продукция специализированная пищевая».
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2019 г. № 1314-ст
4 Настоящий стандарт разработан с учетом основных нормативных положений стандарта ДИН ЕН 16923:2017 «Продукты пищевые. Определение токсинов Т-2 и НТ-2 в зерне и зерновых продуктах для детей грудного и младшего возраста методом высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии (ВЭЖХ-МС/МС) после очистки методом твердофазной экстракции (ТФЭ)» (DIN EN 16923:2017 «Foodstuffs — Determination of Т-2 toxin and HT-2 toxin in cereals and cereal products for infants and young children by LC-MS/MS after SPE cleanup». NEQ)
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ. оформление. 2020
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
и
„ _ Р‘а К* V*,
(3)
ms ' ^аликв
где Vex— объем раствора для экстракции, равный 100 см3;
Vim — объем шеей растворителей, используемых для повторного растворения сгущенной пробы.
равный 0.5 см3; ms— масса навески, равная 25 г;
Уаликв — аликвотная доля экстракта опытного образца, равная 5 см3.
8 Точность
8.1 Общее положение
Межлабораторное испытание для определения точности метода приведено подробно в приложении В. Значения, полученные в результате подобного межлабораторного испытания, не обязательно применимы к диапазонам концентраций и матрицам, которые отличаются от приведенных в приложении В.
8.2 Повторяемость
Абсолютная разница двух единичных результатов, полученных одним исследователем на одинаковых образцах на одном и том же оборудовании в течение минимального отрезка времени, будет превышать предел повторяемости г в таблицах 3 и 4 не чаще, чем в 5 % случаев.
8.3 Воспроизводимость
Абсолютная разница двух единичных результатов, полученных одним исследователем на одинаковых образцах, будет превышать предел воспроизводимости R в таблицах 3 и 4 не чаще, чем в 5 % случаев (согласно ГОСТ Р ИСО 5725-1. ГОСТ Р ИСО 5725-2, ГОСТ Р ИСО 5725-3. ГОСТ Р ИСО 5725-4. ГОСТ Р ИСО 5725-5, ГОСТ Р ИСО 5725-6).
|
Таблица 3 — Точность данных для токсина НТ-2 | ||||||||||||||||||||||||
|
|
Таблица 4 — Точность данных для токсина Т-2 | ||||||||||||||||||||||||
|
9 Протокол испытаний
Протокол испытаний должен содержать следующие минимальные данные:
- необходимые сведения для идентификации опытного образца (вид. происхождение, наименование);
- ссылку на настоящий стандарт;
- дату и способ отбора проб (если известен):
-дату поступления пробы:
-дату проведения испытания;
- результаты испытания и единицы, в которых они указаны:
- все особые признаки, установленные во время испытания;
- все рабочие операции, не установленные этим методом или рассматриваемые как необязательные и которые могут повлиять на результаты.
Приложение А (обязательное)
Примерные условия для подходящих систем ВЭЖХ-МС/МС
А.1 Системные настройки для SCIEX API 4000ТМ и SCIEX API 4000ТМ QTrap А.1.1 Настройки хроматографии
Разделительная колонка
Объем вводимого вещества Температура колонки: Скорость потока Элюент А Элюент В
Эти и все другие хроматографические настройки в А 2 1. А 3 1 и А 4 1 следует рассматривать как ориентировочные значения Точные условия для проведения хроматографии зависят от самой лаборатории, и поэтому допускается небольшое отличие параметров Измерение эталонных растворов должно подтвердить пригодность аналитических растворов
Phenomenex фенилгексил. размерами 125 * 2 мм. 5 мкм, с соответствующей пред-колонкой 25 мкл 40 X
0,2 см3/мин вода
ацетонитрил (4.1)
Схема градиента приведена в таблице А 1
|
Таблица А.1 — Схема градиента | ||||||||||||||||||
|
А.1.2 Параметры детектора
Параметры источника и общие настройки масс-спектрометра (см таблицу А 2)
Все последующие параметры детектора и параметры в А2.2, А 3 2 и А 4.2 можно рассматривать в качестве ориентировочных значений Точные условия для проведения измерений зависят от прибора, и поэтому допускается небольшое отличие параметров Измерение стандартных растворов должно подтвердить пригодность аналитических растворов.
Ионизация: химическая ионизация при атмосферном давлении (APCI, англ, atmospheric
350 X 96527 Па 20684 Па 10 эВ
5500 В 241317 Па 413685 Па
pressure chemical ionization)
Температура
Небулайзер:
Давление газа в ячейке соударения Потенциал на входе (ЕР): Напряжение на электроспрее Положительная ионизация Давление газа ионного источника 1: Давление газа ионного источника 2
Разрешение на квадруполе 1: единица измерения
Разрешение на квадруполе 3: единица измерения
Специфические условия масс-спектрометрии приведены в таблице А2
|
Таблица А. 2 — Специфические условия масс-спектрометрии | ||||||||||||||||||||||||
|
|
Окончание таблицы А 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Потенциал столкновения на выходе из ячейки
Время удерживания токсин НТ-2 и [’^^токсин-НТ-г: 9,68 мин
токсин Т-2 и [13С24Иоксии*т*2; 10,30 мин
А.2 Системные настройки для SCIEX API 2000ТМ
А.2.1 Настройки хроматографии
Хроматографическая колонка Phenomenex Gemini С18, размерами 150 * 3,0 мм, 5 мкм, с предколонкой Phe-
nomonex Gemini С18, размерами 4 мм * 2,0 мм, 5 мкм Обьем вкола: 30 мм3
Температура колонки: 35 “С
Скорость потока 0,25 см3/мин
Элюент А 0,1 % раствор муравьиной кислоты в воде (4 13)
Элюент В: 0.1 % раствор муравьиной кислоты в ацетонитриле (4 13)
Схема градиента приведена в таблице А 3
|
Таблица АЗ — Схема градиента | |||||||||||||||||||||
|
А.2.2 Параметры детектора
(ESI, англ elec-
Параметры источника и специфические настройки масс-спектрометрии (см таблицу А 4): Ионизация: электрораспылительная ионизация
trospray ionization)
Температура 375 °С
Небулайэер: 206843 Па
Давление газа в ячейке соударения (газ для соударений) 20684 Па
Потенциал декластеризации (разделения) 11 эВ
Потенциал фокусировки (FP): 309 эВ
Напряжение на электроспрее
Положительная ионизация: 5500 В
Давление газа ионного источника 1: 172369 Па
Давление газа ионного источника 2. 344738 Па
Разрешение на квадруполе 1: единица измерения
Разрешение на квадруполе 3: единица измерения
|
Таблица А 4 — Специфические условия масс-спектрометрии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Время удерживания токсин НТ-2 и (13С22}-токсин-НТ-2: 7.62 мин токсин Т-2 и [,3С24}-токсин-Т-2: 9.37 мин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
А.З Системные настройки для SCIEX API 3000ТМ
А.3.1 Настройки хроматографии
Хроматографическая колонка Phenomenex Synergi Fusion RP 80, размерами 250 * 2 мм, 5 мкм, с картриджем
Phenomenex Security Guard. 4 * 2 мм Объем вкола: 10 мм3
Температура колонки 25 *С
Скорость потока 0.2 см3/мин
Элюент А 80 частей (1 л воды ♦ 50 мм3 раствора аммиака (4 14); р = 6,25 г/дм3) ♦ 20 частей
элюента В
Элюент В: 1 дм3 ацетонитрила (4.1) ♦ 25 мм3 раствора аммиака (4 14) + 1000 мм3 раствора
ацетата аммония (4.15) (р = 10 мг/дм3)
Схема градиента приведена в таблице А 5
|
Таблица А 5 — Схема градиента | |||||||||||||||
|
А.3.2 Параметры детектора
Ионизация
Температура:
Газовая завеса:
Небулайзер:
Давление газа в ячейке соударения Потенциал на входе (ЕР): Напряжение на электроспрее: Положительная ионизация Давление газа ионного источника 1: Давление газа ионного источника 2 Разрешение на квадруполе 1: Разрешение на квадруполе 3:
Параметры источника и общие настройки масс-спектрометрии (см. также таблицу А 6):
электрораспылительная ионизация (ESI, англ electrospray ionization)
400 eC
55158 Па
55158 Па
27579 Па
10 эВ
4200 В 206843 Па 482633 Па единица измерения единица измерения
|
Таблица А. 6 — Специфические условия масс-спектрометрии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Время удерживания токсин НТ-2 и [,3С22]-токсин-НТ-2 20.72 мин токсин Т-2 и (,3С24)-токсин-Т-2: 26,15 мин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
А.4 Системные настройки для Micromass Quattro LC
А.4.1 Настройки хроматографии
Хроматографическая колонка: Phenomenex Aqua, размерами 150 * 2,1 мм. 3 мкм
Объем вкола 20 мм3
Температура колонки 40 ’С
Скорость потока 0,3 см3/мин
Элюент: метанол (4.2) /вода (80 ♦ 20, В + В), изократическое элюирование
А.4.2 Параметры детектора
Ионизация:
Температура Температура источника Температура осушающего газа Скорость потока осушающего газа Небулзйзер:
Давление газа в ячейке соударений: Потенциал на входе (ЕР): Напряжение на капилляре Положительная ионизация Давление газа ионного источника 1: Давление газа ионного источника 2 Разрешение на квадруполе 1 Разрешение на квадруполе 3:
Параметры источника и специфические настройки масс-спектрометрии (см таблицу А 7):
электрораспылительная ионизация (ESI, англ electrospray ionization)
350 eC
120 *С
450 *С
800 дм3/ч
45 дм3/ч
27579 Па
10 эВ
2000 В 206843 Па 482633 Па единица измерения единица измерения
|
Таблица А. 7 — Специфические условия масс-спектрометрии | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Окончание таблицы А 7 | |||||||||||||||||||||
| |||||||||||||||||||||
|
Время удерживания токсин НТ-2 и (1ЭС22]-токсин-НТ-2: 9,32 мин токсин Т-2 и ['^С24]-токсин-Т-2: 10.65 мин |
Приложение Б (справочное)
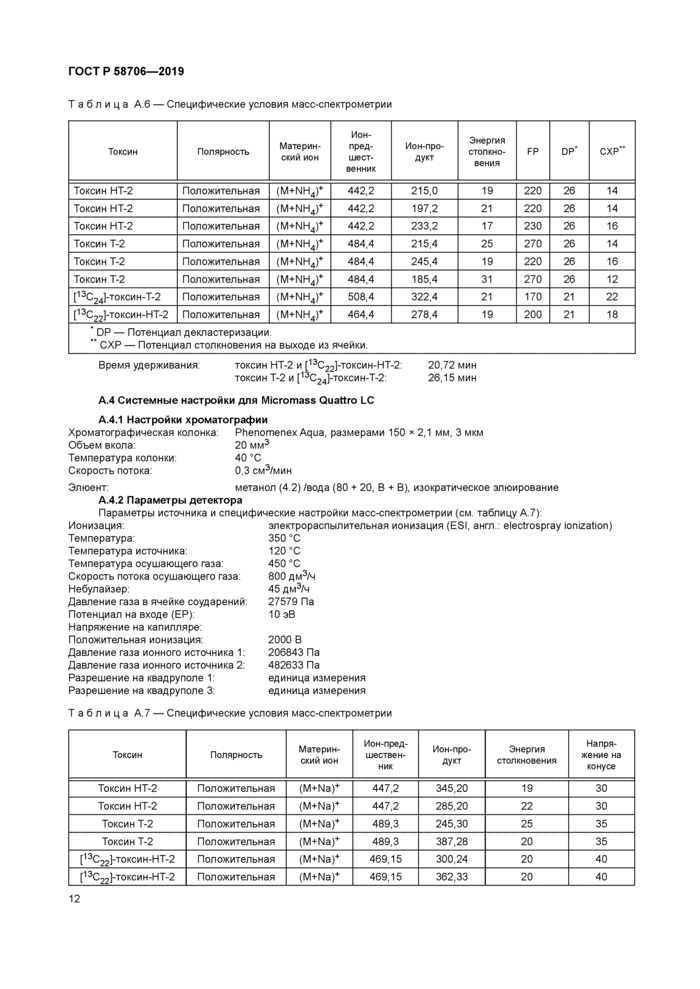
Примерные хроматограммы (API 4000ТМ)
У — интенсивность, импульс в секунду; 1 — токсин НТ-2 при 9,65 мин; 2 — токсин Т-2 при 10,34 мин
Рисунок Б 1 — Хроматограмма общего ионного тока и хроматограммы по отдельным ионам стандартного раствора с массовой концентрацией 20 нг/см3
|
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 X. мин |
6000
4000
2000
. I . I . I . * , I . * I . * . I . I 1. I . I . I . I . I . I . I . I . I
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 X. мин
1500
1000
500
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 X. мин
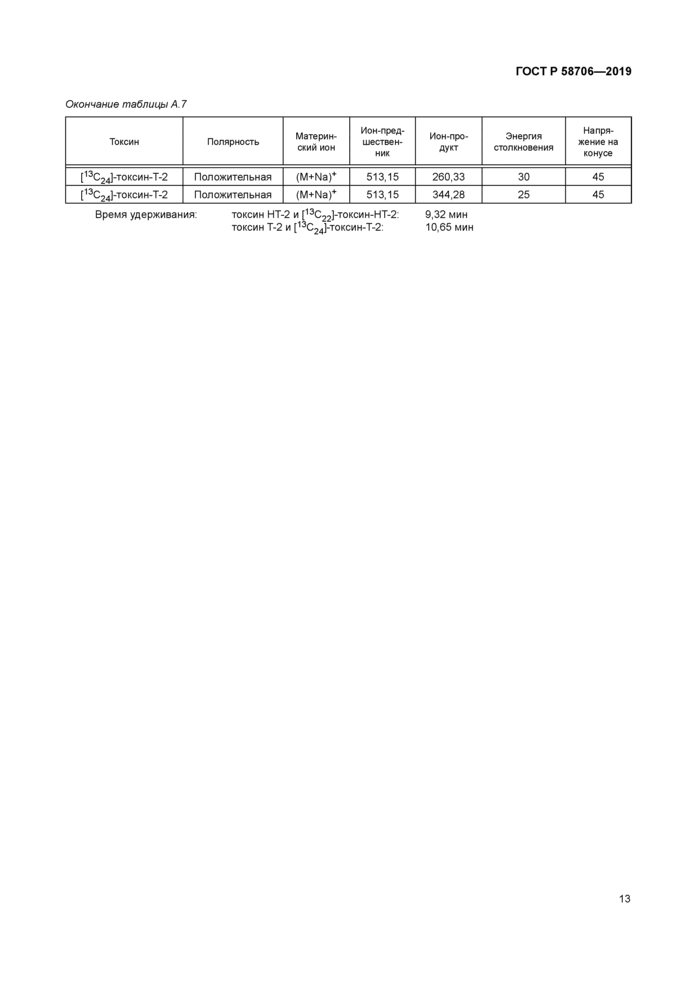
у — интенсивность, импульс в секунду; 1 — токсин НТ-2 при 9,65 мин; 2 — токсин Т-2 при 10,34 мин Рисунок Б 2 — Характерная хроматограмма стандартного раствора с массовой концентрацией 20 нг/см3
|
0 1 2 3 4 5 6 7 8 9 10 II 12 1з" 14 15 16 17 18 19 X. мин |
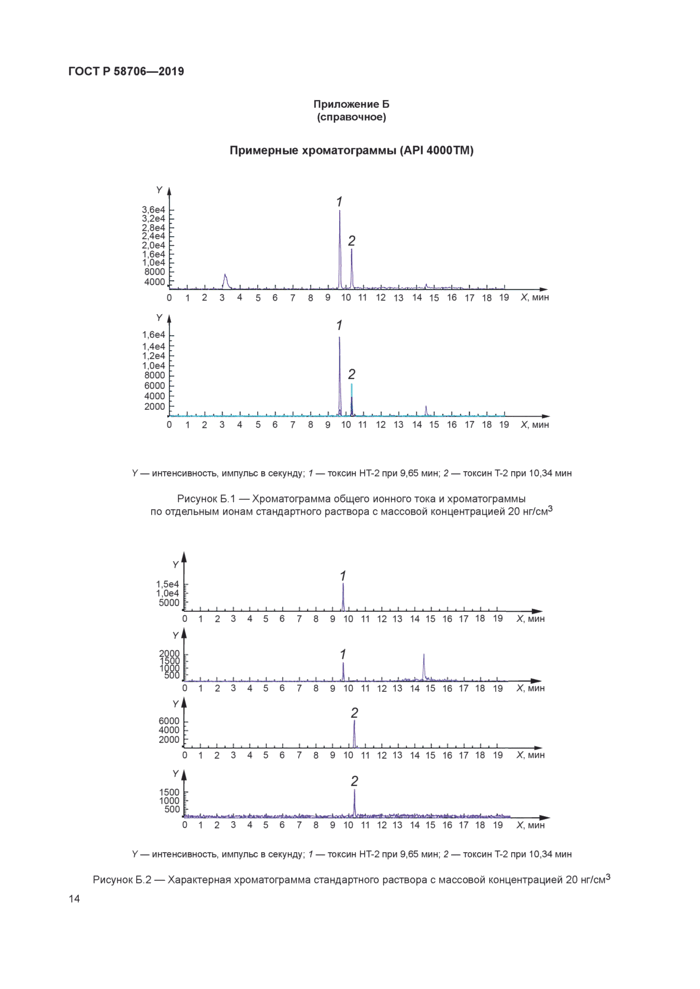
У — интенсивность, импульс в секунду, 1 — токсин НТ-2 при 9,6 мин. массовая доля примерно 9.6 мкг/кг;
2 — токсин Т-2 при 10.3 мин. массовая доля примерно 4.2 мкг/кг
Рисунок Б.З — Хроматограмма общего ионного тока и хроматограммы по отдельным ионам образца овсяной муки
|
2.0е4 Т0е4 5000 |
| |||||||||||||||||||||||||||||||||
|
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 X. мин | ||||||||||||||||||||||||||||||||||
5660
4000
2000
1а-1. «1.1.1
1 . 1.Д1
j-Ll ...1
0 1 2 3 4 5
У
6000
4000
2000
7 8 9 10 11 12 13 14 15 16 17 18 19 X. мин
2
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 X. мин
У
1825
1500
1000
500
LL
I .. i. > I ■ > i.. 1
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 X. мин
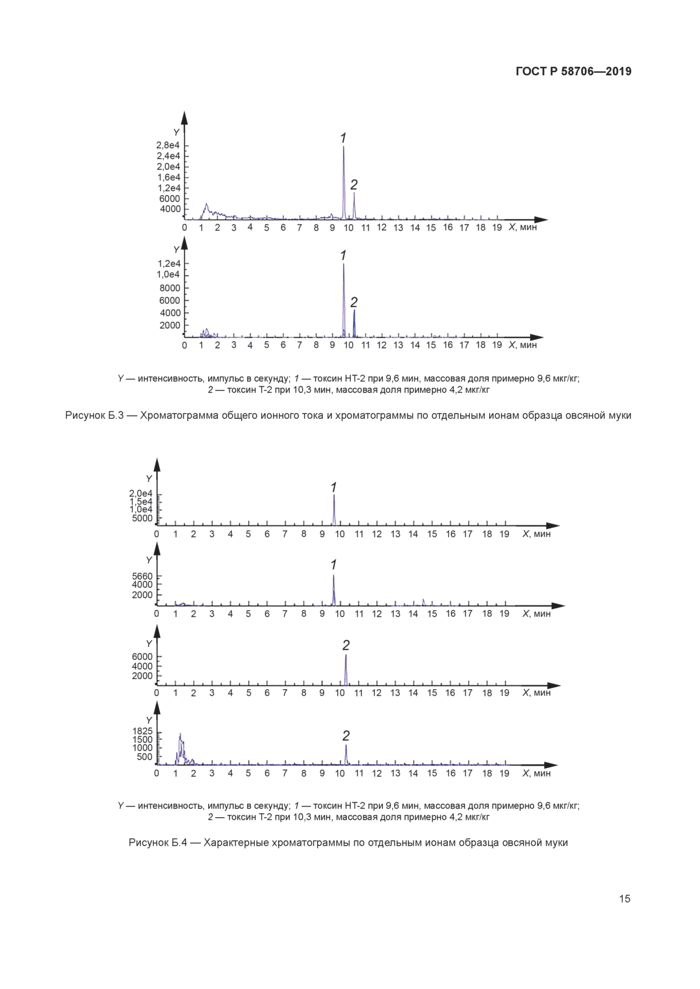
У — интенсивность, импульс в секунду. 1 — токсин НТ-2 при 9,6 мин. массовая доля примерно 9.6 мкг/кг; 2 — токсин Т-2 при 10,3 мин. массовая доля примерно 4.2 мкг/кг
Рисунок Б 4 — Характерные хроматограммы по отдельным ионам образца овсяной муки
Приложение В (справочное)
Точность данных
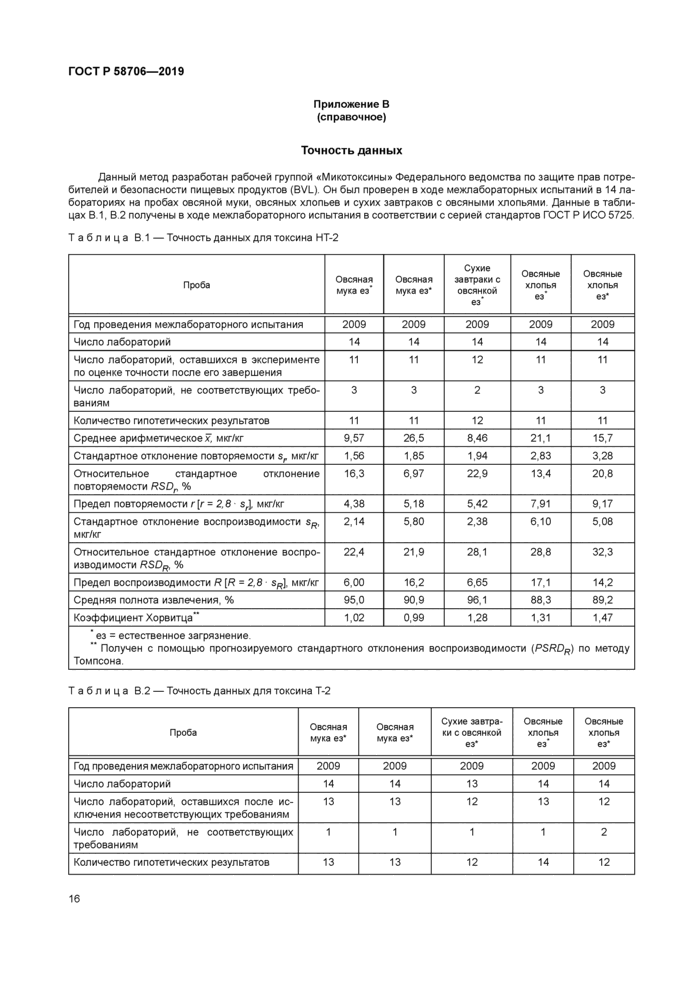
Данный метод разработан рабочей группой «Микотоксины» Федерального ведомства по защите прав потребителей и безопасности пищевых продуктов (8VL) Он был проверен в ходе межлабораторных испытаний в 14 лабораториях на пробах овсяной муки, овсяных хлопьев и сухих завтраков с овсяными хлопьями Данные в таблицах В 1. В 2 получены в ходе межлабораторного испытания в соответствии с серией стандартов ГОСТ Р ИСО 5725
|
Таблица В. 1 — Точность данных для токсина НТ-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
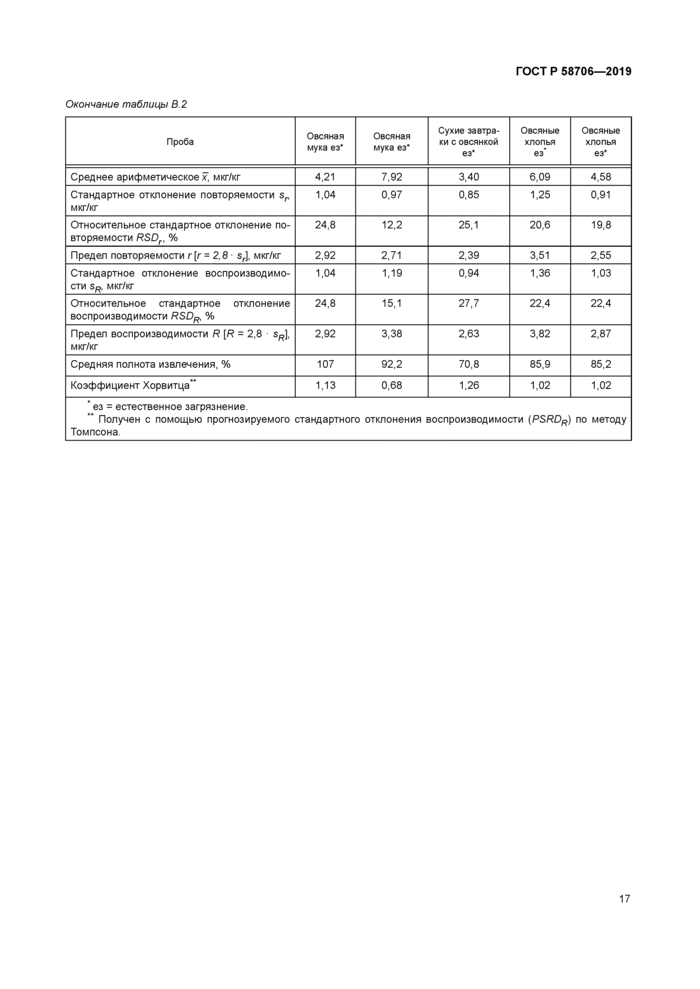
Таблица В. 2 — Точность данных для токсина Т-2 | ||||||||||||||||||||||||||||||||||||
|
Содержание
1 Область применения....................................................................................................................................1
2 Нормативные ссылки....................................................................................................................................1
3 Сущность метода..........................................................................................................................................2
4 Реактивы........................................................................................................................................................2
5 Средства измерения.....................................................................................................................................4
6 Проведение испытания................................................................................................................................5
7 Обработка результатов................................................................................................................................в
8 Точность.........................................................................................................................................................7
9 Протокол испытаний.....................................................................................................................................8
Приложение А (обязательное) Примерные условия для подходящих систем ВЭЖХ-МС/МС..................9
Приложение Б (справочное) Примерные хроматограммы (API 4000ТМ)..................................................14
Приложение В (справочное) Точность данных............................................................................................16
|
Окончание таблицы В 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Введение
Токсин Т-2 и его метаболит токсин НТ-2 относятся к группе трихотеценовых микотоксинов, продуцируемых некоторыми видами семейства плесневых грибов рода фузариум. В основном заражаются злаки: кукуруза, пшеница, ячмень, овес и рожь.
ВНИМАНИЕ! Если выполняют какие-либо действия с опасными химическими веществами, то следует принять соответствующие меры предосторожности и защиты, а также необходимо соблюдать требования безопасности по ГОСТ 12.1.007, ГОСТ 12.1.004, ГОСТ 12.1.005, ГОСТ 12.1.019, ГОСТ 12.4.009. ГОСТ 12.4.021.
ВНИМАНИЕ! При использовании настоящего стандарта могут применяться опасные вещества, действия и оборудование. Настоящий стандарт не решает все проблемы безопасности, связанные с его применением. Пользователь настоящего стандарта несет ответственность за принятие соответствующих мер по технике безопасности и охране здоровья, а также определяет необходимые ограничительные предписания перед его применением.
ВНИМАНИЕ! Известно, что токсин Т-2 и его метаболит токсин НТ-2 обладают канцерогенными свойствами.
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРОДУКЦИЯ ПИЩЕВАЯ СПЕЦИАЛИЗИРОВАННАЯ
Определение токсинов Т-2 и НТ-2 в зерновых и пищевой продукции для питания детей раннего возраста на зерновой основе методом ВЭЖХ-МС/МС после твердофазной очистки
Foods for special dietary uses Determination of T-2 and HT-2 toxins in cereals and cereal based products for infant and
young children by HPLC-MS/MS after SPE-cleanup
Дата введения — 2020—06—01
1 Область применения
Настоящий стандарт устанавливает метод определения токсинов Т-2 и НТ-2 посредством высокоэффективной жидкостной хроматографии (ВЭЖХ. HPLC) в сочетании с тандемной масс-спектрометрией (МС/МС) после очистки методом твердофазной экстракции (ТФЭ. SPE) в зерновых и пищевой продукции для питания детей раннего возраста на зерновой основе.
Метод валидирован для определения токсина НТ-2 в овсяной муке с концентрацией 9,3 и
28,1 мкг/кг. в овсяных хлопьях с концентрацией 16,5 и 21,4 мкг/кг и в сухих завтраках (с содержанием овсяных хлопьев) с концентрацией 8,1 мкг/кг и для токсина Т-2 в овсяной муке с концентрацией от 4.4 до 8,3 мкг/кг, в овсяных хлопьях с концентрацией от 4,9 до 6,6 мкг/кг, а также для сухих завтраков (с содержанием овсяных хлопьев) с концентрацией 3.5 мкг/кг.
Лабораторные исследования показали, что этот метод также применим к сильно разбухающим продуктам (овсяная каша на основе сухих зерновых культур и модифицированный крахмал). Однако эти продукты не были проверены в ходе валидации данного метода. Более подробное описание приведено в 6.3.
Данный метод допускается применять к побочным продуктам переработки овса с более высокой концентрацией токсинов Т-2 и НТ-2. В этом случае следует учитывать этапы разбавления.
Этот метод допускается применять к зерну и зерновым продуктам на основе пшеницы, ячменя и риса для питания детей раннего возраста. В этом случае необходимо проверить метод на всех продуктах в лабораторных условиях (внутренняя валидация). В ходе межлабораторных испытаний проверяется диапазон от 10 до 100 мкг/кг. Предварительные исследования показали, что этот метод охватывает весь диапазон концентраций, несмотря на то. что данный способ был применен только в диапазоне от 3 до 28,1 мкг/кг.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 12.1.004 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.019 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
Издание официальное
ГОСТ 12 4 009 Система стандартов безопасности труда Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.021 Система стандартов безопасности труда. Системы вентиляционные Общие требования
ГОСТ 1770 (ИСО 1042—83. ИСО 4788—80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 28311 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
ГОСТ 33303 Продукты пищевые Методы отбора проб для определения микотоксинов ГОСТ Р 52501 (ИСО 3696:1987) Вода для лабораторного анализа. Технические условия ГОСТ 6709 Вода дистиллированная. Технические условия ГОСТ 6995 Реактивы. Метанол-яд. Технические условия
ГОСТ ISO 7886-1 Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования
ГОСТ OIML R 76-1 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ Р ИСО 5725-1 Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения
ГОСТ Р ИСО 5725-2 Точность (правильность и прецизионность) методов и результатов измерений. Часть 2. Основной метод определения повторяемости и воспроизводимости стандартного метода измерений
ГОСТ Р ИСО 5725-3 Точность (правильность и прецизионность) методов и результатов измерений. Часть 3. Промежуточные показатели прецизионности стандартного метода измерений
ГОСТ Р ИСО 5725-4 Точность (правильность и прецизионность) методов и результатов измерений. Часть 4. Основные методы определения правильности стандартного метода измерений
ГОСТ Р ИСО 5725-5 Точность (правильность и прецизионность) методов и результатов измерений. Часть 5. Альтернативные методы определения прецизионности стандартного метода измерений
ГОСТ Р ИСО 5725-6 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты*, который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия) Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Сущность метода
Токсины Т-2 и НТ-2 экстрагируют водным раствором ацетонитрила путем встряхивания вручную или перемешивания на лабораторном смесителе. Отфильтрованный и разбавленный экстракт очищают и концентрируют в колонке для твердофазной экстракции или в пропускной колонке. Содержание токсинов определяют методом ВЭЖХ в сочетании с тандемной масс-слектрометрией.
4 Реактивы
Если не указано иное, используют только химические чистые реактивы для анализа (ч. д. а) и воду 1-й степени чистоты в соответствии с ГОСТ Р 52501. Если не указано иное, чистота растворителей должна быть соответствующей степени чистоты для ВЭЖХ.
4.1 Ацетонитрил для ВЭЖХ
4.2 Метанол по ГОСТ 6995. для ВЭЖХ.
4.3 Смесь растворителей. 20 частей ацетонитрила (4.1) смешивают с 80 частями воды (20+80. В+В).
4 4 Смесь для экстрагирования 84 части ацетонитрила (4 1) смешивают с 16 частями веды (84+16. В+В)
4.5 Элюент для ВЭЖХ-МС/МС. Примеры элюентов. подходящих для систем ВЭЖХ-МС/МС. приведены в приложении А. Раствор фильтруют через мембранный фильтр (5.18).
4.6 Азот, чистота не менее 99.9 %.
4.7 Уголь активированный для хроматографии на колонке (размер частиц: от 63 до 200 мкм).
4.8 Оксид алюминия (нейтральный, для жидкостной хроматографии).
4.9 Земля диатомитовая, мелкозернистая / измельченная (диатомит, кизельгур), например, Celite 545.
4.10 Агент силилирующий.
4.11 Циклогексан, чистый для анализа (дополнительно).
4.12 Получение разбавленного силилирующего агента (дополнительно), например. 50 см3 силили-рующего агента (4.10) смешивают с 950 см3 циклогексана (4 11).
4.13 Кислота муравьиная, степень чистоты для ВЭЖХ.
4.14 Раствор аммиака, молярная концентрация с(Жз) = 13400 моль/м3 или массовая концентрация ptNH-j) = 250 г/дм3.
4.15 Ацетат аммония (CHjCC^NH^. степень чистоты для ВЭЖХ-МС/МС.
4.16 Материал, защищающий от засорения (препятствующий закупориванию), например промытый морской песок, стеклянные или полиэтиленовые шарики (дополнительно).
4.17 Основной раствор токсина Т-2, массовая концентрация р = 100 мкг/см3, в ацетонитриле.
4.18 Основной раствор токсина НТ-2, р = 100 мкг/см3 в ацетонитриле.
4.19 Раствор внутреннего стандарта меченного изотопом токсина [13С24)-Т-2. Р = 25 мкг/см3 в ацетонитриле. В качестве (13С24]-токсина-Т-2 можно также использовать и другие внутренние стандарты токсина Т-2, меченые изотопом.
4.20 Раствор внутреннего стандарта меченного изотопом токсина [13С22)-НТ-2. р = 25 мкг/см3 в ацетонитриле. В качестве (13С22)-токсина-НТ-2 можно также использовать и другие внутренние стандарты токсина НТ-2. меченые изотопом.
4.21 Смесь основных растворов токсинов Т-2 и НТ-2. р = 500 нг/см3
Пипеткой отбирают по 25 мм3 основных растворов токсинов Т-2 и НТ-2 (4.17 и 4.18) в мерную колбу объемом 5 см3 и добавляют смесь растворителей до метки (4.3).
Раствор допускается хранить 12 мес при температуре минус 18 °С.
4.22 Смесь растворов внутренних стандартов токсинов, р = 1000 нг/см3
Растворы внутренних стандартов токсинов по 200 мм3 (4.19 и 4.20) разбавляют в мерной колбе объемом 5 см3 смесью растворителей (4.3).
Такой раствор допускается хранить 6 мес при температуре минус 18 °С.
4.23 Растворы градуировочные
Для градуировки измерительной системы готовят градуировочные растворы с массовой концентрацией от 5 до 100 нг/см3.
Градуировочные растворы приведены в таблице 1.
|
Таблица 1— Примеры подходящих градуировочных растворов | ||||||||||||||||||||||||||||||||||||||||||
|
|
Окончание таблицы 1 | ||||||||||||||||||
|
5 Средства измерения
Применяют следующие лабораторные приборы:
5.1 Весы лабораторные по ГОСТ OIML R 76-1. предел погрешности: 0.01 г.
5.2 Весы аналитические, предел погрешности: 0.1 мг.
5.3 Ванна ультразвуковая.
5.4 Шейкер лабораторный для пробирок.
5.5 Дозатор ручной, шприцы микромилпигровые по ГОСТ ISO 7886-1 или пипетки, от 10 мм3 до 5 см3.
5.6 Дозатор по ГОСТ 28311, на 20 см3.
5.7 Колба Эрленмейера 250 см3 с пробкой или центрифужная пробирка на 250 см3.
5.8 Фильтр шприцевой (0.45 мкм) или центробежный фильтр (например. Durapore PVDF (0.45 мкм) или Millipore Ultrafree-MC. 0.5 см3, подходящие для центрифужных пробирок, например пробирка типа «Эппендорф».
5.9 Фильтр складчатый, размер пор от 4 до 7 мкм. диаметр 100 мм.
5.10 Центрифуга лабораторная.
5.11 Картриджи пустые объемом 6 см3 из полипропилена (РР) и пористые пластины из полиэтилена (РЕ) или обычные колонки твердофазной экстракции, например CHROMABOND Carbon/Alox/Celite, 6 см3. 500 мг.
5.12 Система для твердофазной экстракции.
5.13 Шейкеры лабораторные, например ротационные шейкеры.
5.14 Смеситель лабораторный, например Ultra Тиетах.
5.15 Пробирки по ГОСТ 1770. подходящие для объема до 10,0 см3.
5.16 Пробирки силанизированные (дополнительно).
Заранее тщательно очищенные пробирки (5.15) заполняют до края разбавленным силилирующим агентом (4.12) и оставляют на 1 мин. Затем раствор реагента выливают из пробирки в специальную емкость. чтобы использовать повторно. Пробирки промывают сначала циклогексаном (4.11), а затем ацетонитрилом (4.1) или метанолом (4.2). Промывочные растворы допускается использовать многократно. Далее пробирки дважды промывают дистиллированной водой по ГОСТ 6709 и просушивают.
ПРЕДУПРЕЖДЕНИЕ — Surfasil представляет собой раствор силилхлорида, который, вступая в реакцию с водой, образует пары соляной кислоты. Поэтому после дериватизации пробирки никогда не следует промывать водой.
Если подтверждена пригодность несиланизированных сосудов, то можно использовать, например. пробирки из полипропилена.
5.17 Система для упаривания, например TurboVap LV Zymark или аналог.
5.18 Фильтр мембранный для водных растворов (размер пор 0.45 мкм).
5.19 Система ВЭЖХ-МС/МС. состоящая из перечисленных в 5.19.1—5.19.6 устройств.
5.19.1 Насос для ВЭЖХ.
5.19.2 Система ввода образцов.
5.19.3 Колонка хроматографическая, например октадецилсилан (ODS), который обеспечивает разрешение пиков токсинов Т-2 и НТ-2 более одного для распознавания от других сигналов, длина 150 мм. внутренний диаметр 2.00 мм. размер частиц 5 мкм. подходящая предколонка с обращенной фазой.
Также можно использовать колонки других размеров.
5.19.4 Термостат для колонок.
5.19.5 Масс-спектрометр тандемный (МС/МС).
5.19 6 Система обработки данных.
6 Проведение испытания
6.1 Подготовка проб для анализа
Перед началом анализа по ГОСТ 33303 или другим нормативным документам, действующим на территории государства, принявшего стандарт, образец измельчается до однородного состояния, размер частиц не должен превышать 1 мм.
6.2 Подготовка колонки для твердофазной экстракции
42 г активированного угля (4.7) смешивают с 30 г нейтрального оксида алюминия (4.8) и 18 г це-лита 545 (4.9) в стеклянной пробирке объемом 500 см3 (соотношение компонентов в смеси 7:5:3 — активированный уголь/оксид алюминия нейтральный/целит 545; м/м/м) до однородного состояния в шейкере (5.13) в течение 1 ч, 0.5 г однородной смеси переносят в пустые картриджи объемом 6 см3 с тремя пористыми пластинами из полиэтилена (2 пластины внизу и 1 вверху для покрытия).
В качестве альтернативы допускается также использовать доступные колонки для твердофазной экстракции. Должна быть проверена эффективность разделения этих колонок и при необходимости проведена процедура очистки.
6.3 Выделение токсинов Т-2 и НТ-2
25.0 г однородного и мелко измельченного образца (6.1) взвешивают в химическом стакане/колбе Эрленмейера объемом 250 см3 или центрифужной пробирке объемом 250 см3 (5.7) с ценой деления 0,1 г. добавляют 100 см3 экстракционной смеси (4.4) и закрывают пробку. Смесь встряхивают вручную или на шейкере (5.13) в течение 1 ч при комнатной температуре.
В качестве альтернативного способа извлечения также используют лабораторный смеситель (5.14). В этом случае смесь перемешивают до однородного состояния в течение 3 мин с высокой скоростью.
После экстракции чуть больше 10 см3 экстракта фильтруют через складчатый фильтр (5.9) в стеклянную пробирку. Это количество центрифугируют в течение 10 мин при комнатной температуре при 2500 д. Удаляют 10 см3 надосадочной жидкости.
Для сильно набухающих пищевых продуктов, в которых содержание влаги в экстракционной среде увеличивается до 200 %. навеску пробы уменьшают до 50 % от описанного количества. Для предотвращения комкования набухающего материала добавляют, например, морской песок (4.16) в объеме, подходящем для массы образца.
Изменение объема и/или массы учитывают при окончательном расчете.
6.4 Очистка методом твердофазной экстракции
Подготовленную колонку с 0.5 г активированного угля/оксида алюминия/целита (6.2) помещают в систему для твердофазной экстракции (5.12) и подставляют пробирку (5.15) для сбора элюата. В колонку твердофазной экстракции добавляют 5.0 см3 экстракта (6.3) и собирают полученный элюат. При этом создают небольшое разрежение, чтобы скорость элюирования достигала от 1 до 2 капель в секунду. Картридж снова промывают 5 см3 экстракционной смеси (4.4) и также собирают элюат.
25 мм3 смеси растворов внутренних стандартов токсинов (4.22) добавляют к объединенным элюа-там и высушивают до сухого состояния в атмосфере азота (4,6) в системе для упаривания (5.12) (30 мин при 45 °С и давлении газа 68 947,6 Па).
Остаток повторно растворяют в 500 мкл смеси растворителей (4.3), энергично встряхивая на лабораторном шейкере в течение 60 с (5.4). При необходимости выполняют процедуру в течение 5 мин в ультразвуковой ванне (5.3) при комнатной температуре. Для удаления имеющихся микрочастиц раствор фильтруют через шприцевой фильтр (5.8) или центробежный фильтр (0,45 мкм, 0.5 см3) при минимуме 10 000 g и получают пробу для ввода.
При необходимости допускается прервать очистку образца. Экстракты образцов (сгущенные до сухого состояния) хранятся без потери аналита в течение нескольких дней при температуре 4 °С и примерно две недели при температуре минус 18 °С.
Если содержание аналитов превышает диапазон градуировки, то остаток следует растворить в смеси растворителей объемом более 500 мм3.
6.5 Определение методом ВЭЖХ-МС/МС
В зависимости от системы ВЭЖХ-МС/МС вводят пробу в объеме от 10 до 25 мм3 в соответствии
С 6.4.
Применяемую систему измерения настраивают, отмеряя нужный объем аналитов и подбирая оптимальные параметры разделения и обнаружения. В приложении Б приведены некоторые примеры хроматограмм на рисунках Б.1—Б.4. а в приложении А приведены примерные параметры.
Применяемые измерительные системы должны соответствовать требованиям, представленным в таблице 2.
|
Таблица 2 — Условия для ионов-предшественников и ионов-продуктов | ||||||||||||||||||
| ||||||||||||||||||
6.6 Идентификация
Токсины Т-2 и НТ-2 идентифицируют в результате сравнения времени удерживания основного раствора и раствора исследуемого образца.
Аналит распознают на основе не менее двух массовых переходов. Кроме того, время удерживания (пики в обоих массовых переходах) и относительная площадь двух пиков должны совпадать с аналогичными данными стандартного вещества.
7 Обработка результатов
В качестве внутреннего стандарта при количественном определении токсинов Т-2 и НТ-2 используют соответствующий внутренний стандарт, меченный изотопом. Многоточечную градуировку выполняют с помощью внутреннего стандарта, например в соответствии с таблицей 1.
Для линейной регрессии рассматривают графическую зависимость отношения площади пиков всех аналитов и отношения соответствующей концентрации. Массовую концентрацию каждого токсина в пробе получают из линейной регрессии, выраженной в нг/мл. по уравнению
_ я Ра 1.
А ~ acal _ + Dcal>
ЛВЭ Рвэ
(1)
где Аа — площадь пика аналита в градуировочном растворе (4.23);
Авэ — площадь пика внутреннего стандарта в градуировочном растворе (4.23);
А^ — наклон калибровочной прямой, определяемой градуировочными растворами (4.23): ра — концентрации массы аналитов в градуировочных растворах (4.23). нг/см3; рвэ — концентрация внутреннего стандарта в градуировочном растворе (4.23). равная 50 нг/см3; Ьса1 — точка пересечения градуировочных прямых, определяемая градуировочными растворами (4 23).
Концентрацию массы аналита в растворе образца р|, нг/см3. вычисляют по формуле
Р*е =&
-ь.
'cal
аса)
Рвэ.
(2)
где AJ — площадь (аналитический сигнал) аналита в исследуемом растворе образца:
А|э — площадь (аналитический сигнал) внутреннего стандарта 8 исследуемом растворе образца; р|э — концентрация массы внутреннего стандарта в исследуемом растворе образца, 50 нг/см3. Массовую долю аналита wa. мкг/кг, вычисляют по формуле