ГОСТ Р 58357-2019
Средства лекарственные биологические для ветеринарного применения. Выявление и идентификация возбудителя болезни Марека методом полимеразной цепной реакции
Купить ГОСТ Р 58357-2019 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на биологические лекарственные средства для ветеринарного применения - живые вакцины для птиц и устанавливает метод выявления и идентификации вируса болезни Марека на основе полимеразной цепной реакции (ПЦР). Настоящий метод также может быть применен для анализа сывороток крови и культур клеток птиц на контаминацию вирусом болезни Марека.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Условия выполнения испытаний и требования безопасности
5 Оборудование, материалы и реагенты
6 Сущность метода
7 Отбор, транспортирование и подготовка проб
8 Экстракция ДНК
9 Постановка полимеразной цепной реакции и проведение амплификации с гибридизационно-флюоресцентной детекцией в режиме реального времени
Библиография
| Дата введения | 01.07.2019 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел Электроэнергия
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 21.02.2019 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 54-ст |
|---|---|---|---|
| Разработан | ФГБНУ ВГНКИ | ||
| Издан | Стандартинформ | 2019 г. |
Medicine biological remedies for veterinary use. Detection and identification of the causative agent of Marek's disease by means of polymerase chain reaction
- ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
- ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
- ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
- ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ 26678-85 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
- ГОСТ 28311-89 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
- ГОСТ Р 52682-2006 Средства лекарственные для ветеринарного применения. Термины и определения
- ГОСТ Р 52833-2007 Микробиология пищевой продукции и кормов для животных. Метод полимеразной цепной реакции (ПЦР) для определения патогенных микроорганизмов. Общие требования и определения
- СП 1.3.2322-08 Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней
- МУ 1.3.2569-09 Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности
- ГОСТ Р 12.1.019-2009 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ ИСО/МЭК 17025-2009Общие требования к компетентности испытательных и калибровочных лабораторий. Заменен на ГОСТ ISO/IEC 17025-2019.- ГОСТ 31719-2012 Продукты пищевые и корма. Экспресс-метод определения сырьевого состава (молекулярный)
- ГОСТ 31929-2013 Средства лекарственные для ветеринарного применения. Правила приемки, методы отбора проб
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9
стр. 10

стр. 11

стр. 12

стр. 13

стр. 14
ГОСТР
58357—
2019
ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
СРЕДСТВА ЛЕКАРСТВЕННЫЕ БИОЛОГИЧЕСКИЕ ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ
Выявление и идентификация возбудителя болезни Марека методом полимеразной цепной реакции
ШЁ
Издание официальное
Москва
Стандартмнформ
2019
Предисловие
1 РАЗРАБОТАН Федеральным государственным бюджетным учреждением «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 454 «Охрана жизни и здоровья животных и ветеринарно-санитарная безопасность продуктов животного происхождения и кормов»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 21 февраля 2019 г. № 54-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
©Стандартинформ. оформление. 2019
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
и
9.4.7 Появление любого значения порогового цикла Ct в таблице результатов для ОКО на канале FAM/Green и JOE/Yellow и/или для отрицательного контроля ПЦР на любом из каналов свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа по всем пробам считаются недействительными. Требуется повторить ПЦР-исследование всех проб, начиная с этапа экстракции ДНК, а также предпринять меры по выявлению и ликвидации источника контаминации.
9.4.8 Образец считают положительным на наличие ДНК вируса болезни Марека 2-го серотипа, если значение порогового цикла Ct на канале Cy5/Red менее 37.
9.4.9 Образец считают положительным на наличие ДНК вируса болезни Марека 3-го серотипа, если значение Ct на канале ROX/Orange менее 37.
9.4.10 Образец считают отрицательным, если по каналам Cy5/Red и ROX/Orange для него значение Ct отсутствует.
9.4.11 Появление любого значения Ct в таблице результатов для ОКО на каналах Cy5/Red и ROX/Orange и для отрицательного контроля ПЦР на любом из каналов свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа по всем пробам считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
9.4.12 Отсутствие положительного сигнала в пробе с положительным контролем ПЦР может свидетельствовать о неправильно выбранной программе амплификации и о других ошибках, допущенных на этапе постановки ПЦР. В таком случае необходимо провести ПЦР повторно.
Библиография
(1J Методические указания МУ 1.3.2569—09
[2] Санитарно-эпидемиологические правила СП 1.3.2322—08
Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I—IV групп патогенности
Безопасность работы с микроорганизмами III—IV групп патогенности (опасности) и возбудителями паразитарных болезней
УДК 619:615.371.57.088:006.354 ОКС 11.220
Ключевые слова: биологические лекарственные средства для ветеринарного применения, живые вакцины для птиц, культуры клеток, болезнь Марека, экстракция ДНК, полимеразная цепная реакция (ПЦР)
Редактор Л И Нахимова Технический редактор В Н. Прусакова Корректор Е Р Ароян Компьютерная верстка Ю В Поповой
Сдано в набор 25 02 2019 Подписано в печать 22 03 2019 Формат 60 * 84'/g Гарнитура Ариал,
Уел печ. л 1.86 УЧ-иэдл.1.70
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
ИД «Юриспруденция». 115419. Москва, ул Орджоникидзе. 11. www.jurisizdat ru y-book@mail.ru
Создано в единичном исполнении ФГУП «СТАНДАРТИНФОРМ» для комплектования Федерального информационного фонда стандартов. 117418 Москва. Нахимовский пр-т. д 31. к 2 www goslinfo ru info@gostinfo ru
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Термины и определения...............................................................2
4 Условия выполнения испытаний и требования безопасности.................................2
5 Оборудование, материалы и реагенты...................................................3
6 Сущность метода.....................................................................4
7 Отбор, транспортирование и подготовка проб.............................................4
8 Экстракция ДНК......................................................................5
9 Постановка полимеразной цепной реакции и проведение амплификации
с гибридизационно-флюоресцентной детекцией в режиме реального времени..................5
Библиография.........................................................................9
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИСРЕДСТВА ЛЕКАРСТВЕННЫЕ БИОЛОГИЧЕСКИЕ ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯВыявление и идентификация возбудителя болезни Марека методом полимеразной цепной реакции
Выявление и идентификация возбудителя болезни Марека методом полимеразной цепной реакции
Medicine biological remedies for veterinary use Detection and identification of the causative agent of Marek's disease by means of polymerase chain reaction
Дата введения — 2019—07—01
1 Область применения
Настоящий стандарт распространяется на биологические лекарственные средства для ветеринарного применения — живые вакцины для птиц и устанавливает метод выявления и идентификации вируса болезни Марека на основе полимеразной цепной реакции (ПЦР).
Настоящий метод также может быть применен для анализа сывороток крови и культур клеток птиц на контаминацию вирусом болезни Марека.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 12.1.004 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007 Система стандартов безопасности труда. Вредные вещества Классификация и общие требования безопасности
ГОСТ 12.4.009 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ ИСО/МЭК 17025 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 26678 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
ГОСТ 28311 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
ГОСТ 31719 Продукты пищевые и корма. Экспресс-метод определения сырьевого состава (молекулярный)
ГОСТ 31929 Средства лекарственные для ветеринарного применения. Правила приемки, методы отбора проб
ГОСТ Р 12.1.019 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ Р 52682 Средства лекарственные для ветеринарного применения. Термины и определения
Издание официальное
ГОСТ Р 52833 (ИСО 22174:2005) Микробиология пищевой продукции и кормов для животных. Метод полимеразной цепной реакции (ПЦР) для определения патогенных микроорганизмов. Общие требования и определения
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений Если изменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
3.1 В настоящем стандарте применены термины по ГОСТ Р 52682. ГОСТ Р 52833 и ГОСТ 31719, а также следующий термин с соответствующим определением:
3.1.1 Гэд-полимераза: Фермент, участвующий в процессе построения цепей нуклеиновых кислот из нуклеотидов.
3.2 В настоящем стандарте использованы следующие сокращения:
ВКО — эндогенный неконкурентный внутренний контрольный образец:
ДНК — дезоксирибонуклеиновая кислота;
дНТФ — раствор, содержащий дезоксиаденозин-трифосфат (дАТФ), дезоксицитозинтрифос-фат (дЦТФ), дезоксигуанидинтрифосфат (дГТФ), дезокситимидинтрифосфат (дТТФ);
ОКО — отрицательный контрольный образец этапа экстракции;
ПКО Марек — положительный контрольный образец, содержащий генно-инженерные конструкции на основе плазмиды, несущей участок гена-мишени вируса болезни Марека 1-го серотипа, и плазмиды, несущей участок гена-мишени внутреннего эндогенного контроля (фрагмента генома курицы);
ПКО Марек 2/3 — положительный контрольный образец, содержащий генно-инженерные конструкции на основе плазмиды, несущей участок гена-мишени вируса болезни Марека 2-го серотипа, и плазмиды, несущей участок гена-мишени вируса болезни Марека 3-го серотипа;
ПЦР — полимеразная цепная реакция;
РНК — рибонуклеиновая кислота.
4 Условия выполнения испытаний и требования безопасности
4.1 Условия выполнения испытаний
4.1.1 Общие требования к помещениям — по методическим указаниям (1), ГОСТ Р 52833.
4.1.2 Требования к персоналу — по ГОСТ Р 52833. ГОСТ ИСО/МЭК 17025.
4.1.3 Персонал должен владеть правилами работы в лаборатории, использующей методы амплификации ДНК, знать санитарно-гигиенические нормы, правила охраны труда, пожарной безопасности и электробезопасности.
4.2 Требования безопасности
4.2.1 При выполнении всех работ необходимо соблюдать требования техники безопасности при работе с химическими реактивами в соответствии с ГОСТ 12.1.007.
4.2.2 Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных ГОСТ 12.1.005.
4.2.3 При работе с электроустановками требования безопасности должны соответствовать ГОСТ Р 12.1.019.
4.2.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и должно быть оснащено средствами пожаротушения по ГОСТ 12.4.009.
4.2.5 При выполнении работ необходимо соблюдать требования [1) и (21.
5 Оборудование, материалы и реагенты
5.1 Требования к оборудованию — по ГОСТ ИСО/МЭК 17025.
5.2 Для проведения испытаний применяют следующее средства измерений и оборудование:
- набор одноканальных лабораторных дозаторов по ГОСТ 28311 с варьируемыми объемами доз: 0.5—10. 2—20. 5—40. 5-50.10—100. 20—200. 40—200.100—1000. 200—1000 мм3;
- боксы ламинарные с вертикальным потоком воздуха II класса защиты типа А;
- амплификатор для реакции амплификации и гибридизационно-флуоресцентной детекции продуктов ПЦР:
- термостат твердотельный диапазоном температур от 25 до 100 °С для микропробирок вместимостью 1,5 см3;
- отсасыватель вакуумный медицинский с колбой-ловушкой;
- микроцентрифуги с угловым ротором для микропробирок вместимостью 1.5 с#и3. со скоростью вращения до 13 000 об/мин. с максимальным ускорением 21 100 д;
- микроцентрифуги и миницентрифуги-встряхиватели с роторами для микропробирок вместимостью 0.2. 0.6. 1.5 см3, со скоростью вращения не менее 2400 об/мин и максимальным ускорением до 700 д;
- холодильник бытовой электрический по ГОСТ 26678. обеспечивающий поддержание температуры от 2 до 8 °С. с морозильной камерой, обеспечивающей поддержание температуры не выше минус 16 °С.
5.3 Для проведения испытаний применяют следующие реактивы:
- комплект реагентов для выделения РНК/ДНК;
- растворы прямого и обратного ПЦР олигонуклеотидных праймеров молярной концентрации 5 ммоль/дм3 и с чистотой специфического олигонуклеотида не менее 98 %, позволяющие амллифици-ровать фрагмент гена meq вируса болезни Марека 1-го серотипа:
Праймер 1: MeqF 5,-GGA-GCC-GGA-GAG-GCT-TTA-TG-3•;
Праймер 2: MeqR S’-ATC-TGG-CCC-GAA-TAC-AAG-GAA-S’;
- раствор меченного флуоресцентным красителем FAM олигонуклеотидного зонда молярной концентрации 3 ммоль/дм3 и с чистотой специфического олигонуклеотида не менее 98 %, позволяющий детектировать фрагмент гена meq вируса болезни Марека 1-го серотипа:
Зонд Meq S'-FAM-CGT-CU-ACC-GAG-GAT-CCC-GAA-CAG-G-BHQI-S’;
- растворы прямого и обратного ПЦР олигонуклеотидных праймеров молярной концентрации 5 ммоль/дм3 и с чистотой специфического олигонуклеотида не менее 98 %, позволяющие амллифици-ровать фрагмент генома UL42 вируса болезни Марека 2-го серотипа:
Праймер 3: MDV2F 5'-AGC-ATG-CGG-GAA-GAA-AAG-AG-3';
Праймер 4: MDV2R 5■-GAA-AGG-TTT-TCC-GCT-CCC-ATA-3•;
- раствор меченного флуоресцентным красителем Су5 олигонуклеотидного зонда молярной концентрации 3 ммоль/дм3 и с чистотой специфического олигонуклеотида не менее 98 %, позволяющий детектировать фрагмент генома UL42 вируса болезни Марека 2-го серотипа:
Зонд MDV2 5'-Cy5-CGC-CCG-TAA-TGC-ACC-CGT-GAC-T-BHQ-3-3’;
- растворы прямого и обратного ПЦР олигонуклеотидных праймеров молярной концентрации 5 ммоль/дм3 и с чистотой специфического олигонуклеотида не менее 98 %, позволяющие амллифици-ровать фрагмент гена sorfl вируса герпеса индеек (3-й серотип вируса болезни Марека):
Праймер 5: MDV3F 5*-GGC-AGA-CAC-CGC-GTT-GTA-T-3';
Праймер 6: MDV3R S’-TGT-CCA-CGC-TCG-AGA-CTA-TCC-S*;
- раствор меченного флуоресцентным красителем ROX олигонуклеотидного зонда молярной концентрации 3 ммоль/дм3 и с чистотой специфического олигонуклеотида не менее 98 %, позволяющий детектировать фрагмент гена sorfl вируса герпеса индеек (3-й серотип вируса болезни Марека):
Зонд 5'-MDV3 ROX-AAC-CCG-GGC-TTG-TGG-ACG-TCT-TC-BHQ-2-3’;
- растворы прямого и обратного ПЦР олигонуклеотидных праймеров молярной концентрации 5 ммоль/дм3 и с чистотой специфического олигонуклеотида не менее 98 %, позволяющие амллифици-ровать фрагмент гена «2 (VI) коллагена курицы:
Праймер 7: ChicF 5•-GGG-AAC-TGG-AGA-ACC-CAA-m-T-3,;
Праймер 8: ChicR 5•-CG-TGC-CGC-TGT-CTC-TAC-CAT-3,;
- раствор меченного флуоресцентным красителем ROX олигонуклеотидного зонда молярной концентрации 3 ммоль/дм3 и с чистотой специфического олигонуклеотида не менее 98 %, позволяющий детектировать фрагмент гена а2 (VI) коллагена курицы:
Зонд Chic 5'-R6G-CCC-TTA-ACT-GAG-TTC-CCC-AGC-TAC-TGC-AG-BHQ1 -3';
- ПЦР-буфер для полимеразы, содержащий магния сульфат MgS04 молярной концентрации 10.7 ммоль/дм3; Трис-HCI молярной концентрации 243 ммоль/дм3 с pH 8.3; аммония сульфат (NH4)2S04 молярной концентрации 60 ммоль/дм3; раствор «Твин-20» 0.036%-ный; глицерина раствор 28,5%-ный. азид натрия 0.05%-ный. бычий сывороточный альбумин 0,36 мг/см3;
- раствор десятикратный дНТФ, содержащий натриевые соли дНТФ со степенью очистки более 98 % и концентрацией каждого 1.76 моль/дм3, pH 7.5;
- TaqF ДНК-полимеразу. химически модифицированную, термостабильную;
- 0,9%-ный стерильный изотонический раствор хлорида натрия;
- воду дистиллированную по ГОСТ 6709;
- воду деионизированную класса чистоты I. свободную от рибонуклеаз, дезоксирибонуклеаз, неорганических и органических примесей с удельным сопротивлением не менее 18 мОм/см;
ПКО Марек — положительный контрольный образец, содержащий ДНК плазмиды, несущей участок гена-мишени вируса болезни Марека 1-го серотипа, и плазмиды, несущей участок гена-мишени внутреннего эндогенного контроля (фрагмента генома курицы);
ПКО Марек 2/3 — положительный контрольный образец, содержащий ДНК плазмиды, несущей участок гена-мишени вируса болезни Марека 2-го серотипа, и плазмиды, несущей участок гена-мишени вируса болезни Марека 3-го серотипа.
5.4 Допускается использование других материалов и оборудования с сопоставимыми техническими и метрологическими характеристиками.
5.5 В случае если вакцина изготовлена без использования куриных эмбрионов или культуры клеток кур, для предотвращения ложноотрицательных результатов и оценки эффективности всех этапов исследования рекомендуется дополнительно использовать ПЦР тест-системы, включающие экзогенный неконкурентный внутренний контроль.
5.6 При испытании сывороток крови и культур клеток птиц, не относящихся к виду Gallus gallus (домашняя курица), рекомендуется дополнительно использовать ПЦР тест-системы, включающие экзогенный неконкурентный внутренний контроль.
6 Сущность метода
6.1 Метод обнаружения вируса болезни Марека основан на экстракции ДНК. проведении амплификации фрагмента генома вируса болезни Марека и детекции продуктов амплификации, которая осуществляется в режиме реального времени с использованием принципа выщепления флуоресцентной метки на 5’ конце олигонуклеотидного зонда.
6.1.1 Метод идентификации вируса болезни Марека 1-го серотипа основан на амплификации ДНК вируса и ДНК эндогенного внутреннего контрольного образца (ВКО) (ДНК курицы) в мультиплексной полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме «реального времени».
6.1.2 Метод идентификации 2-го и 3-го серотипов вируса болезни Марека позволяет специфически амплифицировать фрагмент ДНК вируса болезни Марека 2-го и 3-го серотипов в мультиплексной полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме «реального времени».
7 Отбор, транспортирование и подготовка проб
7.1 При отборе проб, а также при их подготовке для исследования соблюдают меры, предупреждающие обсеменение объектов внешней среды.
7.2 Отбор проб проводят по ГОСТ 31929.
7.3 Отобранная лабораторная проба должна быть репрезентативной.
7.4 Транспортирование проб осуществляют при температуре, рекомендованной для хранения производителем.
7.5 Сыворотки, культуры клеток и жидкие вакцины используют для выделения ДНК без предварительной подготовки, а пробы сухих вакцин готовят следующим образом: в ампулы (флаконы) с сухой вакциной вносят 0.9%-ный изотонический раствор хлорида натрия или дистиллированную воду по ГОСТ 6709 в обьеме. соответствующем объему вакцины до высушивания. После этого содержимое ампул (флаконов) осторожно взбалтывают и отбирают 1 см3 пробы в одноразовую микропробирку вместимостью 1.5 см3.
8 Экстракция ДНК
8.1 Раствор для лизиса комплекта реагентов для выделения РНК/ДНК (если он хранился при температуре от 2 до 8 X) прогревают при температуре 60—65 X до полного растворения кристаллов.
8.2 Готовят необходимое количество одноразовых пробирок вместимостью 1.5 см3 с плотно закрывающимися крышками (включая отрицательный контроль выделения), содержащих 300 мм3 раствора для лизиса. Маркируют пробирки.
8.3 В пробирки с раствором для лизиса вносят по 50—100 мм3 исследуемых проб, используя наконечники с аэрозольным барьером. В пробирку отрицательного контроля экстракции вносят 100 мм3 0,9%-ного изотонического раствора хлорида натрия.
8.4 Содержимое пробирок тщательно перемешивают на микроцентрифуге-встряхивателе и прогревают в термостате 5 мин при температуре 65 X.
8.5 Добавляют в пробирки по 400 мм3 раствора для преципитации, перемешивают на микроцентрифуге-встряхивателе.
8.6 Центрифугируют пробирки на микроцентрифуге в течение 5 мин при скорости вращения 13 тыс. об/мин.
8.7 Аккуратно отбирают надосадочную жидкость, не задевая осадок, используя вакуумный отса-сыватель с колбой-ловушкой и отдельный наконечник вместимостью 200 мм3 для каждой пробы.
8.8 Добавляют в пробирки по 500 мм3 раствора для отмывки 3. плотно закрывают крышки, осторожно промывают осадок, переворачивая пробирки 3—5 раз.
8.9 Центрифугируют пробирки при скорости вращения 13 тыс. об/мин в течение 1—2 мин на микроцентрифуге.
8.10 Осторожно, не захватывая осадок, отбирают надосадочную жидкость, используя вакуумный отсасыватель с колбой-ловушкой и отдельный наконечник вместимостью 200 мм3 для каждой пробы.
8.11 Добавляют в пробирки по 200 мм3 раствора для отмывки 4. плотно закрывают крышки и осторожно промывают осадок, переворачивая пробирки 3—5 раз.
8.12 Центрифугируют пробирки при скорости вращения 13 тыс. об/мин в течение 1—2 мин на микроцентрифуге.
8.13 Осторожно, не захватывая осадок, отбирают надосадочную жидкость, используя вакуумный отсасыватель с колбой-ловушкой и отдельный наконечник для каждой пробы.
8.14 Помещают пробирки в термостат при температуре 65 °С на 5 мин для подсушивания осадка (при этом крышки пробирок должны быть открыты).
8.15 Добавляют в пробирки по 50 мм3 РНК-буфера. Перемешивают на микроцентрифуге-встряхивателе. Помещают в термостат при температуре 65 X на 5 мин. периодически встряхивая на микроцентрифуге-встряхивателе.
8.16 Центрифугируют пробирки при скорости вращения 13 тыс. об/мин в течение 1 мин на микро-центрифуге. Надосадочная жидкость содержит очищенную ДНК. Пробы готовы к постановке ПЦР
9 Постановка полимеразной цепной реакции и проведение амплификации с гибридизационно-флюоресцентной детекцией в режиме реального времени9.1 Приготовление реакционной ПЦР-смеси
Для приготовления реакционной ПЦР-смеси для выявления вируса болезни Марека 1-го серотипа смешивают в отдельной пробирке вместимостью 1.5 см3 (из расчета на каждую реакцию):
- 1 мм3 деионизованной воды:
- 1 мм3 праймера MeqF;
- 1 мм3 праймера MeqR;
- 1 мм3 праймера ChicF;
- 1 мм3 праймера ChicR;
- 1 мм3 зонда Chic;
- 1 мм3 зонда Meq;
- 3 мм3 раствора дНТФ по 5.3.
Срок хранения готовой ПЦР-смеси при температуре не выше минус 18 °С — не более 12 мес.
Для приготовления реакционной ПЦР-смеси для выявления вируса болезни Марека 2-го и 3-го серотипов смешивают в отдельной пробирке вместимостью 1,5 см3 (из расчета на каждую реакцию):
- 1 мм3 деионизованной воды;
- 1 мм3 праймера MDV2F;
- 1 мм3 праймера MDV2R;
- 1 мм3 праймера MDV3F;
- 1 мм3 праймера MDV3R;
- 1 мм3 зонда MDV2;
- 1 мм3 зонда MDV3;
- 3 мм3 раствора дНТФ по 5.3.
Срок хранения готовой ПЦР-смеси при температуре не выше минус 18 °С — не более 12 мес.
9.2 Подготовка пробирок для амплификации
9.2.1 Пробирку с реакционной ПЦР-смесью размораживают, перемешивают на микроцентрифуге-встряхивателе и сбрасывают капли кратковременным центрифугированием.
9.2.2 Смешивают в отдельной пробирке реакционную ПЦР-смесь. ПЦР-буфер. полимеразу TaqF (из расчета на каждую реакцию):
- 10 мм3 ПЦР-смеси:
- 5 мм3 ПЦР-буфера;
- 0.5 мм3 полимеразы TaqF.
9.2.3 Перемешивают смесь на микроцентрифуге-встряхивателе. осаждают кратковременным центрифугированием и вносят no 15 мм3 в пробирки вместимостью 0.2 см3.
9.2.4 Используя наконечник с фильтром, в подготовленные пробирки добавляют по 10 мм3 ДНК, полученных в результате экстракции из исследуемых или контрольных образцов.
9.2.5 Ставят контрольные реакции амплификации:
а) отрицательный контроль ПЦР — вместо ДНК-лробы вносят в пробирку 10 мм3 деионизированной воды;
б) положительный контроль ПЦР — вносят в пробирку 10 мм3 ПКО Марек или ПКО Марек 2/3.
9.2.6 Содержимое пробирок перемешивают на микроцентрифуге-встряхивателе. После этого собирают осаждением капли ПЦР-смеси со стенок пробирок путем центрифугирования на микроцентрифуге-встряхивателе в течение от 1—3 с и помещают в амллификатор для проведения амплификации.
9.3 Проведение амплификации и детекции флюоресцентного сигнала
9.3.1 Амплификацию проводят согласно программе, указанной в таблице 1.
|
Таблица 1 — Программа амплификации фрагментов ДНК | ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
|
Примечание — Использование амплификаторов различных моделей может потребовать изменения времени каждого шага и/или изменения температуры отжига праймеров на 1—2 °С. | ||||||||||||||||||||||||||||||||||||||||||
9.3.2 Флюоресценцию для определения наличия вируса болезни Марека измеряют при температуре 60 °С на запрограммированных на приборе каналах FAM/Green. JOE/Yellow (для выявления вируса болезни Марека 1-го серотипа и эндогенного ВКО) и ROX/Orange, Cy5/Red (для выявления вируса болезни Марека 2-го и 3-го серотипов) согласно инструкции по эксплуатации.
9.4 Анализ результатов амплификации
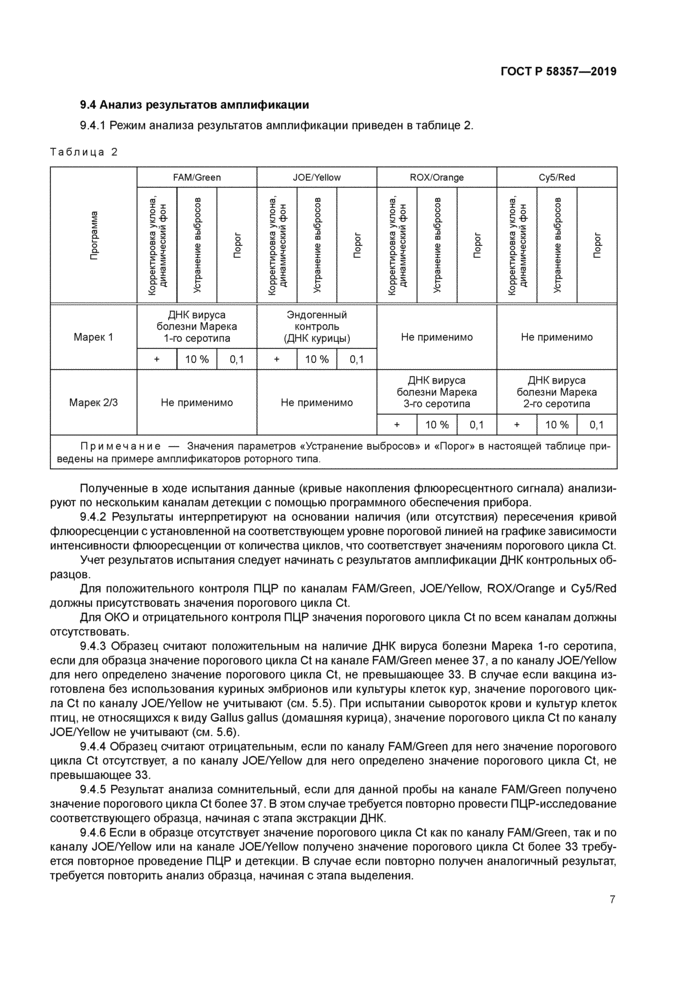
9.4.1 Режим анализа результатов амплификации приведен в таблице 2.
|
Таблица 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Полученные в ходе испытания данные (кривые накопления флюоресцентного сигнала) анализируют по нескольким каналам детекции с помощью программного обеспечения прибора.
9.4.2 Результаты интерпретируют на основании наличия (или отсутствия) пересечения кривой флюоресценции с установленной на соответствующем уровне пороговой линией на графике зависимости интенсивности флюоресценции от количества циклов, что соответствует значениям порогового цикла Ct.
Учет результатов испытания следует начинать с результатов амплификации ДНК контрольных образцов.
Для положительного контроля ПЦР по каналам FAM/Green, JOE/Yellow, ROX/Orange и Cy5/Red должны присутствовать значения порогового цикла Ct.
Для ОКО и отрицательного контроля ПЦР значения порогового цикла Ct по всем каналам должны отсутствовать.
9.4.3 Образец считают положительным на наличие ДНК вируса болезни Марека 1-го серотипа, если для образца значение порогового цикла Ct на канале FAM/Green менее 37. а по каналу JOE/Yellow для него определено значение порогового цикла Ct. не превышающее 33. В случае если вакцина изготовлена без использования куриных эмбрионов или культуры клеток кур. значение порогового цикла Ct по каналу JOE/Yellow не учитывают (см. 5.5). При испытании сывороток крови и культур клеток птиц, не относящихся к виду Gallusgallus (домашняя курица), значение порогового цикла Ct по каналу JOE/Yellow не учитывают (см. 5.6).
9.4.4 Образец считают отрицательным, если по каналу FAM/Green для него значение порогового цикла Ct отсутствует, а по каналу JOE/Yellow для него определено значение порогового цикла Ct. не превышающее 33.
9.4.5 Результат анализа сомнительный, если для данной пробы на канале FAM/Green получено значение порогового цикла Ct более 37 В этом случае требуется повторно провести ПЦР-исследование соответствующего образца, начиная с этапа экстракции ДНК.
9.4.6 Если в образце отсутствует значение порогового цикла Ct как по каналу FAM/Green, так и по каналу JOE/Yellow или на канале JOE/Yellow получено значение порогового цикла Ct более 33 требуется повторное проведение ПЦР и детекции. В случае если повторно получен аналогичный результат, требуется повторить анализ образца, начиная с этапа выделения.