ГОСТ Р 55357-2012
Форматы описания и нормирования требований. Система информации о показателях и требованиях к медицинской технике
Купить ГОСТ Р 55357-2012 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Является одним из комплекса стандартов на форматы описания и нормирования требований (ФОНТ). Комплекс стандартов ФОНТ создается для нормативно-методического обеспечения разработки технических регламентов и стандартов в различных областях промышленности и экономики, а также для информационного обеспечения и более широкого применения менеджмента знаний и проектного менеджмента, включая процедуры надлежащей (добросовестной) практики, в том числе в государственном секторе.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Общие положения
5 Требования и показатели
6 Достижение регулирующего сотрудничества
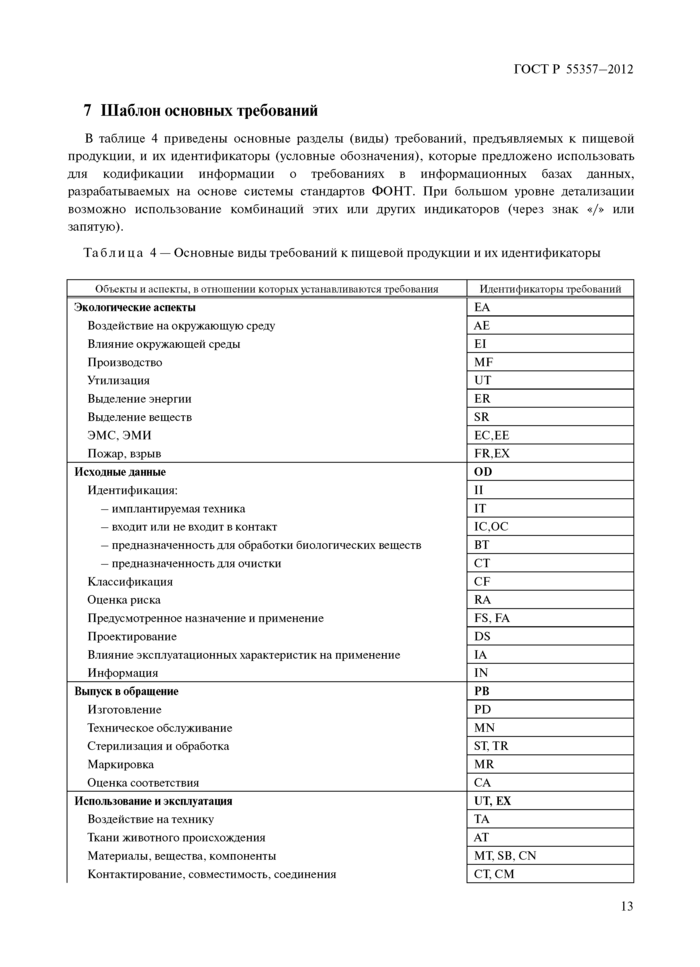
7 Шаблон основных требований
8 Примеры отнесения требований
| Дата введения | 01.01.2014 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 29.11.2012 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1726-ст |
|---|---|---|---|
| Разработан | ТК 100 Стратегический и инновационный менеджмент | ||
| Издан | Стандартинформ | 2016 г. |
Descriptive and normative requirement formats. Information system on indicators and requirements for medical technics
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10
стр. 11

стр. 12
стр. 13

стр. 14
стр. 15

стр. 16

стр. 17
стр. 18
стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ГОСТР
55357-
2012
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ФОРМАТЫ ОПИСАНИЯ И НОРМИРОВАНИЯ ТРЕБОВАНИЙСистема информации о показателях и требованиях к медицинской технике
Издание официальное
Москва
Стандартинформ
2016
ГОСТ P 55357-2012
1I редисловие
1 РАЗРАБОТАН АНО «Международная академия менеджмента и качества бизнеса*
2 ВНЕСЕН Техническим комитетом но стандартизации ТК 100 «Стратегический и инновационный менеджмент»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 г. № 1726-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменении и поправок — в ежемесячно и здаваемых иш)юрмационных указателях * Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе •Национальные стандарты». Соответствующая информация, уведомление и тексты ра змещаются также в информационной системе общего ноль зова ни я — на офи -циальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
< Стандартннформ. 2016
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии.
II
4 Общие положения
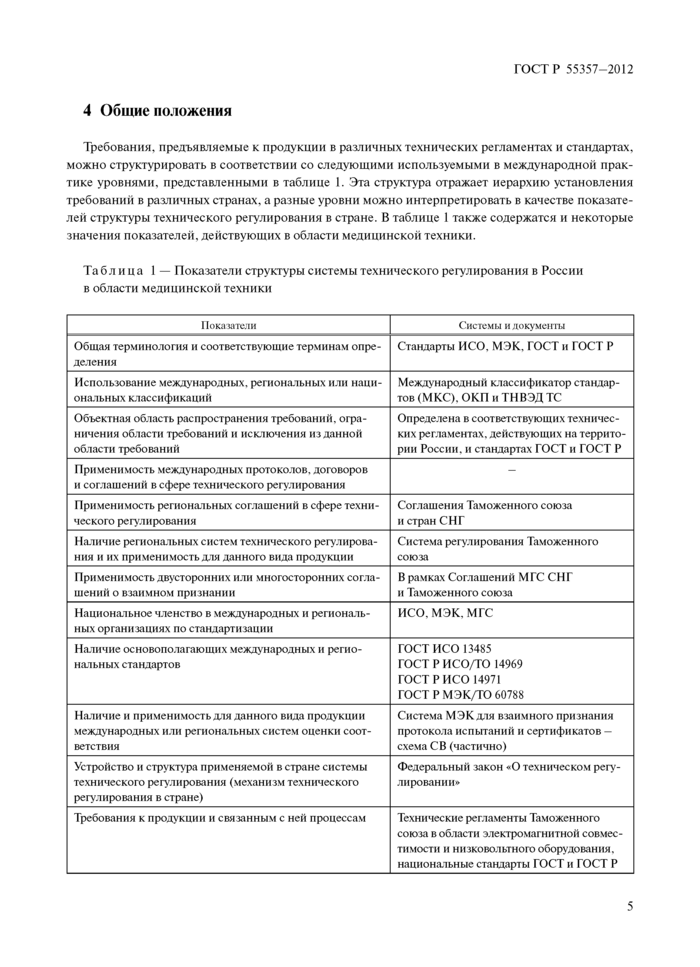
Требования, предъявляемые к продукции в различных технических регламентах и стандартах, можно структурировать в соответствии со следующими используемыми в международной практике уровнями, представленными в таблице I. Эта структура отражает иерархию установления требовании в различных странах, а разные уровни можно интерпретировать в качестве показателей структуры технического регулирования в стране. В таблице 1 также содержатся и некоторые значения показателей, действующих в области медицинской техники.
Табл ица 1 — Показатели структуры системы технического регулирования в России в области медицинской техники
|
Показатели |
Системы и докумс!пи |
|
Общая терминология и соответствующие терминам определения |
Стандарты ИСО. МЭК. ГОСТ и ГОСТ Р |
|
Испольювлиие международных, региональных или национальных классификаций |
Международный классификатор стандартов (МКС). ОКП и ТНВЭД ТС |
|
Объектная область распространения требований, ограничения области требований и исключения изданной области требований Применимость международных протоколов, договоров и соглашений в сфере технического регулирования |
Определена в соответствующих технических регламентах, действующих на территории России, и стандартах ГОСТ и ГОСТ Р |
|
Применимость региональных соглашений в сфере технического регулирования |
Соглашения Таможенного союза и стран СНГ |
|
Наличие региональных систем технического регулирования и их применимость для данного вида продукции |
Система регулирования Таможенного союза |
|
Применимость двусторонних или многосторонних соглашений о взаимном признании |
В рамках Соглашений МГС СНГ и Таможенного союза |
|
Национальное членство в международных и региональных органи зациях по стандартизации |
ИСО. МЭК. МГС |
|
Наличие основополагающих международных и региональных стандартов |
ГОСТ ИСО 13485 ГОСТ Р ИСО/ТО 14969 ГОСТР ИСО 14971 ГОСТ РМЭКДО 60788 |
|
Наличие и применимость для данного вида продукции международных или региональных систем оценки соответствия |
Система МЭК для взаимного при знания протокола испытаний и сертификатов -схема СВ (частично) |
|
Устройство и структура применяемой в стране системы технического регулирования (механизм технического регулирования в стране) |
Федеральный закон «О техническом регулировании» |
|
Требования к продукции и связанным с ней процессам |
Технические регламенты Таможенного союза в области электромагнитной совместимости и ни зковольтного оборудования, национальные стандарты ГОСТ и ГОСТ Р |
|
Окончание таблицы / | ||||
|
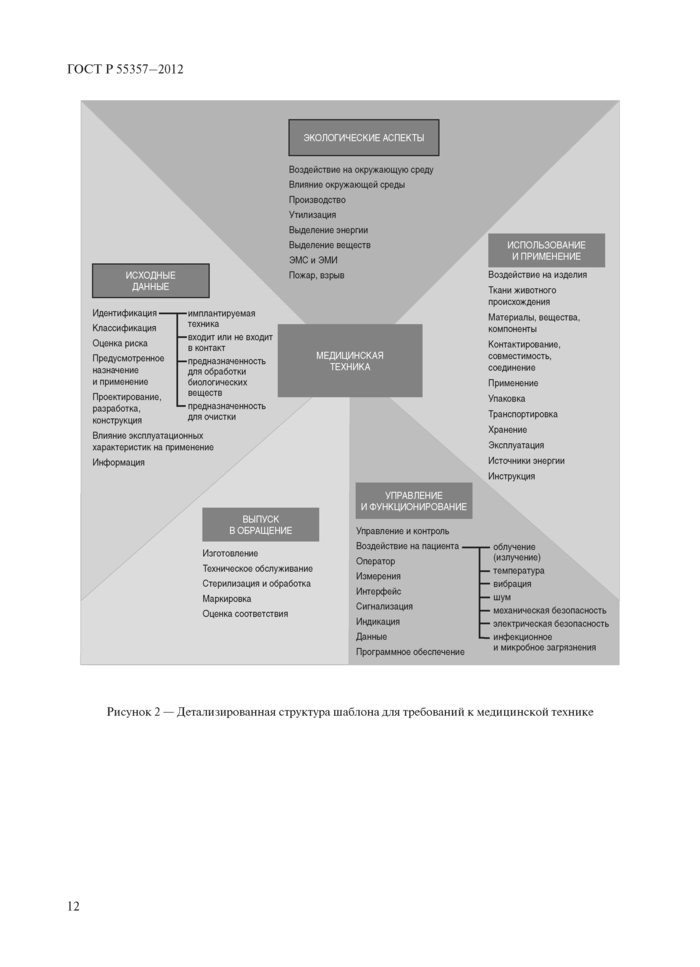
Обобщенная структура описания систем технического регулирования приведена в ГОСТ Р «Форматы описания и нормирования требований. Руководство по разработке и применению* на рисунке 2.
В настоящем стандарте на рисунке 1 представлена общая связь между элементами, характеризующими объекты регулирования, которые используются в системе описания (характеризации) требований, предъявляемых к объектам регулирования. Показатели - это элементы и параметры объектов, с помощью которых описывают их характеристики или свойства, которые могут быть измерены или оценены. Значения показателей - это количественная оценка показателей или их измеренные значения. Диапазоны показателей - это диапазоны значений, которые соответствуют разрешенным значениям или значениям, которые соответствуют установленным требованиям.
|
Рисунок 1 — Связь между элементами, характеризующими объекты регулирования |
Данное разделение требований на классы полезно в том случае, если система регулирования имеет много разноуровневых документов, устанавливающих требования к продукции, и в документах разных уровней эти требования устанавливаются не только в отношении самой продукции, но и в отношении результатов и аспектов данного воздействия. В этом случае возможны различные дальнейшие детализации требований и особенности в отношении оценки соответствия этим требованиям.
5 Требования и показатели
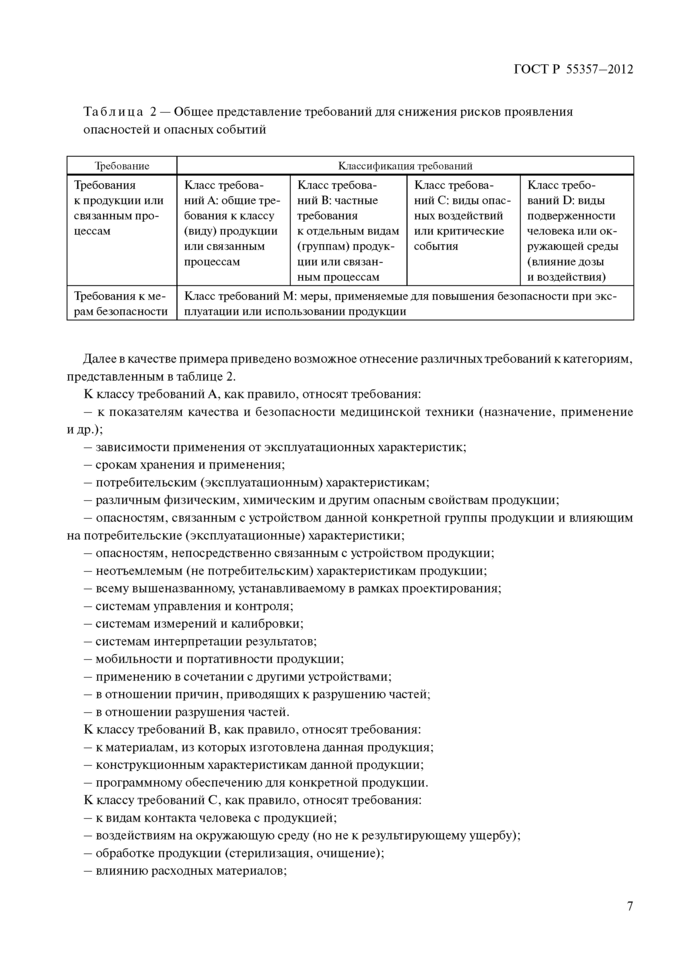
Используемое в настоящем стандарте разделение основных видов существующих требовании представлено в таблице 2.
6
|
Таблица 2 — Общее представление требований для снижения рисков проявления опасностей и опасных событий | |||||||||||||||
| |||||||||||||||
Далее в качестве примера приведено возможное отнесение различных требований к категориям, представленным в таблице 2.
К классу требовании Л, как правило, относят требования:
- к показателям качества и безопасности медицинской техники (назначение, применение
и др);
- зависимости применения от эксплуатационных характеристик;
- срокам хранения и применения;
- потребительским (эксплуатационным) характеристикам;
- различным физическим, химическим и другим опасным свойствам продукции;
- опасностям, связанным с устройством данной конкретной группы продукции и влияющим на потребительские (эксплуатационные) характеристики;
- опасностям, непосредственно связанным с устройством продукции;
- неотъемлемым (не потребительским) характеристикам продукции;
- всему вышеназванному, устанавливаемому в рамках проектирования;
- системам управления и контроля;
-системам измерений и калибровки;
-системам интерпретации результатов;
- мобильности и портативности продукции;
- применению в сочетании с другими устройствами;
- в отношении причин, приводящих к разрушению частей;
- в отношении разрушения частей.
К классу требований В. как правило, относят требования:
- к материалам, из которых изготовлена данная продукция;
- конструкционным характеристикам данной продукции;
- программному обеспечению для конкретной продукции.
К классу требований С. как правило, относят требования:
- к видам контакта человека с продукцией;
- воздействиям на окружающую среду (но не к результирующему ущербу);
- обработке продукции (стерилизация, очищение);
- влиянию расходных материалов:
7
- интерфейсам между продукцией и человеком (в плане влияния на проявление возможных негативных событий).
К классу требовании D. как правило, относят требования:
- к видам физического, химического или биологического действия на человека:
- передаче энергии пользователю или пациенту;
- вводу (выводу) вещества в организм (из организма) пользователя или пациента;
- другим видам вреда, причиняемого человеку или животным;
- вреду, наносимому окружающей среде.
К классу требовании М. как правило, относятся требования:
- к производственным процессам:
- компетенции или обучению персоната;
- влиянию управления продукцией:
- защитным ограждениям;
- маркировке и аспектам информирования;
-демонтажу и утилизации;
- пользовательскому интерфейсу (в плане инициирования действий пользователя в результате регистрации неисправностей или угроз, а также правильного применения);
- отвлекающим факторам, которые могут привести к ошибке применения:
- самому процессу и качеству проектирования:
- в отношении мер. препятствующих разлету разрушившихся частей.
Для выбора наиболее общих требований и показателей, на основе которых формируются структуры (шаблоны) требований, прежде всего необходимо определить:
- какие отношения должны существовать между требованиями, относящимися к различным классам требований:
- каким образом и какие виды требований следует выбирать для создания структур формати-зованныхтребований (шаблонов).
Ниже приведено несколько основных правил для осуществления вышеуказанного выбора.
1. Совокупность требовании должна быть максиматьно независимой. Фактически это означает, что суммарный риск должен быть равен сумме рисков по каждой группе требовании или отдельным требованиям.
2. Суммарный риск должен оцениваться как совокупность рисков, проявляющихся в виде различных воздействий на человека и окружающую среду.
3. При наличии различных требований, которые регулируют риск (безопасность) в цепи последовательных событии (схемах или сценариях), приводящих к негативному воздействию или негативным последствиям, необходимо для оценивания выбирать такие схемы или сценарии и такие требования, риск от которых (или от невыполнения которых) оценивается как максимальный.
Требования к продукции могут устанавливаться не только в отношении безопасности, но и в отношении качества продукции, которое непосредственно влияет на снижение уровня безопасности.
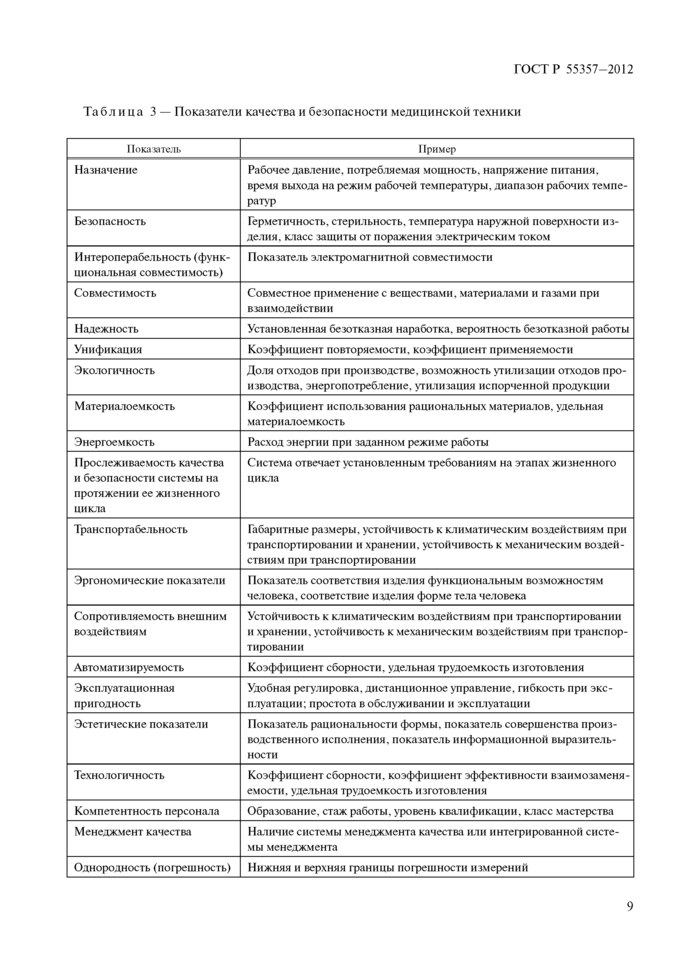
Показатели, которые рассматривают как определяющие в различной степени качество и безопасность продукции, представлены в таблице 3.
|
Табл ица 3 — Показатели качества и безопасности медицинской техники | ||||||||||||||||||||||||||||||||||||||||||
|
6 Достижение регулирующего сотрудничества
Индустрия производства медицинской техники (изделий, приборов), включающей как имплантируемые кардиостимуляторы, так и шприцы, иглы, имплантаты для замены сустава, кресла-каталки. бурно развивается и является строго регулируемой. Стандарты играют важную рать в этом процессе и в то же время удовлетворяют требованиям общественности и регулирующих органов к безопасности и соответствию назначению.
Ключевыми характеристиками этой деятельности являются:
- принятие стандартов как основного элемента в регулирующей инфраструктуре, обеспечивающей производство медицинской техники: стандарты не являются обязательными, но обеспечивают соответствие определенным регулирующим требованиям;
- участие регулирующих органов совместно с производителями медицинской техники и потребителями в процессе разработки международных стандартов;
- тесное сотрудничество между ИСО, МЭК и другими организациями в разработке стандартов в области медицинской техники.
6.1 Участники
К основным участникам относится целевая группа по глобальной гармонизации.
Целевая группа по глобальной гармонизации (Global Harmonization Task Force, GHTF; ЦГГГ) не является регулирующим органом. Она представляет собой форум национальных регулирующих органов и представителей промышленности, содействующий международной согласованности регулирующих требовании и практической деятельности. В частности, целью ЦГГГ является содействие обеспечению безопасности, эффективности, результативности и качества медицинских приборов в интересах технологического инновационного процесса и укрепления международной торговли. Она также выполняет функции форума по обмену информацией, посредством которого страны с развивающимися регулирующими системами по производству медицинских приборов могут знакомиться с опытом стран, уже имеющих функционирующие системы. Такая деятельность осуществляется через разработку руководящих документов и рекомендованных процедур, целью которых является конвергенция регулирующих систем ее членов по производству медицинских приборов в рамках их законодательных и организационных ограничений.
Участие в ЦГГГ включает работу регулирующих органов, ответственных за производство медицинских приборов, и представителей регулирующей отрасли промышленности из стран и регионов, которые имеют опыт в разработке регламентов на медицинские приборы. В состав членов ЦГГГ входят представители из Европы. США. Канады. Японии и Австралии.
6.2 ИСО и МЭК
Многие технические комитеты ИСО и МЭК активно занимаются разработкой стандартов, имеющих большое значение для регулирования медицинских приборов:
ИСО/ТК 121 «Анестезирующее и дыхательное оборудование*;
ИСО/ТК 150 «Имплантаты в хирургии»;
ИСО/ТК 194 «Биологическая оценка медицинских изделий»;
ИСО/ТК 198 «Стерилизация продукции для здравоохранения*:
Содержание
1 Область применения............................................................. 1
2 Нормативные ссылки.............................................................2
3 Термины и определения..........................................................3
4 Обшне положения...............................................................5
5 Требования и показатели..........................................................6
6 Достижение регулирующего сотрудничества........................................10
7 Шаблон основных требовании.................................................... 13
8 Примеры отнесения требований.................................................. 14
III
Введение
Поданным Всемирном торговом организации (ВТО), современная экономика несет значительные потерн из-за большого количества технических барьеров в торговле, которые возникают вследствие несоответствия систем технического регулирования различных стран мира.
Несмотря на требования Соглашения по ТБТ ВТО о максимальном устранении технических барьеров в торговле, в силу сложившейся практики и учета национальных интересов стран, условия доступа продукции на их внутренние рынки остаются во многом различными, чтосоздаетсерьезные препятствия для экспорта/импорта продукции. Кроме того, нужную информацию о требованиях, содержащихся в целом ряде документов (обязательные технические регламенты, добровольные стандарты и др.). как правило, достаточно трудно идентифицировать и получить.
Это приводит к серьезным затруднениям в работе различных участников национальных или региональных систем технического регулирования, которым по роду своих обязанностей необходимо обеспечить требуемое качество и эффективность технических регламентов, стандартов и процедур оценки соответствия. Дал ее приведены основные задачи, которые необходимо решать участникам систем технического регулирования.
При написании технических регламентов или стандартов регулирующим органам необходимо:
- оценить уровень снижения риска за счет мер. устанавливаемых в технических регламентах;
-определить, являются ли зависимыми или корректируемыми требования, включаемые в технические регламенты или стандарты:
- определить перечень стандартов, подтверждающих соответствие требованиям технических регламентов;
- определить наилучшие форматы требовании:
- определить эквивалентные форматы требований для оценки соответствия и обеспечения взаимного признания продукции.
Чтобы обеспечить безопасность продукции, производители должны:
- оценивать уровень снижения рисков, используя схемы распространения опасностей;
- повышать уровень безопасности продукции за счет использования дополнительных добровольных мер безопасности;
- доказывать соответствие своей продукции требованиям технических регламентов;
- использовать принципы эквивалентности дли оценки своих экспортных возможностей;
- разрабатывать инструкции для пользователей и обеспечивать меры зашиты.
Пользователи при применении продукции имеют право:
- принимать дополнительные меры по повышению безопасности продукции;
- получать общие сведения о возможной опасности продукции;
- доказывать в компетентных инстанциях наличие опасных свойств продукции;
- выбирать наиболее безопасные виды продукции из имеющейся на рынке, используя информацию об этой продукции, связанную с аспектами безопасности и качества;
- рекомендовать производителям, каким образом можно повысить безопасность и качество их продукции.
Органы по оценке (подтверждению) соответствия при проведении оценки соответствия продукции установленным требованиям должны:
- выбирать эквивалентные форматы оценки безопасности:
ГОСТ P 55357-2012
- выбирать эквивалентные методы оценки соответствия:
- выбирать наилучшие возможности применения стандартов с целью оценки соответствия;
- помогать производителям оценивать эквивалентность требовании в отношении экспорта продукции;
- оценивать снижение уровня риска, если это предписано техническими регламентами или применяемыми стандартами.
Органам контроля и надзора и регистрирующим органам при осуществлении своей непосредственной деятельности необходимо:
- оценивать уровни риска от использования продукции для планирования проверок:
- соотносить случаи причинения вреда с нарушениями требований технических регламентов;
- оценивать правильность предоставления информации о продукции на этикетках и в инструкциях в отношении требований технических регламентов:
- разрабатывать арбитражные методы оценки соответствия требованиям продукции;
- инициировать применение технических регламентов для снижения уровня риска.
На современном этапе развития мировой торговли создание системы, позволяющей сравнивать требования и получать информацию, является чрезвычайно актуальной задачей, которая вызывает большой интерес у производителей и потребителей продукции во всем мире.
Наличие комплекса стандартов, призванныхсоздатьсистему форматов описания и нормирования требовании (ФОНТ), особенно важно для региональных систем технического регулирования, нацеленных на упрощение процедур обращения продукции за счет максимального сокращения технических барьеров в торговле, без существенного снижения уровня безопасности выпускаемой продукции.
Для обеспечения всех заинтересованных лиц и организаций соответствующей информацией в области технического регулирования необходимо, чтобы в каждой стране или организации, заинтересованной в обмене такой информацией на основе настоящего стандарта (далее - участники), существовали информационные источники, содержащие:
- требования к конкретной продукции;
- условия доступа продукции на рынки участников;
- сведения об отличиях требований и условий доступа на рынки участников.
Для этого участники должны иметь унифицированные механизмы сбора и хранения данных и обмена информацией с целью сравнения требований.
Для того чтобы заинтересованные организации своевременно получали такую информацию, необходимо:
- поддерживать информационные ресурсы в данной области в своей стране;
- наладить прямую связь с другими аналогичными участниками;
- осуществлять взаимный обмен информацией;
- осуществлять перевод этой информации на национальный язык:
- обеспечивать доступ к этой информации всех заинтересованных пользователей, как внутренних, так и внешних;
- использовать единую или совместимую программную основу для комплекса стандартов ФОНТ.
Это позволит приблизиться к реализации принципа эквивалентности, при котором участники торговых отношений признают, что соблюдение требований к продукции, установленных
V
в различных документах, обеспечивает одинаковый результат, а именно - необходимый уровень безопасности.
Для проведения сравнения следует пользоваться шаблоном и структурировать информацию таким образом, чтобы можно было сопоставлять наличие или отсутствие конкретных требований и устанавливать их идентичность или эквивалентность.
В качестве такого шаблона может использоваться модель обеспечения безопасности для конкретного объекта регулирования (продукции или технологии).
Полученная на основе такой модели и доступная всем заинтересованным пользователям информация может применяться для оценки:
- снижения степени риска благодаря применению положений технических регламентов;
- возможности признания эквивалентности требований технических регламентов и стандартов на основе оценки уровня снижения рисков;
- эффективности применения процедур оценки соответствия;
- эффективности и планирования государственного контроля и надзора.
VI
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФОРМАТЫ ОПИСАНИЯ И НОРМИРОВАНИЯ ТРЕБОВАНИЙ Система информации о показателях и требованиях к медицинской технике
Descriptive and normative requirement formats
Information system on indicator» and requirements for medical technics
Дата введения — 2014 — 01 — 01
1 Область применения
Настоящий стандарт является одним из комплекса стандартов на форматы описания и нормирования требований (ФОНТ).
Комплекс стандартов ФОНТ создается для нормативно-методического обеспечения разработки технических регламентов и стандартов в различных областях промышленности и экономики, а также для информационного обеспечения и более широкого применения менеджмента знаний и проектного менеджмента, включая процедуры надлежащей (добросовестной) практики, в том числе в государственном секторе.
Основные цели комплекса стандартов ФОНТ заключаются в том. чтобы:
- разработать методологию и создать условия для обмена знаниями и информацией в соответствующих предметных областях;
- предложить методологию для создания информационного фонда с целью накопления знаний и технических решений в конкретных областях деятельности;
- обеспечить возможность сравнения производственных показателей при проведении сравнительных оценок (бенчмаркинга) с другими предприятиями;
- определить требуемую для этого терминологию;
- установить шаблоны для кодификации знаний и информации ©требованиях в данных предметных областях;
- создать условия для признания эквивалентности требовании рахличных технических регламентов и результатов оценки соответствия;
- содействовать проведению оценки результирующего воздействия технических регламентов и стандартов в данных предметных областях;
- обеспечить обмен данными о технических регламентах и стандартах или других документах, используемых для регулирования конкретных областей и требований.
Применение комплекса национальных стандартов ФОНТ позволит:
- определить форматы описания требований, в первую очередь касающихся аспектов безопасности и качества продукции и услуг для жизни, здоровья, имущества и окружающей среды, что расширит применение стандартов в сфере технического регулирования, обеспечивающих соблto
дение положений соответствующих технических регламентов, техническую и информационную совместимость, взаимозаменяемость продукции и процедур оценки соответствия;
- увязать требования и положения комплексов технических регламентов и стандартов;
- оценить гармонизацию или эквивалентность требований национальных технических регламентов истандартовс международными и региональными, а также национальными техническими регламентами и стандартами промышленно развитых стран.
Комплекс национальных стандартов ФОНТ создаст основу для повышения уровня консолидации и применения знаний в различных сферах экономической деятельности, в первую очередь в сфере технического регулирования, а также дзя расширения информационного обеспечения с целью устранения технических барьеров в торговле и содействия экспортным возможностям отечественной продукции.
Данный комплекс стандартов может быть использован специалистами как дтя разработки технических регламентов и стандартов на конкретные объекты технического регулирования, так и при принятии решения об идентичности или эквивалентности требований, в том числе:
- экспертами — дзя проведения экспертизы технических регламентов и стандартов;
- экспертами в области оценки соответствия — при проведении процедур оценки соответствия или принятии решения о возможности взаимного признания результатов оценки соответствия;
- государственными органами — при осуществлении надзора за рынками;
- производителями — дзя повышения качества и безопасности продукции, особенно при экспорте ее в другие страны:
- производителями или специалистами компетентных органов — при закупках продукции или услуг и проведении соответствующих тендеров.
В отношении требований к медицинской технике настоящий стандарт описывает наиболее обшие обязательные дзя применения и исполнения требования к медицинской технике или связанным с требованиями к медицинской технике процессам производства, использования, хранения. перевозки (транспортирования), редзизаиии и утилизации, атакже правила и формы оценки соответствия, правила идентификации и классификации, требования к терминологии, упаковке, маркировке или этикеткам и правилам их нанесения.
В данном стандарте не делается рахзичия в отношении применения терминов «медицинская техника» и «медицинское изделие*, несмотря на то. что понятие «медицинская техника» рассматривается на практике как менее общее, чем «медицинское изделие*, и распространяется на технические медицинские изделия, включая медицинские приборы и устройства.
2 Нормативные ссылки
Следующие нормативные доку менты содержат положения, которые со ссыл кои в данном тексте представляют собой положения настоящего стандарта. Для ссылок с твердой идентификацией, последующих изменений или пересмотров эти публикации не применяются. Однако странам или организациям, участвующим в реализации соглашений, заключенных на основе настоящего стандарта, предлагается рассмотреть возможность применения самых последних изданий нормативных документов, указанных ниже. Для ссылок со скользящей идентификацией применяется последнее издание нормативного документа.
В настоящем стандарте использованы ссылки наследующие стандарты:
ГОСТ ИСО 13485-2011 Изделия медицинские. Системы менеджмента качества. Системные требования для целен регулирования
ГОСТ ИСО 14971-2011 Изделия медицинские. Применение менеджмента риска к медицинским изделиям.
Примечание - При польювлнии настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользовании - на официальном сайте Федерального агентства по техническому регулированию и метрологии в Интернете или по ежегодно издаваемому информационному указателю -Национальные стандарты», который опубликован по состоянию на I января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный документ отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
3.1 безопасность медицинской техники (изделия): Состояние, при котором отсутствует недопустимый риск причинения вреда жизни или здоровью граждан, имуществу физических или юридических лиц. государственному или муниципальному имуществу, окружающей среде, жизни или здоровью животных, а потенциальный риск применения медицинского изделия ниже предельно допустимого риска причинения вреда при использовании в условиях, предусмотренных изготовителем.
Примечание - Безопасность медицинского изделия обеспечивается сохранением его эксплуатационных свойств.
3.2 ввод в эксплуатацию: Этап жизненного цикла, на котором изделие готово к первому применению на территории Российской Федерации в соответствии с предусмотренным назначением.
3.3 выпуск в обращение: Первая платная или бесплатная передача изделия, предназначенного не для клинических исследований, с целью распространения и/или применения на территории Российской Федерации, независимо от того, новое это изделие или модифицированное.
3.4 изготовитель: Физическое или юридическое лицо, ответственное за разработку, изготовление, упаковку и/или маркирование этого изделия, сборку системы или модификацию изделия перед выпуском на рынок под его наименованием независимо оттого, выполняются ли указанные действия самим упомянутым лицом или от его имени третьей стороной.
Примечание - И зготовителнми не являются лица, которые осущест&тяют сборку или модификацию и заели й для конкретного пациента, при условии, что такие изделия уже введены в обращение.
3.5 изделие для клинических исследований/испытаиий: Изделие, предназначенное изготовителем для проведения клинических испытании в медицинских организациях либо частнопрактикующим врачом соответствующей квалификации для проведения в надлежащей медицинской обстановке надлежащих исследований.
3.6 изделие индивидуального назначения: Изделие, изготовленное в соответствии с техническим заданием, в котором должным образом квалифицированный врач либо другое лицо с соответствующей квалификацией и полномочиями в письменном виде, под свою ответственность предъяаляет специальные требования для проектирования или изготовления.
Примечание - Такое изделие должно быть предназначено исключительно для конкретного пациента.
3
3.7 клинические исследования/исиытания: Любое разработанное и запланированное систематическое исследование с участием человека в качестве субъекта клинических испытаний, предпринятое для оценки безопасности и/илн эксплуатационных свойств конкретного медицинского изделия.
3.8 медицинская техника: Совокупность технических средств, используемых в медицине в целях профилактики, диагностики, лечения, реабилитации, проведения санитарно-гигиенических, противоэпидемических и других медицинских мероприятий, а также работ по приготовлению лекарств.
3.9 медицинские изделия: Любые инструменты, аппараты, приборы, устройства, программное обеспечение, матери&ты или иные изделия, используемые по отдельности или в сочетании между собой, включая программное обеспечение, необходимое дли их применения по назначению, и предназначенные изготовителем для человека посредством реализации их функций.
Примечание - Медицинские изделия используются с целью:
— профилактики, диагностики, наблюдения, лечении или облегчения заболеваний;
— диагностики, наблюдения, лечения, облегчения или компенсации нарушенных или утраченных физиологических функций:
— исследования, замещения или изменения анатомического строения или физиологических процессов;
— предотвращения или прерывания беременности;
— получения информации в диагностических или медицинских целях путем исследования образцов биологического материала человека.
Необходимым условием является то. что принципиальное воздействие медицинских изделий не основывается на фармакологическом, иммунологическом или метаболическом эффектах применения, но они могут способствовать введению в организм или доставке к поверхности тела человека средств, вызывающих вышеуказанные эффекты.
3.10 пользователь: Лицо, осуществляющее применение медицинского изделия в целях, установленных в пункте 1 статьи 3 настоящего стандарта.
3.11 потенциальный риск применения: Минимально возможный риск причинения вреда при применении по назначению сохранившего эксплуатационные свойства медицинского изделия, который нельзя изменить мерами по ограничению рисков.
3.12 предусмотренное назначение: Применение медицинского изделия в соответствии с информацией изготовителя, указанной на этикетке, в инструкции по применению или руководстве по эксплуатации.
3.13 принадлежности: Предметы, которые при отдельном применении не являются медицинскими изделиями, но специально предназначены изготовителем для использования совместно с ними.
3.14 серийно выпускаемое изделие: Изделие, изготовленное или подвергающееся модификации в соответствии со специфическими требованиями квалифицированного врача либо другого лица с соответствующей квалификацией и полномочиями и не являющееся изделием индивидуального назначения.
3.15 эксплуатационные свойства, характеристики: Сочетание клинической результативности изделия и его технических характеристик. Эксплуатационные свойства тесно связаны с безопасностью.