ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
(Щ)
Технологии лабораторные клинические
КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Часть 3
Описание материалов для контроля качества клинических лабораторных исследований
Издание официальное
Москва
Стандартииформ
2009
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 РАЗРАБОТАН Лабораторией проблем клинико-лабораторной диагностики Государственного образовательного учреждения высшего профессионального образования Московской медицинской академии им. И М. Сеченова Росздрава
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 466 «Медицинские технологии»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 18 декабря 2008 г. № 558-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ. 2009
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
и
ГОСТ P 53133.3—2008
Содержание
1 Область применения............................................1
2 Нормативные ссылки............................................1
3 Термины и определения..........................................2
4 Классификация и наименование контрольных материалов.......................2
5 Описание контрольных материалов....................................5
6 Маркировка................................................12
7 Сертификат................................................12
8 Вложение в упаковку...........................................13
Приложение А (справочное) Особенности приписывания значений контрольным материалам правильности для некоторых групп аналитов (без метрологической прослеживаемости до единиц СИ)...........................................14
Приложение Б (справочное) Особенности описания контрольных материалов для контроля качества
исследования свойств, отличных от величин......................15
Приложение В (справочное) Специальные требования к контрольным материалам (сывороткам). . 16 Библиография................................................18
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Технологии лабораторные клинические
КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ Часть 3
Описание материалов для контроля качества клинических лабораторных исследований
Clinical — laboratory technologies. Quality control of clinical laboratory tests. Part 3. Description of materials for quality
control of clinical laboratory investigations
Дата введения — 2010—01—01
1 Область применения
Настоящий стандарт устанавливает требования к материалам, предназначенным для контроля качества клинических лабораторных исследований, выполняемых в клинико-диагностических лабораториях медицинских организаций всех форм собственности.
2 Нормативные ссылки
В настоящем стандарте приведены нормативные ссылки на следующие национальные стандарты Российской Федерации:
ГОСТ Р ИСО 5725-2-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 2. Основной метод определения повторяемости и воспроизводимости стандартного метода измерений
ГОСТ Р ИСО 9000-2008 Системы менеджмента качества. Основные положения и словарь ГОСТ Р ИСО 15189-2006 Лаборатории медицинские. Частные требования к качеству и компетентности
ГОСТ Р ИСО 15193-2007 Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание методик референтных измерений
ГОСТ Р ИСО 15194-2007 Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание стандартных образцов
ГОСТ Р ИСО 15195-2006 Лабораторная медицина. Требования к лабораториям референтных измерений
ГОСТ Р ИСО 17511-2006 Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам
ГОСТ Р ИСО 18153-2006 Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений каталитической концентрации ферментов, приписанных калибраторам и контрольным материалам
ГОСТ Р 52361-2005 Контроль объекта аналитический. Термины и определения ГОСТ Р 53133.1-2008 Технологии лабораторные клинические. Контроль качества клинических лабораторных исследований. Часть 1. Пределы допускаемых погрешностей результатов измерений аналитов в клинико-диагностических лабораториях
ГОСТ Р 53133.2-2008 Технологии лабораторные клинические. Контроль качества клинических лабораторных исследований. Часть 2. Правила проведения внутрилабораторного контроля качества количественных методов клинических лабораторных исследований с использованием контрольных материалов
Издание официальное
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на нею. применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ Р ИСО 15189. ГОСТ Р ИСО 17511, ГОСТ Р 52361, ГОСТ Р 53133.1. ГОСТ Р 53133.2. а также следующие термины с соответствующими определениями:
3.1 контрольный материал: Однородный материал человеческого или животного происхождения или искусственный материал, насколько это возможно приближающийся по своим наиболее существенным свойствам к исследуемому биологическому материалу пробы и предназначенный для оценки качества исследований проб пациентов, выполняемых в клинико-диагностических лабораториях медицинских организаций.
Примечание — Термин «контрольный материал» может быть использован для материалов, реализующих номинальные свойства, например цвет.
3.2 контрольный материал правильности: Контрольный материал с приписанными (метрологически прослеженными), аттестованными (полученными в результате сравнения с установленным эталоном. калибратором), установленными (на основе межлабораторного консенсуса с применением референтных методик измерения) значениями исследуемых компонентов, предназначенный для оценки правильности (значения аналитического смещения) результатов клинических лабораторных исследований соответствующих компонентов.
3.3 контрольный материал прецизионности: Контрольный материал, не имеющий приписанных, аттестованных или установленных значений компонентов и используемый для оценки прецизионности (повторяемости или воспроизводимости) результатов клинических лабораторных исследований.
3.4 коммутабельность контрольного материала: Способность контрольного материала проявить те же количественные взаимоотношения между результатами измерений в данной совокупности методик (референтной и рутинной), предназначенных для измерения той же величины, что и взаимоотношения, полученные теми же методиками при исследовании других соответствующих биологических материалов.
Примечани е — Для контрольных материалов, используемых для контроля качества методик, предназначенных для исследования биологических проб, «другие соответствующие типы материалов» включают пробы, полученные как от здоровых, так и от больных конкретными болезнями лиц.
3.5 внутрилабораторный контроль качества: Система процедур с применением контрольных материалов или на основе статистического анализа результатов исследований проб пациентов для оценки характеристик аналитического качества используемых методик исследования с целью удовлетворения требований по качеству и повседневного мониторинга стабильности результатов.
3.6 внешняя оценка качества: Система процедур для оценки сравнимости результатов лабораторных исследований, полученных в нескольких лабораториях на одном и том же контрольном материале одними и теми же методами или методами, дающими статистически сравнимые результаты.
3.7 контрольная проба: Аликвотная часть контрольного материала, обработанная таким же образом. как и проба исследуемого биологического материала: используется непосредственно для анализа в серии проб биологических материалов пациентов.
4 Классификация и наименование контрольных материалов
4.1 Описание свойств контрольных материалов
Контрольный материал обладает свойствами, каждое из которых должно быть описано, как указано ниже:
- система (то есть сам материал):
- любой(ые) соответствующий(ив) компонент(ы);
- род величины (величина в общем смысле).
ГОСТ P 53133.3—2008
Если свойство является измеряемой величиной, то его значение должно быть приведено с указанием единиц измерения.
Примечание — В лабораторной медицине, где изучаются индивидуальные величины — компоненты биологических материалов человека. — каждое назначение исследования задается в исчерпывающей и недвусмысленной форме, предложенной Международным Союзом теоретической и прикладной химии и Международной Федерацией клинической химии и лабораторной медицины: «Система — Компонент, род величины*, где «Система» — это обьект изучения, преимущественно имеющий компонент, представляющий специальный интерес, а «род величины» (или «род свойства», если исследуется номинальное свойство) обозначает общее понятие, например. «концентрация количества вещества».
Пример — Плазма (кровь) — ион натрия; концентрация количества вещества, эквивалентная 143 ммоль/л у данного человека в данное время.
4.2 Система
4.2.1 Функция
Контрольный материал в зависимости от наличия или отсутствия приданного ему значения компонента^) предназначен выполнять следующие функции:
- контрольного материала правильности: оценивать аналитическую правильность результатов новой или повседневно применяемой методики измерения в референтной или в практической клинико-диагностической лаборатории; или
- контрольного материала прецизионности: оценивать прецизионность (повторяемость или воспроизводимость) новой или повседневно применяемой методики измерения в данной лаборатории или в группе лабораторий.
В рамках данной измерительной системы в данной лаборатории контрольный материал правильности. имеющий приписанное(ые) значение(ия) определенного компонента(ов) и аналогичный по свойствам с калибратором, может выполнять только одну из функций, которая должна быть задана термином «калибровочный материал» либо «контрольный материал».
4.2.2 Разрешения для применения
Документ, подтверждающий разрешение применять материал, должен содержать следующие сведения:
а) наименование ответственного органа, например органа власти, регистрирующего медицинские изделия для диагностики in vitro;
б) наименование организации, ответственной за аттестацию свойств материала или установление наличия и/или значений аналитов в данном материале: например национальный метрологический институт, изготовитель контрольного материала, лаборатория референтных измерений, аккредитованные в соответствии с ГОСТ Р ИСО 15195 и ГОСТ Р ИСО 17511.
4.2.3 Характеристики контрольного материала
Характеристики контрольного материала должны включать в себя:
а) происхождение и природу исходного материала: неорганический, органический, синтетический, натуральный, биологический установленного рода, например человеческий, свиной.
б) характеристику матрицы:
1) простая, когда контрольный материал состоит из чистого компонента в хорошо определенной среде;
2) сложная, когда компонент представлен в частично известной среде, например в стабилизированной крови или сыворотке.
Примечани е —Для контроля качества в клинико-диагностических лабораториях предпочтительно применять контрольные материалы, наиболее близкие по составу своей матрицы к матрице материала исследуемой пробы пациента. Биологические материалы представляют собой сложные смеси различных веществ и клеток. Исследуемый аналит является лишь одним из многих компонентов этой смеси. Ряд других компонентов — колко-митантов и растворителей, составляющих матрицу пробы. — может влиять на результаты измерения аиалита вследствие их способности интерферировать с некоторыми методиками исследования. Поэтому в зависимости от свойств применяемой методики исследования сигнал от контрольного материала с той же концентрацией аналита. что и в исследуемой пробе пациента, может отличаться от сигнала пробы, если матрица образца сравнения (контрольного материала) не соответствует матрице исследуемой пробы биоматериала. Из этой особенности измерений биологических аналитов вытекает требование к оценке коммутабельности контрольных материалов (см. 5.8.7, 5.10.2);
в) физическое состояние контрольного материала: твердое вещество, жидкость:
3
г) гомогенность и фазы: описание контрольного материала в терминах одной или нескольких индивидуальных гомогенных или негомогенных фаз. например кровь может рассматриваться как комбинация гомогенной фазы плазмы и негомогенной фазы клеток.
Примечание — Для клинических лабораторных исследований биологических объектов, отличающихся нестабильностью, контрольные материалы могут иметь специфическую форму. Например, для контроля качества гематологических исследований допускается применять фиксированные (окрашенные или неокрашенные) мазки крови, для микробиологических исследований — образцы микроорганизмов в лиофилизированной форме или в транспортной питательной среде, для гистологических и цитологических исследований, а также для микроскопических исследований экскретов — цифровые изображения образцовых препаратов исследуемого материала на электронных носителях.
4.3 Компонент(ы)
Комлонент(ы) должен(ны) быть назван(ы) 8 соответствии с принятой международной номенклатурой, включая, например, любые необходимые указания элементарных частиц, относительной молекулярной массы или молярной массы, состояния окисления, множественных форм, для ферментов — номер в классификации ферментов, для антител — моноклональные или поликлональные, специфичность для определенного антигена, для гематологических, цитологических препаратов — наименования клеток, их структурных элементов.
Примеры — фибриноген (340000), железо (11*111), изофермент 1 лактатдегидрогоназы (ЕС. 1.1.1.27), основной фактор роста фибробластов (человеческий, рекомбинированная ДНК).
4.4 Род величины (величина в общем смысле)
Род величины (величина в общем смысле), например масса, количество вещества, числовая доля, концентрация вещества, во всех случаях должен быть установлен. Если не может быть выражено простое отношение между компонентом и системой, должна быть приведена ссылка на методику измерения.
Примечания
1 Термин «величина в общем смысле» (1] соответствует термину «род величины», принятому Международной Федерацией клинической химии и лабораторной медицины (IFCC) и Международным Союзом теоретической и прикладной химии (IUPAC).
2 Соответствующие наименования и символы для родов величины (величин в общем смысле) приведены в ИСО 31 (2) и публикациях Международной Федерации клинической химии и лабораторной медицины (IFCC) и Международного союза теоретической и прикладной химии (IUPAC).
4.5 Числовое значение
Число значащих цифр результата должно быть избрано таким образом, чтобы значащие цифры неопределенности измерения располагались на последней или. если первая значащая цифра меры неопределенности 1 или 2. на двух последних цифрах значения.
4.6 Единицы измерения
Следует применять единицы Международной системы единиц СИ или другие международно признанные единицы из возможных.
Примечание — Некоторые контрольные материалы, применяемые в клинической лабораторной практике, имеют величины, которые, из-за отсутствия корреляции с известной химической структурой или по другим причинам, не могут быть измерены в соответствии с методиками измерения, дающими результаты измерения, метрологически прослеживаемые до единиц измерения Международной системы единиц (СИ) или другой системы единиц. Дли таких материалов биолотической природы Всемирная ор1аиизация здравоохранения или другие международные организации установили некоторые внесистемные единицы, называемые международными единицами (ME).
См. также приложение А.
4.7 Построение общепринятых обозначений и рабочих наименований
4.7.1 Общепринятое (систематическое) обозначение и значение должны состоять из элементов, указанных в 4.2—4.6. и должно быть приведено согласно 4.1.
Пример 1 — Материал для контроля (ВОЗ IS XXX; аттестован, лиофилизированный) — компонент; род величины = (ххх * хх) единица; средняя и расширенная неопределенность, приведенная как интервал, определенный для доверительной вероятности 0,95.
Пример 2 — Систематическое наименование контрольного материала для гематологического анализатора (Ответственный орган (NN; продукт Ыя YYYY):
4
ГОСТ P 53133.3—2008
эритроциты; числовая концентрация = (ххх i vv) единиц; средняя и расширенная неопределенность (уровень доверительной вероятности 0,95);
лейкоциты; числовая концентрация = (vvv ± zz) единиц: средняя и расширенная неопределенность (уровень доверительной вероятности 0.95);
тромбоциты; числовая концентрация = (zzz t уу) единиц; средняя и расширенная неопределенность (уровень доверительной вероятности 0,95).
4.7.2 Рабочее наименование должно быть образовано путем исключения систематического наименования элементов, которые не являются необходимыми для понимания функции контрольного материала при измерении.
Пример 1 — Рабочее наименование для материала, приведенного в 4.7, пример 1, может выглядеть так: ВОЗ (IS XXX) — компонент.
Пример 2 — Рабочее наименование в общей форме для материала, приведенного в 4.7, пример 2, может выглядеть так: контрольный материал (ответственный орган NN; продукт № YYYY) — эритроциты. лейкоциты, тромбоциты
или даже так: контрольный материал (ответственный орган NN; продукт N9 YYYY) — клетки крови.
Рабочее наименование для соответствующего индивидуального продукта может быть представлено так: контрольный материал (компания NN; продукт N9 YYYY; серия № АААА) — клетки крови.
5 Описание контрольных материалов
5.1 Разделы описания
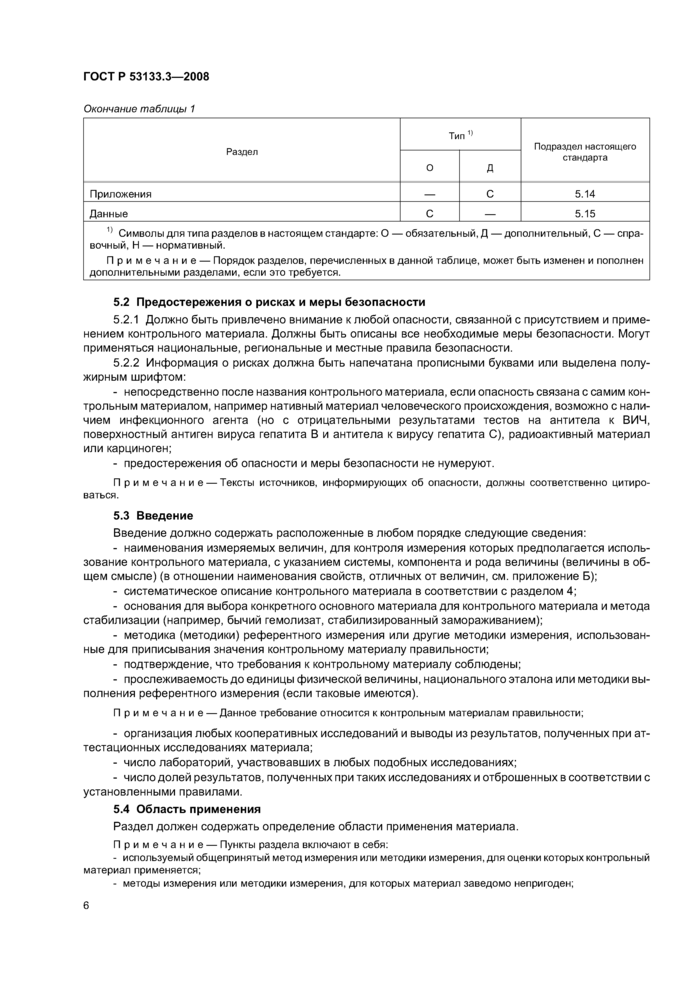
Описание контрольного материала должно включать в себя, по меньшей мере разделы, обозначенные как обязательные (О) в таблице 1.
|
Таблица 1 — Основные разделы описания контрольного материала |
|
Раздел |
Тип " |
Подраздел настоящего стандарта |
|
О |
д |
|
Титульный лист |
С |
— |
— |
|
Содержание |
— |
с |
— |
|
Предисловие |
С |
— |
— |
|
Предостережения о рисках и меры безопасности |
н |
— |
5.2 |
|
Введение |
— |
с |
5.3 |
|
Наименование |
н |
— |
— |
|
Область применения |
н |
— |
5.4 |
|
Определения |
— |
н |
— |
|
Символы и сокращения |
— |
н |
— |
|
Терминология |
— |
н |
5.5 |
|
Обоснование выбора материала |
с |
— |
5.6 |
|
Основные характеристики |
с |
— |
5.7 |
|
Специфические характеристики |
с |
— |
5.8 |
|
Подтверждение |
с |
— |
5.9 |
|
Предполагаемое использование |
с |
— |
5.10 |
|
Инструкции по применению |
с |
— |
5.11 |
|
Поставщик |
с |
— |
5.12 |
|
Библиография |
— |
с |
5.13 |
|
|
Окончание таблицы 1 |
|
Раздел |
Тип ’’ |
Подраздел настоящего стандарта |
|
О |
д |
|
Приложения |
— |
с |
5.14 |
|
Данные |
С |
— |
5.15 |
|
|
Символы для типа разделов в настоящем стандарте: О — обязательный. Д — дополнительный. С — справочный. Н — нормативный.
Примечание — Порядок разделов, перечисленных в данной таблице, может быть изменен и пополнен дополнительными разделами, если это требуется._ |
5.2 Предостережения о рисках и меры безопасности
5.2.1 Должно быть привлечено внимание к любой опасности, связанной с присутствием и применением контрольного материала. Должны быть описаны все необходимые меры безопасности. Могут применяться национальные, региональные и местные правила безопасности.
5.2.2 Информация о рисках должна быть напечатана прописными буквами или выделена полужирным шрифтом:
- непосредственно после названия контрольного материала, если опасность связана с самим контрольным материалом, например нативный материал человеческого происхождения, возможно с наличием инфекционного агента (но с отрицательными результатами тестов на антитела к ВИЧ. поверхностный антиген вируса гепатита В и антитела к вирусу гепатита С), радиоактивный материал или карциноген;
- предостережения об опасности и меры безопасности не нумеруют.
Примечание — Тексгы источников, информирующих об опасности, допжны соответственно цитироваться.
5.3 Введение
Введение должно содержать расположенные в любом порядке следующие сведения:
- наименования измеряемых величин, для контроля измерения которых предполагается использование контрольного материала, с указанием системы, компонента и рода величины (величины в общем смысле) (в отношении наименования свойств, отличных от величин, см. приложение Б);
- систематическое описание контрольного материала в соответствии с разделом 4:
- основания для выбора конкретного основного материала для контрольного материала и метода стабилизации (например, бычий гемолизат, стабилизированный замораживанием);
- методика (методики) референтного измерения или другие методики измерения, использованные для приписывания значения контрольному материалу правильности;
- подтверждение, что требования к контрольному материалу соблюдены;
- прослеживаемость до единицы физической величины, национального эталона или методики выполнения референтного измерения (если таковые имеются).
Примечани е — Данное требование относится к контрольным материалам правильности:
- организация любых кооперативных исследований и выводы из результатов, полученных при аттестационных исследованиях материала;
- число лабораторий, участвовавших в любых подобных исследованиях;
- число долей результатов, полученных при таких исследованиях и отброшенных в соответствии с установленными правилами.
5.4 Область применения
Раздел должен содержать определение области применения материала.
Примечание — Пункты раздела включают в себя:
- используемый общепринятый метод измерения или методики измерении, для оценки которых контрольный материал применяется;
• методы измерения или методики измерения, для которых материал заведомо непригоден;
6
ГОСТ P 53133.3—2008
- влияющие на контрольный материал факторы, например лекарства, метаболиты, добавки, микробный
рост;
- информацию о важных требуемых процедурах предварительной обработки контрольного материала, которые не выполняются в отношении биологических проб в соответствии с заданной методикой измерения (например, восстановление лиофилизированного материала).
5.5 Терминология
5.5.1 Общие сведения
Этот элемент должен содержать описание понятий и терминов, приведенных в описании и не знакомых возможному пользователю или выбранных из ряда возможных в соответствии с особенностями данного контрольного материала.
Примечание — Подраздел «Терминология» является дополнением к разделу «Определения» (см. таблицу 1) и иногда также к разделу «Символы и сокращения» (см. таблицу 1). а термины могут быть включены о какой-то из них или распределены в обоих разделах.
5.5.2 Номенклатура
Наименования измеряемых величин, а также их написание и структуру приводят в соответствии с системой СИ. Наименования родов величин (величин в общем смысле), их обозначения и единицы измерения должны соответствовать международным стандартам серии ИСО 31(2).
5.5.3 Рабочие наименования
В случае употребления рабочих наименований их приводят в скобках после первого упоминания в тексте общепринятого наименования.
5.6 Обоснование выбора
Выбор исходного материала для производства контрольных материалов является предметом многофакторной оптимизации и должен определяться клиническими потребностями, производственными возможностями, метрологическими потребностями, аналитическими проблемами, соображениями экономики, этики и безопасности, а также требованиями конечного использования. Все эти соображения должны быть приведены в полном описании контрольного материала.
5.7 Общие характеристики
5.7.1 Происхождение исходного материала должно быть установлено в соответствии с 4.2.3.
5.7.2 Должны быть указаны существенные детали относительно исходного материала, поскольку они влияют на свойства конечного продукта, например пол и возраст доноров, температура и длительность хранения сыворотки крови вместе со сгустком до их разделения, время хранения и температура после отделения от сгустка. Должны быть учтены обусловленные санитарными правилами меры безопасности, например, при исследовании материала человеческого происхождения на поверхностный антиген вируса гепатита В, антитела к вирусу гепатита С. антитела к ВИЧ и на другие маркеры инфекций, применительно к каждой взятой порции.
5.7.3 Должны быть описаны детали процедуры взятия пробы исходного материала. Должна быть указана процедура очистки с контролем на загрязнения.
5.7.4 Вещества и концентрации любых добавок должны быть заданы.
Пример — Добавки к контрольным материалам, используемым в клинической лаборатории, включают в себя антикоагулянты, антиоксиданты, антимикробные средства, стабилизаторы, смачивающие средства, вещества, покрывающие поверхность шариков: для гематологических и цитологических контрольных материалов — красители.
5.7.5 Физическое состояние и фазы контрольного материала должны быть установлены в соответствии с 4.2.3.
5.7.6 Должна быть указана оцененная гомогенность внутри пробы и между пробами по отношению к минимальной аналитической порции (см. 5.9.2).
Пример — Аттестованный контрольный материал представляет собой порошок лиофилизиро-ванной ткани, помещенный в флакон. Его гомогенность внутри флакона была исследована в трех дублированных пробах, каждая массой 200 мг, взятых из материала в каждом из 20 флаконов. Межфлаконная вариация была исследована в одной пробе из каждого из 60 флаконов, выбранных из различных мест на лиофилизационной площадке. Инструкция по применению устанавливает, что • рекомендуемая минимальная аналитическая порция имеет массу 200 мг».
7