ГОСТ Р 50326-2020
Основные принципы безопасности электрического оборудования, применяемого в медицинской практике
Купить ГОСТ Р 50326-2020 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
В настоящем стандарте приведены основные положения, которые необходимо учитывать при разработке стандартов для обеспечения безопасности медицинских электрических изделий
| Дата введения | 01.03.2021 |
|---|---|
| Актуализация | 01.06.2021 |
Этот ГОСТ находится в:
- Раздел Общероссийский классификатор стандартов
- Раздел Здравоохранение
- Раздел Медицинское оборудование
- Раздел Здравоохранение
Basic aspects of the safety philosophy of electrical equipment, used in medical practice
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27
стр. 28

стр. 29

стр. 30
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ГОСТ Р 50326— 2020/
IEC/TR 60513: 1994
ОСНОВНЫЕ ПРИНЦИПЫ БЕЗОПАСНОСТИ ЭЛЕКТРИЧЕСКОГО ОБОРУДОВАНИЯ, ПРИМЕНЯЕМОГО В МЕДИЦИНСКОЙ ПРАКТИКЕ
(IEC/TR 60513:1994, Fundamental aspects of safety standards for medical electrical equipment, IDT)
Издание официальное
Сшщчш«ф1чи
20»
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия» (ФГУП «СТАНДАРТИНФОРМ») и Обществом с ограниченной ответственностью «Медтехстаидарт» (ООО «Медтехстаидарт») на основе официального перевода на русский язык англоязычной версии документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 011 «Медицинские приборы, аппараты и оборудование»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 9 октября 2020 г. № 784-ст
4 Настоящий стандарт идентичен международному документу IEC/TR 60513:1994 «Фундаментальные аспекты стандартов безопасности для медицинских электрических изделий» (IEC/TR 60513:1994 «Fundamental aspects of safety standards for medical electrical equipment». IDT).
Наименование настоящего стандарта изменено относительно наименования указанного между-народного документа для увязки с наименованиями, принятыми в существующем комплексе национальных стандартов Российской Федерации
5 ВЗАМЕН ГОСТ Р 50326-92 (МЭК 513—76)
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. No 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официалыюм сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ. оформление. 2020
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии II
3.2 Опасности, связанные с пациентом
Некоторые опасности характерны для медицинского электрического изделия и возникают или усугубляются следующими обстоятельствами:
a) неспособностью пациента или оператора обнаружить наличие потенциально опасных факторов. таких как ионизирующее или высокочастотное излучение:
b) отсутствием у пациента, который может быть без сознания, под наркозом, под действием мышечно-расслабляющих препаратов, иммобилизованных и т. д. нормальной реакции:
c) отсутствием защиты от электрического тока, обычно обеспечиваемой сопротивлением кожи пациента. когда кожа специально обрабатывается для получения низкого сопротивления проникновению;
d) применением электрических цепей через соединения с низким импедансом к пациенту. Эта опасность существует при достаточно низких уровнях тока, когда оборудование подключено непосредственно к сердцу пациента;
e) осаждением ионов металлов в кожу пациента при прохождении постоянного тока или тока, имеющего постоянный компонент, который может привести к некрозу ткани даже при достаточно низких уровнях тока, если ток протекает в течение более чем ограниченного времени.
f) ненадежностью или отказом оборудования, используемого для поддержки или замены жизненно важных функций организма;
д) одновременным подключением более одного элемента медицинского электрического изделия к пациенту;
h) комбинацией высокочастотного оборудования и оборудования с низким уровнем сигнала, часто в специальных комбинациях;
i) условиями окружающей среды в зонах лечения пациентов, которые могут представлять собой комбинацию влажности, увлажнения и/или опасности пожара или взрыва, вызванной воздухом, кислородом или закисью азота, в сочетании с анестезирующими средами и чистящими средствами.
3.3 Опасности оператора
Операторы медицинских электрических изделий могут подвергаться опасности от воздействия веществ, энергий и ионизирующего или неионизирующого излучения, которые превышают уровни, разрешенные для основной части населения, например:
a) работники в таких областях, как ядерная медицина, радиология и радиотерапия, могут подвергаться воздействию уровней радиации, превышающих уровни, разрешенные для основной части населения;
b) многие работники здравоохранения подвергаются риску поражения электрическим током или ожога от выхода высокого напряжения оборудования, такого как кардиодефибрилляторы и высокочастотное хирургическое оборудование, в то время как пользователи большинства электрооборудования общего назначения защищены от воздействия напряжений выше сверхнизкого напряжения.
Однако эти уровни все же должны быть ограничены приемлемыми пределами, которые должны быть настолько низкими, насколько это разумно достижимо, и иногда должны быть ограничены более низкими пределами, чем допустимые для пациента.
4 Факторы, влияющие на безопасность
Безопасное использование медицинского электрического изделия зависит от ряда факторов, в том числе:
a) конструкции оборудования, которая должна учитывать и включать средства предотвращения опасностей;
b) соответствующей проверки дизайна, как аппаратного, так и программного обеспечения, до начала производства оборудования:
c) применения надлежащих производственных практик при производстве оборудования:
d) выбора соответствующего оборудования для конкретной процедуры:
е) понимания оператором оборудования и его применения, которое может зависеть от обучения или от маркировки оборудования и инструкций изготовителя;
0 использования принадлежностей, совместимых с оборудованием;
д) подключения оборудования к соответствующим источникам (например, к электросети, линиям сжатого газа);
h) профилактического технического обслуживания оборудования:
i) использования предусмотренных запасных частей при ремонте оборудования.
5 Меры по обеспечению безопасности
Безопасность медицинского электрического изделия часто требует комплексного подхода, при котором изготовители и пользователи применяют комплекс мер, включающий:
a) требования, включенные в конструкцию оборудования;
b) дополнительные меры, такие как требования к установке, официальному вводу в эксплуатацию. повседневному обслуживанию и испытаниям на безопасность; а также
c) меры, требующие, чтобы пользователи знали о необходимости принятия особых мер предосторожности при использовании некоторых видов медицинских электрических изделий или при выполнении определенных процедур.
Для достижения общей безопасности следует рассмотреть вопрос о необходимости стандартов в каждой из вышеуказанных областей.
6 Цель стандартов
Целью стандартов безопасности и основных функциональных характеристик для медицинских электрических изделий является повышение безопасности при использовании такого оборудования. Эта цель должна быть достигнута путем разработки стандартов, которые помогают:
a) изготовителям при проектировании и сборке безопасных и эффективных продуктов:
b) изготовителям, испытательным лабораториям и регулирующим органам при оценке соответствия требованиям, а также
c) медицинским работникам в управлении рисками, связанными с использованием этих продуктов.
7 Типы стандартов
Стандарты безопасности и основных функциональных характеристик для медицинских электрических изделий могут относиться к одной или нескольким категориям в соответствии с 19.4.
7.1 Стандарты на продукцию
Эти стандарты относятся к конкретному продукту или группе продуктов и включают в себя:
a) стандарты безопасности, включающие требования безопасности, которые необходимы и применимы к предполагаемому использованию продукта (например, МЭК 601-1 и связанные с ним дополнительные и частные стандарты для медицинских электрических изделий):
b) стандарты на основные функциональные характеристики, которые включают требования, которые:
- необходимы для обеспечения эффективной работы продукта;
- необходимы для многих пользователей, которые не смогут идентифицировать или указать их без ссылки на соответствующий стандарт или оценить их без специализированных лабораторных средств: а также
- могут быть определены в полностью проверяемых технических условиях посредством воспроизводимых испытаний на соответствие или оценки процесса проектирования.
Примечание — Для медицинских электрических изделий требования, описанные в а) и Ь), часто публикуются как часть одного и того же стандарта:
c) стандарты на неосновные функциональные характеристики, включающие вопросы, которые не попадают в область, описанную в а) или Ь). Эти стандарты включают требования к производительности или методы испытаний, которые помогают изготовителю или пользователю определить пригодность для использования.
Могут быть разработаны стандарты раскрытия информации, в том числе связанные методы испытаний, где должно быть стандартизировано соблюдение промаркированных или заявленных характеристик.
7.2 Стандарты на процессы
В эту категорию входит ряд типов стандартов, в том числе:
a) стандарты обеспечения качества (QA) [например, стандарты надлежащей производственной практики (GMP) и контроля качества (QC). которые являются частью системы качества и применяются там, где критически важно поддерживать утвержденные типовые требования или уникальные рабочие характеристики процесса];
b) другие стандарты, которые требуют оценки «доказательств процесса» (например, стандарты для программируемых электронных систем, стерильности и эргономики).
7.3 Инсталляционные и экологические стандарты
Эти стандарты включают в себя:
a) стандарты конструкции и монтажа (например, экранирование от рентгеновских лучей, правила электропроводки);
b) системные стандарты (например, критические требования для правильного сопряжения и взаимодействия). такие как:
- МЭК 601-1-1. дополнительный стандарт для медицинских электрических систем;
- стандарты для компьютерных систем архивирования медицинских изображений;
- стандарты для медицинских информационных систем.
c) стандарты ввода в эксплуатацию, где безопасность может быть улучшена путем проведения оценки конструкции или проверки правильности установки и настройки оборудования непосредственно перед первым использованием;
d) стандарты, ограничивающие вероятное влияние оборудования на окружающую среду или влияние внешних воздействий на оборудование (например, стандарты, касающиеся электромагнитной совместимости).
7.4 Стандарты применения
Эти стандарты включают:
a) стандарты на регулярные испытания в процессе эксплуатации, где безопасность может быть поставлена под угрозу из-за износа оборудования или условий инсталляции (например, предлагаемые стандарты МЭК для испытаний в процессе эксплуатации для кардиодефибрилляторов и высокочастотного хирургического оборудования).
b) стандарты постоянства и калибровки, где безопасность зависит от подтвержденного функционирования и точности оборудования;
c) пояснительные руководящие принципы, предоставляющие информацию об опасностях, связанных с конкретными типами оборудования и процедур, вместе с соответствующими рекомендациями по безопасности;
d) руководства пользователя, содержащие информацию о системах классификации безопасности. используемых в соответствующих стандартах на продукцию.
8 Приемлемые уровни риска
Руководство ИСОУМЭК 51 устанавливает, что безопасность — это баланс между свободой от риска и другими требованиями к продукту, процессу или услуге, включая полезность, пригодность и стоимость. Безопасность, определяемая как свобода от какого-либо риска, не может быть абсолютной при использовании медицинского электрического изделия; его применение может быть только относительно безопасным или относительно небезопасным. Требования общества и. следовательно, приемлемая степень безопасности или риска подвержены социальным изменениям.
Очень немногие вещи абсолютно безопасны и предполагают полное отсутствие риска. Реалистичное ожидание должно состоять в том, чтобы риски были бы как можно более низкими, принимая во внимание соотношения затрат, которые будут понесены при последовательном снижении риска, и выгод, получаемых от использования продукта, процесса или услуги.
Общество (включая пользователей медицинских электрических изделий, пациентов, изготовителей. регулирующие органы и общественность) может желать или даже ожидать, что медицинское электрическое изделие будет физически безопасным, работать в соответствии с указаниями и давать соответствующие результаты. Однако при разработке соответствующих стандартов на продукты ба-
ланс между риском и затратами должен учитывать неблагоприятное влияние отказа от использования продукта. Медицинское изделие, которое спасает тысячи жизней и ранит одного человека, может быть предпочтительнее устройства, которое спасает сотни жизней и никого не ранит. Связанное с этим соображение — это разница (которую нелегко оценить) между, с одной стороны, травмирующим воздействием на пациента и. с другой стороны, неспособностью сласти его жизнь.
Одной из функций стандартов на медицинские электрические изделия является определение приемлемого уровня риска при надлежащем использовании или даже при неправильном использовании оборудования. В этом отношении конструкция и оценка безопасности продукта зависят от четырех дополнительных действий:
a) определения опасностей, которые необходимо учитывать;
b) оценки рисков, связанных с этими опасностями;
c) установления требуемого уровня безопасности и получения согласия по приемлемым уровням риска;
d) определения требований безопасности для устранения или минимизации этих опасностей и достижения приемлемого уровня риска.
В зависимости от обстоятельств, эти действия могут выполняться одним и тем же человеком или разными людьми, в одно и то же время.
Все эти действия осуществляются при разработке стандартов на продукцию. Тем не менее разработчик или оценщик продукта также должен будет выполнить дополнительную итерацию, чтобы гарантировать. что продукт не представляет дополнительных опасностей, помимо тех. которые описаны в стандарте. Действие с) также является политической и социальной деятельностью, затрагивающей широкий круг интересов.
Поэтому в стандартах на продукцию должны быть указаны требования и испытания, которые соответствующие организации могут использовать для оценки готового продукта или процессов, с помощью которых продукт разработан и изготовлен. Однако зачастую изготовителям разрешается принимать решения. отличные от тех. которые указаны в стандарте, при условии, что они могут продемонстрировать, что достигается эквивалентный уровень безопасности. Рисунок 1 представляет собой блок-схему для определения риска, установления приемлемых уровней риска и разработки требований к безопасности и основным функциональным характеристикам.
|
Рисунок 1 — Блок-схема управления рисками |
9 Разработка требований к безопасности и основным функциональным характеристикам
9.1 Идентификация опасности
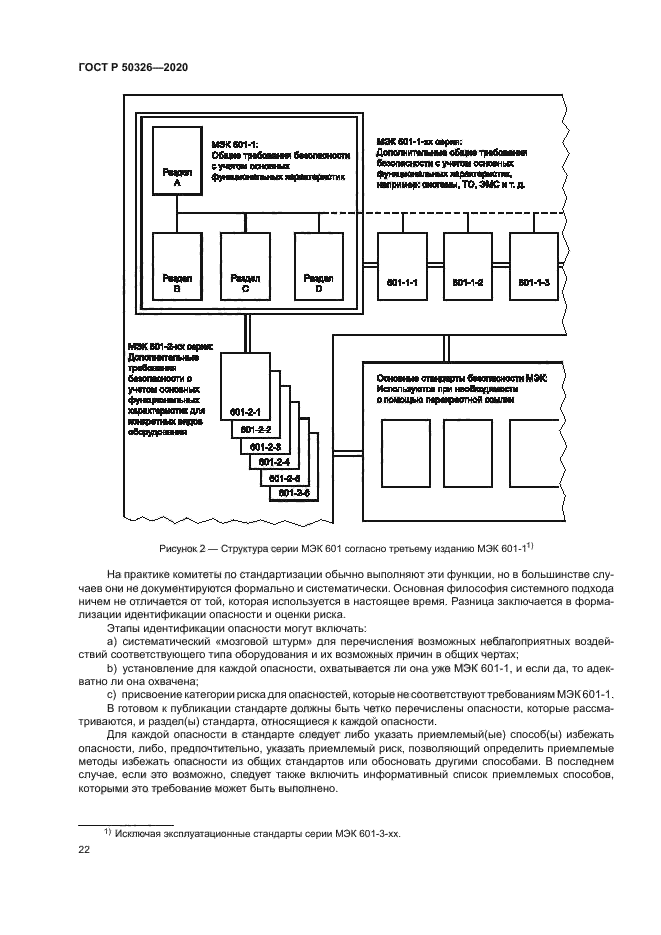
Прежде чем разрабатывать требования к безопасности и основным функциональным характеристикам. необходимо определить опасности, связанные с конкретным видом оборудования. Конкретный элемент медицинского электрического изделия может вызывать или способствовать возникновению различных опасностей (см. 3.1). В МЭК 601-1 также перечислены опасности в соответствии с рядом категорий. которые следует использовать в качество основы для анализа рисков для каждого конкретного вида оборудования.
Важной функцией частного стандарта является перечисление опасностей, характерных для конкретного вида оборудования, которые необходимо избегать или минимизировать, что позволяет более точно определить общие опасности, которые рассматриваются в МЭК 601-1.
Например, пункт 51 второго издания МЭК 601-1 определяет необходимость защиты от опасных выходов. Однако общий стандарт определяет только общие требования, и конкретное изделие может иметь несколько важных выходных характеристик. Например, производительность инфузионного насоса — это скорость доставки раствора, и любая из следующих конкретных характеристик выхода может вызвать опасность:
a) ошибки в средней скорости относительно установленной скорости при нормальной работе;
b) изменения мгновенной скорости во времени при нормальной работе.
с) ошибки в общем доставленном объеме, с или без включения сигнала тревоги, в случае ошибки.
Как правило, использование новой технологии (например, используемой в программируемых электронных системах) не влияет на диапазон опасностей, связанных с конкретным видом оборудования, хотя может привести к появлению дополнительных механизмов отказа, которые приводят к тем же опасностям. Соответствующие требования к новым технологиям обычно связаны с необходимыми характеристиками, а не с защитой от основных угроз безопасности, таких как пожар и поражение электрическим током.
9.2 Уровень серьезности
Другой функцией частного стандарта является оценка каждой выявленной опасности для определения уровня ее серьезности.
Даже если приемлемый риск не может быть точно определен, процесс систематического перечисления опасностей и определения уровня их серьезности гарантирует, что каждая опасность получает соответствующую степень рассмотрения при разработке продукта.
Может быть несколько способов возникновения одной и той же опасности с разными уровнями тревог. Например, потенциальной опасностью в инфузионном насосе может быть невозможность прекратить инфузию, когда будет доставлен желаемый объем. Это может произойти из-за неисправности насоса или из-за ошибки оператора при настройке желаемого объема. Уровень серьезности одинаков в обоих случаях, но меры по борьбе с риском и эффективность этих мер могут различаться. Вероятность доставки чрезмерного объема из-за неисправности оборудования должна быть низкой, поскольку эту проблему можно решить при проектировании. Однако лучшее, что можно сделать, чтобы избежать ошибки оператора, может потребовать, чтобы оборудование четко указывало установленный объем.
Серьезность опасности может зависеть не только от конструкции оборудования. Например, влияние на пациента чрезмерной скорости потока из инфузионного насоса зависит от того, какая жидкость подается, как долго сохраняется избыточная скорость и каково состояние здоровья пациента. Таким образом, одна и та же опасность может иметь разные уровни серьезности при разных обстоятельствах. Если обстоятельства непредсказуемы, уровень серьезности должен быть определен из худшего вероятного случая.
9.3 Выбор приемлемых уровней риска
Риск — это сочетание частоты и вероятности (в течение определенного периода или при определенных обстоятельствах) и, как следствие, конкретной опасности. Эта концепция всегда имеет два элемента: частоту или вероятность возникновения опасности и последствия (серьезность) опасности.
Хотя безопасность широко упоминается при обсуждении медицинского электрического изделия, важно помнить, что абсолютная безопасность — это полное отсутствие риска. На практике нулевой риск недостижим. Каждый уровень риска должен быть сделан достаточно низким, чтобы быть приемлемым с учетом всех обстоятельств.
Почти любую конструкцию оборудования можно изменить, чтобы сделать ее более безопасной, например, за счет более жесткой конструкции, дополнительных систем безопасности или контроля, или дополнительных процедур производстваУиспытаний. Однако такие улучшения могут повлечь за собой дополнительные расходы или потерю полезности. Поэтому для каждой опасности необходимо решить, является ли риск приемлемым; то есть приемлема ли комбинация серьезности опасности и вероятности ее возникновения.
Технический комитет МЭК 62 и его подкомитеты не привыкли определять приемлемые уровни риска как таковые, и концепция приемлемого риска может быть незнакомой и даже нежелательной. Тем не менее эта концепция подразумевается в согласованных стандартах, таких как МЭК 601-1. (Одной из областей, где были определены некоторые риски, связанные с медицинским оборудованием, является радиационная защита).
Испытания, которые обычно применяются при принятии решения о приемлемости риска, включают определение;
a) настолько велик риск или настолько неприемлем результат, что от него следует отказаться вообще; или же
b) является ли или был ли сделан риск настолько малым, что является незначительным; или же
c) риск попадает между а) и Ь). и он был снижен до минимально возможного уровня с учетом выгод, вытекающих из его принятия, и с учетом затрат на любое дальнейшее снижение-
Риски должны быть снижены до уровня, который является настолько низким, насколько это практически возможно (принцип «ALARP»). Если риск попадает между двумя крайностями, то есть «недопустимым» и «незначительным», и применяется принцип «ALARP». результирующий риск приемлем для этого конкретного применения.
Хотя основными соображениями при определении приемлемых уровней риска являются серьезность и вероятность, необходимо учитывать и другие факторы, такие как:
a) частоту ожгщаемых предпосылок для возникновения опасности (например, частоту использования оборудования или количество пациентов, которых им лечат);
b) целесообразность дальнейшего улучшения;
c) стоимость дальнейшего улучшения;
d) клинические ограничения;
e) преимущества, связанные с использованием устройства;
0 общественное восприятие.
В отличие от некоторых других отраслей промышленности, не существует общепринятой системы классификации различных опасностей, которые может представлять медицинское электрическое изделие. Например, мнения могут отличаться относительно серьезности следующего:
a) неспособности оборудования для мониторинга пациента подавать звуковой сигнал, когда это необходимо:
b) неспособности оборудования для лучевой терапии доставить правильную дозу облучения;
c) неспособности инфузионного устройства доставить правильное количество лекарства.
Следовательно, еще одной функцией частного стандарта является определение максимально
приемлемой вероятности для каждой опасности. При разработке стандарта необходимо принять отдельное решение об уровне серьезности для каждой из общих опасностей для конкретного вида оборудования.
Если вероятность отказов, приводящих к опасности, известна или может быть оценена приблизительно. в качестве отправной точки в оценке риска могут использоваться таблицы 1 и 2.
Эти таблицы были адаптированы для медицинских электрических изделий из документа, который в настоящее время рассматривается SC 65АЧ Однако несмотря на включение их в первый столбец таблицы 1. катастрофические последствия редко бывают приемлемы для медицинских электрических изделий.
Количество внимания, которое следует уделять оценке рисков, зависит от количества продуктов определенного вида в обслуживании. Однако это число не должно влиять на соотношение рисков и выгод. Если количество единиц больше, риски больше, но выгоды также.
|
Таблица 1 — Классификация рисков несчастных случаев | |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
Документ 65А (Секретариат) 123 находится на рассмотрении.
|
Таблица 2 — Интерпретация уровней риска | ||||||||||
|
Соотношение затрат и выгод различается для медицинских электрических изделий и большинства других видов оборудования. Может быть лучше успешно лечить большое количество пациентов, чем делать оборудование более дорогим и лечить меньше пациентов. Такие вопросы должны обсуждаться и решаться на основе консенсуса среди всех заинтересованных сторон (изготовителей, пользователей, регулирующих органов и т. д.). Комитет по разработке стандартов, в котором представлены все интересы. является подходящим форумом для определения такого консенсуса.
Комитет, готовящий новый стандарт на продукцию, должен пересмотреть все возможные опасности и указать приемлемый риск для каждой из них. Отправной точкой для этого процесса может стать оценка известных рисков в существующих конструкциях аналогичного оборудования. Комитет, возможно, пожелает указать более высокий или более низкий приемлемый риск, чем в существующих конструкциях. Однако, как правило, в худшем случае целесообразно ожидать того же приемлемого риска. что и раньше, т. е. вероятность каждого вида опасного события одинакова.
Внедрение различных технологий, таких как программируемые электронные системы, само по себе не оправдывает каких-либо изменений по сравнению с принятыми в настоящее время уровнями риска. Однако внедрение новых технологий вместе с изменениями в ожиданиях пользователей может оправдать переоценку баланса между безопасностью и другими соображениями. Однако эта основа для определения приемлемых рисков может оказаться неприемлемой, если оборудование выполняет новые функции, которые были бы невозможны без новой технологии.
9.4 Устранение неисправностей и контроль
Разница между медицинскими электрическими изделиями и другими сопоставимыми электронными устройствами заключается в возможной опасности. Как отмечено выше, одной из функций частного стандарта является выявление конкретных опасностей для соответствующего вида оборудования.
Однако средства, которые можно использовать для предотвращения опасностей, не относятся к медицинским электрическим изделиям. Компоненты и узлы, используемые в медицинских электрических изделиях, в основном являются стандартными компонентами, соответствующими их собственным стандартам. Как правило, также похожи и используемые конфигурации. То же самое относится и к программным компонентам и операционным системам.
В случае случайных или систематических неисправностей можно применять предотвращение неисправностей или контроль неисправностей. Предотвращение неисправности означает предотвращение возникновения ошибки. Контроль неисправности означает принятие дополнительных мер. чтобы в случае возникновения неисправности все еще предотвращались опасные воздействия.
Поскольку сложные системы не могут быть полностью оценены путем испытаний, их правильность и надежность должны оцениваться другими способами. Уверенность достигается применением соответствующих процедур в процессе проектирования, и это оценивается путем анализа доказательств этого процесса. (Оценка «доказательств процесса» также необходима для некоторых других аспектов медицинских изделий, таких как стерильность и эргономика).
Растущее признание того, что абсолютная безопасность не может быть обеспечена, привело к разработке концепций управления рисками. Эти концепции могут быть использованы в рамках более широкого системного подхода к проектированию и производству более качественных медицинских электрических изделий.
ИСО 9004:1987 «Управление качеством и элементы системы качества. Руководящие положения» содержит надлежащее описание этих концепций. Основой этих концепций является то. что качество, включая безопасность и результативность, легче всего внедрить в продукт на самых ранних этапах его проектирования.
Риск-менеджеры должны рассмотреть вопрос об использовании стандартов безопасности в системах качества. Например, раздел 19 ИСО 9004 отмечает, что: «Должны быть предприняты шаги как для ограничения риска ответственности за качество продукции, так и для минимизации количества случаев путем определения соответствующих стандартов безопасности, чтобы повысить эффективность формулировки спецификаций продукта или услуги».
Тщательный и упорядоченный подход ко всем этапам проектирования, включая анализ возможных опасностей, желателен для любого медицинского электрического изделия. Внедрение новых технологий, таких как программное обеспечение, увеличивает потребность в таком подходе по сравнению с традиционными проектами, когда изготовители и разработчики стандартов могут рассчитывать на накопленный опыт основных проблемных областей.
Существует множество методов, с помощью которых вероятность возникновения неисправностей может быть сведена к минимуму, но невозможно применить их все к одному и тому же элементу аппаратного или программного обеспечения. Поэтому изготовитель должен решить, какие методы использовать и в какой степени: и орган по сертификации или регулирующий орган должен решить, принял ли изготовитель разумные решения. Поэтому необходимо установить целевой показатель, который может быть выражен в терминах приемлемого риска в готовом проекте или в отношении целостности, связанной с безопасностью систем(ы).
Кроме того, часто существуют альтернативные подходы к проектированию для достижения эквивалентных. общих уровней безопасности. Например, можно использовать одну систему управления с очень высокой целостностью или несколько независимых систем управления с более низкой индивидуальной целостностью. То. как далеко изготовитель должен зайти с каждой системой, зависит не только от общего уровня требуемой безопасности, но и от конфигурации систем, связанных с безопасностью.
9.5 Уровни целостности
Общие стандарты, разрабатываемые подкомитетом 65А11 МЭК. вводят концепцию уровней целостности безопасности, которые соответствуют различным уровням гарантии или вероятности того, что программное или аппаратное обеспечение будет функционировать, как предполагалось.
Эта концепция служит инструментом для связи надежности аппаратных или программных компонентов (которая зависит от методов, используемых при их разработке и изготовлении) с уровнями риска от всего оборудования. Для каждого уровня целостности безопасности необходимо соблюдать набор процедур. чтобы обеспечить необходимую уверенность. При таком подходе конкретный комитет по продукту должен будет только определить соответствующий уровень целостности для каждой системы защиты.
Такие общие стандарты будут необходимы для руководства проектировщиками и оценщиками при определении того, насколько эффективно были предотвращены общие режимы отказов в процессе проектирования.
Однако они не могут указать, как далеко должен зайти конструктор, чтобы избежать конкретной опасности.
Это зависит от серьезности опасности и таких факторов, как общественные ожидания и соображения затрат/выгод. которые варьируются от случая к случаю. Для каждой конкретной опасности комитет по разработке стандартов должен будет установить целевой приемлемый риск, либо в явной форме, либо путем установления требований к допустимым конструктивным особенностям и/или методам проектирования и производства.
Понятие уровней целостности применимо к:
a) общей конфигурации систем, связанных с безопасностью:
b) индивидуальным системам безопасности, а также
c) компонентам (включая программное обеспечение) в рамках отдельной системы, связанной с безопасностью.
Примеры того, как могут быть назначены уровни целостности безопасности, приведены в некоторых дополнительных и частных стандартах.
9.6 Достижение приемлемых уровней риска
Оценка конкретного продукта включает определение того, были ли определенные виды неисправностей сделаны достаточно маловероятными. В целом этот процесс более характерен для технологии.
На момент подготовки настоящего стандарта — 65А (Секретариат) 122 и 123.
от которой зависит продукт, чем от его применения. Например, медицинское, офисное и бытовое электрооборудование требует одинаковых методов защиты от поражения электрическим током и схожих критериев для проверки диэлектрической прочности и т. д. Аналогичным образом уровень целостности программируемых электронных систем будет оцениваться практически одинаково независимо от вида оборудования, которым они управляют. Различия будут в основном отражать различные уровни целостности. которые подходят для конкретного применения. Поэтому критерии могут быть определены в общих стандартах, охватывающих многие виды оборудования.
Одно из различий между медицинскими электрическими изделиями и большинством других видов оборудования, связанное с безопасностью, заключается в вовлечении пациента в состав системы. Для оборудования, предназначенного для мониторинга, измерения или контроля физиологических параметров. идеальная характеристика результативности может быть определена с уверенностью. В таких случаях все еще необходимо будет установить, что риск того, что оборудование не соответствует его спецификации, является приемлемо низким, но также необходимо будет оценить адекватность и уместность самой спецификации.
Медицинские электрические изделия все чаще используют для выполнения функций, которые ранее выполнялись людьми (например, анализ физиологических данных, принятие решения о доставке терапевтических агентов). Особенно трудно определить, следует ли принимать систему, в которой программное обеспечение провоцирует потенциально опасные действия без вмешательства медицинского персонала.
Предыдущие стандарты безопасности оборудования не должны были решать эту проблему, но теперь они должны будут это сделать. Не имеет смысла указывать некоторые аспекты безопасности, если пренебрегают другими.
9.7 Превышение установленных требований
Изготовитель всегда может произвести продукт, который соответствует требованиям, указанным в стандарте. Если частный стандарт определяет приемлемый риск (в отношении конкретной опасности), изготовитель может обнаружить возможность снизить риск до более низкого уровня по стоимости, которую он считает коммерчески приемлемой. Внедрение такого продукта не обязательно означает, что стандарт не содержит жестких требований.
Однако стандарты должны учитывать то. что является разумно достижимым.
9.8 Оценка риска в серии МЭК 601
МЭК 601-1 и МЭК 601-2-хх идентифицируют большинство общих опасностей, применимых к различным видам медицинских электрических изделий. Для многих видов опасности эти стандарты уже:
a) указывают приемлемую конфигурацию систем, связанных с безопасностью (то есть систем, которые способствуют обеспечению безопасности, таких как базовая изоляция и защитное заземление, в качестве одной допустимой конфигурации для предотвращения поражения электрическим током); или же
b) заявляют, что конкретные события не должны происходить в нормальном состоянии или в состоянии единичного отказа.
Требование, сформулированное любым из этих способов, неявно определяет приемлемый риск.
В некоторых других отраслях вероятность опасных явлений определяется количественно. Стандарт или спецификация проекта требуют, чтобы каждый риск был уменьшен до или ниже указанной вероятности. Фактические вероятности рассчитываются (для случайных отказов оборудования).
9.9 Неисправности
Неисправности, которые необходимо учитывать при разработке стандартов на медицинские электрические изделия, подразделяют на несколько категорий:
a) некоторые неисправности, очевидные для оператора (например, осторожный пользователь может наблюдать внешнее физическое повреждение; обрыв заземляющего провода вызовет явную неисправность в некоторых видах медицинских электрических изделий);
b) некоторые неисправности, которые не могут быть обнаружены даже осторожным оператором, но могут быть обнаружены при регулярном обслуживании (например, частичное повреждение изоляции между питающей сетью и защитным заземлением медицинского электрического изделия);
c) некоторые неисправные состояния, которые не могут быть замечены оператором или обнаружены во время регулярного обслуживания (например, выход из строя одной части двойной изоляции). 14
Содержание
1 Область применения.................................................................1
2 Понятия............................................................................1
2.1 Основная безопасность.................................. 1
2.2 Эффективность..................................................................2
2.3 Действенность...................................................................2
2.4 Основные функциональные характеристики ............. 2
2.5 Основные требования............................... 2
2.6 Пригодность для использования....................................................2
2.7 Опасность......................................................................2
2.8 Обеспечение качества............................................................3
2.9 Риск...........................................................................3
2.10 Уровень риска..................................................................3
2.11 Безопасность...................................................................3
2.12 Уровень целостности безопасности................................................3
2.13 Уровень серьезности (опасности)..................................................3
2.14 Пользователь/оператор..........................................................4
3 Опасность..........................................................................4
3.1 Причины опасностей................................ 4
3.2 Опасности, связанные с пациентом.................................................5
3.3 Опасности оператора................... 5
4 Факторы, влияющие на безопасность...................................................5
5 Меры по обеспечению безопасности....................... 6
6 Цель стандартов....................................... 6
7 Типы стандартов........................................ 6
7.1 Стандарты на продукцию..........................................................6
7.2 Стандарты на процессы...........................................................7
7.3 Инсталляционные и экологические стандарты........................................7
7.4 Стандарты применения...........................................................7
8 Приемлемые уровни риска............................................................7
9 Разработка требований к безопасности и основным функциональным характеристикам.........9
9.1 Идентификация опасности........................................................9
9.2 Уровень серьезности............................................................10
9.3 Выбор приемлемых уровней риска.................................................10
9.4 Устранение неисправностей и контроль.............................................12
9.5 Уровни целостности.............................................................13
9.6 Достижение приемлемых уровней риска............................................13
9.7 Превышение установленных требований............................................14
9.8 Оценка риска в серии МЭК 601....................................................14
9.9 Неисправности..................................... 14
9.10 Философия единичного нарушения/единичного отказа...............................15
9.11 Уровни целостности, указанные в МЭК 601-1........................................16
9.12 Приемлемые уровни риска в соответствии с МЭК 601................................16
10 Принадлежности для оборудования..................................................17
9.10 Философия единичного нарушения/единичного отказа
Для медицинских изделий фактические вероятности различных опасностей редко определяются количественно. Вместо этого предлагается «философия единичного нарушения», которая может быть сформулирована следующим образом:
a) опасности не должны возникать ни в одном из перечисленных «условий единичного нарушения»;
b) все части оборудования, имеющие отношение к безопасности, должны быть достаточно надежными, чтобы вероятность «единичного нарушения» была низкой;
c) вероятность двух «единичных нарушений» будет тогда очень низкой, поэтому допустимо, чтобы состояние с множественными неисправностями создавало опасность:
d) если одно «единичное нарушение» непосредственно вызывает другие, вероятность такая же. как и у первой неисправности, и оборудование должно оставаться безопасным;
e) если при некоторых обстоятельствах две неисправности могут возникать по общей причине (например, короткое замыкание обоих слоев двойной изоляции проводящими жидкостями или металлическими предметами), вероятность двух неисправностей такая же. как и у общей причины;
f) если неисправность не может быть обнаружена с помощью практических процедур технического обслуживания и вряд ли будет замечена оператором, поскольку она не влияет на работу оборудования. высокая вероятность того, что неисправность останется необнаруженной в течение длительного периода, должна учитываться при разработке требований безопасности.
Существующие требования МЭК 601-1, касающиеся электрической безопасности, иллюстрируют философию единственного отказа. Обеспечением основной безопасности является базовая изоляция. Однако, поскольку она может быть неисправна (может выйти из строя или может быть обойдена), требуется дополнительная защита.
МЭК 601-1 признает три возможности:
a) защитное заземление (доступной части или промежуточной части);
b) дополнительная изоляция; или же
c) усиленная изоляция (которая считается эквивалентной двойной изоляции).
Признано, что соединение защитного заземления может выйти из строя, и. если оно выходит из строя, опасность не допускается. Однако предполагается, что существует незначительная вероятность того, что как базовая изоляция, так и соединение защитного заземления, прервутся в одно и то же время (или. точнее, если один из этих элементов выйдет из строя после того, как другой уже вышел из строя, но не был отремонтирован).
Вероятность двух условий «единичного нарушения» не равна нулю. В некоторых отраслях, в которых потенциальные опасности очень серьезны (например, расплавление ядерного реактора или авиационные катастрофы), вероятность должна быть чрезвычайно низкой. Поэтому необходимы многочисленные защитные системы, а вероятность двойных и даже множественных отказов оценивается и сравнивается с заявленной приемлемой вероятностью.
Для медицинского электрического изделия было сочтено достаточным, чтобы гарантировать, что опасности не могут возникнуть при единичном нарушении. В случае двойной неисправности может возникнуть опасность, но риск считается незначительным.
Комитеты по разработке стандартов должны идентифицировать те угрозы безопасности, связанные с медицинскими электрическими изделиями, которые требуют болев высокого уровня защиты, чем тот. который предусмотрен философией единичного нарушения.
Философия единственного отказа подразумевает, что, как правило, медицинское электрическое изделие должно иметь два средства защиты от каждой опасности. Считается, что это дает незначительный риск при условии низкой вероятности отказа отдельных систем. (Иногда может быть предоставлено более двух, но это не требуется существующими стандартами.)
Философия «единичного нарушения» оказалась успешной для большинства традиционных технологий и должна быть сохранена, насколько это возможно, поскольку она в целом подходит для простых аппаратных систем. Например, необходимо только удвоить расстояние утечки, чтобы получить эквивалент двойной или усиленной изоляции. Преодоление такого расстояния исключено по определению. Однако требуется только монета, чтобы соединить такие «две» изоляции одновременно и вызвать электрическую опасность. Этот простой пример показывает, что риск отказа по «общей причине» существует даже при использовании традиционных технологий безопасности.
Медицинское электрическое изделие должно оставаться в допустимых пределах риска при наличии отказов, которые:
11 Стандартизация...................................................................17
12 Координация стандартов............................................................18
12.1 Общий подход к безопасности...................................... 18
12.2 Общее планирование при разработке стандартов...................................18
13 Стандарты и закон.................................................................18
14 Роль стандартов...................................................................18
15 Несчастные случаи................................................................19
16 Поддержание стандартов...........................................................19
17 Выявление проблем...............................................................19
18 Приоритет........................................................................19
19 Формат и структура................................................................19
19.1 Наименования.................................................................19
19.2 Область применения и обоснование..............................................19
19.3 Форма спецификации...........................................................20
19.4 Структура.....................................................................20
20 Определение требований к безопасности и основным функциональным характеристикам.....20
20.1 Общие положения.............................................................20
20.2 Конкретные требования к испытаниям для оценки процесса проектирования.............23
21 Требования к испытаниям...........................................................23
21.1 Общие положения.............................................................23
21.2 «Условие единичного нарушения» и «Угроза безопасности»...........................23
21.3 Защитные устройства...........................................................24
21.4 Компоненты высокой надежности.................................................24
21.5 Факторы безопасности..........................................................24
21.6 Методы испытаний.............................................................24
21.7 Основные стандарты безопасности...............................................25
21.8 Маркировка и лейбелинг........................................................25
21.9 Предупреждения...............................................................25
21.10 Другая информация, которая должна быть предоставлена...........................26
22 Проверка конструкции..............................................................26
23 Клинические испытания и аналогичная оценка.........................................26
24 Требования к производительности....................................................26
24.1 Общие положения.............................................................26
24.2 Требования к основным функциональным характеристикам...........................27
24.3 Основные требования к раскрытию информации............ 27
24.4 «Необязательные» требования к функциональным характеристикам...................27
Приложение А Классификация рабочих частей...........................................28
Приложение В Роль стандартов в оценке и одобрении медицинских электрических изделий......32
Приложение С Улучшение общей безопасности...........................................34
Приложение D Факторы безопасности...................................................36
Приложение Е История первого издания МЭК 513 и серии МЭК 601..........................37
Введение
IEC/TR 60513:1994 был подготовлен подкомитетом 62А МЭК «Общие аспекты электрического оборудования, используемого в медицинской практике», Технического комитета 62 «Электрооборудование в медицинской практике».
Текст IEC/TR 60513:1994 основан на следующих документах:
|
Проект комитета |
Отчет о голосовании |
|
62A(SEC)136 |
62A(SEC)148 |
Полная информация о голосовании для утверждения IEC/TR 60513:1994 приведена в отчете о голосовании, указанном в приведенной выше таблице.
Первое издание МЭК 513 «Основные аспекты философии безопасности для электрического оборудования. используемого в медицинской практике» было опубликовано в 1976 году и послужило основой для разработки:
- первого и второго изданий МЭК 601-1 (исходный стандарт безопасности для медицинских электрических изделий);
- серии дополнительных стандартов МЭК 601-1-хх для медицинских электрических изделий, и
- серии частных стандартов МЭК 601-2-хх для конкретных видов медицинских электрических изделий.
Первоначальный подход МЭК заключался в том. чтобы подготовить отдельные стандарты «безопасности» и «функциональных характеристик» для медицинских электрических изделий. Это было естественным продолжением исторического подхода, принятого на национальном и международном уровне, с другими стандартами для электрического оборудования (например, для бытового оборудования). где основная физическая безопасность регулируется обязательными стандартами, а другие технические характеристики регулируются рыночным давлением. В этом контексте было сказано: «Способность электрочайника кипятить воду не имеет решающего значения для его безопасного использования!»
В настоящее время признано, что это утверждение не относится ко многим элементам медицинских электрических изделий, и пользователи должны опираться на стандарты, чтобы обеспечить его основные функциональные характеристики, а также основную безопасность. Медицинские организации в равной степени обеспокоены способностью оборудования работать правильно и предотвращением других опасностей.
Хотя структура и содержание первого и второго изданий МЭК 601-1 были ограничены вопросами основной безопасности, растущее клиническое участие в подготовке частных стандартов подтвердило, что для многих типов медицинских электрических изделий пользователь должен зависеть от формальных стандартов для обеспечения надлежащих функциональных характеристик, а также основной безопасности. К таким областям относится точность, с которой оборудование контролирует доставку энергии или терапевтических веществ пациенту, или обрабатывает и отображает физиологические данные, которые влияют на ведение пациента.
Исходя из признания того, что разделение «безопасности» и «функциональных характеристик» несколько неуместно при устранении опасностей, возникающих в результате несовершенной конструкции медицинского электрического изделия, многие частные стандарты в серии МЭК 601-2-хх охватывают ряд основных требований к основным функциональным характеристикам, которые не могут быть непосредственно оценены пользователем без применения таких стандартов. Тем не менее текущая серия МЭК 601 вкпючает гораздо меньше требований к функциональной безопасности, чем к основной безопасности.
Также существует и получает все большую поддержку мнение о том. что все требования к безопасности и основным функциональным характеристикам для медицинских электрических изделий должны быть сгруппированы в рамках одного набора международных стандартов. Предложенная европейская директива о медицинских изделиях также подчеркивает необходимость единой серии стандартов, охватывающих основные требования для всех таких продуктов.
История первого издания МЭК 513 и серии МЭК 601 приведена в приложении Е.
Предполагается, что второе издание МЭК 513 послужит руководством для разработки третьего издания МЭК 601-1 и последующей разработки стандартов МЭК 601-1-хх и МЭК 601-2-хх.
Для достижения согласованности с международными стандартами, учета текущих ожиданий в сообществе здравоохранения и согласования с разработками в МЭК 601-2-хх второе издание МЭК 513 включает в себя два основных изменения:
- первое изменение состоит в том. что понятие «безопасность» было расширено по сравнению с простыми, основными положениями безопасности в первом и втором изданиях МЭК 601-1 путем включения в него основных функциональных характеристик (например, точности оборудования для физиологического мониторинга);
- второе изменение заключается в том. что при определении минимальных требований безопасности предусматривается оценка соответствия процесса проектирования, которая позволит обеспечить надлежащую альтернативу лабораторным испытаниям с конкретными критериями «годен/не годен» (например, при оценке безопасности таких новых технологий, как программируемые электронные системы).
Второе издание отменяет и заменяет первое издание, опубликованное в 1976 году.
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОСНОВНЫЕ ПРИНЦИПЫ БЕЗОПАСНОСТИ ЭЛЕКТРИЧЕСКОГО ОБОРУДОВАНИЯ, ПРИМЕНЯЕМОГО В МЕДИЦИНСКОЙ ПРАКТИКЕ
Basic aspects of the safety philosophy of electrical equipment used in medical practice
Дата введения — 2021—03—01
1 Область применения
В настоящем стандарте приведены основные положения, которые необходимо учитывать при разработке стандартов для обеспечения безопасности медицинских электрических изделий.
Примечание — Настоящий стандарт полностью следует рекомендациям Руководства ИСО/МЭК 5111 и расширяет вопросы, которые являются уникальными или имеют решающее значение для применения медицинских электрических изделий.
Настоящий стандарт в первую очередь предназначен для использования:
- теми, кто разрабатывает стандарты на проектирование, установку и использование медицинских электрических изделий.
- регулирующими органами здравоохранения, испытательными центрами и другими организациями, ответственными за внедрение стандартов для медицинских электрических изделий:
- изготовителями медицинских электрических изделий;
- теми, кто собирает системы, включающие медицинские электрические изделия.
Настоящий стандарт также может помочь:
- пользователям или операторам медицинских электрических изделий:
- администраторам больниц;
- нетехническому персоналу, занимающемуся закупкой медицинских электрических изделий;
- преподавателям и студентам;
- больничным и клиническим инженерам, отвечающим за строительство медицинских организаций или за закупку или обслуживание медицинских электрических изделий.
2 Понятия
Следующий материал не предназначен для введения новых определений. Это общее обсухздение терминологии и понятий, используемых в настоящем стандарте. Если конкретный термин определен в международной публикации, определение воспроизводится после соответствующего обсуждения в настоящем стандарте.
2.1 Основная безопасность
Основная безопасность обеспечивает защиту от прямых физических опасностей, когда медицинское электрическое изделие используется в нормальных или других достаточно предсказуемых условиях (например, механическая прочность, ток утечки и пожарная безопасность).
Руководство ИСО/МЭК 51:1990 «Руководство по включению вопросов безопасности в стандарты».
Издание официальное
2.2 Эффективность
Эффективность элемента медицинского электрического изделия заключается в его способности выполнять предусмотренные функции (например, точность доставленной энергии от кардиодефибриллятора).
Этот термин определен в IEV11 следующим образом:
Эффективность (результативность): способность элемента удовлетворять потребность в заданных количественных характеристиках.
2.3 Действенность
Действенность элемента медицинского электрического изделия заключается в его способности достигать ожидаемый результат в ходе диагностики или лечения (например, способность кардиодефибриллятора обнаруживать фибрилляцию).
2.4 Основные функциональные характеристики
Эта концепция менее понятна, чем основная безопасность. Многие элементы медицинского электрического изделия жизненно необходимы или имеют решающее значение для правильной диагностики. Медицинское электрическое изделие, не работающее надлежащим образом, может представлять неприемлемый риск, и, следовательно, оно может быть небезопасным. Например, большинство людей считают небезопасным дефибриллятор, который не разряжается. Кроме того, неправильный диагноз в результате неисправности оборудования может привести к неправильному лечению.
Для медицинских электрических изделий различие между стандартами безопасности и стандартами на функциональные характеристики часто неясно, и возникает концепция основных функциональных характеристик.
Как правило, основные функциональные характеристики ограничивают или устанавливают критические параметры, такие как частотная характеристика диагностического электрокардиографа и выходная энергия кардиодефибриллятора. Тем не менее в некоторых случаях основные функциональные характеристики лучше всего рассматривать с помощью требований к раскрытию информации.
2.5 Основные требования
Невозможно провести полное различие между безопасностью, эффективностью и действенностью медицинского электрического изделия. Успешная диагностика и лечение, и даже жизнь пациента могут быть поставлены под угрозу устройством, которое:
a) физически опасно:
b) не работает в соответствии с указаниями изготовителя, или же
c) неправильно используется.
Соответственно, в настоящем стандарте понятие «основные требования» определяются как сочетание понятий «основная безопасность» (см. 2.1) и «основные функциональные характеристики» (см. 2.4).
2.6 Пригодность для использования
Некоторые аспекты производительности, не влияющие на основные функциональные характеристики, могут определять пригодность для использования. Пригодность для использования может включать вопросы, касающиеся эффективности или надежности, и требовать раскрытия достаточного количества информации, чтобы позволить потребителю оценить пригодность конструкции для предполагаемого применения.
2.7 Опасность
Обычно слово «опасность» относится к источнику риска или угрозы. В настоящем стандарте слово «опасность», как правило, используется для описания ситуации потенциального вреда людям или имуществу (то есть состояния, ситуации, процедуры, объекта или материала, способного причинить вред).
МЭК 50(191 ):1990 * Международный электротехнический словарь. Глава 191. Надежность и качество обслуживания» (191-02-01).
Опасность определяется в Руководстве ИСО/МЭК 51 как: «Потенциальный источник вреда».
2.8 Обеспечение качества
Обеспечение качества (QA) включает в себя надлежащую производственную практику (GMP) и контроль качества (ОС).
Обеспечение качества определено в ИСО S4021) как: «Все запланированные и систематические действия, необходимые для обеспечения достаточной уверенности в том. что продукт или услуга будут соответствовать заданным требованиям к качеству».
Контроль качества определен в ИСО 84021) как: «Операционные методы и действия, которые используются для выполнения требований к качеству».
2.9 Риск
Применение медицинского электрического изделия может привести к «прямым» рискам, когда несовершенная конструкция, отказ или неправильное использование оборудования приведут к физическому ущербу для пациента, оператора, оборудования или окружающей среды. Другие «косвенные» риски, возникающие из-за некорректной работы оборудования, могут отрицательно повлиять на пациента (например, выход из строя систем жизнеобеспечения и неправильная диагностика).
Риск определяется в Руководстве ИСО/МЭК 51 как: «Вероятная частота возникновения опасности. вызывающей вред, и степень серьезности ущерба».
2.10 Уровень риска
Уровень риска является качественной мерой риска (см. таблицы 1 и 2).
2.11 Безопасность
Обычно слово «безопасность» означает свободу от опасности или риска. Абсолютная безопасность — это полная свобода от условий и обстоятельств, которые могут причинить вред.
Нецелесообразно ожидать абсолютной безопасности при использовании медицинского электрического изделия. В настоящем стандарте слово «безопасность» обычно относится к свободе от недопустимого риска.
«Безопасность» использовалась в первом и втором изданиях МЭК 601-1 для обозначения «основной» безопасности, связанной с «прямыми» рисками, когда несовершенная конструкция или неправильное использование, или отказ оборудования приводят к физическому ущербу для пациента, оператора, оборудования или окружающей среды.
Тем не менее «безопасность» также используется в настоящем стандарте в связи с более широким спектром «косвенных» рисков, при которых пациент может пострадать из-за неисправности оборудования или оборудования, которое не подходит для предусмотренного назначения. Предполагается. что «безопасность» будет использоваться в этом более широком смысле в будущих изданиях МЭК 601-1.
Безопасность определяется в Руководстве ИСО/МЭК 51 следующим образом: «Свобода от недопустимого риска причинения вреда» (см. также пояснительные примечания в Руководстве ИСО/МЭК 51).
2.12 Уровень целостности безопасности
Уровень целостности безопасности — это мера уровня уверенности в том. что компонент или система будут функционировать должным образом или, в случае неисправности, будут работать безопасным образом. Целостность связана с опасными неисправностями и учитывает нестохастические аспекты, такие как ошибки проектирования, и стохастические аспекты, такие как отказы компонентов.
2.13 Уровень серьезности (опасности)
Уровень серьезности является качественным показателем возможных последствий опасного события. В случае медицинского электрического изделия, как правило, нет необходимости различать более четырех уровней:
- катастрофический, если он может привести к гибели множества людей с серьезными травмами;
ИСО 8402:1986 «Качество. Словарь».
- критический, если он может привести к смерти или серьезным травмам;
- предельный, если он может привести к травме; а также
- незначительный, когда потенциальная возможность получения травмы мала или отсутствует.
2.14 Пользователь/оператор
Эти термины определены в МЭК 601-1:1988 следующим образом, чтобы различать лицо, которое (или организацию, которая) несет ответственность за оборудование, и лицо, которое фактически использует его во время нормальной работы:
- ПОЛЬЗОВАТЕЛЬ — авторитетный специалист, ответственный за использование и техническое обслуживание ОБОРУДОВАНИЯ (пункт 2.12.13):
- ОПЕРАТОР — лицо, управляющее ОБОРУДОВАНИЕМ (пункт 2.12.17).
3 Опасность
3.1 Причины опасностей
Применение медицинского электрического изделия может представлять опасность из-за ряда причин, включая следующие:
a) неспособность устройства выполнять предназначенную ему функцию (например, неспособность аппарата искусственной вентиляции легких вентилировать пациента, неспособность монитора апноэ выдать сигнал тревоги);
b) неправильная функция (например, чрезмерная доставка лекарств инфузионным насосом, чрезмерная температура в детском инкубаторе, неточное измерение физиологического параметра);
c) энергии, доставляемые при нормальном функционировании, например:
- ток утечки или функциональный ток. протекающий от кардиодефибриллятора или от блока высокочастотного хирургического оборудования по непредусмотренным путям у пациента или оператора;
- непреднамеренное облучение пациента или оператора;
- воздействие на пациента или оператора ультразвуковой энергией или ускоренными элементарными частицами;
- чрезмерный нагрев или охлаждение пациента:
d) неисправности оборудования, например:
- пожар, поражение электрическим током, взрыв, отказ деталей;
- чрозмерное ионизирующее или неионизирующее излучение в результате неисправности оборудования. утечки или чрезмерного воздействия;
* чрезмерные температуры контактных поверхностей, приводящие к ожогам:
e) пожар или взрыв в результате воспламенения горючего материала в непосредственной близости от медицинского электрического изделия;
0 механические неисправности в нормальных условиях и условиях нарушения;
д) неправильная установка медицинского электрического изделия, например:
- ненадлежащее заземление элемента медицинского электрического изделия класса I;
- наличие опасных поверхностей, углов или ребер:
- физическая нестабильность.
h) неправильный выбор медицинского электрического изделия (например, использование медицинского электрического изделия, имеющего рабочую часть типа BF или В для проведения внутрисер-дечной процедуры);
i) неправильное использование медицинского электрического изделия (например, выбор неправильной шкалы энергии при использовании имплантируемого кардиодефибриллятора);
j) электромагнитные помехи (например, помехи дисплея ЭКГ из-за высокочастотного хирургического оборудования, генерация помех соседнему медицинскому электрическому изделию под действием сильных магнитных полей, излучаемых дисплеем);
k) выделение едких, ядовитых или горячих жидкостей или газов или контакт с биологически небезопасными материалами,
l) удаление материалов и побочных продуктов, возникающих в результате использования медицинского электрического изделия (например, удаление радиоактивных веществ, используемых в ядер-ной медицине).