ГОСТ ISO 18416-2018
Продукция парфюмерно-косметическая. Микробиология. Обнаружение Candida albicans
Устанавливает общие требования к методу обнаружения и идентификации специфического микроорганизма Candida albicans в парфюмерно-косметической продукции. Микроорганизмы, рассматриваемые в стандарте, в зависимости от применяемой национальной практики или требований национальных регламентов в разных странах могут относиться или не относиться к специфическим.
- Заменяет ГОСТ ISO 18416-2013 «Продукция парфюмерно-косметическая. Микробиология. Обнаружение Candida albicans» на территории Республики Беларусь
Оглавление
Введение
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Сущность метода
5 Разбавители и питательные среды
5.1 Общие положения
5.2 Разбавитель для дрожжевой суспензии (раствор хлорида натрия с триптоном)
5.2.1 Общие положения
5.2.2 Состав
5.2.3 Приготовление
5.3 Питательные среды
5.3.1 Общие положения
5.3.2 Агаризованная среда для теста на пригодность (см. раздел 11)
5.3.3 Бульон для обогащения
5.3.4 Селективная агаризованная среда для выделения Candida albicans
5.3.5 Кукурузный агар с 1 % полисорбата 80
6 Инструменты и стеклянная лабораторная посуда
7 Штаммы микроорганизмов
8 Обращение с парфюмерно-косметической продукцией и лабораторными пробами
9 Методика
9.1 Общие рекомендации
9.2 Приготовление исходной суспензии в бульоне для обогащения
9.2.1 Общие положения
9.2.2 Водорастворимая продукция
9.2.3 Нерастворимая в воде продукция
9.2.4 Фильтруемая продукция
9.3 Инкубация инокулированного бульона для обогащения
9.4 Обнаружение и идентификация Candida albicans
9.4.1 Выделение
9.4.2 Идентификация Candida albicans
10 Представление результатов (обнаружение Candida albicans)
11 Нейтрализация антимикробных свойств продукции
11.1 Общие положения
11.2 Приготовление инокулята
11.3 Пригодность метода обнаружения
11.3.1 Процедура
11.3.2 Интерпретация результатов теста на пригодность
12 Протокол испытания
Приложение А (справочное) Другие питательные среды
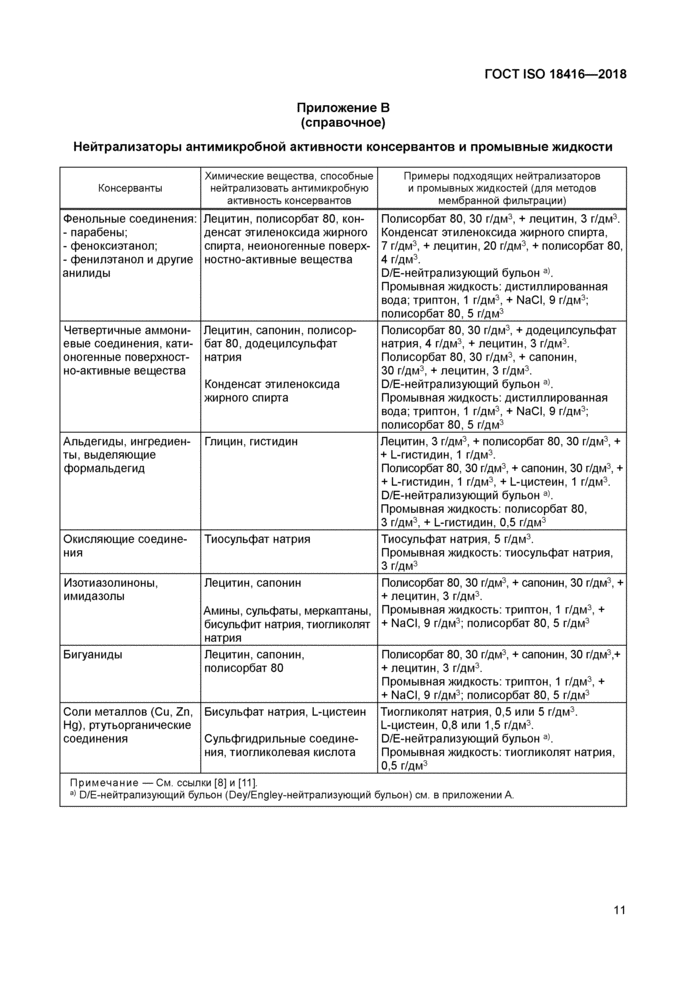
Приложение В (справочное) Нейтрализаторы антимикробной активности консервантов и промывные жидкости
Библиография
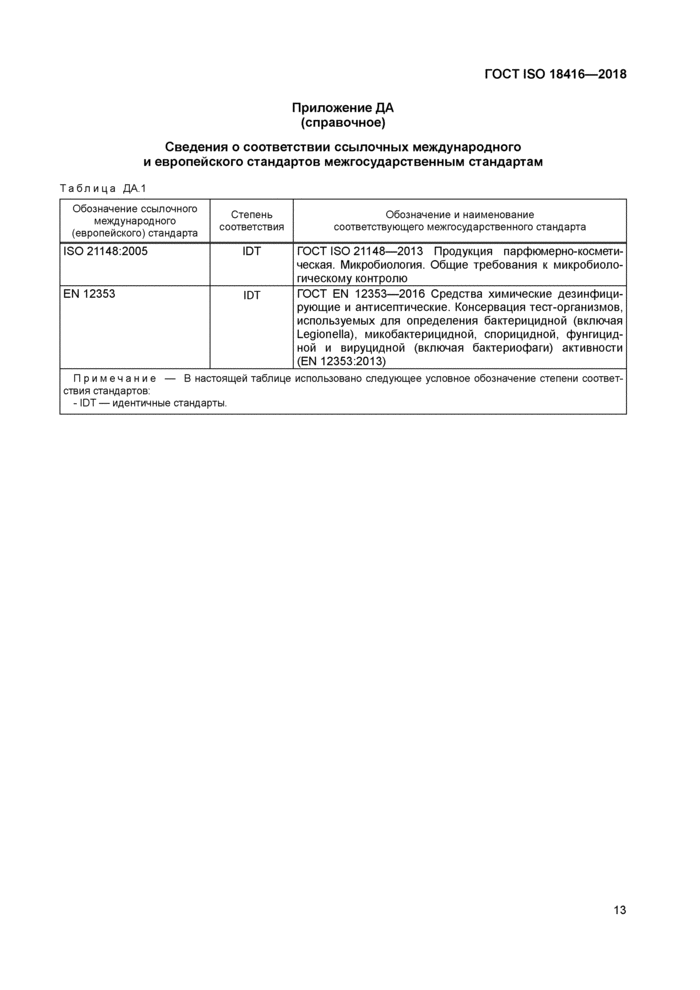
Приложение ДА (справочное) Сведения о соответствии ссылочных международного и европейского стандартов межгосударственным стандартам
19 страниц
| Дата введения | 27.07.2018 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Организации:
| 27.07.2018 | Утвержден | Евразийский совет по стандартизации, метрологии и сертификации | 110-П |
|---|---|---|---|
| Разработан | БелГИМ |
Perfume and cosmetic products. Microbiology. Detection of Candida albicans
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15
стр. 16

стр. 17
стр. 18

стр. 19
ЕВРАЗИЙСКИЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(ЕАСС)
EURO-ASIAN COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(EASC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ГОСТISO 18416— 2018
ПРОДУКЦИЯ ПАРФЮМЕРНО-КОСМЕТИЧЕСКАЯМикробиология. Обнаружение Candida albicans
(ISO 18416:2015, IDT)
Издание официальное
Минск
Евразийский совет по стандартизации, метрологии и сертификации
Предисловие
Евразийский совет по стандартизации, метрологии и сертификации (ЕАСС) представляет собой региональное объединение национальных органов по стандартизации государств, входящих в Содружество Независимых Государств. В дальнейшем возможно вступление в ЕАСС национальных органов по стандартизации других государств.
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-2015 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2015 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки. принятия, обновления и отмены».
Сведения о стандарте
1 ПОДГОТОВЛЕН республиканским унитарным предприятием «Белорусский государственный институт метрологии» (БелГИМ) на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Госстандартом Республики Беларусь
3 ПРИНЯТ Евразийским советом по стандартизации, метрологии и сертификации по результатам голосования в АИС МГС (протоколом от 27 июля 2018 г. №110-П)
|
За принятие стандарта проголосовали: | |||||||||||||||||||||
|
4 Настоящий стандарт идентичен международному стандарту ISO 18416:2015 «Косметика. Микробиология. Обнаружение Candida albicans» («Cosmetics — Microbiology — Detection of Candida albicans». IDT).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для увязки с наименованиями, принятыми в существующем комплексе межгосударственных стандартов.
Международный стандарт разработан техническим комитетом 1ЭОЯС 217 «Косметика» Международной организации по стандартизации (ISO).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международного и европейского стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВЗАМЕН ГОСТ ISO 18416-2013
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств пубпикуется в указатепях национальных (государственных) стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных (государственных) органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация также будет опубликована в сети Интернет на сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
Исключительное право официального опубликования настоящего стандарта на территории указанных выше государств принадлежит национальным (государственным) органам по стандартизации этих государств.
Проводят дальнейшее изучение подозрительных колоний, выделенных на декстрозном агаре Са-буро с хлорамфениколом. Наличие Candida albicans может быть подтверждено и другими подходящими культуральными и биохимическими тестами.
9.4.2.2 Окраска по Граму
Следуют процедуре, установленной в ISO 21148
Под микроскопом клетки Candida albicans фиолетовые, короткие овальные или удлиненные, иногда почкуются.
9.4.2.3 Образование ростковой трубки
9.4.2.3.1 Помещают 0.5-1 см3 сыворотки (эмбриональная телячья или лошадиная сыворотка) в небольшую пробирку
9 4.2.3.2 Эмульгируют небольшую часть дрожжевой колонии в сыворотке.
9.4.2.3.3 Инкубируют на водяной бане при температуре (37 ± 1) °С в течение 1.5-2 ч или в термостате при температуре (37 ± 2) °С в течение 3 ч.
9 4.2.3.4 Помещают каплю сыворотки на предметное стекло, закрывают покровным стеклом и исследуют под микроскопом образование ростковой трубки.
Ростковые трубки появляются в виде цилиндрических волокон (нитей) из бластопор без каких-либо сужений (перетяжек) в месте возникновения и без утолщений вдоль длины волокна.
Образование ростковых трубок является признаком присутствия Candida albicans.
Если ростковые трубки не были сформированы, колонии исследуют на образование гифов, псев-догифов и хламидоспор согласно 9.4.2.4.
9.4.2.4 Культивирование на кукурузном агаре с 1 % полисорбата 80
9.4.2.4.1 Петлей делают посев небольшой части дрожжевой колонии на поверхности среды через центр чашки Петри методом штриха. На штрих помещают стерильное покровное стекло.
9 4.2.4.2 Инкубируют при температуре (32.5 ± 2.5) X до 3 дн.
9.4.2.4.3 Через 24 ч снимают крышку чашки Петри и изучают полученный рост через покровное стекло под микроскопом с увеличением от 100* до 400*.
Candida albicans образует крупную, сильно преломляющую свет, толстостенную хламидоспору. которая может быть расположена терминально или на коротких боковых ветвях.
10 Представление результатов (обнаружение Candida albicans)
Если при идентификации колоний подтверждено наличие данного вида, результат представляют следующим образом: бактерии вида Candida albicans обнаружены в количестве S пробы.
Если после обогащения роста не наблюдалось и/или если идентификация колоний не подтвердила наличие данного вида, результат представляют следующим образом: бактерии вида Candida albicans не обнаружены в количестве S пробы.
11 Нейтрализация антимикробных свойств продукции
11.1 Общие положения
Описанные ниже процедуры демонстрируют, что микроорганизмы могут расти в условиях проведения анализа.
11.2 Приготовление инокулята
Перед проведением испытания засевают поверхность агаризованной среды с соево-казеиновым гидролизатом (SCDA) или другой подходящей среды (неселективной и не оказывающей нейтрализующего действия) штаммом Candida albicans. Инкубируют чашку при температуре (32.5 ± 2.5) X в течение 18-24 ч.
Стерильной петлей штриховыми движениями снимают с поверхности среды выросшие колонии и ресуспендируют в разбавителе для приготовления стандартной суспензии с концентрацией 1x10е КОЕ/см3 (например, используя спектрофотометр, см. ISO 21148:2005 (приложение С)).
Стандартную суспензию и ее разведения используют в течение 2 ч.
11.3 Пригодность метода обнаружения
11.3.1 Процедура
11.3.1.1 В пробирках, содержащих по 9 см3 разбавителя, готовят разведения стандартной суспензии, чтобы в конечном счете получить концентрацию, равную 100-500 КОЕ/см3. Для подсчета окончательного количества жизнеспособных микроорганизмов в разведенной стандартной суспензии вносят
1 см3 суспензии в чашку Петри и заливают от 15 до 20 см3 расплавленной агаризованной среды, которая выдерживалась на водяной бане при температуре, не превышающей 48 °С. Дают среде в чашках застыть, а затем инкубируют при температуре (32.5 ± 2.5) °С в течение 20-24 ч.
11.3.1.2 Готовят в двух повторностях исходную суспензию пробы в пробирке или колбе, соблюдая выбранные для анализа условия (не менее 1 г или 1 см3 испытуемой продукции и определенный объем бульона для обогащения). Если используют метод мембранной фильтрации, то фильтруют в двух повторностях не менее 1 см3 испытуемой продукции и переносят каждый мембранный фильтр в пробирку или колбу, содержащую бульон для обогащения в условиях, выбранных для проведения испытаний.
11.3.1.3 Стерильно вносят 0.1 см3 разведенной стандартной суспензии (см. 11.3.1.1) микроорганизмов в одну пробирку или колбу (тест на пригодность). Перемешивают, затем инкубируют обе пробирки или колбы (тест на пригодность и контроль неконтаминированной пробы) при температуре (32,5 ± 2.5) °С в течение 20-24 ч.
11.3.1 4 Проводят выделение для каждой пробирки или колбы (тест на пригодность и контроль неконтаминированной пробы). Используя стерильную петлю, делают высев инкубированной смеси методом истощающего штриха (при таких же условиях, как в тесте) на поверхность декстрозного агара Сабуро с хлорамфениколом, разлитого в чашки Петри (диаметром от 85 до 100 мм) в количестве приблизительно от 15 до 20 см3. Инкубируют чашки при температуре (32.5 ± 2.5) °С в течение 24-48 ч.
11.3.2 Интерпретация результатов теста на пригодность
Проверяют, что разведенная стандартная суспензия дрожжей (см. 11.3.1.1) содержит от 100 до 500 КОЕ/см3.
Нейтрализация подтверждается и метод обнаружения является удовлетворительным, если ростовые характеристики Candida albicans наблюдаются на чашке, которая использовалась в тесте на пригодность, и если отсутствует рост на контрольной чашке.
Если обнаружен рост на контрольной чашке пробы (контаминированная продукция), то нейтрализация подтверждается и метод обнаружения является удовлетворительным, если дрожжи вида Candida albicans выделены на чашке, используемой в тесте на пригодность.
Отсутствие роста на чашках, используемых в тесте на пригодность, указывает на то, что антимикробная активность все еще не нейтрализована и требуется изменение условий метода путем увеличения объема питательного бульона (при этом количество продукции остается тем же), или путем добавления большего количества инактивирующего вещества в бульон для обогащения, или путем комбинации изменений, которые позволят обеспечить рост Candida albicans.
Если все еще невозможно выделить жизнеспособные культуры несмотря на введение подходящих инактивирующих веществ и значительное увеличение бульона, как описано выше, то это указывает на малую вероятность контаминации продукции дрожжами вида Candida albicans.
12 Протокол испытания
Протокол испытания должен содержать следующую информацию:
a) ссылку на настоящий стандарт:
b) всю информацию, необходимую для полной идентификации продукции;
c) примененный метод;
d) полученные результаты:
e) все детали приготовления исходной суспензии;
0 описание метода с указанием использованных нейтрализующих веществ и питательных сред;
д) подтверждение пригодности метода, даже если испытание было выполнено отдельно;
h) любые особенности, не указанные в настоящем стандарте или рассматриваемые как необязательные, вместе с подробностями, которые могли повлиять на полученные результаты.
Другие питательные среды
А.1 Другие бульоны для обогащения
А.1.1 Жидкая среда с соево-казеиновым гидролизатом А.1.1.1 Состав
- Панкреатический гидролизат казеина — 17,0 г;
- папаиновый перевар соевой муки — 3.0 г;
- хлорид натрия — 5,0 г;
- двузамещенный фосфат калия — 2.5 г;
- декстроза — 2.5 г;
- вода — 1 ООО см3.
А.1.1.2 Приготовление
Растворяют все компоненты (или готовую сухую среду) в воде, нагревая при необходимости. Разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
После стерилизации и охлаждения pH должен быть равен 7.3 ± 0.2 при измерении при комнатной температуре.
А.1.2 Модифицированный летиновый (Letheen) бульон А.1.2.1 Состав
- Пептический перевар мяса — 20,0 г;
- панкреатический гидролизат казеина — 5.0 г;
- говяжий экстракт — 5.0 г;
- дрожжевой экстракт — 2.0 г;
- лецитин — 0,7 г;
- полисорбат 80 — 5.0 г;
- хлорид натрия — 5.0 г;
- бисульфит натрия — 0.1 г;
- вода — 1 000 см3.
А.1.2.2 Приготовление
Растворяют последовательно в кипящей воде полисорбат 80 и лецитин до их полного растворения. Растворяют другие компоненты, перемешивая при нагревании. Перемешивают осторожно во избежание пенообразования. Разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
После стерилизации и охлаждения pH должен быть равен 7.2 ± 0.2 при измерении при комнатной температуре.
А.1.3 Глюкозо-пептонная среда с лецитином и полисорбатом 80 (бульон GPLP 80)
А.1.3.1 Состав
- Глюкоза — 20.0 г;
- дрожжевой экстракт — 2,0 г;
- сульфат магния — 0.5 г;
- пептон — 5.0 г.
- двузамещенный фосфат калия — 1.0 г;
- лецитин — 1.0 г;
- полисорбат 80 — 7.0 г;
- вода — 1 000 см3.
А.1.3.2 Приготовление
Растворяют последовательно компоненты или готовую сухую среду в кипящей воде до их полного растворения. Разливают среду в подходящую пабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
После стерилизации и охлаждения pH должен быть равен 5.7 ± 0.2 при измерении при комнатной температуре.
А.1.4 Нейтрализующий бульон D/Е (нейтрализующий бульон Dey/Engley) [5]
А. 1.4.1 Состав
- Глюкоза — 10,0 г;
- соевый лецитин — 7.0 г;
- тиосульфат натрия 5-водный — 6,0 г;
- полисорбат 80 — 5.0 г;
- панкреатический гидролизат казеина — 5.0 г;
- бисульфит натрия — 2.5 г;
- дрожжевой экстракт — 2.5 г;
- тиогликолят натрия — 1.0 г;
- бромкрезол пурпуровый — 0,02 г;
- вода — 1 000 см3.
А.1.4.2 Приготовление
Растворяют последовательно все указанные компоненты или готовую сухую среду в кипящей воде до их полного растворения. Разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
После стерилизации и охлаждения pH должен быть равен 7.6 ± 0.2 при измерении при комнатной температуре.
А.1.5 Среда с соево-казеиновым гидролизатом, лецитином и полисорбатом 80 (бульон SCDLP 80)
А. 1.5.1 Состав
- Казеиновый пептон — 17,0 г;
- соевый пептон — 3.0 г;
- хлорид натрия — 5,0 г;
- двузамещенный фосфат калия — 2.5 г;
- глюкоза — 2,5 г;
- лецитин — 1.0 г;
- полисорбат 80 — 7,0 г;
- вода — 1 000 см3.
А.1.5.2 Приготовление
Растворяют последовательно все указанные компоненты или готовую сухую среду в кипящей воде до их полного растворения. Разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации pH должен быть равен 7.6 ± 0,2 при измерении при комнатной температуре.
А.2 Другие агаризованные среды для теста на пригодность
А.2.1 Картофельный декстрозный агар (PDA)
А.2.1.1 Состав
- Картофельный экстракт — 4,0 г;
- декстроза — 20,0 г;
- агар— 15,0 г;
- вода — 1 000 см3.
А.2.1.2 Приготовление
Растворяют компоненты или готовую сухую среду в воде, перемешивая при нагревании. Разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
После стерилизации и охлаждения pH должен быть равен 5.6 ± 0.2 при измерении при комнатной температуре.
А.2.2 Агаризованная среда с соево-казеиновым гидролизатом (SCDA) или триптон-соевый агар (TSA)
А.2.2.1 Состав
- Панкреатический гидролизат казеина — 15,0 г;
- папаиновый перевар соевой муки — 5,0 г;
- хлорид натрия — 5.0 г;
- агар— 15,0 г;
- вода — 1 000 см3.
А.2.2.2 Приготовление
Растворяют компоненты или готовую сухую среду в воде, перемешивая при нагревании. Разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
После стерилизации и охлаждения pH должен быть равен 7,3 ± 0,2 при измерении при комнатной температуре.
А.З Другие селективные агаризованные среды. Картофельный декстрозный агар с антибиотиками
А.3.1 Состав
- Картофельный экстракт — 4,0 г;
- декстроза — 20,0 г;
- агар — 15,0 г;
- хлорамфеникол — 0,05 г;
- вода — 1 000 см3.
А.3.2 Приготовление
Смешивают все компоненты и разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации и охлаждения pH должен быть равен 5.6 ± 0.2 при измерении при комнатной температуре.
Вместо хлорамфеникола можно использовать 0,10 г бензилпенициллина калия и 0,10 г тетрациклина на кубический дециметр среды, которые добавляются в качестве стерильного раствора непосредственно перед использованием среды.
|
Нейтрализаторы антимикробной активности консервантов и промывные жидкости | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
Библиография
(1] COLIPA, Guidelines on Microbial Quality Management, 1997, published by the European Cosmetic, Toiletry and Perfumery Association (COLIPA)
(Руководство по менеджменту качества в микробиологии)
(2] CTFA, Microbioloey Guidelines. 2007, published by the Cosmetic, Toiletry and Fragrance Association. ISBN 1-882621-32-8
(Руководство no микробиологии)
(3] EP, Microbiological Examination of non-sterile products, 4th edition, 2002, published by the European Pharmacopoeia
(Микробиологическая экспертиза нестерипьной продукции)
(4] FDA, Bacteriological Analytical Manual. 8th edition, 1995 published by the U.S. Food and Drug Administration. http://www.cfsan.fda.gov/~ebam/bam-23.html
(Руководство no бактериологическому анализу)
(5] JP14. General Tests - Microbial Limit Test. 2001. published by the Japanese Pharmacopoeia (Общие испытания. Испытания на предельное содержание микроорганизмов)
(6] USP 28, Microbial Limit Test (61), 2005, published by the U.S. Pharmacopoeia (Испытания на предельное содержание микроорганизмов)
(7] ATLAS. R.M., Handbook of Microbiological Media. CRC Press. 1993, ISBN 0-8493-2944-2 (Справочник no микробиологическим средам)
(8] SINGER. S.. The Use of Preservative Neutralizers in Diluents and Plating Media. Cosmetics and Toiletries, 102, December 1987, p 55
(Применение нейтрализаторов-консервантов в разбавителях и средах для чашек Петри. Косметика и туалетные принадлежности)
(9] ISO 21149 Cosmetics — Microbiology — Enumeration and detection of aerobic mesophilic bacteria
(Косметика. Микробиология. Подсчет и обнаружение аэробных мезофильных бактерий)
[10] ISO 18415 Cosmetics — Microbiology — Detection of specified microorganisms and non-specified
microorganisms
(Косметика. Микробиология. Обнаружение специфических и неспецифических микроорганизмов)
[11] EN 1040 Chemical disinfectants and antiseptics — Basic bactericidal activity — Test method
and requirements (phase 1)
(Средства химические дезинфицирующие и антисептики. Базовая бактерицидная активность. Метод испытания и требования (этап 1))
[12] Kelly, J.P., and Funitiello, F, Candida albicans: A study of media designed to promote chlamydo-spore production, J. Lab. & Clin. Med., 53,1959, pp 807-809
(Candida albicans: Исследование сред, предназначенных для стимулирования образования хламидослор)
[13] Gordon, М.А., and Little. T.N., Effective dehydrated media with surfactants for identification of Candida albicans. J. of Int. Soc. for Human and Animal Mycol.. 2,1963, pp 171-175 (Эффективная дегидрированная питательная среда с поверхностно-активными веществами для определения Candida albicans)
[14] ISO 16212 Cosmetics — Microbiogy — Enumeration of yeast and mould
(Косметика. Микробиология. Подсчет дрожжей и плесневых грибов)
[15] Evans, E.G.V. and Richard. M.D., Medical mycology: a practical approach, Oxford University Press, 1989
(Медицинская микология: практический подход)
[16] ISO 29621, Cosmetics— Microbiology— Guidelines for the risk assessment and identification of microbiologically low-risk products
(Продукция косметическая. Микробиология. Руководящие указания по оценке риска и идентификации продукции с микробиологически низким риском)
Сведения о соответствии ссылочных международного и европейского стандартов межгосударственным стандартам
|
Таблица ДА1 | ||||||||||||
| ||||||||||||
УДК 665.57/.58:579.8.083.12(083.74)(476) МКС 07.100.99; 71.100.70 ЮТ
Ключевые слова; продукция парфюмерно-косметическая, микробиологические исследования, микроорганизмы. разбавители, питательные среды, штаммы микроорганизмов
Содержание
Введение..................................................................................................................................................V
1 Область применения............................................................................................................................1
2 Нормативные ссылки............................................................................................................................1
3 Термины и определения.......................................................................................................................2
4 Сущность метода..................................................................................................................................2
5 Разбавители и питательные среды.....................................................................................................2
5.1 Общие положения..........................................................................................................................2
5.2 Разбавитель для дрожжевой суспензии (раствор хлорида натрия с триптоном)........................2
5.2.1 Общие положения.................................................................................................................2
5.2.2 Состав.....................................................................................................................................2
5.2.3 Приготовление.......................................................................................................................3
5.3 Питательные среды........................................................................................................................3
5.3.1 Общие положения..................................................................................................................3
5.3.2 Агаризованная среда для теста на пригодность (см. раздел 11).........................................3
5.3.3 Бульон для обогащения..............................................................................................................3
5.3.4 Селективная агаризованная среда для выделения Candida albicans..................................4
5.3.5 Кукурузный агаре 1 % полисорбата 80....................................................................................4
6 Инструменты и стеклянная лабораторная посуда.............................................................................4
7 Штаммы микроорганизмов...................................................................................................................4
8 Обращение с парфюмерно-косметической продукцией и лабораторными пробами.....................4
9 Методика................................................................................................................................................5
9.1 Общие рекомендации....................................................................................................................5
9.2 Приготовление исходной суспензии в бульоне для обогащения.................................................5
9.2.1 Общие положения..................................................................................................................5
9.2.2 Водорастворимая продукция................................................................................................5
9.2.3 Нерастворимая в воде продукция........................................................................................5
9.2.4 Фильтруемая продукция........................................................................................................5
9.3 Инкубация инокулированного бульона для обогащения............................................................5
9.4 Обнаружение и идентификация Candida albicans.......................................................................5
9.4.1 Выделение.............................................................................................................................5
9.4.2 Идентификация Candida albicans.........................................................................................5
10 Представление результатов (обнаружение Candida albicans)..........................................................6
11 Нейтрализация антимикробных свойств продукции..........................................................................6
11.1 Общие положения.........................................................................................................................6
11.2 Приготовление инокулята.............................................................................................................6
11.3 Пригодность метода обнаружения...............................................................................................6
11.3.1 Процедура............................................................................................................................6
11.3.2 Интерпретация результатов теста на пригодность...........................................................7
12 Протокол испытания.............................................................................................................................7
Приложение А (справочное) Другие питательные среды.......................................................................8
Приложение В (справочное) Нейтрализаторы антимикробной активности консервантов
и промывные жидкости.................................................................................................11
Библиография..........................................................................................................................................12
Приложение ДА (справочное) Сведения о соответствии ссылочных международного
и европейского стандартов межгосударственным стандартам.............................13
Введение
Микробиологические исследования парфюмерно-косметической продукции должны выполняться на основании соответствующего анализа степени микробиологического риска, для того чтобы обеспечить ее качество и безопасность для потребителей.
Проведение анализа микробиологического риска обусловлено несколькими факторами, такими как:
- возможное изменение парфюмерно-косметической продукции;
- патогенность микроорганизмов;
- область нанесения парфюмерно-косметической продукции (волосы, кожа, глаза, слизистые оболочки);
- тип потребителей (взрослые, дети, включая детей до трех лет).
Для парфюмерно-косметической и другой аналогичной продукции важным является обнаружение кожных болезнетворных микроорганизмов, таких как Staphylococcus aureus, Pseudomonas aeruginosa и Candida albicans, так как они могут вызвать инфекции на коже человека или в области глаз. Обнаружение других видов микроорганизмов также может представлять интерес, поскольку эти микроорганизмы (включая индикаторы фекального загрязнения, например Escherichia coli) указывают на несоблюдение гигиенических требований в процессе производства.
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКЦИЯ ПАРФЮМЕРНО-КОСМЕТИЧЕСКАЯ Микробиология. Обнаружение Candida albicans
Perfume and cosmetic products Microbiology. Detection of Candida albicans
Дата введения
1 Область применения
Настоящий стандарт устанавливает общие требования к методу обнаружения и идентификации специфического микроорганизма Candida albicans в парфюмерно-косметической продукции. Микроорганизмы, рассматриваемые в настоящем стандарте, в зависимости от применяемой национальной практики или требований национальных регламентов в разных странах могут относиться или не относиться к специфическим.
Чтобы обеспечить качество и безопасность продукции для потребителя, рекомендуется проводить соответствующий анализ микробиологического риска с целью определения видов парфюмернокосметической продукции, к которой применим настоящий международный стандарт. К продукции с низкой степенью микробиологического риска (см. ISO 29621) относится продукция с низкой водной активностью, продукция на спиртовой основе, продукция с крайними значениями pH и т. д.
Метод, установленный в настоящем стандарте, основан на обнаружении Candida albicans в неселективной жидкой среде (бульоне для обогащения) с последующим выделением микроорганизмов на селективной агаризованной среде. Можно применять и другие методы в зависимости от требуемого уровня обнаружения.
Примечание — Для обнаружения Candida albicans субкультуры могут быть пересеяны на неселективные питательные среды с последующей поэтапной идентификацией (например, с помощью идентификационных тестов).
Из-за большого разнообразия парфюмерно-косметической продукции в рассматриваемой области применения отдельные детали данного метода могут быть непригодными для некоторых видов продукции (например, для нерастворимой в воде продукции). Могут применяться другие стандарты (например. ISO 18415). Можно применять другие методы (например, автоматизированные) вместо представленных тестов, при условии, что была доказана их равнозначность или подтверждена пригодность должным образом.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные стандарты. Для датированных ссылок применяют только указанное издание ссылочного стандарта. Для недатированных ссылок применяют последнее издание ссылочного стандарта (включая все его изменения).
ISO 21148:2005 Cosmetics — Microbiology — General instructions for microbiological examination (Косметика. Микробиология. Общие указания по микробиологическому контролю)
EN 12353 Chemical disinfectants and antiseptics — Preservation of test organisms used for the determination of bactericidal (including Legionella), mycobactericidal. sporicidal. fungicidal and virucidal (including bacteriophages) activity (Средства дезинфицирующие химические и антисептики. Консервация тест-микроорганизмов, используемых для определения бактерицидной (включая микроорганизмы Legionella), микобактерицидной, спорицидной, фунгицидной и вируцидной (включая бактериофаги) активности)
^Заменен на ISO 21148 2017. Однако для однозначного соблюдения требования настоящего стандарта, выраженного в датированной ссылке, рекомендуется использовать только указанное в этой ссылке издание
Издание официальное
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 продукция (product): Часть идентифицированной парфюмерно-косметической продукции, полученная лабораторией для испытания (анализа).
3.2 проба (sample): Часть продукции (не менее 1 г или 1 см3), которая используется при проведении испытаний для приготовления исходной суспензии.
3.3 исходная суспензия (initial suspension): Суспензия (или раствор) пробы в определенном объеме соответствующего бульона для обогащения.
3.4 разведение пробы (sample dilution): Разбавление исходной суспензии.
3.5 специфические микроорганизмы (specified microorganisms): Мезофильные аэробные бактерии или дрожжи, нежелательные в парфюмерно-косметической продукции и признанные патогенными для кожи микроорганизмами, которые способны причинить вред здоровью человека или являются признаком нарушения гигиенических требований в процессе производства.
3.6 Candida albicans Дрожжи, которые образуют выпуклые колонии от белого до бежевого и кремового цветов на поверхности селективной среды.
Примечание — Главными признаками для идентификации являются образование ростковой трубки и/или псевдомицелия и хламидоспоры при проведении испытания по методу, установленному в настоящем стандарте
3.7 бульон для обогащения (enrichment broth): Неселективная жидкая питательная среда, содержащая соответствующие нейтрализаторы и/или диспергирующие вещества, которая прошла проверку пригодности для испытуемой продукции.
4 Сущность метода
Первым этапом испытания является обогащение в неселективной питательной среде (бульоне) для увеличения числа микроорганизмов без риска ингибирования селективными ингредиентами, которые присутствуют в селективной/дифференциальной питательной среде.
Второй этап испытания (выделение) выполняется на селективной среде с последующей идентификацией.
Возможное ингибирование роста микроорганизмов пробой должно быть нейтрализовано для обеспечения обнаружения жизнеспособных микроорганизмов (1]. Во всех случаях и независимо от применяемой методики должна быть проверена и доказана нейтрализация антимикробных свойств продукции (см. раздел 11).
5 Разбавители и питательные среды
5.1 Общие положения
Общие указания приведены в ISO 21148 Если в настоящем стандарте упоминается вода, то это означает, что применяют дистиллированную или очищенную воду, как установлено в ISO 21148.
Бульон для обогащения используют для диспергирования пробы и для увеличения первоначальной микробной популяции. Он может содержать нейтрализаторы, если испытуемая проба обладает антимикробными свойствами. Эффективность нейтрализации должна быть доказана (см. раздел 11). Информация относительно подходящих нейтрализаторов приведена в приложении В
Бульон для обогащения (см. 5.3.3.1) или любой из бульонов, приведенных в приложении А. пригоден для контроля наличия Candida albicans в соответствии с методом настоящего стандарта при условии, что он прошел проверку пригодности в соответствии с разделом 11.
Можно использовать другие разбавители и питательные среды, если была доказана их пригодность.
5.2 Разбавитель для дрожжевой суспензии (раствор хлорида натрия с триптоном)
5.2.1 Общие положения
Разбавитель используют для приготовления суспензии дрожжей, применяемой в процедуре теста на пригодность (см. раздел 11).
5.2.2 Состав
- Триптон, панкреатический гидролизат казеина — 1,0 г;
- хлорид натрия — 8.5 г;
- вода — 10ОО см3.
5.2.3 Приготовление
Растворяют компоненты в воде, перемешивая при нагревании. Разливают в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
После стерилизации и охлаждения pH должен быть равен 7.0 ± 0.2 при измерении при комнатной температуре.
5.3 Питательные среды
5.3.1 Общие положения
Питательные среды могут быть приготовлены согласно описанию, приведенному ниже, или из сухих питательных сред согласно инструкциям изготовителя. Должны соблюдаться инструкции поставщика среды.
Примечание — Готовые к употреблению среды можно использовать, если их состав и/или ростовые свойства сопоставимы с приведенными ниже
5.3.2 Агаризованная среда для теста на пригодность (см. раздел 11)
5.3.2.1 Декстрозный агар Сабуро (SDA)
5.3.2.1.1 Состав
- Декстроза —40.0 г;
- пептический перевар животной ткани — 5.0 г;
- панкреатический гидролизат казеина — 5,0 г;
- агар —15.0 г;
- вода — 1000 см3.
5.3.2.1.2 Приготовление
Растворяют компоненты или готовую сухую среду в воде, перемешивая при нагревании. Разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 ®С в течение 15 мин. После стерилизации pH должен быть равен 5.6 ± 0.2 при измерении при комнатной температуре.
5.3.2.2 Другие агаризованные среды для теста на пригодность
Могут использоваться другие подходящие агаризованные среды (см. приложение А).
5.3.3 Бульон для обогащения
5.3.3.1 Бульон Эугон (Eugon) LT 100
5.3.3.1.1 Общие положения
Данная среда содержит ингредиенты — лецитин и полисорбат 80. которые нейтрализуют ингибирующие вещества, присутствующие в пробе, а также диспергирующий агент октоксинол 9.
5.3.3.1.2 Состав
- Панкреатический гидролизат казеина - 15,0 г;
- папаиновый перевар соевой муки - 5.0 г;
- L-цистин — 0.7 г;
- хлорид натрия — 4.0 г;
- сульфит натрия — 0.2 г;
- глюкоза — 5.5 г;
- яичный лецитин — 1.0 г;
- полисорбат 80 — 5.0 г;
- октоксинол 9 — 1.0 г;
- вода — 1 000 см3.
5.3.3.1.3 Приготовление
Растворяют последовательно компоненты (полисорбат, октоксинол 9 и яичный лецитин) в кипящей воде до их полного растворения. Растворяют остальные компоненты в воде, перемешивая их при нагревании. Разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
После стерилизации и охлаждения pH должен быть равен 7.0 ± 0,2 при измерении при комнатной температуре.
5.3.3.2 Другие бульоны для обогащения
Можно использовать и другие подходящие бульоны для обогащения (см. приложение А).
5.3.4 Селективная агаризованная среда для выделения Candida albicans
5.3.4.1 Декстрозный агар Сабуро с хлорамфениколом
5.3.4.1.1 Состав
- Декстроза — 40.0 г;
- пептический перевар животной ткани — 5.0 г;
- панкреатический гидролизат казеина — 5.0 г;
- хлорамфеникол — 0,050 г;
- агар — 15,0 г;
- вода — 1 000 см3.
5.3.4.1.2 Приготовление
Растворяют компоненты (включая хлорамфеникол) или готовую сухую среду в воде, перемешивая при нагревании. Разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации pH должен быть равен 5.6 ± 0.2 при измерении при комнатной температуре.
5.3.4.2 Другие селективные агаризованные среды
Можно использовать другие селективные агаризованные среды (см. приложение А).
5.3.5 Кукурузный агар с 1 % лолисорбата 80
5.3.5.1 Состав
■ Кукурузный экстракт — 50.0 г;
- агар — 15,0 г;
- полисорбат 80 — 10,0 г;
- вода — 1 000 см3.
5.3.5.2 Приготовление
Растворяют компоненты или готовую сухую среду в воде, перемешивая при нагревании. Разливают среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации pH должен быть равен 6.0 ± 0.2 при измерении при комнатной температуре.
6 Инструменты и стеклянная лабораторная посуда
Используют лабораторное оборудование, инструменты и стеклянную посуду 8 соответствии с ISO 21148.
7 Штаммы микроорганизмов
Для проверки условий проведения испытаний используют следующий референсный штамм: Candida albicans АТСС 11 10231 или эквивалентный штамм: IP21 48.72. или NCPF3' 3179. или NBRC 4) 1594, или КСТС 5) 17205. или другой эквивалентный штамм из национальной коллекции.
Культуру следует восстановить согласно процедурам, предоставляемым поставщиком референс-ного штамма.
Штамм может храниться в лаборатории согласно EN 12353.
8 Обращение с парфюмерно-косметической продукцией и лабораторными пробами
При необходимости продукцию, подлежащую испытаниям, хранят при комнатной температуре.
Не следует выдерживать в термостате, охлаждать и замораживать продукцию и пробы ни до. ни после анализа.
Отбор проб парфюмерно-косметической продукции для анализа следует проводить в соответствии с ISO 21148. Анализируют пробы согласно ISO 21148 и методике, приведенной в разделе 9.
’> АТСС — American Type Culture Collection (Американская коллекция типовых культур (микроорганизмов)) я IP — Institute Pasteur (Институт Пастера)
35 NCPF — National Collection of Pathogenic Fungi (Национальная коллекция патогенных грибов).
4> NBRC — National Biological Resource Center (Национальный центр биологических исследований).
КСТС — Korean Collection for Type Culture (Корейская коллекция типовых культур).
9 Методика
9.1 Общие рекомендации
Приготовление пробы, исходной суспензии и разведений выполняют с соблюдением условий асептики, используя стерильные материалы, оборудование. В случае приготовления исходной суспензии с использованием подходящего солюбилизирующего компонента время между окончанием приготовления суспензии и моментом ее внесения в бульон для обогащения не должно превышать 45 мин. если иное не оговорено в соответствующих протоколах или документах.
9.2 Приготовление исходной суспензии в бульоне для обогащения
9.2.1 Общие положения
Для обогащения вносят пробу (см. 3.2) хорошо перемешанной испытуемой продукции в количестве не менее 1 г или 1 см3 в бульон для обогащения объемом не менее 9 см3.
Отмечают S. точную массу или точный объем пробы.
При выполнении метода необходимо осуществлять контроль для гарантии того, что состав (с добавленным в конце приготовления нейтрализатором) и объем бульона удовлетворяют требованиям
(см. 11.3).
Примечание — В некоторых случаях (когда это возможно) фильтруют парфюмерно-косметическую продукцию через мембранный фильтр, который затем погружают в бульон для обогащения, что облегчает нейтрализацию антимикробных свойств продукции (см 11.3).
9.2.2 Водорастворимая продукция
Переносят количество S пробы продукции в подходящую посуду, содержащую соответствующий объем бульона.
9.2.3 Нерастворимая в воде продукция
Переносят количество S пробы продукции в подходящую лабораторную посуду, содержащую соответствующее количество солюбилизирующего компонента (например, лолисорбат 80).
Диспергируют пробу в солюбилизирующем компоненте и добавляют соответствующий объем бульона.
9.2.4 Фильтруемая продукция
Используют мембранный фильтр с номинальным размером пор не более 0,45 мкм.
Переносят количество S пробы продукции на мембранный фильтр в фильтровальном аппарате (см. ISO 21148). Сразу же фильтруют и промывают мембранный фильтр, используя определенные объемы воды и/или разбавителя.
Переносят и погружают мембранный фильтр в пробирку или колбу подходящего размера, содержащие соответствующий объем бульона.
9.3 Инкубация инокулированного бульона для обогащения
Инкубируют исходную суспензию, приготовленную в бульоне (см. 9.2), при температуре (32.5 ± 2.5) °С в течение не менее 20 ч. но не более 72 ч.
9.4 Обнаружение и идентификация Candida albicans
9.4.1 Выделение
Стерильной петлей делают пересев аликвоты инкубированного бульона для обогащения на поверхность декстрозного агара Сабуро с хлорамфениколом. чтобы получить изолированные колонии.
Переворачивают чашку Петри и инкубируют при температуре (32,5 ± 2,5) °С в течение не менее 24 ч, но не более 48 ч. Проверяют на наличие характерных колоний (см. таблицу 1).
|
Таблица 1 — Морфологические характеристики Candida albicans на селективной агаризованной среде | ||||
|
9.4.2 Идентификация Candida albicans
9.4.2.1 Общие положения
Candida albicans могут быть диморфными и способны создавать псевдогифы, некоторые — истинные гифы и грозди круглых бластоконидий, а также крупные толстостенные хламидоспоры. При низкой температуре окружающей среды данная культура может представлять эту псевдомицелиаль-ную форму, однако она может изменяться на одноклеточную форму при повышенных температурах.