ГОСТ ISO/TR 10993-33-2018
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 33. Руководство по испытаниям на генотоксичность. Дополнение к ISO 10993-3
(технический отчет - ТО) предназначен для предоставления информации, служащей основой при выборе тестов и руководства по проведению исследований ввиду явного различия во мнениях авторитетных органов на исследования генотоксичности.
Идентичен ISO/TR 10993-33:2015
Оглавление
1 Область применения
2 Выбор методов исследований
3 Рекомендуемые методы исследования
4 Методы in vitro для оценки генотоксичности
5 Методы in vitro для оценки генотоксичности
6 Метод оценки обратных мутаций на бактериях
6.1 Общие положения
6.2 Препараты
6.2.1 Бактерии
6.2.2 Среда
6.2.3 Метаболическая активация
6.2.4 Подготовка тестируемого образца
6.3 Условия исследования
6.3.1 Растворители
6.3.2 Исследуемые концентрации
6.3.3 Контроли
6.4 Проведение исследования
6.4.1 Обработка тестируемым образцом
6.4.2 Инкубация
6.4.3 Сбор данных
6.5 Данные и отчетность
6.5.1 Обработка результатов
6.5.2 Оценка и интерпретация результатов
6.5.3 Критерии обоснованного исследования
6.5.4 Отчет об исследовании
7 Метод оценки in vitro хромосомных аберраций на клетках млекопитающих
7.1 Общие положения
7.2 Препараты
7.2.1 Клетки
7.2.2 Среды и условия культивирования
7.2.3 Приготовление культур
7.2.4 Метаболическая активация
7.2.5 Подготовка тестируемого образца
7.3 Условия исследования
7.3.1 Растворители
7.3.2 Исследуемые концентрации
7.3.3 Контроли
7.4 Проведение исследования
7.4.1 Инкубация с тестируемым образцом или экстрактом и период наблюдения
7.4.2 Приготовление препаратов хромосом
7.4.3 Анализ
7.5 Данные и отчетность
7.5.1 Обработка результатов
7.5.2 Оценка и интерпретация результатов
7.5.3 Отчет об исследовании
8 Микроядерный тест in vitro на клетках млекопитающих
8.1 Общие положения
8.2 Препараты
8.2.1 Клетки
8.2.2 Среды и условия культивирования
8.2.3 Приготовление культур
8.2.4 Метаболическая активация
8.2.5 Применение цитохалазина B в качестве блокатора цитокинеза
8.2.6 Подготовка тестируемого образца
8.3 Условия исследования
8.3.1 Растворители
8.3.2 Исследуемые концентрации
8.3.3 Контроли
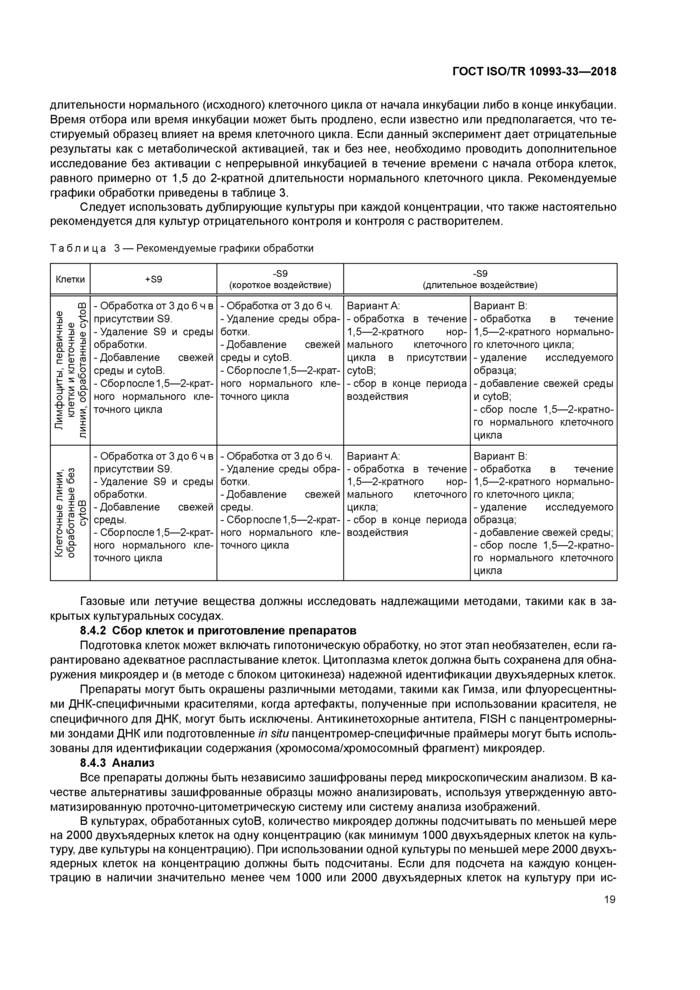
8.4 Проведение исследования
8.4.1 Инкубация с исследуемым образцом или экстрактом и период наблюдения
8.4.2 Сбор клеток и приготовление препаратов
8.4.3 Анализ
8.5 Данные и отчетность
8.5.1 Обработка результатов
8.5.2 Оценка и интерпретация результатов
8.5.3 Отчет об исследовании
9 Метод оценки in vitro генных мутаций на клетках млекопитающих с использованием клеток лимфомы (L5178Y) мышей
9.1 Общие положения
9.2 Препараты
9.2.1 Клетки
9.2.2 Среды и условия культивирования
9.2.3 Приготовление культур
9.2.4 Метаболическая активация
9.2.5 Подготовка исследуемого образца
9.3 Условия исследования
9.3.1 Растворитель/несущая среда
9.3.2 Исследуемые концентрации
9.3.3 Контроли
9.4 Проведение исследования
9.4.1 Общие положения
9.4.2 Обработка исследуемым образцом
9.4.3 Определение выживаемости, жизнеспособности и частоты мутаций
9.5 Данные и отчетность
9.5.1 Обработка результатов
9.5.2 Оценка и интерпретация результатов
10 Микроядерный тест in vitro на эритроцитах млекопитающих
10.1 Общие положения
10.2 Препараты
10.2.1 Выбор вида животных
10.2.2 Условия размещения и питания
10.2.3 Подготовка животных
10.2.4 Подготовка исследуемого образца
10.3 Условия исследования
10.3.1 Растворитель/разбавитель
10.3.2 Контроли
10.4 Проведение исследования
10.4.1 Количество и пол животных
10.4.2 Дизайн эксперимента
10.4.3 Исследование предельных значений
10.4.4 Уровни доз
10.4.5 Пути введения и уровни доз
10.4.6 Препараты костного мозга/крови
10.4.7 Анализ
10.5 Данные и отчетность
10.5.1 Оценка результатов
10.5.2 Оценка и интерпретация результатов
10.5.3 Отчет об исследовании
11 Метод оценки хромосомных аберраций in vitro
11.1 Общие положения
11.2 Препараты
11.2.1 Выбор вида животных
11.2.2 Условия размещения и питания
11.2.3 Подготовка животных
11.2.4 Подготовка исследуемого образца
11.3 Условия исследования
11.3.1 Растворитель/разбавитель
11.3.2 Контроли
11.4 Проведение исследования
11.4.1 Количество и пол животных
11.4.2 Дизайн эксперимента
11.4.3 Уровни доз
11.4.4 Исследование предельных значений
11.4.5 Уровни доз и способы их введения
11.4.6 Забор костного мозга и приготовление гистологических препаратов
11.4.7 Метафазный анализ
11.5 Данные и отчетность
11.5.1 Обработка результатов
11.5.2 Оценка и интерпретация результатов
11.5.3 Отчет об исследовании
Библиография
49 страниц
| Дата введения | 01.06.2019 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 30.08.2018 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 111-П |
|---|---|---|---|
| 03.10.2018 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 699-ст |
| Разработан | АНО ИМБИИТ | ||
| Издан | Стандартинформ | 2018 г. |
Medical devices. Biological evaluation of medical devices. Part 33. Guidance on tests to evaluate genotoxicity. Supplement to ISO 10993-3
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25
стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ГОСТ
ISO/TR 10993-33-2018
ИЗДЕЛИЯ МЕДИЦИНСКИЕ.
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 33
Руководство по испытаниям на генотоксичность. Дополнение к ISO 10993-3
(ISO/TR 10993-33:2015,
Biological evaluation of medical devices — Part 33: Guidance on tests to evaluate genotoxicity — Supplement to ISO 10993-3,
IDT)
Издание официальное
Москва
Стандартинформ
2018
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-2015 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2015 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «Институт медико-биологических исследований и технологий» (АНО «ИМБИИТ») на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 августа 2018 г. № 111-П)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004—97 |
Код страны по МК(ИСО 3166) 004—97 |
Сокращенное наименование национального органа по стандартизации |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Киргизия |
KG |
Кыргызстандарт |
|
Россия |
RU |
Росстандарт |
|
Узбекистан |
UZ |
Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 3 октября 2018 г. № 699-ст межгосударственный стандарт ГОСТ ISO/TR 10993-33—2018 введен в действие в качестве национального стандарта Российской Федерации с 1 июня 2019 г.
5 Настоящий стандарт идентичен международному документу ISO/TR 10993-33:2015 «Оценка биологического действия медицинских изделий. Часть 33. Руководство по исследованиям оценки гено-токсичности. Дополнение к ISO 10993-3» («Biological evaluation of medical devices — Part 33: Guidance on tests to evaluate genotoxicity — Supplement to ISOI0993-3», IDT).
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для увязки с наименованиями, принятыми в существующем комплексе межгосударственных стандартов
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© ISO, 2015 — Все права сохраняются © Стандартинформ, оформление, 2018
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
6.2.3 Метаболическая активация
Исследуемый образец должен воздействовать на бактерии как в присутствии, так и в отсутствие системы метаболической активации. Наиболее часто используемой системой является дополненная кофактором постмитохондриальная фракция S9, приготовленная из печени грызунов, обработанных фермент-индуцирующими агентами, такими как Ароклор 1254 или комбинация фенобарбитона и В-нафтофлавона. Постмитохондриальную фракцию обычно используют при концентрациях в диапазоне от 5 % до 10 % объемной доли в смеси S9.
Поставщики и информация о контроле качества S9 (т. е. метод приготовления, линия грызунов, концентрация индуктора Р450 и т. д.) должны быть отражены документально. Если S9 получен непосредственно в лаборатории, то источник и метод подготовки должны быть отражены документально. Таким образом, активность S9 должна быть проверена при использовании двух эталонных промутагенов для определенного штамма (например, S. typhimurium ТА100) и сравнена с историческим контролем.
Концентрация гомогената S9 должна быть выражена в единицах активности на чашку, так как разные поставщики могут изготовлять S9 по-разному, например: использовать разные кофакторы в смеси S9, разное соотношение ткани и гомогенизирующей жидкости во время приготовления S9.
Должны быть выбраны буфер и концентрации компонентов.
Простое исключение компонента смеси S9 в верхнем слое агара не рекомендуется в отсутствие системы метаболической активации, так как различающиеся объемы поверхностного агара изменят воспринимаемую дозу соединения (по крайней мере, изначально, в зависимости от растворимости и/или диффузии в базальный агар). Смесь S9 должна быть заменена подходящим буфером.
6.2.4 Подготовка тестируемого образца
Выбор процедуры подготовки образца любого медицинского изделия должен учитывать химический состав и физико-химические свойства материала или материалов, используемых в медицинском изделии. При приготовлении образца необходимо руководствоваться ISO 10993-12. Дополнительная информация приведена в приложении A ISO 10993-3:
- медицинские изделия или материалы, которые могут быть растворены или суспендированы в растворителе, могут быть дозированы напрямую для анализа (см. приложение А, метод A ISO 10993-3);
- медицинские изделия или материалы, которые не растворимы в растворителе, могут быть испытаны с использованием экстрактов в качестве тестируемого образца. Выбор методов экстракции зависит от процентной доли экстрагируемых веществ, полученных из исследуемого образца (см. приложение А, методы В и С ISO 10993-3).
Исследуемые экстракты должны быть использованы в течение 24 ч после приготовления. Экстракты должны быть использованы по возможности незамедлительно после их приготовления для предотвращения адсорбции на стенки емкости для экстракции или других изменений в составе. Если экстракт хранится более 24 ч, необходимо подтвердить стабильность и гомогенность экстракта при условиях хранения.
6.3 Условия исследования6.3.1 Растворители
Растворитель для исследования должен быть выбран в соответствии с ISO 10993-12 или приложением А ISO 10993-3 и быть совместимым, т. е. не должен влиять на выживаемость бактерий и активность S9. Обоснование выбора растворителя должно быть отражено документально. Если выбранный растворитель широко не применяют, необходимо представить доказательства/данные, демонстрирующие совместимость. Если используют малоизвестные растворители, их включение должно сопровождаться данными, указывающими на их совместимость.
6.3.2 Исследуемые концентрации
Значения максимальных исследуемых концентраций будут зависеть от растворимости и цитотоксичности исследуемого соединения или цитотоксичности экстракта исследуемого образца.
Выбор диапазона доз
Выбор диапазона доз может быть сделан до проведения основного исследования, если ожидается значительная цитотоксичность исследуемого образца, например цитотоксичность или подавление роста выше 50 %. Цитотоксичность может проявляться сокращением количества колоний ревертантов, подавлением или уменьшением роста клеток или снижением жизнеспособности культур. Цитотоксичность исследуемого образца может быть изменена в присутствии систем метаболической активации. Нерастворимость должна быть оценена как преципитация в конечной смеси при реальных условиях исследования и очевидна невооруженному глазу.
4
ГОСТ ISO/TR 10993-33—2018Исследование предельных доз
Для растворимых нецитотоксичных тестируемых компонентов (определенных в исследовании DRF) приемлемо единственное измерение при одной дозе, составляющей по меньшей мере 5 мг/чаш-ка, или 5 мкл/чашка (см. приложение А, метод А или, если выполнимо, метод В ISO 10993-3), или 0,1 мл 100 %-ного (чистого) экстракта исследуемого образца (см. приложение А, метод С ISO 10993-3). Для исследуемых образцов, приготовленных следуя руководству, предоставленному в ISO 10993-12, в большинстве ситуаций исследование наивысшей дозы с использованием 100 %-ного экстракта исследуемого образца является приемлемым и исследование других доз необязательным.
Исследование основной дозы
Если исследуемый образец демонстрирует видимые признаки преципитации или уже является цитотоксичным ниже уровня дозы 5 мг/чашка или 5 мкл/чашка, или 100 %-ного экстракта исследуемого образца, необходимо проводить полное исследование по меньшей мере с пятью разными концентрациями исследуемого образца. Для цитотоксичных соединений/экстрактов исследуемого образца уровни доз для ревертантной частоты должны покрывать диапазон от максимальной до небольшой цитотоксичности или ее отсутствия. Для нецитотоксичных веществ, которые не растворимы при 5 мг/чашка или 5 мкл/чашка, одна или более из исследуемых концентраций должны быть нерастворимыми при окончательном тестировании. Преципитат не должен мешать подсчету.
При определении наибольшего количества исследуемого образца следует учитывать такие критерии, как цитотоксичность и растворимость смеси на завершающей стадии обработки. Полезно определить токсичность и нерастворимость в предварительном исследовании. Цитотоксичность может проявляться сокращением количества колоний ревертантов, подавлением или уменьшением фонового роста клеток или снижением жизнеспособности культур. Цитотоксичность исследуемого образца может быть изменена в присутствии системы метаболической активации. Нерастворимость должна быть оценена как преципитация конечной смеси при реальных условиях исследования и очевидна невооруженному глазу. Рекомендуемая максимальная исследуемая концентрация будет зависеть от выбранного метода приготовления исследуемого образца:
a) для растворимых нецитотоксичных исследуемых образцов (см. приложение А, метод А, ISO 10993-3) рекомендуемая максимальная исследуемая концентрация составляет 5 мг/чашка или 5 мкл/чашка. Для нецитотоксичных исследуемых образцов, которые не растворимы при 5 мг/чашка или 5 мкл/чашка (в случае жидких химических веществ), одна или более из исследуемых концентраций окончательного образца должны быть нерастворимыми. Исследуемые образцы, являющиеся цитотоксичными в дозах менее 5 мг/чашку или 5 мкл/чашку (в случае жидких химических веществ), следует тестировать в концентрациях ниже цитотоксичной. Преципитат не должен мешать подсчету;
b) для тестируемых образцов в соответствии с приложением А, метод В, ISO 10993-3 рекомендуемая максимальная исследуемая концентрация составляет 5 мг/чашка, если это выполнимо. Для нецитотоксичных тестируемых образцов, которые не растворимы при концентрации 5 мг/чашка, одна или более из исследуемых концентраций должны быть нерастворимыми в окончательном образце. Преципитат не должен мешать подсчету. Тестируемые образцы, являющиеся цитотоксичными ниже уровня дозы 5 мг/чашка, должны исследоваться в концентрациях ниже цитотоксичной;
c) для тестируемых образцов в соответствии с приложением А, метод С, ISO 10993-3 рекомендуемой максимальной исследуемой концентрацией является 100 %-ный экстракт исследуемого образца.
Если наблюдается преципитат или исследуемый образец цитотоксичен, необходимо использовать по меньшей мере пять разных анализируемых концентраций тестируемого образца. Для предварительных исследований могут быть полезны исследуемые концентрации с использованием интервалов, для которых логарифм отношения соседних значений равен 0,5. Меньшие интервалы могут быть приемлемы при проведении последующих исследований. Если тестируемый образец растворим и не цитотоксичен, приемлема единственная максимальная концентрация.
6.3.3 Контроли
Соответствующие положительные и отрицательные (растворитель/среда) контроли (с метаболической активацией и без нее) должны быть включены для каждого штамма. Кроме групп воздействия тестируемого образца должны быть группы положительного и отрицательного контроля, идентичные основным группам. Подсчет жизнеспособных колоний бактерий в исходной культуре должен быть продемонстрирован и отражен документально как часть исследования каждой пробы. Индуцированные уровни мутаций с эталонным мутагеном должны быть в диапазоне значений, описанном в научной литературе. При анализах с использованием системы метаболической активации эталонное(ые) вещество(а) положительного контроля должно(ы) быть выбрано(ы) с учетом используемого штамма
бактерий. Следующие химические вещества служат примерами подходящих положительных контролей для проб с метаболической активацией:
- 9,10-диметилантрацен [номер CAS781-43-1];
- 7,12-диметилбензантрацен [номер CAS 57-97-6];
- Конго красный [номер CAS 573-58-0] (для метода редуктивной метаболической активации);
- бензо(а)пирен [номер CAS50-32-8];
- циклофосфамид (моногидрат) [номер CAS 50-18-0 (номер CAS 6055-19-2)];
- 2-аминоантрацен [номер CAS613-13-8],
2-аминоантрацен не должен быть использован как единственный индикатор эффективности смеси S9. Если используется 2-аминоантрацен, каждая партия S9 должна также быть охарактеризована мутагеном, требующим метаболической активации микросомальными ферментами, например бензо(а)-пиреном, диметилбензантраценом.
Для проб, проведенных без системы метаболической активации, примеры положительных контролей, специфичных для конкретных штаммов, приведены в таблице 1.
|
Таблица 1 — Примеры положительных контролей для конкретных штаммов | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
6.4 Проведение исследования6.4.1 Обработка тестируемым образцом
При методе внесения образца на чашку в варианте без системы метаболической активации смешивают 0,1 мл тестируемого образца, 0,1 мл свежей бактериальной культуры (содержащей по меньшей мере 108 жизнеспособных клеток) и 0,5 мл стерильного буфера с 2,0 мл агара. При анализе с системой метаболической активации смешивают 0,5 мл смеси с системой метаболической активации, содержащей адекватное количество постмитохондриальной фракции (в диапазоне от 5 % до 10 % объемного содержания в смеси метаболической активации) с агаром (2,0 мл) вместе с бактериями и исследуемым образцом/раствором. Содержимое каждой пробирки смешивают и выливают на поверхность чашки с минимальным агаром. Поверхность агара должна затвердеть перед инкубацией.
Для метода преинкубации тестируемый образец/раствор предварительно инкубируют с исследуемым штаммом (содержащим по меньшей мере 108 жизнеспособных клеток) и стерильным буфером или с системой метаболической активации (0,5 мл) в течение 20 мин или более при температуре 37 °С до смешивания с агаром и выливают на поверхность чашки с минимальным агаром. Как правило, 0,1 мл тестируемого образца или экстракта, 0,1 мл бактерий и 0,5 мл смеси S9 или стерильного раствора буфера смешивают с 2,0 мл агара. Пробирки должны быть аэрированы во время предварительной инкубации с помощью аппарата для встряхивания. Для адекватной оценки вариации следует использовать для каждого уровня доз по три чашки. Применение двух чашек приемлемо при соответствующем научном обосновании. Случайная потеря чашки не обязательно делает опыт недействительным.
ГОСТ ISO/TR 10993-33—2018
Газообразные или летучие вещества должны быть исследованы подходящими методами, например с использованием герметичных емкостей.
При необходимости проведения количественных сравнений между экспериментами при наличии и отсутствии смеси S9 исследования должны проводить в течение одного дня.
Для исследований in vitro с наличием дополнительных подтверждающих этапов, таких как многократное повторение длительного эксперимента или исследования с использованием экзогенной системы метаболической активации и без нее, дальнейшее подтверждающее исследование не проводят при получении четко положительных или отрицательных результатов. Неоднозначные результаты могут потребовать повторных экспериментов, возможно, с модифицированным протоколом, таким как подходящий выбор исследуемых концентраций.
6.4.2 Инкубация
Все чашки в каждом эксперименте должны быть инкубированы при температуре 37 °С в течение от 48 до 72 ч. После инкубационного периода подсчитывают количество колоний ревертантов на чашку.
6.4.3 Сбор данных
Автоматизированные счетчики колоний должны быть откалиброваны путем сравнения с подсчетом колоний на тех же чашках вручную при диапазоне мутантных колоний от очень низкого до очень высокого и колоний различных размеров. Состояние бактериального фона оценивают на предмет токсичности экстракта исследуемого образца посредством лупы или темнопольного счетчика. Преципитат должен оцениваться визуальным осмотром без увеличения. Токсичность и степень преципитации должны подсчитываться относительно соответствующего бланка экстракции с использованием стандартизованного метода (например, таблица в конце документа).
6.5 Данные и отчетность6.5.1 Обработка результатов
Результаты должны быть представлены как количество колоний ревертантов на чашку. Необходимо также определить количество колоний ревертантов на чашку в вариантах как с отрицательным контролем (контроль с растворителем и, если использован, необработанный контроль), так и с положительным контролем.
Количество колоний ревертантов на каждую чашку, среднее количество колоний ревертантов на чашку (из трех повторов) и стандартное отклонение должны быть указаны для каждой дозы тестируемого образца, положительного и отрицательного (необработанный и/или растворитель) контролей.
Для проб in vitro с дополнительными подтверждающими этапами, такими как многократное повторение длительного эксперимента или исследования с системой метаболической активации и без нее, дальнейший подтверждающий эксперимент не проводят при получении четко положительных или отрицательных результатов. Неоднозначные результаты могут потребовать повторных исследований, возможно, с модифицированным протоколом, таким как подходящий выбор исследуемых концентраций.
Для методов А и В приложения A ISO 10993-3 доза исследуемого вещества должна быть выражена как масса (на чашку или на миллилитр), а не объем.
6.5.2 Оценка и интерпретация результатов
Существуют различные критерии для определения положительного результата, такие как зависимое от концентрации увеличение эффекта в исследуемом диапазоне концентраций и/или воспроизводимое увеличение количества колоний ревертантов на чашку при одной или более концентрациях по меньшей мере на одном штамме с системой метаболической активации или без нее. Биологическая значимость результатов должна быть рассмотрена в первую очередь. Статистические методы могут быть использованы как вспомогательные при оценке результатов испытания. Исследуемое вещество, результаты для которого не соответствуют вышеупомянутым критериям, считается немутагенным в условиях проведения данного метода.
Хотя в большинстве экспериментов получают четко положительные или отрицательные результаты, в редких случаях совокупность данных не дает определенного заключения о мутагенной активности исследуемого образца. Результаты могут оставаться неоднозначными или сомнительными независимо от количества повторов эксперимента. Неоднозначным ответом является увеличение количества ревертантов, которое частично отвечает критерию положительной оценки. Это может быть увеличение, которое не отвечает указанному порогу. Ответ будет оценен как отрицательный, если он не является ни положительным, ни неоднозначным.
Положительные результаты в методе оценки обратных мутаций бактерий означают, что вещество индуцирует точковые мутации путем замены пар оснований или сдвига рамки считывания в геноме Salmonella typhimurium и/или Escherichia coli. Отрицательные результаты означают, что в условиях проведения данного метода исследуемый образец не является мутагенным для данных бактерий.
6.5.3 Критерии обоснованного исследования
Для того чтобы оценка мутагенности каждого исследуемого образца была признана валидизи-рованной, необходимо соответствовать следующему критерию: все культуры стандартных штаммов Salmonella, рекомендуемые выше, должны продемонстрировать наличие специфических мутаций (rfa) и делеций в гене uvrB. Культуры стандартных штаммов ТА98 и ТА100 должны продемонстрировать наличие плазмидного R-фактора pKMIOI. Все культуры WP2 иvrA должны продемонстрировать чувствительность к ультрафиолету, вызванную мутацией uvrA. Все культуры должны продемонстрировать характерное среднее количество спонтанных ревертантов в бланках экстракции, например: ТА98 от 10 до 50; ТА100 от 80 до 240; ТА1535 от 5 до 45; ТА1537 от 3 до 21; WP2 uvrA от 10 до 60. Для того чтобы убедиться, что высеяно надлежащее количество бактерий, титры культуры стандартных штаммов должны быть выше или равняться 0,3 ■ 109 клеток/мл. Среднее значение количества ревертантов в каждом положительном контроле должно показывать значительное увеличение по сравнению со значением в соответствующем контроле растворителя и в диапазоне контроля, имеющимся в архиве данных лаборатории.
О токсичности судят по одному или двум критериям:
- снижение более 50 % с дозовой зависимостью среднего количества ревертантов на чашку по сравнению со средним соответствующим контролем;
- по крайней мере, умеренное сокращение спонтанного фона (см. код 3, 4 или 5 в таблице 2).
|
Таблица 2 — Спонтанный фон для метода бактериальных мутаций | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
ГОСТ ISO/TR 10993-33—20186.5.4 Отчет об исследовании
Отчет об исследовании должен включать следующую информацию:
a) исследуемый образец:
1) исследуемые медицинское изделие, компоненты или материалы,
2) идентификационные данные и номер CAS, если известен,
3) физическая природа и чистота исследуемых материалов, если известны,
4) физико-химические свойства, релевантные к проведению исследования,
5) стабильность исследуемого образца, если известна,
6) данные о стерильности,
7) описание приготовления исследуемого образца, включая обоснование выбора метода, растворителя и условий приготовления образца,
8) описание физических характеристик исследуемого образца (например, прозрачность, цвет и наличие частиц),
9) информация по длительности измеренной экстракции и времени, прошедшего между приготовлением образца и использованием в исследовании,
10) метод приготовления исследуемого образца с обоснованием выбора используемого метода. При проведении метода В ISO 10993-3 необходимо включить процент осадка, определенный в предварительном эксперименте;
b) растворитель/разбавитель:
1) обоснование выбора растворителя/разбавителя,
2) растворимость и стабильность исследуемого образца в растворителе/разбавителе, если известны;
c) штаммы:
1) используемые штаммы,
2) количество клеток на культуру,
3) характеристики штамма;
d) условия исследования:
1) количество исследуемого образца на чашку (мг/чашку или мкл/чашку) с обоснованием выбора дозы и количества чашек на концентрацию,
2) используемая среда,
3) метод приготовления исследуемого образца с обоснованием выбора используемого метода. При проведении метода В ISO 10993-3 необходимо включить процент осадка, определенный в пилотном исследовании экстракции,
4) тип и состав системы метаболической активации, включая критерий приемлемости,
5) процедуры обработки;
e) результаты:
1) признаки токсичности,
2) признаки преципитата,
3) подсчеты по индивидуальным чашкам,
4) среднее число колоний ревертантов на чашку и стандартное отклонение,
5) данные «доза—ответ», если определяли,
6) статистический анализ, при наличии,
7) исторический отрицательный (растворитель/разбавитель) и положительный контроль с указанием диапазонов, средних значений и стандартных отклонений;
f) документально представленная информация о поставщике и о контроле качества S9 (например, метод приготовления, линия грызунов, концентрация индуктора Р450 и т. д.). Если S9 получен в собственной лаборатории, то источник и метод приготовления должны быть отражены документально;
д) используемая в тесте концентрация S9;
h) документально зафиксированные результаты титров используемых штаммов;
i) внесение в протокол значения среднеквадратичных отклонений и обсуждение того, как они влияют на достоверность результатов исследования. Фиксирование отсутствия среднеквадратичных отклонений;
j) обсуждение результатов;
k) заключение.
9
7 Метод оценки in vitro хромосомных аберраций на клетках млекопитающих
7.1 Общие положения
Метод оценки хромосомных аберраций на клетках млекопитающих in vitro адаптирован для медицинских изделий путем использования OECD 473 [2]. В тест-системе для оценки генотоксичного потенциала медицинских изделий объектами тестирования могут быть материал медицинских изделий, экстракты или экстрагированные и выпаренные осадки.
При использовании двух экстрактов генотоксичный потенциал каждого экстракта должен быть оценен в соответствии сданным разделом.
Исследуют воздействие образца на клеточные культуры с использованием системы метаболической активации или без нее. Через заранее определенные интервалы времени (см. 7.4.1) после экспозиции клеточных культур с исследуемым образцом в культуру вносят вещество, блокирующее клеточный цикл на стадии метафазы (например, Colcemid® или колхицин). Затем клетки фиксируют, красят и анализируют под микроскопом для обнаружения хромосомных аберраций.
7.2 Препараты7.2.1 Клетки
Могут быть использованы разнообразные клеточные линии, штаммы или первичные клеточные культуры, включая клетки человека (например, клеточные линии СНО, V79 и CHL китайского хомячка, лимфоциты периферической крови человека или других млекопитающих).
7.2.2 Среды и условия культивирования
В перевиваемых культурах необходимо использовать соответствующие культуральные среды и условия инкубации (посуда для культивирования, концентрация С02, температура и влажность). Выбранные клеточные линии и штаммы должны регулярно проверять на предмет стабильности модального числа хромосом и отсутствия контаминации микоплазмой. При изменении числа хромосом и наличии контаминации их нельзя использовать. Для клеток и условий их культивирования должна быть известна нормальная продолжительность клеточного цикла.
7.2.3 Приготовление культур
Установленные клеточные линии и штаммы
Клетки, полученные из исходных культур, высевают в культуральную среду до плотности, при которой культуры не достигают конфлюентности до времени сбора, и инкубируют при температуре 37 °С.
Лимфоциты
Цельную кровь, содержащую антикоагулянт (например, гепарин) или выделенные лимфоциты, полученные от здоровых доноров, добавляют к культуральной среде, содержащей митоген (например, фитогемагглютинин) и инкубируют при температуре 37 °С.
7.2.4 Метаболическая активация
Тестируемый образец должен воздействовать на клетки как в присутствии, так и в отсутствие соответствующей экзогенной системы метаболической активации. Наиболее часто используемой системой является дополненная кофактором постмитохондриальная фракция S9, приготовленная из печени грызунов, обработанныхфермент-индуцирующими агентами, такими как Ароклор 1254 или комбинация фенобарбитона и В-нафтофлавона. Постмитохондриальную фракцию используют при концентрациях в диапазоне от 1 % до 10 % объемной доли в конечной исследуемой среде. Состояние системы метаболической активации может зависеть от класса исследуемого химического вещества. В некоторых случаях может понадобиться использовать более чем одну концентрацию постмитохондриальной фракции.
Информация о поставщике и контроле качества S9 (т. е. метод приготовления, линия грызунов, концентрация индуктора Р450, метаболическая активность и т. д.) должна быть отражена документально. Если S9 получен в собственной лаборатории, то источник и метод приготовления должны быть отражены документально, так как используются буфер и концентрация компонентов.
Простое исключение компонента S9 не рекомендуется, так как различающиеся объемы изменят исследуемую дозу соединения. Смесь S9 должна быть заменена на подходящий буфер.
7.2.5 Подготовка тестируемого образца
При выборе способа подготовки образца любого медицинского изделия следует учитывать химический состав и физико-химические свойства материала или материалов, используемых в меди-
ГОСТ ISO/TR 10993-33—2018
цинском изделии. Руководство по приготовлению образца приведено в ISO 10993-12. Дополнительная информация содержится в приложении A ISO 10993-3:
- медицинские изделия или материалы, которые могут быть растворены или суспензированы в соответствующих растворителях, используются непосредственно в качестве тестируемых образцов (см. приложение А, метод A, ISO 10993-3);
- медицинские изделия или материалы, которые не растворимы в растворителях, могут быть испытаны с использованием экстрактов в качестве исследуемых образцов. Выбор методов экстракции зависит от процентной доли экстрагируемых веществ, полученных из исследуемого образца (см. приложение А, методы В и С, ISO 10993-3).
Исследуемые экстракты должны быть использованы в течение 24 ч после приготовления. Если экстракт хранится более 24 ч, необходимо подтвердить стабильность и гомогенность экстракта при данных условиях хранения.
7.3 Условия исследования7.3.1 Растворители
Растворители для исследования должны быть выбраны в соответствии с ISO 10993-12 или приложением A ISO 10993-3 и не должны влиять на жизнеспособность клеток и активность S9, т. е. быть совместимыми. Если использованы малоизвестные растворители, их включение должно сопровождаться данными, указывающими на их совместимость.
7.3.2 Исследуемые концентрации
Учитываемыми критериями при определении максимальной концентрации являются цитотоксичность, растворимость в системе исследования и изменения в pH или осмолярность.
Рекомендуемая максимальная исследуемая концентрация будет зависеть от избранного метода приготовления тестируемого образца. Согласно ISO 10993-12 достаточно использования 100 %-ного экстракта тестируемого образца, и исследование других доз не является необходимым. В соответствии с приложением A ISO 10993-3 необходимо учитывать следующее:
a) для растворимых нецитотоксичных тестируемых образцов (см. приложение А, метод А, ISO 10993-3) рекомендуемая максимальная исследуемая концентрация составляет 5 мг/мл или 5 мкл/мл. Для нецитотоксичных тестируемых образцов, которые не растворимы при концентрации 5 мг/мл или 5 мкл/мл, одна или более из исследуемых концентраций должны быть нерастворимыми в окончательном образце. Тестируемые образцы, уже являющиеся цитотоксичными в дозах менее 5 мг/мл или 5 мкл/мл, должны быть исследованы в концентрациях менее цитотоксичной. Преципитат не должен мешать подсчету;
b) для тестируемых образцов в соответствии с приложением А, метод В, ISO 10993-3 рекомендуемая максимальная исследуемая концентрация составляет 5 мг/мл, если это выполнимо. Для нецитотоксичных исследуемых образцов, которые не растворимы в концентрации 5 мг/мл, одна или более из исследуемых концентраций должны быть нерастворимыми в окончательном образце. Исследуемые образцы, уже являющиеся цитотоксичными в концентрации менее 5 мг/мл, должны быть исследованы в концентрациях менее цитотоксичной. Преципитат не должен мешать подсчету;
c) для тестируемых образцов в соответствии с приложением А, метод С, ISO 10993-3 рекомендуемой максимальной исследуемой концентрацией является 100 %-ный экстракт образца. Для нецитотоксичных тестируемых образцов, которые не растворимы при 100 %, одна или более из исследуемых концентраций должны быть нерастворимыми в окончательном образце. Исследуемые образцы, уже являющиеся цитотоксичными в концентрациях менее чем 100 %, должны быть исследованы в концентрациях менее цитотоксичной.
Предпочтительна замена среды на свежую среду с экстрактом во избежание истощения питательных веществ.
Цитотоксичность следует определять в основном эксперименте как в присутствии метаболической активации, так и без нее, используя достоверные признаки целостности и роста клеток, такие как относительное повышение количества клеток (RICC) или относительное удвоение популяции (RPD), степень конфлюентности, количество жизнеспособных клеток или митотический индекс. Может быть полезным определение цитотоксичности и растворимости в предварительном эксперименте. При наличии цитотоксичности необходимо использовать по меньшей мере три анализируемые концентрации. Эти концентрации должны покрывать диапазон от максимальной до небольшой цитотоксичности или до ее отсутствия. Это означает, что интервал концентраций должен быть в промежутке между 2 и корнем квадратным из 10. На момент фиксации при максимальной концентрации должно быть значи-
тельное снижение удвоения популяции, количества клеток или митотического индекса (более чем на 50 % по отношению к отрицательному контролю/растворителю). Митотический индекс является только косвенным измерением цитотоксичных/цитостатических эффектов и зависит от времени после введения вещества в культуру. Однако митотический индекс приемлем для суспензионных культур, в которых другие измерения цитотоксичности могут быть затруднены и трудно определимы. Для относительно нецитотоксичных экстрактов чистые экстракты должны быть исследованы в концентрации 10 % (водные растворы) или 1,0 % (безводные/растворители) от объема культуры. Если культуральная среда используется в качестве среды экстракции, рекомендуемая максимальная исследуемая концентрация составляет 100 % экстракта тестируемого образца. Если культуральную среду без сыворотки используют в качестве полярного растворителя для экстракции, исследуемый экстракт исследуют в чистом виде после дополнения сывороткой перед введением клеток. Исследуемый экстракт в клеточной культуральной среде с сывороткой (как неполярный растворитель) исследуют как чистый экстракт. Тестируемые образцы, уже являющиеся цитотоксичными в концентрациях менее 100 %, должны быть исследованы в концентрации, индуцирующей цитотоксичность, требуемую для исследования.
Для относительно нецитотоксичных тестируемых образцов максимальная концентрация должна составлять 5 мкл/мл (в случае чистых жидких химических веществ), 5 мг/мл или 0,01 М в зависимости от того, что соответствует самой низкой концентрации. В таких случаях приемлема единственная максимальная концентрация.
Для относительно нерастворимых тестируемых образцов, которые нетоксичны при концентрациях менее чем нерастворимая концентрация, максимально используемой должна быть концентрация выше предела растворимости в конечной культуральной среде в окончательном образце. В отдельных случаях (например, когда токсичность наблюдается только при более высокой концентрации, чем минимальная нерастворимая концентрация), предпочтительно исследовать более чем одну концентрацию с видимым преципитатом. Полезно оценить растворимость в начале и в конце обработки, так как растворимость может меняться в течение воздействия в тест-системе из-за наличия клеток, S9, сыворотки и т. д. Нерастворимость может быть обнаружена невооруженным глазом. Преципитат не должен мешать анализу.
7.3.3 Контроли
Соответствующие положительные и отрицательные (растворитель или разбавитель) контроли как с метаболической активацией, так и без нее должны быть включены в каждый эксперимент. В варианте с метаболической активацией вещество положительного контроля должно проявлять мутагенный эффект. В качестве положительного следует применять кластоген в концентрации, при которой имеется воспроизводимое и значимое повышение эффекта над контролем, чтобы охарактеризовать чувствительность тест-системы. Концентрации положительного контроля следует подбирать таким образом, чтобы был четкий эффект, но в то же время чтобы его уровень не позволял исследователю определить зашифрованный препарат.
Примеры веществ положительного контроля включают следующие:
a) отсутствие экзогенной метаболической активации:
1) метилметансульфонат [номер CAS 66-27-3],
2) этилметансульфонат [номер CAS 62-50-0],
3) митомицин С [номер CAS 50-07-7],
4) 4-нитрохинолин-Л/-оксид [номер CAS 56-57-5];
b) наличие экзогенной метаболической активации:
1) бензо(а)пирен [номер CAS 50-32-8],
2) циклофосфамид (моногидрат) [номер CAS 50-18-0 (номер CAS 6055-19-2)].
Могут применяться другие подходящие вещества положительного контроля. Если возможно, можно рассмотреть применение химических веществ положительного контроля того же химического класса. Отрицательные контроли, состоящие из растворителя/разбавителя в культуральной среде и применяющиеся для обработки клеток в том же режиме, что и в вариантах с тестируемым образцом, должны быть использованы в каждом эксперименте. Дополнительно необходимо ставить контроли без обработки, кроме тех случаев, когда в лаборатории существует исторический контроль, демонстрирующий, что выбранный растворитель не индуцирует вредный или кластогенный эффект.
7.4 Проведение исследования7.4.1 Инкубация с тестируемым образцом или экстрактом и период наблюдения
В первом эксперименте тестируемый образец инкубируют с клетками как с системой метаболической активации, так и без нее от 3 до 6 ч с приготовлением препаратов после начала инкубации
12
ГОСТ ISO/TR 10993-33—2018
через период, соответствующий примерно 1,5 нормальным клеточным циклам. Если эксперимент дает отрицательные результаты как с метаболической активацией, так и без нее, необходимо производить дополнительное исследование без активации с непрерывной инкубацией до забора пробы в течение времени, равного примерно 1,5 клеточным циклам. Некоторые химические вещества могут быть быстрее обнаружены после инкубации/времени приготовления препаратов более чем 1,5 клеточных цикла. Отрицательные результаты с системой метаболической активации необходимо подтверждать в каждом конкретном случае. При исследовании как полярных, так и неполярных экстрактов отрицательные результаты с обоими экстрактами считаются подтвержденными. Когда подтверждение отрицательных результатов не требуется, нужно предоставить обоснование. Пролиферирующие клетки инкубируют с тестируемым образцом в присутствии и в отсутствие системы метаболической активации. Обработку лимфоцитов следует проводить примерно через 48 ч после митогенной стимуляции.
При каждой концентрации необходимо использовать дублирующие культуры, что также настоятельно рекомендуется для культур отрицательного контроля/контроля с растворителем. Газообразные или летучие вещества должны быть исследованы соответствующими методами, например в закрытых культуральных сосудах.
7.4.2 Приготовление препаратов хромосом
Клеточные культуры обрабатывают Colcemid®1) или колхицином, как правило, за 1—3 ч до приготовления препаратов. Каждую клеточную культуру обрабатывают отдельно. Приготовление препаратов хромосом включает гипотоническую обработку клеток, фиксацию и окрашивание.
7.4.3 Анализ
При подсчете митотического индекса необходимо оценить как минимум 1000 клеток на культуру.
Все гистологические препараты, включая препараты положительного и отрицательного контроля, должны быть независимо зашифрованы и рандомизированы перед микроскопическим анализом.
Так как процедура фиксации часто приводит к появлению метафаз с потерей хромосом, подсчитываемые клетки должны содержать количество центромер, равное модальному числу ± 2 для всех типов клеток. По меньшей мере 200 хорошо распределенных метафаз должны быть подсчитаны на каждую концентрацию и контроль. Если ставятся повторы, то это количество следует разделить поровну. Это количество может быть уменьшено, если наблюдается большое количество аберраций. Несмотря на то что цель исследования — выявление структурных хромосомных аберраций, важно учитывать также полиплоиды и эндоредупликацию, при их наличии.
7.5 Данные и отчетность7.5.1 Обработка результатов
Исследуемой единицей является клетка, и, следовательно, нужно оценить процентное содержание клеток со структурными хромосомными аберрациями (или аберрацией). Различные типы структурных хромосомных аберраций должны быть приведены в виде перечня с их количеством и частотой для исследуемой и контрольной культур. Пробелы отмечают отдельно и отражают документально, но, как правило, не включают в общую частоту аберраций. Одновременные измерения цитотоксичности для всех обработанных культур и культур отрицательного контроля в основном исследовании или исследованиях аберрации должны быть также отражены документально.
Необходимо предоставить данные по индивидуальным культурам. Дополнительно все данные должны быть суммированы в форме таблицы.
Не существует требования для подтверждения четкого положительного ответа. Неоднозначные результаты следует проверять в дальнейших исследованиях, предпочтительно используя модификацию условий эксперимента. Необходимость подтверждения отрицательных результатов обязательна. В последующих исследованиях следует модифицировать параметры исследования для расширения диапазона оцениваемых условий. Параметры исследования, которые могут быть модифицированы, включают расширение диапазона концентраций и условия метаболической активации.
В подсчет не должны быть включены клетки, выбранные на малом увеличении, качество которых при большом увеличении непригодно для точного подсчета хромосомных аберраций (например, чрезмерно «смазанная» картина или накладывающиеся хромосомы). Первоначально по меньшей мере
^ Colcemid является торговой маркой продукта, поставляемого компанией Ciba-Geigy Company, Базель, Швейцария. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой ISO означенного продукта. Можно использовать эквивалентные продукты, если продемонстрировано, что они приводят к аналогичным результатам.
13
ГОСТ ISO/TR 10993-33—2018
Содержание
1 Область применения..................................................................1
2 Выбор методов исследований..........................................................1
3 Рекомендуемые методы исследования...................................................1
4 Методы in vitro для оценки генотоксичности...............................................2
5 Методы in vivo для оценки генотоксичности...............................................2
6 Метод оценки обратных мутаций на бактериях............................................3
6.1 Общие положения ................................................................3
6.2 Препараты.......................................................................3
6.2.1 Бактерии...................................................................3
6.2.2 Среда......................................................................3
6.2.3 Метаболическая активация ...................................................4
6.2.4 Подготовка тестируемого образца..............................................4
6.3 Условия исследования.............................................................4
6.3.1 Растворители...............................................................4
6.3.2 Исследуемые концентрации...................................................4
6.3.3 Контроли...................................................................5
6.4 Проведение исследования..........................................................6
6.4.1 Обработка тестируемым образцом..............................................6
6.4.2 Инкубация..................................................................7
6.4.3 Сбор данных................................................................7
6.5 Данные и отчетность..............................................................7
6.5.1 Обработка результатов.......................................................7
6.5.2 Оценка и интерпретация результатов ...........................................7
6.5.3 Критерии обоснованного исследования..........................................8
6.5.4 Отчет об исследовании.......................................................9
7 Метод оценки in vitro хромосомных аберраций на клетках млекопитающих....................10
7.1 Общие положения ...............................................................10
7.2 Препараты......................................................................10
7.2.1 Клетки....................................................................10
7.2.2 Среды и условия культивирования.............................................10
7.2.3 Приготовление культур.......................................................10
7.2.4 Метаболическая активация...................................................10
7.2.5 Подготовка тестируемого образца.............................................10
7.3 Условия исследования............................................................11
7.3.1 Растворители..............................................................11
7.3.2 Исследуемые концентрации..................................................11
7.3.3 Контроли..................................................................12
7.4 Проведение исследования.........................................................12
7.4.1 Инкубация с тестируемым образцом или экстрактом и период наблюдения...........12
7.4.2 Приготовление препаратов хромосом..........................................13
7.4.3 Анализ....................................................................13
7.5 Данные и отчетность.............................................................13
7.5.1 Обработка результатов......................................................13
7.5.2 Оценка и интерпретация результатов...........................................14
7.5.3 Отчет об исследовании......................................................14
200 клеток должны подсчитывать из каждой группы, по 100 метафаз от каждого из двух повторов. Если получены сомнительные результаты, можно проводить дальнейший «слепой» подсчет тех же образцов, включая дополнительные повторы отрицательного контроля или контроля с растворителем.
7.5.2 Оценка и интерпретация результатов
Существует несколько критериев для определения положительного результата, таких как воспроизводимое увеличение количества клеток с хромосомными аберрациями. В первую очередь необходимо учитывать биологическую значимость результатов. Для помощи в оценке результатов исследования можно использовать статистические методы. Статистическая значимость не должна быть единственным определяющим фактором положительного ответа.
Увеличение числа полиплоидных клеток может означать, что исследуемый образец может ингибировать митотические процессы и индуцировать численные хромосомные аберрации. Повышение количества клеток с эндоредуплицированными хромосомами может означать, что исследуемый образец имеет потенциал ингибирования прогрессии клеточного цикла (см. [7] и [8]).
Тестируемое вещество, или экстракт, результаты для которого не отвечают вышеуказанному критерию, считается не мутагенным по результатам данной тест-системы. Хотя в большинстве экспериментов получаются четко положительные или отрицательные результаты, в редких случаях полученные данные не позволяют сделать однозначное заключение об активности исследуемого вещества. Результаты могут оставаться противоречивыми или сомнительными независимо от числа проведенных повторов. Положительные результаты исследования хромосомных аберраций in vitro означают, что тестируемый образец индуцирует структурные хромосомные аберрации в культивированных соматических клетках млекопитающих. Отрицательные результаты означают, что при данных условиях эксперимента тестируемый образец не индуцирует хромосомные аберрации в культивированных соматических клетках млекопитающих.
7.5.3 Отчет об исследовании
Отчет об исследовании должен включать следующую информацию:
a) исследуемый образец:
1) исследуемые медицинское изделие, компоненты или материалы,
2) идентификационные данные и номер CAS, если известен,
3) физическая природа и чистота исследуемых материалов, если известны,
4) физико-химические свойства, релевантные к проведению исследования,
5) стабильность тестируемого образца, если известна,
6) данные о стерильности,
7) описание подготовки тестируемого образца, включая обоснование выбора метода, растворителя и условий подготовки образца,
8) описание физических характеристик тестируемого образца (например, прозрачность, цвет и наличие частиц),
9) информация по длительности измеренной экстракции и времени, прошедшего между приготовлением образца и использованием в исследовании,
10) способ подготовки исследуемого образца с обоснованием выбора используемого метода. Согласно методу В ISO 10993-3 необходимо включать процент осадка, определенный в пилотном исследовании экстракции,
b) растворитель/разбавитель:
1) обоснование выбора растворителя/разбавителя,
2) растворимость и стабильность тестируемого образца в растворителе/разбавителе, если известны;
c) клетки:
1) тип и источник клеток,
2) особенности кариотипа и пригодность используемого типа клеток,
3) отсутствие микоплазмы, если определяли,
4) информация о длительности клеточного цикла,
5) пол доноров крови, используемые цельная кровь или отделенные лимфоциты, митоген,
6) число пассажей, если использовали,
7) методы поддержания клеточных культур, если применимо,
8) модальное число хромосом;
8 Микроядерный тест in vitro на клетках млекопитающих ....................................15
8.1 Общие положения ...............................................................15
8.2 Препараты......................................................................16
8.2.1 Клетки....................................................................16
8.2.2 Среды и условия культивирования.............................................16
8.2.3 Приготовление культур.......................................................16
8.2.4 Метаболическая активация...................................................16
8.2.5 Применение цитохалазина В в качестве блокатора цитокинеза.....................16
8.2.6 Подготовка тестируемого образца.............................................16
8.3 Условия исследования............................................................17
8.3.1 Растворители..............................................................17
8.3.2 Исследуемые концентрации..................................................17
8.3.3 Контроли..................................................................18
8.4 Проведение исследования ........................................................18
8.4.1 Инкубация с исследуемым образцом или экстрактом и период наблюдения...........18
8.4.2 Сбор клеток и приготовление препаратов.......................................19
8.4.3 Анализ....................................................................19
8.5 Данные и отчетность.............................................................20
8.5.1 Обработка результатов......................................................20
8.5.2 Оценка и интерпретация результатов...........................................20
8.5.3 Отчет об исследовании......................................................20
9 Метод оценки in vitro генных мутаций на клетках млекопитающих с использованием клеток
лимфомы (L5178Y) мышей ...........................................................22
9.1 Общие положения ...............................................................22
9.2 Препараты......................................................................22
9.2.1 Клетки........................................................................22
9.2.2 Среды и условия культивирования................................................22
9.2.3 Приготовление культур..........................................................22
9.2.4 Метаболическая активация.......................................................22
9.2.5 Подготовка исследуемого образца.................................................23
9.3 Условия исследования............................................................23
9.3.1 Растворитель/несущая среда.....................................................23
9.3.2 Исследуемые концентрации......................................................23
9.3.3 Контроли......................................................................24
9.4 Проведение исследования.........................................................24
9.4.1 Общие положения..............................................................24
9.4.2 Обработка исследуемым образцом................................................26
9.4.3 Определение выживаемости, жизнеспособности и частоты мутаций.....................26
9.5 Данные и отчетность.............................................................26
9.5.1 Обработка результатов..........................................................26
9.5.2 Оценка и интерпретация результатов..............................................27
10 Микроядерный тест in vivo на эритроцитах млекопитающих ...............................29
10.1 Общие положения..............................................................29
10.2 Препараты....................................................................29
10.2.1 Выбор вида животных.....................................................29
10.2.2 Условия размещения и питания.............................................29
ГОСТ ISO/TR 10993-33—2018
10.2.3 Подготовка животных......................................................29
10.2.4 Подготовка исследуемого образца...........................................29
10.3 Условия исследования .........................................................30
10.3.1 Растворитель/разбавитель.................................................30
10.3.2 Контроли ...............................................................30
10.4 Проведение исследования ..................................................30
10.4.1 Количество и пол животных ................................................30
10.4.2 Дизайн эксперимента .....................................................30
10.4.3 Исследование предельных значений ........................................31
10.4.4 Уровни доз ..............................................................31
10.4.5 Пути введения и уровни доз ...............................................31
10.4.6 Препараты костного мозга/крови ............................................32
10.4.7 Анализ .................................................................32
10.5 Данные и отчетность........................................................32
10.5.1 Оценка результатов.......................................................32
10.5.2 Оценка и интерпретация результатов.........................................33
10.5.3 Отчет об исследовании....................................................33
11 Метод оценки хромосомных аберраций in vivo...........................................34
11.1 Общие положения..............................................................34
11.2 Препараты....................................................................34
11.2.1 Выбор вида животных.....................................................34
11.2.2 Условия размещения и питания.............................................34
11.2.3 Подготовка животных......................................................34
11.2.4 Подготовка исследуемого образца...........................................34
11.3 Условия исследования..........................................................35
11.3.1 Растворитель/разбавитель..................................................35
11.3.2 Контроли................................................................35
11.4 Проведение исследования.......................................................35
11.4.1 Количество и пол животных.................................................35
11.4.2 Дизайн эксперимента......................................................35
11.4.3 Уровни доз ..............................................................36
11.4.4 Исследование предельных значений.........................................36
11.4.5 Уровни доз и способы их введения ..........................................36
11.4.6 Забор костного мозга и приготовление гистологических препаратов................36
11.4.7 Метафазный анализ.......................................................37
11.5 Данные и отчетность............................................................37
11.5.1 Обработка результатов.....................................................37
11.5.2 Оценка и интерпретация результатов.........................................37
11.5.3 Отчет об исследовании....................................................38
Библиография........................................................................40
V
Введение
ISO (Международная организация по стандартизации) является Всемирной федерацией национальных органов по стандартизации (органов — членов ISO). Работу по подготовке международных стандартов проводят через ISO технические комитеты. Каждый комитет-член, заинтересованный в деятельности, для которой создан технический комитет, имеет право быть представленным в этом комитете. Международные организации, правительственные и неправительственные, имеющие связи с ISO, также принимают участие в работе. ISO тесно сотрудничает с Международной электротехнической комиссией (IEC) по всем вопросам электротехнической стандартизации.
Процедуры, примененные при разработке стандарта, а также процедуры, предназначенные для его дальнейшей поддержки, описаны в части 1 Директив ISO/IEC. В частности, нужно отметить необходимость различных критериев утверждения для различных типов документов ISO. Настоящий стандарт составлен в соответствии с редакционными правилами части 2 Директив ISO/IEC (www.iso.org/ directives). Необходимо обратить внимание на возможность того, что некоторые из элементов настоящего стандарта могут быть объектом патентных прав.
ISO не несет ответственности за идентификацию определенного или всех патентных прав. Подробности, касающиеся патентных прав и отмеченные при разработке настоящего стандарта, будут включены в предисловие и/или в список ISO полученных патентных заявлений (www.iso.org/patents). Любая торговая марка, упомянутая в настоящем стандарте, является информацией, приведенной для удобства пользователей, и не носит рекламный характер. Разъяснение значений конкретных терминов ISO и выражений, связанных с оценкой соответствия, а также информация о приверженности ISO принципам ВТО по техническим барьерам в торговле (ТВТ) представлены в URL: https://www.iso. org/foreword-supplementary-information.html. Настоящий стандарт подготовлен техническим комитетом ISO/TC 194.
В серию ISO 10993 входят следующие части под общим названием «Оценка биологического действия медицинских изделий»:
- часть 1 «Оценка и испытания в рамках процесса менеджмента риска»;
- часть 2 «Требования к охране здоровья животных»;
- часть 3 «Испытания на генотоксичность, канцерогенность и токсичность, влияющие на репродуктивность»;
- часть 4 «Выбор испытаний, относящихся к взаимодействию с кровью»;
- часть 5 «Испытания на цитотоксичность in vitro»;
- часть 6 «Испытания для определения локальных эффектов после имплантации»;
- часть 7 «Остатки при стерилизации этиленоксидом»;
- часть 9 «Структура идентификации и квантификации потенциальных продуктов разложения»;
- часть 10 «Пробы на раздражение и аллергическую реакцию кожи»;
- часть 11 «Исследования общетоксического действия»;
- часть 12 «Приготовление проб и стандартные образцы»;
- часть 13 «Идентификация и количественная оценка продуктов разложения в полимерных медицинских устройствах»;
- часть 14 «Идентификация и количественная оценка продуктов разложения керамики»;
- часть 15 «Идентификация и количественная оценка продуктов разложения металлов и сплавов»;
- часть 16 «Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ»;
- часть 17 «Установление допустимых пределов выщелачиваемых веществ»;
- часть 18 «Определение химических характеристик материалов»;
- часть 19 «Физико-химическая, морфологическая и топографическая характеристики материалов (технические требования)»;
- часть 20 «Принципы и методы иммунотоксикологических испытаний медицинских изделий (технические требования)»;
-часть 33 «Руководство по испытаниям на генотоксичность. Дополнение к ISO 10993-3» (Технический отчет — ТО).
Тесты по оценке генотоксичности предназначены для обнаружения соединений, которые индуцируют прямые или косвенные генетические повреждения путем различных механизмов. Эти тесты должны способствовать определению опасности появления генетических повреждений. Экспрессия генных мутаций, значительные повреждения хромосом, рекомбинация и изменения количества хромосом счи-VI
таются основными для наследственных эффектов и многостадийного канцерогенеза. Положительный результат оценки генотоксичности указывает на возможность выявления канцерогенного потенциала соединения. Так как связь между воздействием конкретных химических веществ и канцерогенезом для человека установлена, а для наследственных заболеваний сходную связь доказать сложно, исследования генотоксичности в основном использовали для прогнозирования канцерогенности. Тем не менее, так как мутации клеток зародышевой линии четко связаны с заболеваниями человека, подозрение, что соединение может индуцировать наследственные эффекты, считается таким же серьезным, как и подозрение, что соединение может индуцировать рак. Кроме того, результаты, полученные такими методами, могут быть полезны для интерпретации исследований канцерогенности.
VII
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТИЗДЕЛИЯ МЕДИЦИНСКИЕ.ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙЧасть 33Руководство по испытаниям на генотоксичность.Дополнение к ISO 10993-3
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙЧасть 33Руководство по испытаниям на генотоксичность.Дополнение к ISO 10993-3
Руководство по испытаниям на генотоксичность.Дополнение к ISO 10993-3
Medical devices. Biological evaluation of medical devices. Part 33. Guidance on tests to evaluate genotoxicity.
Supplement to ISO 10993-3
Дата введения — 2019—06—01
1 Область применения
Настоящий стандарт (технический отчет — ТО) предназначен для предоставления информации, служащей основой при выборе тестов и руководства по проведению исследований ввиду явного различия во мнениях авторитетных органов на исследования генотоксичности.
2 Выбор методов исследований
Так как химические вещества могут индуцировать генетические повреждения различными механизмами, использование батареи тестов, выявляющих различные типы генетических повреждений, считается лучшей гарантией обнаружения генотоксической опасности. Выбранные методы обычно включают тесты для выявления точковых (генных) мутаций и хромосомных аберраций. Как бактериальные клетки, так и культивированные клетки млекопитающих используют для обнаружения генотоксических агентов. Иногда в систему тестов включают тесты in vivo. Эти тесты в некоторых случаях включают в первичную систему тестов или используют для уточнения результатов тестов in vitro (см. [13]).
3 Рекомендуемые методы исследования
Несмотря на некоторые различия в деталях, большинство регулирующих органов обычно рекомендуют одинаковые тесты оценки генотоксичности. Рекомендуемыми тестами являются следующие:
- тест обратных мутаций на бактериях (см. OECD 471 [1] и раздел 6);
- тест хромосомных аберраций in vitro на клетках млекопитающих (см. OECD 473 [2] и раздел 7);
- микроядерный тест in vitro на клетках млекопитающих (см. OECD 487 [6] и раздел 8);
- тест генных мутаций in vitro на клетках млекопитающих с использованием клеток лимфомы мышей (L5178Y) (см. OECD 475 [4] и раздел 9);
- микроядерный тест in vivo на эритроцитах млекопитающих (см. OECD 474 [3] и раздел 10);
- метод оценки хромосомных аберраций in vivo (см. OECD 475 [4] и раздел 11).
Для медицинских изделий при оценке генотоксичности, как правило, используют систему тестов. Согласно стратегии, изложенной в ISO 10993-3, она включает в себя следующие методы:
a) метод оценки генных мутаций на бактериях: метод оценки обратных мутаций на бактериях, OECD 471 [1], модифицированный для медицинских изделий, что позволяет, например, проводить исследование экстрактов из изделий (см. раздел 6); и/или
b) метод in vitro с цитогенетической оценкой хромосомных повреждений в клетках млекопитающих: метод оценки хромосомных аберраций в клетках млекопитающих in vitro, OECD 473 [2], модифицированный для медицинских изделий (см. раздел 7); или
Издание официальное
c) тест tk (thymidine kinase assay) in vitro с использованием клеток лимфомы мышей, OECD 476 [5], модифицированный для медицинских изделий (см. раздел 8), включая обнаружение малых (медленно растущих) и крупных колоний; или
d) микроядерный тест на клетках млекопитающих in vitro для оценки хромосомных повреждений и анеугенности, OECD 487, модифицированный для медицинских изделий (см. раздел 8).
Международная конференция по гармонизации технических требований для регистрации фармацевтических изделий для использования человеком (ICH) рекомендует систему из трех тестов, описанную в «1СН S2 (R1) Genotoxicity», которая по требованию отдельных регулирующих органов может быть обязательной для медицинских изделий.
4 Методы in vitro для оценки генотоксичности
Методы in vitro часто используют для определения потенциала химических веществ индуцировать генотоксичность. Применяют несколько методов, так как один выбранный метод не может обнаружить все известные генотоксиканты. Генотоксиканты часто приводят к различным эффектам (например, к крупным хромосомным перестройкам по сравнению с небольшими повреждениями, или к точковым мутациям, или к различию в специфической последовательности ДНК). Кроме того, индуцированные генетические повреждения отличаются различной репарацией ДНК. Батарея тестов ЮН разработана для расширения возможностей обнаружения генотоксикантов. Несмотря на то что методы исследования генотоксичности in vitro могут быть признаны чрезмерно чувствительными, их используют для обнаружения большинства генотоксичных канцерогенов грызунов. Сравнения «оценочных листов» исследования генотоксичности с исследованием канцерогенности веществ для грызунов показали наличие нескольких «ложноположительных» результатов (то есть обнаружение агентов, не являющихся канцерогенами грызунов). Тем не менее неясно, является ли исследование канцерогенности на грызунах более надежным методом, чем оценка непосредственно генотоксичности.
Недавние работы определили два новых класса лекарственных средств, вызывающих повреждение ДНК путем взаимодействия с топоизомеразами. Они приводят к значительному количеству ложноположительных результатов in vitro (см. [29]). В последующих работах представлена гораздо более низкая процентная доля необъяснимых положительных результатов in vitro относительно лекарственных средств (см. [16]). Вся информация, подтверждающая возможность на основе оценки генотоксичности прогнозировать канцерогенность и мутагенность половых клеток, получена в результате анализа промышленно выпускаемых химических веществ и лекарственных средств. Исследование медицинских изделий, как правило, включает применение экстрактов, которые часто содержат сложные смеси химических веществ. В настоящее время на экстрактах из изделий, содержащих неизвестные на данный момент вещества, получено небольшое количество положительных результатов.
5 Методы in vivo для оценки генотоксичности
Методы исследования генотоксичности in vivo являются неотъемлемой частью системы тестов ЮН и применяются для повышения весомости доказательства при оценке лекарственных средств. Эти методы необходимы для доказательства того, что химическое вещество или его метаболит достигли органа-мишени. В отношении медицинских изделий выполнение последнего требования представляется достаточно сложным ввиду того, что обычно исследуют сложные смеси, а доза агента или агентов в экстрактах может быть ниже уровня чувствительности системы методов.
Метод оценки хромосомных повреждений in vivo с использованием гемопоэтических клеток грызунов включен в батарею тестов для обеспечения дополнительных факторов (абсорбции, распределения, метаболизма, выделения), которые могут повлиять на генетическую активность химических веществ (см. [14]). Существует также небольшое количество генотоксичных канцерогенов, которые достоверно обнаруживаются при использовании тестов оценки хромосомных повреждений в клетках костного мозга in vivo, представляющих отрицательные/слабые/противоречивые результаты в исследованиях двумя независимыми методами in vitro, полученные в различных вариантах стандартной системы тестов (например, в тесте оценки обратных мутаций на бактериях и в одном из методов цитогенетической оценки хромосомных повреждений или в тесте оценки мутаций у бактерий плюс тест tk на клетках лимфомы мышей). Некоторые промышленные химические канцерогены, такие как уретан и бензол, относятся к этой категории (см. [31]). Ценность включения методов in vivo в первичную оценку генотоксичности
ГОСТ ISO/TR 10993-33—2018
признают спорной. Ограниченная чувствительность исследований in vivo к выявлению значительного числа канцерогенов (см. [10] и [27]) может служить аргументом против их применения. Тем не менее тот факт, что небольшая группа биологически активных соединений, являющихся известными или потенциальными канцерогенами человека, не может быть легко обнаружена методами in vitro (см. [26]), свидетельствует о необходимости использования методов in vivo в тех случаях, когда степень воздействия биологически активных составляющих медицинского изделия указывает на необходимость получения более надежной гарантии.
6 Метод оценки обратных мутаций на бактериях
6.1 Общие положения
Метод оценки обратных мутаций на бактериях адаптирован для медицинских изделий путем использования OECD 471 [1]. Для оценки генотоксического потенциала медицинских изделий в тест-системах могут быть применены материалы, входящие в состав медицинских изделий, экстракты или экстрагированные и выпаренные осадки.
При использовании двух экстрактов генотоксический потенциал каждого экстракта должен быть оценен в соответствии сданным разделом.
Суспензии бактериальных клеток инкубируют с исследуемым образцом в присутствии и в отсутствие экзогенной системы метаболической активации. При стандартном методе внесения образца в чашку Петри (In the plate incorporation method) полученную суспензию смешивают с верхним слоем агара и немедленно выливают на чашку с минимальной средой. При предынкубационном варианте метода исследуемую смесь предварительно инкубируют с суспензией бактерий, затем смешивают с верхним слоем агара и выливают в минимальную среду. При обоих вариантах метода после 48 или 72 ч инкубации подсчитывают колонии ревертантов и сравнивают с количеством спонтанных колоний ревертантов в контрольных чашках с растворителем.
6.2 Препараты6.2.1 Бактерии
Необходимо использовать культуры бактерий позднего экспоненциального роста или ранней стабильной фазы роста (примерно 109 клеток/мл). Рекомендуемая температура при культивировании составляет 37 °С.
Рекомендуемой комбинацией штаммов является
- S. typhimurium ТА1535, и
- S. typhimurium ТА1537, или ТА97, или ТА97а, и
- S. typhimurium ТА98, и
- S. typhimurium ТА100, и
- Е. coli WP2 uvrA, или Е. coli WP2 uvrA (pKMIOl), или S. typhimurium ТА102.
Необходимо использовать стандартные процедуры для приготовления, хранения и проверки генотипов исходных штаммов.
Потребность в аминокислоте для роста следует проверять при каждом приготовлении замороженной исходной культуры (гистидин для штаммов S. Typhimurium и триптофан для штаммов Е. coli).
Должны быть проверены следующие фенотипические характеристики:
a) наличие или отсутствие плазмид R-фактора, где необходима устойчивость:
1) к ампициллину для штаммов ТА98, ТА100 и ТА97а или ТА97 и WP2 uvrA (pKMIOl),
2) к ампициллину + тетрациклину для штамма ТА102;
b) наличие характерных мутаций:
1) мутация rfa в S. typhimurium по чувствительности к кристаллическому фиолетовому,
2) мутация uvrA в Е. coli или мутация uvr В в S. typhimurium по чувствительности к ультрафиолетовому свету.
Также для каждого штамма необходимо определить количество спонтанных колоний ревертантов на чашку; он должен быть в пределах колебаний показателя, ожидаемого по имеющейся базе контрольных данных лаборатории, и желательно в пределах колебания показателя по данным литературы.
6.2.2 Среда
Используют подходящий минимальный агар (т. е. содержащий Фогеля-Боннера минимальную среду Е и глюкозу) с поверхностным слоем, содержащим гистидин и биотинил или триптофан, обеспечивающие небольшое число клеточных делений.
3