ГОСТ EN 14131-2015
Продукция пищевая. Определение фолата методом микробиологических испытаний
Купить ГОСТ EN 14131-2015 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает микробиологический метод определения общего содержания фолата посредством турбидиметрического обнаружения роста микроорганизмов Lactobacillus casei, подвид rhamnosus (АТСС 7469).
Метод применяется для определения фолатов в пищевой продукции, в том числе фолатов природного происхождения и добавленной фолиевой кислоты (птероилглутаминовой кислоты).
Идентичен EN 14131:2003, IDT
Оглавление
1 Область применения
2 Нормативные ссылки
3 Сущность метода
4 Реактивы
5 Оборудование
6 Методика проведения испытания
7 Вычисление
8 Прецизионность
9 Протокол испытаний
Приложение А (справочное) Дополнительная обработка ферментами
Приложение В (справочное) Результаты межлабораторных испытаний
Библиография
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2021 |
| Завершение срока действия | 01.07.2020 |
| Актуализация | 01.01.2021 |
Организации:
| 27.02.2015 | Утвержден | Евразийский совет по стандартизации, метрологии и сертификации | 75-П |
|---|---|---|---|
| Разработан | БелГИСС |
Foodstuffs. Determination of folate by microbiological assay
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7
стр. 8

стр. 9

стр. 10

стр. 11

стр. 12
стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
ЕВРАЗИЙСКИЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(ЕАСС)
EURO-ASIAN COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(EASC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ГОСТ
EN 14131— 2015
ПРОДУКЦИЯ ПИЩЕВАЯ
Определение фолата методом микробиологических испытаний
(EN 14131:2003, ЮТ)
Издание официальное
Минск
Евразийский совет по стандартизации, метрологии и сертификации
Предисловие
Евразийский совет по стандартизации, метрологии и сертификации (ЕАСС) представляет собой региональное объединение национальных органов по стандартизации государств, входящих в Содружество Независимых Государств. В дальнейшем возможно вступление в ЕАСС национальных органов по стандартизации других государств.
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены».
Сведения о стандарте
1 ПОДГОТОВЛЕН научно-производственным республиканским унитарным предприятием «Белорусский государственный институт стандартизации и сертификации» (БелГИСС)
2 ВНЕСЕН Госстандартом Республики Беларусь
|
За принятие стандарта проголосовали: | ||||||||||||||||||||||||
| ||||||||||||||||||||||||
|
4 Настоящий стандарт идентичен европейскому стандарту EN 14131:2003 Foodstuffs — Determination of folate by microbiological assay (Продукция пищевая. Определение фолата методом микробиологических испытаний). |
3 ПРИНЯТ Евразийским советом по стандартизации, метрологии и сертификации (протокол от 27 февраля 2015 г. № 75-П)
Европейский стандарт разработан техническим комитетом по стандартизации CEN/TC 275 «Анализ пищевой продукции. Горизонтальные методы» Европейского комитета по стандартизации (CEN).
Перевод с английского языка (еп).
Официальные экземпляры европейского стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, и европейского стандарта, на который даны ссылки, имеются в Госстандарте Республики Беларусь.
В разделе «Нормативные ссылки» и тексте стандарта ссылки на европейский стандарт актуализированы.
В стандарт внесено следующее редакционное изменение: наименование настоящего стандарта изменено относительно наименования европейского стандарта в целях увязки с существующей группой межгосударственных стандартов.
Сведения о соответствии межгосударственного стандарта ссылочному европейскому стандарту приведены в дополнительном приложении Д А.
Степень соответствия — идентичная (IDT)
5 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных (государственных) стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных (государственных) органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация также будет опубликована в сети Интернет на сайте Межгосударственного совета по стандартизации, метрологии и сер<пификации в каталоге «Межгосударственные стандарты»
Исключительное право официального опубликования настоящего стандарта на территории указанных выше государств принадлежит национальным (государственным) органам по стандартизации этих государств.
Дополнительная обработка ферментами
А.1 Общие положения
Обработка аналитической пробы дополнительными ферментами может облегчить экстракцию фолатов ((5Н9)) Протеазу и а-амилазу можно добавить в пробы, богатые белками и крахмалом соответственно. Также можно использовать сочетание этих двух ферментов. Важно оптимизировать условия (например, порядок добавления. pH и температуру во время инкубации) в зависимости от типа исследуемой пробы. Примеры процедур дополнительной обработки ферментами приведены в А.2 и А.З.
Может понадобиться выполнить фильтрацию экстракта, в особенности если этап обработки ферментом исключен. Фильтрацию можно облегчить, если довести pH до 4,5 перед разбавлением и экстракцией.
у-глутамил гидролазу можно приготовить из одного из нескольких источников. Важно обеспечить достаточную активность у-глутамил гидролазы в используемом ферментном препарате и оптимизировать pH и температуру во время инкубации ((10], [11]). Может потребоваться сочетание разных ферментных препаратов. Приготовление у-глутамил гидролазы из почки свиньи описано в основном тексте (4.4 2.2), а использование дополнительных источников — в настоящем приложении (А.4. А.5, А.6).
Примечание — Ацетоновый порошок из почки свиньи типа II 51 также можно использовать как источник у-глутамил гидролазы.
А.2 Обработка протеазой
А.2.1 Протеаза
Бактериальная протеаза (муколизин. ЕС 3.4.24.31) (12] из Streptomyces griseus или эквивалентный фермент 3).
А.2.2 Раствор протеазы (2 мг/мл)
Растворяют 0,05 г бактериальной протеазы в 25 мл воды. При необходимости фильтруют через стекловату и хранят при низких температурах Используют свежеприготовленный раствор.
А.2.3 Процедура проведения обработки
Добавляют 1 мл раствора протеазы (А.2.2) в экстракт пробы (6.3.2). накрывают и проводят инкубацию при температуре 37 °С в течение 3 ч. Блокируют активность фермента нагреванием при температуре 100 °С в течение 3 мин и охлаждают. Далее выполняют обработку а-амилазой (А.З) или обработку у-глутамил гидролазой (6.3.3 или А 4).
А.З Обработка а-амилазой
А.3.1 и-амилаза
Грибковая а-амилаза (ЕС 3.2.1.1) ([12]) или эквивалентный фермент 5).
А.3.2 Раствор a-амилазы (20 мг/мл)
Растворяют 0.5 г грибковой а-амилазы (А.3.1) 8 25 мл воды. Хранят при низких температурах. Используют свежеприготовленный раствор.
А.3.3 Процедура проведения обработки
Добавляют 1 мл раствора а-амилазы (А.3.2) в экстракт пробы (6.3.2). накрывают и проводят инкубацию при температуре 37 °С в течение 2 ч. Блокируют активность фермента нагреванием при температуре 100 °С в течение 3 мин и охлаждают. Далее выполняют обработку y-глутамил гидролазой (6.3.3 или А.4).
3: Приведены примеры подходящих продуктов, которые можно приобрести у фирм Sigma и Difco За дополнительной информацией необходимо обратиться в Национальный институт по стандартизации Информация приводится для удобства пользователей настоящего стандарта и не является рекламой указанных продуктов со стороны CEN Могут быть использованы эквивалентные продукты, если было установлено, что они дают аналогичные результаты.
А.4 Источник у-глутамил гидролазы: поджелудочная железа цыпленка
А.4.1 Высушенная поджелудочная железа цыпленка 31
А.4.2 Раствор поджелудочной железы (5 мг/мл)
Суспендируют 0.5 г поджелудочной железы цыпленка в 100 мл фосфатного буфера (4.3.6). Энергично размешивают в течение 10 мин. Переносят в аналитические пробирки размером 20 * 150 мм и центрифугируют в течение 10 мин при 1000р. Надосадочную жидкость сливают через стекловату в мензурку, накрывают и хранят при низких температурах. Используют свежеприготовленный раствор.
А.4.3 Процедура проведения обработки
Осторожно перемешивают 1 мл экстракта пробы (6.3.2). 3.5 мл фосфатного буфера с аскорбатом с pH 7.8 (4.3.6) и 0.6 мл раствора поджелудочной железы цыпленка (А.4.2). Проводят инкубацию при температуре 37 °С в течение 16 ч. Блокируют активность фермента нагреванием при температуре 100 X в течение 3 мин и охлаждают. Переносят в мерную колбу вместимостью 10 мл и объем содержимого колбы доводят до метки фосфатным буфером с аскорбатом с pH 6.1 (4.3.5). Центрифугируют (10000. 10 мин), чтобы удалить осажденный белок. Хранят надосадочную жидкость при температуре минус 20 °С для последующего анализа.
А.5 Альтернативный источник у-глутамил гидролазы: плазма крови крысы
А.5.1 Свежая плазма крови крысы 31
А.5.2 Диализированная плазма крови крысы ([13])
Переносят 100 мл свежей плазмы крови крысы в пробирку для диализа (5.6) и выполняют диализ против буфера CHES/HEPES с pH 7.85 (4.3.7) при температуре 4 °С в течение 24 ч. Хранят диализированную плазму крови крысы в порциях по 0.5 мл при температуре минус 80 °С в течение не более 3 мес.
А.5.3 Процедура проведения обработки
Осторожно перемешивают 1 мл экстракта пробы (6.3.2). 2,75 мл фосфатного буфера с аскорбатом с pH 7.8 (4.3.6). 1 мл 2-меркалтоэтанола (4.2.4) и 0.25 мл диализированной плазмы крови крысы (А.5.2). Проводят инкубацию при температуре 37 X в течение 4 ч. Блокируют активность фермента нагреванием при температуре 100 X в течение 3 мин и охлаждают. Доводят pH до 6.1 соляной кислотой (4.2.6), переносят в мерную колбу вместимостью 10 мл и объем содержимого колбы доводят до метки фосфатным буфером с аскорбатом с pH 6.1 (4.3.5). Центрифугируют (ЮООд, 10 мин), чтобы удалить осажденный белок. Хранят надосадочную жидкость при температуре минус 18 °С для последующего анализа.
А.6 Источник у-глутамил гидролазы: плазма крови человека
А.6.1 Лиофилизированная плазма крови человека
А.6.2 Восстановленная плазма крови человека
Восстанавливают лиофилизированную плазму человека 5 мл воды и слегка помешивают в течение 30 мин при комнатной температуре. Хранят на льду. Используют свежеприготовленный раствор.
А.6.3 Процедура проведения обработки
Осторожно перемешивают 1 мл экстракта пробы (6.3.2), 2,75 мл фосфатного буфера с аскорбатом с pH 4,5 (4.3.4), 1 мл 2-меркаптоэтанола (4.2.4), и 0,25 мл восстановленной плазмы крови человека (А.6.2). Проводят инкубацию при температуре 37 °С в течение 3 ч. Блокируют активность фермента нагреванием при температуре 100 °С в течение 3 мин и охлаждают. Доводят pH до 6.1 гидроксидом натрия (4.2.7). переносят в мерную колбу вместимостью 10 мл и объем содержимого колбы доводят до метки фосфатным буфером с аскорбатом с pH 6.1 (4.3.5). Центрифугируют (ЮООд, 10 мин), чтобы удалить осажденный белок. Хранят надосадочную жидкость при температуре минус 18 °С для последующего анализа.
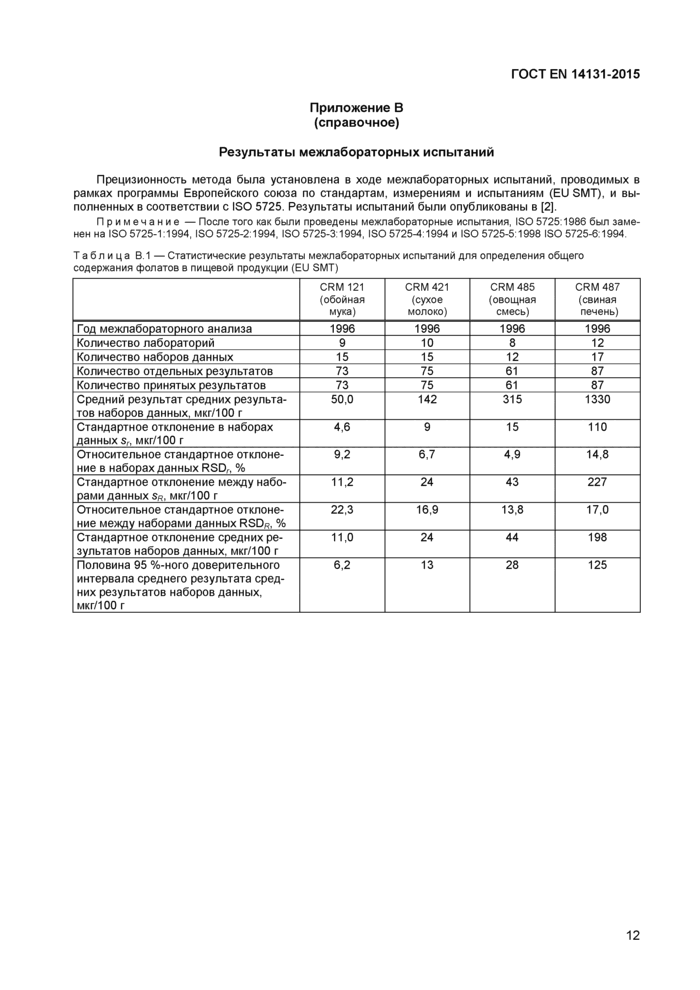
Результаты межлабораторных испытаний
Прецизионность метода была установлена в ходе межлабораторных испытаний, проводимых в рамках программы Европейского союза по стандартам, измерениям и испытаниям (EU SMT), и выполненных в соответствии с ISO 5725. Результаты испытаний были опубликованы в (2].
Примечание — После того как были проведены межлабораторные испытания, ISO 5725 1986 был заменен на ISO 5725-1 1994, ISO 5725-2 1994. ISO 5725-3 1994, ISO 5725-4 1994 и ISO 5725-5 1998 ISO 5725-6 1994
|
Таблица В 1 — Статистические результаты межлабораторных испытаний для определения общего содержания фолатов в пищевой продукции (EU SMT) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Библиография
[0) ISO 5725:1986 Precision of test methods — Determination of repeatability and repro
ducibility for a standard test method by intertaboratory tests (Прецизионность методов анализов. Определение повторяемости и воспроизводимости стандартного метода анализов посредством межпабораторных анализов)
[1) Barrett. A. J.. Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Enzyme Nomenclature. Recommendations 1992. Supplement 4: corrections and additions. 1997. Eur J Biochem. 1997.250 (1): p. 1-6
(Комитет no номенклатуре Международного союза no биохимии и молекулярной биологии. Номенклатура ферментов)
[2) Finglas, Р. М., et al., The certification of the mass fractions of vitamins in four reference materials: wholemeal flour (CRM 121), milk powder (CRM 421), lyophilized mixed vegetables (CRM 485) & lyophilized pig's liver (CRM 487). В,. B. & folate in CRM 121; В,. B:. Br;. B, ■ & folate in CRMs 421 & 487. and B,, B6, folate & carotenoids in CRM 485. 1999. Luxembourg: Office for Official Publications of the European Communities
(Сертификация массовых долей витаминов в четырех эталонных материалах: мука грубого помола (обойная) (CRM 121). сухое молоко (CRM421). лиофилизированная овощная смесь (CRM485) и лиофилизированная печень свиньи (CRM487). В,, В и фолат в CRM 121; В-. В^. Be. В,2 и фолат в CRM 421 и CRM487 и В,. Be. фолат и каротеноиды в CRM 485)
[3) Gregory, J. F., Ill, Sartain, D. В. and Day, В. P. F.: Fluorometric determination of folacin in biological materials using high performance liquid chromatography. Journal of Nutrition. 1984. 114: p. 341-353
(Флуорометрическое определение фолацина в биологических материалах с применением высокоэффективной жидкостной хроматографии)
[4) Blakley, R. L., The biochemistry of folic acid and related pteridines. Frontiers of Biology. Vol. 13. 1969. Amsterdam: North-Holland Publishing
(Биохимия фолиевой кислоты и родственных птеридинов)
[5) Rader. J. I.. Weaver. С. М., and Angyal, G.: Use of a microbiological assay with tri-enzyme extraction for measurement of pre-fortification levels of folates in enriched cereal-grain products. Food Chemistry. 1998. 62 (4): p. 451-465
(Использование микробиологического анализа вместе с триферментной экстракцией для измерения уровней донасыщения фолатами обогащенных злаковых продуктов)
[6) Pfeiffer. С. М.. Rogers. L. М.. and Gregory. J. F., Ill: Determination of folate in cereal-grain food products using trienzyme extraction and combined affinity and reversed-phase liquid chromatography. Journal of Agricultural and Food Chemistry, 1997. 45: p. 407-413
(Определение фолата в злаковых пищевых продуктах с использованием триферментной экстракции и аффинной и обращено-фазовой жидкостной хроматографии)
[7) Tamura, Т.. et al.. Food folate assay with protease, a-amylase. and folate conjugase treatments. Journal of Agricultural and Food Chemistry. 1997. 45: p. 135-139
(Анализ фолатов в пищевых продуктах вместе с обработкой протеазой, а-амилазой и конъюгатом фолата)
[8) Martin. J. I.. Landen. W. I. Jr. and Soliman, A. G. M.: Application of a tri-enzyme extraction for total folate determination in foods. Journal of the Association of Official Analytical Chemists, 1990. 73 (5): p. 805-808
(Применение триэнзимной экстракции для определения общего содержания фолата в пищевых продуктах)
[9) DeSouza. S. and Eitenmiller, R.: Effect of different enzyme treatments on extraction of total folate from various foods prior to microbiological assay and radioassay. Journal of Micronutrient Analysis. 1990, 7: p. 37-57
(Влияние различных обработок на экстракцию общего фолата из различных пищевых продуктов до микробиологического анализа и радиоанализа)
[10) Goli. D. M. and Vanderslice. J. T.: Investigation of the conjugase treatment procedure in the microbiological assay of folate. Food Chemistry. 1992, 43: p. 57-64
(Изучение методики обработки конъюгатом при микробиологическом анализе фолата)
[11) Pedersen. J. С.: Comparison of gamma-glutamyl hydrolase (conjugase; EC 3.4 22.12) and amylase treatment procedures in the microbiological assay for food folates. British Journal of Nutrition. 1988.59 (2): p. 261-271
(Сравнение методик обработки гамма-глутамил гидролазой (конъюгат; ЕС 3.4.22.12) и амилазой при микробиологическом анализе пищевых фолатов)
(12) NC-IUBMB. Enzyme nomenclature 1992. 1992. San Diego: Academic Press (Номенклатура ферментов 1992)
(13) Konings, E. J. M.: A validated liquid chromatographic method for determining folates in vegetables. milk powder, liver, and flour. Journal of AOAC International. 1999. 82 (1): p. 119-127 (Метод жидкостной хроматографии, прошедший валидацию, для определения фолатов в овощах, сухом молоке, печени и муке)
Сведения о соответствии межгосударственного стандарта ссылочному европейскому стандарту
|
Таблица Д.А.1 - Сведения о соответствии межгосударственного стандарта ссылочному европейскому стандарту, который является идентичным международному стандарту | ||||||||
|
УДК 664.017:579.67(083.74)(476) МКС 67.050 ЮТ
Ключевые слова: продукция пищевая, определение, фолат, микробиологические испытания
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКЦИЯ ПИЩЕВАЯ Определение фолата методом микробиологических испытаний
Foodstuffs
Determination of folate by microbiological assay
Дата введения
1 Область применения
Настоящий стандарт устанавливает микробиологический метод определения общего содержания фолата посредством турбидиметрического обнаружения роста микроорганизмов Lactobacillus casei. подвид rbamnosus (АТСС 7469).
Метод применяется для определения фолатов в пищевой продукции, в том числе фолатов природного происхождения и добавленной фолиевой кислоты (лтероилглутаминовой кислоты).
2 Нормативные ссылки
Для применения настоящего стандарта необходим следующий ссылочный стандарт. Для недатированных ссылок применяют последнее издание ссылочного стандарта (включая все его изменения).
EN ISO 3696:1995 Water for analytical laboratory use — Specification and test methods (Вода для лабораторного анализа. Технические требования и методы испытаний)
3 Сущность метода
Пробы, суспендированные в фосфатном буфере, нагревают, чтобы обеспечить экстракцию фолатов. Допускается использовать обработку протеазой и а-амилазой, чтобы продолжить ферментативное расщепление пищевой матрицы. Фолилполиглутамат природного происхождения гидролизуют у-глутамил гидролазой (ЕС 3.4.19.9) ((1J) до фолилмоно- или фолилди-глутаматов.
Экстрагированные фолаты разбавляют основной средой, содержащей все необходимые для роста питательные вещества, кроме фолата. Проводят турбидиметрический анализ ростовой реакции Lactobacillus casei. подвид rbamnosus (АТСС 7469). на экстрагированные фолаты, и сравнивают эту ростовую реакцию с ростовой реакцией на калибрующие растворы с известной концентрацией.
На усмотрение пользователей настоящего стандарта могут быть использованы полуавтоматическая система распределения жидкости и микропланшеты или аналитические пробирки для инкубации микроорганизма.
4 Реактивы
4.1 Общие положения
Для проведения анализа, если не указано иное, используют только реактивы признанной аналитической чистоты и воду не ниже первой степени чистоты по EN ISO 3696 Воду, используемую для приготовления реактивов, должна быть получена в стеклянном бидистилляторе.
4.2 Растворители и химические вещества
4.2.1 Глицерин. и^СзНеОз) = 80 %.
Смешивают 120 мл глицерина с 30 мл дистиллированной воды.
4.2.2 1-Октанол. C6HieO.
4.2.3 Толуол. С7Н8.
4.2.4 2-Меркаптоэтанол. c(C:H6OS) = 0.1 моль/л.
Добавляют 70 мкл 2-меркаптоэтанола в 10 мл воды.
4.2.5 Аскорбат натрия, C$H70$Na.
Аскорбат натрия используют в качестве реактива в нескольких растворах, описанных в настоящем стандарте. Также можно использовать аскорбиновую кислоту, но в этом случае может потребоваться изменить порядок регулирования pH.
4.2.6 Соляная кислота. с(НС1) = 1 моль/л.
Издание официальное
4.2.7 Гидроксид натрия. w(NaOH) = 40 %.
Растворяют 400 г гидроксида натрия в воде и разбавляют до 1 л.
4.2.8 Сульфат аммония. H9N;04S.
4.2.9 Фосфат натрия, одноосновный, безводный. NaH:P04.
Количества одноосновного фосфата натрия, используемые для приготовления буферов (4.3). были рассчитаны по безводному веществу. Может также использоваться моно- или дигидрированное вещество, но при этом проводят соответствующий перерасчет вещества.
4.2.10 2-(М-Циклогексиламино)этансульфоновая кислота (CHES). CgH^NCbS.
4.2.11 Nn(2-rидроксиэтил)пиперазин-М’-<2-этансульфоновая кислота) (HEPES). CaHiaN:04S.
4.2.12 Угольный порошок, промытый кислотой.
4.2.13 Физиологический раствор, стерильный.
Растворяют 9 г хлорида натрия в 1000 мл воды Разливают по 10 мл раствора в аналитические пробирки размером 20 « 150 мм. Закрывают пробирки и стерилизуют при температуре 121 °С в течение 15 мин. Охламадают и хранят при низких температурах.
4.2.14 Раствор основной среды, не содержащей фолиевую кислоту, двойной концентрации.
На каждые необходимые 100 мл суспендируют рекомендуемое количество основной среды (среда Bacto Folic Acid Casei Medium или эквивалентная среда ) в 100 мл дистиллированной воды. Добавляют 0.050 г аскорбата натрия (4.2.5) и нагревают до кипения в течение 1-2 мин. Дают остыть до комнатной температуры и доводят pH до 6.1 ± 0.1.
4.2.15 Стандартное вещество фолиевой кислоты
Фолиевая кислота может быть приобретена у различных поставщиков и может содержать до 8 % воды. Стандартная фолиевая кислота может иметь различную степень чистоты, поэтому необходимо определить концентрацию калибрующего раствора методом измерения ультрафиолетового поглощения (см. процедуру калибровки в 6.4.2).
4.3 Буферы
4.3.1 Фосфатный буфер. pH 5.0 (с= 0,002 моль/л).
Растворяют 0.24 г фосфата натрия одноосновного (4.2.9) в 900 мл воды. Доводят pH до 5,0 ± 0.1 гидроксидом натрия (4.2.7) и разбавляют до 1000 мл водой.
4.3.2 Фосфатный буфер. pH 7.0 (с= 0,1 моль/л).
Растворяют 12.0 г фосфата натрия одноосновного (4.2.9) в 900 мл воды. Доводят pH до 7.0 ± 0.1 гидроксидом натрия (4.2.7) и разбавляют до 1000 мл водой.
4.3.3 Фосфатный буфер. pH 5.0 (с= 0.1 моль/л) с 2-меркаптоэтанолом (с = 10 ммоль/л).
Растворяют 12.0 г фосфата натрия одноосновного (4 2.9) в 900 мл воды. Доводят pH до 5,0 ± 0.1.
добавляют 0.70 мл 2-меркалтоэтанола (4 2 4) и разбавляют до 1000 мл водой.
4.3.4 Фосфатный буфер. pH 4.5 (с = 0,1 моль/л) с аскорбатом (1 %).
Растворяют 12.0 г фосфата натрия одноосновного (4.2.9) и 10 г аскорбата натрия (4 2.5) в 900 мл воды. Доводят pH до 4,5 ± 0.1 гидроксидом натрия (4.2.7) и разбавляют до 1000 мл водой. Используют свежеприготовленный раствор.
4.3.5 Фосфатный буфер. pH 6.1 (с = 0,1 моль/л) с аскорбатом (1 %).
Растворяют 12.0 г фосфата натрия одноосновного (4.2.9) и 10 г аскорбата натрия (4.2.5) в 900 мл воды. Доводят pH до 6,1 ±0.1 гидроксидом натрия (4.2.7) и разбавляют до 1000 мл водой. Используют свежеприготовленный раствор.
4.3.6 Фосфатный буфер, pH 7,8 (с = 0.1 моль/л) с аскорбатом (1 %).
Растворяют 12.0 г фосфата натрия одноосновного (4.2.9) и 10 г аскорбата натрия (4.2.5) в 900 мл воды. Доводят pH до 7,8 ± 0.1 гидроксидом натрия (4.2.7) и разбавляют до 1000 мл водой. Используют свежеприготовленный раствор.
4.3.7 Буфер CHES/HEPES, pH 7,85 (с = 0.05 моль/л) с аскорбатом и 2-меркаптоэтанолом (4.2.4) для диализа плазмы крови крысы.
Растворяют 23.8 г HEPES (4.2.11). 20.7 г CHES (4.2.10). 40 г аскорбата натрия (4.2.5) и 1.4 мл 2-меркаптоэтанола (4.2.4) в 1900 мл воды. Доводят pH до 7.85 ±0,10 гидроксидом натрия (4.2.7) и разбавляют до 2000 мл водой. Добавляют 4 г угольного порошка, промытого кислотой (4.2.12). Используют свежеприготовленный раствор.
11 Bacto Folic Acid Casei Medium— торговое название продукта, поставляемого фирмой Difco Информация приводится для удобства пользователей настоящего стандарта и не является рекламой указанного продукта со стороны CEN Могут быть использованы эквивалентные продукты, если было установлено, что они дают аналогичные результаты
4.4 Ферменты
4.4.1 Дополнительная обработка ферментом (на усмотрение пользователей настоящего стандарта)
Допускается применять дополнительную инкубацию с протеазой и/или а-амилазой, чтобы улучшить экстрагируемость фолатов. Процедуры дополнительной обработки ферментом рассмотрены в приложении А.
4.4.2 у-глутамил гидролаза
4.4.2.1 Общие положения
Деконьюгация обеспечивается у-глутамил гидролазой (ЕС 3.4.19.9) из различных источников. Пример, описывающий приготовление у-глутамил гидролазы из свиной почки, представлен далее (4.4.2.2). Процедуры приготовления у-глутамил гидролазы из других возможных источников представлены в приложении А. Соответствие выбранного ферментного препарата следует проверить подходящим способом.
Примечание — Подходящими образцами для проверки ферментного препарата могут быть сухие дрожжи, лиофилизированная печень свиньи (например. BCR CRM 487 ([2])), или небольшое количество птероил-триглутаминовой кислоты
4.4.2.2 Источник у-глутамил гидролазы: почка свиньи ([3])
Гомогенизируют 250 г свежей почки свиньи при температуре 2 °С в 750 мл фосфатного буфера с 2-меркалтоэтанолом (4,3.3). Центрифугируют при температуре 2 °С (18000д, 20 мин). Проводят инкубацию надосадочной жидкости при температуре 50 °С в течение 2 ч. слегка помешивая, и повторяют центрифугирование. Фракционируют надосадочную жидкость путем осаждения насыщенным сульфатом аммония (4.2.8). Собирают фракцию, осажденную при 50 % — 75 % насыщении сульфатом аммония. Суспендируют осадок в минимальном объеме фосфатного буфера (4.3.1). Выполняют диализ против того же буфера 2 * 24 ч и центрифугируют (18000д, 20 мин). Переносят аликвоты по 1 мл в виалы и лиофилизируют.
4.5 Инокулят
4.5.1 Тест-микроорганизм
Лиофилизированная культура Lactobacillus casei, подвид rhamnosus (АТСС 7469) 2>.
4.5.2 Культуральная среда
Разбавляют 50 мл раствора основной среды, не содержащей фолиевую кислоту, двойной концентрации (4.2.14) до 100 мл дистиллированной водой. Добавляют 0.5 мл разбавленного исходного раствора фолиевой кислоты (6.4.4), перемешивают и подвергают стерильной фильтрации или стерилизуют при температуре 121 ®С в течение 15 мин и быстро охлаждают до комнатной температуры.
4.5.3 Криозащищенный инокулят
Асептически добавляют 1 мл приготовленной культуральной среды (4 5.2) в лиофилизированную культуру (4.5.1) и переносят 0,15 мл полученной суспензии в культуральную среду по 4.5.2. Инкубируют при температуре 37 °С в течение 18 ч.
Нагревают 150 мл глицерина (4.2.1) при температуре 121 °С в течение 15 мин и охлаждают в ледяной бане. Охлаждают инкубированную бактериальную культуру в ледяной бане и добавляют 100 мл стерилизованного и охлажденного глицерина. Слегка перемешивают. Распределяют в стерильные виалы аликвоты по 2 мл.
Хранят при температуре минус 20 °С в течение не более 3 мес или при температуре минус 70 °С в течение не более 6 мес.
Примечание — Необходимо поддерживать асептические условия на протяжении всего процесса
4.5.4 Рабочий инокулят
4.5.4.1 Рабочий инокулят для культур, выращиваемых в пробирке
Разбавляют 2 мл криозащищенного инокулята (4.5.3) до 50 мл стерильным физиологическим раствором (4.2.13). Перемешивают на вортексе.
' К дистрибьюторам указанной культуры относятся «Национальная коллекция промышленные и морские бактерии* (г Абердин, Великобритания) и «Коллекция культур Гетеборгского университета» (г Гетеборга. Швеция) Информация приводится для удобства пользователей настоящего стандарта и не является рекламой CEN указанных дистрибьюторов
4.5.4.2 Рабочий инокулят для культур, выращиваемых на микропланшете (на усмотрение пользователей настоящего стандарта)
Добавляют 5 мл стерильного физиологического раствора (4.2.13) в 2 мл криозащищенного инокулята (4.5.3) Перемешивают на вортексе.
4.5.5 Раствор инокулированной основной среды, не содержащей фолиевую кислоту, для анализа на микропланшетах (на усмотрение пользователей настоящего стандарта)
Добавляют 1 мкл рабочего инокулята (4.5.4 2) на 1 мл раствора основной среды, не содержащей фолиевую кислоту (4.2.14). Тщательно перемешивают.
5 Оборудование
Используют стандартное лабораторное оборудование, в том числе нижеперечисленное.
5.1 Центрифуга, с охлаждением, для приготовления коньюгата почки свиньи (4.4.2.2). обеспечивающая центробежное ускорение 18000д.
5.2 Нагревательное устройство, автоклав или аналогичное устройство.
5.3 Инкубатор, водяная баня для инкубации при температуре (37 ± 0.2) °С.
5.4 Спектрометр/нефелометр для измерения мутности экстрактов фолата после инкубации в аналитических пробирках.
5.5 Штативы с крышкой для аналитических пробирок для удержания аналитических пробирок во время нагревания и инкубации.
5.6 Пробирка для диализа (на усмотрение пользователей настоящего стандарта), с номинально отсекаемой молекулярной массой 12000-14000. для приготовления коньюгата плазмы крови крысы (приложение А).
5.7 Система распределения жидкости (на усмотрение пользователей настоящего стандарта) для автоматической обработки данных аналитической пробирки.
5.8 Считывающее устройство для микропланшетов (на усмотрение пользователей настоящего стандарта) для измерения мутности после инкубации на микропланшетах.
5.9 Плоскодонные 96-луночные микропланшеты, стерильные (на усмотрение пользователей настоящего стандарта).
6 Методика проведения испытания
6.1 Общие положения
Фолаты чувствительны к ультрафиолетовому свету и окислению. Все работы выполняют при отсутствии естественного и сильного флуоресцентного света. По возможности используют посуду из темного стекла.
Проводят два независимых определения.
6.2 Подготовка аналитической пробы
Аналитическая проба должна иметь однородную консистенцию. Грубый материал измельчают до однородной консистенции при помощи надлежащего измельчителя и/или блендера. Следует принять меры, чтобы не допустить воздействия высоких температур во время данного процесса. Гомогенизированные аналитические пробы хранят в герметичных контейнерах при отсутствии света.
6.3 Приготовление раствора пробы
6.3.1 Общие положения
В зависимости от типа пробы приготовление раствора аналитической пробы может включать обработку протеазой иУили а-амилазой, чтобы гидролизовать белки и углеводы и, следовательно, облегчить экстракцию фолата. Экстракт из пробы обрабатывают у-глутамил гидролазой, чтобы гидролизовать фолилполиглутаматы природного происхождения до фолилмоно- или фолилди-глутаматов. В методе, описанном в настоящем стандарте, используют у-глутамил гидролазу из почки свиньи, но можно использовать и другие источники при условии обеспечения достаточной ферментной активности. Процедуры дополнительной обработки ферментами и использование у-глутамил гидролазы из других источников описаны в приложении А.
6.3.2 Экстракция
Взвешивают точное количество аналитической пробы (соответствующее 2-2.5 г сухого вещества) и переносят в мерную колбу вместимостью 100 мл. Добавляют 20 мл фосфатного буфера с аскорбатом с pH 6.1 (4.3.5). и тщательно перемешивают. Добавляют 30 мл воды и 0.1-1 мл 1-октанола (4.2.2). Накрывают колбу и нагревают при температуре 100 °С — 121 °С в течение 15 мин. Охлаждают и разбавляют до 100 мл фосфатным буфером с аскорбатом с pH 6.1 (4.3.5).
6.3.3 Обработка у-глутамил гидролазой (из почки свиньи)
Восстанавливают лиофилизированную у-глутамил гидролазу из почки свиньи в виале добавлением 1,1 мл воды и хранят во льду. Осторожно перемешивают в мерной колбе вместимостью 10 мл: 1 мл экстракта пробы (6.3.2), 3.5 мл фосфатного буфера с аскорбатом с pH 4.5 (4.3.4) и 0,5 мл восстановленной у-глутамил гидролазы. Инкубируют при температуре 37 °С в течение 3 ч. Блокируют активность фермента нагреванием при температуре 100 °С в течение 3 мин. Охлаждают и доводят до объема фосфатным буфером с аскорбатом с pH 4,5 (4.3.4). Центрифугируют (100Од, 10 мин), чтобы удалить осажденный белок. Надосадочную жидкость хранят при температуре минус 18 °С для последующего анализа.
6.4 Калибровка
6.4.1 Исходный раствор фолиевой кислоты (100 мкг/мл)
Точно взвешивают 50 мг фолиевой кислоты (4.2.15), высушенной до постоянной массы, и растворяют в фосфатном буфере (4.3.2) в мерной колбе вместимостью 500 мл. Объем содержимого колбы доводят до метки фосфатным буфером. Прокапывают толуолом, чтобы поверхность была покрыта.
6.4.2 Проверка концентрации исходного раствора фолиевой кислоты
Переносят 10 мл исходного раствора (6.4.1) в мерную колбу вместимостью 100 мл и объем содержимого колбы доводят до метки фосфатным буфером с pH 7,0 (4.3.2). Измеряют поглощение раствора при 282 нм. используя фосфатный буфер в качестве холостой пробы. Рассчитывают концентрацию фолиевой кислоты р, г/л, по формуле (1):
О)
V,
Р =
А ■ М
е • Ь
где А — величина поглощения раствора при 282 нм;
М — молярная масса фолиевой кислоты, равная 441,4 г моль*1:
с — молярный коэффициент поглощения фолиевой кислоты [4] при 282 нм, равный 27600 л моль'1 см'1;
b —длина поглощения, см;
V — коэффициент разбавления (при разбавлении).
6.4.3 Стандартный раствор фолиевой кислоты (1 мкг/мл)
Добавляют 5 мл исходного раствора (6.4.1) в 475 мл воды и доводят pH до 7.5 гидроксидом натрия (4.2.7). Разбавляют до 500 мл водой. Используют свежеприготовленный раствор. Можно выполнить дополнительные разбавления при необходимости.
6.4.4 Разбавленный стандартный раствор фолиевой кислоты (100 нг/мл) для использования в инокуляте
Добавляют 10 мл стандартного раствора (6.4.3) в примерно 60 мл воды и доводят pH до 7.5 гидроксидом натрия (4.2.7). Разбавляют до 100 мл водой. Используют свежеприготовленный раствор.
6.5 Определение
6.5.1 Общие положения
Определяют содержание фолиевой кислоты в использованных ферментных препаратах и корректируют его соответствующим образом.
6.5.2 Обработка стандартного раствора (1 мкг/мл)
1 мл стандартного раствора (6.4.3) рассматривают как аналитическую пробу и проводят на ней экстракцию и соответствующую обработку ферментом, как описано в 6.3. В результате, как правило, концентрация фолиевой кислоты составит 10 нг/мл.
6.5.3 Разбавление экстрактов и обработанных стандартных растворов
6.5.3.1 Общие положения
Этапы разбавления, описанные в 6.5.3.2. 6.5.3.3. 6.5.3.4. выполняют с применением стандартной методики с использованием аналитической пробирки. В случае анализа с использованием 96-луночного микропланшета действуют в соответствии с 6.5.4.3.
Этап разбавления можно скорректировать при низких или высоких уровнях концентрации фолата.
6.5.3.2 Калибровочный раствор (0,3 нг/мл)
Переносят пипеткой 7,5 мл обработанного стандартного раствора (6.5.2) в мерную колбу вместимостью 250 мл. Добавляют 7.5 мл фосфатного буфера (4.3.5) и объем содержимого колбы доводят до метки водой.
6.5.3.3 Вторичные калибровочные растворы (0,2 и 0,4 нг/мл) (на усмотрение пользователей настоящего стандарта)
Переносят пипеткой 5 и 10 мл обработанного стандартного раствора (6.5.2) в мерные колбы вместимостью 250 мл Добавляют одинаковый объем фосфатного буфера с pH 6.1 (4.3.5) и объем содержимого колб доводят до метки водой.
6.5.3.4 Пробы
Для каждой пробы переносят пипеткой 5 мл раствора пробы, обработанного ферментом (6.3.3), в мерную колбу вместимостью 250 мл. Добавляют 5 мл фосфатного буфера с pH 6.1 (4.3.5) и объем содержимого колб доводят до метки водой.
6.5.4 Анализ
6.5.4.1 Общие положения
Первоначальное значение pH раствора во время инкубации должно составлять 6.1 ± 0.1.
Микробиологический анализ можно проводить в аналитических пробирках или на 96-луночных микропланшетах. Объем калибровочных растворов, экстрактов пробы и аналитической среды может варьироваться в зависимости от вида анализа. Типичные примеры объемов и так далее представлены в 6.5.4 2 и 6.5.4.3.
6.5.4.2 Анализ при использовании аналитических пробирок
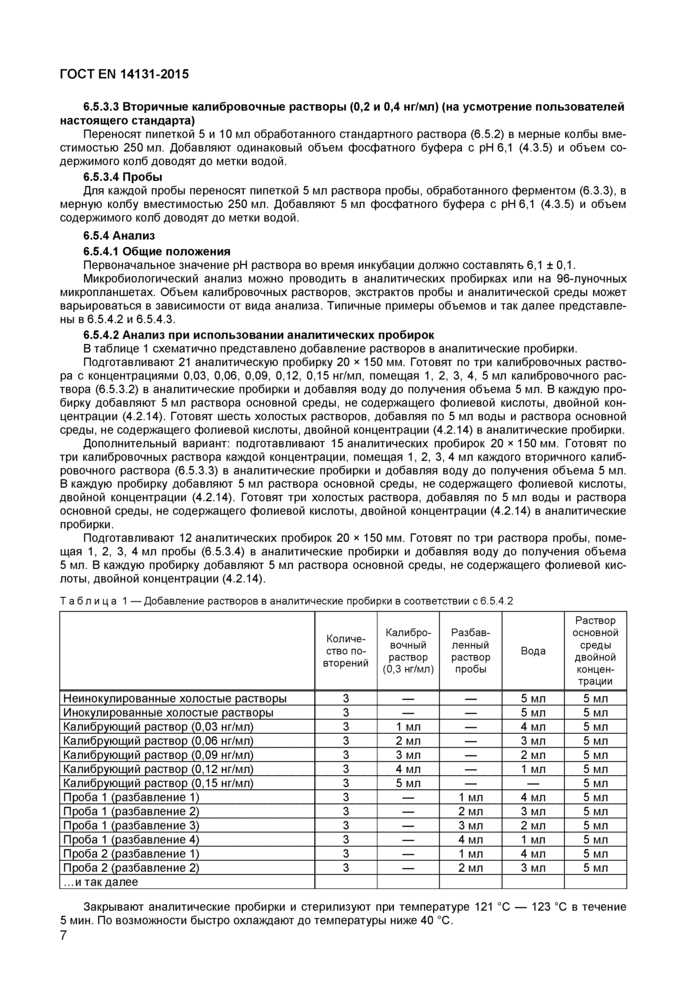
В таблице 1 схематично представлено добавление растворов в аналитические пробирки.
Подготавливают 21 аналитическую пробирку 20 * 150 мм. Готовят по три калибровочных раствора с концентрациями 0,03, 0,06, 0,09, 0.12, 0,15 нг/мл, помещая 1. 2. 3. 4. 5 мл калибровочного раствора (6.5.3.2) в аналитические пробирки и добавляя воду до получения объема 5 мл. В каждую пробирку добавляют 5 мл раствора основной среды, не содержащего фолиевой кислоты, двойной концентрации (4.2.14). Готовят шесть холостых растворов, добавляя по 5 мл воды и раствора основной среды, не содержащего фолиевой кислоты, двойной концентрации (4 2.14) в аналитические пробирки.
Дополнительный вариант: подготавливают 15 аналитических пробирок 20 x 150 мм. Готовят по три калибровочных раствора каждой концентрации, помещая 1. 2. 3. 4 мл каждого вторичного калибровочного раствора (6.5.3.3) 8 аналитические пробирки и добавляя воду до получения объема 5 мл. В каждую пробирку добавляют 5 мл раствора основной среды, не содержащего фолиевой кислоты, двойной концентрации (4.2.14). Готовят три холостых раствора, добавляя по 5 мл воды и раствора основной среды, не содержащего фолиевой кислоты, двойной концентрации (4.2.14) в аналитические пробирки.
Подготавливают 12 аналитических пробирок 20 х 150 мм. Готовят по три раствора пробы, помещая 1, 2, 3, 4 мл пробы (6.5.3.4) в аналитические пробирки и добавляя воду до получения объема 5 мл. В каждую пробирку добавляют 5 мл раствора основной среды, не содержащего фолиевой кислоты, двойной концентрации (4.2.14).
|
Таблица 1 —Добавление растворов в аналитические пробирки в соответствии с 6 5 4 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Закрывают аналитические пробирки и стерилизуют при температуре 121 °С — 123 °С в течение 5 мин. По возможности быстро охлаждают до температуры ниже 40 °С.
Асептически инокулируют каждую пробирку, кроме трех пробирок с холостыми растворами. 50 мкл рабочего инокулята (4.5.4). который вводят стерильным шприцем или аналогичным устройством.
Проводят инкубацию при температуре (37 ± 0.2) °С в течение 15-24 ч.
Перемешивают и помещают аналитические пробирки с неинокулированными холостыми растворами в спектрометр, установленный на 550-650 нм. и задают 100 %-ное пропускание при установившемся состоянии. Измеряют поглощение оставшихся растворов в установившемся состоянии. Временной промежуток между перемешиванием и считыванием должен быть идентичным.
6.5.4.3 Анализ при использовании микропланшета (на усмотрение пользователей настоящего стандарта)
При помощи 12-канальной пипетки вводят 150 мкл фосфатного буфера (4.3.5) в лунки А1-Н12 в стерильном 96-луночном микропланшете.
Пипеткой переносят 150 мкл стандартного раствора, обработанного ферментом (6.5.2) в лунки G1-G2.
150 мкл каждого раствора аналитической пробы, обработанного ферментом (6.3.3), переносят дважды в лунки в ряде G. Тщательно перемешивают.
Выполняют серию разбавлений калибровочного раствора и растворов аналитической пробы, при которой переносят 150 мкл из лунок G1-G12 в лунки F1-F12, перемешивают, затем из F1-F12 в Е1-Е12 и т. д. В конце извлекают и отбрасывают 150 мкл из каждой лунки А1-А12 после перемешивания.
Добавляют 150 мкл инокулированного раствора основной среды, не содержащей фолиевую кислоту (4.5.5), в лунки А1-Н12.
Помещают микропланшет в пластмассовый контейнер и герметически закрывают. В контейнер помещают чашу с водой, чтобы обеспечить достаточный уровень влажности и предотвратить испарение воды из лунок. Проводят инкубацию микропланшета при температуре 37 °С в течение 15-24 ч. Вынимают планшет и охлаждают до комнатной температуры.
Перемешивают содержимое каждой лунки 12-канальной пипеткой, повторяя всасывание и введение. пока бактериальные суспензии не станут однородными.
Устанавливают поглощение всех лунок по считывающему устройству микропланшета при 550-650 нм, используя инокулированные холостые растворы (Н1-Н12) в качестве эталона.
7 Вычисление
7.1 Калибровочная кривая
Отмечают на графике точки величин поглощения для всех уровней калибровки относительно соответствующей массы фолиевой кислоты и строят калибровочную кривую.
7.2 Аналитические пробы
Определяют массу фолата, нг. для каждого разбавления аналитической пробы, выполненного согласно 6.5.4.2 (среднее из трех значений) методом интерполяции по калибровочной кривой.
Рассчитывают массовую долю фолата w. мкг/100 г, для каждой аналитической пробы по формуле (2):
(2)
(т: - т:) V1 100
ПЬ V2 ' 1000*
где гл, — масса фолата, присутствующего в каждом разбавлении аналитической пробы, выполненном согласно 6.5.4.2. установленная по калибровочному графику, нг; т2 — масса фолата, присутствующего в использованных ферментных препаратах, нг;
V\ —окончательный общий объем раствора аналитической пробы, полученного согласно 6.5.3.4, мл;
т3 — масса аналитической пробы, взятой для анализа, г;
V2 —объем раствора аналитической пробы, перенесенного в аналитическую пробирку согласно 6.5.4.2. мл;
100 — коэффициент конверсии для получения результата на 100 г аналитической пробы;
1000 — коэффициент конверсии для получения результата в микрограммах фолата.
7.3 Критерии приема данных
Критерии приема данных зависят от вида анализа и должны быть установлены в каждой лаборатории. Как минимум должны быть учтены следующие параметры:
- максимальная мутность инокулированных холостых растворов;
- минимальная мутность наиболее концентрированного калибровочного раствора;
- вариации величин поглощения по результатам повторных опытов, полученных на каждом уровне калибровки;
- вариации полученных по расчету значений концентрации фолата всех разбавлений раствора аналитической пробы;
- анализ соответствующего сертифицированного эталонного материала (по возможности).
Критерии приема данных также могут охватывать проверку результатов, полученных при использовании 5-формилтетрагидрофолиевой кислоты в качестве стандартного вещества. Результаты должны быть эквивалентны результатам, полученным при использовании фолиевой кислоты в качестве стандартного вещества.
7.4 Выражение результатов
Результаты выражают как массовую долю общего количества фолата в аналитической пробе (мкг/100 г).
8 Прецизионность
8.1 Общие положения
Прецизионность метода была установлена в ходе межлабораторных испытаний, проводимых в соответствии с ISO 5725 (2). Результаты испытаний кратко изложены в приложении В. Возможно, что значения, полученные в ходе испытаний, нельзя будет применить к диапазонам концентраций исследуемого вещества и матрицам аналитической пробы, отличным от указанных в приложении.
8.2 Повторяемость
Абсолютное расхождение между двумя отдельными результатами испытания, которые были получены при применении одного и того же метода на идентичном испытательном материале одним и тем же оператором на одном и том же оборудовании в течение короткого промежутка времени, не должно превышать предел повторяемости г более чем в 5 % случаев.
|
Мука грубого помола (обойная) (CRM 121) |
х = 50,0 мкг/100 г |
г= 12,9 мкг/100 г |
|
Сухое молоко (CRM 421) |
х= 142 мкг/100 г |
г = 26 мкг/100 г |
|
Овощная смесь (CRM 485) |
х = 315 мкг/100 г |
г - 43 мкг/100 г |
|
Свиная печень (CRM 487) |
х = 1330 мкг/100 г |
г = 307 мкг/100 г |
|
8.3 Воспроизводимость | ||
|
Абсолютное расхождение между двумя отдельными результатами испытания, полученными при | ||
|
применении одного и того же метода на идентичном испытательном материале в двух лабораториях, не должно превышать предел воспроизводимости R более чем в 5 % случаев. | ||
|
Значения: | ||
|
Мука грубого помола (обойная) (CRM 121) |
х = 50.0 мкг/100 г |
R = 31.3 мкг/100 г |
|
Сухое молоко (CRM 421) |
х= 142 мкг/100 г |
R = 67 мкг/100 г |
|
Овощная смесь (CRM 485) |
х = 315 мкг/100 г |
/?= 122 мкг/100 г |
|
Свиная печень (CRM 487) |
х = 1330 мкг/100 г |
R = 637 мкг/100 г |
Значения:
9 Протокол испытаний
Протокол испытаний должен содержать следующие данные:
a) всю информацию, необходимую для полной идентификации пробы;
b) ссылку на настоящий стандарт;
c) дату и тип методики отбора пробы (если они известны);
d) дату поступления пробы в лабораторию;
e) дату проведения испытаний;
О результаты испытания с указанием единиц выражения результатов; д) любые особенности, наблюдавшиеся при проведении испытаний;
h) любые операции, не оговоренные в методике или рассматриваемые как необязательные;
i) фамилию и подпись ответственного лаборанта.