ГОСТ 31580.7-2012
Имплантаты офтальмологические. Интраокулярные линзы. Часть 7. Клинические испытания
Купить ГОСТ 31580.7-2012 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на переднекамерные и заднекамерные интраокулярные линзы (далее - ИОЛ) независимо от материала, из которого они изготовлены, места локализации в глазу пациента и функционального назначения (протез хрусталика глаза или линза, предназначенная для коррекции афакии и аномалий рефракции). Стандарт устанавливает методы клинических испытаний модификаций ИОЛ, а также требования к протоколам клинических испытаний ИОЛ.
Содержит требования ISO 11979-7:2001
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Этические соглашения
5 Требования
6 Методология
7 Требования к представлению результатов клинических испытаний
Приложение А (справочное) Примеры серьезных неблагоприятных исходов для переднекамерных и заднекамерных ИОЛ и показателей остроты зрения
Приложение В (рекомендуемое) Требования к расписке об информированности
Приложение С (рекомендуемое) Руководство по определению модификации базовой модели ИОЛ
Приложение D (рекомендуемое) Элементы, включаемые в протокол клинических испытаний ИОЛ, и дополнительное клиническое руководство по разработке плана клинических испытаний и анализу результатов
Приложение Е (рекомендуемое) Окончательный отчет о клинических испытаниях ИОЛ
Библиография
| Дата введения | 01.01.2015 |
|---|---|
| Добавлен в базу | 01.10.2014 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 24.05.2012 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 41-2012 |
|---|---|---|---|
| 01.11.2012 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 649-ст |
| Разработан | ФГУП ВНИИНМАШ | ||
| Издан | Стандартинформ | 2013 г. |
Ophthalmic implants. Intraocular lenses. Part 7. Clinical investigations
- ГОСТ 31580.2-2012 Имплантаты офтальмологические. Интраокулярные линзы. Часть 2. Оптические свойства и методы испытаний
- ГОСТ 31580.3-2012 Имплантаты офтальмологические. Интраокулярные линзы. Часть 3. Механические свойства и методы испытаний
- ГОСТ 31580.6-2012 Имплантаты офтальмологические. Интраокулярные линзы. Часть 6. Срок годности и стабильность при транспортировании
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17
стр. 18
стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ (МГС)
EURO-ASIAN COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION (ISC)
МЕЖГОСУДАРСТВЕННЫЙ
ГОСТ 31580. 7 — 2012
СТАНДАРТ
(ISO 11979-7:2001)
Имплантаты офтальмологические
ИНТРАОКУЛЯРНЫЕ ЛИНЗЫ
Часть 7
Клинические испытания
(ISO 11979-7:2001, MOD)
Издание официальное
(ИЗ
Москва
Стандартинформ
2013
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт стандартизации и сертификации в машиностроении» (ВНИИНМАШ)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Госстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол № 41-2012 от 24 мая 2012 г.)
|
За принятие стандарта проголосовали: | ||||||||||||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 01 ноября 2012 г. № 649-ст межгосударственный стандарт ГОСТ 31580-7-2012 (ISO 11979-7:2001) введен в действие в качестве национального стандарта Российской Федерации с 1 января 2015 г.
5 Настоящий стандарт модифицирован по отношению к международному стандарту ISO 11979-7:2001 Ophthalmic implants - Intraocular lenses - Part 7: Clinical investigations (Имплантаты офтальмологические. Интраокулярные линзы. Часть 7.
II
с планом клинических испытаний, требованиям нормативных документов, чтобы следить за деятельностью испытателя.
6.3 Требования к дополнительному медицинскому обслуживанию
6.3.1 Требования к медицинскому обслуживанию приведены в 4.1.3.
6.4 Требования к плану клинических испытаний6.4.1 Общие требования
Требования к плану клинических испытаний приведены в [2] (подраздел
4.2).
6.4.2 Дополнительные требования
6.4.2.1 Испытуемая линза должна быть имплантирована только в один глаз субъекта.
6.4.2.2 Клиническим испытаниям в каждый отчетный период подвергают минимальное число образцов ИОЛ. Организатор должен убедиться в наличии необходимого числа субъектов для обеспечения клинических испытаний необходимым числом образцов ИОЛ.
Примечание — Примеры клинических предоперационных/операционных и послеоперационных форм отчета приведены в таблицах D.1 — D.5 приложения D.
6.5 Требования к организатору клинических испытаний
6.5.2 Перед началом клинических испытаний организатор должен определить, установить, обеспечить и распределить все связанные с испытаниями обязанности и функции.
6.5.3 Организатор должен обеспечить соответствие всей документации, находящейся у испытателя, организатора и наблюдателя, плану клинических испытаний и применяемым требованиям для обеспечения качества испытаний.
6.5.4 Организатор является ответственным лицом за:
а) выбор клинических испытателей и клинических испытательных центров для конкретного испытания и, в случае необходимости, координатора;
б) выбор и назначение наблюдателя для клинических испытаний. При отсутствии наблюдателя организатор должен взять на себя его обязанности.
Организатор обеспечивает контроль за клиническими испытаниями даже в случае, если контрольные полномочия переданы другому лицу. Организатор должен проинструктировать наблюдателя о действиях в случае отсутствия и/или некорректных данных, приведенных в плане клинических испытаний;
в) подготовку и обновление журнала клинического испытателя;
г) обеспечение клинического испытателя планом клинических испытаний и всеми поправками, сопутствующими клиническим испытаниям;
д) утверждение плана клинических испытаний;
е) предоставление образцов ИОЛ, подлежащих клиническим испытаниям;
ж) предоставление испытателю необходимой информации и его обучение, если это предусмотрено планом клинических испытаний;
и) информирование в письменном виде в течение клинических испытаний всех клинических испытателей о всех серьезных неблагоприятных исходах и воздействиях ИОЛ на субъект, произошедших при клинических испытаниях, проводимых в разных организациях (лабораториях) и ставших известными организатору;
к) немедленное информирование клинического испытателя о преждевременном окончании или приостановке клинических испытаний, и, в случае необходимости, отслеживание, чтобы такая информация была передана соответствующим полномочным лицам, этическим комитетам и комиссиям по безопасности;
л) информирование клинических испытателей об уровне развития ИОЛ и о требованиях, необходимых для проверки эксплуатационных характеристик и безопасности ИОЛ;
м) проверку и утверждение любых отклонений от плана клинических испытаний и осуществление необходимых корректирующих или превентивных действий;
н) сбор, хранение, обеспечение целостности и полноты заполнения соответствующими исполнителями следующих документов:
1) всех документов по 6.1.3,
2) копии подписанных и датированных форм отчета,
з) записи о любых неблагоприятных исходах или неблагоприятных воздействиях ИОЛ на субъект, о которых сообщено организатору в процессе клинических испытаний,
4) все статистические сводки и сопутствующие им данные,
5) окончательный отчет о клинических испытаниях,
п) обеспечение системы учета применяемых и неиспользуемых ИОЛ.
6.6 Требования к наблюдателю
6.6.1 Наблюдатель является ответственным лицом за:
9
а) соответствие предпринимаемых действий плану клинических испытаний, чтобы любое отклонение от плана клинических испытаний было оговорено с клиническими испытателями, задокументировано и доложено организатору;
б) использование ИОЛ в соответствии с планом клинических испытаний и сообщение организатору, в случае необходимости внесения изменения в конструкцию ИОЛ или метод ее использования;
в) обеспечение клинического испытателя всеми необходимыми инструментами, приспособлениями и расходными материалами для безопасного и эффективного проведения клинических испытаний;
г) наличие в распоряжении клинического испытателя адекватного числа субъектов и ИОЛ;
д) получение подписанных и датированных расписок об информированности от каждого субъекта перед началом клинических испытаний;
е) заполнение в соответствующие сроки форм отчета с информацией, соответствующей полученным данным;
ж) соблюдение процедур регистрации и отчета организатора о неблагоприятных исходах и неблагоприятных воздействиях ИОЛ на субъект;
и) выполнение процедур подсчета и учета ИОЛ;
к) своевременное проведение и оформление документации по техническому обслуживанию и калибровке оборудования, используемого при клинических испытаниях;
л) оформление соответствующего документа при отказе субъекта от дальнейшего участия в клинических испытаниях, обсуждение с клиническим испытателем и информирование организатора;
м) обсуждение обнаруженных несоответствий с испытателем и информирование организатора в письменном виде.
6.7 Требования к клиническому испытателю6.7.1 Общие требования
6.7.1.1 Если клиническим испытателем является организация, то в качестве ее представителя должно быть назначено лицо, обладающее необходимой квалификацией и выполняющее обязанности, указанные в 6.7.1.2— 6.7.1.3.
6.7.1.2 Клинический испытатель должен:
а) быть практикующим врачом, имеющим соответствующую квалификацию,
10
и иметь допуск к клиническим испытаниям;
б) иметь опыт в области применения испытуемой ИОЛ;
в) знать методологию и требования к проведению клинических испытаний;
г) быть обучен корректному получению расписки об информированности.
6.7.1.3 Клинический испытатель отвечает за каждодневное проведение клинических испытаний, а также за безопасность и благополучие субъектов, вовлеченных в клиническое испытание. Клинический испытатель должен:
а) обладать ресурсами для проведения клинических испытаний;
б) быть уверен в том, что проведение клинических испытаний не приведет к конфликту интересов;
в) получить от организатора и ознакомиться со всей необходимой информацией о ИОЛ;
г) изучить план клинических испытаний до его подписания;
д) оказывать помощь наблюдателю и аудитору в действиях по контролю соответствия клинических испытаний плану, проверке данных и ведению документации;
е) обсуждать с организатором и наблюдателем и получать письменное разрешение на изменение плана клинических испытаний в случае необходимости;
ж) следить за тем, чтобы план клинических испытаний соблюдался всеми вовлеченными в испытания лицами. Немедленно сообщать организатору в письменном видео любых отклонениях от плана;
и) обеспечить правильное проведение и завершение клинических испытаний;
к) обеспечить лечение субъекта при возникновении чрезвычайных ситуаций, а также защиту здоровья и благополучия субъекта;
л) убедиться в том, что получено согласие комитета по этике на проведение клинических испытаний в организации, проводящей испытания;
м) информировать организатора о выводах комитета по этике;
н) информировать комитет по этике и иметь разрешение на любые существенные изменения в плане клинических испытаний, утвержденные организатором;
п) информировать комитет по этике о любых серьезных
неблагоприятных воздействиях ИОЛ на субъект;
р) своевременно информировать организатора о всех неблагоприятных
11
исходах и воздействиях ИОЛ на субъект;
с) обеспечить адекватный предварительный набор субъектов;
т) обеспечить адекватное информирование субъектов;
у) получить у субъекта расписку об информированности;
ф) обеспечить маркировку клинических записей субъектов, участвующих в клинических испытаниях. Если необходимо, вовлеченные в клинические испытания субъекты должны получить документы, подтверждающие их участие в клинических испытаниях, вместе с идентификационной и сопутствующей информацией для оказания своевременной медицинской помощи, с указаниями адресов и телефонов субъектов.
Если необходимо, с разрешения субъекта его персональный врач должен получать информацию о состоянии субъекта;
х) снабдить субъекта инструкциями по его поведению при возникновении любых чрезвычайных ситуаций для охраны интересов субъекта. В этом случае отклонения от плана клинических испытаний не требуют предварительного согласования с организатором и комитетом по этике. Такие отклонения не должны рассматриваться как разрыв соглашений, однако должны документироваться и докладываться организатору;
ц) убедиться в том, что важная для безопасности и благополучия субъекта и продолжения клинических испытаний информация, полученная в процессе клинических испытаний, была предоставлена организатору и, при необходимости, с разрешения субъекта — персональному врачу субъекта;
ч) информировать субъекта и/или с разрешения субъекта — персонального врача субъекта о приостановке или досрочном прекращении клинических испытаний с указанием причин прекращения;
ш) нести первичную ответственность за точность, законность и безопасность данных о клинических испытаниях, документах и записях субъекта, сделанных во время и после окончания клинических испытаний. Клинический испытатель должен подписывать отчеты. Любые исправления в данных допускается вносить только персоналу, участвующему в испытаниях; исправления должны быть подписаны и датированы, а исходные данные — сохранены;
щ) нести ответственность за сохранность исходных данных в течение всего периода испытаний, установленного в плане клинических испытаний;
э) обеспечивать руководство и распределение обязанностей всех лиц,
ответственных за проведение и оценку клинических испытаний в соответствующем центре клинических испытаний;
ю) убедиться, что все ИОЛ, подлежащие клиническим испытаниям, учтены.
Число полученных для испытаний ИОЛ должно соответствовать числу использованных и/или неиспользованных ИОЛ.
6.7.2 Дополнительные требования
6.7.2.1 Клинический испытатель должен немедленно сообщать организатору о всех случаях серьезного неблагоприятного исхода и указывать в отчетах о любых других неблагоприятных исходах.
7 Требования к представлению результатов клинических испытаний
7.1 Окончательный отчет о клинических испытаниях представляют даже в том случае, если клинические испытания прекращены преждевременно.
7.2 Окончательный отчет должен быть представлен в письменном виде. Он должен быть подписан организатором, координатором (если он имеется) и главным клиническим испытателем каждого испытательного центра. Отчет должен предоставляться по запросу всем клиническим испытателям и комитетам по этике.
7.3 Окончательный отчет о клинических испытаниях должен включать точную идентификацию ИОЛ, описание методологии и планирования клинических испытаний, все отклонения от плана клинических испытаний, анализ данных и все статистические данные и критические заметки, касающиеся целей исследований.
В окончательном отчете должны быть учтены данные по всем вовлеченным в клинические испытания субъектам. Идентификации субъектов по
испытательным центрам не должно быть в окончательном отчете или в публикуемых результатах.
7.4 Все клинические испытатели должны иметь возможность просмотреть и, при необходимости, внести замечания в окончательный отчет. Организатор должен сохранять записи, подтверждающие, что все испытатели получали отчет для ознакомления. Если клинический испытатель не согласен с окончательным отчетом, то его замечания должны быть записаны и предоставлены другим испытателям.
7.5 Если организатор или любой из испытателей не подписывает окончательный отчет, то он должен обосновать причины в письменном виде.
Примечание — Руководство по составлению окончательного отчета приведено в приложении Е.
13
Приложение А (справочное)
Примеры серьезных неблагоприятных исходов для переднекамерных и заднекамерных ИОЛ и показателей остроты зрения
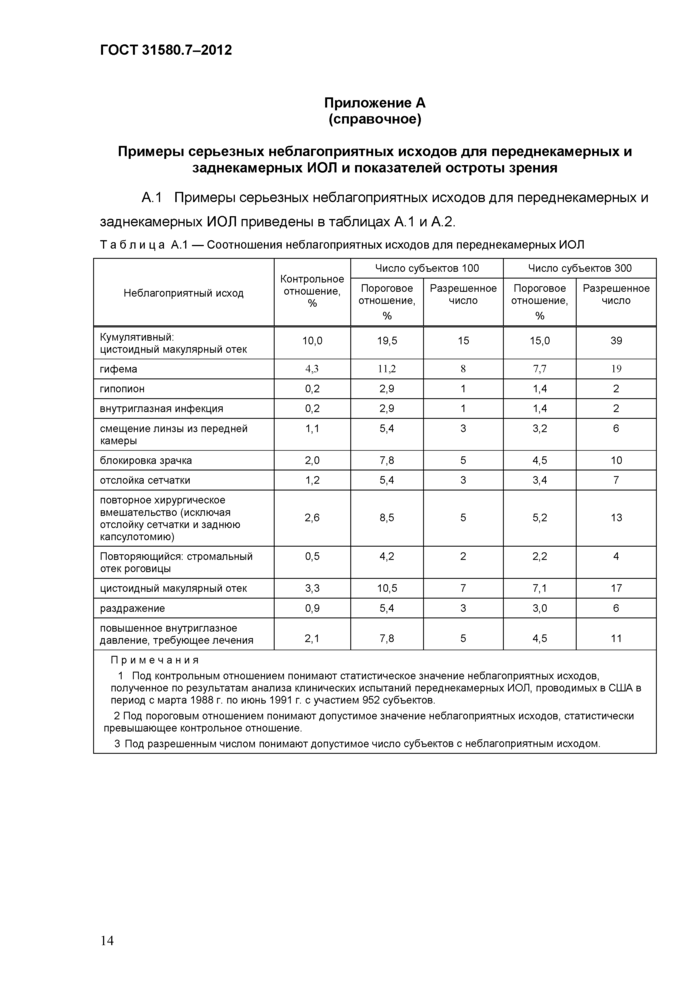
А.1 Примеры серьезных неблагоприятных исходов для переднекамерных изаднекамерных ИОЛ приведены в таблицах А.1 и А.2.
1 Под контрольным отношением понимают статистическое значение неблагоприятных исходов, полученное по результатам анализа клинических испытаний переднекамерных ИОЛ, проводимых в США в период с марта 1988 г. по июнь 1991 г. с участием 952 субъектов.
2 Под пороговым отношением понимают допустимое значение неблагоприятных исходов, статистически превышающее контрольное отношение.
3 Под разрешенным числом понимают допустимое число субъектов с неблагоприятным исходом.
Таблица А.1 — Соотношения неблагоприятных исходов для переднекамерных ИОЛ
1 Под контрольным отношением понимают статистическое значение неблагоприятных исходов, полученное по результатам анализа клинических испытаний переднекамерных ИОЛ, проводимых в США в период с марта 1988 г. по июнь 1991 г. с участием 952 субъектов.
2 Под пороговым отношением понимают допустимое значение неблагоприятных исходов, статистически превышающее контрольное отношение.
3 Под разрешенным числом понимают допустимое число субъектов с неблагоприятным исходом.
Таблица А.1 — Соотношения неблагоприятных исходов для переднекамерных ИОЛ
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Примечания | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
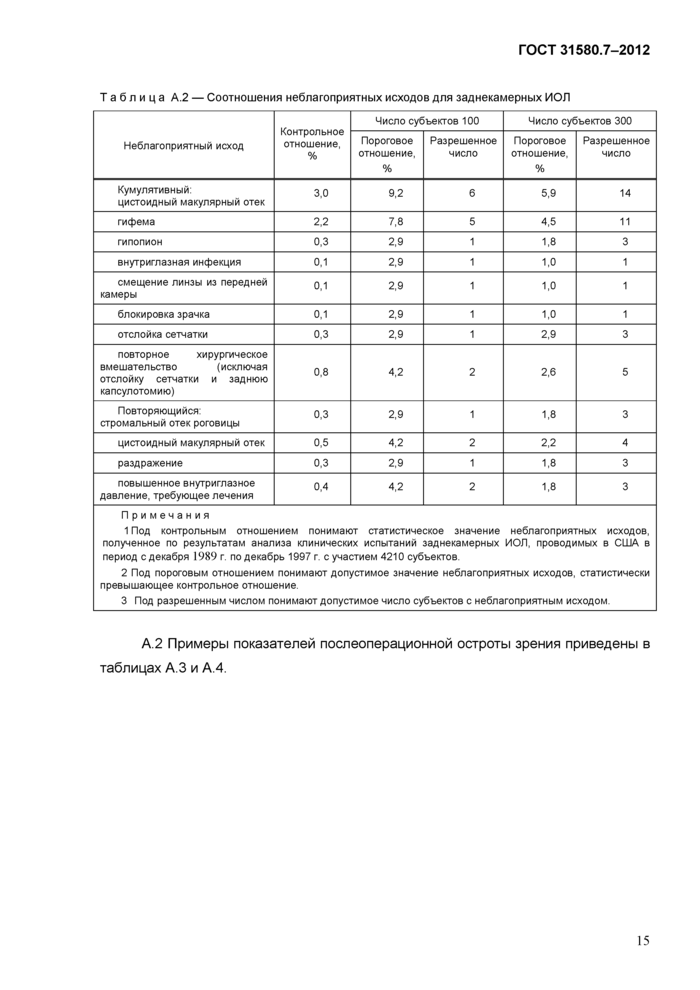
14Таблица А.2 — Соотношения неблагоприятных исходов для заднекамерных ИОЛ
|
Неблагоприятный исход |
Контрольное отношение, % |
Число субъектов 100 |
Число субъектов 300 | ||
|
Пороговое отношение, % |
Разрешенное число |
Пороговое отношение, % |
Разрешенное число | ||
|
Кумулятивный: цистоидный макулярный отек |
3,0 |
9,2 |
6 |
5,9 |
14 |
|
гифема |
2,2 |
7,8 |
5 |
4,5 |
11 |
|
гипопион |
0,3 |
2,9 |
1 |
1,8 |
3 |
|
внутриглазная инфекция |
0,1 |
2,9 |
1 |
1,0 |
1 |
|
смещение линзы из передней камеры |
0,1 |
2,9 |
1 |
1,0 |
1 |
|
блокировка зрачка |
0,1 |
2,9 |
1 |
1,0 |
1 |
|
отслойка сетчатки |
0,3 |
2,9 |
1 |
2,9 |
3 |
|
повторное хирургическое вмешательство (исключая отслойку сетчатки и заднюю капсулотомию) |
0,8 |
4,2 |
2 |
2,6 |
5 |
|
Повторяющийся: стромальный отек роговицы |
0,3 |
2,9 |
1 |
1,8 |
3 |
|
цистоидный макулярный отек |
0,5 |
4,2 |
2 |
2,2 |
4 |
|
раздражение |
0,3 |
2,9 |
1 |
1,8 |
3 |
|
повышенное внутриглазное давление, требующее лечения |
0,4 |
4,2 |
2 |
1,8 |
3 |
Примечания
1 Под контрольным отношением понимают статистическое значение неблагоприятных исходов, полученное по результатам анализа клинических испытаний заднекамерных ИОЛ, проводимых в США в период с декабря 1989 г. по декабрь 1997 г. с участием 4210 субъектов.
2 Под пороговым отношением понимают допустимое значение неблагоприятных исходов, статистически превышающее контрольное отношение.
3 Под разрешенным числом понимают допустимое число субъектов с неблагоприятным исходом.
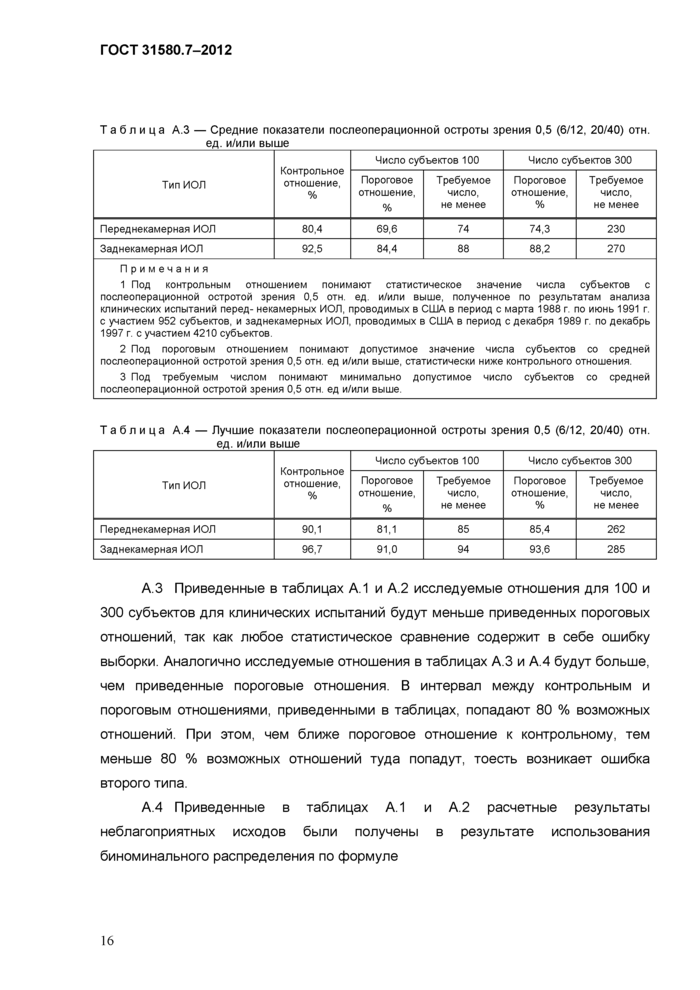
А.2 Примеры показателей послеоперационной остроты зрения приведены в таблицах А.З и А.4.15ед. и/или выше
ед. и/или выше
|
Таблица А.4 — Лучшие показатели послеоперационной остроты зрения 0,5 (6/12, 20/40) отн. _ед. и/или выше_ | ||||||||||||||||||||||
| ||||||||||||||||||||||
|
Таблица А.З — Средние показатели послеоперационной остроты зрения 0,5 (6/12, 20/40) отн. | ||||||||||||||||||||||
| ||||||||||||||||||||||
Примечания
1 Под контрольным отношением понимают статистическое значение числа субъектов с послеоперационной остротой зрения 0,5 отн. ед. и/или выше, полученное по результатам анализа клинических испытаний перед- некамерных ИОЛ, проводимых в США в период с марта 1988 г. по июнь 1991 г. с участием 952 субъектов, и заднекамерных ИОЛ, проводимых в США в период с декабря 1989 г. по декабрь 1997 г. с участием 4210 субъектов.
2 Под пороговым отношением понимают допустимое значение числа субъектов со средней послеоперационной остротой зрения 0,5 отн. ед и/или выше, статистически ниже контрольного отношения.
3 Под требуемым числом понимают минимально допустимое число субъектов со средней послеоперационной остротой зрения 0,5 отн. ед и/или выше.
А.З Приведенные в таблицах А.1 и А.2 исследуемые отношения для 100 и 300 субъектов для клинических испытаний будут меньше приведенных пороговых отношений, так как любое статистическое сравнение содержит в себе ошибку выборки. Аналогично исследуемые отношения в таблицах А.З и А.4 будут больше, чем приведенные пороговые отношения. В интервал между контрольным и пороговым отношениями, приведенными в таблицах, попадают 80 % возможных отношений. При этом, чем ближе пороговое отношение к контрольному, тем меньше 80 % возможных отношений туда попадут, тоесть возникает ошибка второго типа.
А.4 Приведенные в таблицах А.1 и А.2 расчетные результаты неблагоприятных исходов были получены в результате использования биноминального распределения по формуле
16
|
Pr\X > |
-ICK*
i" 1 < 0,05,
(A-1)
где p — контрольное отношение (тое. отношение неблагоприятных исходов для контрольной группы);
п — размер выборки;
х — число зарегистрированных во время клинического испытания неблагоприятных исходов;
X — число неблагоприятных исходов.
А.5 Биноминальное распределение используют для того, чтобы проверить, является ли исследуемое отношение неблагоприятных исходов меньше или равным отношению для исторической контрольной группы. Аналогично для таблиц А.З и А.4 биноминальное распределение используют для того, чтобы проверить, является ли исследуемое отношение остроты зрения 0,5 отн. ед. и выше более или равным отношению для контрольной группы. Альтернативная гипотеза состоит в том, что исследуемое отношение менее отношения для контрольной группы.
А.6 Максимальное значение благоприятных исходов (таблица А.4) может быть получено с использованием биноминального распределения по формуле
(А. 2)
где р — контрольное отношение для остроты зрения 0,5 отн. ед. и выше; п — размер выборки;
х — число зарегистрированных успешных исходов испытания;
X — число неблагоприятных исходов.
17
Клинические испытания) путем изменения структуры (в том числе исключения приложения А и включения приложения В).
Сравнение структуры международного стандарта со структурой настоящего стандарта приведено в приложении ДА.
Дополнительные фразы, слова, показатели и/или их значения, внесенные в текст стандарта, выделены курсивом.
При ссылке на ISO 14155-1:2003 «Clinical investigation of medical device for human subjects - Part 1: General requirements» (ИСО 14155-1:2003 «Клинические испытания медицинских изделий. Часть 1. Общие требования») в настоящем стандарте дополнительно приведены содержание соответствующих пунктов и приложение Е данного международного стандарта, которые выделены вертикальной линией, расположенной слева от текста.
Степень соответствия - модифицированная (MOD).
Стандарт подготовлен на основе применения ГОСТ Р 52458-2005 (ИСО 11979-7:2001)
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта публикуется в ежемесячно издаваемом информационном указателе «Национальные стандарты».
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячно издаваемом информационном указателе «Национальные стандарты». В случае пересмотра ши отмены настоящего стандарта соответствующая информация будет опубликована в ежемесячно издаваемом информационном указателе «Национальные стандарты»
© Стандартинформ, 2013
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Ш
Приложение В (рекомендуемое)Требования к расписке об информированностиВ.1 Общие требования
В.1 Общие требования
Расписка об информированности должна быть получена от субъекта в письменном виде перед началом участия субъекта в клинических испытаниях.
Примечание — Форма расписки обычно состоит из информационной части и согласительной/подписной части. Эти две части могут быть либо скомбинированы в одном документе (информация для пациента и форма расписки) или разделены на лист информации для пациента и форму расписки пациента.
В.2 Процесс получения расписки об информированности
При получении расписки об информированности следует соблюдать следующие правила:
а) избегать любого принуждения или незаконного влияния на субъект для обеспечения его участия;
б) не уклоняться или не пытаться уклониться от соблюдения законных прав субъекта;
в) использовать язык, который не является специальным и понятен субъекту или его законному представителю;
г) предоставить субъекту время для обдумывания решения об участии;
д) расписка должна содержать датированные подписи субъекта или его законного представителя и клинического испытателя;
е) включать субъект в план клинических испытаний.
В.З Информация, предоставляемая субъекту для получения расписки об информированности
На понятном для субъекта или его законного представителя языке должна быть изложена следующая информация:
а) описание испытания/назначение:
1) исследования, включенные в испытания,
2) цель испытаний,
3) предполагаемая длительность испытаний и степень вовлеченности субъекта в процесс испытаний,
4) описание исследуемой ИОЛ,
ГОСТ 31580.7-2012 (ISO 11979-7:2001)МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТИмплантаты офтальмологические
Имплантаты офтальмологические
ИНТРАОКУЛЯРНЫЕ ЛИНЗЫ Часть 7 Клинические испытания
Ophthalmic implants. Intraocular lenses. Part 7. Clinical investigations
Дата введения 2015-01-01
1 Область применения
Настоящий стандарт распространяется на переднекамерные и заднекамерные интраокулярные линзы (далее — ИОЛ) независимо от материала, из которого они изготовлены, места локализации в глазу пациента и функционального назначения (протез хрусталика глаза или линза, предназначенная для коррекции афакии и аномалий рефракции).
Стандарт устанавливает методы клинических испытаний модификаций ИОЛ, а также требования к протоколам клинических испытаний ИОЛ.
Примечание — Другие типы ИОЛ подвергают клиническим испытаниям по [1].
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие межгосударственные стандарты:
ГОСТ 31580.2-2012 (ISO 11979-2:1999) Имплантаты
офтальмологические. Интраокулярные линзы. Часть 2. Оптические свойства и методы испытаний
ГОСТ 31580.3-2012 (ISO 11979-3:1999) Имплантаты
офтальмологические. Интраокулярные линзы. Часть 3. Механические свойства и методы испытаний
ГОСТ 31580.6-2012 (ISO 11979-6:1999) Имплантаты
офтальмологические. Интраокулярные линзы. Часть 6. Срок годности и
Издание официально
стабильность при транспортировании
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов по указателю «Национальные стандарты», составленному по состоянию на 1 января текущего года, и по соответствующим информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом, следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
3.1 В настоящем стандарте применены термины по национальному стандарту государств, упомянутых в предисловии, как проголосовавших за принятие настоящего межгосударственного стандарта, ГОСТ 31580.3 и следующие термины с соответствующими определениями:
3.1.1 серьезный неблагоприятный исход (adverse device effect): Послеоперационный исход, потенциально угрожающий зрению.
Примечание — Примеры серьезных неблагоприятных исходов приведены в таблицах А.1 и А.2 приложения А.
3.1.2 план клинических испытаний; ПКИ (clinical investigation plan): Документ, определяющий цели, задачи, методологию, систему контроля, проведения анализа и хранения данных о клинических испытаниях.
3.1.3 клиническое испытание (clinical investigation): Любое
разработанное и запланированное систематическое изучение с целью проверки безопасности и/или эксплуатационных свойств ИОЛ с участием субъектов.
3.1.4 субъект (subject): Лицо, участвующее в клинических испытаниях с применением испытуемой ИОЛ и/или в составе контрольной группы.
3.1.5 клинический испытатель (clinical investigator): Лицо и/или организация, ответственные за проведение клинических испытаний и несущие клиническую ответственность за благополучие вовлеченных субъектов.
Примечание — Лицо и/или организация назначаются в соответствии с действующим законодательством.
3.1.6 организатор (sponsor): Лицо и/или организация, которые несут ответственность за начало и/или проведение клинических испытаний.
3.1.7 главный клинический испытатель (principal clinical investigator):
ГОСТ 31580.7-2012
Клинический испытатель, ответственный за организацию клинических испытаний, проводимых в одной организации (лаборатории).
3.1.8 координатор (coordinating clinical investigator): Клинический
испытатель, назначаемый организатором для координации клинических испытаний, проводимых в нескольких организациях (лабораториях).
3.1.9 клиническая эффективность (clinical performance): Изучение определенного типа ИОЛ и/или его потребительских свойств в случае конкретного использования на субъектах, для которых оно предназначено.
3.1.10 форма отчета (case report form): Документ, предназначенный для записи всей информации, предоставляемой организатору по каждому субъекту в соответствии с требованиями плана клинических испытаний.
3.1.11 журнал клинического испытателя (clinical investigator’s brochure): Документ, предназначенный для записи клинической и неклинической информации об испытуемой ИОЛ, относящейся к испытаниям на субъектах.
3.1.12 наблюдатель (monitor): Лицо, назначенное организатором для наблюдения за соответствием действий клинического испытателя протоколу клинических испытаний и проверки исходных данных.
3.1.13 исходные данные (source documents): Информация,
представленная в виде оригинальных, идентифицированных и
сертифицированных записей клинических осмотров, наблюдений и/или других действий в течение клинических испытаний, необходимая для оценки клинических испытаний.
3.1.14 окончательный отчет (final report): Документ, заполняемый после окончания клинических испытаний, содержащий описание и оценку результатов.
3.1.15 комитет по этике (ethics committee): Независимый
компетентный орган, отвечающий за безопасность, благополучие и права субъектов, принимающих участие в клинических испытаниях.
3.1.16 расписка об информированности (informed consent): Документ, имеющий юридическую силу, подтверждающий согласие субъекта на добровольное участие в клинических испытаниях.
Примечание — Требования к расписке об информированности приведены в приложении В.
3.1.17 контрольная группа (control populations): Субъекты, которым
3
имплантированы ИОЛ, соответствующие требованиям ГОСТ 31580.2— ГОСТ 31580.6.
3.1.18 историческая контрольная группа (historical control population): Контрольная группа, прошедшая клинические испытания и имеющая серьезные неблагоприятные исходы.
4 Этические соглашения
4.1 Общие требования
4.1.1 Права, безопасность и добровольность участия субъектов клинических испытаний должны быть защищены в соответствии с этическими принципами, изложенными в Хельсинской декларации, и должны соблюдаться на любом этапе клинических испытаний.
4.1.2 Организатор и клинический испытатель не должны оказывать давления или принуждающих действий на субъект, наблюдателя, клинического испытателя-координатора и других лиц, участвующих в клинических испытаниях.
4.1.3 Организатор должен документально подтвердить компенсацию субъектам в случае травмы, произошедшей при проведении клинических испытаний. Дополнительное медицинское обслуживание субъектов, которым оно потребуется в результате неблагоприятного исхода клинических испытаний, должно быть запланировано и задокументировано.
4.1.4 Все участники клинических испытаний должны разделять ответственность за этическое поведение в соответствии с их ролью при проведении клинических испытаний.
5 Требования
5.1 Общие требования
5.1.1 Между организатором, испытателем и другими лицами, участвующими в клинических испытаниях, должны существовать формальные соглашения, определяющие круг их обязанностей. Все формальные соглашения должны быть задокументированы в письменном виде и подписаны всеми участниками.
5.1.2 Все лица, участвующие в проведении клинических испытаний, должны иметь соответствующую квалификацию/образование и/или опыт для
ГОСТ 31580.7-2012
исполнения своих обязанностей.
5.1.3 План клинических испытаний должен соответствовать требованиям
[2].
5.1.4 Клинические испытания должны быть разработаны для определения соответствия ИОЛ назначенной группе субъектов, для которой они предназначены. Испытания должны соответствовать требованиям клинической релевантности и научной достоверности.
5.1.5 В период клинических испытаний все участвующие лица должны соблюдать конфиденциальность. Данные, полученные в период клинических испытаний, должны быть защищены от несанкционированного использования.
5.1.6 В отчетах и публикациях о клинических испытаниях должна соблюдаться конфиденциальность информации о каждом субъекте.
5.1.7 Список имен субъектов и идентификационная информация должны, при необходимости, храниться отдельно от отчетных форм.
5.1.8 Перед началом клинических испытаний необходимо провести следующие действия:
разработать и утвердить план клинических испытаний;
получить согласие комитета по этике;
получить соответствующее разрешение контролирующих органов.
5.2 Дополнительные требования
5.2.1 Организатор и клинические испытатели должны оценивать уровни неблагоприятных исходов и остроты зрения для ИОЛ при клинических испытаниях.
5.2.2 Безопасность и эффективность каждой модели ИОЛ должны быть подтверждены:
клиническими испытаниями, проведенными в соответствии с требованиями настоящего стандарта;
сравнением параметров модели с параметрами базовой модели, показывающим, что модель является незначительной модификацией базовой модели, безопасность и эффективность которой доказаны клиническими испытаниями.
Примечание — Руководство по определению модификации базовой модели ИОЛ приведено в приложении С.
5.2.3 Клинические испытания ИОЛ, предназначенных для коррекции
5
афакии у взрослых субъектов, должны проводиться организатором с использованием элементов протоколирования по приложению D. Организатор должен разработать протокол с учетом оценки различий постоянных неблагоприятных исходов у испытуемых субъектов и субъектов из контрольной группы.
Если ИОЛ предназначена для расположения в передней и задней камерах глаз, то должны быть проведены отдельные клинические испытания для проверки клинической эффективности ИОЛ в каждой глазной камере.
5.2.4 Все субъекты клинических испытаний в период испытаний должны проходить периодические обследования. Клинические испытания считают оконченными, когда на все субъекты, вовлеченные в испытания, включая тех, у которых ИОЛ были извлечены или заменены, будет составлен окончательный отчет по приложению Е.
6 Методология
6.1 Требования к документации
6.1.1 Журнал клинического испытателя и документы по 6.1.3 должны быть подготовлены до начала клинических испытаний. Предоставляемая клиническим испытателем информация должна быть задокументирована.
6.1.2 Журнал клинического испытателя должен включать:
а) обзор научной литературы, оценку рациональности предполагаемого использования испытуемой ИОЛ и цели клинических испытаний.
Примечание — Обзор научной литературы включает в себя получение информации об оптических и механических свойствах ИОЛ;
б) общее описание ИОЛ;
в) описание принципа действия ИОЛ с указанием научной литературы, и, при необходимости, с инструкцией изготовителя по ее использованию и установке.
Должны быть указаны потенциальные противопоказания, предупреждения, возможный риск от испытания и т. п.;
г) описание предполагаемых клинических эксплуатационных характеристик;
д) описание материалов, использованных в ИОЛ;
е) обзор и оценка данных in vitro и/или in vivo, имеющих отношение к ИОЛ, включая предклинические данные, такие как биологические исследования, неклинические лабораторные исследования и исследования на животных;
ж) описание предыдущих попыток проведения клинического испытания ИОЛ с похожими характеристиками;
и) обозначения и наименования национальных стандартов, которым должны полностью или частично соответствовать ИОЛ;
к) результаты анализа риска.
Важная информация, получаемая в процессе клинических испытаний, должна регистрироваться в журнале.
6.1.3 У организатора и/или испытателя должны храниться следующие документы:
а) план клинических испытаний;
б) подписанное и датированное резюме каждого клинического испытателя;
в) наименование(я) организации(ий), проводящей(их) клинические испытания;
г) мнение и/или разрешение комитета по этике, изложенные в письменном виде и сопровождаемые соответствующей документацией, предусмотренной действующим законодательством;
д) соглашение между главным клиническим испытателем, координатором и организатором;
е) необходимые сертификаты;
ж) формы расписок об информированности и другая информация, предоставленная субъектам;
и) форма отчета;
к) формы отчета о неблагоприятном исходе клинических испытаний и неблагоприятном воздействии ИОЛ;
л) контактные данные наблюдателя(ей).
6.2 Требования к доступу информации
6.2.1 Каждый клинический испытатель, участвующий в клинических испытаниях, должен иметь право доступа к необходимой предклинической информации. Вся полученная информация должна храниться конфиденциально.
6.2.2 Наблюдатель должен иметь доступ к исходным документам и другой информации, необходимой для контроля соответствия деятельности испытателя
7