Изменение №1 для ГОСТ Р 52174-2003
Биологическая безопасность. Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Отменено приказом Федерального агентства по техническому регулированию и метрологии от 24 апреля 2009 г. № 142-ст; ИУС 5-2009
| Дата введения | 01.07.2009 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 24.04.2009 |
| Актуализация | 01.01.2021 |
| Опубликован | ИУС 4-2009 |
| Дополняет: | ГОСТ Р 52174-2003 |
Организации:
| 25.12.2008 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 731-ст |
|---|
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5
стр. 6

стр. 7

стр. 8
ИЗМЕНЕНИЯ, УТВЕРЖДЕННЫЕ К НАЦИОНАЛЬНЫМ СТАНДАРТАМ РОССИЙСКОЙ ФЕДЕРАЦИИ
65 СЕЛЬСКОЕ ХОЗЯЙСТВО
ОКС 65.140, 65Л60, 67.060, 67.080, 67.100, 67.120, 67.140, 67.140.30, 67.160, 67.180, 67.190,
67.200, 67.220 Группа НИ, Н13, Н17, Н23, Н31-Н34, Н36, Н41-Н43, Н51-Н56, Н62, Н65, Н68, Н72-Н74,
Н81, Н97, СИ, С23-С25, С32-С36, С41-С45, С52
Изменение № 1 ГОСТ Р 52174-2003 Биологическая безопасность. Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа
Утверждено и введено в действие Приказом Федерального агентства по техническому регулированию и метрологии от 25.12.2008 № 731-ст
Дата введения 2009—07—01
Разделы 1 (первый абзац), 5. Заменить слова: «пищевое сырье» на «продовольственное сырье»;
дополнить абзацем:
«Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением технологии FLASH изложен в обязательном приложении Д».
Пункт 4.1. Исключить слова: «или «Био-1» [23]».
Пункт 4.2. Исключить слова: «или «Евробио-ВТО» [24]».
Пункт 6.2.1 дополнить абзацем:
«6.2.1 Дополнительно готовят отрицательную контрольную пробу. Для этого в чистую стерильную микроцентрифужную пробирку вместимостью 1,5 см3 помещают 50 мм3 особо чистой воды по 4.30 и 400 мм3 буфера экстракции по 6.1.8. Дальнейшее приготовление и хранение отрицательной контрольной пробы — в соответствии с требованиями 6.2.2—6.2.6 настоящего стандарта1».
Пункт 8.1. Исключить слова: «или «Био-1» [23]».
Приложение Д изложить в новой редакции:
важк
«Приложение Д (обязательное)
Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением технологии
FLASH
Д.1 Сущность метода
Метод основан на технологии FLASH, то есть проведении полимеразной цепной реакции (ПЦР) со специфической гибридизацией флуоресцентномеченых зондов в процессе амплификации и последующей детекции продуктов амплификации при помощи ПЦР-детектора «Джин». Чувствительность метода — не менее 100 копий ДНК на реакционный объем.
Д.2 Определения
Д.2.1 ПЦР-детектор «Джин»: Специализированный флуориметр, предназначенный для регистрации результатов ПЦР при использовании комплектов реагентов, основанных на принципах флуоресцентной детекции.
Д.З Аппаратура, материалы и реактивы — в соответствии с разделом 4 настоящего стандарта со следующими дополнениями:
Д.З. 1 Компьютерная программа «Gene» для учета и интерпретации результатов, полученных при помощи ПЦР-детектора «Джин» [23].
Д.3.2 ПЦР-детектор «Джин» [24] или ПЦР-детектор «Джин-4» [25].
Д.3.3 Четыре комплекта реагентов для ПЦР-амплификации ДНК в микроцентрифужных пробирках для амплификации — «СКАН-J55», «СКАН-gz/s», «С К А Н - /7 os>> и «СКАН-я/;/» [26], каждый из которых включает:
- 50 микроцентрифужных пробирок для амплификации, запечатанных парафином, содержащих по 20 мм3 смеси, включающей ПЦР-бу-фер, дезоксирибонуклеотидтрифосфаты, праймеры, флуоресцентномеченые зонды, внутренний контрольный образец ДНК;
- 500 мм3 раствора Taq-полимеразы — одна микроцентрифужная пробирка;
- 200 мм3 буферного раствора «ПЦР-буфер» — одна микроцентрифужная пробирка;
- 1,0 см3 минерального масла — одна микроцентрифужная пробирка;
- положительная контрольная проба ДНК, 150 мм3 — одна микроцентрифужная пробирка.
Допускается применение других средств измерений с метрологическими характеристиками, а также оборудования и реактивов с технически -ми характеристиками не хуже указанных в приложении Д и разделе 4 настоящего стандарта.
Д.4 Отбор проб
Отбор проб — в соответствии с требованиями раздела 5 настоящего стандарта.
Д.5 Подготовка к проведению анализа
Д.5.1 Приготовление растворов
Приготовление растворов осуществляется в соответствии с 6.1 настоящего стандарта.
Д.5.2 Приготовление пробы для анализа (выделение ДНК)
Приготовление пробы для анализа (выделение ДНК) — в соответствии с требованиями 6.2 настоящего стандарта
Д.6 Проведение анализа
Д.6.1 Растворы ДНК, подготовленные в соответствии с Д.5 и 6.2, анализируют при помощи комплектов для амплификации ДНК: «CKAH-J5<5», «СКАН-gw^», «СКАН-иол» и «СКАН-и/tf» по Д.3.3.
Д.6.2 Маркируют микроцентрифужные пробирки с запечатанной парафином смесью для амплификации по Д.3.3 в количестве, соответствующем количеству анализируемых растворов ДНК. Дополнительно маркируют:
- две микроцентрифужные пробирки для ПЦР-амплификации ДНК маркируют как «К+» (положительный контроль);
- две микроцентрифужные пробирки для ПЦР-амплификации ДНК маркируют как «К—» (отрицательный контроль);
- две микроцентрифужные пробирки для ПЦР-амплификации ДНК маркируют как «ФОН».
Д.6.3 В промаркированные микроцентрифужные пробирки по Д.6.2, за исключением пробирок, промаркированных как «ФОН», не повреждая слой парафина, микродозатором по 4.12 настоящего стандарта вносят по 10 мм3 раствора Taq-полимеразы по Д.3.3, тщательно перемешанного на аппарате для встряхивания по 4.10 настоящего стандарта. В микроцентрифужные пробирки, промаркированные как «ФОН» по Д.6.2, микродозатором вносят по 10 мм3 ПЦР-буфера по Д.3.3.
Д.6.4 Во все микроцентрифужные пробирки по Д.6.3 микродозатором вносят по 20 мм3 минерального масла по Д.3.3, плотно закрывают пробирки крышками.
Д.6.5 В микроцентрифужные пробирки по Д.6.4, за исключением пробирок, промаркированных как «ФОН», «К—» и «К+», не повреждая слой парафина, микродозатором вносят по 5,0 мм3 анализируемого раствора ДНК по 6.2 настоящего стандарта.
Д.6.6 В микроцентрифужные пробирки, промаркированные как «ФОН» и «К—» по Д.6.4, не повреждая слой парафина, микродозатором вносят по 5,0 мм3 отрицательной контрольной пробы по 6.2 настоящего стандарта.
Д.6.7 В микроцентрифужные пробирки по Д.6.4, промаркированные как «К+», не повреждая слой парафина, микродозатором вносят по 5,0 мм3 положительной контрольной пробы из состава соответствующего комплекта реагентов для амплификации ДНК по Д.3.3.
Д.6.8 Все микроцентрифужные пробирки, подготовленные по Д.6.5 — Д.6.7, плотно закрывают крышками и центрифугируют на настольной микроцентрифуге по 4.8 настоящего стандарта при частоте вращения 1000 мин-1 в течение 5—10 с и сразу же используют для проведения анализа.
Д.6.9 Все микроцентрифужные пробирки по Д.6.8 помещают в ампли-фикатор ДНК по 4.3 настоящего стандарта и проводят ПЦР по программе, указанной в таблице Д.1. При запуске программы указывают объем реакционной смеси, равный 35 мм3.
|
Таблица Д.1 — Программа проведения ПЦР | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Д.6.10 Все определения должен проводить квалифицированный, специально обученный персонал в соответствии с требованиями [22]. При проведении анализа каждую микроцентрифужную пробирку открывают только перед отбором или внесением анализируемой пробы, а по окончании манипуляции — сразу же закрывают. Запрещается открывать одновременно несколько микроцентрифужных пробирок с анализируемыми пробами и оставлять их открытыми длительное время. Каждую анализируемую пробу отбирают микродозатором с новым стерильным наконечником с фильтром по 4.14 настоящего стандарта.
Д.7 Обработка результатов анализа
Д.7.1 После прохождения реакции амплификации все микроцентри-фужные пробирки по Д.6.9 помещают в ПЦР-детектор «Джин» по Д.3.2 для проведения регистрации результатов ПЦР. В соответствии с руководством по эксплуатации к ПЦР-детектору «Джин» проводят регистрацию результатов ПЦР (пороговые значения для продукта амплификации и для внутреннего контрольного образца указаны в инструкции к комплектам реагентов для амплификации ДНК).
Д.7.2 Учет и интерпретация результатов
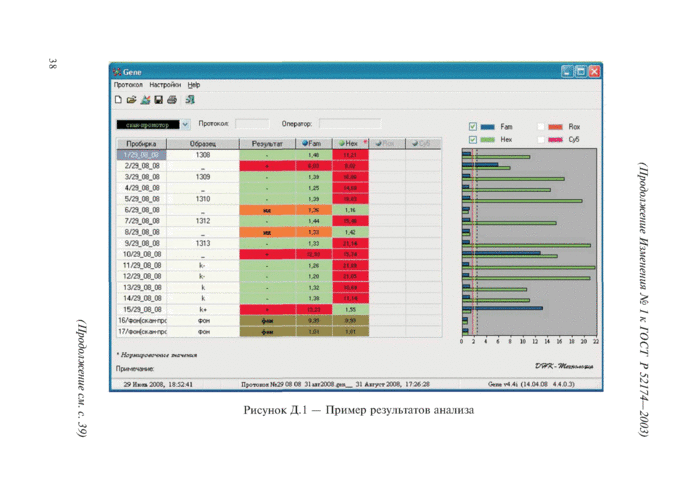
Д.7.2.1 Учет и интерпретация результатов анализа осуществляется автоматически при помощи компьютерной программы «Gene» [23]. Результаты анализа отображаются на экране компьютера в виде таблицы (рисунок Д.1).
Д.7.2.2 За положительный результат принимают отображение символа «+» на красном фоне напротив обозначения анализируемой пробы в графе «Результат» таблицы. Положительный результат фиксируется в микроцентрифужных пробирках комплектов реагентов «CKAH-J55», «СКАН -nos», «СКАН -gi/я», «СКАН-npt» для анализируемых проб, содержащих нуклеотидные последовательности, характерные для промотора 355*, промотора nos, гена gus, гена nptII, соответственно.
Д.7.2.3 За отрицательный результат принимают отображение символа «—» на зеленом фоне напротив обозначения анализируемой пробы в графе «Результат» таблицы. Отрицательный результат фиксируется в микроцентрифужных пробирках комплектов реагентов «CKAH-J5.S», «СКАН -nos», «CKAH-gi/д», «СКАН-npt» для проб, не содержащих нуклеотидные последовательности, характерные для промотора 35S, промотора nos, гена gus, гена nptII соответственно.
Пример оформления протокола испытания — в соответствии с приложением Г настоящего стандарта.
Д.7.2.4 За недостоверный результат принимают отображение символа «НД» на оранжевом фоне или символа «?» на желтом фоне (на рисунке Д. 1 желтый фон отсутствует) напротив обозначения анализируемой пробы в графе «Результат» таблицы.
Это может быть вызвано несоблюдением условий анализа или несоблюдением условий выделения ДНК. В случае получения недостоверного результата определение повторяют.
Д.7.2.5 В случае отображения символа «+» на красном фоне напротив обозначения отрицательной контрольной пробы в графе «Результат» таблицы, результаты анализа считают ложноположительными.
Причиной может быть загрязнение ГМИ реактивов и/или оборудования. В этом случае определение повторяют с заменой реактивов на свежеприготовленные.
Gene
Протокол Настройки yelp
д
□
|
v Протокол: | |||||||||
|
Пробирка | ||||||||||
0
|
Fam Нек |
Образец
|
SC 13Q8 | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
|
* НеpMtip&jsoчные лл*ммия Примечание: |
(Продолжение Изменения № 1 к ГОСТ Р 52174—2003)
I
(Продолжение см. с. 39)
Р
Gere v4.4i (J4.04.08 4.4 0.3)
29 Июль 2008. 13:52.41
|
Оператор: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Протоиог №29 08 08 31 мг2008. eeft 31 А1густ2008т 17:26:28
Рисунок Д. 1 — Пример результатов анализа
1-1-1-1-1-1-!-1-1-I-1-Г
О 2 4 6 £ 10 и 1+ 16 IS 10 22
Д.8 Требования безопасности
При проведении всех работ необходимо соблюдать требования техники безопасности в соответствии с разделом 9 настоящего стандарта». Стандарт дополнить приложением — Е:
«Приложение Е (справочное)
Библиография
|
[1] Центр биологических микрочипов ИМБ РАН [2] ТУ 9443-001-02699501-2003 [3] ТУ 9452-001-4648062-98 [4] ТУ 42-619-61 [5] Корпорация «Эппендорф», кат. № 5425 000.014 [6] Корпорация «Хеликон», кат. № MSH-300 [7] Корпорация «Хеликон», кат. № FV- 2400 [8] Корпорация «Хеликон», кат. № RP-30 и RP-80 [9] Корпорация «Хеликон», кат. № FA 104; FA 108; FA 111; FA 113N [10] ТУ 6-09-11-1721-83 [11] ТУ 6-09-4292-76 [12] Корпорация «Сигма Алдрич» («Sigma»), кат. № L-6026 [13] Корпорация «Сигма Алдрич» («Sigma»), кат. № Д 1806 |
Компьютерная программа «Imageware» для анализа изображений, полученных при помощи «Чипдетектора-03» Комплекс аппар атно - про граммный для анализа флуоресценции биологических микрочипов «Чипдетектор-03» Амплификатор «Терцик МС-2» Термостат суховоздушный ТВР-25 Микроцентрифуга настольная 5415С, 13000 мин-1 Мешалка магнитная с подогревом Аппарат для встряхивания (центрифуга — вортекс) Штативы под микроцентрифужные пробирки Наконечники с фильтром для микропипеток Этилендиаминтетрауксусной кислоты натриевая соль дигидрат Трис(оксиметил)аминометан [NH2C(CH2OH)3] Додецилсульфат натрия (SDS) Фермент Taq-полимераза 5 Ед.акг./мм3 |
|
[14] Корпорация «Хеликон», кат. № Ат-038-0.5 [15] Корпорация «Хеликон», кат. № Ат-0485-01 [16] Корпорация «Хеликон», кат. № Н-4044-0.4 [17] ИФР РАН [18] ИФР РАН [19] ТУ 46-22-603-75 [20] Центр биологических микрочипов ИМБ РАН [21] Центр биологических микрочипов ИМБ РАН [22] Методические рекомендации по проведению работ в диагностических лабораториях, использующих метод полимеразной цепной реакции. Основные положения [23] ООО «НПО ДНК-Технология» [24] ТУ 9443-005-46482062-2003 [25] ТУ 9443-001-96301278-2007 [26] ООО «БИОМАСТЕР-ПРОМ» |
Гуанидин тиоцианат [CH.N. -HSCN] N - [ 2 - оксиэти л ] пиперазин - N' - [ 2 -этансульфоновая кислота] (HEPES) [C8H17N2J4SNa] Раствор смеси дАТФ, дГТФ, дТТФ, дЦТФ, по 25 мМ каждого Раствор заведомо трансгенной ДНК около 100 нг/мм3 или 106 копий/мм3 Раствор заведомо нетрансгенной ДНК около 100 нг/мм3 или 106 копий/мм3 Баня водяная с электрическим или огневым подогревом Раствор водный праймеров «ПР-1» Микрочипы гелевые с иммобилизованными олигонуклеотидами Государственный Комитет Сан-эпиднадзора Российской Федерации; № 06-19/52-17 от 15.06.95 Компьютерная программа «Gene» для учета и интерпретации результатов, полученных при помощи ПЦР-детектора «Джин» ПЦР-детектор «Джин» ПЦР-детектор «Джин-4» Комплекты реагентов для ПЦР-амплификации ДНК «СКАН-35S», «СКАН-£И5», «СКАН-л as» и «СКАЯ-npt» |
(ИУС № 4 2009 г.)
40
1
Отрицательную контрольную пробу по 6.2.1 подготавливают только при применении технологии FLASH (приложение Д).
(Продолжение см. с. 34)