Мук 4.2.2315-08 для МУК 4.2.2218-07
Лабораторная диагностика холеры
Купить МУК 4.2.2315-08 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
| Дата введения | 18.01.2008 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
| Опубликован | Роспотребнадзор, 2010 |
| Дополняет: | МУК 4.2.2218-07 |
Организации:
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21
стр. 22
стр. 23
стр. 24
стр. 25
стр. 26
стр. 27
стр. 28
стр. 29
стр. 30
Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Серологические методы в диагностике холеры
Дополнение к МУК 4.2.2218—07 «Лабораторная диагностика холеры»
Методические указания МУК 4.2.2315—08
Издание официальное
Москва * 2010
Федеральная служба по надзору в сфере защиты прав потребителей
и благополучия человека
I
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Серологические методы в диагностике холеры
Дополнение к МУК 4.2.2218—07
«Лабораторная диагностика холеры»
Методические указания МУК 4.2.2315—08
ББК51.9
С32
С32 Серологические методы в диагностике холеры: Методические указания.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010.—34 с.
ISBN 978—5—7508—0806—9
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Ю. М. Федоров, Н. Я. Жилина); ФГУЗ «Ростовский-на-Дону научно-исследовательский противочумный институт» (Ю. М. Ломов, JI. С, Подосинниковд, Б. Л. Мазрухо,
Э, А. Москвитина, Л. М. Веркина, Н, Р. Телесманич, В. В. Агафонова); ФГУЗ «Противочумный центр» (Ю. С. Королев, С. М. Иванова); ФГУЗ «Ставропольский научно-исследовательский противочумный институт» (В. Н. Савельев, И. В. Савельева); ФГУЗ «Российский научно-исследова-тельский противочумный институт «Микроб» (В. П. Топорков); ФГУЗ «Причерноморская противочумная станция» (Г. В. Гальцева); Управлением Роспотребнадзора по г. Москве (Л. А. Цвиль, Г. М. Маненкова, Т. И. Шестиперова).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 6 декабря 2007 г. № 3).
3. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г. Г. Онищенко 18 января 2008 г.
4. Введены в дополнение к Методическим указаниям МУК 4.2.2218—07 «Лабораторная диагностика холеры».
ББК 51.9
ISBN 978—5—7508—0806—9
© Роспотребнадзор, 2010 © Федеральный центр гигиены и
эпидемиологии Роспотребнадзора, 2010
Содержание
1. Область применения......................................................................................................4
2. Нормативные ссылки.....................................................................................................4
3. Значение серологических методов в диагностике холеры.......................................... 5
4. Методы выявления противохолерных антител............................................................6
4.1. Подготовка проб......................................................................................................7
4.2. Определение агглютининов в сыворотке крови....................................................7
4.3. Определение токсин нейтрализующих антител...................................................10
4.4. Определение вибриоцидных антител...................................................................11
5. Тактика применения систем серологических реакций различных сочетаний
(основные принципы).................................................................................................. ] 7
5.1. Система РНАг-РПГАэхэд.....................................................................................18
5.2. Система РА-РНАг.................................................................................................18
5.3. Система РПГА-РНАг............................................................................................19
5.4. Система РА-РПГАЭхэд.........................................................................................20
5.5. Системы РВА-РА и РВА-РНАг...........................................................................20
6. Приложения...................................................................................................................21
Приложение 6.1. РПГА (поиск иммуноглобулинов /антител/ к холерному
вибриону)............................................................................................21
Приложение 6.2. РТПГА (поиск иммуноглобулинов/антител/ к холерному
вибриону)............................................................................................22
Приложение 6.3. РНАг (поиск иммуноглобулинов/антител/ к холерному
вибриону 01 серогруппы)..................................................................23
Приложение 6.4. Определение 2АЕ (определение величины двух антигенных
единиц культуры холерного вибриона 01 серогруппы для поиска антител в РНАг).....................................................................24
Приложение 6.5. РВА (на основе чашечного метода)..................................................25
Приложение 6.6. РВА (на основе ферментации углеводов).........................................26
Приложение 6.7. РВА (на основе серологического метода).........................................27
Приложение 6.8. Протокол серологического исследования сывороток людей
на наличие антител к возбудителю холеры......................................28
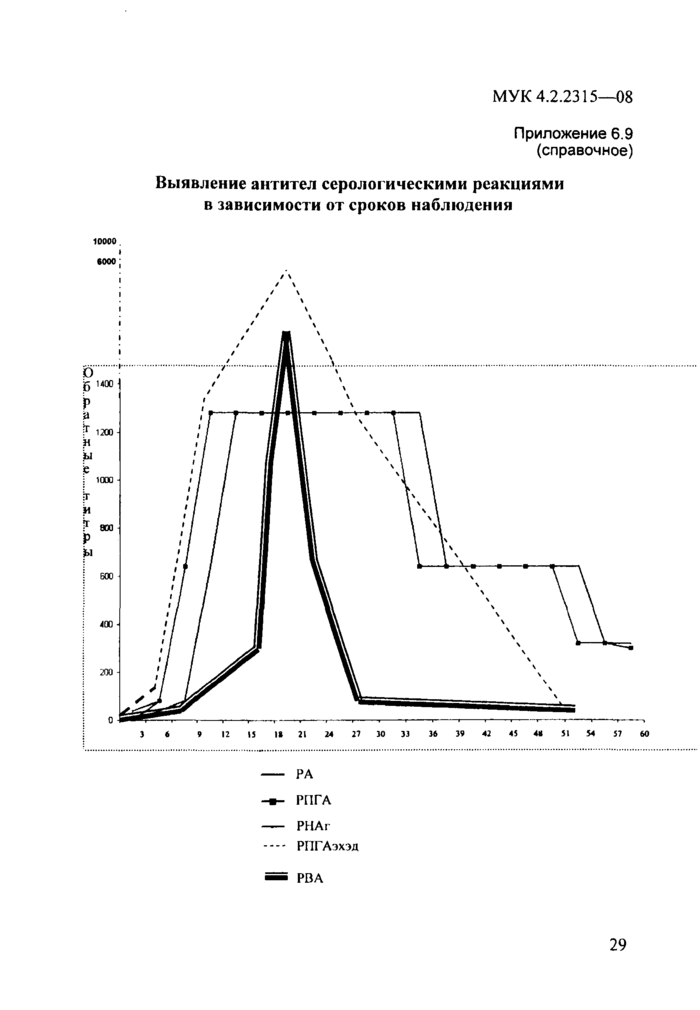
Приложение 6.9. Выявление антител серологическими реакциями в
зависимости от сроков наблюдения..................................................29
Приложение 6.10. Тактика применения серологических реакций при
обследовании различных контигентов............................................30
Приложение 6.11. Тактика применения серологических реакций в
зависимости от сроков и целей обследования...............................31
7. Новые серологические методы в идентификации холерных вибрионов.................32
7.1. Серологическая идентификация холерных вибрионов 01 и 0139
серогрупп с помощью реакции коагглютинации (РКОА)..................................32
7.2. Реакция агглютинации объемная с диагностикумом антилипазным иммуноглобулиновым полимерным для выявления липазной активности холерных вибрионов Эльтор с целью дифференциации гемолитичных (атоксигенных) и негемолитичных (токсигенных) штаммов, выделенных
из окружающей среды (РАО)...............................................................................33
УТВЕРЖДАЮ
Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
18 января 2008 г.
Дата введения: с момента утверждения
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Серологические методы в диагностике холеры
Дополнение к МУК 4.2.2218—07 «Лабораторная диагностика холеры» Методические указания МУК 4.2.2315—08
■ I ■ ■■ ■ ..................■ ■ ^
1. Область применения
1.1. Настоящий методический документ «Серологические методы в диагностике холеры» разработан в дополнение к методическим указаниям МУК 4.2,2218—07 «Лабораторная диагностика холеры» в части, касающейся организации и проведения серологической диагностики холеры у людей.
1.2. Документ предназначен для специалистов управлений по субъектам Российской Федерации, центров гигиены и эпидемиологии в субъектах Российской Федерации и противочумных учреждений Роспотребнадзора, лечебно-профилактических учреждений.
2. Нормативные ссылки
2.1. СП 1.3.1285—03 «Безопасность работы с микроорганизмами
1—II групп патогенности (опасности)».
2.2. СП 1.3.2322—08 «Безопасность работы с микроорганизмами III—IV групп патогенности (опасности) и возбудителями паразитарных болезней».
2.3. СП 1.3.2518—09 «Безопасность работы с микроорганизмами III—IV групп патогенности (опасности) и возбудителями паразитарных болезней». Доп. и изм. 1 к СП 1.3.2322—08.
2.4. СП 3.3.2.1248—03 «Условия транспортирования и хранения медицинских иммунобиологических препаратов».
2.5. СП 3.1.1.2521—09 «Профилактика холеры. Общие требования к эпидемиологическому надзору за холерой на территории Российской Федерации».
2.6. МУК 4.2.2218—07 «Лабораторная диагностика холеры».
2.7. МР «Метод микрообъемной реакции агглютинации для идентификации холерных вибрионов».
3. Значение серологических методов в диагностике холеры
Серологические методы в диагностике холеры используют как с целью выявления противохолерных антител в крови больных (переболевших) и вакцинированных, так и в идентификации возбудителя. Последние достаточно полно описаны в МУК 4.2.2218—07 «Лабораторная диагностика холеры» и в настоящем документе приводится описание лишь новых реакций, упрощающих видовую идентификацию холерных
01 и 0139 вибрионов в РКОА (реакция коагглютинации) или ориентировочную оценку эпидемической значимости посредством выявления липазной активности в РАО.
Что же касается выявления противохолерных антител у людей, то значимость этого факта, величина и динамика их титров рассматриваются и оцениваются в сочетании с клинико-эпидемиологической ситуацией и характеристикой обследуемого контингента.
Диагностика первых случаев холеры является наиболее ответственной и сложной и должна быть максимально обоснованной, что связано с возможностью ошибок при сходных с холерой состояниях. Следует иметь в виду, что официальная регистрация первых случаев холеры влечет за собой, помимо чисто медицинских мер, введение ряда ограничительных мероприятий, требующих больших экономических затрат.
Серологическое обследование людей на холеру имеет, как правило, дополнительное значение. Но в отдельных случаях, при проведении оперативного и ретроспективного эпидемиологического анализа, серо-позитивнее результаты в структуре критериев диагностики холеры могут иметь решающее значение.
Серологическое обследование позволяет подтвердить диагноз у больных с атипичной клиникой холеры при отсутствии выделения возбудителя, в т. ч. при обследовании на фоне лечения антибиотиками, или исключить диагноз холеры, поставленный на основании одних клинических данных. Серологический анализ является также существенным методом ретроспективной диагностики холеры. В ряде случаев иммунологические тесты дополняют клинико-эпидемиологические данные и позволяют установить или исключить факт внутрибольничного заражения холерой.
Определение токсиннейтрализующих антител в сыворотке людей позволяет сделать заключение об эпидемичности (токсигенности) штаммов холерных вибрионов 01 или 0139 серогрупп, циркулирующих в очаге холеры, что играет важную роль в определении объема противохолерных мероприятий. При этом целесообразно дифференфицировать серопозитивные результаты как следствие холерной инфекции или иммунизации холерной вакциной.
Для серологической диагностики холеры используют различные иммунологические реакции, выявляющие в сыворотке крови больных, вибриононосителей и реконвалесцентов, а также вакцинированных специфические антитела: агглютинины, антитоксины и вибриоцидные антитела.
У больных холерой специфические антитела, как правило, выявляются на 5—7 день от начала заболевания.
Наиболее достоверные данные могут быть получены при исследовании парных сывороток с интервалом 7—10 дней и/или при использовании системы иммунологических реакций.
Тактика применения иммунологических тестов зависит от конкретных целей и задач серологического обследования людей на холеру, которое должно проводиться в основном по эпидемиологическим показаниям и с использованием комплекса реакций. Выбор схем исследования сывороток людей на холеру также определяется целями и задачами обследования больных, вибриононосителей, переболевших, контактных с ними и др.
4, Методы выявления противохолерных антител
Специфические агглютинины к холерным вибрионам 01 серогруппы можно выявить путем постановки объемной реакции агглютинации (РА), в двухкомпонентной реакции пассивной гемагглютинации (РПГА) с использованием антигенного поливалентного 01 холерного диагно-стикума, а также при постановке трехкомпонентной реакции нейтрализации антигена (РНАг) с иммуноглобулиновым холерным диагностику-мом. Реакция пассивной гемагглютинации с использованием энтероток-
сического холерного диагностикума (РПГАЭХэд) позволяет выявлять иммуноглобулины к токсигенным штаммам холерных вибрионов 01 и 0139 серогрупп - антитоксины. С помощью реакции вибриоцидных антител (РВА) можно выявлять вибриоцидные антитела.
4. L Подготовка проб
Для постановки серологических реакций кровь берут из локтевой вены в объеме 1—5 мл, при отсутствии такой возможности - из пальца. В последнем случае исследование ведут микрометодом с учетом возможности получения результатов в 2—4 раза ниже, чем при постановке серологических реакций макрометодом.
После свертывания сгусток отслаивают от стенки пробирки стерильной стеклянной палочкой или платиновой петлей. Пробирки сохраняют в холодильнике или транспортируют в лабораторию охлажденными (в сумке-холодильнике, термосе и т. п.). В лаборатории сыворотку
инактивируют при температуре (56,0 ± 0,5) °С в течение 30 мин. Если кровь забирают в день постановки реакции, то пробирки со свернувшейся кровью необходимо центрифугировать 10—15 мин при 3 000 оборотов в минуту. Кровь из пальца берут в объеме 0,4 мл и вносят в стерильный пенициллиновый флакон или пробирку с 1,6 мл 0,9 %-го раствора хлорида натрия (1 : 5).
При отсутствии возможности исследовать сыворотку немедленно,
ее сохраняют в ампулах при температуре (4,0 ± 0,5) °С.
4.2. Определение агглютининов в сыворотке крови
4.2.1. Реакция агглютинации (РА) с живыми культурами
Агглютинины в крови больных холерой обнаруживаются, начиная с 6—9 дня болезни в титрах 1 : 40—1 : 80, достигая к 12—16 дню максимальных значений 1 : 640—1 : 1 280. Диагностическими считаются титры агглютинации в разведении 1 : 40 и выше или их 4-кратное нарастание в парных сыворотках.
Работу с живыми культурами холерных вибрионов осуществляют с соблюдением требований действующих санитарных правил по безопасности работы с микроорганизмами I—II групп патогенности (опасности).
Методика постановки реакции агглютинации (РА) в макрообъеме
Исследуемую сыворотку титруют в 1 %-й пепгонной воде pH 7,5 ± 0,1 в объеме 1 мл от 1 : 10 до 1 : 640. В качестве антигена используют 3-ча-совую бульонную культуру холерного вибриона, выделенного в данном
очаге, или сыворотку исследуют в 3-х рядах с 3-часовыми бульонными культурами тест-штаммов холерных вибрионов 01 (сероваров Огава, Инаба) и 0139 серогрупп, В пробирки с титрованной сывороткой вносят по 1 капле культуры-антигена и ставят на 1 ч в термостат при 37 °С, затем до утра в холодильник при температуре (4,0 ± 0,5) °С, после чего отмечают результаты. Реакция сопровождается контролями антигена и сыворотки.
При определении титра реакции учитывают разведения с агглютинацией на 3—4 креста.
Методика постановки реакции агглютинации (РА) в микрообъеме
Материалы и оборудование.
Микропланшеты для иммунологических реакций с круглодонными лунками и прозрачными крышками.
Механические 1-, 4- и 8-канальные дозаторы с переменным объемом 50—200 мкл и соответствующие наконечники.
Кюветы (подносы) эмалированные, фаянсовые,
Стереомикроскоп типа МБС-10.
Культура холерного вибриона, выделенная в данном очаге, или тест-штаммы холерных вибрионов 01 (сероваров Огава и Инаба) и 0139 серогрупп (допускается использование убитых кулыур).
Постановка реакции.
Реакция осуществляется в объеме 0,1 мл (100 мкл).
Готовят взвесь культуры (антигена) холерного вибриона, выделенного в данном очаге, или тест-штаммов холерных вибрионов 01 (сероваров Огава и Инаба) и 0139 серогрупп в 3—4 мл 0,85 %-го раствора хлорида натрия из 6—18-часовой агаровой культуры до концентрации
2 х 10^ м.к. в 1 мл, что соответствует 10 ед. стандарта мутности ГИСК им. Л. А. Тарасевича.
Микропланшеты маркируют, надписывая карандашом с левой стороны номер исследуемой сыворотки, а сверху ее разведения от 1 : 5 до
1 : 640, номер штамма (живой или убитой культуры).
В лунки каждого ряда дозаторами разливают по 50 мкл 0,85 %-го раствора хлорида натрия. Затем в 1-ю лунку вносят 50 мкл исследуемой
сыворотки, инактивированной при 56 °С 30 мин, в разведении 1 : 5 и проводят двукратное ее разведение микропипеткой на 50 мкл, из последней лунки удаляют 50 мкл. Затем в каждую лунку вносят 50 мкл взвеси культуры-антигена в концентрации 2 х 109 м.к. в 1 мл. Реакция сопровождается контролями антигена (антигенов) и исследуемой сыво-
ротки. Планшет накрывают крышкой и помещают в термостат при 37 °С на 2 ч.
Учет реакции.
Учет реакции проводят в косо проходящем свете под стереомикроскопом МБС-1, МБС-2 или МБСМО.
Реакцию оценивают по характеру агглютинации на дне лунки:
• полная агглютинация: наличие на дне лунки рыхлой разорванной пленки, четких хлопьев на фоне темного поля;
• неполная агглютинация: наличие нежной пленки и полиморфных комочков агглютината на темном фоне;
• слабая агглютинация: наличие мелких хлопьев на фоне сероватого поля;
• следы агглютинации: мелкие единичные хлопья на фоне мутной жидкости.
Реакцию оценивают отрицательно, когда в луночке вибрионы равномерно выстилают дно или собираются в «пуговку». Под микроскопом видно равномерное мелкозернистое поле без темных промежутков.
Положительной считают реакцию при наличии полной и неполной агглютинации.
При постановке реакции агглютинации в микрообъеме дополнительно предусматривают следующее:
• планшеты помещают на поднос (фаянсовый, эмалированный). На дно подноса предварительно расстилают марлевую салфетку, смоченную дезинфицирующим раствором (3 %-й раствор хлорамина, 3 %-й раствор перекиси водорода с 0,5 % моющего средства);
• после внесения дозатором в каждую лунку 50 мкл взвеси живых культур холерных вибрионов в дозе 2 х 109 м.т./мл планшет накрывают крышкой и на подносе ставят в термостат при 37 °С на 2 ч;
• для учета реакции поднос с планшетом переносят на лабораторный стол, затем планшет ставят на стеклянную подставку и оценивают характер реакции агглютинации в косо проходящем свете с помощью стереоскопического микроскопа (системы МБС);
• при учете реакции крышку с планшета не снимают. В случае запотевания крышки ее меняют на другую, а запотевшую помещают в емкость с 3 %-м раствором хлорамина;
• после учета реакции крышку снимают, планшет и крышку складывают в кювет, заливают 3 %-м раствором хлорамина, накрывают и оставляют на 24 ч. Разовые планшеты обеззараживают физическим спо-собом — автоклавированием при 1,5 кгс/см в течение 60 мин. Стеклян-
ную крышку столика приспособления для косого освещения обрабатывают 70 %-м спиртом.
4.2.2. Реакция пассивной гемагглютинацьш (РПГА)
РПГА с диагностикумом эритроцитарным или полимерным холерным антигенным 01 или 0139 предназначена для выявления полных антител в сыворотке крови. По чувствительности значительно превосходит реакцию агглютинации. Антитела в крови больных выявляются с 6—£ дня болезни в титрах 1 : 80—1 : 320, максимальных титров 1 : 640—
1 : 1 280 и более достигают к 12—16 дню. Диагностическими считаются титры агглютинации в разведении 1 : 80 и выше или 4-кратное нарастание титров антител в парных сыворотках.
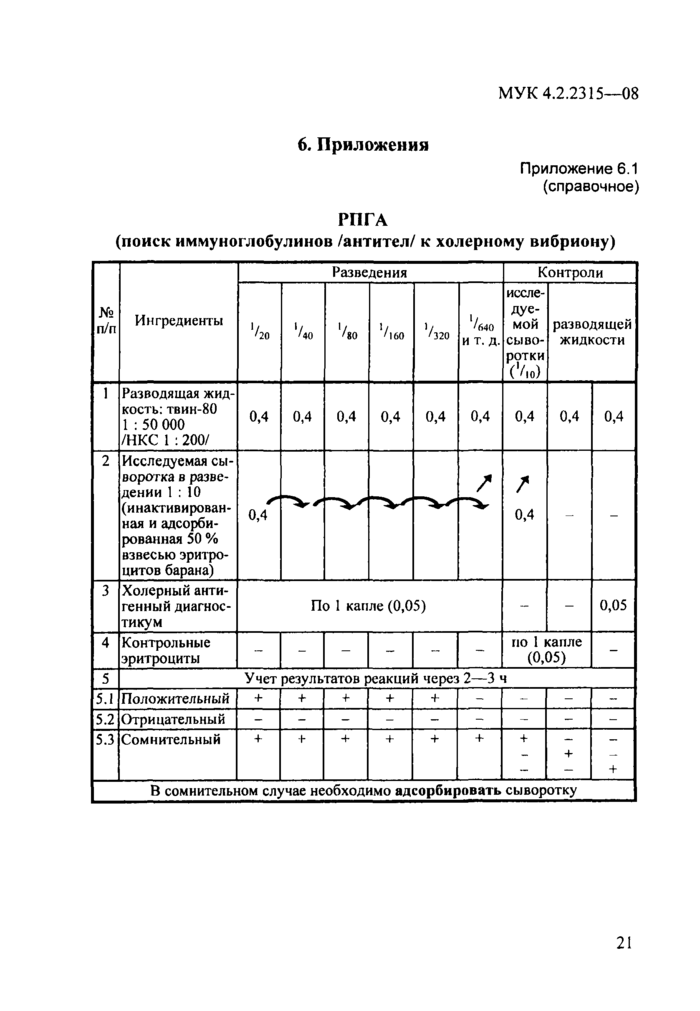
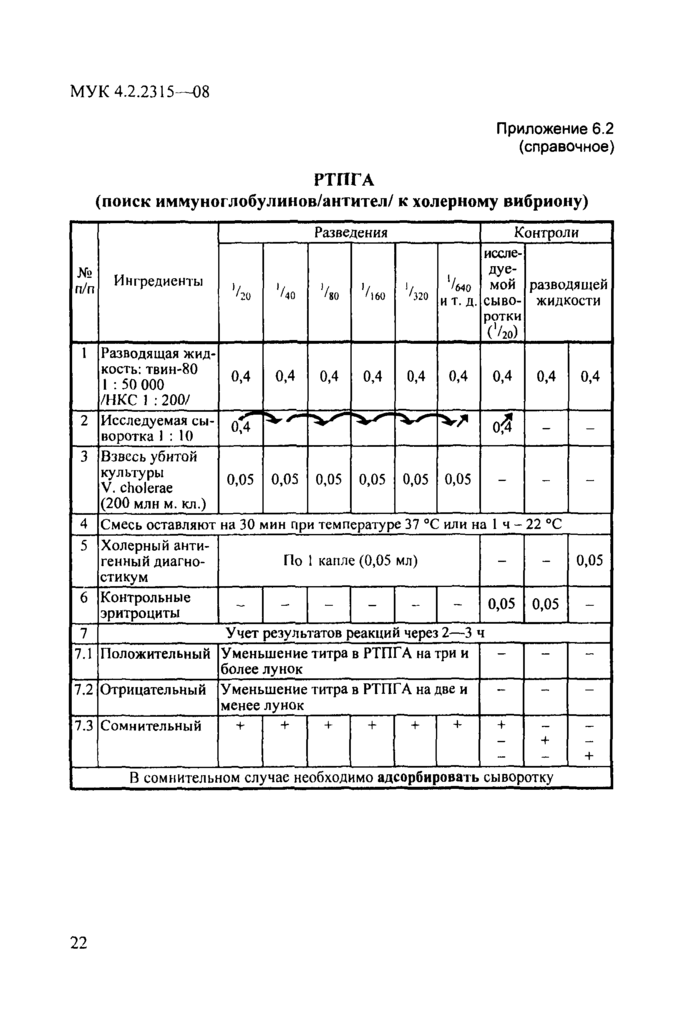
Необходимые ингредиенты, методика постановки реакции в макро-и микрообъемах изложены в наставлении к диагностикуму холерному антигенному. Схемы методик постановки РПГА и РТПГА (реакция торможения пассивной гемагглютинации) представлены в прилож. 6.1 и 6.2 (макрометод).
4.2.3. Реакция нейтрализации антигена (РНАг)
РНАг с использованием диагностикума эритроцитарного холерного иммуноглобулинового 01 или 0139 служит для выявления антител в сыворотке крови. Преимуществом этой реакции является выявление специфической нейтрализации добавляемого антигена не только полными, но и неполными антителами, появляющимися в крови раньше полных антител (3—5),
Иммуноглобулины к холерному вибриону в крови больных выявляются с 7—10 дня болезни в титрах 1 : 80—1 : 320 и достигают максимальных значений 1 : 1 280 и выше к 12—16 дню. Диагностическими считаются титры агглютинации в разведении 1 : 80 и выше или 4-кратное нарастание титров антител в парных сыворотках.
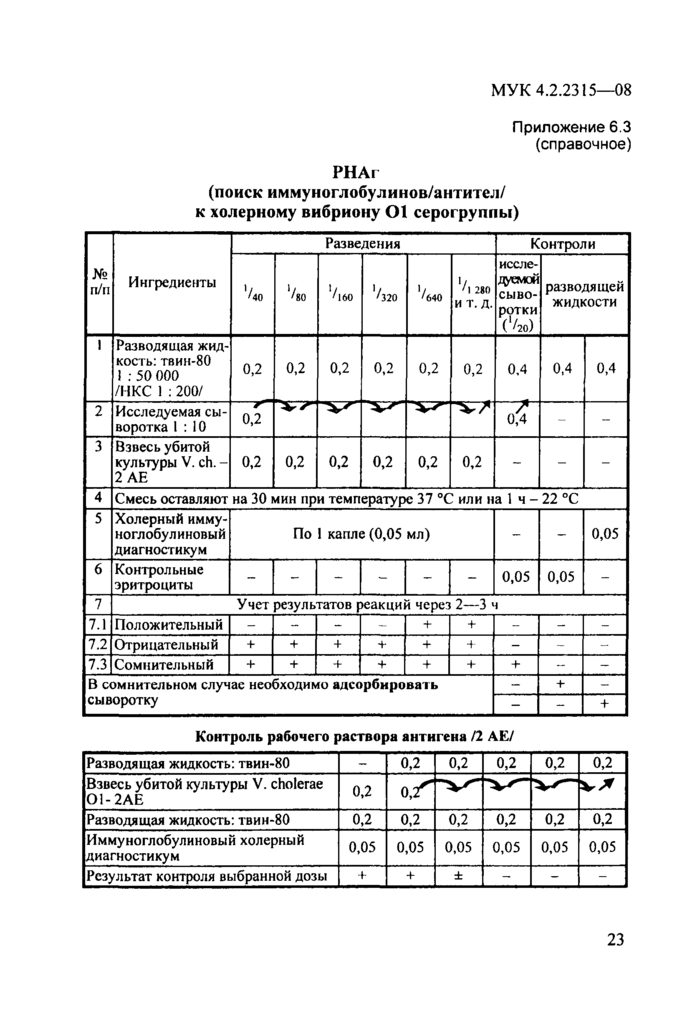
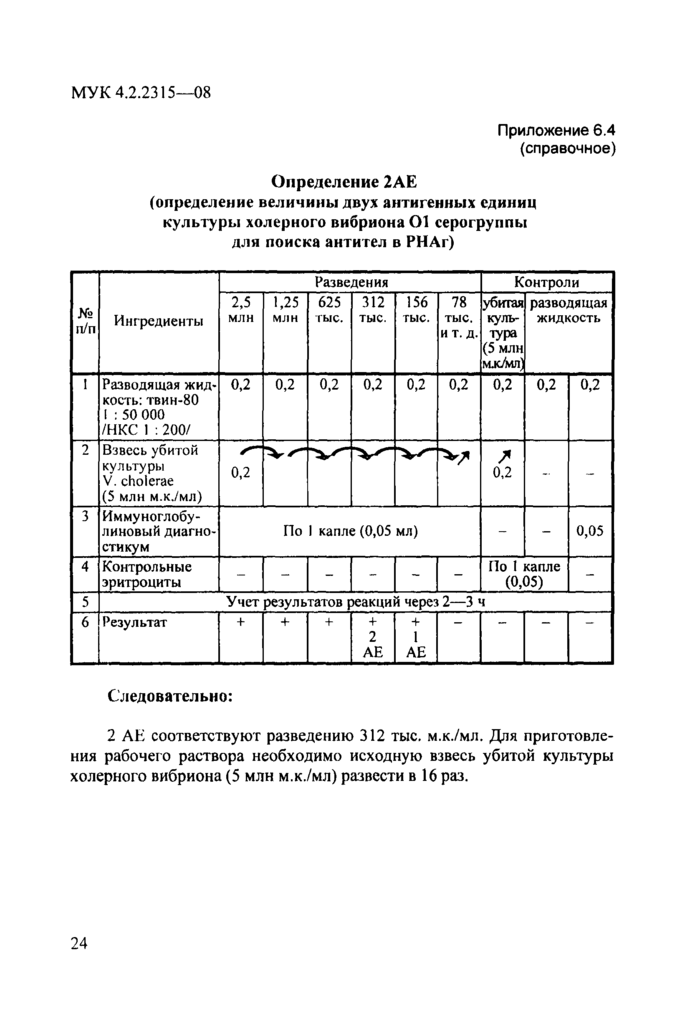
Необходимые ингредиенты и методика постановки реакции изложены в инструкции по применению диагностикума эритроцитарного холерного иммуноглобулинового. Схемы методик постановки РНАг и определения величины антигенных единиц (АЕ) представлены в прилож. 6.3 и 6.4 (макрометод).
4.3. Определение токсиннейтрализующих антител
4,3.1. Реакция пассивной гемагглютинации с эритроцитарным 01 холерным энтеротоксическим диагностикумом (РПГАЭхэд)
РПГА с эритроцитарным 01 холерным энтеротоксическим диагностикумом (ЭХЭД) предназначена для определения в сыворотке больных
холерой, вибриононосителей и привитых холерной вакциной (холеро-ген-анатоксином) антител, нейтрализующих холерный токсин холерных вибрионов OI и 0139 серогрупп. Токсиннейтрализующие антитела появляются на 3—5 день болезни в титрах 1 : 160— 1 : 640, достигают максимума 1 : 1 280—10 240 и выше на 12—20 день, а затем их титры снижаются до 1 : 160—1 :40. Диагностическим титром РПГАэхэд следует считать 1 : 160 и выше или 4-кратное нарастание титров антител в парных сыворотках.
4.4* Определение вибриоцидных антител
Вибриоцидные антитела в крови больных обнаруживаются с 3—9 дня болезни в титрах 10*1—10'3 и достигают максимальных значений
А _D Л
10 —10 к 10—16 дню, а затем резко снижаются до титров 10" —10“ и ниже.
Принцип метода во всех его вариантах заключается в том, что в присутствии вибриоцидных антител не происходит размножения холерных вибрионов.
При проведении серологических исследований в очаге с определенной серологической характеристикой возбудителя в реакции используют один штамм соответствующего серовара, при отсутствии этих данных - штаммы 01 холерных вибрионов обоих сероваров и холерных вибрионов 0139 серогруппы.
4.4.L Определение вибриоцидных антител (ВА) в сыворотке крови
на основе чашечного метода (Finkelstein)
Материалы и оборудование.
Исследуемые сыворотки, инактивированные прогреванием 30 мин при температуре (56,0 ± 0,5) °С.
Сухой комплемент или свежеполученная сыворотка морской свинки в разведении 1 : 20.
0,9 %-й раствор хлорида натрия pH 7,2 ±0,1-
Штаммы холерных вибрионов 01 серогруппы сероваров Огава и Инаба и 0139 серогруппы, типичные, в S-форме, не чувствительные к комплементу.
Чашки Петри со щелочным агаром.
Лоток со льдом.
Термостат на (37,0 ± 1,0) °С.
Методика постановки реакции.
Комплемент, разведенный 0,9 %-м раствором хлорида натрия
1 :20, разливают в два ряда пробирок по 0,9 мл. В первую пробирку
вносят 0,1 мл исследуемой сыворотки и после тщательного перемешивания последовательно, меняя пипетки, переносят по 0,1 мл до разведения Ю40, получая десятикратные разведения сыворотки в объеме 0,9 мл. Титрацию сыворотки проводят на льду, который помещают в любую емкость.
Из односуточной агаровой культуры холерного вибриона готовят взвесь в 0,9 %-м растворе хлорида натрия, содержащую в 1 мл 1 х 10 —
2 х Ю4 м.к. Стерильной градуированной пипеткой полученную взвесь по 0,1 мл вносят в опытные пробирки с титрованной сывороткой.
Ставят следующие контроли: а) контроль комплемента (0,9 мл комплемента и 0,1 мл культуры); б) контроль сыворотки (0,8 мл 0,9 %-го раствора хлорида натрия, 0,1 мл сыворотки и 0,1 мл культуры); в) контроль культуры (0,9 мл 0,9 %-го раствора хлорида натрия и 0,1 мл культуры).
Штатив с пробирками на 1 ч помещают в водяную баню или термостат при температуре (37,0 ± 0,5) °С, сделав предварительно высев из пробирки контроля культуры на пластинки щелочного агара для определения фактической концентрации живых вибрионов в опытной суспензии (контроль разведения).
Через 1 ч штатив вновь ставят на лед и из каждой пробирки отдельной стерильной пипеткой 0,1 мл культуры высевают на чашку со щелочным агаром pH 8,0 ± 0,2. Посев равномерно распределяют по поверхности чашки покачиванием или шпателем. Чашки помещают на 18—24 ч в термостат при температуре (37,0 ± 0,5) °С, после чего подсчитывают количество выросших колоний.
В посевах из контрольных пробирок с культурой должно вырастать количество колоний, близкое к контролю разведения.
Вибриоцидным титром считают максимальное разведение сыворотки, которое вызывает гибель не менее чем 50 % клеток холерного вибриона, что выявляется при посеве на агаровые пластинки в чашки Петри по сравнению с количеством выросших колоний из пробирки контроля комплемента.
Пример вычисления: при посеве из опытных пробирок с разведением сыворотки Ю'1; 10“2;. 10~3; 10^; 10~5; 10^; 10“7 и т. д. на чашках соответственно выросло 0; 0; 5; 10; 15; 30; 38 и т. д. колоний. При высеве из пробирки контроля комплемента также после 18—24-часовой инкубации при температуре (37,0 ± 0,5) °С выросло 36 колоний, 50 % от этого числа будет составлять 18, Из 5-й пробирки выросло 15 колоний, т. е. меньше 50 % от количества колоний в контроле (18), в следующей - 30,
т. е. более 50 % этого же показателя. Разведение сыворотки в 5-й пробирке составляет 10 , следовательно, вибриоцидный титр в данном примере будет составлять 10 5.
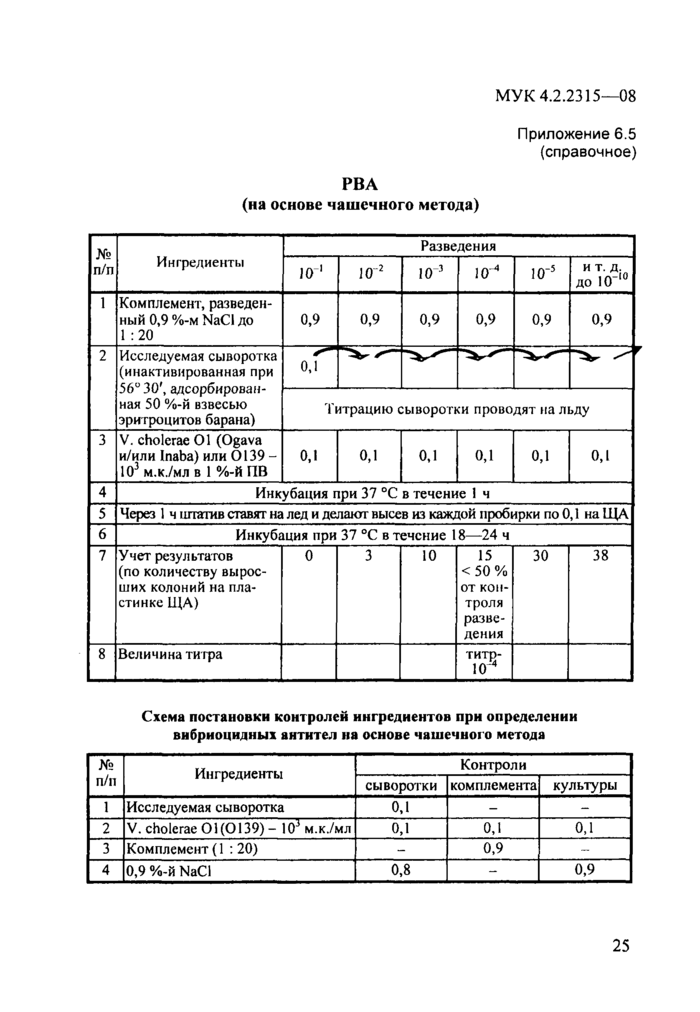
Схема методики определения вибриоцидных антител (ВА) в сыворотке крови на основе чашечного метода представлена в прилож. 6.5.
4.4.2. Определение вибриоцидных антител (ВА) в сыворотке крови
на основе ферментации углеводов
Об отсутствии или наличии ВА судят по ферментации сахарозы, регистрируемой с помощью индикатора.
Материалы и оборудование.
Инактивированная при 56 °С в течение 30 мин исследуемая сыворотка крови.
Штаммы холерного вибриона серовара Огава и Инаба.
Комплемент, разведенный 1 :20 1 %-й пептонной водой, содержащей 1 % сахарозы и 1 % индикатора Андреде.
Лоток со льдом.
Термостат на (37,0 ± 1,0) °С.
Методика постановки реакции.
Комплемент, разведенный 1 :20 1 %-й пептонной водой с сахарозой и индикатором Андреде, разливают в пробирки по 0,45 мл, штативы с пробирками помещают в лоток со льдом. В первую пробирку добавляют 0,05 мл исследуемой сыворотки и после тщательного перемешивания, меняя пипетки, переносят 0,05 мл смеси во вторую пробирку, из второй в третью и т.д. (до разведения 10~5—10~9). Готовят суспензию 18—20-часовой агаровой культуры холерного вибриона и разводят 1 %-й пептонной водой до концентрации 10э м.к. в 1 мл. Во все пробирки вносят по 0,45 мл суспензии и помещают в термостат.
Постановку реакции сопровождают следующими контролями:
• 0,45 мл 1 %-й пептонной воды, содержащей 1 % сахарозы и 1 % индикатора Андреде + 0,05 мл исследуемой сыворотки + 0,45 мл взвеси культуры (контроль сыворотки);
• 0,45 мл комплемента с сахарозой и индикатором + 0,45 мл культуры (контроль комплемента);
• 0,45 мл 1 %-й пептонной воды с сахарозой и индикатором + 0,45 мл культуры (контроль культуры);
• 0,45 мл 1 %-й пептонной воды с сахарозой и индикатором +
0,05 мл исследуемой сыворотки (контроль стерильности сыворотки).
Через 5—6 ч инкубации проводят учет реакции. При этом в кон-тролях (кроме контроля стерильности сыворотки) цвет содержимого пробирок должен перейти в красный или розовый. Изменение цвета индикатора в пробирках рабочего ряда, связанное с ферментацией сахарозы размножившимися вибрионами, свидетельствует об отсутствии вибриоцидных антител в исследуемой сыворотке. За вибриоцидный титр принимают то наибольшее разведение сыворотки, при котором цвет содержимого пробирок остается неизмененным или интенсивность его значительно отличается от окраски контрольных проб. Результат выражают в виде десятичного логарифма разведения сыворотки, взятого с обратным знаком.
Примечание. Для постановки РВА при холере, обусловленной холерным вибрионом 0139 серогруппы, не может быть использован выделенный в очаге штамм в связи с возможной чувствительностью его к комплементу. В этих случаях рекомендуется использовать предложенный специалистами Ростовского НИПЧИ штамм № 16077 МА холерного вибриона 0139 серогруппы, депонированный в Государственной коллекции патогенных бактерий РосНИПЧИ «Микроб» под № КМ-151.
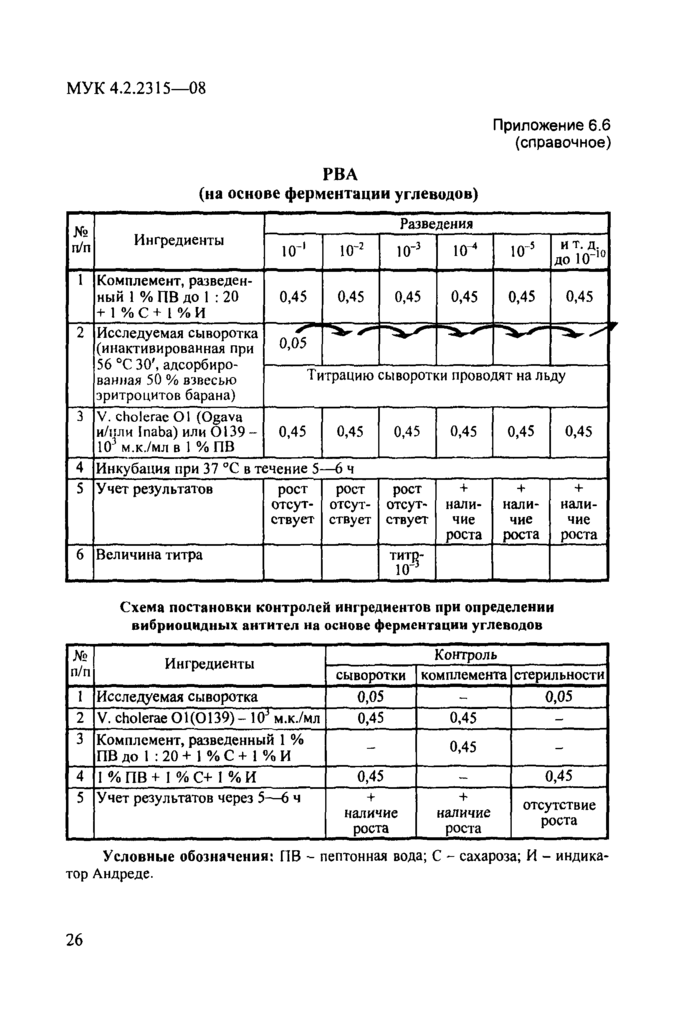
Схема определения вибриоцидных антител (ВА) в сыворотке крови на основе ферментации углеводов представлена в прилож. 6.6.
4.4.3. Определение вибриоцидных антител (ВА) с использованием холерного иммуноглобулинового эритроцитарного диагностикума
Метод основан на выявлении в РПГА задержки размножения холерных вибрионов 01 серогруппы в питательной среде с комплементом и исследуемой сывороткой, при наличии в последней специфических
антител.
Материалы и оборудование.
Исследуемая сыворотка, разведенная 1 : 10 и инактивированная при 56 °С 30 мин.
Взвесь 16—18-часовой агаровой культуры холерных вибрионов 01 серогруппы концентрацией 100 тыс. м.к. в 1 мл среды.
Комплемент (свежая сыворотка морской свинки или лиофилизиро-ванный комплемент, растворенный в 0,86 %-м растворе хлористого натрия), разведенный 1 %-й пептонной водой 1 : 20.
10 %-й раствор формалина.
Иммуноглобулиновый холерный эритроцитарный диагности-кум 2,5 %.
1 %-я пептонная вода.
Макро- или микропланшеты для постановки иммунологических реакций.
Микропипетки для постановки иммунологических реакций.
Термостат на (37,0 ± 1,0) °С.
Методика постановки реакг^ии,
Постановка основного опыта (РПГА) предусматривает определение минимального срока инкубации холерного вибриона в питательной среде с комплементом (без сыворотки), необходимого для получения положительной реакции гемагглютинации с эритроцитарным иммуноглобулиновым холерным диагностикумом.
А. Определение минимального срока инкубации холерных вибрионов в питательной среде с комплементом.
Для определения минимального срока инкубации холерных вибрионов в питательной среде с комплементом в шесть лунок планшета разливают по 0,9 мл комплемента, разведенного 1 %-й пептонной водой до 1 : 20. Затем во все лунки вносят по 0,1 мл взвеси холерных вибрионов из 100 тыс. м.к. (фактически в каждую лунку вносят 10 тыс. м.к., что в 10—25 раз ниже минимальной дозы, выявляемой в РПГА эритроцитарным холерным иммуноглобулиновым диагностикумом). Планшет ставят в термостат на 37 °С.
Через 3,5, 4, 4,5, 5, 5,5 и 6 ч инкубации поочередно в лунки добавляют по одной капле 10 %-го раствора формалина.
Не ранее чем через час после добавления формалина в каждую лунку планшеты добавляют по одной капле иммуноглобулинового холерного диагностикума. Содержимое лунок перемешивают осторожным покачиванием планшеты и оставляют её на 2—3 ч при комнатной температуре, после чего производят учет результатов. Наибольшая инкубация при 37 °С, после которой в лунке отмечается полноценная агглютинация эритроцитов, и является оптимальной для используемых ингредиентов.
Б. Постановка РПГА.
Для постановки основной реакции в 10 лунок планшеты разливают по 0,9 мл комплемента, разведенного 1 : 20 1 %-й пептонной водой, В первую лунку вносят 0,1 мл исследуемой сыворотки и титруют ее переносом по 0,1 мл из лунки в лунку. Из последней лунки 0,1 мл разведения сыворотки выливают. Получают ряд десятикратных разведений сыворотки, начиная с 1 : 100 и более. Затем во все лунки добавляют по 0,1 мл взвеси холерных вибрионов.
Постановку реакции сопровождают следующими контролями:
• 11-я лунка - контроль на отсутствие спонтанной агглютинации эритроцитов в исследуемой сыворотке с комплементом (0,9 мл комплемента и 0,1 мл исследуемой сыворотки);
• 12-я лунка - контроль специфичности гемагглготинации в отсутствии сыворотки (0,9 мл 1 %-го комплемента и 031 мл взвеси холерных вибрионов).
Планшету помещают в термостат при 37 °С на срок, на 30 мин превышающий минимальный срок инкубации холерных вибрионов в питательной среде с комплементом, определенный ранее опытным путем.
По прошествии этого срока во все лунки добавляют по одной капле 10 %-го раствора формалина. Через час после добавления формалина во все лунки, включая контрольные, вносят по одной капле иммуноглобулинового холерного эритроцитарного диагностикума. Содержимое лунок осторожно гомогенизируют покачиванием пластинки. Учет результатов РПГА проводят через 2—3 ч после инкубации реакции при комнатной температуре.
За вибриоцидный титр принимают наибольшее разведение сыворотки с отсутствием гемагглютинации в лунке. Титр выражают в виде десятичных логарифмов разведения сыворотки, взятых с обратным знаком.
В 11-й контрольной лунке (контроль всех ингредиентов без культуры) гемагглютинации не должно быть* В 12-й лунке (контроль всех ингредиентов без сыворотки) должна быть выраженная гемагглютинация.
Примечания.
1. В отдельных случаях в 11 -й контрольной лунке, а иногда и в первых лунках опытного ряда, может иметь место гемагглютинация. В таких случаях следует помнить, что данная гемагглютинация эритроцитов обусловлена не отсутствием вибриоцидных антител в сыворотке, а зависит от присутствия в ней значительного количества гетерогенных антител к бараньим эритроцитам.
2. В целях обеспечения биологической безопасности при данной работе возможна постановка предварительного опыта и основной реакции непосредственно в пробирках до момента полной формалинизации культуры.
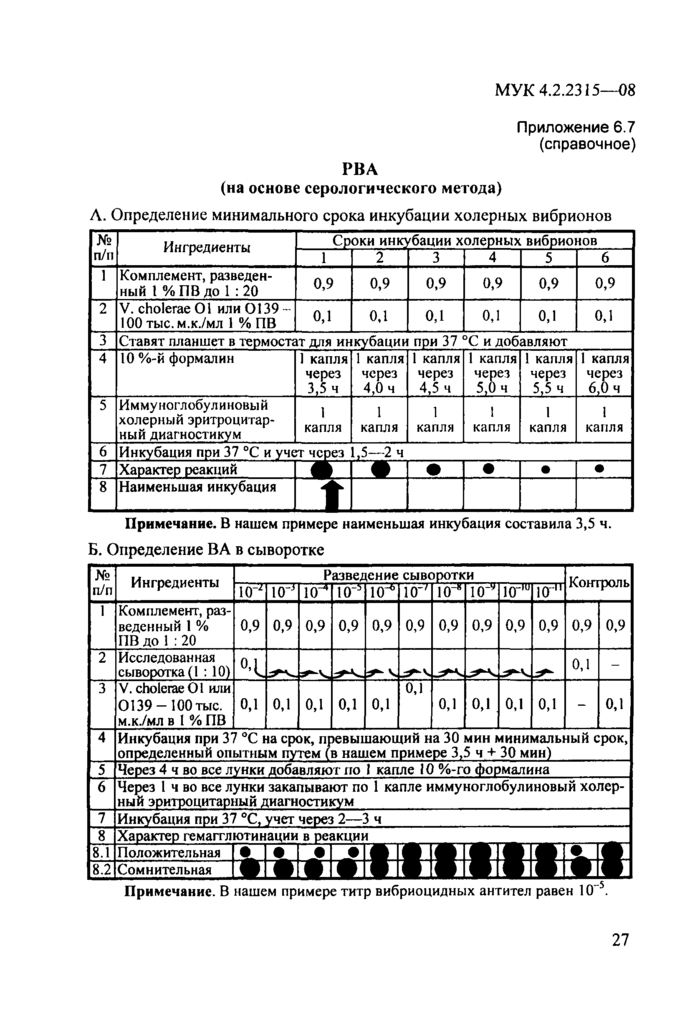
Схема определения вибриоцидных антител (ВА) в сыворотке крови на основе серологического метода с использованием холерного иммуноглобулинового эритроцитарного диагностикума представлена в прилож. 6,7.
5. Тактика применения систем серологических реакций
различных сочетаний (основные принципы)
При выборе оптимальных схем серологического исследования необходимо учитывать такие важные аспекты, как диагностическая ценность той или иной реакции в разные сроки обследования от начала заболевания, чувствительность и специфичность реакций, а также трудоемкость их постановки. Последний аспект имеет немаловажное значение, т. к. при проведении массовых исследований объемы затрачиваемого труда весьма существенны. Надо иметь в виду сложность и трудоемкость постановки реакций по определению вибриоцидных антител (ВА) в сыворотке крови на основе ферментативного и особенно чашечного методов, требующих большой тщательности в технике постановки реакций и продолжительных по времени. Вследствие чего возможность использования этих методов при массовых исследованиях значительно ограничена.
Наиболее рациональной и эффективной тактикой серологического исследования на выявление специфических иммуноглобулинов разных видов к возбудителю холеры следует признать постановку реакций в системах: РПГА-РНАг, РА-РНАг, PHАг-РПГАЭхэд> РА-РПГАЭхэд, РВА-РНАг. Главным достоинством таких сочетаний является повышение достоверности результатов. Во многих случаях оптимальный выбор схем позволяет решать разные задачи в зависимости от сроков обследования, экономить средства и силы диагностики, без потери информативности исключить повторный забор крови для исследования (прилож. 6.11).
При использовании системы РПГА-РНАг отпадает необходимость в постановке контроля специфичности с каждой исследованной сывороткой, т. к. эти две реакции взаимно контролируют полученные результаты. Существенным достоинством схемы РНАг-РПГАэхэд является ее универсальность за счет выявления в наиболее ранние сроки неполных агглютининов в РНАг и энтеротоксических холерных иммуноглобулинов в РПГАЭхэд> а в поздние сроки (свыше 30 дней), в отличие от других тестов, выявление в относительно высоких титрах энтеротоксических холерных иммуноглобулинов, что одновременно свидетельствует также о циркуляции токсигенных штаммов холерных вибрионов серогрупп 01 или 0139 в очаге холеры.
Таким образом, выбор наиболее оптимальных схем исследования при поиске антител к холерному вибриону 01 (0139) серогруппы в сы-
воротках крови больных, вибриононосителей и переболевших зависит от сроков обследования со дня заболевания (инфицирования), а также от значимости систем иммунологических реакций по специфичности, информативности и с учетом конкретных целей, задач обследования (оперативная или ретроспективная диагностика холеры).
Одновременное использование двух и более иммунологических реакций, направленных на выявления различных видов агглютининов, повышает достоверность специфичности результата анализа и в ряде случаев исключает обследование в динамике.
При массовых исследованиях первичную (отборочную) постановку серологических тестов, независимо от избранной схемы, целесообразнее проводить в 3-х разведениях (лунках), а при необходимости ускоренного ответа - в развернутом варианте в 6—10 лунках, в зависимости от чувствительности теста.
5.1. Система PHАг-РПГАэхэд
Система РНАг-РПГАэхэд является универсальной, высоко информативной и позволяет за счет высокой активности, специфичности решать многие вопросы серодиагностики холеры у людей как на ранних этапах обследования, так и в более поздние сроки (60 и более дней) при ретроспективной диагностике холеры. В большинстве случаев с 10—12 дня за счет высокой активности и специфичности (величина титров в этих реакциях в 4—8 и более раз превышает условно диагностические) отпадает необходимость исследования парных сывороток.
Использование в этой системе РПГА с ЭХЭД позволяет в более поздние сроки выявлять холерные энтеротоксические антитела, которые, в отличие от других иммуноглобулинов, сохраняются более длительно, их наличие свидетельствует о холере, обусловленной токсиген-ными (эпидемическими) холерными вибрионами 01 или 0139 серологических групп.
5.2. Система РА-РНАг
Достоинством системы РА-РНАг является простота постановки агглютинационного теста с живой или убитой культурой холерного вибриона, возможность постановки РА с циркулирующим в очаге холеры штаммом. Микрометод РА с использованием разовых микропланшет менее трудоемок в сравнении с пробирочным методом, дает определенный экономический эффект и сокращает время постановки реакции до
2 ч. РНАг позволяет в более ранние сроки, начиная с 4—6 дня болезни, выявлять неполные антитела.
При получении положительного результата в РНАг и отрицательного в РА на ранних стадиях исследования сывороток в этой системе реакций (4—9 день от начала заболевания) обязательным условием является исследование парных сывороток. При постановке РА-РНАг в относительно более поздние сроки (после 10—12 дня) в большинстве случаев такой необходимости нет (прилож. 6.9).
Достоинством этой высокоинформативиой и относительно простой системы реакций является также использование только одного иммуноглобулинового эритроцитарного поливалентного холерного 01 диагностикума.
5.3. Система РПГА-РНАг
Иммуноглобулины к холерным вибрионам 01 серогруппы могут выявляться в исследуемых сыворотках с помощью системы РПГА-РНАг с использованием антигенного и иммуноглобулинового эритроцитарных холерных диагностикумов. При использовании системы однонаправленных реакций РПГА и РНАг отпадает необходимость в постановке контроля специфичности с каждой исследуемой сывороткой, т. к. эти реакции, направленные на выявление агглютининов, взаимно контролируют полученные результаты. Использование системы РПГА-РНАг в зависимости от сроков исследования от начала заболевания холерой позволяет без потери информативности исключить необходимость исследования парных сывороток. Начиная с 11—13 дня характерно превышение величины титров РНАг над титрами РПГА в 4—8 и более раз за счет большей концентрации неполных антител, появляющихся раньше полных. Целесообразно исключить исследование парных сывороток и в более поздние сроки (14—30 день), когда имеют место случаи с равными или близкими высокими титрами РПГА и РНАг, свидетельствующими о том, что в сыворотках имеются только полные антитела.
Специального анализа и оценки требуют случаи с положительным результатом в РНАг и отрицательным в РПГА. В этом случае определяющим моментом является целесообразность исследования парных сывороток или дополнительного использования других иммунологических реакций. С этой целью предпочтительно использовать РПГАэхэд-
5.4. Система РА-РПГАэхэд
Систему сочетаний РА-РПГАЭХэд можно использовать с целью оперативной и ретроспективной диагностики холеры у людей, начиная соответственно с 6—9 дня заболевания и в более поздние сроки (21—31 день и более) за счет более длительного сохранения при относительно высокой величине титров в сыворотках людей холерных энтеротоксических антител и агглютининов в сравнении с ВА.
5.5. Системы РВА-РА и РВА-РНАг
Могут быть использованы эти системы, но необходимо помнить о случаях позднего появления вибриоцидных антител и возможности выявления без связи с холерной инфекцией. Отмечены находки вибриоцидных антител в сыворотке у здоровых лиц (не вакцинированных), которые не болели холерой, и у лиц, переболевших бруцеллезом, иерси-ниозом (Y. enterocolitica, серотип 9) и др. Это обстоятельство подчеркивает необходимость осторожной интерпретации данных о наличии ВА,
особенно в тех случаях, когда взята только одна (первая) проба сыворотки. Есть сведения о том, что пары сывороток, оказываясь положительными в вибриоцидном тесте, были отрицательными в агглютинаци-онном и наоборот.
Оценка отрицательных результатов требует большой осторожности, т. к. при использовании системы РВА-РА в ряде случаев необходимо исследование третьей парной сыворотки. В то же время система реакций РНАг-РВА позволяет в ранние сроки (с 3—7) дня выявлять агглютинины за счет неполных антител. Следует иметь в виду, что в ряде случаев в сроки (12—17 дни) необходимо проводить дополнительный забор крови для исследования парных сывороток.
6. Приложения
Приложение 6.1 (справочное)
РПГА
(поиск иммуноглобулинов /антител/ к холерному вибриону)
Разведения
Контроли
иссле
дуе
мой
сыво
ротки
(У.о) I
№
п/п
Ингредиенты
1/
/640
и т. д.
разводящей жидкости
1
/
/
/,
/
/
20
80
320
40
160
,
..
1
Разводящая жид кость: твин-80
1 : 50 000 /НКС 1 :200/
0,4
0,4
0,4
0,4
0,4
0,4
0,4
0,4
0,4
2
Исследуемая сы воротка в разведении 1:10 (инактивированная и адсорбированная 50 % взвесью эритроцитов барана)
/
/
0,4
3
По 1 капле (0,05)
0,05
Холерный антигенный диагнос-тикум
по 1 капле
(0,05)
4
Контрольные
эритроциты
|
5 Учет результатов реакций через 2—3 ч | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
В сомнительном случае необходимо адсорбировать сыворотку |
РТПГА
(поиск иммуноглобулинов/антител/ к холерному вибриону)
|
" |
Разведения |
Контроли | ||||||||
|
№ п/п |
Ингредиенты |
%0 |
Чо |
'/|60 |
h '320 |
1/ '640 ИТ. Д. |
иссле дуе мой сыво ротки (V20) |
разводящей жидкости | ||
|
1 |
Разводящая жидкость: твин-80 1 : 50 ООО /ИКС 1 :200/ |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
2 |
Исследуемая сыворотка 1:10 |
0^4* |
V/ |
0* |
— |
- | ||||
|
3 |
Взвесь убитой культуры V. choJerae (200 млн м. кл.) |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
— |
— |
- |
|
4 |
Смесь оставляют на 30 мин при температуре 37 °С или на 1 ч - |
22 °С | ||||||||
|
5 |
Холерный антигенный диагно* стикум |
По 1 капле (0,05 мл) |
— |
- |
0,05 | |||||
|
6 |
Контрольные эритроциты |
— |
— |
-- |
- |
— |
- |
0,05 |
0,05 |
— |
|
7 |
Учет результатов реакций через 2—3 ч | |||||||||
|
7.1 |
Положительный |
Уменьшение титра в РТПГА на три и более лунок |
— |
- | ||||||
|
7.2 |
Отрицательный |
Уменьшение титра в РТПГ А на две и менее лунок |
— |
— |
- | |||||
|
7.3 _ |
Сомнительный |
+ |
+ |
+ |
+ |
+ |
+ |
+ - |
+ | |
|
В сомнительном случае необходимо адсорбировать сыворотку | ||||||||||
Приложение 6.3 (справочное)
РНАг
(поиск иммуноглобулинов/антител/ к холерному вибриону 01 серогруппы)
|
№ п/п |
Ингредиенты |
Разведения |
Контроли | |||||||
|
• / '40 |
'/go |
1/ '160 |
1/ '320 |
1/ '640 |
1/ ' 1 280 ИТ. д. |
иссле дуемой сыво ротки (1 /20) |
разводящей жидкости | |||
|
1 |
Разводящая жидкость: твин-80 1 ; 50 ООО /ИКС 1 ; 200/ |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 ,— . —* |
0,4 |
0,4 |
0,4 |
|
2 |
Исследуемая сыворотка 1:10 |
0,2 |
0,4 |
■- |
- | |||||
|
3 |
Взвесь убитой культуры V. ch. -2 АЕ |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
— |
- |
- |
|
4 |
Смесь оставляют на 30 мин при температуре 37 °С или на 1 ч - 22 °С | |||||||||
|
5 |
Холерный иммуноглобулиновый диагностикум |
По 1 капле (0,05 мл) |
- |
- |
0,05 | |||||
|
6 |
Контрольные эритроциты |
— |
— |
- |
— |
— |
0,05 |
0,05 |
— | |
|
7 |
Учет результатов реакций через 2—3 ч | |||||||||
|
7.1 |
Положительный |
— |
— |
-— |
+ |
+ |
—* |
— | ||
|
7.2 |
Отрицательный |
+ |
+ |
+ |
+ |
+ |
+ |
— |
— |
— |
|
7.3 |
Сомнительный |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
- |
— |
|
В сомнительном случае необходимо адсорбировать сыворотку |
— |
+ |
— | |||||||
|
— |
- |
+ | ||||||||
|
Контроль рабочего раствора антигена /2 АЕ/ | |||||||||||||||||||||||||||||||||||
|
Определение 2АЕ (определение величины двух антигенных единиц культуры холерного вибриона 01 серогруппы
для поиска антител в РНАг)
|
№ п/п |
Ингредиенты |
Разведения |
Контроли | |||||||
|
2,5 млн |
1,25 млн |
625 тыс. |
312 тыс. |
156 тыс. |
78 тыс. ИТ. д. |
убитая куль тура (5 млн Mjc/ton) |
разводящая жидкость | |||
|
1 |
Разводящая жидкость: твин-80 1 : 50 ООО /НКС 1 : 200/ |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
2 |
Взвесь убитой культуры V. cholerae (5 млн м.к,/мл) |
0,2 |
0,2 |
— - |
— | |||||
|
3 |
Иммуноглобулиновый диагно-стикум |
По 1 капле (0,05 мл) |
— |
— |
0,05 | |||||
|
4 |
Контрольные эритроциты |
— |
— |
— |
— |
По 1 капле (0,05) |
— | |||
|
5 |
Учет результатов реакций через 2—3 ч | |||||||||
|
6 |
Результат |
+ |
+ |
+ |
+ 2 АЕ |
+ 1 АЕ | ||||
Следовательно:
2 АЕ соответствуют разведению 312 тыс. м.к./мл. Для приготовления рабочего раствора необходимо исходную взвесь убитой культуры холерного вибриона (5 млн м.к./мл) развести в 16 раз.
Приложение 6.5 (справочное)
Разведения
№
п/п
Ингредиенты
и т. д.
до Ю10
-2
—4
-5
10
10
10
10
10
1
Комплемент, разведен ный 0,9 %-м NaCl до 1 :20
|
0,9 0,9 0,9 0,9 0,9 0,9 |
2
|
Исследуемая сыворотка (инактивированная при 56° 30\ адсорбированная 50 %-й взвесью эритроцитов барана) Гитрацию сыворотки проводят на льду | ||||||||||||||
| ||||||||||||||
|
4 Инкубация при 37 °С в течение 1 ч 5 |
0,1
Через 1 ч штатив ставят на лед и делают высев из каждой пробирки по 0,1 на ЩА
6
Инкубация при 37 °С в течение 18—24 ч
3
38
7
У чет резул ьтатов (по количеству выросших колоний на пластинке ЩА)
0
10
15
< 50 % от контроля разведения
30
Величина титра
8
титр-
ю4
Схема постановки контролей ингредиентов при определении вибриоцидных антител на основе чашечного метода
|
№ п/п |
Ингредиенты |
Контроли | ||
|
сыворотки |
1 комплемента |
культуры | ||
|
1 |
Исследуемая сыворотка |
0,1 |
— | |
|
2 |
V. cholerae 01(0139)- 103 м.к./мл |
0,1 |
0,1 |
0,1 |
|
3 |
Комплемент (1 :20) |
- |
0,9 |
- |
|
4 |
0,9 %-й NaCl |
0,8 |
0,9 | |
Разведения
№
п/п
Т
Ингредиенты
и т. д. до Ю“10
-I
5
-з
-I
4
10
10
10
10
10
■
Комплемент, разведенный 1 % ПВ до 1 : 20
+ 1 % С + I % И
|
0,45 0,45 0,45 0,45 0,45 0,45 |
|
Титрацию сыворотки проводят на льду |
2
Исследуемая сыворотка (инактивированная при 56 °С 30', адсорбированная 50 % взвесью эритроцитов барана)
3
V. cholerae О! (Ogava и/пли Inaba) или 0139 10 м.кУмл в 1 % ПВ
0,45
0,45
0,45
0,45
0,45
0,45
4
5
Инкубация при 37 °С в течение 5—6 ч
|
рост |
рост |
рост |
+ |
+ |
+ |
|
отсут |
отсут |
отсут |
нали |
нали |
нали |
|
ствует |
ствует |
ствует |
чие |
чие |
чие |
|
роста |
роста |
роста | |||
|
титр- 10'3 |
Учет результатов
6
Величина титра
Схема постановки контролей ингредиентов при определении вибриоцидных антител на основе ферментации углеводов
|
№ п/п пг |
Ингредиенты |
Контроль | ||
|
сыворотки | комплемента |
стерильности | |||
|
Исследуемая сыворотка |
0,05 |
— |
0,05 | |
|
2 |
V. cholerae 01(0139) - 10J м.к./мл |
О Lfl - |
0,45 |
— |
|
3 |
Комплемент, разведенный 1 % ПВ до 1 : 20 + 1 % С + 1 % И |
0,45 |
— | |
|
4 |
1 % ПВ + I % С+ 1 % И |
0,45 |
0,45 | |
|
5 |
Учет результатов через 5—6 ч |
+ наличие роста |
наличие роста |
отсутствие роста |
Условные обозначения: ПВ - пептонная вода; С - сахароза; И - индикатор Андреде.
Приложение 6.7 (справочное)
А. Определение минимального срока инкубации холерных вибрионов
№
п/п
Сроки инкубации холерных вибрионов
Ингредиенты
2
4
6
3
1
5
Комплемент, разведенный 1 % ПВ до 1 : 20
1
0,9
0,9
0,9
0,9
0,9
0,9
V. cholerae 01 или 0139 100 тыс, м.к./мл 1 % ПВ
2
ОД
0,1
0,1
0,1
0,1
0,1
3
Ставят планшет в термостат для инкубации при 37 °С и добавляют
10 %-й формалин
4
1 капля через
4,5 ч
1 капля через 5,0 ч
1 капля через 3,5 ч
1 капля через 6J) ч
1 капля через 4,0 ч
1 капля через
5,5 ч
Иммуноглобулиновый холерный эритроцитар-ный диагн ости кум
5
i
капля
1
капля
1
капля
1
капля
1
капля
1
капля
|
6 Инкубация при 37 °С и учет через 1,5—2 ч | ||||||||||||||||
| ||||||||||||||||
|
Примечание. В нашем примере наименьшая инкубация составила 3,5 ч Б. Определение ВА в сыворотке |
№
п/п
т
Разведение сыворотки
~°| 10 110~*
Ингредиенты
Комплемент, разведенный 1 %
ПВ до 1 : 20
Исследованная сыворотка (1 :10)
Контроль
10^110
10^110-™
-J
FT1
2
V. cholerae 01 или
0139 —100 тыс.
м.кУмл в 1 % ПВ_______
Инкубация при 37 °С на срок, превышающий на 30 мин минимальный срок, определенный опытным путем (в нашем примере 3,5 ч + 30 мин)
3
4
Через 4 ч во все лунки добавляют по 1 капле 10 %-го формалина_
Через I ч во все лунки закапывают по 1 капле иммуноглобулиновый холер-ный эритроцитарный диагностикум
5
6
7 8.1
8.2
Инкубация при 37 °С, учет через 2 Характер гемагглютинации в реакции Положительная
Сомнительная
-5
Примечание. В нашем примере титр вибриоцидных антител равен 10 .
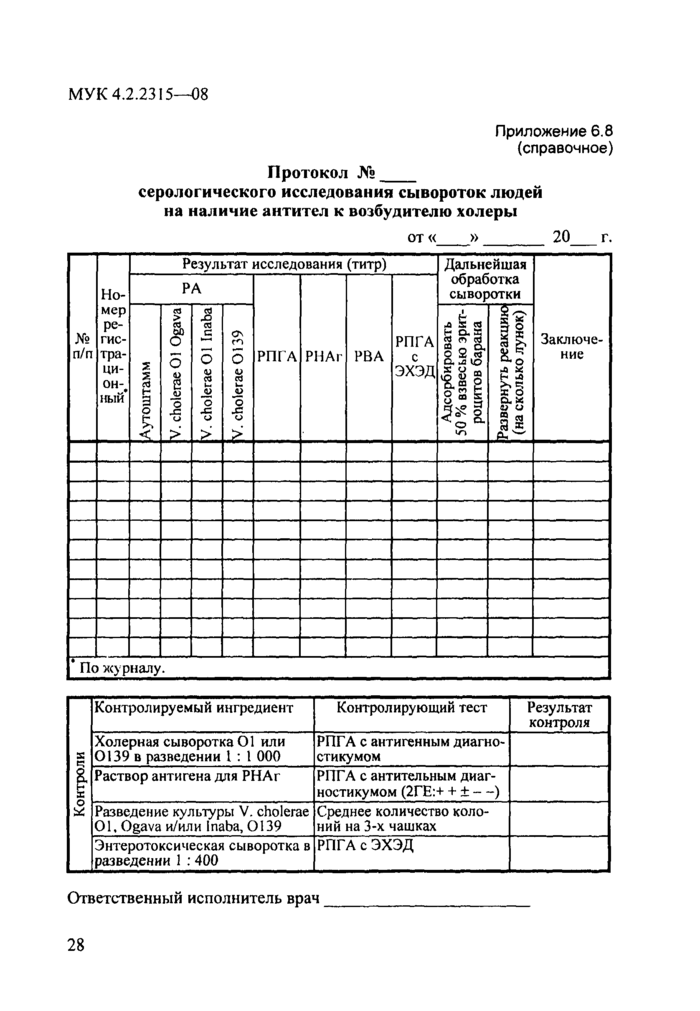
Протокол №_
серологического исследования сывороток людей на наличие антител к возбудителю холеры
от« » 20 г.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
I " - • - ------- По журналу. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
*ч | ||||||||||||||||
|
Ответственный исполнитель врач
Приложение 6.9 (справочное)
Выявление антител серологическими реакциями
в зависимости от сроков наблюдения
РВА
|
10000 I | ||
|
w -i- ■ ■- p w i ■ ^3* i p^^l p t ##111 t ■ ЗЙ * r |
- - * -■ + + | |
|
РА РПГА РНАг РПГАэхэд | ||
Тактика применения серологических реакций при обследовании различных контингентов
Дни исследований
20
|
16 16 16 15 15 | |
|
8 8 8 | |
|
Переболевшие | |
15
10
|
8 8 |
|
Больные |
8 8
5 5
5
ИР
шШ
3
0
Вибриононосители
Вакцинированные
Контингенты
|
РПГА |
□ РА
Q РНАг
И РВА
В РПГАэхзд
Тактика применения серологических реакций в зависимости от сроков и целей обследования
|
Иммунологические реакции |
Оперативная диагностика холеры |
Ретроспективная диагностика холеры | |
|
день болезни |
сроки исследования | ||
|
РПГ А эхэд + РНАг исследование парных сывороток |
3 8 |
I 9—10 |
>10—60 |
|
+ |
— | ||
|
Р11ГА'зхэд РА исследование парных сывороток |
3 9 |
10—12 |
12 60 |
|
+ |
— |
— | |
|
РПГ Аэхэд + РВА исследование парных сывороток |
3—9 |
10 12 |
10—60 |
|
+ |
— |
— | |
|
РПГАЗХЭД + РПГА исследование парных сывороток |
3—9 |
12 14 |
12—60 |
|
+ |
— |
— | |
|
РНАг + РА исследование парных сывороток |
3 9 |
9—12 |
10—30 |
|
+ |
— |
— | |
|
РНАг + РПГА исследование парных сывороток |
3—9 |
10—12 |
10—30 |
|
+ |
- | ||
|
РНАг + РВА исследование парных сывороток |
3—9 |
9—12 |
10—30 |
|
+ |
— | ||
|
РВА + РА исследование парных сывороток |
6— н |
12—15 |
10 30 |
|
+ |
+ |
+ | |
7. Новые серологические методы в идентификации холерных вибрионов
7.7. Серологическая идентификация холерных вибрионов О! и 0139
серогрупп с помощью реакции коагглютинации (РКОА)
Реакция коагглютинации (РКОА) ставится на стекле в соответствии с инструкцией по применению коагглютинирующих 01 и 0139 холерных вибрионов диагностикумов и действующими СП «Безопасность работы с микроорганизмами I—II групп патогенности (опасности)».
Диагностику мы холерные сухие 01 и 0139 представляют собой лиофилизированные препараты, основой которых является стафилококковый реагент, содержащий белок А (по ФС 42-31 ВС-90), сенсибилизированный кроличьими 01 и 0139 холерными сыворотками.
Препараты имеют вид пористых таблеток белого цвета.
Холерные антитела, сорбированные на стафилококковом реагенте, при соединении их с гомологичными антигенами вызывают реакцию коагглютинации.
Приготовление ингредиентов для РКОА. К содержимому ампулы с диагностикумом добавляют 1,5 мл 0,9 %-го раствора хлорида натрия pH 7,0—7,2. Образовавшуюся в течение 1 мин суспензию переносят в стерильную пробирку и используют для работы до 1 месяца при условии хранения при 4—6 °С.
Подготовка исследуемого материала. С целью идентификации культуру выращивают на питательной среде для холерного вибриона при (37 ± 1) °С в течение 18 ч. Для исследования используют суспензию данной культуры, обеззараженную 2 % формалина или кипячением в течение 15—20 мин.
Методика постановки РКОА. Взвесь холерных вибрионов в концентрации п • 108'9 в растворе 0,9 %-го хлорида натрия наносят в виде двух отдельных капель на дно чашки Петри или на предметное стекло, в одну из них добавляют каплю коагглютинирующего диагностикума, в другую - каплю 0,9 %-го раствора хлорида натрия для контроля материала на возможность спонтанной агглютинации. Одновременно контролируют диагностику м на спонтанную агглютинацию в капле 0,9 %-го раствора хлорида натрия.
Учет результатов. Проводят на темном фоне, визуально, в течение
2—3 мин. Реакцию считают положительной, если в исследуемом материале регистрируется полная агглютинация с полным просветлением жидкости или хорошо выраженная агглютинация и значительное просветление жидкости (4 или 3 креста) при отсутствии реакции в контролях.
Диагностикум должен выявлять с помощью РКОА 10 и более м.к. холерного вибриона в 1 мл.
7,2. Реакция агглютинации объемная с диагностикумом антилипазным иммуноглобулиновым полимерным для выявления
липазной активности холерных вибрионов Эльтор с целью дифференциации гемолитичных (атоксигенных) и негемолитичных (токсигенных) штаммов, выделенных из окружающей среды (РАО)
Диагностикум представляет собой пористую гигроскопическую массу сиреневато-розового цвета. Выпускается в комплекте с сывороткой нормальной кроличьей сухой 1 : 10(НКС).
Для постановки РАО готовят взвесь 10 м.к./мл (по стандартному образцу мутности) в 0,9 %-ом растворе натрия хлорида из 24-часовой агаровой культуры холерных вибрионов.
Далее 0,1 мл приготовленной взвеси (10 м.к./мл) вносят в 4,5 мл мясопептонного бульона (для гемолиза) и инкубируют посевы в термостате при температуре (37 ± 2) °С в течение 4 ч. Полученную бульонную культуру исследуют в РАО.
В качестве положительного контроля используется любой заведомо известный гемолитичный штамм V. cholerae, в качестве отрицательного контроля - любой заведомо известный токсигенный (негемолитичный) штамм V. cholerae. Бульонную культуру обоих штаммов готовят для исследования изложенным выше способом.
Работу проводят с соблюдением требований действующих СП «Безопасность работы с микроорганизмами I—II групп патогенности (опасности)».
Планшет для иммунологических реакций помещают на смоченную дезинфицирующим раствором салфетку. В U-образные лунки планшета (3) разливают по 50 мкл 1 %-го раствора НКС пипеткой-дозатором (на
50—200 мкл А 200 mkl). Исследуемую бульонную культуру холерных вибрионов в количестве 50 мкл вносят в первую лунку пипеткой-дозатором и делают последовательные двукратные разведения в 3-х лунках включительно, из последней 50 мкл удаляют. Затем во все лунки добавляют пипеткой-капельницей по 1 капле (25 мкл) диагностикума в рабочем разведении, указанном в наставлении к препарату. После добавления диагностикума содержимое лунок перемешивают покачиванием планшета в течение 1 мин и оставляют при температуре (20 ± 2) °С на (2,5 ± 0,5) ч, накрыв крышкой.
Постановку контролен производят аналогичным способом, в рядах по 3 лунки, содержащих 50 мкл НКС 1 : 100.
В первую лунку ряда вносят соответственно:
• 50 мкл гемолитичного штамма холерных вибрионов (1-й контроль -положительный);
• 50 мкл токсигенного штамма V. cholerae (2-й контроль - отрицательный);
• 50 мкл мясопептонного бульона (3-й контроль - отрицательный).
Затем во все лунки добавляют по 25 мкл диагностикума:
• для контроля диагностикума на отсутствие спонтанной агломерации в лунки вносят только НКС и диагностикум (4-й контроль - отрицательный).
Учет результатов. За положительный результат реакции принимают ярко-розовый агломерат, выстилающий все дно лунки равномерным слоем (зонтик). Положительная реакция указывает на продукцию липазы штаммом холерного вибриона и свидетельствует о гемолитической активности.
В случае отрицательного результата образуется компактное колечко или «точка» в центре лунки (пуговка), что указывает на отсутствие тестируемой липазы в культуре, свидетельствует об отсутствии гемолитической активности и позволяет предположить, что штамм токсигенен.
Диагностикум в РАО выявляет антиген (липазу) - в 1—3 лунках.
Форма выпуска. Диагностикум - во флаконах по 6 мг. НКС - во флаконах по 0,5 мл в разведении 1 : 10 в лиофилизированном состоянии. Одного флакона диагностикума достаточно для определения липазной активности у 30 исследуемых штаммов холеры.
Транспортирование. В соответствии с СП 3.3.2.1248—03 при температуре от 2 до 20 °С.
Хранение. В сухом, защищенном от света месте при температуре от
2 до 10 °С в соответствии с СП 3.3.2.1248—03.
Серологические методы в диагностике холеры
Дополнение к МУК 4.2.2218—07 «Лабораторная диагностика холеры»
Методические указания МУК 4.2.2315—08
Редакторы Н. В. Кожока, Е. В. Николаева Технический редактор £. В. Ломанова
Подписано в печать 17.02.10
Формат 60x88/16
Печ. л. 2,25
Тираж 500 экз. Заказ 13
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека 127994, Москва, Вадковский пер., д. 18, стр. 5, 7
Оригинал-макет подготовлен к печати и тиражирован
отделом издательского обеспечения Федерального центра гигиены и эпидемиологии Роспотребнадзора
117105, Москва, Варшавское ш., 19а Отделение реализации, тел ./факс 952-50-89