Изменение №2 для ГОСТ Р 52174-2003
Биологическая безопасность. Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
| Дата введения | 01.07.2014 |
|---|---|
| Добавлен в базу | 01.10.2014 |
| Актуализация | 01.01.2021 |
| Опубликован | ИУС 4-2014 |
| Дополняет: | ГОСТ Р 52174-2003 |
Организации:
| 22.11.2013 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1896-ст |
|---|
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1
стр. 2
стр. 3

стр. 4

стр. 5
стр. 6

стр. 7
стр. 8

стр. 9
стр. 10

стр. 11

стр. 12

стр. 13
65 СЕЛЬСКОЕ ХОЗЯЙСТВО
ОКС 65.140, 65.160, 67.060, 67.080, 67.100, 67.120, 67.140, 67.140.30, 67.160, 67.180, 67.190, 67.200, 67.220 Изменение № 2 ГОСТ Р 52174-2003 Биологическая безопасность. Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа
Утверждено и введено в действие Приказом Федерального агентства по техническому регулированию и метрологии от 22.11.2013 № 1896-ст
Дата введения — 2014—07—01
Раздел 1. Второй абзац. Заменить слова: «пяти» на «десяти», «10~12 г (1 пг)» на «10~9 г (1 нг, -103 геном-эквивалентов тотальной растительной ДНК/1 мкл пробы)».
Раздел 2 дополнить ссылкой:
«ГОСТ 20015-88 Хлороформ. Технические условия».
Пункты 4.1,4.2 изложить в новой редакции:
«4.1 Универсальный аппаратно-программный комплекс (УАПК) для анализа биологических микрочипов с компьютерной программой для анализа полученных результатов (1).
4.2 Хлороформ по ГОСТ 20015, х.ч.».
Пункт 4.3. Заменить ссылку: [31 на [2J.
Пункт 4.4. Заменить ссылку: [4] на [3).
Пункт 4.8. Заменить ссылку: (5) на [4].
Пункт 4.9. Заменить ссылку: [6) на (5).
Пункт 4.10. Заменить ссылку: [7] на [6].
Пункт 4.13. Заменить ссылку: [8] на [71.
Пункт 4.14. Заменить ссылку: (9) на [81-Пункт 4.24. Заменить ссылку: [10] на [9].
Пункт 4.25. Заменить ссылку: [11J на [10].
Пункт 4.28 изложить в новой редакции:
«4.28 Цетилтриметиламмоний бромид [111».
Пункт 4.31 изложить в новой редакции:
«4.31 Фермент термостабильный HotTaq-полимераза для ПЦР с «горячим стартом», оптимум активности при температуре 70 °С — 72 °С [12]».
Пункты 4.33—4.36 изложить в новой редакции:
«4.33 Буфер гибридизационный [13].
4.34 Баня водяная [18].
4.35 Раствор водный дезоксирибонуклеозидтрифосфатов: дАТФ, дГТФ, дУТФ, дЦТФ с молярной концентрацией по 2 мМ каждого [14].
4.36 Раствор флуоресцентного субстрата ФС [15]».
Пункт 4.37. Заменить ссылку: [17] на [16].
Пункт 4.38. Заменить ссылку: [18] на [17].
Пункты 4.39—4.41 изложить в новой редакции:
«4.39 Раствор водный праймеров «ПР-1» для амплификации соответствующих участков генома, включающий следующие пары праймеров [19]:
- праймеры для амплификации фрагмента гена RBCL, кодирующего большую субъединицу рибуло-зы-f. 5-бифосфат карбоксилазы/оксигеназы (Асе. №Z95552, поз. 160—720):
-праймеры для амплификации фрагмента гена лектина LE1 (Асе.№К00821М30884,поз. 1080— 1720);
- праймеры для амплификации фрагмента гена IVR1, кодирующего бета-фруктозидазу (Асе. № U16123. поз. 300—1090):
- праймеры для амплификации фрагмента 355-промотора вируса мозаики цветной капусты (Асе. № FM 177585. поз. 3560—3870):
- праймеры для амплификации фрагмента 355-терминатора вируса мозаики цветной капусты (Асе. № FM177585, поз. 1260—1590):
39
(Продолжение Изменения №2 к ГОСТР 52174—2003)
- праймеры для амплификации фрагмента 355-промотора каулимоеируса мозаики норичника (FMV, Асе. №Х06166. поз. 6260—6630);
- праймеры для амплификации фрагмента терминатора гена белка теплового шока пшеницы (Асе. № Х58279, поз. 10—210);
- праймеры для амплификации фрагмента маркерного гена BAR, определяющего устойчивость к фосфинотрицину (Асе. № AY310901, поз. 380—920);
- праймеры для амплификации фрагмента терминатора nos из агробактерии Agrobactehum tumefadens: (Асе. № FM177585, поз. 10—370).
4.40 Раствор водный праймеров «ПР-2» для амплификации соответствующих участков генома, включающий следующие пары праймеров [20];
- праймеры для амплификации фрагмента гена фосфорилазы УДФ-глюкозы (UDP-GP) (Асе. № D00667, поз. 50—310);
- праймеры для амплификации фрагмента гена фосфат-синтазы риса (SPS) (Асе. № U33175, поз. 5910-6250);
- праймеры для амплификации фрагмента маркерного гена nptll из транспозона Тп5 бактериального происхождения (Асе. Ne EU886197, поз. 9792—10145);
- праймеры для амплификации фрагмента терминатора ocs из агробактерии Agrobactehum tumefadens (Асе. № AJ311872, поз. 5050—5240);
- праймеры для амплификации фрагмента терминатора гена RBCS гороха (Асе. № FM 177582.1, поз. 5782—5920);
- праймеры для амплификации фрагмента промотора гена актина риса АСТ1 (Асе. Ne S44221, поз. 12—380);
- праймеры для амплификации фрагмента маркерного гена gus из бактерии Escherichia coli (Асе. № EU503042, поз. 2770—3140).
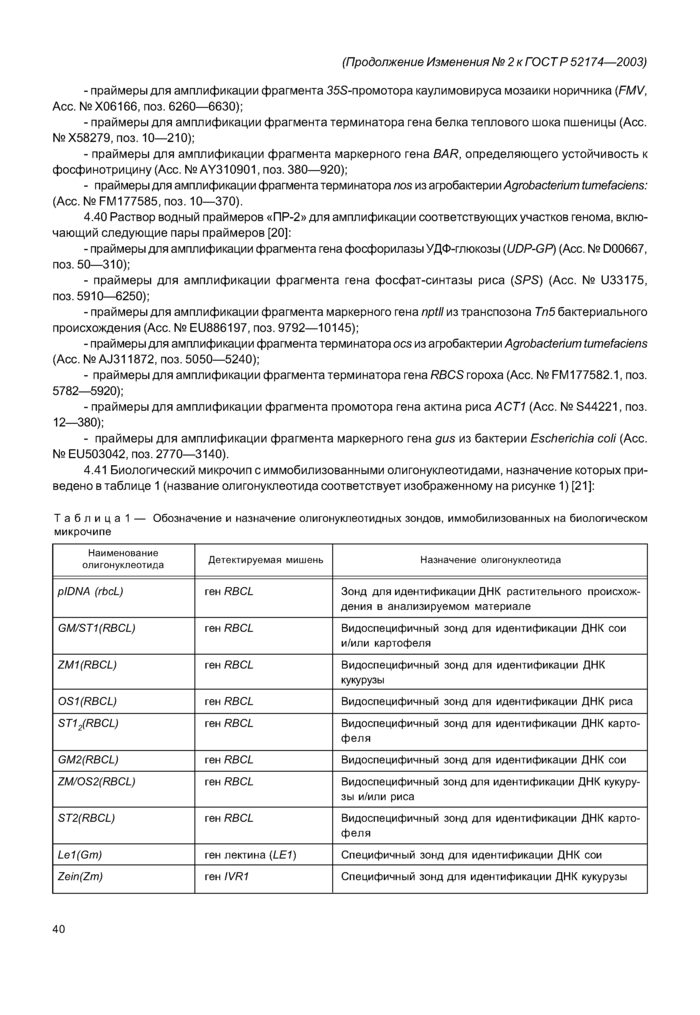
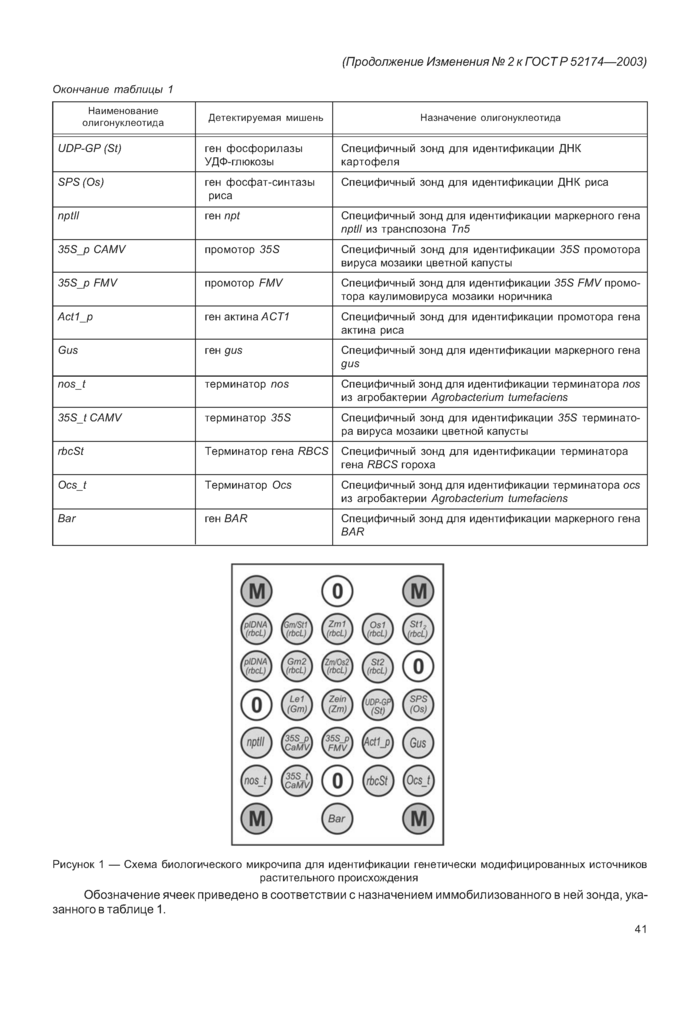
4.41 Биологический микрочип с иммобилизованными олигонуклеотидами, назначение которых приведено в таблице 1 (название олигонуклеотида соответствует изображенному на рисунке 1) [21]:
|
Таблица 1 — Обозначение и назначение олигонуклеотид» ых зондов, иммобилизованных на биологическом микрочипе | |||||||||||||||||||||||||||||||||
|
Результат анализа: В образцах 7/кс и 9/кс обнаружены следующие растительные компоненты: в образце 6/кс и 7/кс обнаружено присутствие ДНК сои, а в образцах 8/кс и 9/кс обнаружено присутствие ДНК картофеля.
|
Таблица 2 — Трансгенные видоспецифичные последовательности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Результат анализа: В образцах 7/кс и 9/кс обнаружены следующие трансгенные компоненты: в
образце 7/кс обнаружен гомолог гена nptll: промотор 35SCaMV и терминатор nos, а в образце 9/кс обнаружены промотор 35S СаМУ и терминатор nos. В образцах 6/кс и 8/кс трансгенные компоненты не обнаружены. Маркировка на упаковке, информирующая о наличии в продукте ГМИ, в образце 7/кс отсутствует, а в образце 9/кс присутствует.
Вывод: Все образцы содержат растительную ДНК, образец 6/кс содержит нетрансгенную ДНК сои; образец 7/кс содержит трансгенную ДНК сои; образец 8/кс содержит нетрансгенную ДНК картофеля; образец 9/кс содержит трансгенную ДНК картофеля.
Исполнители:
Иванов И И.
подпись Фамилия, инициалы
Петров П.П.
подпись Фамилия, инициалы
Руководитель испытательной лаборатории_
подпись
МП _
Фамилия, инициалы
Заключение распространяется на образец, представленный на испытания». Приложение Д изложить в новой редакции:
49
(Продолжение Изменения №2 к ГОСТ Р 52174—2003)
«ПРИЛОЖЕНИЕ Д (справочное)
Библиография
Универсальный аппаратно-программный комплекс для анализа биологических микрочипов (УАПК) Амплификатор «Терцик МС-2»
Термостат суховоздушный ТВР-25 Микроцентрифуга настольная 5415С, 13000 мин-’ Мешалка магнитная с подогревом Аппарат для встряхивания (центрифуга — вортекс) Штативы под микроцентрифужные пробирки Наконечники с фильтром для микропипеток
Этилендиаминтетрауксусной кислоты натриевая соль дигидрат
Т рис(оксиметил)аминометан [NH2C(CH2OH).J Цетилтриметиламмоний бромид (ЦТАБ) [C19H4?NBr] Фермент HotTaq-полимераза 5 Ед. акт. в мм3 Буфер гибридизационный Раствор смеси дАТФ. дГТФ, дТТФ.дЦТФ, по 25 мМ каждого
Флуоресцентный субстрат «ФС»
[1] ТУ 9443-004-02699501—2006 ООО «Биочип-ИМБ»
[2] ТУ 9642-001-4648062—98
[3] ТУ 42-619—61
[4] Корпорация «Эппендорф», кат. № 5425 000.014
[5] Корпорация «Хеликон». кат. № MSH-300
[6] Корпорация «Хеликон», кат. № CV-1500
[7] Корпорация «Хеликон», кат. № RP-30 и RP-80
[8] Корпорация «Хеликон», кат. № FA104; FA108; FA 111; FA 113N
[9] ТУ 6-09-11-1721—83
[10] ТУ 6-09-4292—76
[11] Корпорация «Хеликон», кат. № Ат-0833
[12] Корпорация «Силекс», кат. № Е0320 [ 13] ТУ 9398-003-02699501 —2006
[14] Корпорация «Силекс». кат. № N1101
[15] Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им. В.А. Энгельгардта Российской Академии наук (ИМБ РАН)
[16] Федеральное государственное бюджетное учреждение науки Институт физиологии растений им. К.А. Тимирязева Российской Академии наук (ИФР РАН)
[17] Федеральное государственное бюджетное учреждение науки Институт физиологии растений им. К.А. Тимирязева Российской Академии наук (ИФР РАН)
[18] ТУ 46-22-603—75
[19] Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им. В.А. Энгельгардта Российской Академии наук (ИМБ РАН)
[20] Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им. В.А. Энгельгардта Российской Академии наук (ИМБ РАН)
[21] Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им. В.А. Энгельгардта Российской Академии наук (ИМБ РАН)
[22] Государственный Комитет Санэпиднадзора Российской Федерации; №06-19/52-17 от 15.06.95
Раствор заведомо трансгенной ДНК около 100 нг/мм3 или 106 копий/мм3
Раствор заведомо нетрансгенной ДНК около 100 нг/мм3 или 10* копий/мм3
Баня водяная с электрическим или огневым подогревом
Раствор водный праймеров «ПРИ »
Раствор водный праймеров «ПР-2»
Биологические микрочипы (биочипы) гелевые с иммобилизованными олигонуклеотидами
Методические рекомендации по проведению работ в диагностических лабораториях, использующих метод полимеразной цепной реакции. Основные положения
Компьютерная программа «Gene» для учета и интерпретации результатов, полученных при помощи ПЦР-детектора «Джин»
[23] ЗАО «НПФ ДНК-Технология»
50
(Продолжение Изменения Ns 2 к ГОСТР 52174—2003) ПЦР-детектор «Джин»
[24] ТУ 9443-005-46482062—2003
[25] ООО «БИОМАСТЕР-ПРОМ»
Комплекты реагентов для ПЦР-амплификации ДНК «CKAH-35S», «СКАН-gus», «СКАН-nos» и «СКАНЕР*».
(ИУС №4 2014 г.)
|
Окончание таблицы 1 | |||||||||||||||||||||||||||||||||||||||
|
|
Рисунок 1 — Схема биологического микрочипа для идентификации генетически модифицированных источников растительного происхождения Обозначение ячеек приведено в соответствии с назначением иммобилизованного в ней зонда, указанного в таблице 1. |
41 (Продолжение Изменения №2 к ГОСТР 52174—2003)
Биологический микрочип представляет собой пластиковую подложку, выполненную в формате предметного стекла по ГОСТ 9284, на поверхности которой в определенном порядке расположена 31 ячейка полиакриламидного геля в форме полусферы диаметром 100 мкм (обозначены кружками на рисунке 1). 22 из них содержат индивидуальный ковалентно иммобилизованный олигонуклеотид (перечень и назначение олигонуклеотидов приведены в таблице 1). Пять ячеек с индексом «0» не содержат перечисленных индивидуальных ковалентно иммобилизованных олигонуклеотидов и выполняют роль отрицательного контроля гибридизации. Четыре ячейки с индексом «М», содержат ковалентно связанный флуоресцентный краситель и предназначены для автоматического вычисления интенсивности флуоресценции ячеек биологического микрочипа после гибридизации. Поверхность биологического микрочипа должна быть закрыта специальной составной крышкой с отверстиями, которая вместе с подложкой образует гибридизационную камеру, предназначенную для проведения реакции гибридизации анализируемых ПЦР-продуктов с иммобилизованными на биологическом микрочипе олигонуклеотидами, и исключающую возможность испарения реакционной смеси в процессе гибридизации. Диагностическая специфичность при идентификации растительной ДНК сои, картофеля, кукурузы, риса составляет не менее 95 %.
Допускается применение других средств измерений с метрологическими характеристиками, а также оборудования и реактивов с техническими характеристиками не хуже указанных выше».
Пункт 6.1.2. Заменить слова: «186,12 г/дм3» на «74,4 г/дм3». «18,61 г» на «7,44 г», «гидроокиси натрия» на «NaOH».
Пункты 6.1.4—6.1.9 изложить в новой редакции:
«6.1.4 Приготовление раствора Трис-HCI массовой концентрации 242,2 г/дм3
В колбу вместимостью 100 см3 помещают 24,22 г трис(оксиметил)аминометана по 4.25 (10) и растворяют приблизительно в 80 см3 особо чистой стерильной воды. Концентрированной соляной кислотой по ГОСТ 3118 доводят pH раствора до 7,5 ед. pH, а объем—до 100 см3 особо чистой стерильной водой.
Срок хранения при комнатной температуре — не более 6 мес.
6.1.5 Приготовление раствора NaCI массовой концентрации 146,2 г/дм3
В плоскодонную колбу вместимостью 100 см3 помещают 14,62 г хлористого натрия по ГОСТ 4233, растворяют в 70—80 см3 особо чистой стерильной воды, затем полученный раствор переносят в мерную колбу вместимостью 100 см3 и особо чистой стерильной водой доводят объем раствора до метки.
Срок хранения при комнатной температуре — не более одного года.
6.1.6 Приготовление ЦТАБ-буфера
В стеклянную колбу вместимостью 100 см3 помещают 2.0 г сухого цетилтриметиламмония бромида по 4.28 (11), далее добавляют 5 см3 раствора Трис-HCI, приготовленного по 6.1.4,56 см3 раствора NaCI, приготовленного по 6.1.5, и 10 см3 раствора ЭДТА, приготовленного по 6.1.2. Объем раствора доводят до 100 см3 особо чистой стерильной водой. Перемешивают на магнитной мешалке до полного растворения соли.
Срок хранения при комнатной температуре — не более одного года.
6.1.7 Приготовление ЦТАБ-раствора
В стеклянную колбу вместимостью 100 см3 помещают 0.5 г сухого цетилтриметиламмония бромида по 4.28 (11), и добавляют 1,6 см3 раствора NaCI, приготовленного по 6.1.5. Объем раствора доводят до 100 см3 особо чистой стерильной водой.
Срок хранения при температуре 4 °С — 5 °С — не более месяца, в морозильной камере по ГОСТ 26678 при температуре минус 20 *С—до одного года.
6.1.8 Приготовление разведенного раствора NaCI
В мерную колбу вместимостью 100 см3 вносят 48 см3 раствора NaCI, приготовленного по 6.1.5, и особо чистой стерильной водой доводят объем раствора до метки.
Срок хранения при комнатной температуре — не более 6 мес.
6.1.9 Раствор Taq-полимеразы по 4.31 хранят при температуре минус 20 °С не более шести месяцев. Не допускается хранение раствора Taq-лолимеразы ниже температуры минус 23 °С».
Пункты 6.2.1—6.2.6 изложить в новой редакции:
«6.2.1 Две параллельные пробы анализируемого продукта массой около 100 мг каждая помещают в две чистые стерильные микроцентрифужные пробирки по 4.15 вместимостью 1,5 см3, добавляют по 500 мм3 ЦТАБ-буфера, приготовленного по 6.1.6, перемешивают на аппарате для встряхивания по 4.10 (6) в течение 2 мин и выдерживают 15—20 мин при температуре 65 °С в термостате для микропробирок.
(Продолжение Изменения №2 к ГОСТ Р 52174—2003)
6.2.2 Микроцентрифужные пробирки со смесью, приготовленной по 6.2.1. центрифугируют при комнатной температуре в настольной центрифуге по 4.8 [4] при частоте вращения 13000 мин"’ в течение 10 мин.
6.2.3 Надосадочную жидкость, полученную по 6.2.2. отбирают микродозатором (обычно по 500 мм3) и переносят в чистые микроцентрифужные пробирки, добавляют равный объем хлороформа по ГОСТ 20015. Содержимое перемешивают на аппарате для встряхивания в течение 2 мин и центрифугируют 10 мин при частоте вращения 13000 мин"1.
6.2.4 Верхнюю жидкую фазу из смеси, полученной по 6.2.3, аккуратно отбирают микродозатором в чистые микроцентрифужные пробирки, не захватывая промежуточную или нижнюю фазу. В пробирки добавляют два объема ЦТАБ-раствора. приготовленного по 6.1.7, аккуратно перемешивают, переворачивая пробирки вручную, и выдерживают 60 мин при комнатной температуре.
6.2.5 Смесь, полученную по 6.2.4, центрифугируют 5 мин при частоте вращения 13000 мин"1. Надосадочную жидкость тщательно удаляют микродозатором, а осадок растворяют в 350—600 мм3 (в зависимости от объема осадка) разведенного раствора NaCI, приготовленного по 6.1.8, добавляют равный объем хлороформа по ГОСТ 20015, перемешивают на аппарате для встряхивания в течение 30 сек и центрифугируют 10 мин при частоте вращения 13000 мин"1.
6.2.6 Надосадочную жидкость, полученную по 6.2.5, отбирают микродозатором и переносят в чистые микроцентрифужные пробирки, добавляют равный объем изопропилового спирта по 4.27, аккуратно перемешивают содержимое пробирок вручную и выдерживают в течение 1 часа при комнатной температуре».
Подраздел 6.2 дополнить пунктами 6.2.7—6.2.9:
«6.2.7 Смесь, полученную поб.2.6, центрифугируют 10 мин при частоте вращения 13000 мин"1, надосадочную жидкость аккуратно сливают, а к осадку ДНК добавляют 1 см3 70%-ного этилового спирта, приготовленного по 6.1.3 и охлажденного до температуры 0 °С—4 °С, перемешивают и центрифугируют 5 мин при частоте вращения 13000 мин"1.
6.2.8 Полученную надосадочную жидкость вновь тщательно удаляют, а осадок ДНК подсушивают при комнатной температуре до полного удаления этилового спирта, но не более 30 мин.
6.2.9 Осадок ДНК. полученный по 6.2.8, перерастворяют в 40—50 мм3 особо чистой стерильной воды. Полученный раствор ДНК используют для проведения амПЦР.
Срок хранения раствора ДНК при температуре минус 20 °С —до одного года».
Пункт 6.3.1.1 изложить в новой редакции:
«6.3.1.1 Готовят две микроцентрифужные пробирки вместимостью по 1,5 см3 и маркируют их «М1» и «М2».
В пробирку «М1» микродозатором вносят (из расчета на каждую анализируемую пробу): 2.5 мм310х буфера реакционного для ПЦР по 4.32; 2,5 мм3 смеси дезоксирибонуклеозидтрифосфатов по 4.35 (14), 2 мм3 фермента Taq-полимеразы по 4.31 (12] (концентрацией 5 Ед.акт/мм3)1, 1 мм3 флуоресцентного субстрата ФС по 4.36 (15], а также 1 мм3 водного раствора праймеров «ПР-1» по 4.40 (19].
В пробирку «М2» микродозатором вносят (из расчета на каждую анализируемую пробу): 2,5 мм310х буфера реакционного для ПЦР по 4.32; 2,5 мм3 смеси дезоксирибонуклеозидтрифосфатов по 4.35 [14], 2 мм3 фермента Taq-полимеразы по 4.31 (12] (концентрацией 5 Ед. акт/мм3)', 1 мм3 флуоресцентного субстрата ФС по 4.36 [15], а также 1 мм3 водного раствора праймеров «ПР-2» по 4.41 [20].
Смесь разбавляют особо чистой стерильной водой до объема 20 мм3 (из расчета на одну анализируемую пробу) и осторожно перемешивают в течение 3—5 с на аппарате для встряхивания, не допуская образования пены. Общий объем реакционных смесей в микропробирках «М1» и «М2» для амПЦР готовят с учетом числа анализируемых проб и двух контрольных проб: положительный контроль (заведомо трансгенная ДНК по 4.37) и отрицательный контроль (заведомо нетрансгенная ДНК по 4.38)».
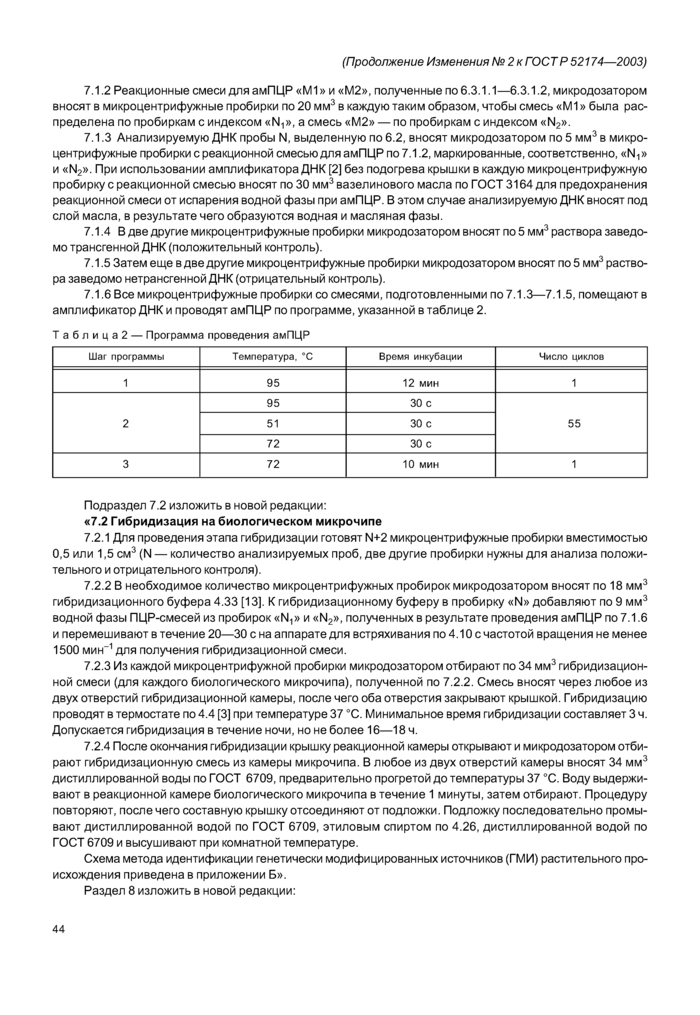
Пункты 7.1.1—7.1.4 изложить в новой редакции: дополнить пунктами — 7.1.5,7.1.6:
«7.1.1 Для каждой анализируемой пробы готовят 2 чистые микроцентрифужные пробирки вместимостью 0,2 или 0,5 см3, маркируя их «N,» и «N2». где N — номер анализируемой пробы.
(Продолжение Изменения №2 к ГОСТР 52174-2003)
7.1.2 Реакционные смеси для амПЦР «М1» и «М2», полученные по 6.3.1.1—6.3.1.2. микродозатором вносят в микроцентрифужные пробирки по 20 мм3 в каждую таким образом, чтобы смесь «М1» была распределена по пробиркам с индексом «N,», а смесь «М2» — по пробиркам с индексом «N2».
7.1.3 Анализируемую ДНК пробы N. выделенную по 6.2. вносят микродозатором по 5 мм3 в микроцентрифужные пробирки с реакционной смесью для амПЦР по 7.1.2, маркированные, соответственно, «N,» и «N2». При использовании амплификатора ДНК [2] без подогрева крышки в каждую микроцентрифужную пробирку с реакционной смесью вносят по 30 мм3 вазелинового масла по ГОСТ 3164 для предохранения реакционной смеси от испарения водной фазы при амПЦР. В этом случае анализируемую ДНК вносят под слой масла, в результате чего образуются водная и масляная фазы.
7.1.4 В две другие микроцентрифужные пробирки микродозатором вносят по 5 мм3 раствора заведомо трансгенной ДНК (положительный контроль).
7.1.5 Затем еще в две другие микроцентрифужные пробирки микродозатором вносят по 5 мм3 раствора заведомо нетрансгенной ДНК (отрицательный контроль).
7.1.6 Все микроцентрифужные пробирки со смесями, подготовленными по 7.1.3—7.1.5, помещают в амплификатор ДНК и проводят амПЦР по программе, указанной в таблице 2.
|
Т а б л и ц а 2 — Программа проведения амПЦР | ||||||||||||||||||||
|
Подраздел 7.2 изложить в новой редакции:
«7.2 Гибридизация на биологическом микрочипе
7.2.1 Для проведения этапа гибридизации готовят N+2 микроцентрифужные пробирки вместимостью 0.5 или 1.5 см3 (N — количество анализируемых проб, две другие пробирки нужны для анализа положительного и отрицательного контроля).
7.2.2 В необходимое количество микроцентрифужных пробирок микродозатором вносят по 18 мм3 гибридизационного буфера 4.33 (13). К гибридизационному буферу в пробирку «N» добавляют по 9 мм3 водной фазы ПЦР-смесей из пробирок «N,» и «N2». полученных в результате проведения амПЦР по 7.1.6 и перемешивают в течение 20—30 с на аппарате для встряхивания по 4.10 с частотой вращения не менее 1500 мин-1 для получения гибридизационной смеси.
7.2.3 Из каждой микроцентрифужной пробирки микродозатором отбирают по 34 мм3 гибридизационной смеси (для каждого биологического микрочипа), полученной по 7.2.2. Смесь вносят через любое из двух отверстий гибридизационной камеры, после чего оба отверстия закрывают крышкой. Гибридизацию проводят в термостате по 4.4 [3] при температуре 37 °С. Минимальное время гибридизации составляет 3 ч. Допускается гибридизация в течение ночи, но не более 16—18 ч.
7.2.4 После окончания гибридизации крышку реакционной камеры открывают и микродозатором отбирают гибридизационную смесь из камеры микрочипа. В любое из двух отверстий камеры вносят 34 мм3 дистиллированной воды по ГОСТ 6709, предварительно прогретой до температуры 37 °С. Воду выдерживают в реакционной камере биологического микрочипа в течение 1 минуты, затем отбирают. Процедуру повторяют, после чего составную крышку отсоединяют от подложки. Подложку последовательно промывают дистиллированной водой по ГОСТ 6709, этиловым спиртом по 4.26, дистиллированной водой по ГОСТ 6709 и высушивают при комнатной температуре.
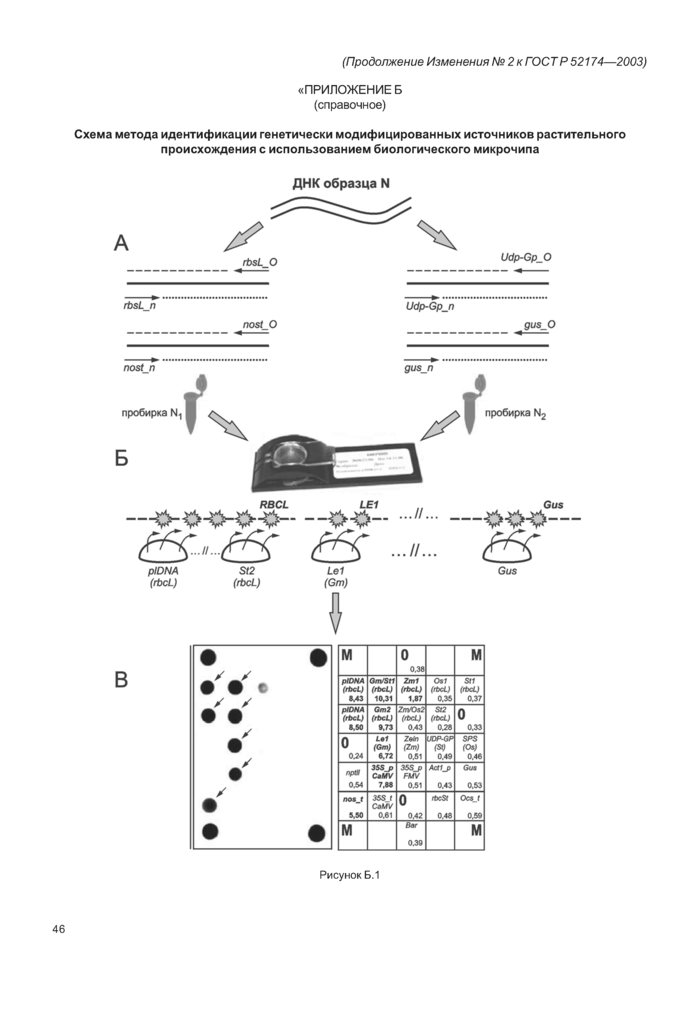
Схема метода идентификации генетически модифицированных источников (ГМИ) растительного происхождения приведена в приложении Б».
Раздел 8 изложить в новой редакции:
(Продолжение Изменения №2 к ГОСТР 52174—2003)
«8 Обработка и интерпретация результатов анализа
8.1 Результаты гибридизации регистрируют с помощью универсального аппаратно-программного комплекса для анализа биочипов (УАПК) [1). Инсталляция и эксплуатация комплекса осуществляется в соответствии с руководством по эксплуатации УАПК.
8.2 Производят запуск программного обеспечения, поставляемого вместе с комплексом (файл imageware.exe). При запуске на мониторе появляется схема биочипа с указанием отдельных ячеек и обозначением находящихся в них зондов. Названия зондов соответствуют указанным в таблице 1 и на рисунке 1.
8.3 Биологический микрочип после проведения гибридизации, промывки, удаления гибридизацион-ной камеры, ополаскивания и высушивания помещают в держатель УАПК «лицевой» стороной (содержащей гелевые ячейки) вверх.
8.4 Нажимают пиктограмму с надписью «Пуск» в верхней части диалогового окна «Снимок». При этом происходит возбуждение флуоресценции ячеек биочипа лазерами с длиной волны 640 нм, захват флуоресцентного изображения, его обработка и выдача отчета о присутствии в исследуемом образце ДНК растительного происхождения, идентификации видоспецифичной ДНК (соя, кукуруза, картофель, рис) и наличии/отсутствии генетических элементов, используемых как детерминанты трансгенности. Применение универсального аппаратно-программного комплекса (УАПК) для анализа биологических микрочипов (1) позволяет автоматизировать все этапы регистрации и интерпретации результатов и получать заключение о наличии/отсутствии ДНК растительного происхождения в исследуемом образце, а также о наличии/отсутствии генетических детерминант трансгенности.
8.5 Анализ биологических микрочипов с прогибридизованными ПЦР-лродуктами. полученными при амплификации ДНК. выделенной из различных образцов, начинают с регистрации и интерпретации гибри-дизационных картин положительного (заведомо трансгенной ДНК) и отрицательного контроля (заведомо нетрансгенной ДНК).
8.6 Результат анализа ДНК сои, содержащей трансгенные элементы, с использованием гибридизации на биочипе, представлен в приложении В.
8.7 В случае, если при использовании заведомо нетрансгенной ДНК регистрируют сигнал в ячейках, содержащих олигонуклеотиды, комплементарные последовательностям фрагментов векторных конструкций и маркерных генов, это свидетельствует о получении ложноположительного результата. При этом результаты анализа остальных исследуемых образцов не учитываются. Причиной может быть загрязнение (контаминация) ГМИ реактивов и/или оборудования. В этом случае необходимо обработать поверхности лабораторных столов и оборудования раствором соляной кислоты по ГОСТ 3118 (0,1 моль/дм3), заменить реактивы на свежеприготовленные и повторить анализ. В случае отсутствия сигналов в ячейках, содержащих зонды, специфичные к различным генетическим детерминантам трансгенности, при использовании заведомо нетрансгенной ДНК, делают заключение об отсутствии контаминации и проводят анализ образцов ДНК согласно протоколу.
8.8 Отсутствие флуоресцентных сигналов в ячейках, содержащих олигонуклеотиды, специфичные к гену RBCL, при использовании нетрансгенной растительной ДНК свидетельствует о получении ложноотрицательного результата. При этом результаты анализа остальных исследуемых образцов не учитываются. Причиной могут быть потеря активности одного из компонентов реакционной смеси для амПЦР или несоблюдение условий проведения амПЦР и/или гибридизации на биологическом микрочипе. В этом случае необходимо заменить реактивы на свежеприготовленные и повторить анализ. Наличие сигнала в ячейках, содержащих олигонуклеотиды, специфичные к ДНК растительного происхождения, при использовании заведомо нетрансгенной ДНК. свидетельствует об эффективно проведенной амПЦР и гибридизации на биочипе. При этом анализ образцов ДНК проводят далее согласно протоколу».
Приложение Б изложить в новой редакции:
45
46
(Продолжение Изменения №2 к ГОСТР 52174—2003)
«ПРИЛОЖЕНИЕ Б (справочное)
Схема метода идентификации генетически модифицированных источников растительного происхождения с использованием биологического микрочипа
ДНК образца N
|
rt>sL_n Udp-Gp_n nost_Q gus_0 |
|
RBCL LEI —o-o- Gus —— <£3' Gus |
ptDNA St2 Lei
(rtocL) (rtocL) (Gm)
В
|
м |
0 0,38 |
M | ||
|
ptONA |
OmSlI |
Zmf |
Oil |
SI» |
|
(rbcL) |
(rbcL) |
(rbcL) |
(rbcL) |
(rfccO |
|
М3 |
10.31 |
1.87 |
0.35 |
0.37 |
|
ptOSA |
Cm2 |
/rvO<;- |
a? | |
|
(rbcL) |
(rbcL) |
(rbcL) |
(rbcL) |
U |
|
8.50 |
9,73 |
0.43 |
038 |
0.33 |
|
n |
L»1 |
■ЮР-СЯ |
SPS | |
|
w |
(Cm) |
(2m) |
1SO |
(CM) |
|
0.24 |
in |
031 |
0.49 |
0.48 |
|
nfiO 034 |
3SS _p |
35S_p |
A3!JJ |
GU4 |
|
CtkTV 7.88 |
FUV 0.51 |
0 4.' |
0.53 | |
|
3SS 1 |
o |
roe» |
Ос» 1 | |
|
5.50 |
CaUV 031 |
032 |
0.48 |
0.59 |
|
M |
for 038 |
M |
Рисунок Б.1
(Продолжение Изменения №2 к ГОСТР 52174—2003)
А — мультиплексная асимметричная амплификация ДНК образца «N» в двух независимых пробирках «N,» и «N2» с уникальным набором праймеров для получения преимущественно одноцепочечных флуоресцентно меченных фрагментов;
Б — гибридизация ПЦР-продуктов, полученных в независимых пробирках «N,» и «N2» со специфическими олигонуклеотидами, иммобилизованными на биологическом микрочипе;
В — регистрация и интерпретация флуоресцентной картины гибридизации на биологическом микрочипе».
Приложение В изложить в новой редакции:
«ПРИЛОЖЕНИЕ В (обязательное)
Результат анализа ДНК сои, содержащей трансгенные элементы, с использованием гибридизации на биологическом микрочипе
(флуоресцентная картина гибридизации, полученная в результате анализа ДНК генетически модифицированной сои и распределение нормированных сигналов ячеек биологического микрочипа)
А
® ® ®
ооооо©@о©®
© о о о о ©©<§)©© ©@® ©© ® © ®
Б
в
|
м |
0 0.38 |
M | ||
|
ptDNA |
GmSlI |
2m t |
Osf |
SI1 |
|
(rbcL) |
<rtxl) |
(rbcL) |
ItKL) |
l*ct) |
|
8.43 |
10.31 |
1.87 |
0.35 |
0.31 |
|
ptDNA |
Gm 2 |
Stt |
n | |
|
I'txL) |
I'txL) |
<*>*) |
(**) | |
|
8.SO |
*.73 |
0.43 |
0.28 |
0.33 |
|
Q |
Ul |
Z*n |
JOP-GP |
SPS |
|
iGm) |
iZm) |
(SO |
(О»; | |
|
0.24 |
*.72 |
0.51 |
0.49 |
0.48 |
|
JSS p |
35Sp |
Ad1J> |
Gut | |
|
0.54 |
C«*fV 7 M |
FUV 0.51 |
0.43 | |
|
3SS t |
n |
rt<Sr |
Ota r | |
|
5.SO |
CaktV 0.61 |
0.42 |
0.48 |
0.59 |
|
M |
bar 0.» |
M |
Рисунок В.1
А—схема биологического микрочипа для идентификации генетически модифицированного источника растительного происхождения;
Б — гибридизационная картина на биологическом микрочипе флуоресцентных продуктов амПЦР анализируемой ДНК сои, содержащей 355-промотор, терминатор nos. Стрелками обозначены ячейки, в которых образовались совершенные гибридизационные дуплексы.
В — распределение нормированных сигналов ячеек биологического микрочипа. Жирным шрифтом выделены ячейки, в которых образовались совершенные гибридизационные дуплексы».
Приложение Г изложить в новой редакции:
47
(Продолжение Изменения №2 к ГОСТ Р 52174—2003)
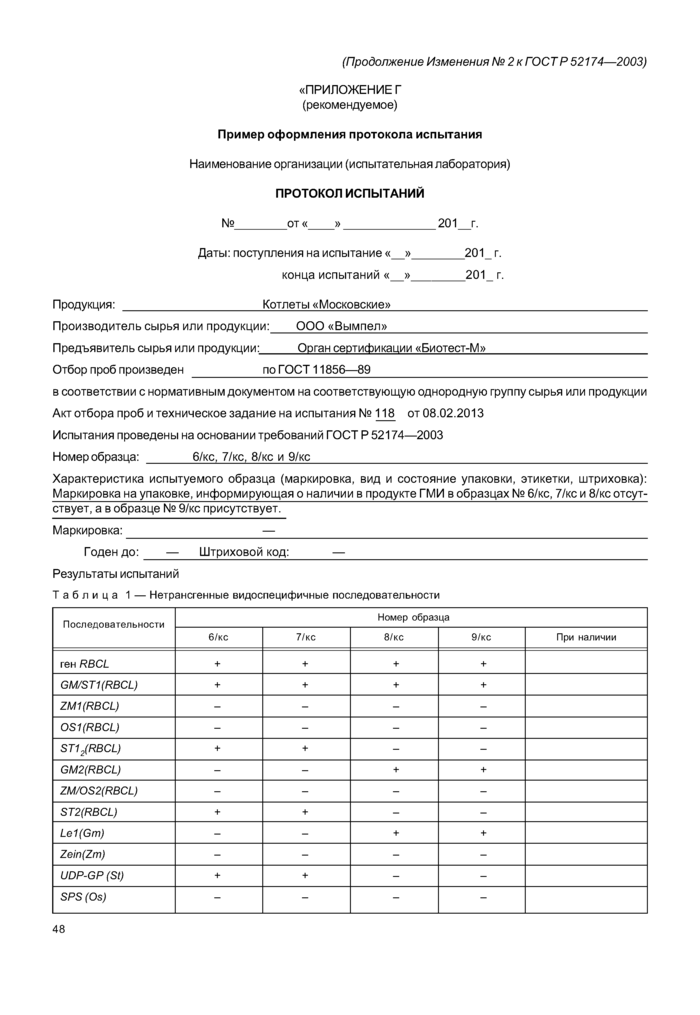
«ПРИЛОЖЕНИЕ Г (рекомендуемое)
Пример оформления протокола испытания
Наименование организации (испытательная лаборатория)
ПРОТОКОЛ ИСПЫТАНИЙ
№_от «_» 201 Г.
Даты: поступления на испытание « »_201_ г.
конца испытаний « »_201_ г.
Продукция: _Котлеты «Московские»_
Производитель сырья или продукции: ООО «Вымпел»_
Предъявитель сырья или продукции:_Орган сертификации «Биотест-М»_
Отбор проб произведен _по ГОСТ 11856-89_
в соответствии с нормативным документом на соответствующую однородную группу сырья или продукции Акт отбора проб и техническое задание на испытания № 118 от 08.02.2013 Испытания проведены на основании требований ГОСТ Р 52174-2003
Номер образца: _6/кс. 7/кс. 8/кс и 9/кс__
Характеристика испытуемого образца (маркировка, вид и состояние упаковки, этикетки, штриховка): Маркировка на упаковке, информирующая о наличии в продукте ГМИ в образцах № 6/кс. 7/кс и 8/кс отсут-ствует. а в образце № 9/кс присутствует.
Маркировка:_—_
|
Годен до: — Штриховой код:_—_ Результаты испытаний Таблица 1 — Нетрансгенные видоспецифичные последовательности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1
Срок хранения Taq-полимеразы после разведения при температуре от 2 1С до 8 °С — не более 2 ч.
43