Дополнение 1 для Методические указания по санитарно-гигиенической оценке резиновых и латексных изделий медицинского назначения
Методические указания по санитарно-гигиенической оценке резиновых и латексных изделий медицинского назначения
Купить дополнение 1 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 05.05.2017 |
| Актуализация | 01.01.2021 |
| Дополняет: | Методические указания по санитарно-гигиенической оценке резиновых и латексных изделий медицинского назначения |
Организации:
| 14.05.2001 | Утвержден | Заместитель Главного Государственного санитарного врача Российской Федерации |
|---|
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9
стр. 10
стр. 11
стр. 12
стр. 13
стр. 14
стр. 15
стр. 16
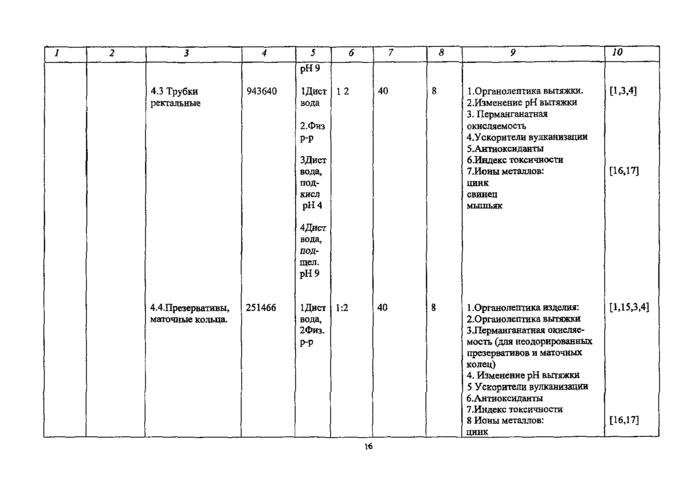
стр. 17
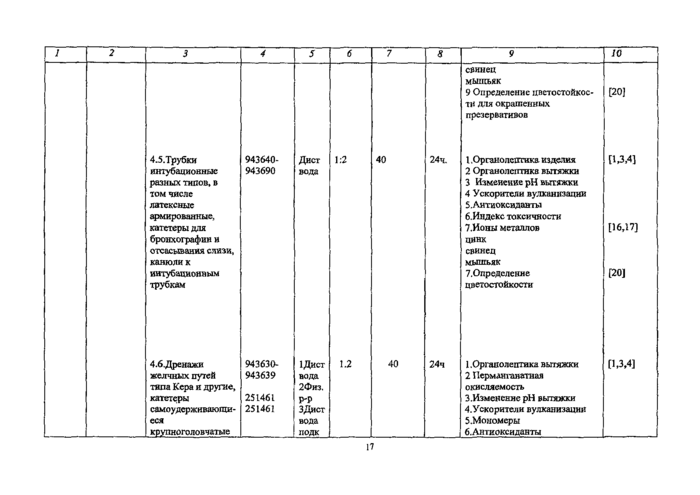
стр. 18
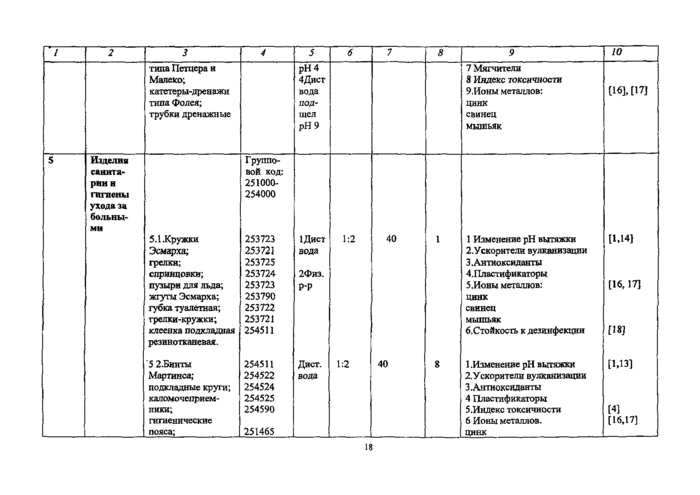
стр. 19
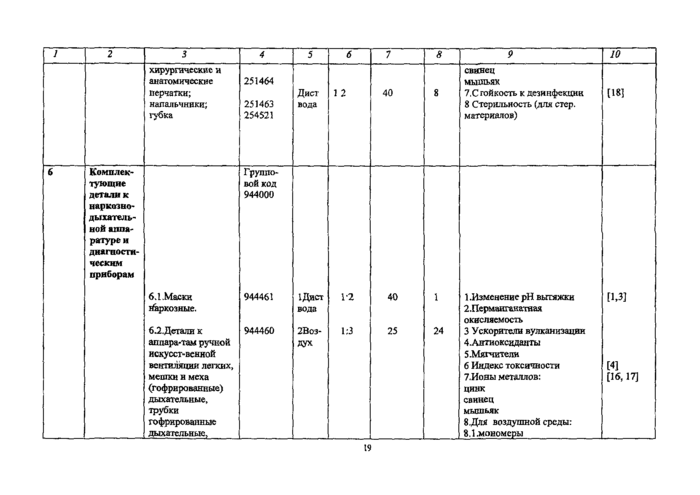
стр. 20
стр. 21
стр. 22
стр. 23
стр. 24
стр. 25

стр. 26

стр. 27
ФЕДЕРАЛЬНЫЙ ЦЕНТР ГОСУДАРСТВЕННОГО САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОГО НАДЗОРА МИНЗДРАВА РОССИИ
Дополнение № 1 к «Методическим указаниям по санитарно-гигиенической оценке резиновых и латексных изделий медицинского назначения»
Методические рекомендации
Минздрав России Москва * 2001
Дополнение № 1 к «Методическим указаниям по санитарно-гигиенической оценке резиновых н латексных изделий медицинского назначения»
Методические рекомендации
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
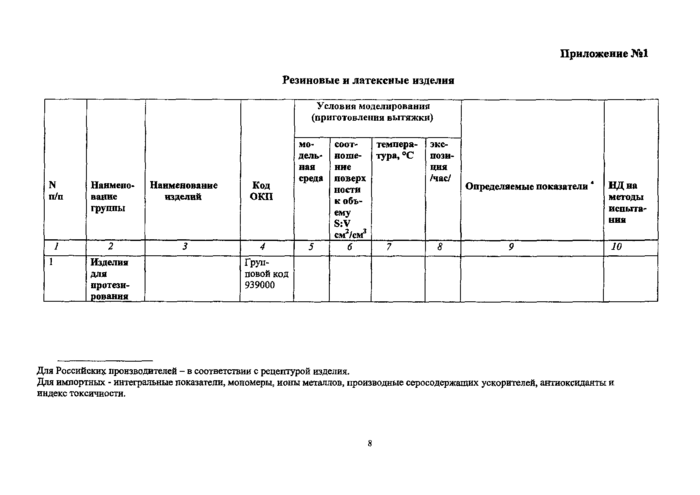
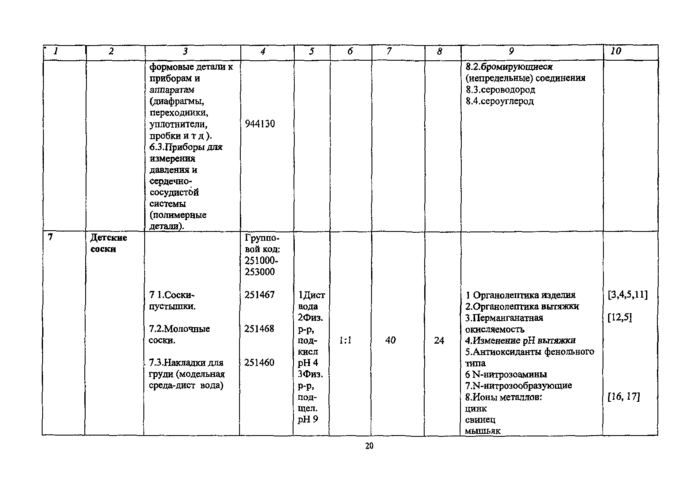
кровезаменителями и другими парантеральными препаратами 2.2.Трубки медицинские для переливания крови |
943640 |
Диет вода |
1:2 |
120°С, Настан-вание 25 °С 40 |
5 сут 24 |
3. Перманганатная окисляемо сть 4. Изменение pH вытяжки 5 Ускорители вулканизации (тиурам Д, цимат) 6 .Антиоксиданты 7. Мягчители 8. Содержание сульфатов 9-Содержание хлоридов Ю.Содержанне золы в пробках П Стойкость к кипячению пробок 12 Ионы металлов: ЦИНК свинец кальций мышьяк 1 .Органолептика вытяжки. 2. Изменение мутности вытяжки 3 .Перманганатная окисляемость 4 Изменение pH вытяжки 5 Ускорители вулканизации (тиурам Д, цимат) 6. Антиоксиданты 7. Мягчит ели 8 Ионы металлов. ЦИНК |
[16.17] П,8] [16.17] |
|
1 |
.2 - _ |
3 |
4 |
5 |
б |
7 |
“5 |
9 |
10 |
|
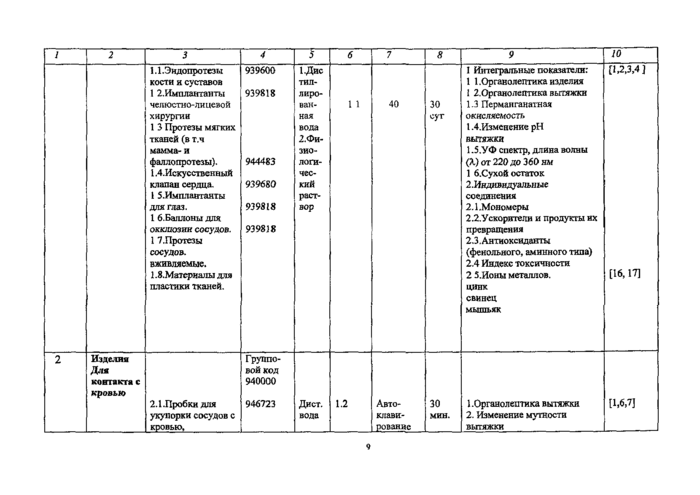
свинец кальций мышьяк | |||||||||
|
2.3 .Трубки латексные для системы переливания крови (одноразового использования). |
943640 |
Диет. вода |
1:2 |
40 |
8 |
1.Органолептика вытяжки. 2. Изменение pH вытяжки 3. Перманганатная окисляемосгь 4. Ускорители вулканизации (турам Е, этил цимат) 5. Антиоксиданты фенольного или аминного типа 6 .Индекс токсичности 7 Ионы металлов: цинк свинец мышьяк |
[Ц И] [16,17] | ||
|
2.4 Делали к аппаратам АИК и АИЛ. |
944480 |
Диет вода |
1:2 |
40 |
24 |
1. Мономеры 2 Ускорители вулканизации 3 .Антиоксиданты 4. Индекс токсичности 5, Ионы металлов: цинк свинец мышьяк |
[1,9,10] [4] [16,17] | ||
|
2 5 .Лейкопластыри |
939330 |
1,6.1 |
40 |
7 сут |
1.Ионы металлов: |
fl6,17] |
| ||||||||||||||||||||||||||||||
|
i г |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
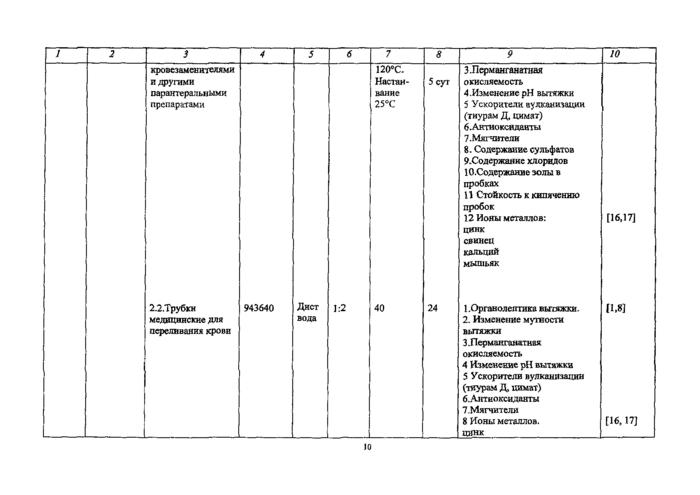
к пенициллину 13.Ионы металлов: цинк свинец мышьяк |
[16,17] | ||||||||
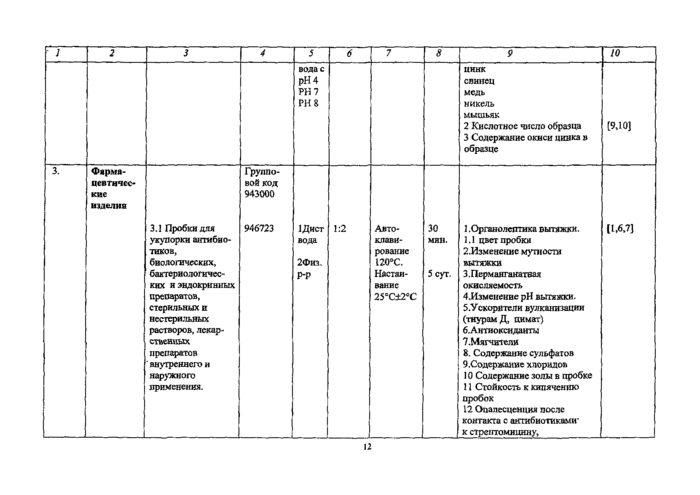
|
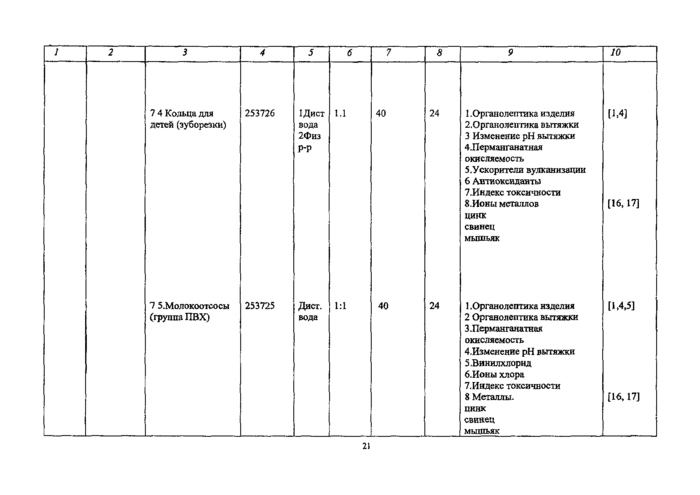
3.2.Детали к инъекторам (шприцы). |
943280 |
1Дист вода 2фш. ГР|
1-2 |
40 |
1 |
1 .Восстановительные примеси, мл 0,01 М р-ра тиосульфата натрия 2. Изменение pH вытяжки. 3. Ультрафиолетовое поглощение в диапазоне 220-ЗбОвм 4. Ионы металлов-цинк свинец МЫШЬЯК 5. Стерильность 6. Индекс токсичности |
[3,19] [16Д7] [18] [4] | ||
|
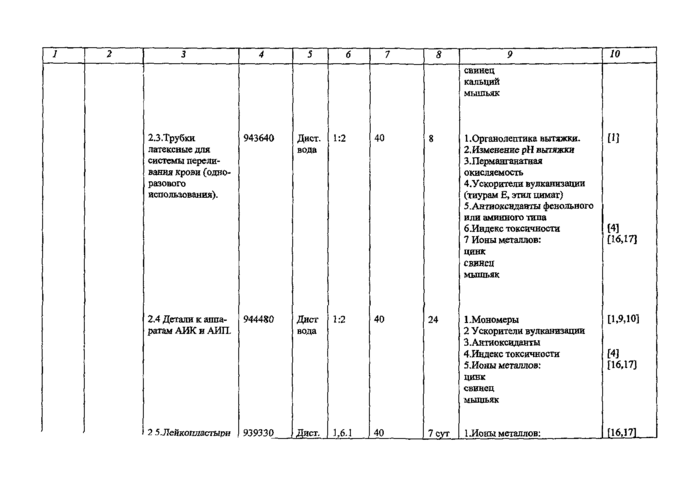
3.3.Трубки медициносие- бакте- риологические |
943640 |
1Дист вода 2Физ. Р-Р |
1-2 |
40 |
8 |
1 Органолептика вытяжки 2.Перманганатная окисляемость 3 .Изменение pH вытяжки 4 Ускорители вулканизации 5 .Анти оксиданты 6 Индекс токсичности 7.Йоны металлов: |
[1,3,4] [4] _QM7L_ |
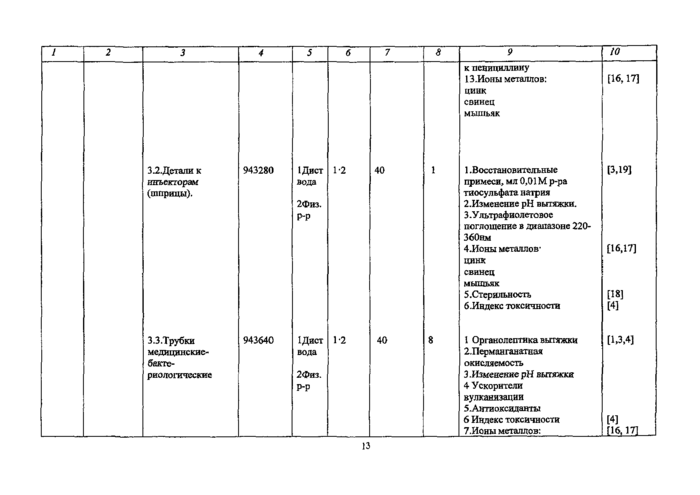
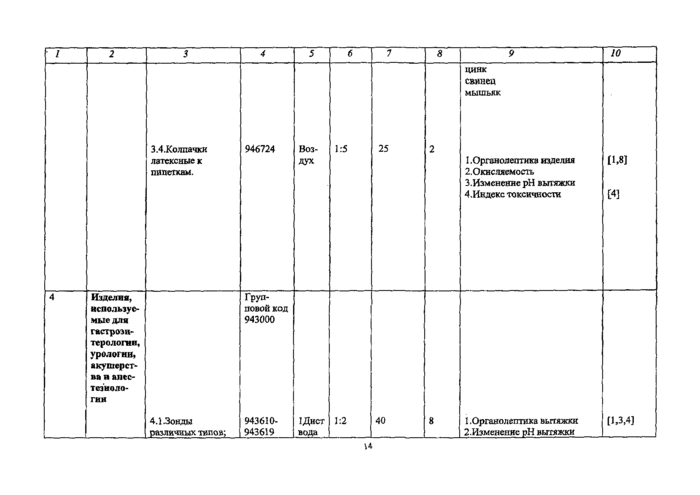
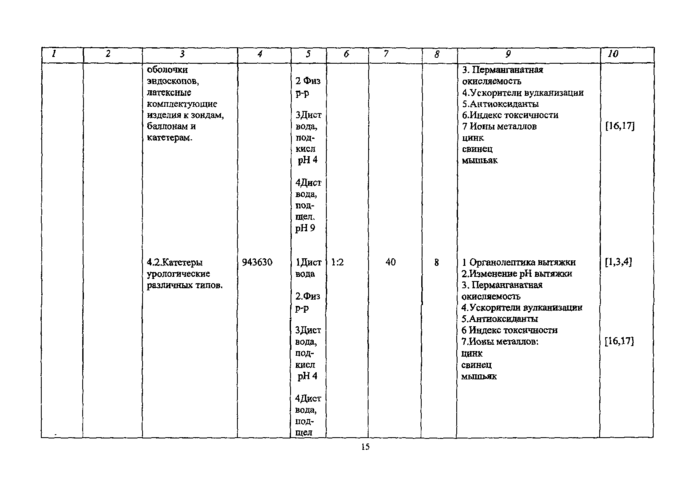
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
\4 |
Методические рекомендации разработаны: Федеральным центром
госсанэпиднадзора Минздрава России (Чибураев В.И,* Двосхин Я.Г., Сомов Л.И., Выборнова М.С., Брагина Й.В., Беликова И.Г,, Йгнатущенко Л.И-Х Государственным унитарным предприятием научно-исследовательского института резиновых н латексных изделий Лопатин В.В., Кузнецова Е.А.).
«УТВЕРЖДАЮ»
Заместитель главного государственного санитарного врача Российской Федерации Д.м.н.,проф. Е.Н.Беляев « 14 » мая 2001г.
МР №29Ф11/1683
Дополнение №1 к «Методическим указаниям по санитарно-гигиенической оценке резиновых и латексных изделий медицинского назначения».
Методические рекомендации
Введение.
В 1986 году Министерством здравоохранения СССР были утверждены Методические указания по санитарно-гигиенической оценке резиновых и латексных изделий медицинского назначения.
За период с 1986 по 2000 года претерпели изменения методические подходы по изучению резино-латексных материалов и изделий из них с целью определения их безопасности, появились новые требования по санитарно-эпидемиологической экспертизе изделий медицинского назначения. Разработаны новые и усовершенствованы существующие методы химического анализа веществ, мигрирующих из резин в контактирующие среды. Значительно расширился ассортимент изделий (в частности немедицинского назначения), подлежащий санитарно-эпидемиологической экспертизе. В этой связи появилась необходимость внесения дополнений в существующие методические указания.
Основанием для проведения санитарно-эпидемиологической экспертизы изделий из резино-латексных материалов медицинского и
з
немедицинского назначения являются Закон РФ № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения». Порядок проведения санитарно-эпидемиологической экспертизы изделий медицинского назначения регламентирован приказом Минздрава Российской Федерации от 02.07.99г. № 274 «О порядке регистрации изделий медицинского назначения и медицинской техники отечественного производства в Российской Федерации» и Инструкцией о порядке гигиенической оценки медицинских изделий для целей их регистрации в Российской Федерации утвержденной 14.01.2000г.; изделий не медицинского назначения; - приказом М3 РФ от 20.07.98г. №217 «О гигиенической оценке производства, поставки и реализации продукции и товаров».
ПОРЯДОК ПРОВЕДЕНИЯ САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОЙ
ЭКСПЕРТИЗЫ
Основанием для проведения санитарно-эпидемиологической экспертизы медицинских изделий является выписка из решения специализированной экспертной комиссии Комитета по новой медицинской технике Минздрава России, содержащая указание о необходимости проведения гигиенической оценки, выданная организации-разработчику медицинского изделия отечественного производства или фирме, заявившей в установленном порядке о своем намерении зарегистрировать в Российской Федерации медицинское изделие зарубежного производства.
Перечень территорий и учреждений для проведения гигиенической оценки медицинских изделий определен в Приложении 2 «Инструкции о порядке гигиенической оценки медицинских изделий для целей их регистрации в Российской Федерации».
Заявитель представляет в учреждение, проводящее гигиеническую оценку следующие документы.
Для продукции отечественного производства:
заявку на проведение испытаний и оформление санитарно-эпидемиологического заключения;
- выписку из решения специализированной экспертной комиссии Комитета по новой медицинской технике Минздрава России, содержащую указание о необходимости проведения гигиенической оценки медицинского изделия - 1экз.;
- нормативный документ на медицинские изделия отечественного производства (ГОСТ, ОСТ, проект ТУ) -1 экз.;
4
- проекты эксплуатационных документов (инструкция по эксплуатации, технический паспорт) - 1эхз.;
- фотография медицинского изделия размером 13x18 или 18x24 - 1экз.;
- образцы изделий с актами отбора.
Для продукции зарубежного производства:
- заявку на проведение испытаний и оформление санитарно-эпидемиологического заключения;
- выписку из решения специализированной экспертной комиссии Комитета по новой медицинской технике Минздрава России, содержащую указание о необходимости проведения гигиенической оценки медицинского изделия - 1экз.;
- назначение и область применения изделия, условия эксплуатации;
- сведения об упаковочном материале (для стерильных изделий);
- сертификаты на медицинское изделие, выданные в стране-изготовителе - 1 экз.;
- фотография медицинского изделия размером 13x18 или 18x24 -1 экз.;
- рекламные иллюстративные материалы в 1 экз.;
- инструкция фирма-производителя по эксплуатации медицинского изделия (на русском языке) - 1 экз.;
- образцы изделий с актами отбора.
- акты (отчеты, протоколы) санитарно-химических, токсикологогигиенических исследований, проводившихся в стране фирмы-производителя при регистрации (сертификации) медицинского изделия (при наличии) - по 1 экз. каждый.
По желанию заявителя на изделие медицинского назначения, уже имеющего Регистрационное удостоверение Минздрава России, может быть выдано санитарно-эпидемиологическое заключение (после проведения специальных испытаний). В этом случае представляется пакет документов в соответствии с вышеуказанным перечнем за исключением направления экспертной комиссии Комитета по новой медицинской технике Минздрава России, а также фотография изделия.
Санитарно-эпидемиологическая экспертиза изделий немедицинского назначения проводится в соответствии с «Порядком проведения гигиенической оценки продукции и товаров» (приказ №217 Минздрава России от 20.07.98г.).
1. Гигиенические требования к резиновым и латексным изделиям.
1.1. В состав резин, предназначенных для приготовления изделий медицинского назначения, могут вводиться ингредиенты, предусмотренные перечнем (приложение 1) Методических указаний по
5
санитарно-гигиенической оценке резиновых и латексных изделий медицинского назначения, утвержденных М3 СССР 19.12.86г. и специальными согласованиями Минздрава России.
1.2. Рецептура резин, из которых произведено изделие, должна быть согласована с Министерством здравоохранения Российской Федерации;
1.3. При использовании импортных материалов необходимо представить документ о разрешении его использования в стране-изготовителе. Материалы должны быть подвергнуты в Российской Федерации санитарно-гигиенической оценке в соответствии с требованиями, предъявляемыми к продукту отечественного производства.
Санитарно-эпидемиологическая экспертиза резино-латексных изделий медицинского и немедицинского назначений заключается в проведении санитарно-химических, микробиологических и токсиколого-гигиенических исследованиях.
1.4. Санитарно-гигиеническая оценка резиновых и латексных изделий должна осуществляться с учетом их назначения и конкретных условий эксплуатации.
1.5. Отбор образцов осуществляется в соответствии с ГОСТ Р 51148-98 «Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания на стерильность и пирогеняость».
1.6. Образцы резиновых и латексных изделий должны быть с однородной, гладкой, сухой, нелипкой: внутренней и наружной поверхностями.
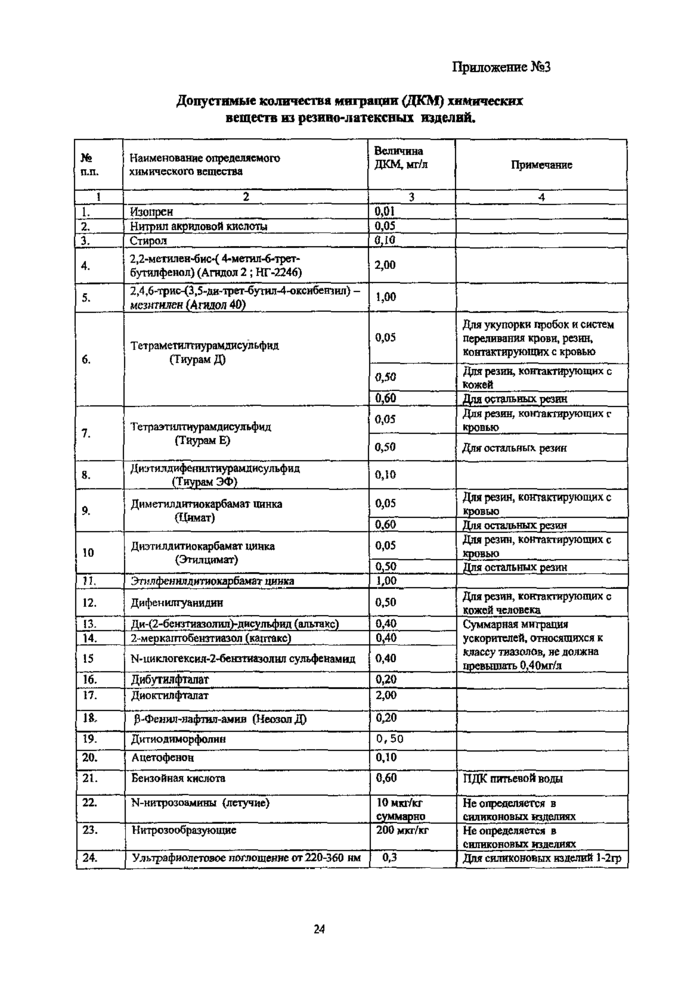
1.7. Резиновые изделия не должны выделять в контактирующие среды химические вещества в количествах, превышающих допустимые (приложение № 3), изменять свойства лекарственных препаратов, оказывать токсическое действие на организм человека.
1.8. Импортные образцы изделий подлежат испытаниям в условиях, аналогичных условиям при испытании отечественных образцов.
1.9. Акт отбора проб образца оформляется согласно ИР 50-03.002-95 «Типового порядка обращения с образцами, используемыми при проведении обязательной сертификации продукции».
1.10. Количество образцов, необходимое для испытаний (исследований), определяется экспертом, осуществляющим санитарно-эпидемиологическую экспертизу. По окончании испытаний оформляется протокол установленного образца.
1.11. По результатам санитарно-эпидемиологической экспертизы представленного пакета документов с протоколами испытаний (исследований) оформляется санитарно-эпидемиологическое заключение.
6
2.Перечень санитарно-гигиенических показателей для оценки
продукции.
2.1. Перечень определяемых показателей, условия моделирования, нормативная документация на методы исследования указаны в приложении Ла 1.
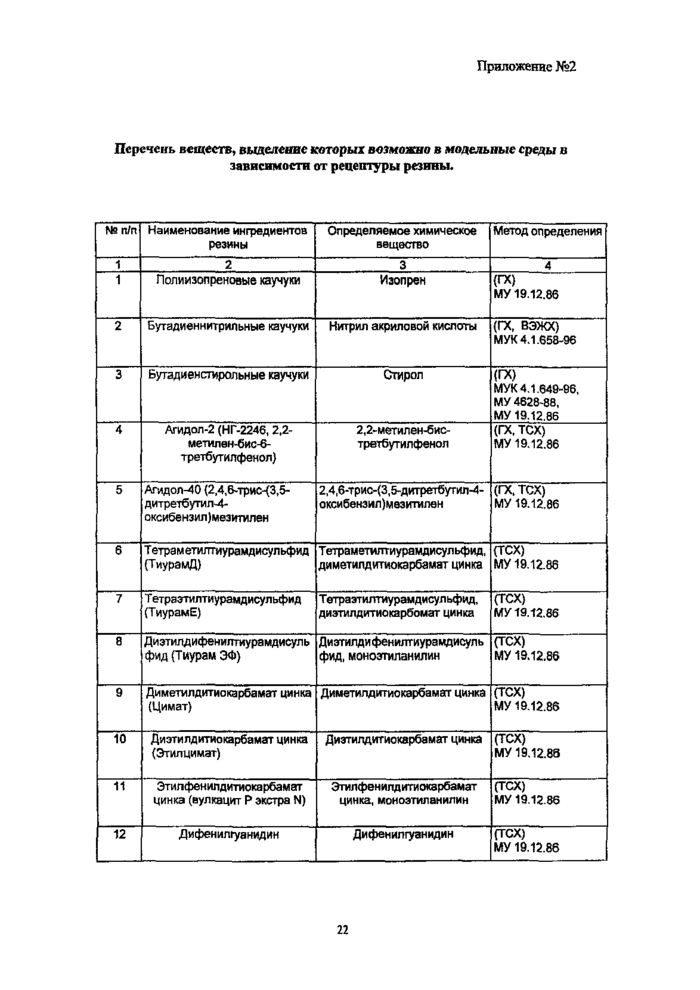
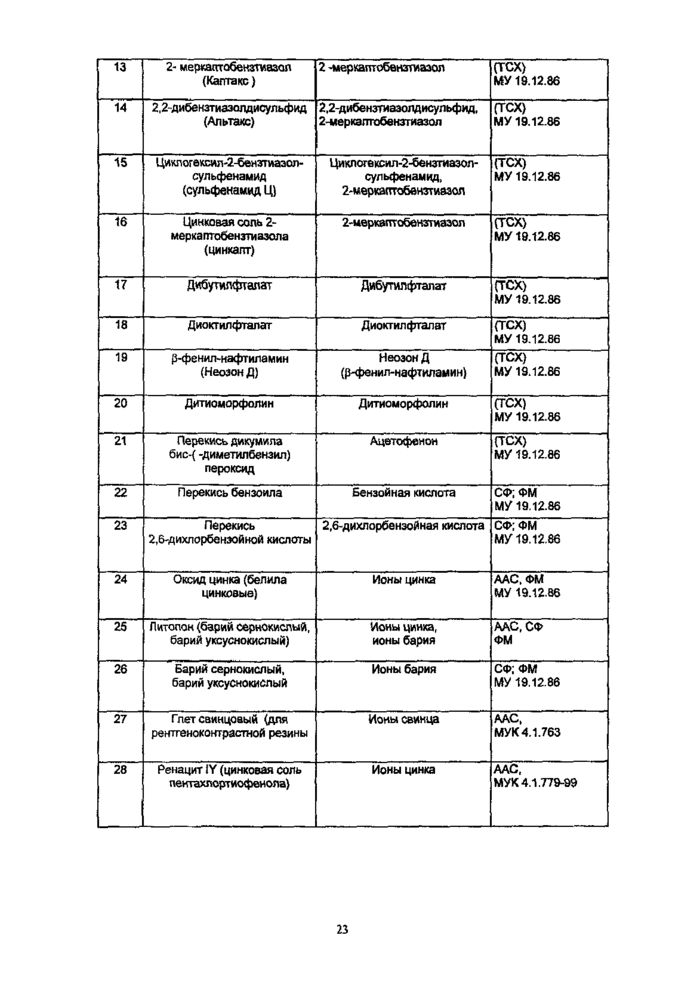
2.2. Перечень веществ, выделение которых возможно в модельные среды в зависимости от рецептуры резины, указаны в приложении № 2.
2.3. В случае несоответствия изделий санитарно-химическим показателям, токсиколого-гигиенические исследования не проводятся.
2.4. Токсикологические исследования проводятся в соответствии с Методическими указаниями Минздрава СССР от 19.12.86г. при разработке и постановке на производство новой продукции, а также для регистрации Минздравом России вновь ввозимой продукции.
Для проведения периодического контроля и получения санитарно-эпидемиологического заключения могут быть использованы экспрессные методы определения индекса токсичности в соответствии с Методическими указаниями Минздрава России № 1.1.037-95 «Биотестирование продукции из полимерных и других материалов» или Методическими рекомендациями М3 России № 11-1/131-09 «Определение токсичности химических соединений, полимеров, материалов и изделий с помощью люминесцентного бактериального теста».
7
Приложение №1Резиновые и латексные изделия
|
Условия моделирования (приготовления вытяжки) | |||||||||
|
N п/п |
Наимено вание группы |
Наименование изделий |
Код ОКП |
мо дель ная среда |
соотношение поверх пости к объему S:V см2/см3 |
температура, °С |
экс пози ция /час/ |
Определяемые показатели * |
НД на методы испытанна |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
1 |
Изделия для протези рования |
Групповой код 939000 | |||||||
Для Российских производителей - в соответствии с рецептурой изделия.
Для импортных - интегральные показатели, мономеры, ионы металлов, производные серосодержащих ускорителей, антиоксиданты и индекс токсичности.
8
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
$ |