МУК 4.2.2046-06
Методы выявления и определения парагемолитических вибрионов в рыбе, нерыбных объектах промысла, продуктах, вырабатываемых из них, воде поверхностных водоемов и других объектах
Купить МУК 4.2.2046-06 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания устанавливают порядок выявления и определения парагемолитических вибрионов - возбудителей пищевых токсикоинфекций и острых кишечных заболеваний в рыбе, нерыбных объектах промысла, продуктах, вырабатываемых из них, воде поверхностных водоемов и других объектах при осуществлении государственного санитарно-эпидемиологического надзора (контроля), а также при санитарно-эпидемиологическом расследовании вспышек пищевых отравлений и инфекций с пищевым путем передачи.
Оглавление
1 Область применения
2 Парагемолитические вибрионы - возбудители пищевых токсикоинфекций
3 Отбор проб для микробиологического анализа
4 Подготовка проб к исследованию
5 Схема бактериологического анализа
6 Методы изучения свойств парагемолитических вибрионов
7 Аппаратура, материалы, лабораторная посуда, питательные среды и тест-штаммы
8 Библиографические данные
| Дата введения | 01.04.2006 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
- ГОСТ 17206-96 Агар микробиологический. Технические условия
- ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
- ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
- ГОСТ 7631-85 Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний
- ГОСТ Р 51446-99 Микробиология. Продукты пищевые. Общие правила микробиологических исследований
- СанПиН 2.3.2.1078-01 Гигиенические требования безопасности и пищевой ценности пищевых продуктов
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23
стр. 24
стр. 25

стр. 26

стр. 27

стр. 28
Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы
выявления и определения
парагемолитических вибрионов в рыбе,
нерыбных объектах промысла, продуктах,
вырабатываемых из них, воде поверхностных
водоемов и других объектах
Методические указания
МУК 4.2.2046-06
1. Разработаны: Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Ю. М. Федоров); ФГУЗ Ростовский-на-Дону Ордена Трудового Красного Знамени Научно-исследовательский противочумный институт (Ю. М. Ломов, Б. Н. Мишанькин, Л. М. Смоликова, Л. Г. Воронежская, Л. С. Подосинникова, А. Е. Либин-зон, Е. М. Санамянц, Е. Н. Голенищева, Н. В. Божко, Н. Г. Пузанова, А. Б. Мазрухо, Д. И. Каминский); ФГУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора (И. В. Братина, Э. Ф. Опочинский, Н. С. Кривопалова); ФГУЗ Причерноморская противочумная станция (Г. В. Гальцева); ГУ Научно-исследовательский институт питания РАМН (С. А. Шевелева).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека 6 октября 2005 г. (протокол № 3).
3. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г. Г. Онищенко 30 января 2006 г.
4. Введены взамен «Методических указаний по контролю за содержанием в рыбных продуктах парагемолитических вибрионов - возбудителей пищевых токсикоинфекций» № 5780-91 от 03.04.91.
Содержание
|
1. Область применения 2. Парагемолитические вибрионы - возбудители пищевых токсикоинфекций 3. Отбор проб для микробиологического анализа 4. Подготовка проб к исследованию 5. Схема бактериологического анализа 5.1. Исследование пищевых продуктов 5.2. Исследование воды поверхностных водоемов и обитающих в ней гидробионтов 5.3. Оценка результатов исследования объектов окружающей среды 6. Методы изучения свойств парагемолитических вибрионов 6.1. Определение подвижности 6.2. Определение цитохромоксидазы 6.3. Определение галофильности и солевой толерантности 6.4. Выявление способности к роению 6.5. Биохимические тесты 6.6. Определение β-галактозидазы 6.7. Постановка реакции Фогес-Проскауэра 6.8. Определение нитратредуктазы 6.9. Серологическое типирование парагемолитических вибрионов 6.10. Определение патогенных свойств парагемолитических вибрионов 7. Аппаратура, материалы, лабораторная посуда, питательные среды и тест-штаммы 7.1. Аппаратура, материалы, лабораторная посуда 7.2. Питательные среды и тест-системы для выделения и идентификации парагемолитических вибрионов 7.3. Контроль питательных сред для выделения парагемолитических вибрионов 7.4. Тест-штаммы 8. Библиографические данные |
|
|
УТВЕРЖДАЮ |
|
|
Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации |
|
|
Г. Г. Онищенко |
|
|
30 января 2006 г. |
|
|
Дата введения: 1 апреля 2006 г. |
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы
выявления и определения
парагемолитических вибрионов в рыбе,
нерыбных объектах промысла, продуктах,
вырабатываемых из них, воде поверхностных
водоемов и других объектах
Методические указания
МУК 4.2.2046-06
1. Область применения
1.1. Методические указания устанавливают порядок выявления и определения парагемолитических вибрионов - возбудителей пищевых токсикоинфекций и острых кишечных заболеваний в рыбе, нерыбных объектах промысла, продуктах, вырабатываемых из них, воде поверхностных водоемов и других объектах при осуществлении государственного санитарно-эпидемиологического надзора (контроля), а также при санитарно-эпидемиологическом расследовании вспышек пищевых отравлений и инфекций с пищевым путем передачи.
1.2. Настоящие методические указания предназначены для органов и организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также могут использоваться другими организациями, аккредитованными в установленном порядке.
2. Парагемолитические вибрионы - возбудители пищевых токсикоинфекций
Парагемолитические вибрионы - условно патогенные галофильные микроорганизмы семейства Vibrionaceae, обитающие в соленых водоемах. Выделяют их из морской воды, рыб, креветок, мидий, устриц, омаров, крабов. Впервые V. parahaemolyticus стал известен как причина крупной вспышки токсикоинфекций в Японии в 1950 г., связанной с употреблением в пищу слабосоленой рыбы. Крупные вспышки отмечены в 1984 - 1986 гг. на побережье Черного и Азовского морей в городах Бердянске, Мариуполе, Николаеве, Керчи. Спорадические заболевания имели место на побережье Балтийского и Японского морей, солёных озёр Узбекистана и Туркмении. Во Владивостоке в 1997, 2001 гг. зарегистрированы вспышки острой кишечной инфекции, обусловленные вибрионами этого вида. Фактором передачи инфекции явились варено-мороженые креветки и другие морепродукты. В 2001 г. в Запорожской области Украины отмечены групповые острые кишечные заболевания, связанные с употреблением кильки сухого посола, контаминированной парагемолитическими вибрионами.
Опасность заражения парагемолитическими вибрионами существует везде, где население использует в питании продукты моря. Заболевания возникают, в основном, в теплое время года, зачастую в момент массового отлова рыбы, моллюсков, ракообразных. В местах, удаленных от побережья, отмечены заболевания, связанные с завозом инфицированных продуктов моря. Риск возникновения заболеваний увеличивается с ростом импортируемой продукции из регионов, потенциально опасных по возможности возникновения вспышек пищевых токсикоинфекций, обусловленных парагемолитическими вибрионами. Зарегистрированы случаи выделения парагемолитических вибрионов от больных острыми кишечными инфекциями, из гидробионтов, водоемов и в пресноводном регионе (дельте Волги). Отмечены случаи вторичного инфицирования овощных продуктов при обработке их водой, содержащей парагемолитические вибрионы. Острые кишечные заболевания, вызываемые V. parahaemolyticus, относят к пищевым токсикоинфекциям (ПТИ), возникающим при употреблении в пищу продуктов, в которых произошло массовое размножение микроорганизмов-возбудителей и накопление их токсинов. У парагемолитических вибрионов известны термостабильный прямой гемолизин (ТПГ), детерминируемый tdh-геном, термолабильный гемолизин и неидентифицированный энтеротоксин. Инфективная доза возбудителя составляет 105 - 106 вибрионов в 1 грамме продукта. Особую опасность представляют сырые гидробионты, в которых концентрация V. parahaemolyticus может достигать 109 в грамме, а также продукты, подвергнутые недостаточной кулинарной обработке. Хотя парагемолитические вибрионы чувствительны к высокой температуре, находясь внутри больших кусков рыбы или крупных крабов, они могут выдерживать термическую обработку. Время генерации этого микроорганизма составляет 12 мин при температуре 30 - 37 °С, поэтому при неправильном хранении вибрионы довольно быстро размножаются с накоплением экзотоксинов в продуктах. Употребление их в пищу приводит к развитию токсикоинфекции. В малосоленой и недовяленной рыбе при определенной температуре вибрионы не только сохраняются, но и размножаются.
Требования к качеству рыбы, нерыбных объектов промысла и продуктов, вырабатываемых из них, определены СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
Одним из микробиологических показателей оценки безопасности этих продуктов является V. parahaemolyticus. Определение его осуществляется по массе продукта, в которой не допускается присутствие парагемолитических вибрионов, или по количеству колониеобразующих единиц (КОЕ) в 1 г продукта.
Исследование рыбы и морских беспозвоночных на присутствие парагемолитических вибрионов проводят в порядке текущего надзора (контроля) на этапах производства и реализации, по эпидемическим показаниям, а также в случае возникновения неблагоприятной экологической ситуации в регионе лова рыбы, моллюсков и ракообразных.
При выявлении в прибрежных морских зонах спорадических или групповых случаев заболевания, обусловленных парагемолитическими вибрионами, а также при возникновении неблагоприятной экологической ситуации проводят исследование воды открытых водоёмов и обитающих в них гидробионтов, а также свежевыловленных гидробионтов в местах их организованной и неорганизованной реализации.
3. Отбор проб для микробиологического анализа
Микробиологическому анализу подлежат: сырье, используемое для производства различных видов рыбной продукции, употребляемые в пищу в сыром виде продукты моря, различные виды готовой продукции, соленая, вяленая, копченая рыба, консервы, икра и т. д. в соответствии с перечнем групп продуктов в санитарно-эпидемиологических правилах и нормативах СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов», разделе 1.3. Отбор проб и подготовку к исследованию осуществляют согласно ГОСТ 26668-85 «Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов», ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов», ГОСТ 7631-85 «Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний», а также «Инструкции по санитарно-микробиологическому контролю производства пищевой продукции из рыбы и морских беспозвоночных» № 5319-91 от 22.02.91, утв. МЗ СССР и справочника «Санитарная микробиология» (1998 г.) Пробы для бактериологического исследования собирают до изъятия образцов для органолептического и химического анализа.
Пробы продуктов отбирают асептическим способом, исключающим микробное загрязнение из окружающей среды, и переносят в стерильную посуду или на стерильную бумагу, фольгу с помощью стерильных инструментов (ножа, пинцета, ложки, пробоотборника). Масса (объем) пробы, устанавливаемая в соответствии с нормативно-техническими документами на конкретный вид продукции, должна быть достаточной для выполнения микробиологического анализа и соответствовать требованиям санитарно-эпидемиологических правил и нормативов СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов», определяющим допустимые концентрации этих микроорганизмов в 1 г исследуемого продукта или отсутствие их в навеске 25 г. Общая масса пробы должна быть около 200 г, а икры - 25 г.
Из каждой партии крупной рыбы: свежей, охлажденной, мороженой, соленой, пряной, маринованной, сушеной, вяленой, копченой и крупных экземпляров морских беспозвоночных отбирают не более 3-х штук. От каждого экземпляра из нескольких мест вырезают кусочки с кожей и мышцами, мелкую рыбу (3 - 10 штук) берут целиком из разных мест исследуемой партии. Гидробионтов (мелких рыб, мидий, устриц, креветок, крабов) отлавливают и доставляют в лаборатории в ведрах, банках или других сосудах с водой, в которой они находились до отлова. Морскую воду для качественного исследования отбирают в объеме 1,0 л, а для количественного - в объеме 200 мл в стерильную посуду с непромокаемой пробкой. В лабораторию пробы доставляют в опечатанном виде с сопроводительными документами. Материал исследуют немедленно после доставки.
Порядок отбора, доставки и исследования материала от больного, проб воды и других объектов описан в методических указаниях МУК 4.2.1097-02 «Лабораторная диагностика холеры» и МУК 4.2.1793-03 «Лабораторная диагностика заболеваний, вызываемых парагемолитическими и другими патогенными для человека вибрионами».
4. Подготовка проб к исследованию
Из поступивших в лабораторию проб продуктов берут навеску 25 г, измельчают и гомогенизируют в размельчителе тканей (например, блендере, гомогенизаторе типа Stomacher со стерильными пакетами или других с аналогичными характеристиками, разрешенных к применению для этих целей в Российской Федерации в установленном порядке) или тщательно растирают в стерильной ступке с 2 - 3 г стерильного кварцевого песка.
При количественном определении парагемолитических вибрионов измельченную навеску переносят в стерильную колбу с 225 мл 0,1 %-го раствора пептонной воды с 3 % натрия хлорида (п. 7.2.1.2), получая исходное разведение 1:10. Взвесь тщательно взбалтывают, не допуская намокания пробки, дают отстояться и из надосадочной жидкости готовят десятикратные разведения (1:100, 1:1000) путем последовательного переноса по 1,0 мл из предыдущего разведения в 9,0 мл разводящей жидкости, каждый раз меняя пипетку для смешивания и переноса взвеси. В качестве разводящей жидкости могут быть использованы 0,1 %-й раствор пептона с 3 % натрия хлорида или фосфатной буферный раствор (п. 7.2.1.1). При контроле на соответствие СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов» готовят десятикратные разведения до 10-3, а при расследовании вспышек пищевых токсикоинфекций (ПТИ) - до разведения 10-7. Во избежание ошибок при количественном определении парагемолитических вибрионов интервал между приготовлением разведений исследуемого продукта и посевом на питательные среды должен быть не более 45 мин.
Для определения присутствия (отсутствия) парагемолитических вибрионов в исследуемой пробе всю гомогенизированную навеску в 25 г переносят в 125 мл жидкой среды обогащения - 1 %-й пептонной воды с 3 % натрия хлорида и ингибиторами роста сопутствующей микрофлоры или без них. Исследования проводят с соблюдением требований санитарно-эпидемиологических правил СП 1.2.731-99 «Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами» в лабораториях, имеющих лицензии на работу с микроорганизмами III - IV групп патогенности.
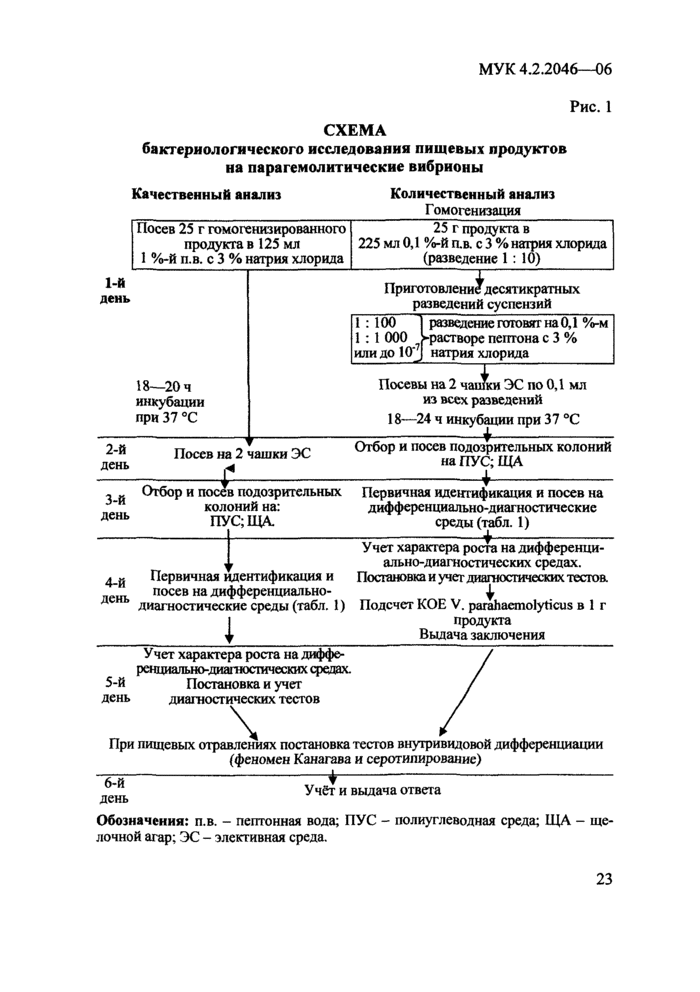
5. Схема бактериологического анализа
Метод основан на выявлении в посевах исследуемого материала на элективных агаровых средах колоний, подозрительных на парагемолитические вибрионы, последующего выделения из них чистой культуры и идентификации её по набору признаков, определяющих принадлежность к виду V. parahaemolyticus.
В работе используют готовые питательные среды, разрешенные к применению для этих целей в Российской Федерации в установленном порядке, и лабораторного изготовления. Обогатительные и элективные среды должны содержать натрия хлорида до 3 %, а дифференциально-диагностические - от 1,5 до 3,0 %.
5.1. Исследование пищевых продуктов
Порядок исследования и содержание работы по этапам схематически представлены на рис. 1.
При количественном анализе из разведений пробы 1:10, 1:100 и 1:1000 высевают по 0,1 мл на 2 чашки с элективной агаровой средой, например: питательной средой элективно-дифференциальной для выделения холерного вибриона сухой - СЭДХ - ВФС 42-411 ВС-93, селективной средой для выделения патогенных вибрионов - TCBS или дифференциально-диагностический агар с пенициллином - ДДА (п. 7.2.1.6). Посевной материал распределяют по поверхности агара и дают подсохнуть. Посевы помещают в термостат при (37 ± 0,5) °С на 18 - 24 ч.
При качественном анализе посевы в накопительные среды инкубируют при (37 ± 0,5) °С в течение 18 - 20 ч, после чего делают высев петлей с поверхностного слоя обогатительной среды на 1 - 2 чашки элективной среды для получения роста в виде изолированных колоний.
5.1.1. Отбор колоний и идентификация выделенных культур
Изучают рост на элективных средах, отбирают подозрительные на парагемолитические вибрионы колонии. При количественном анализе для подсчёта отбирают чашки с посевом двух последовательных разведений, где выросло не более 300 колоний. Необходимо, чтобы хотя бы в одной чашке содержалось не менее 15 колоний. С каждой из 4-х отобранных для подсчёта чашек отсевают по 5 колоний. Парагемолитические вибрионы на элективной среде формируют колонии правильной округлой формы, плосковыпуклые, полупрозрачные в проходящем свете с влажной блестящей поверхностью размером 2 - 3 мм в диаметре, не отличающиеся по цвету от голубовато-зеленого цвета элективных сред (СЭДХ, TCBS, ДДА), т.к. вибрионы этого вида не ферментируют сахарозу, входящую в них. Подозрительные колонии отсевают на щелочной агар - питательную среду для выделения и культивирования холерного вибриона, сухую (ФС 42-213 ВС-88) и на одну из полиуглеводных сред Ресселя (п. 7.2.1.7), Клиглера (ФС 42-3387-97) или другие с аналогичными характеристиками, разрешенные к применению для этих целей в Российской Федерации в установленном порядке.
На полиуглеводных средах отбирают культуры с типичным для парагемолитических вибрионов ростом. На среде Ресселя и Клиглера отмечают характерное для кислой реакции изменение цвета столбика при сохранении цвета скошенной части агара.
Культуры, выросшие на щелочном агаре, изучают на наличие цитохромоксидазы. Из оксидазопозитивных готовят мазки по Граму.
Для дальнейшей идентификации отбирают оксидазопозитивные грамотрицательные культуры с характерным ростом на полиуглеводных средах. Отобранные культуры изучают по набору признаков (подвижность, лизиндекарбоксилаза, аргининдигидролаза, индол, рост в средах с различными концентрациями натрия хлорида, ферментация/окисление глюкозы на среде Хью и Лейфсона (п. 7.2.1.8), арабинозы, сахарозы, целлобиозы, салицина, реакция Фогес-Проскауэра), методами, описанными в разделе 6 и методических указаниях МУ 4.2.1097-02 «Лабораторная диагностика холеры».
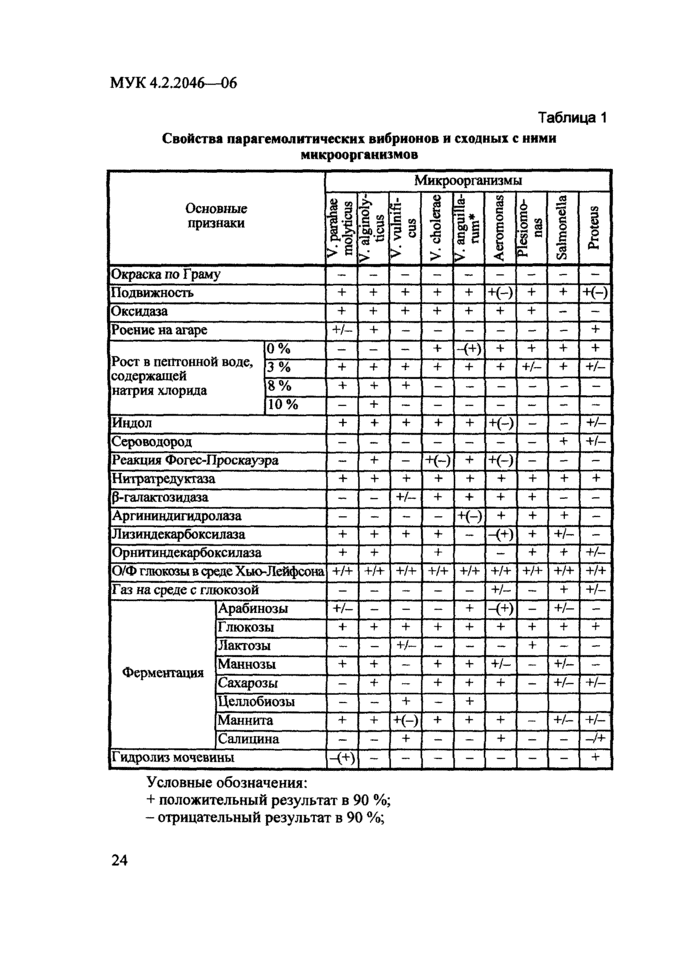
При расследовании случаев заболевания, обусловленных V. рагаhaemolyticus, выделенные культуры изучают по расширенному набору признаков, приведенному в табл. 1, а также по тестам внутривидовой дифференциации: серотипированию и феномену Канагава.
5.1.2. Обработка результатов
Количество парагемолитических вибрионов в 1 г продукта (N) в соответствии с ГОСТ Р 51446-99 (ИСО 7218-96) «Продукты пищевые. Общие правила микробиологических исследований» подсчитывают по формуле:
где Σа - сумма парагемолитических вибрионов, рассчитанная по формуле:
где a - количество вибрионов для каждой чашки;
b - количество колоний, микроорганизмы которых идентифицированы как V. parahaemolyticus;
А - количество колоний, отобранных для идентификации;
С - общее число выросших на чашке колоний;
V- объём посевного материала, внесенного в каждую чашку, см3;
n1 - количество отобранных для подсчёта чашек в первом разведении;
n2 - количество отобранных для подсчёта чашек во втором разведении;
d - коэффициент разбавления, соответствующий первому разведению.
Если в каждой из двух чашек, отобранных для подсчёта колоний, содержится их менее 15, то приближённое количество микроорганизмов в 1 г продукта (NE) рассчитывают по формуле:
где γ - среднее арифметическое колоний, подсчитанных в указанных двух чашках;
d - коэффициент разбавления исходной суспензии.
Если две чашки не содержат колоний на уровне исходной суспензии, то результаты выражают следующим образом:
- менее микроорганизмов в 1 г, где d - коэффициент разбавления исходной суспензии.
Доверительный интервал, характеризующий статистическое распределение микроорганизмов в пробе, рассчитывают в соответствии с ГОСТ Р 51446-99 (ИСО 7218-96) «Продукты пищевые. Общие правила микробиологических исследований».
5.2. Исследование воды поверхностных водоемов и
обитающих в ней гидрабионтов
Воду и гидробионтов исследуют качественным и количественным методами при проведении санитарно-эпидемиологического расследования.
5.2.1. Качественный анализ воды
Исследование воды отличается от схемы анализа пищевых продуктов, приведенной на рис. 1, только на первом этапе. К 1,0 л исследуемой воды добавляют основной 10 %-й раствор пептона, приготовленный из пептона основного сухого (ФСП 42-002-621-2801) до 1 %-й концентрации. При необходимости ингибиции посторонней микрофлоры используют пептонную воду с теллуритом калия или препаратом «Прогресс», или другие препараты с аналогичными двойствами, разрешенные к применению для этих целей в установленном порядке (п. 7.2.1.4). Посевы инкубируют 18 - 20 ч при 37 °С. Дальнейшие этапы исследования воды совпадают с этапами исследования пищевых продуктов (рис. 1).
5.2.2. Количественное исследование воды
Воду исследуют в объёмах 50, 10 и 1 мл в трёх параллельных пробах. Объёмы воды 10 мл и 1 мл засевают в 50 мл 1 %-й пептонной воды с 3 % NaCl (п. 7.2.1.3), а в пробы объёмом 50 мл добавляют 5 мл основного раствора пептона. Дальнейшее исследование всех проб проводят по схеме качественного анализа пищевых продуктов, представленной на рис. 1. По окончании идентификации выделенных культур подсчитывают число проб, из которых выделены парагемолитические вибрионы (положительный результат). В зависимости от различных комбинаций положительных и отрицательных результатов определяют наиболее вероятное число (НВЧ) парагемолитических вибрионов в 100 мл воды по таблицам Swaroop, опубликованным в методических указаниях МУК 4.2.671-97 «Методы санитарно-микробиологического анализа питьевой воды».
5.2.3. Исследование гидробионтов
Доставленные в лабораторию гидробионты исследуют по схеме, представленной на рис. 1.
5.3. Оценка результатов исследования объектов окружающей среды
При контроле пищевых продуктов на этапах их производства и реализации оценивают соответствие полученных результатов гигиеническим критериям их безопасности, предусмотренным санитарно-эпидемиологическими правилами и нормативами СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
В случае санитарно-эпидемиологического расследования вспышек, обусловленных парагемолитическими вибрионами, культуры этих микроорганизмов, выделенных из продуктов, морской воды и обитающих в ней гидробионтов изучают по тестам внутривидовой дифференциации. Доказательством роли объектов внешней среды, контаминированных парагемолитическими вибрионами, в возникновении заболевания является:
• обнаружение в объектах окружающей среды и от больных людей Канагава-позитивных V. parahaemolyticus;
• выделение от больных, из пищевых продуктов, морской воды и обитающих в ней гидробионтов вибрионов идентичных серологических групп.
Индекс парагемолитических вибрионов в воде морских прибрежных зон должен быть не выше 1000 КОЕ в 1 л в местах рекреации и 500 КОЕ в 1 л - в местах водозабора. В сырых гидробионтах с учетом возможного использования их в пищу в соответствии с санитарно-эпидемиологическими правилами и нормативами СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов» допускается присутствие V. parahaemolyticus в количестве 100 КОЕ в 1 г. Превышение этих показателей позволяет оценить эпидемическую обстановку в плане возможного распространения инфекции как опасную.
Объём и характер санитарно-противоэпидемических (профилактических) мероприятий в каждом конкретном случае с учётом полученных результатов определяют эпидемиологи и гигиенисты.
6. Методы изучения свойств парагемолитических вибрионов
6.1. Определение подвижности
Подвижность определяют при микроскопировании раздавленной капли с помощью фазово-контрастного устройства или посевом в 0,3 %-й агар, приготовленный из мясопептонного агара (МПА) с 3 % натрия хлорида (п. 7.2.1.5).
6.2. Определение цитохромоксидазы
Для постановки теста используют реактивы: 1 %-е водные растворы диметил-пара-фенилендиамина, тетраметил-пара-фенилендиамина (гидрохлорида) и пара-аминодиметиланилина (гидрохлорида или оксалата). Первые два реактива используют самостоятельно, последний в сочетании с 1 %-м спиртовым раствором а-нафтола.
Постановка реакции
Первый способ.
Для постановки пробы можно использовать бумажки из наборов систем индикаторных бумажных для идентификации микроорганизмов (набор № 1 для вибрионов; набор № 2 для межродовой дифференциации энтеробактерий) - СИБ (ФС 42-3566-98) или пропитать полоску фильтровальной бумаги 2 - 3 каплями однокомпонентного 1 %-го реактива или смесью 1 %-го раствора реактива с а-нафтолом в соотношении 2:3. На обработанную реактивом полоску бумаги наносят платиновой петлей, деревянной или стеклянной палочкой исследуемую культуру. При появлении красного или синего окрашивания через 30 - 60 с реакцию считают положительной.
Второй способ.
На поверхность колонии 18 - 24-часовой культуры, выросшей на щелочном агаре, наносят каплю однокомпонентного реактива. Положительная реакция - красная окраска появляется через 20 - 30 с. При использовании двухкомпонентной реакции (с а-нафтолом) в положительных случаях появляется синее окрашивание культуры. Из грамотрицательных бактерий положительную пробу на цитохромоксидазу дают вибрионы, аэромонады, плезиомонады, а отрицательную - энтеробактерий.
6.3. Определение галофильности и солевой толерантности
Суточную агаровую культуру засевают в 1 %-ю пептонную воду с 1 % натрия хлорида (п. 7.2.1.3). Через 3 - 4 ч инкубации при температуре (37 ± 0,5) °С переносят строго по 1 капле выросшей культуры в пептонную воду без соли и с 3, 6, 8 и 10 % натрия хлорида. Через 18 - 20 ч инкубации оценивают рост по помутнению среды.
Пептонную воду готовят из сухих компонентов без натрия хлорида и с внесением в нее необходимой навески соли.
Негалофильные вибрионы растут в отсутствии соли в среде. Галофильные вибрионы не растут в 1 %-й пептонной воде без добавления натрия хлорида и устойчивы к различным его концентрациям.
6.4. Выявление способности кроению
На пластинке МПА с 3 % натрия хлорида (п. 7.2.1.5) алгинолитические вибрионы, в отличие от большинства штаммов парагемолитических, растут в виде сплошного налета, напоминающего рост вульгарного протея. Для выявления феномена роения суточную агаровую культуру наносят в центр подсушенной пластины щелочного агара и сутки инкубируют при (37 ± 0,5) °С. Роящиеся культуры распространяются по поверхности всей среды, а нероящиеся - вырастают только на месте посева.
6.5. Биохимические тесты
Тип расщепления глюкозы, декарбоксилазную активность, ферментацию углеводов и спиртов, гидролиз мочевины, образование индола, сероводорода определяют с использованием общепринятых питательных сред, содержащих 1,5 % натрия хлорида.
6.6. Определение β-галактозидазы
Суточную агаровую культуру засевают на скошенную поверхность агара, содержащего 10 % лактозы. Посевы инкубируют 1 - 2 суток при температуре (37 ± 0,5) °С. Петлю культуры суспендируют в 0,25 мл 0,9 %-го раствора натрия хлорида, добавляют 0,25 мл водного раствора ортонитрофенил-β-D-галактопиранозида (ONPG) и помещают в термостат при (37 ± 0,5) °С. Для приготовления раствора ONPG 80 мг вещества растворяют в 15 мл дистиллированной воды при 37 °С. Затем добавляют 5 мл фосфатного буфера и доводят рН до 7,0. Раствор должен быть бесцветным. Хранят его при 4 °С. Перед использованием выдерживают несколько минут при 37 °С до растворения фосфата, который на холоде кристаллизуется. Реакцию учитывают через 20 мин, 1, 3 и 24 ч. В положительном случае взвесь приобретает желтую окраску, отрицательном -остается бесцветной.
6.7. Постановка реакции Фогес-Проскауэра
Культуру засевают в глюкозофосфатный бульон Кларка (ВФС 42-46 ВС-86) и инкубируют при температуре (37 ± 0,5) °С в течение 1 - 3 суток. Затем к 1 мл культуры добавляют 0,6 мл 6 %-го спиртового раствора альфа-нафтола и 0,4 мл 40 %-го раствора едкого калия. Пробирки встряхивают и помещают на 1 ч в термостат. При положительной реакции среда окрашивается в розовый или красный цвет.
6.8. Определение нитратредуктазы
а) Суточную агаровую культуру засевают в 1 мл бульона Хоттин-гера с 0,1 % калия азотно-кислого. После 2-х суток инкубации при температуре (37 ± 0,5) °С в посевы добавляют 0,5 мл реактива Грисса. В положительных случаях среда сразу же окрашивается в красный цвет.
б) К 1 - 2-суточной культуре в бульоне Хоттингера с 0,1 % KNO3 добавляют 3 - 5 капель реактива, представляющего собой смесь равных объёмов 0,1 %-го раствора риванола в дистиллированной воде и 12 %-го раствора соляной кислоты. В случае положительной реакции бульон окрашивается в красный цвет.
6.9. Серологическое типирование парагемолитических вибрионов
В основу серологической классификации парагемолитических вибрионов положены различия в строении О- и К-антигенов. Известно 12 типов термостабильного О-антигена и 68 термолабильного К-антигена. Каждый К-антиген сочетается с одним и тем же О-антигеном, образуя ту или иную серогруппу (табл. 2).
Используют наборы агглютинирующих О- и К-сывороток для серологического типирования на стекле, разрешенные к применению для этих целей в Российской Федерации в установленном порядке (например, Toschiba Kazaki Co. Ltd и др.). Для определения К-антигена исследуют суточную агаровую живую культуру, О-антигена - убитую двухчасовым кипячением.
Групповые заболевания чаще обусловливают парагемолитические вибрионы серогрупп О4:К12, О4:К8, О3:К6, спорадические - О3:К33, О3:К57, О5:К47, О6:К46, О10:К52.
6.10. Определение патогенных свойств парагемолитических вибрионов
О патогенности парагемолитических вибрионов судят по способности вызывать гемолиз на среде Вагатцума (п. 7.2.1.10). Этот тест назван феноменом Канагава. По результатам тестирования штаммы делят на Канагава-положительные, образующие зону р-гемолиза и Канагава-отрицательные, не лизирующие эритроциты человека. Гемолиз на среде Вагатцума обусловлен способностью парагемолитических вибрионов продуцировать прямой термостабильный гемолизин, обладающий энтеротоксигенными свойствами.
Постановка теста
Суточную бульонную культуру наносят каплей на пластину свежеприготовленной среды Вагатцума. Посевы инкубируют при (37 ± 0,5) °С 24 - 48 ч. Результат учитывают по величине и полноте зоны гемолиза. Штаммы оценивают как Канагава-позитивные, если зона четкого лизиса достигает 3-х и более миллиметров, считая от края колонии до наружного края зоны. При зоне менее 3 мм результат оценивают как слабо положительный.
7.
Аппаратура, материалы, лабораторная посуда,
питательные среды и тест-штаммы
7.1. Аппаратура, материалы, лабораторная посуда
Перечень аппаратуры, оборудования лаборатории и требования к ним представлены в ГОСТ Р 51446-99 (ИСО 7218-96) «Продукты пищевые. Общие правила микробиологического исследования».
7.2. Питательные среды и тест-системы для выделения
и
идентификации парагемолитических вибрионов
7.2.1. Растворы и среды лабораторного изготовления
7.2.1.1. Фосфатный буферный раствор для подготовки проб к исследованию, 01 М, рН 7,4 - 7,5 (PBS).
Двузамещённый фосфорно-кислый натрий Na2HPО4 (безводный) - 12,0 г.
Однозамещённый фосфорно-кислый натрий NaH2PО4 · Н20 - 2,2 г.
Натрия хлорид - 85,0 г.
Дистиллированная вода - 1,0 л.
Способ приготовления. Растворить ингредиенты в малом объёме дистиллированной воды в колбе. После растворения довести объём дистиллированной водой до 1,0 литра. Перед использованием развести бидистиллированной водой 1:10. В случае необходимости довести рН до 7,4 - 7,5 с помощью 0,1 н НСl или 0,1 н NaOH. Стерилизовать 15 мин при 121 °С.
7.2.1.2. Раствор 0,1 %-й пептонной воды с 3% натрия хлорида (для подготовки проб к исследованию).
Пептон ферментативный - 1,0 г.
Натрия хлорид - 30,0 г.
Вода дистиллированная - 1 л.
Ингредиенты перемешивают, подщелачивают 20 %-м раствором гидроокиси натрия до рН 8,5 ± 0,1. Варят в автоклаве текучим паром в течение 40 мин. Фильтруют через ватный фильтр. Устанавливают рН 8,0 ± 0,2 с помощью 18 %-го раствора соляной кислоты. Среду разливают в емкости и стерилизуют при температуре 112 °С в течение 20 мин.
7.2.1.3. Пептонная вода 1 %-я с 3, 6, 8, 10 % натрия хлорида (для определения солевой толерантности).
Пептон ферментативный - 10,0 г.
Натрия хлорид - 30,0 (80,0; 100,0) г.
Калия нитрат - 0,1 г.
Вода дистиллированная - 1,0 л.
рН 8,2 ± 0,2.
В воду очищенную вносят пептон ферментативный и требуемую навеску натрия хлорида. Подщелачивают 20 %-м раствором гидроокиси натрия до рН 8,6 ± 0,1. Варят текучим паром в автоклаве 40 мин или кипятят до растворения ингредиентов. Добавляют навеску калия нитрата, перемешивают, фильтруют через ватный фильтр и устанавливают рН с помощью 18 %-го раствора соляной кислоты.
Среду для определения галофильности - 1 %-ю пептонную воду без натрия хлорида готовят по этой прописи, но без добавления натрия хлорида. Эту среду не допускается готовить из основного раствора пептона, так как в нём уже содержится натрия хлорид.
7.2.1.4. Пептонная вода с ингибиторами (теллуритом калия или препаратом «Прогресс»).
В 1 %-ю пептонную воду с 3 % натрия хлорида после автоклавирования добавляют теллурит калия в конечном разведении 1:100000 или 1:200000, или же к 1 %-й пептонной воде добавляют 0,1 - 0,2 % моющего средства «Прогресс». Конечная концентрация ингибиторов в средах может быть изменена с учётом результатов контроля. Водный раствор натриевых солей вторичных алкилсульфатов в виде моющего вещества «Прогресс-30» или «Прогресс-40» по ТУ 38.10719-77.
7.2.1.5. Мясопептонный агар МПА с 3 % натрия хлорида.
Мясная вода - 1,0 л.
Пептон ферментативный - 10,0 г.
Натрия хлорид - 30,0 г.
Агар микробиологический (ГОСТ 17206-96) - (13,0 ± 1,0) г.
рН 8,0 ± 0,2.
В мясную воду вносят пептон ферментативный и натрия хлорид, перемешивают и подщелачивают 20 %-м раствором гидроокиси натрия до рН 8,5 ± 0,1. Затем добавляют агар микробиологический. Варят в автоклаве текучим паром (50 ± 10) мин. Фильтруют через ватный фильтр. Устанавливают рН 8,0 ± 0,2 с помощью 18 %-го раствора соляной кислоты. Среду разливают в посуду и стерилизуют в автоклаве при 112 °С в течение 20 мин. При необходимости в состав среды вводят 0,1 - 0,2 % препарата «Прогресс» (перед автоклавированием или в стерильный агар с последующим 10-минутным кипячением). Теллурит калия добавляют к автоклавированной среде перед её использованием в конечном разведении 1:100000 или 1:200000.
7.2.1.6. Дифференциально-диагностический агар с пенициллином ДДА.
Среда рекомендована методическими документами: «Временные методические рекомендации по контролю за содержанием парагемолитического вибриона в рыбе и рыбопродуктах. Методы исследования и нормативы» № 3933-85, утв. Зам. Главного государственного санитарного врача СССР, «Методические указания по контролю в рыбных продуктах парагемолитических вибрионов - возбудителей пищевых токси-коинфекций» №5780-91, утв. Зам. Главного государственного санитарного врача СССР и Зам. Министра рыбного хозяйства СССР, «Временная инструкция по борьбе с вибриозом рыб» 1998 г., Министерство сельского хозяйства и продовольствия РФ, Департамент ветеринарии.
Рыбо- или мясопептонный агар 2 %-й щелочной - 1 л.
Натрия хлорид - 25,0 г.
Сахароза- 15,0 г.
Пенициллин - 5000 ЕД.
Бромтимоловый синий (1,6 %-й спиртовой раствор) - 10,0 мл.
Жидкость «Прогресс-30» или «Прогресс-40» - 1 - 2 мл.
Калия теллурит (1:1000) - 7,5 мл.
К стерильному расплавленному рыбо- или мясопептонному агару (рН 8,0), охлаждённому до 50 °С, добавляют указанные ингредиенты и, не стерилизуя, разливают в чашки Петри. Среда имеет сине-зелёный цвет, хранят в холодильнике до 14 суток.
Парагемолитические вибрионы, не ферментирующие сахарозу, растут в виде голубоватых колоний, V. alginolyticus, V. anguillanun и V. cholerae - колоний жёлтого цвета. Некоторые штаммы аэромонад и псевдомонад формируют колонии жёлтого цвета.
7.2.1.7. Среда Ресселя.
К расплавленному и охлаждённому до 50 - 60 °С 1,5 %-му мясопептонному агару или агару Мартена рН 7,3 ± 0,1 добавляют лактозу -10,0 г/л, глюкозу - 1,0 г/л, индикатор Андреде - 20 - 40 мл/л (количество которого устанавливают экспериментальным путём в зависимости от качества используемого для приготовления фуксина кислого). Среду разливают в стерильные пробирки по 7 - 8 мл и стерилизуют в автоклаве при 104 °С 20 мин. После стерилизации среду скашивают так, чтобы в каждой пробирке были столбик и скошенная часть.
7.2.1.8. Среда Хью-Лейфсона.
Пептон ферментативный - 2,0 г.
Натрия хлорид - 15,0 г.
Калий фосфорно-кислый двузамещённый - 0,3 г.
Глюкоза- 10,0 г.
Бромтимоловый синий (1 %-й водный раствор) - 3,0 мл.
Агар микробиологический (ГОСТ 17206-96) - 3,0 г.
Вода дистиллированная - 1,0 л.
рН после стерилизации 7,2 ± 0,1.
К воде дистиллированной добавляют пептон ферментативный, натрия хлорид, калий фосфорно-кислый двузамещённый, агар микробиологический. Подщелачивают 20 %-м раствором гидроокиси натрия до рН 8,5 ± 0,1. Доводят до кипения и кипятят до расплавления агара и растворения ингредиентов. Фильтруют через ватный фильтр. Устанавливают рН 7,4 ± 0,1 с помощью 18 %-го раствора соляной кислоты. Добавляют глюкозу и 1 %-й водный раствор бромтимолового синего. Среду разливают в пробирки по 5,0 мл и стерилизуют при 112 °С 20 мин. Цвет среды после стерилизации травянисто-зелёный. При кислой реакции среда желтеет.
7.2.1.9. Среды для определения декарбоксилаз и дигидролазы аминокислот (Среды Мёллера.)
Пептон ферментативный - 5,0 г.
Дрожжевой экстракт - 3,0 г.
Натрия хлорид - 15,0 г.
Глюкоза - 1,0 г.
Вода дистиллированная - 1,0 л.
Бромкрезоловый пурпурный (1,6 %-й спиртовой раствор) - 0,6 мл.
Крезоловый красный (0,1 %-й спиртовой раствор) - 5,0 мл.
L-аминокислота - 10,0 г
или DL-аминокислота - 20,0 г.
В воду очищенную вносят пептон ферментативный, дрожжевой экстрат, натрия хлорид и глюкозу. Подщелачивают 20 %-м раствором гидроокиси натрия до рН 8,0 ± 0,2. Варят текучим паром 40 мин или кипятят до растворения ингредиентов. Фильтруют через ватный фильтр. Устанавливают рН 6,4 ± 0,1 с помощью 18 %-го раствора соляной кислоты. Добавляют навеску соответствующей аминокислоты (в контрольный вариант аминокислоту не добавляют). Затем вносят необходимые количества индикаторов. Среду разливают в стерильные, химическй чистые пробирки по 1 - 2 мл и стерилизуют при 104 °С 20 мин. Цвет готовой среды тёмно-сиреневый.
7.2.1.10. Среда Вагатцума для изучения гемолитической активности парагемолитических вибрионов.
Пептон ферментативный - 1,0 г.
Дрожжевой экстракт сухой - 0,3 г.
Натрия хлорид - 7,0 г.
Калий двузамещённый фосфорно-кислый - 0,5 г.
Агар микробиологический (ГОСТ 17206-96) - 13,0 ± 1,0.
Дистиллированная вода - 100,0 мл.
Все компоненты растворяют при нагревании, но не стерилизуют, добавляют 1 г маннита, 0,1 мл 0,1 %-го спиртового раствора кристалл-виолета, 5 мл дефибринированной крови человека и разливают по чашкам.
7.3.
Контроль питательных сред для выделения
парагемолитических вибрионов
Контроль питательных сред и ингибиторов роста посторонней микрофлоры проводят в соответствии с «Инструкцией по бактериологическому контролю диагностических питательных сред для холерного вибриона» 1983 г., утв. Начальником Главного управления карантинных инфекций МЗ СССР, используя вместо тест-штаммов холерного вибриона тест-штамм V. parahaemolyticus, а для оценки показателя ингибиции - Е. coli и P. vulgaris.
В качестве ингибиторов роста используют теллурит калия, контроль которого описан в упомянутой выше инструкции, и препарат «Прогресс», обеспечивающий торможение роения протея и алгинолитических вибрионов.
Каждая серия ингибиторов подлежит предварительному контролю на отсутствие бактерицидного эффекта по отношению к тест-штамму V. parahaemolyticus при обеспечении ингибирующего действия по отношению к тест-штаммам P. vulgaris и Е. coli.
Препарат «Прогресс» контролируют до и после его стерилизации при 0,5 атм. или кипячения на водяной бане в течение 20 мин.
Концентрацию препарата, необходимую для добавления в среды, определяют посевом 18 - 24-часовой культуры вульгарного протея в центр пластины агара с 0,05; 0,1; 0,2 % «Прогресса». В качестве контроля используют среду без добавления ингибитора. Посевы инкубируют при 37 °С в течение суток и определяют минимальную концентрацию препарата, подавляющую роение протея. На следующем этапе определяют чувствительность вибрионов тест-штамма V. parahaemolyticus к установленной ингибирующей дозе «Прогресса».
В три флакона со 100 мл 1 %-й пептонной воды с «Прогрессом» добавляют по 0,1 мл взвеси, содержащей 100 клеток V. parahaemolyticus. Через 18 ч из каждого флакона высевают по 0,1 мл на пластины агара. Также поступают с контрольной средой без «Прогресса». Препарат считают пригодным, если через 18 ч выращивания в 1 %-й пептонной воде с ингибитором и последующим высевом на плотную среду вырастает не менее 70 % от количества в контроле.
7.4. Тест-штаммы
С целью контроля ростовых свойств питательных сред используют тест-штаммы V. parahaemolyticus АТСС 17802, Е. coli 18 и P. vulgaris НХ19 N222, а для контроля гемолитической и уреазной активностей-штаммы V. parahaemolyticus KM-187, КМ-186 соответственно и другие с аналогичными свойствами, разрешенные в установленном порядке к применению для этих целей в Российской Федерации.
Рис.1
СХЕМА
бактериологического исследования пищевых
продуктов на парагемолитические вибрионы
Обозначения:
п.в. - пептонная вода; ПУС - полиуглеводная среда;
ЩА - щелочной агар; ЭС - элективная среда.
Таблица 1
Свойства парагемолитических
вибрионов и сходных с
ними микроорганизмов
|
Основные признаки |
Микроорганизмы |
||||||||||
|
V. parahae molyticus |
V. alginolyticus |
V. vulnificus |
V. cholerae |
V. anguillarum* |
Aeromonas |
Plesiomonas |
Salmonella |
Proteus |
|||
|
Окраска по Граму |
- |
- |
- |
- |
- |
- |
- |
- |
- |
||
|
Подвижность |
+ |
+ |
+ |
+ |
+ |
+ (-) |
+ |
+ |
+ (-) |
||
|
Оксидаза |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
||
|
Роение на агаре |
+/- |
+ |
- |
- |
- |
- |
- |
- |
+ |
||
|
Рост в пептонной воде, содержащей натрия хлорида |
0 % |
- |
- |
- |
+ |
- (+) |
+ |
+ |
+ |
+ |
|
|
3 % |
+ |
+ |
+ |
+ |
+ |
+ |
+/- |
+ |
+/- |
||
|
8 % |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
||
|
10 % |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
||
|
Индол |
+ |
+ |
+ |
+ |
+ |
+ (-) |
- |
- |
+/- |
||
|
Сероводород |
- |
- |
- |
- |
- |
- |
- |
+ |
+/- |
||
|
Реакция Фогес-Проскауэра |
- |
+ |
- |
+ (-) |
+ |
+ (-) |
- |
- |
- |
||
|
Нитратредуктаза |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||
|
β-галактозидаза |
- |
- |
+/- |
+ |
+ |
+ |
+ |
- |
- |
||
|
Аргининдигидролаза |
- |
- |
- |
- |
+ (-) |
+ |
+ |
+ |
- |
||
|
Лизиндекарбоксилаза |
+ |
+ |
+ |
+ |
- |
- (+) |
+ |
+/- |
- |
||
|
Орнитиндекарбоксилаза |
+ |
+ |
|
+ |
|
- |
+ |
+ |
+/- |
||
|
О/Ф глюкозы в среде Хью-Лейфсона |
+/+ |
+/+ |
+/+ |
+/+ |
+/+ |
+/+ |
+/+ |
+/+ |
+/+ |
||
|
Газ на среде с глюкозой |
- |
- |
- |
- |
- |
+/- |
- |
+ |
+/- |
||
|
Ферментация |
Арабинозы |
+/- |
- |
- |
- |
+ |
- (+) |
- |
+/- |
- |
|
|
Глюкозы |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||
|
Лактозы |
- |
- |
+/- |
- |
- |
- |
+ |
- |
- |
||
|
Маннозы |
+ |
+ |
- |
+ |
+ |
+/- |
- |
+/- |
- |
||
|
Сахарозы |
- |
+ |
- |
+ |
+ |
+ |
- |
+/- |
+/- |
||
|
Целлобиозы |
- |
- |
+ |
- |
+ |
|
|
|
|
||
|
Маннита |
+ |
+ |
+ (-) |
+ |
+ |
+ |
- |
+/- |
+/- |
||
|
Салицина |
- |
- |
+ |
- |
- |
+ |
- |
- |
-/+ |
||
|
Гидролиз мочевины |
- (+) |
- |
- |
- |
- |
- |
- |
- |
+ |
||
Условные обозначения:
+ положительный результат в 90 %;
- отрицательный результат в 90 %;
+/- признак вариабелен;
+ (-) или - (+) в скобках - редко наблюдаемый результат;
* - V. anguillarum реклассифицирован в Listonella anguillarum (Mcc Donell M.T., Colwell R.R., 1985), является возбудителем инфекционного заболевания рыб и других гидробионтов, обитающих в соленых и реже - в пресных водоемах. Роль в патологии человека микроорганизмов этого вида не установлена;
О/Ф тест окисления/ферментации глюкозы в среде Хью-Лейфсона.
Таблица 2
Схема серотипирования V. parahaemolyticus (Sakazaki R., 1979)
|
О-группы |
К-антиген |
|
O1 |
1, 25, 26, 32, 38, 41, 56, 58* |
|
О2 |
3, 28 |
|
О3 |
4*, 5, 6, 7, 29, 30*, 31, 33, 37, 43, 45, 48, 54, 57, 58*, 59 |
|
О4 |
4*, 8, 9, 10, 11, 12, 13, 34, 42, 49, 53, 55 |
|
О5 |
15, 17, 30*, 47, 60 |
|
О6 |
18, 46 |
|
О7 |
19* |
|
О8 |
20, 21, 22, 39 |
|
О9 |
23, 44 |
|
О10 |
19*, 24, 52 |
|
О11 |
36, 40, 50, 51 |
|
О12 |
61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71 |
Условные обозначения:
* - К-антигены, принадлежащие к двум О-серогруппам.
8. Библиографические данные
1. Санитарно-эпидемиологические правила СП 1.2.731-99 «Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами».
2. Санитарно-эпидемиологические правила и нормативы СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
3. ГОСТ 26668-85 «Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов».
4. ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов».
5. ГОСТ 7631-85 «Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолеп-тические методы оценки качества, методы отбора проб для лабораторных испытаний».
6. ГОСТ Р 51446-99 (ИСО 7218-96) «Продукты пищевые. Общие правила микробиологических исследований».
7. Методические указания МУК 4.2.671-97 «Методы санитарно-микробиологического анализа питьевой воды».
8. Методические указания МУ 4.2.1097-02 «Лабораторная диагностика холеры».
9. Методические указания МУК 4.2.1793-03 «Лабораторная диагностика заболеваний, вызываемых парагемолитическими и другими патогенными для человека вибрионами».
10. «Временные методические рекомендации по контролю за содержанием парагемолитического вибриона в рыбе и рыбопродуктах. Методы исследования и нормативы» № 3933-85, утв. Зам. Главного государственного санитарного врача СССР.
11. «Методические рекомендации по лабораторной диагностике, эпидемиологии, клинике, лечению и профилактике заболеваний, вызываемых парагемолитическими и другими условно патогенными морскими вибрионами» 1985, утв. Зам. начальника Главного управления карантинных инфекций МЗ СССР.
12. «Инструкция по бактериологическому контролю диагностических питательных сред для холерного вибриона» 1983, утв. начальником Главного управления карантинных инфекций МЗ СССР.
13. «Инструкция по санитарно-микробиологическому контролю производства пищевой продукции из рыбы и морских беспозвоночных» № 5319-91 от 22.02.91, утв. Зам. Главного государственного санитарного врача СССР, Зам. министра рыбного хозяйства СССР.
14. «Временная инструкция по борьбе с вибриозом рыб» /Министерство сельского хозяйства и продовольствия РФ, Департамент ветеринарии, 1998.
15. Санитарная микробиология: Справочник. Санкт-Петербург, 1998.
16. C.L. Sears and J.B. Kaper. Enteric Bacterial Toxins: Mechanisms of Action and Linkage to Intestinae Secretion. //Microbiological Reviews, Mar. 1996, vol 60, № 1, p. 167-215.