Методические указания по лабораторным исследованиям на хламидийные инфекции сельскохозяйственных животных
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
1. Общие положения
2. Обнаружение, выделение и идентификация хламидий
3. Серологические исследования
4. Схема определения рабочего разведения комплемента для РДСК
5. Схема титрования гемолитической системы
| Дата введения | 15.04.1986 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Завершение срока действия | 30.06.1999 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
Организации:
| 15.04.1986 | Утвержден | Министерство сельского хозяйства СССР | |
|---|---|---|---|
| Издан | Агропромиздат | 1987 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12
стр. 13

стр. 14
стр. 15
стр. 16
стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25
СПР/ТО
Ш
АБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАР ИИ
ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
СПРАВОЧНИКЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ
ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
Под редакцией Б. И. АНТОНОВА
т
тивной, негативной и испытуемыми сыворотками (взятыми из опыта) разливают специфический антиген в рабочем разведении по 0,2 мл, а во вторые ряды — по 0,2 мл физиологического раствора. Пробирки встряхивают и ставят в водяную баню на 60 мин при 37—38 °С.
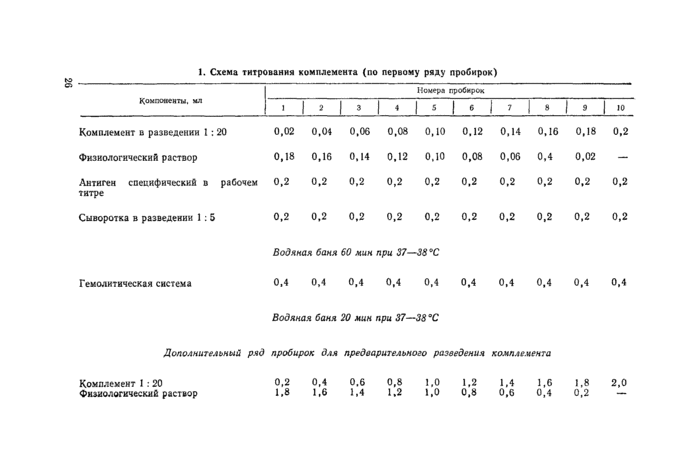
Затем во все пробирки разливают гемолитическую систему по 0,4 мл, встряхивают и ставят в водяную баню на 20 мин при 37— 38°С (схему титрования комплемента см. в табл. 1).
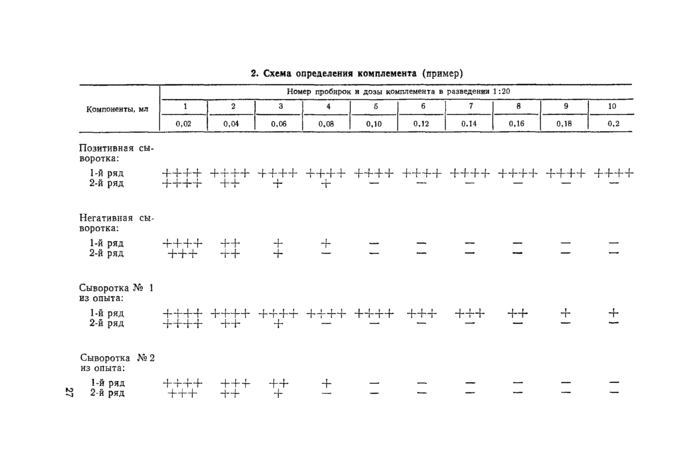
Титром (единицей) комплемента считают его наименьшую дозу, которая дает полный гемолиз эритроцитов с негативной и испытуемыми сыворотками в пробирках первого и второго рядов и с позитивной сывороткой — в пробирках второго ряда (без антигена).
В примере, приведенном в таблице 2, титр комплемента, разведенного 1 :20, равен 0,1 мл, что и будет являться его рабочей дозой.
Примечание. Если в первом ряду пробирок с сыворотками из опыта получена ясно выраженная задержка гемолиза эритроцитов более чем на два интервала по сравнению с безантигенным рядом, это значит, что испытуемые сыворотки содержат специфические (к данному антигену) антитела и в таком случае рабочую дозу комплемента определяют по негативной сыворотке и безантигенным рядам позитивной и испытуемых сывороток.
Расчет количества чистого комплемента, необходимого для постановки главного опыта, делают по формуле
где Л — рабочая доза комплемента; £ — количество пробирок, занятых в реакции; С — основное разведение комплемента.
0,М00
20
Пример:
= 0,5.
Количество разведенного комплемента, требуемое для всей реакции (в данном примере 100 пробирок), равно 20 мл (0,2-100), поэтому к 0,5 мл чистого комплемента следует добавить 19,5 мл фи зиологического раствора.
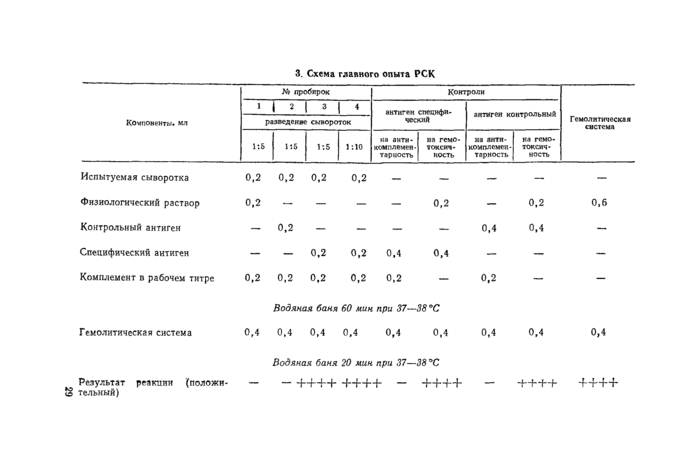
3.7.3. Главный опыт РСК. Испытуемые сыворотки исследуют в разведениях 1 :5 и 1 : 10 (доза сыворотки 0,04 и 0,02 мл) со специфическим антигеном, в разведении 1:5с контрольным антигеном (на специфичность) и без антигена (на антикомплементзр-ность).
Испытуемые и контрольные сыворотки инактивируют в день постановки реакции в разведенном виде при 56— 60 °С в зависимости от вида животного в течение 30 мин (также в РДСК).
Оба этапа реакции проводят в водяной бане при 37—38 °С, бак-териолитическую систему выдерживают 60 мин, второй этап реакции (с гемолитической системой) — 20 мин.
Контроля главного опыта РСК:
позитивная сыворотка в разведении 1 :5 без антигена и с контрольным антигеном; в разведениях от 1 :5 до ее предельного титра — со специфическим антигеном;
|
Номе!» пробирок | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Номер пробирок я дозы комплемент» я разведем** 1-.20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
негативная сыворотка в разведениях ) ;5 и 1 :10 со специфиче* ским антигеном; в разведении 1:5 —с контрольным антигеном и без антигена;
антигены специфический и контрольный в двойной дозе — на ан-тикомплементарность (комплемент +) и на гемотоксичность (комплемент —);
гемолитическая система — на гемотоксичность (комплемент —)»
Схема постановки главного опыта представлена в таблице 3.
3.8. Постановка реакции длительного связывания комплемента (РДСК).
3.8.1. Первую фазу реакции проводят в холодильнике при 2— 6®С в течение 16—18 ч, вторую фазу — в водяной бане 20 мин при 37—38 °С.
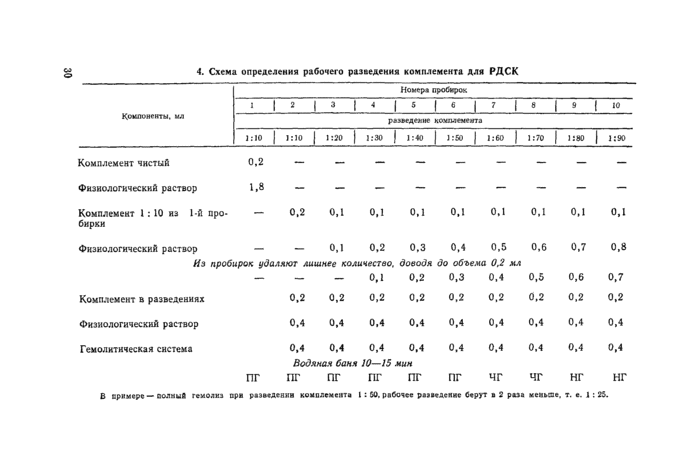
Комплемент применяют в рабочем разведении 1 :25 или 1 :30 (при титре, указанном биофаорнкой, для гемолитической системы 0,19—0,22). Если рабочий титр комплемента неизвестен или вызывает сомнение, перед титрованием гемолитической системы для РДСК определяют его рабочее разведение по схеме, представленной в таблице 4.
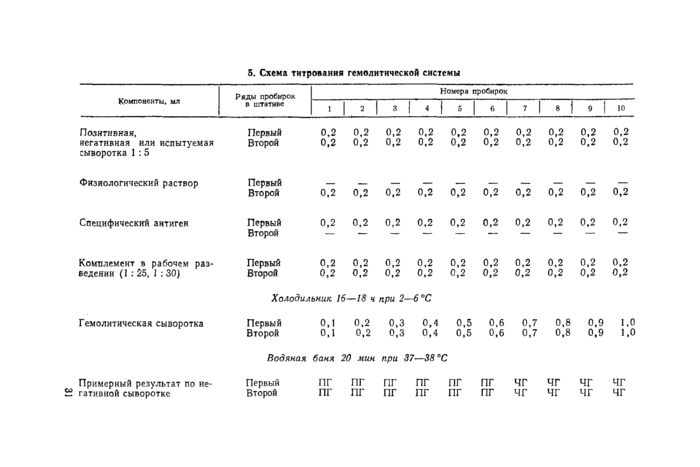
3.8.2. Титрование гемолитической системы, дозу гемолитической системы для главного опыта РДСК определяют путем титрования ее на 3—4 сыворотках: позитивной, негативной и 1—2 испытуемых из партии, поступившей на исследование.
Инактивированные сыворотки (позитивную, негативную и испытуемые) в разведении 1 :5 разливают каждую в два ряда пробирок штатива Флоринского по 0,2 мл. Затем в первые ряды пробирок каждой сыворотки вносят по 0,2 мл антигена в рабочем разведении, а во вторые ряды —0,2 мл физиологического раствора; во все пробирки разливают по 0,2 мл комплемента в рабочем разведении (I : 25 или 1 : 30), встряхивают и помещают в холодильник на 16—18 ч при температуре 2—6°С.
На следующий день штативы вынимают из холодильника и выдерживают в течение 20—30 мин при комнатной температуре.
Затем в первые пробирки с позитивной, негативной и испытуемыми сыворотками разливают гемолитическую систему (приготовленную согласно пунктам 3.3 и 3.4) по 0,1 мл, во вторые пробирки— по 0,2 мл, в третьи —по 0,3 мл и т. д. до 1 мл. Пробирки встряхивают, ставят в водяную баню на 20 мин при 37—38 иС, после чего определяют титр гемолитической системы.
Схема титрования гемолитической системы представлена в таблице 5.
Титром гемолитической системы считают наибольшее се количество, в котором получен полный гемолиз эритроцитов в обоих рядах пробирок' с негативной и испытуемой сыворотками и в безантиген-ном ряду с позитивной сывороткой, при полной задержке гемолиза в ряду с позитивной сывороткой и антигеном. В приведенном примере (табл. 5) титр гемолитической системы равен 0,6 мл.
3.8.3. Главный опыт РДСК. В первый день, одновременно с разливом сывороток для титрования гемолитической системы, разливают сыворотки и антиген для главного опыта, как указано в пункте 3.7.3.
Затем во все пробирки главного опыта и соответствующих кон-тролей разливают комплемент по 0,2 мл в рабочем разведении (1 : 25 или I :30), пробирки встряхивают и помещают в холодильник на 16—18 ч при 2—6 °С.
|
Компоненты. Ю1 |
Л» пробирок |
Контроля |
Гемолитическая система | ||||||
|
1 |
2 |
3 |
антиген спеммфи-чесхяЯ |
антиген контрольны» | |||||
|
разведена* сывороток | |||||||||
|
1:6 |
1:6 |
1:5 |
1:10 |
на анти- ком плачея -таркость |
иа гемо-токсич-иоеть |
на анти- НОМВМММ -тарное л. |
на гемо, токсичность | ||
|
Испытуемая сыворотка |
0.2 |
0.2 |
0.2 |
0.2 |
— |
— |
— |
— |
— |
|
Физиологический раствор |
0,2 |
— |
— |
— |
— |
0.2 |
— |
0.2 |
0.6 |
|
Контрольный антиген |
— |
0.2 |
— |
— |
— |
— |
0.4 |
0.4 |
— |
|
Специфический антиген |
— |
— |
0.2 |
0.2 |
0.4 |
0.4 |
— |
— |
— |
|
Комплемент п рабочем титре |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
— |
0,2 |
— |
— |
|
Водяная баня 60 мин при 37—38 "С | |||||||||
|
Гемолитическая система |
0.4 |
0.4 |
0.4 |
0.4 |
0.4 |
0.4 |
0.4 |
0.4 |
0,4 |
Водяная баня 20 мин при 37—38 ®С
Результат реакции (положи- — — ++++ ++++ — ++++ — ++++ ++++
3 тельный)
|
Номера пробирок. | |||||||
|
* |
2 1 |
3 |
4 | S | 6 | 7 |
8 |
10 | ||
|
Компоненты, ил |
разделение кохшемемта | ||||||
|
1:10 |
1:ю | |
1:30 | 1:40 | 1:50 J 1:60 |
1:70 |
1:«0 |
1:90 | ||
Комплемент чистый 0,2
Физиологический раствор 1,8
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
В срнмерс — полный гемолиз ара разделение комплемента I : 60. рабочее разделение берут в 2 раза кемьае. т. е. 1 : 25. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Компоненты, мл |
Ряды пробирок |
Комере пробирок | |||||||||
|
в платине |
1 |
1 * |
4 |
1 S |
в 1 |
г 1 |
» 1 |
« 1 |
10 | ||
|
Позитивная. |
Первый |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
|
негативная или испытуемая сыворотка 1 :5 |
Второй |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
|
Физиологический раствор |
Первый Второй |
0.2 |
0,2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
|
Специфический антиген |
Первый Второй |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
|
Комплемент в рабочем раз- |
Первый |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
|
велении (1: 25. 1 :30) |
Второй |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0,2 |
0.2 |
0.2 |
0.2 |
0.2 |
|
Холодильник 16—18 ч |
при 2—6*С | ||||||||||
|
Гемолитическая сыворотка |
Первый |
0.! |
0.2 |
0.3 |
0,4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
1. |
|
Второй |
0.1 |
0.2 |
о.з |
0.4 |
0.5 |
0.6 |
0,7 |
0.8 |
0.9 |
1. | |
|
Водяная |
баня |
20 мин |
при 37—38‘С | ||||||||
|
Примерный результат по ие- |
Первый |
ПГ |
ПГ |
пг |
ПГ |
ПГ |
ПГ |
ЧГ |
ЧГ |
ЧГ |
ЧГ |
|
гативной сыворотке |
Второй |
пг |
11Г |
ПГ |
ПГ |
ПГ |
ПГ |
ЧГ |
ЧГ |
ЧГ |
ЧГ |
На следующий день штативы с первой фазой вынимают из холодильника и после выдерживания в течение 20—30 мин при комнатной температуре во все пробирки разливают гемолитическую систему в дозе, полученной при титровании (в приведенном примере 0,6 мл). Штативы встряхивают и помещают в водяную баню на 20 мин при 37—38 °С.
3.9. При массовых постановках (РДСК) испытуемые сыворотки исследуют только со специфическим антигеном в разведении сыворотки 1 :5 (0,04 мл сыворотки + 0,16 мл физиологического раствора) с последующей перестановкой сомнительно и положительно реагирующих проб, как указано в пп. 3.7, 3.8. Допускается при работе с аппаратом Флоринского для разведения сыворотки 1 :5 к 0,04 мл сыворотки добавлять 0,2 мл физиологического раствора; перед разливом компонентов в РСК и РДСК — смешивание равных объемов антигена и комплемента в рабочих разведениях.
3.10. Учет результатов РСК (РДСК) проводят дважды: первый раз —сразу после водяной бани, второй — после оседания эритроцитов на дно пробирки (через 3—4 ч после бани) или на следующий день при хранении в холодильнике (2—6°С),
Для объективного определения результатов реакции оценку рекомендуется проводить в процентах гемолиза. Для этого из реакции выбирают 5 пробирок с полным (100 %-ным) гемолизом и жидкость из них сливают в одну пробирку. Из нее готовят разведения с меньшим процентом гемолиза по следующей схеме.
|
Номера пробирок | ||||||||||||||||||||||||||||||||||||||||
|
«Стандартную» шкалу готовят перед учетом реакции.
Степень гемолиза в пробирках с исследуемыми сыворотками определяют путем сравнения со степенью гемолиза в «стандартных» пробирках и процент гемолиза выражают в крестах.
Степень задержки обратно пропорциональна проценту гемолиза эритроцитов:
+ + ++ (4 креста) — отсутствие гемолиза, надосадочная жидкость прозрачная и бесцветная;
+ + + (3 креста) — гемолиз 25% эритроцитов;
+ + (2 креста) — гемолиз 50 % эритроцитов;
+ (1 крест) — гемолиз 75 % эритроцитов;
— (минус) — полный гемолиз эритроцитов, осадок отсутствует, жидкость интенсивно окрашена гемоглобином.
3.11. Оценка результатов РСК и РДСК.
Диагностическими дозами испытуемой сыворотки являются дозы 0,04 и 0,02 мл (разведения 1 : 5 и 1:10) при полном гемолизе эритроцитов в контроле сыворотки без антигена и с контрольным антигеном.
Положительной оценивают реакцию при задержке гемолиза эритроцитов на 4, 3 или 2 креста в разведении I : 10; сомнительной—
при задержке гемолиза эритроцитов на 1 крест в разведении сыворотки 1 : 10 и от I до 4 крестов в разведении 1 :5, отрицательной— при полном гемолизе эритроцитов в разведениях сыворотки 1 :5 я 1 : 10.
3.12. Животных, с сыворотками крови которых получены сомнительные результаты, исследуют повторно в сроки, установленные действующей инструкцией.
Животных, давших дважды сомнительную реакцию, считают положительно реагирующими.
4. Диагноз на хламидийные инфекции считают подтвержденным лабораторными исследованиями в случаях:
выделения возбудителя из исследуемого материала и его идентификации;
обнаружения возбудителя в исследуемом материале и получения положительных результатов исследования на хламидиоз сывороток крови от этих же животных;
получения нарастания титра антител в 2 и более раз при исследовании сыворотки крови абортировавших животных.
При первичной постановке диагноза в хозяйстве выделение и идентификация возбудителя обязательны. В дальнейшем, при оздоровлении хозяйств, больных и переболевших животных выделяют путем серологических исследований.
5. Сроки исследований:
микроскопические и серологические — до 4 дн.;
выделение и идентификация хламидий — от 12 до 40 дн.
|
Агар мясо-пептонный 83, 92 Альбумин бычий 63, 64 Аппарат Киппа 35, 39 Бульон мясо-пептонный 92 — триптозно-фосфатный 113 Гемолизин 105 Гемолитическая система (гем- система) 56, 105 Жидкость Барбагалло 170, 188 — Руге 127 Иммуноасцитическая жидкость (ИАЖ) 13 Йодный реактив Мелена 79 Комплемент 16, 24, 105 Метод гельминтоскопии 164, 176 — биопсии 176 — биохимический 179, 187 — Вишняускаса 160 — Гнединой 175 — Ковоана 175 — комбинированный 177 — микроагглютинации с помощью аппарата Такачи 85, 105 — раздавленной капли 198, 204, 210, 213, 215, 226 — световой микроскопии (три-хинеллоскопии) 179 — седиментации с целлофановыми пленками 160 — Щербовича 185 — Фюллеборна 183 Методика Бермана 171, 183 — Кивако 176 — комбинированная в модификации Котельникова и Хренова 173 Методика культивирования личинок стронгилят и лавроско-пии 168 — седиментации с центрифугированием по Котельникову, Корчагину и Хренову 172 — упрощенная модификация методики Бермана 171 — флотации 160, 164, 166, 176 |
Окраска гистопрепаратов по Ленцу 1! ---Туревичу 11 — мазков по Борману —Гайнуллиной 7 ---Бурри 227 ---Лейшману 225, 228 --— Михину 6 ---Морозову 127 ---Муромцеву 6 ---Нохту 70 ---Паппенгейму 70 ---Пашену 127 ---Романовскому 191, 199, 211, 215, 216, 225, 228 ---Романовскому — Гим- эе 21 --- Селлерсу 6 — --Стемну 21 ■---Щуренковой 191 Перевиваемая линия почки свиньи (СПЭВ) 92 Первично-трипсинизированная культура клеток почки свиньи (ПЭС) 41, 92 --эмбриона коров (ПЭК) 58 --тестикулов бычка (ТБ) 58 Раствор азотнокислого натрия 185 — азотнокислого свинца 159, 160, 173 — азотнокислого серебра 127 — Альсевера 96 Раствор аммиачной селитры 164, 166, 173, 176 — борной кислоты 184 — буферный борантный 157 — веронал-мединаловый 12, 13, 149 — гексаметафосфата 56, 61 — гипосульфита натрия 185 — забуференного глицерина 181 — забуференный физиологический (ЗФР) 82 — лимоннокислого натрия 97 — мертиолята 40, 98, 156 — сернокислого цинка 160, 171, 172 — соляной кислоты 179 |
ББК 48.73 Л12
УДК 619: 616.98/.99 (031)
Составители: Б. И. Антонов, В. В. Борисова, Л. П. Каменева, Л. И. Ковалерчук, Г. А. Михальский, В, Д. Пев• нева, Л. И. Прянишникова.
Лабораторные исследования в ветеринарии: Ви« Л12 русные, риккетсиозные и паразитарные болезни: Справочник/Под ред. Б. И. Антонова. — М.: Агро-промиздат, 1987.—-240 с.: ил.
В книге даны методы лабораторного исследования патологического ма!ермала с целью определения возбудителей вирусных, риккетсиозных и паразитарных болезней животных. Они изложены по единой схеме. Методы унифицированы и стандартизированы.
3805020000—166 035(01)—87
332-87
ББК 48.73
Для ветврачей и фельдшеров, лаборантов ветеринарных лабораторий.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ: ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
Справочник
Составители; Борис Иванович Антонов, Валерия Валентиновна Борисова, «Людмила Петровна Каменева и др.
Зав. редакцией В. Г. Федотов. Редактор В. //. Сайтаниди. Художественный редактор Н. А. Никонова. Технический редактор И. А. Зубкова. Корректор И. В. Карпова
И Б № 5093
Сдано в набор 02.10.86. Подписано к печати 22.01.87. Т-00912. Формат
84X108711. Бумага тип. JV* 2. Гарнитура Литературная. Печать высокая. Уел. псч. л. 12,6. Уел. кр.-отт. 12,6. Уч.-иэд. л. 18,25. Изд. № 226. Тираж 33 000 экз. Заказ .Ns 668. Цена 1 р. 10 к.
Ордена Трудового Красного Знамени ВО «Агропромнздат», 107807, ГСП, Москва, Б-53, ул. Садовая-Спасская, 18
Владимирская типография Союэполиграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли 600000, г. Владимир, Октябрьский проспект, д. 7
© ВО «Агропромнздат», 1987
|
— уксусной кислоты 177 — фосфатно-буферный 9, 66, 96 — Хенке 63, 81 —- хлорида цинка 177 — электролита 68 — Эрла 100 Реакция гемагглюгннацин (РГА) 36, 60 — гемадсорбции (РГАд) 42, 59 Среда 199, 81, 92 — 0,5 %-ного гидролизата лак-тальбумина 81, 92, 113 — Игла 97, 100 — диффузионной преципитации (РДП) 55, 61, 141, 155 — длительного связывания комплемента (РДСК) 16, 23, 9ft — ЙАТ 151 — иммунофлуоресценции (ИФ) 54, 79, 80, 91, 111 — иммуноэлектроосмиофореза (РИЭОФ) 147 —кольцепреципитации в капилляре 182 — нейтрализации (PH) 42, 81, 91, 94, 115, 117 — нейтрализации вирусных гемагглютинииов (РНВГ) 63 — непрямой гемагглютинации (РИГА) 64, 65, 66, 82, 84 — непрямой иммунофлуоресценции 180 — подавления иммунофлуоресценции 54, 91 — радиальной иммунодиффу-вии (РРИД) 71, 76, 78 диагиостикум — связывания комплемента (РСК) 23, 24, 56, 57, 192, 199, 219 |
--конглютинирующего комплекса 207 — торможения гемагглютинации (Р'ГГА, или РЗГА) 43, 60 --гемадсорбции (РТГАд) 42, 60 --непрямой гемагглютииа- ции (РТНГА) 62, 63, 142 — формалиновая 205, 226 ■— Игла (МЕМ) 113 — Кнтта — Тароцци 83, 92 — пептонно-агаровая 211 — Петровского 211 — поддерживающая 87, 92 — ростовая 92 — Сабуро 134 Тельца Бабеща — Нсгри 5, 6 Тканевая цитопатическая доза (ТЦД) 64, 103 Термолабильные ингибиторы 35, 95 Термостабильные ингибиторы 35, 95 Цитопатическое действие (ЦПД) 58, 81, 87, 93 Эритроцитарный |
Успешное выполнение намеченной XXVII съездом КПСС широкой программы развития в нашей стране агропромышленного комплекса в немалой степени зависит от хорошей организации ветеринарного обслуживания животноводства, четко налаженной работы ветеринарных диагностических лабораторий. Проводимые в лабораториях исследования позволяют правильно организовать мероприятия по предупреждению инфекционных и инвазионных болезней, а в случаях возникновения заболевания своевременно поставить диагноз и принять целенаправленные меры по его быстрейшей ликвидации.
В работе ветеринарных лабораторий все большее применение находят современные методы исследований, одновременно идет совершенствование диагностики многих заболеваний, предлагаются новые более чувствительные и достоверные методы, позволяющие полнее и на ранних стадиях выявлять заболевших животных и тем самым способствовать быстрейшему оздоровлению хозяйств.
Специалисты лабораторий постоянно расширяют перечень показателей и болезней, на которые проводятся исследования.
За последнее время утверждено значительное количество инструктивных документов по проведению лабораторных исследований, что позволило более четко организовать работу специалистов, улучшить качество исследований, получать сопоставимые результаты.
Оснащение лабораторий современным оборудованием позволяет внедрять в работу более точные инструментальные методы.
В своей работе ветеринарные лаборатории не могут использовать всего многообразия предлагаемых методов исследования из-за того, что они или недостаточно апробированы, или из-за сложности используемого оборудования. Имеют место случаи, когда предлагаемые различными авторами методы при определении одних и тех же показателей дают несовпадающие результаты. Поэтому в настоящий справочник включены методы лабораторных исследований патологического материала, полученного от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные в разные годы бывшим Министерством сельского хозяйства СССР.
Книга содержит методические указания по диагностике вирусных, риккетсиозных, хламидиозиых болезней, а также методические указания по лабораторной диагностике паразитарных болезней животных и пчел.
Методики излагаются по единой схеме: взятие и пересылка патологического материала, методы его обработки, микроскопические исследования, включая световую и люминесцентную микроскопию, выделение возбудителей на куриных эмбрионах и культурах клеток, заражение лабораторных животных, гистологические исследования, идентификация и дифференциация возбудителей с использованием различных методов, определение биологической активности вакцин и исследования на напряженность иммунитета.
Методы лабораторных исследований, представленные и справочнике, унифицированы и стандартизированы, что создает возможность для стандартизации аппаратов, приборов, инструментов, посуды, реактивов, биопрепаратов и другого специального имущества, определения объема подготовки специалистов и степень оснащения ветеринарных диагностических лабораторий. Таким образом, стандартизация методов исследования является способом наведения строгого порядка в ветеринарной лабораторной работе.
ХЛАМИДИЙНЫЕ ИНФЕКЦИИ
Методические указания по лабораторным исследованиям на хламидийные инфекции сельскохозяйственных животных
(Утверждены 15 апреля 1986 г.)
1. Общие положения.
1.1. Лабораторные методы исследования на хламидийные инфекции животных включают: обнаружение хламидий в патологическом материале методами световой микроскопии или иммунофлуоресценции (ИФ); выделение хламидий на куриных эмбрионах или лабораторных животных с последующей их идентификацией; выявление антител в сыворотке крови больных или переболевших животных и установление нарастания титра в сыворотках крови в РСК (РДСК).
1.2. В лабораторию для исследования на хламидийные инфекции направляют: патологический материал от павших или вынужденно
убитых больных животных (кусочки паренхиматозных органов); патологический материал от абортировавших животных (кусочки плаценты, влагалищную слизь); абортированные плоды целиком или паренхиматозные органы н сычуг плода; пробы эякулята или замороженной спермы, полученные от производителей, подозрительных по заболеванию; при их убое отбирают кусочки паренхиматозных органов, лимфатических узлов и семенников; сыворотку крови в количестве 2—3 мл от абортировавших и подозрительных по заболеванию животных, а также во всех случаях, предусмотренных действующей инструкцией.
Патологический материал отбирают не позднее 2 ч после гибели, убоя животных или аборта в стерильные, герметически закрывающиеся флаконы.
Флаконы с патматериалом помещают в термос со льдом, а абортированные плоды во влагонепроницаемую тару и в тот же день, но не позже чем через 24 ч доставляют в лабораторию с соблюдением мер, исключающих распространение возбудителя инфекции.
Пробы эякулята направляют для исследования в количестве 1 мл; замороженную сперму доставляют не менее 4 гранул в контейнерах с жидким азотом или в пробирках с сухим льдом.
Кровь от абортировавших или подозрительных по заболеванию хламидиозом животных берут дважды: в период клинического проявления болезни и повторно через 2 нед.
2. Обнаружение, выделение и идентификация хламидий.
2.1. Обнаружение хламидий. Для обнаружения хламидий из доставленного патологического материала готовят мазки или мазки-отпечатки для световой микроскопии или иммунофлуоресценции.
2.1.1. Метод световой микроскопии. При исследовании материала с помощью световой микроскопии мазки или мазки-отпечатки окрашивают по Стемпу или Романовскому—Гимзе.
При окраске по Стемпу препараты фиксируют над пламенем горелки 1—2 мин и окрашивают в следующей последовательности: фуксин Циля в разведении 1 :5 на дистиллированной воде pH 7,4— 15 мин; промывка дистиллированной водой pH 7,4; 0,05 %-ный раствор серной кислоты — 1 мин; промывка дистиллированной водой pH 7,4; 1 %-ный водный раствор малахитовой зелени —30 с; промывка дистиллированной водой; высушивание фильтровальной бумагой.
При окраске по Романовскому—Гимзе препараты фиксируют спирт-эфиром (поровну) в течение 15—20 мин и окрашивают краской Романовского—Гимзы в разведении 1:5 l'/г—2 ч, после чего их промывают дистиллированной водой и высушивают фильтровальной бумагой.
Окрашенные и высушенные мазки или мазки-отпечатки просматривают под иммерсией в микроскопе. Результаты микроскопии считают положительными при обнаружении в препаратах хламидий, которые имеют круглую форму и расположены отдельно или скоплениями внутри или вне клеток.
При окраске по Стемпу хламидии ярко-красные на зеленоватом фоне клеток.
При окраске по Романовскому—Гимзе хламидии темно-фиолетовые на синем фоне клеток.
2.1.2. Методы иммунофлуоресценции. Для исследования методами нммунофлуоресценции мазки или мазки-отпечатки фиксируют в охлажденном при минус 15—20 °С (в морозильной камере бытового холодильника) ацетоне в течение 15 мин. Препараты промывают физиологическим раствором, затем дистиллированной водой и слегка подсушивают на воздухе.
При исследовании материала прямым методом ИФ на препарат наносят флуоресцирующие хламидийные иммуноглобулины в рабочем разведении и выдерживают во влажной камере при 37 °С в течение 45 мин. Препараты промывают 3 раза физиологическим раствором, высушивают на воздухе и просматривают под люминесцентным микроскопом.
При получении положительного результата иммунофлуоресценции специфичность свечения проверяют в контрольных препаратах. Для этого на один из фиксированных препаратов наносят иммунную хламндийную, на другой — контрольную отрицательную сыворотки, выдерживают во влажной камере в течение 45 мин при 37 °С. Затем промывают физиологическим раствором, слегка подсушивают и оба препарата окрашивают флуоресцирующими хламидийными иммуноглобулинами, как указано выше.
При исследовании материала непрямым методом ИФ на фиксированный препарат наносят иммунную хламидийную сыворотку и выдерживают его во влажной камере при 37 °С в течение 45 мин. Затем препараты промывают физиологическим раствором, слегка подсушивают, наносят антивидовую флуоресцирующую сыворотку и вновь выдерживают во влажной камере при 37 °С в течение 50— 40 мин. Затем препараты промывают физиологическим раствором, высушивают и просматривают под люминесцентным микроскопом.
При положительном результате исследования материала методом нммунофлуоресценции в препаратах, окрашенных флуоресцирующими хламидийными иммуноглобулинами или антивидовой флуоресцирующей сывороткой, обнаруживают ярко светящиеся желто-зеленым цветом гранулы округлой или овальной формы, расположенные одиночно или скоплениями на тусклом зеленоватосером фоне клеток.
В контрольных препаратах, обработанных последовательно контрольной отрицательной сывороткой и флуоресцирующими хламидийными иммуноглобулинами, должно быть аналогичное свечение, а в препаратах, обработанных иммунной хламидийной сывороткой и флуоресцирующими хламидийными иммуноглобулинами, специфическое свечение должно отсутствовать.
2.2. Выделение хламидий. Выделение хламидий проводят на куриных эмбрионах или лабораторных животных.
2.2.1. Для заражения эмбрионов из патологического материала готовят 10 %-ную суспензию на физиологическом растворе pH 7,2— 7,4 и центрифугируют ее при 2 тыс. об/мин 15 мин. Надосадочную жидкость обрабатывают антибиотиками: 100 ЕД/мл пенициллина и 500 ЕД/мл стрептомицина или 150 мкг/мл гентамицина. Пробы спермы, эякулята, влагалищной слизи используют в цельном виде или разводят 1 :2, обрабатывают антибиотиками. Затем выдерживают п холодильнике при 4 °С в течение 2—4 ч и высевают на питательные среды (МПБ, МПА) для исключения бактериального загрязнения. Через сутки, при отсутствии роста микрофлоры на питательных средах, исследуемый материал вводят 6—7-дневным куриным эмбрионам в желточный мешок в дозе 0,2 мл. Каждым материалом зара-
жают не менее б эмбрионов. Эмбрионы инкубируют в термостате при 37 °С и относительной влажности 75 %. Гибель эмбрионов в течение 72 ч после заражения считают неспецифической.
При отсутствии специфической гибели эмбрионы на 12-й день вскрывают и проводят следующий пассаж по общепринятой методике, используя для заражения центрифугат 10%-ной суспензии желточных мешков.
Эмбрионы, погибшие на 4—12-й день после заражения, вскрывают. Аллантоисную жидкость проверяют на бактериальную контаминацию путем высева на питательные среды (МПБ, МПА). Желточные мешки эмбрионов отбирают в стерильную посуду и из каждого готовят мазки-отпечатки.
Результаты исследования считают положительными в случае обнаружения и идентификации хламидий в мазках отпечатках из желточных мешков куриных эмбрионов, павших на 4—-12 й день после заражения в любом из трех последовательных пассажей.
2.2.2. Для выделения хламидий на лабораторных животных заражают 5 белых мышей массой 16—20 г или 2—3 морских свинок массой 300—350 г.
Материал, подготовленный, как описано в п. 2.2.1, вводят внут-рибрюшинно или интраторакально (в грудную полость через межреберные ткани с правой стороны) белым мышам в дозе 0,3 мл, морским свинкам — 0,5 мл.
Животные находятся под наблюдением до 10 дн. При наличии в материале патогенных хламидий животные заболевают и через 7—10 дн. после заражения погибают. При вскрытии павших животных обнаруживают значительное количество серозно-фибринозного экссудата в грудной и брюшной полостях, очаговую пневмонию, точечные кровоизлияния под легочной плеврой.
На 10-й день после заражения (при отсутствии гибели) животных убивают и проводят следующий пассаж на этом же виде животных по общепринятой методике, используя для заражения центрифугат 10 %-иой суспензии из паренхиматозных органов.
Результаты исследования считают положительными в случае обнаружения и идентификации хламидий в патматериале от животных, павших на 7—10-й день после заражения, в любом из трех последовательных пассажей.
2.3. И д е и т и ф и к а ц и я хламидий. Идентификацию хламидий проводят путем их обнаружения в мазках-отпечатках из патологического материала от павших куриных эмбрионов или лабораторных животных методами световой микроскопии или иммунофлуоресценции (согласно п. 2.1).
3. Серологические исследования.
3.1. Серологические исследования на хламидийные инфекции основаны на выявлении специфических антител в сыворотке крови животных реакцией связывания комплемента (РСК) или реакцией длительного связывания комплемента (РДСК); у абортировавших животных — на установлении нарастания титра антител в 2 и более раз.
Животных, вакцинированных против хламидийного аборта, серологически не исследуют.
3.2. В РСК (РДСК) используют следующие компоненты: ком-плементсвязывающий группоспецифический хламидийный антиген; контрольный антиген; позитивную (иммунную) сыворотку крови
овец, содержащую группоспецифические хламидийные антитела; негативную (отрицательную) сыворотку крови овец; комплемент (свежая, консервированная или лиофильно высушенная сыворотка крови морской свинки); гемолизин (сыворотка крови кролика, иммунизированного эритроцитами барана); эритроциты барана; испытуемые сыворотки; физиологический раствор.
Специфический и контрольный антигены, позитивную и негативную сыворотки изготавливают биофабрики, вып>скающие их в специальных наборах.
Антиген применяют в РСК (РДСК) в рабочих титрах, указанных на этикетке.
3.3. Гемолизин в РСК используют в удвоенном титре (например, при титре гемолизина 1 ; 1000 его берут 2 : 1000), а в РДСК — в утроенном.
3.4. Эритроциты барана отмывают физиологическим раствором путем центрифугирования при 2,5—3 тыс. об/мин в течение 10 — 15 мин до полной прозрачности надосадочной жидкости.
Для РСК применяют 2,5 %-ную, для РДСК —3 %-ную взвесь эритроцитов из осадка.
Перед работой взвесь эритроцитов и гемолитическую сыворотку в рабочем разведении смешивают в равных объемах, полученную гемолитическую систему ставят в термостат при 37 °С на 20—30 мин для сенсибилизации. Во время работы гемолитическую систему хранят при комнатной температуре или в холодильнике при 2—4°С.
3.5. Для серологического исследования пригодны лишь свежие испытуемые сыворотки. Допускаются к исследованию и замороженные (однократно), а также консервированные борной кислотой (2 % к объему) или мертиолятом (1 : 10 000) сыворотки. Мутные, проросшие или гемолизированные сыворотки для исследования непригодны.
3.6. Физиологический раствор для разведения компонентов (0,85 %-ный раствор химически чистого хлорида натрия в дистиллированной воде, pH 7,2—7,4) готовят и кипятят в течение 5 мин за день или в день постановки реакции.
3.7. Постановка реакции связывания комплемента (РСК).
Комплемент титруют каждый раз перед постановкой главного опыта на позитивной, негативной и 1—2 испытуемых сыворотках.
3.7.2. Титрование комплемента. Сухой биофабричный комплемент растворяют физиологическим раствором до первоначального объема, указанного на этикетке, и готовят основное разведение 1 :20.
Каждую сыворотку, разведенную 1:5 (1 мл сыворотки+ 4 мл физиологического раствора) и инактивированную при 58—60 СС 30 мин, разливают по 0,2 мл в два ряда пробирок штатива Флоринского.
Титрование комплемента начинают с дозы 0,02 до 0,2 мл с интервалом по 0,02 мл. Для этого в дополнительный ряд пробирок вносят комплемент (разведенный 1 :20) в дозах 0,2; 0,4; 0,6 и т. д. до 2,0 мл и добавляют в каждую пробирку недостающее до 2 мл количество физиологического раствора, т. е. 1,8; 1,6; 1,4 н т. д. Затем из первого разведения комплемента переносят по 0,2 мл в первые пробирки всех сывороток, из второго разведения соответственно во вторые и т. д. (это можно выполнять аппаратом Флоринского с мерными пипетками по 0,2 мл). В первые ряды пробирок с поэм*
3.7.1. Реакцию ставят в объеме 1 мл (по 0,2 мл каждого компонента).