Выделение и идентификация штаммов синегнойной палочки из клинического материала (методические рекомендации)
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
Общие сведения о бактериях рода PSEUDOMONAS
Характеристика и идентификация культур синегнойной палочки
Способы взятия и посева исследуемого материала
Схема и методика исследования материала
Типирование штаммов синегнойной палочки
Определение чувствительности Рs. Aeruginosa к антибактериальным веществам
Приложение. Основные методы, используемые для определения биохимических свойств Рs. Aeruginosa
Дифференциально-диагностические тесты бактерий рода PSEUDOMONAS
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
Организации:
| 17.01.1988 | Утвержден | Управление лечебно-профилактической помощи Минздрава СССР | 10 11-10 |
|---|---|---|---|
| Разработан | Институт эпидемиологии и микробиологии им. Н.Ф. Гамалеи АМН СССР |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17

стр. 18
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР
ГЛАВНОЕ УПРАВЛЕНИЕ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЙ ПОМОЩИ
УТВЕРЖДАЮ Зам. Начальника Главного управления лечебно-профилактической помощи Минздрава СССР
Г. А. ДОВГИЛЕВИЧ 17 января 1983 г.
М 10 11—10 28-1-83 г.
ВЫДЕЛЕНИЕ И ИДЕНТИФИКАЦИЯ ШТАММОВ СИНЕГНОЙНОИ ПАЛОЧКИ ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА
(МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ)
1984 г.
Москва
Методические рекомендации составлены в Институте эпидемиологии и микробиологии им. Н. Ф. Гамалеи АМН СССР А. Ф. Мороз, Б. М. Бекбергеновым, Н. Г. Анциферовой.
2
разведений и критерии оценки показателей чувствительности или резистентности тест-микробов приведены в методических указаниях «по применению унифицированных методов определения чувствительности микроорганизмов к химиотерапевтическим веществам», утвержденных приказом Министра здравоохранения СССР № 250 от 13 марта 1975 г.
На этом анализ исследуемого клинического материала заканчивают и выдают ответ.
Таким образом, поэтапность идентификации и тииирова-ния культур синегнойной палочки может быть кратко представлена следующим образом:
I стадия: — определение рода микроорганизма — Pseudomonas (образование цитохромоксидазы, аргининдегидрола-зы, окисление глюкозы в аэробных условиях).
II стадия — определение вида микроорганизма — Ps. aeruginosa (образование пигментов пиоцианина или пиорубина, рост при +42° С, гидролиз ацетамида, восстановление нитратов в нитриты, а последние до газообразного азота).
III стадия — типирование идентифицированных штаммов Ps. aeruginosa с эпидемиологическими целями (серо-, пиоци-но- и фаготипирование).
IV стадия — определение антибиотикограмм выделенных штаммов Ps. aeruginosa (методом диффузии в агар с использованием набора бумажных дисков—качественное определение и методом серийных разведений антибактериальных веществ в бульоне или агаре (количественное определение).
11
ПРИЛОЖЕНИЕ
Основные методы, используемые для определения биохимических свойств PS. AERUGINOSA
1. Определение продукции пиоцианина. Исследуемую культуру засеять в пробирку с 4,0 мл жидкой питательной средой (мясо-пептонный бульон, бульон Хоттингера, 1% пеп-гонную воду) и инкубировать в течение 18—24 часов при 37° С. При слабом помутнении бульона, отсутствии придонного роста и поверхностной серебристой пленки необходимо продолжить инкубирование культуры в термостате до 3-х суток. Затем к бульонной культуре добавить 1 —1,5 мл хлороформа и довести pH до 7,8—8,0, после чего пробирку сильно встряхнуть. Синее окрашивание осевших на дно капель хлороформа свидетельствует о наличии пиоцианина и является абсолютным доказательством принадлежности данного микроорганизма в виду Ps. aeruginosa.
2. Цитохромоксидазный тест, а) Приготовить смесь, состоящую из 3-х частей 1% водного раствора диметилпарафе-нилендиамииа гидрохлорида (или парааминодиметиланила-иилина гидрохлорида или оксалата) и 2-х частей 1% спиртового раствора а-нафтола. Приготовленную смесь нанести каплями на выросшие на чашке колонии. Колонии, образующие фермент цитохромоксидазу, в течение 20—30 секунд становятся темно-сипнми.
б) Суточную агаровую культуру нанести в виде штриха платиновой петлей или стеклянной палочкой на диски или полоски фильтровальной бумаги (ватман ЗММ), пропитанные смесью, состоящей из тстрамстилпарафенилендиамина дигидрохлорида — 3 части и а-нафтола — 2 части. При положительной реакции появляется синяя окраска в течение 30 секунд.
3. Окисление глюкозы. Для определения способности культур синегнойной палочки к окислительному усвоению глюкозу (окисление без ферментации) исследуемую культуру засеять в 2 пробирки с 4 мл среды Хью Лейвсена или Гисса с глюкозой, в одну из которых предварительно наслаивают 0,5 мл стерильного вазелинового масла. Пробирки инкубировать в течение 24—48 часов, хотя положительная реакция, сопровождающаяся изменением цвета индикатора, в подавляющем большинстве случаев отмечается в первые сутки. Штаммы синегиойной палочки образуют кислоту без газа
в аэробных условиях, в анаэробных условиях ферментации углевода нет.
4. Гидролиз (разжижение) желатины.
а) Исследуемую культуру петлей засеять уколом в столбик питательной желатины. Инкубировать при температуре 22°С в течение 30 дней с ежедневным наблюдением за ростом и наличием эффекта разжижения.
б) Культуру засеять уколом в столбик питательной желатины и инкубировать при 37° С в течение 14 дней. Каждые 2—3 дня пробирку с культурой охлаждать в холодильнике в течение 2 часов и наблюдать наличие разжижения. Параллельно с опытной пробой все те же манипуляции провести с контрольной пробиркой со столбиком желатины, не засеянной тест-культурой.
в*) Культуру засеять на косяк или чашку с желатиновым агаром и инкубировать в течение 3-х дней при 37° С. Затем поверхность агара с областью бактериального роста оросить (смочить) 5—10 мл 1% раствора ртутно-хлористой кислоты. Образовавшаяся вокруг выросшей культуры светлая зона свидетельствует о наличии области гидролиза желатины.
5. Восстановление нитратов.
а) Культуру петлей засеять в нитратный бульон и инкубировать в течение 5 суток. Отмечать любое появление газа в поплавке. Добавить 1 мл нитрит-реагента А, затем 1 мл реагента В (Реагент А — 0,8% раствор сульфаниловой кислоты в 5н уксусной кислоте; Реагент В —0,6% раствор ди-метил-а-нафтиламина в 5н уксусной кислоте или 0.5%' а-нафтиламина в 5н уксусной кислоте; реагенты смешиваются путем легкого нагревания). Красное окрашивание, появившееся после добавления этих реагентов, указывает на присутствие нитритов и выявляет восстановление нитратов. Если красное окрашивание не появляется в течение 5 минут, в пробирку добавить порошкообразный цинк (5 мг на 1 мл) и дать постояь. Наличие красного окрашивания свидетельствует о присутствии нитрата в среде, т. е. его восстановления микроорганизмом не произошло. Если красное окрашивание отсутствует, это указывает на восстановление нитратов до нитритов с дальнейшей редукцией последних до газообразного азота. 5-дневная инкубация в ряде случаев необязательна. Необходимо лишь ежедневно испытывать исследуемый образец и повторно инкубировать в случае восстановления нитрата.
б) Brough использовал небольшие объемы (1 мл в пробирке размерами 75X10 мм) среды (0,1% KN03 в питательном бульоне), которую необходимо нагреть до 37°С перед
13
засевом густой суспензии исследуемой культуры и после этого быстро помещать в водяную баню при 37° С. Через 15 минут испытывают, добавляя 3 капли сульфанилового и 3 капли а-нафтиламинового реагентов.
в) Микрометод. Приготовить суспензии из предварительно выраженных в течение 18—24 часов на одной из плотных питательных исследуемых штаммов и добавить 0,04 мл их к смеси следующего состава: 0,05% NaNC>3 — 0,04 мл,
0.025М фосфатный буфер pH = 6,8—0,04 мл. Полученную смесь инкубировать в водяной бане при 37° С в течение 1 часа, после чего добавить 0,06 мл реагента А для испытания нитритов и 0,06 мл реагента В (диметил-а-нафтиламина). Встряхнуть и наблюдать 1—2 минуты за появлением розового окрашивания, свидетельствующего о наличии нитритов. При осуществлении этой реакции в качестве контрольного используется образец бездобавления микробной взвеси для исключения наличия примесей нитритов в субстрате.
6. Восстановление нитритов.
Суточную агаровую тест-культуру засеять петлей в нит-ритный бульон (0,1 % KN02 в питательном бульоне) и инкубировать в течение 7—12 дней. Затем добавить реагенты, рекомендованные выше для выявления нитритов. В случае появления красного окрашивания реакция отрицательная. Отсутствие окрашивания указывает на восстановление нитритов данным микроорганизмом.
Рекомендуемые питательные среды
— 4,0 г
— 100 мл
— 1000,0 мл
1. Среды с желатиной а) Желатиновый агар
Желатина
Дистиллированная вода. Питательный агар
Желатину поместить в дистиллированную воду и оставить для набухания на 15—30 минут. Медленно нагревая, растворить желатину и раствор прибавить к расплавленному питательному агару. Довести pH до 7,0, разлить в пробирки по 5,0 мл и стерилизовать при 115° С в течение 20 минут.
— 3,0 г
— 5,0 г
— 120,0 г
б) Питательная желатина:
Мясной экстракт
Пептон
— 1000,0 мл
Желатина
Вода дистиллированная
14
Добавить желатину к воде и оставить для набухания в течение 15—30 минут. Медленно нагревая, растворить желатину, добавить и растворить остальные компоненты среды. Довести pH до 7,0, разлить по 5,0 мл в пробирки и стерилизовать при 115° С в течение 20 минут.
2. Среда для усиления пигментообразования:
Среда Кинг А (для образования пиоцианина)
Пептон —20 г
Глицерин — 10 г
Калий сернокислый — 10 г
Магний хлористый — 1,4 г
Агар-агар — 20 г
Вода дистиллированная — 1000 мл
Среду стерилизуют при 115° С в течение 20 минут
3. Среда с ацетамидом
Натрий хлористый — 5,0 г
Магний сернокислый — 0,2 г
Аммоний фосфорнокислый
одноэамещенный — 1,0 г
Калий фосфорнокислый двузамещенный — 1,0 г
Ацетамид — 20,0 г
Агар-агар — 15,0 г
Вода дистиллированная — 1000,0 мл
рН = 6,7±0,1
Стерилизовать в автоклаве при 120° С 20 минут
Тесты для определения аргининдегидролазы, лизиндекар-боксилазы и орнитиндекарбоксилазы:
Полоски бумаги (ватман ЗМ) размером 0,5X5,0 см пропитываются 0,03 М растворами аминокислот и подсушиваются.
Аргинин-НС1 — 63 мг+10 мл фосфатного буфера 0.0125М
pH = 5,0
Лизин-НС1 —54 мг+10 мл То же
Орнитин-НС1 — 40 мг+10 мл — » —
Приготовление фосфатного буфера:
1,19 г NaHPO*X2H20+ 100 мл диет, воды (1) 1/15 М р-р 900 мг КН2РО4+Ю0 мл диет, воды (II) 1/15 М р-р 2 мл (I) +18 мл (II) — фосфатный буфер pH 5,91 (III) 1/15 М
J0 мл (III)+40 мл диет, воды —50 мл 0,0125 М р-р pH = 5,0
15
Ход реакции:
Приготовить густую суспензию исследуемой культуры и разлить ее в 3 агглютинационныс пробирки. Затем в эти пробирки поместить бумажные полоски, пропитанные соответственно аргинином, лизином или ориитином и инкубировать при 37° С в термостате в течение 2-х часов, после чего в каждую пробирку добавить по 1—2 капли 0,04% раствора индикатора бромкрезол-пурпура. В случае ферментации аминокислоты окраска фильтровальной бумажки становится фиолетовой, в отрицательном случае — желтой.
— 2,0 г
— 5,0 г
— 0,3 г
— 3,0 г
— 1000,0 мл
— 15,0 мл 0,2%. водного раствора.
5. Среда Хью Лейвсена
Пептон
Натрий хлористый Калий фосфорнокислый двузамещенный Агар-агар
Вода дистиллированная Бромтимоловый голубой
Стерилизовать при 115° С 20 минут. Добавить стерильный раствор глюкозы (или другого углевода) до концентрации 1%, тщательно смешать и разлить по 10 мл в пробирки диаметром не более 10 мм.
6. Селективная среда для выделения культур Ps. aeruginosa
(А. Ф. Мороз, Б. М. Бекбергенов, Г. Е. Афиногенов. 1976)
Пептон ферментативный — 20.0 г
Калий сернокислый — 7,0 г
Магний .хлористый — 1,5 г
Магний сернокислый — 1,5 г
N-цетилпиридиний хлорид —2,0 г
(Киевский з-д РИАП)
Агар-агар — 10,0 г
Вода дистиллированная — 1000,0 мл
pH = 6,8—7,0
Среду довести до кипения, кипятить 2—3 минуты и разлить по чашкам.
16
В настоящее время благодаря широкому повсеместному применению антибиотиков с профилактическими и лечебными целями произошло изменение этиологической структуры многих бактериальных инфекций, вследствие замещения ранее ведущих возбудителей гнойных ран кокковой флоры штаммами, обладающими приобретенной в процессе лечения или природной резистентностью к антибактериальным препаратам. Все более четко намечается стирание грани между патогенными и условнопатогенными или непатогенными для организма человека и животных микробами, наблюдается увеличение числа внутрибольничных и «оппортунистических» инфекций.
В этой сложившейся на сегодняшний день ситуации прослеживается тенденция к значительному возрастанию удельного веса синегнойной палочки на фоне других известных возбудителей серьезных септических осложнений, имеющих место особенно часто у ожоговых и хирургических больных. Синегнойная инфекция у этих контингентов больных носит, как правило, внутрибольничный характер, что доказывается значительным увеличением частоты выделения Ps. aeruginosa от больных в процессе пребывания их в стационаре, а также результатами типирования штаммов синегнойной палочки, обнаруженных у больных и во внешней среде отделений.
В настоящее время назрела необходимость унифицировать методы лабораторных исследований по выделению и идентификации этого микроорганизма с учетом ряда рекомендаций подкомитета по Pseudomonaceae и родственным микроорганизмам при Международном комитете по систематике бактерий. Все это послужило основанием для составления настоящих методических рекомендаций по выделению и идентификации клинических штаммов.
Общие сведения о бактериях рода PSEUDOMONAS
Род Pseudomonas насчитывает около 200 видов, большинство из которых не представляет никакого значения для медицины. Морфологически бактерии этого рода являются грамотрицательными, подвижными, прямыми или слегка
3
изогнутыми палочками, не образующими спор напоминающие по своей форме клетки представителей Enterobacteria-сеае.
Бактерии рода Pseudomonas не требовательны к источникам питания. Они хорошо растут на обычных питательных средах и некоторых минеральных средах, не содержащих ростовых факторов и включающих ионы аммония в качестве единственного источника азота и глюкозу в качестве источника углерода и энергии. Меньшее число представителей этого рода нуждается в витаминах в качестве факторов роста.
Представители рода Pseudomonas отличаются высокой ферментативной активностью и разлагают разнообразные белки и жиры. Углеводы они ферментируют сравнительно редко и усваивают их путем окисления. Большинство псевдомонад является облигатными аэробами, хотя некоторые из них представляют собой факультативные анаэробы, осуществляющие процесс дыхания в анаэробных условиях в присутствии таких субстратов как аргинин или нитраты (последние являются акцепторами электронов).
Все виды, входящие в этот род, каталазо-положительны, дают отрицательные реакции на индол, не реагируют с метиловым красным и не образуют ацетилметилкарбинола. Большинство представителей рода Pseudomonas за небольшим исключением дает строго положительную реакцию на цитохромоксидазу.
Среди достаточно большого числа микроорганизмов, входящих в род Pseudomonas наибольшую важность для медицины и ветеринарии представляют виды Ps. mallei, Ps. aeruginosa. Большой неожиданностью было установление огромной потенциальной опасности еще одного представителя этого рода — Ps. pseudomallei. Другими представителями этого рода, встречающимися в исследуемом материале больных, являются Ps. fltiorescens, Ps. cepacia, Ps. putida, Ps. alcali-genes.
По сравнению с синегнойной палочкой они характеризуются достаточно низким уровнем вирулентности и ограниченной инвазивностью для организма здорового человека, но с появлением предрасполагающих факторов, ослабляющих защитные силы организма, эти псевдомонады также могут вызывать интенсивные гнойные поражения.
Характеристика и идентификация культур синегнойной палочки
Культуры синегнойной палочки образуют синий или зеленовато-синий, или фиолетовый пигменты, проникающие в
субстраты. Один из них — пиоцианин, дающий синюю или сине-зеленую окраску, растворим в воде. Другой — флюорес-цеин — дает зеленовато-желтое окрашивание, флюоресцирующее в проходящем свете и Уф-лучах.
Пиоцианин образуют только штаммы синегнойной палочки, другие представители рода Pseudomonas могут образовывать флюоресцеин.
Пиоцианин можно легко экстрагировать из питательного агара или бульона, на которых выращены штаммы синегнойной палочки, с помощью хлороформа.
Для стимуляции синтеза пиоцианина, переходящего в среду и окрашивающего ее в сине-зеленый цвет вокруг колоний синегнойной палочки, применима среда Кинг А. На этой среде образуется также другой пигмент — пиорубин, дающий красное окрашивание. Образование этого пигмента также характерно для некоторых штаммов синегнойной палочки.
При выращивании культур синегнойной палочки на среде Кинг Б усиливается образование пигмента флюоресцеина. В зависимости от условий роста и состава питательной среды эти пигменты образуются в различных количественных соотношениях и поэтому окраска культуральной среды может меняться. Иногда какой-либо из этих пигментов может утрачиваться совсем (чаще пиоцианин).
Способы взятия и посева исследуемого материала
Немаловажную роль при осуществлении анализа микрофлоры играет способ взятия исследуемого материала, подлежащего бактериологическому исследованию. Техника взятия и первичного посева клинического материала на наличие в нем культур синегнойиой палочки должны быть те же, что и при лабораторной диагностике возбудителей других бактериальных кишечных и гнойно-воспалительных инфекций. Однако при взятии материала для исследования следует соблюдать и учитывать следующие важные моменты:
1. Брать исследуемый материал желательно до начала лечения больного антибактериальными препаратами или же, если таковое начато, то только после того, как применяемый препарат будет выведен из организма.
2. Материал, предназначающийся для бактериологического исследования на присутствующую в нем микрофлору, должен быть взят непосредственно из очага инфекции с соблюдением всех необходимых правил асептики (стерильными инструментами, тампонами, в стерильную посуду и т. д.).
3. В случаях, когда взятие материала непосредственно из очага инфекции осуществить невозможно, но он сообщается с внешней средой, производят исследование соответствующего отделяемого, к примеру мочи при пиелонефрите, мокроты при пневмонии, отделяемого цервикального канала или влагалища при воспалении гениталий и др.
4. Посев взятого от больного материала осуществляется на соответствующий набор элективных питательных сред, предназначающихся для выделения различных видов микроорганизмов в виде чистых культур. Это обусловлено прежде всего тем, что нередко в исследуемом материале присутствует главным образом смешанная флора, среди которой важно выявить истинного возбудителя заболевания.
Схема и методика исследования материала
Первый день: Гной, отделяемое ран, мокроту, слизь и др. засевают непосредственно на элективные и селективные среды 5% кровяной агар, агар Эндо, 1,5% МПА, ЦПХ-агар. Смывы с поверхности предметов, рук медперсонала, аппаратуры, инвентаря и др. Засевают для накопления в мясо пеп-тонный бульон или бульон Хоттингера при температуре 37° С в течение 18—24 часов. Затем содержимое пробирки в количестве 0,2 мл высевают на чашки с селективными средами, тщательно втирая шпателем.
Исследуемый материал, взятый с объектов внешней среды, после его посева на 1,5% МПА, кровяной агар и селективные среды инкубируют 16—18 часов при температуре 42°С. Посевы из раневого отделяемого инкубируют 16— 18 часов при температуре 37° С.
Второй день: Отмечают наличие или отсутствие роста культур синегнойной палочки на жидких и плотных питательных средах. При выращивании культур синегнойпой палочки в бульоне в течение 18—24 час. образуется гомогенная взвесь с сероватой серебристой пленкой на поверхности среды.
Засеянные накануне исследуемым материалом агаровые чашки просматривают и отмечают колонии, подлежащие дальнейшему изучению. На обычных питательных средах различают 5 морфологических типов колоний синегнойной палочки: 1 — плоские колонии неправильной формы; 2 — колонии, напоминающие кишечную палочку; 3 — складчатые («цветок маргаритки»); 4 — мукоидные — редко даюг пигментацию при первичном выделении, а образующийся слизистый налет со временем приобретает зеленую окраску; 5 —
6
карликовые колонии, формирующиеся при инкубировании посевного материала при 37° С неменее, чем в течение 18 часов. Рост Ps. aeruginosa на агаризованной среде часто сопровождается феноменом радужного лизиса, который характеризуется наличием нежного блестящего металлического палета и зон лизиса. В 80—90% случаев вокруг выросших на кровяном агаре колоний синегнойной палочки выявляется четкая зона гемолиза. На среде Эндо культуры синегнойной палочки образуют бледнорозовые колонии небольших размеров.
Примерно 75% выделенных культур Ps. aeruginosa можно идентифицировать на второй день по морфологии колоний, наличию роста на селективных средах и образованию сине-зеленого пигмента, являющегося уникальным признаком культур синегнойной палочки. Беспигментные колонии пересевают на среду Кинг А.
Беспигментные колонии (с каждой чашки не менее трех колоний, одинаковых по виду) отбирают и суспендируют в 0,5 мл физиологического раствора, а затем отсевают на следующие среды: Кинг А, на среду Хью Лейвсена или среду Гисса с глюкозой и последующей инкубацией в аэробных и анаэробных условиях, на среды с желатиной, с аргинином (инкубация в аэробных и анаэробных условиях), нитратный и нитритный бульоны, ацетамидный агар и на любую обычно принятую питательную среду с целью выявления способности роста при 42° С и 5° С (для дифференциации культур Ps. aeruginosa и Ps. fluorescens).
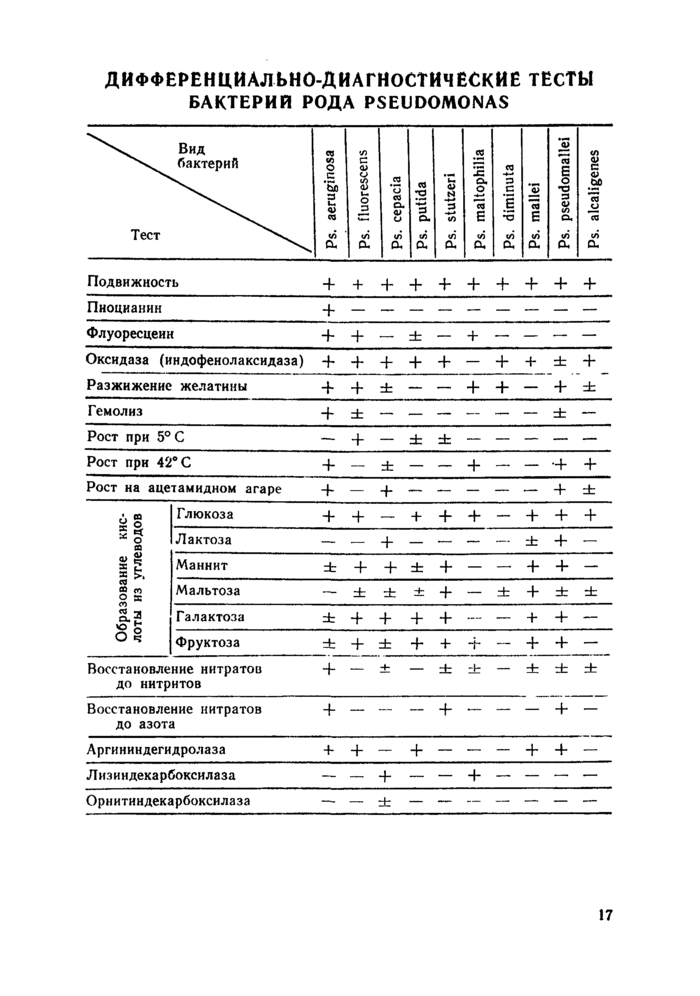
Третий день: Учитывают результаты ряда биохимических тестов. Культуры синегнойной палочки характеризуются ци-тохромоксидазной активностью (постановку реакции см. в разделе «Приложение») и обладают слабой сахаролитической активностью, расщепляя только глюкозу с образованием кислоты без газа в аэробных условиях, протеолитически активны: разжижают желатину, образуют аммиак из аргинина в аэробных условиях, восстанавливают нитраты и нитриты. а последние редуцируют до газообразного азота. Окончательный учет результатов некоторых биохимических тестов осуществляется в более поздние сроки (см. раздел «Приложение»). Дифференциальные биохимические характеристики, присущие бактериям рода Pseudomonas представлены п приложении (табл. 1).
При исследовании материала, взятого не из кишечника, необходимо подробное микроскопическое изучение беспигментных и малопигментированных форм. При просматривании мазков необходимо учитывать, что штаммы сииегнойной
7
палочки грамотрицатсльны. Размеры клеток. Ps. aeruginosa варьируют в пределах 1,5—3,0X0,4—0,6 мкм. В мазках клетки синегнойной палочки располагаются одиночно, парами или короткими цепочками, они подвижны и являются моно- или лофотрихами, спор не образуют, продицируют слизь, окружающую микробную клетку тонким слоем.
Характерным признаком культур синегнойной палочки является образование ими специфического ароматного запаха. Выделяемый клетками Ps. aeruginosa триметиламнн напоминает запах жасмина у типичных штаммов и может давать неприятный запах с аммиачным отенком при росте атипичных культур.
Основными дифференциальными признаками, различающими между собой штаммы Ps. aeruginosa и культуры одного из наиболее распространенных видов флюоресцирующих псевдомонад—Ps. fiuorescens являются гермофильность бактерий вида Ps. aeruginosa (наличие роста при 42° С и отсутствие роста при 5° С) и их способность утилизировать ацетамид.
Типирование штаммов синегнойной палочки
После осуществления биохимической идентификации культур Ps. aeruginosa с помощью ряда необходимых для этих целей тестов, при необходимости проведения эпидемиологического анализа производится типирование выделенных штаммов. Для типироваиия клинических культур синегнойной палочки используют 3 основных метода: серо-, пиоцнно-и фаготипированис. Сочетанное использование этих методов позволяет с большой точностью (в 90% случаев) установить наличие в клинике госпитальных штаммов Ps. aeruginosa и проследить их распространение внутри клинического учреждения.
1. Серологическое типирование культур Ps. aeruginosa
производится методом агглютинации на стекле с использованием набора, состоящего из поливалентных сывороток к 12 групповым 0-антигенам или с 23 адсорбированными сыворотками к 23 факторам 0-антигена. Сыворотки выпускаются в Днепропетровске предприятием по производству бак. препаратов и используются для типироваиия в соответствии с «наставлением по применению».
Серологическое типирование культур синегнойной палочки достаточно легко и четко воспроизводимый метод, и днффе-рснция штаммов с его помощью достаточно стабильна из-за моноспецифичности серологических типов. Этот метод исполь-
8
зуется, главным образом, для следующих целей: 1) выявления наличия или отсутствия штамов синегнойной палочки преобладающих серотипов; 2) обнаружения идентичности штаммов, выделенных от больных и из окружающей среды; 3) выявление доминирования штаммов специфических серотипов в определенный период времени.
2. Пиоцинотипирование штаммов Ps. aeruginosa по продукции ими бактериоцинов — пиоцинов (аеругиноцинам). используя метод Jones, т. е. разделение их на пиоцинотипы, основывается на использовании 2-х основных методических принципов: 1) продукции или активности пиоцинов неизвестных штаммов в отношении набора инфикаторных штаммов Ps. aeruginosa и 2) по чувствительности неизвестных штаммов к набору индикаторных пиоцинов.
Пиоцинотипирование культур синегнойной палочки базируется на следующих положениях: 1) пиоцины различных
штаммов синегнойной палочки по-разному действуют на набор индикаторных штаммов этого возбудителя; 2) штамм-продуцент пиоцина резистентен к продуцируемым им пиоци-нам; 3) различные штаммы синегнойной палочки обладают и различной чувствительностью к набору индикаторных пиоцинов, а идентичные штаммы должны обладать одинаковой чувствительностью к такому набору. Методы определения активности пиоцинов подразделяются на 2 основные группы в зависимости от способа их получения: в жидкой или на плотной питательных средах. Наиболее часто для этих целей используется метод Farmer и Herman (1969), заключающийся в следующем: выделяемые тест-штаммами синегнойной палочки в питательный бульон пиоцины вносятся в лунки штампа-репликатора и наносятся с его помощью на чашки, засеянные газоном индикаторного штамма Ps. aeruginosa. На следующий день учитываются зоны ингибиции роста пио-цинами индикаторных штаммов. Недостатком метода является присутствие бактериофагов в пиоцинолизатах, что затрудняет учет результатов и отрицательно сказывается на репродуцибельности метода.
3. Фаготипирование выделенных культур синегнойней палочки основывается на типировании по чувствительности к наборам типовых бактериофагов. С помощью нескольких предложенных учеными разных стран систем фаготипирова-ния удается типировать 70—95% культур синегнойной палочки. В большинстве стран фаготипирование выделенных культур Ps. aeruginosa проводят с помощью набора 20 типовых бактериофагов системы Lindberg на плотной питательной среде (1,5% МПА) с использованием штампа-репликато-
9
ра. При отборе фагов, используемых в наборах, обязательно должны учитываться следующие показатели: 1) процент ти-пируемых с их помощью штаммов; 2) способность данного набора фагов разделять типируемые штаммы на фаготипы;
3) среднее количество литических реакций на тест-штаммах;
4) воспроизводимость результатов. Bergan в 1972 г. предложил новую схему типирования культур синегнойной палочки, преимуществом которой является то, что фаготип каждого штамма представлен небольшим количеством фагов. Новая схема состоит из основного набора фагов, включающего 15 фагов, лизирующих 12,0±8,6% культур синегнойной палочки, и дополнительного набора из 5 фагов, лизирующих 31 ±11% культур.
Использование с целью типирования культур синегнойной палочки комбинаций 2-х — 3-х методов позволяет получить более достоверные и четкие результаты за счет повышения разделительной способности каждого из них.
Определение чувствительности Ps. aeruginosa к антибактериальным веществам
Поскольку штаммы синсгнойиой палочки характеризуются в целом высокой природной резистентностью к большинству широко применяемых в клинике антибактериальных агентов, что значительно затрудняет лечение инфекций, обусловленных этими возбудителями, то выделенные из клинического материала и идентифицированные по определенным тестам микроорганизмы исследуются на чувствительность к препаратам, имеющим широкий спектр антибактериальной активности. Химиотерапия того или иного заболевания зависит от правильного выбора соответствующего лечебного препарата, поэтому для рационального и своевременного назначения химиотерапевтических препаратов необходимо располагать данными (не только качественными, но и количественными) о чувствительности возбудителя инфекции к набору антибактериальных агентов.
Определение чувствительности Ps. aeruginosa к химиотерапевтическим препаратам в настоящее время может осуществляться методом диффузии в агар с применением бумажных дисков или методом серийных разведений препаратов в плотной и жидкой питательных средах. Иыбор метода зависит от цели исследования и возможностей лаборатории, выполняющей исследование.
Эти методы, а также схемы приготовлении необходимых концентраций антибактериальных веществ методом серийных
10