Методические рекомендации
Диагностика и санация стафилококковых бактерионосителей
Купить Методические рекомендации — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
В методических рекомендациях представлена принципиально новая схема лабораторной диагностики стафилококковых бактерионосителей: цитоскопический метод выявления бактерионосителей стафилококков; питательная среда, позволяющая выделять стафилококки с персистеными свойствами; способ дифференциации стафилококковой микрофлоры, основанный на определении у штаммов, вьделенных от бактерионосителей, факторов персистенции; предложены новые средства санации: масляный раствор витамина А, микроклимат спелеошахты, препарат электролизного водного раствора гипохлорита натрия.
Методические рекомендации предназначены для бактериологов, эпидемиологов, инфекционистов и врачей других специальностей
Оглавление
Введение
Диагностика стафилококковых бактерионосителей
Цитоскопический метод
Бактериологический метод
А. Выделение чистой культуры стафилококка с персистентными свойствами путем посева на элективную питательную среду с фузидином
Б. Идентификация чистой культуры: определение резидентной стафилококковой микрофлоры
1. Реактивы, приборы, стекло
2. Определение свойств стафилококков
2.1. Чувствительность к фузидину
2.2. Антилизоцимная активность (АЛА)
2.3. Антиинтерфероновая активность (АИА)
2.4. Антикомплементарная активность (АКА)
3. Оценка штаммов стафилококков (вид, экотоп)
Заключение
Санация стафилококковых бактерионосителей
Санация раствором витамина А
Санация микроклиматом спелеошахты
Санация препаратом электролизного водного раствора гипохлорита натрия
Заключение
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2018 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 06.04.2001 | Утвержден | Главный государственный санитарный врач Российской Федерации | |
|---|---|---|---|
| Разработан | Оренбургская государственная медицинская академия | ||
| Разработан | УрО РАН | ||
| Издан | Федеральный центр Госсанэпиднадзора Минздрава России | 2001 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10
стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
Министерство здравоохранения Российской Федерации Департамент государственного санитарно-эпидемиологического надзора М3 РФ
Диагностика и санация стафилококковых бактерионосителей
Методические рекомендации
Москва • 2001
Диагностика и санация стафилококковых бактерионосителей
Методические рекомендации
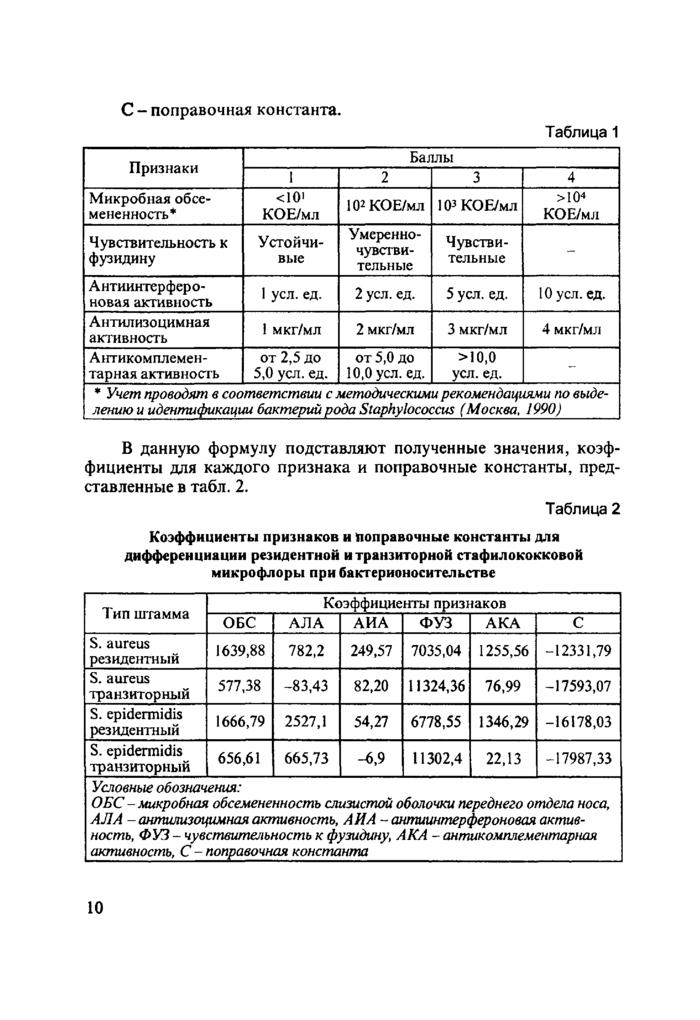
С - поправочная константа*
|
Таблица 1 | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
|
* Учет проводят в соответствии с методическими рекомендациями по выде-лению и идентификации бактерий рода Staphylococcus (Москва. 1990)_ | ||||||||||||||||||||||||||||||||||
В данную формулу подставляют полученные значения, коэффициенты для каждого признака и поправочные константы, представленные в табл. 2.Таблица 2
Тип штамма
Коэффициенты признаков
ОБС
АЛА
АИА
ФУЗ
АКА
С
S. aureus резидентный
1639,88
782,2
249,57
7035,04
1255,56
-12331,79
S. aureus транзиторный
577,38
-83,43
82,20
11324,36
76,99
-17593,07
S. epidermidis резидентный
1666,79
2527,1
54,27
6778,55
1346,29
-16178,03
S. epidermidis транзиторный
656,61
665,73
-6,9
11302,4
22,13
-17987,33
Условные обозначения:
ОБС-микробная обсемененностъ слизистой оболочки переднего отдела носа, АЛА - антилизоцимная активность, АН А - антиинтерфероновая активность, ФУЗ - чувствительность к фузидину, АКА - антикомплементарная активность, С - поправочная константа_
| |||||||||||||||||||||||||||||||||||||||||
|
Условные обозначения: ОБС-микробная обсемененностъ слизистой оболочки переднего отдела носа, АЛА - антилизоцимная активность, АН А - антиинтерфероновая активность, ФУЗ - чувствительность к фузидину, АКА - антикомплементарная активность, С - поправочная константа_ | |||||||||||||||||||||||||||||||||||||||||
Коэффициенты признаков и Поправочные константы для дифференциации резидентной и транзиторной стафилококковой микрофлоры при бактерионосительстве
10
Расчет проводится по всем строкам соответствующей таблицы. Наибольшая величина из всех полученных будет в 95 % случаев соответствовать обозначенному на данной строке типу штамма.
Примеры установления принадлежности штамма к виду (S. aureus или S. epidermidis) и к определенному типу (резидентному или транзиторному):
Пример 1. Исследуемый штамм стафилококка характеризуется следующими показателями: микробная обсемененность Ю4КОЕ/мл (4 балла), антилизоцимная активность - 1 мкг/мл (1 балл), антиин-терфероновая активность - 5 уел. ед. (5 баллов), антиком плементар-ная активность - 2,5 уел. ед. (1 балл), умеренно устойчив к фузидину (2 балла). Расчет математической модели дифференциации штамма по строкам таблицы следующий:
Д| = 1639,88 х 4 + 782,2 х 1 + 249,57 х 5 + 7035,04 х 2 + 1255,56 х 1 +
+ -12331,79 = 11583,42
Д2 = 577,38 х 4 + -83,43 х 1 + 82,20 х 5 + 11324,36 х 2 + 76,99 х I + -17593,07 = = 7769,73
Дз = 1666,79 х 4 + 2527,1 х 1 + 54,27 х 5 + 6778,55 х 2 + 1346,29 х 1 +
+ -16178,03 = 8190,97
Д4 = 656,61 х 4 + 665,73 х 1 + -6,9 х 5 + 11302,4 х 2 + 22,13 х 1 + -17987,33 =
= 7897,27
В результате проведенного расчета максимальная величина установлена на первой строке (ДО, что позволяет отнести исследуемый штамм к виду S. aureus и к резидентному типу.
Пример 2. Исследуемый штамм стафилококка характеризуется следующими показателями: микробная обсемененность 102 КОЕ/мл (2 балла), антилизоцимная активность 2 мкг/мл (2 балла), антиин-терфероновая активность - 2 уел. ед. (2 балла), антикомплементар-ная активность 2,5 уел. ед. (1 балл), чувствителен к фузидину 3 балла. Расчет математической модели дифференциации штамма по строкам таблицы следующий:
Д| = 1639,88x2 + 782,2x2 + 249,57x2 + 7035,04x3 + 1255,56 х 1 +
+ -12331,79= 15372,19
Д2 = 577,38 х 2 + -83,43 х 2 + 82,20 х 2 + 11324,36 х 3 + 76,99 х 1 +
+ -17593,07 = 17609,30
Дз = 1666,79 х 2 + 2527,1 х 2 + 54,27 х 2 + 6778,55 х 3 + 1346,29 х 1 +
+ -16178,03= 14000,23
Д4 = 656,61 х 2 + 665,73 х 2 + -6,9х 2 + 11302,4х 3 + 22,13 х 1 +-17987,33 =
= 18572,88
11
По результатам проведенного расчета наибольшая величина установлена на четвертой строке (Д4), что позволяет отнести исследуемый штамм к виду S. epidermidis и к транзиторному типу.
Заключение
Разработанные способы диагностики стафилококкового бактерионосительства, в основу которых положено выявление штаммов с персистентными характеристиками (антилизоцимная, антиинтерфе-роновая, антикомплементарная активности) позволяют проводить однократное обследование и повысить эффективность диагностики на 15—20 %.
Разработанным цитоскопическим методом обследовано 3307 человек, применение метода позволило повысить частоту выявления стафилококковых бактерионосителей на 14% по сравнению с имеющимся цитоскопическим методом (Стафилококковое носи-тельство: Методические рекомендации: М3 РСФСР.—Свердловск, 1983). Новый метод удобен для экспресс-диагностики при обследовании большого контингента.
Лабораторная апробация селективной среды с фузидином при посеве 303 проб исследуемого материала подтвердила возможность ее использования для выделения стафилококков, обладающих персистентными признаками.
Материалом для оценки диагностической модели при бактерионосительстве служили штаммы стафилококков, выделенные от 8400 человек. Статистическая обработка материала, проведенная посредством системы программ для многомерных критериев показала возможность дифференцировать данным способом резидентную стафилококковую микрофлору от транзиторной среди 95% штаммов, выделенных от бактерионосителей.
Санация стафилококковых бактерионосителей
Предлагаемые средства для санации стафилококковых бактерионосителей: масляный раствор витамина А (А. с. СССР № 1571069 «Способ определения антистафилококковой активности препаратов»), микроклимат спелеошахты (патент РФ №2100994 «Способ санации стафилококковых бактерионосителей»), препарат электролизного водного раствора гипохлорита натрия (патент РФ №2114913 «Способ определения эффективной дозы антисептического препарата, электролизного раствора гипохлорита натрия, для лечения и профилактики гнойно-воспалительных заболеваний»), отличаются от
12
существующих тем, что снижают персистентный потенциал возбудителя. Подавление персистентных свойств стафилококка затрудняет его паразитирование внутри клеток и, тем самым, повышает эффективность санации.
Санация раствором витамина А
Масляный раствор витамина А, являющийся активным антиоксидантом, наряду со снижением персистентных свойств стафилококков, оказывает репаративный и стабилизирующий эффекты на слизистую оболочку переднего отдела носа бактерионосителей. Противопоказаний к применению метода нет. Экспериментально установлена эффективная одноразовая доза масляного раствора витамина А для санации: 6—10 тысяч единиц.
1. Реактивы, приборы, стекчо
1.1. Ватный тампон, укрепленный на проволоке.
1.2. Витамин А - ретинола ацетат 3,44% раствор в масле (Уманский витаминный завод),
1.3. Растительные масла или вазелиновое масло
1.4. Масляный ингалятор
1.5. Пипетки
2. Санация осуществляется следующим образом:
2.1. Для приготовления раствора нужной концентрации витамин А разводят оливковым, персиковым, вазелиновым или растительным маслом в соотношении 1:1. Формы проведения санации следующие:
а) Стерильным ватным тампоном, смоченным в 0,5 мл масляного раствора витамина А, протирают передние отделы носа.
б) Закапывают по 2 капли раствора в каждый носовой ход, используя глазные пипетки, после чего производят легкий массаж передних отделов носа.
в) Ингалируют теплый масляный раствор при помощи масляного ингалятора. Время ингаляции устанавливают экспериментально, учитывая, что за одну ингаляцию в носовые ходы должно поступать не более 0,5 мл масла с содержанием витамина А 6—10 тысяч единиц. (Приготовление раствора для ингалятора ПАИ-2: к 10 мл витамина А добавляют 40 мл оливкового масла, ингаляцию проводят в течение 4 минут).
2.2. Санацию проводят в течение 6 дней. Эффективность санации оценивают на следующий день и через 7 дней после ее окончания при помощи цитоскопического метода.
13
Санация микроклиматом спелеошахты
Микроклимат спелеошахты, наряду со снижением персистент-ных свойств стафилококков, укрепляет антиинфекционную резистентность организма. Показания к применению: данный способ может использоваться для санации бактерионосителей, страдающих аллергическими заболеваниями. Противопоказаний к применению метода нет.
1. Оборудование
1Л. Сиелеошахта с лечебной средой*
• Распылением 20 % раствора хлорида натрия через аппарат типа «Комфорт» в помещении создают лечебную среду: плотность хлористого натрия 3—8 мг/м3, размер частиц 3—8 ммк не менее 70—80 %
• количество кислорода 20,7 %;
• углекислоты 0,03—0,4 %;
• движение воздуха 0,1—0,2 м/с;
• барометрическое давление 750—775 мм рт. ст.;
• число микробных тел в м3 не более 100;
• влажность воздуха 40—60 %;
• температура 20—30 °С.
2. Санация осуществляется следующим образом:
Бактерионосителя помещают в условия микроклимата спелеошахты на 20—30 минут ежедневно в течение 14 дней. По окончании санации проводят контрольное бактериологическое исследование с определением персистентных свойств у выделенных стафилококков. Об эффективности санации судят по отсутствию стафилококков и (или) снижению их персистентных свойств не менее, чем на 20 %.
Санация препаратом электролизного водного раствора гипохлорита натрия
Электролизный водный раствор гипохлорита натрия (в концентрации 1,7—1,9 мг/л) - антисептик, обладающий антимикробным, детоксицирующим, иммуномодулирующим свойствами, его получают при помощи электролиза физиологического раствора на аппарате электрохимической детоксикации организма. При применении данного препарата для санации не отмечается дис-биотических изменений в микробиоценозе слизистой оболочки носовой полости. Противопоказаний к применению метода нет.
14
}. Реактивы, приборы, стекло
1.1. Изотонический раствор хлористого натрия (0,89 %)
1.2. Электрохимический детоксикатор организма «ЭДО-4» (региональный центр научно-технических исследований - РЕГНАТИС, г. Москва).
1.3. Пипетки
2. Санация осуществляется следующим образом:
2.1. Изотонический раствор хлорида натрия (0,89 %) подвергается электролизу на электрохимическом детоксикаторе организма.
2.2. Полученный электролизный раствор с концентрацией 240 мг/л доводится физиологическим раствором с помощью метода серийных разведений до экспериментально установленной эффективной концентрации 1,7—1,9 мг/мл (готовится непосредственно перед применением).
2.3. Формы проведения санации следующие:
а) Препарат закапывают 4 раза в день по 5—6 капель в оба носовых хода в течение 2 недель.
б) Местная аппликация препарата на слизистую оболочку носовой полости с использованием ватных тампонов, пропитанных раствором гипохлорита натрия, закладываемых в оба носовых хода на 10—20 минут ежедневно в течение 2 недель.
2.4. По окончании санации проводят контрольное бактериологическое исследование с определением обсемененности слизистой оболочки переднего отдела носа стафилококками, а также вирулентных и персистентных свойств у выделенных штаммов.
Заключение
Рекомендуемые средства (масляный раствор витамина А, микроклимат спелеошахты, препарат электролизного водного раствора, снижая персистентные признаки стафилококков, повышают качество санации, обеспечивая положительный эффект в 78—91 % случаев.
Масляным раствором витамина А просанировано 200 человек, эффект санации составил 78 %; препаратом электролизного водного раствора гипохлорита натрия просанировано 64 бактерионосителя с эффективностью 87,5 %; в спелеошахте просанировано 250 человек, эффективность использования метода -91 %.
15
ББК51.9
Д44
Д44 Диагностика и санация стафилококковых бактерионосителей: Методические рекомендации.—М.: Федеральный центр госсанэпиднадзора Минздрава России, 2001.—15 с.
ISBN 5-7508—0268—X
В методических рекомендациях представлена принципиально новая схема лабораторной диагностики стафилококковых бактерионосителей: цитоско-пический метод выявления бактерионосителей стафилококков; питательная среда, позволяющая выделять стафилококки с персистеными свойствами; способ дифференциации стафилококковой микрофлоры, основанный на определении у штаммов, выделенных от бактерионосителей, факторов перси-стенции; предложены новые средства санации: масляный раствор витамина А, микроклимат спелеошахты, препарат электролизного водного раствора гипохлорита натрия.
Методические рекомендации предназначены для бактериологов, эпидемиологов, инфекционистов и врачей других специальностей.
Рекомендации разработаны сотрудниками Оренбургской государственной медицинской академии и Оренбургского института клеточного и внутриклеточного симбиоза УрО РАН (член-корреспондент РАН и РАМН, профессор О. В. Бухарин; профессор Б. Я. Усвяцов, доктор биологических наук
О. Л. Карташова, кандидат биологических наук С. Б. Киргизова, кандидат медицинских наук Л. И. Паршута).
ББК 51.9
ISBN 5—7508—0268—X
© Федеральный центр госсанэпиднадзора Минздрава России, 2001
УТВЕРЖДАЮ Главный государственный санитарный врач Российской Федерации - Первый заместитель Министра здравоохранения Российской Федерации
Г. Г. Онищенко
6 апреля 2001 г.
Введение
Настоящие методические рекомендации посвящены проблеме профилактике стафилококкового бактерионосительства.
В этиологической структуре внутрибольничных инфекций, возникающих в акушерских и хирургических стационарах, большая роль принадлежит стафилококкам. Основным источником гнойной стафилококковой инфекции являются бактерионосители.
Работами сотрудников Оренбургской медицинской академии и Института клеточного и внутриклеточного симбиоза УрО РАН (1989—1997) установлено, что факторы персистенции стафилококков (антилизоцимная, антиинтерфероновая, антикомплементарная активности), направленные на инактивацию защитных механизмов хозяина, обеспечивают длительное переживание бактерий и создают основу резидентного бактерионосительства.
В представленных методических рекомендациях предлагаются новые подходы к профилактике стафилококковых инфекций, включающие: цитоскопический метод выявления бактерионосителей; питательную среду, позволяющую избирательно выделять стафилококки с персистентными свойствами; способ дифференциации резидентной и транзиторной стафилококковой микрофлоры, основанный на определении факторов персистенции у штаммов, выделенных от бактерионосителей.
Учитывая то обстоятельство, что подавление персистирующих свойств возбудителя затрудняет его паразитирование и, тем самым, повышает эффективность лекарственных воздействий, разработаны эффективные способы санации через снижение персистентных характеристик стафилококка.
Апробация предлагаемых методик в лечебно-профилактических учреждениях города показала их преимущество по сравнению с классическими методами профилактики.
3
Приоритетность способов диагностики и санации стафилококковых бактерионосителей подтверждена 2 авторскими свидетельствами и 4 патентами РФ на изобретения.
Диагностика стафилококковых бактерионосителей
Предлагаемый метод диагностики стафилококкового бактерионосительства отличается от существующих принципиально новой схемой исследования, включающей в себя: цитоскопический метод выявления бактерионосителей стафилококков; посев на питательную среду, позволяющую избирательно выделять стафилококки с персистентными свойствами (патент РФ № 2088668 «Питательная среда для выделения стафилококков с персистентными характеристиками»); способ дифференциации резидентной и транзиторной стафилококковой микрофлоры, основанный на определении факторов персистенции у штаммов, выделенных от бактерионосителей.
Цитоскопический метод L Реактивы, приборы, стекло
1.1. Среда-199 - официнальная среда для сохранения культуры клеток, производится в Свердловском НИИ вирусных инфекций.
1.2. Пробирки, ГОСТ 10515, диаметр 15 мм, высота 145—150 мм
1.3. Термостат
1.4. Пастеровские пипетки
1.5. Предметное стекло
1.6. Метанол
1.7. Ватный тампон, укрепленный на проволоке
2. Метод заключается в следующем:
2.1. Исследуемый материал (клетки эпителия слизистой оболочки переднего отдела носа) забирают с помощью стерильных ватных тампонов, смоченных в физиологическом растворе.
2.2. Тампон погружают в стерильную пробирку с 1,0 мл среды-199, встряхивают в течение 15 минут, тампон отжимают о стенки пробирки и удаляют.
2.3. Содержимое пробирки инкубируют в течение 1—2 часов при 37 °С в термостате (для сохранения жизнеспособности эпителиальных клеток и размножения в них стафилококков).
2.4. Верхний слой жидкости удаляют при помощи пастеровской пипетки, из осадка делают мазок на чистое, хорошо обезжиренное стекло (стекла обезжиривают при помощи смеси Никифорова).
4
2.5. После подсыхания мазок фиксируют метанолом в течение 5 минут и окрашивают одним из принятых методов (синькой Мансона, по Романовскому-Гимзе и др.).
2.6. При микроскопии мазков просматривают не менее 30 эпителиальных клеток (учитывают клетки с хорошо видимым ядром). В том случае, если обнаруживают 5 и более клеток, содержащих микроколонии стафилококков (группа из 4 и более кокков), то делают заключение о резидентном бактерионосительстве.
2.7. Для уточнения видовой характеристики стафилококков проводят бактериологическое исследование.
Бактериологический метод
А. Выделение чистой культуры стафилококка с персистентными свойствами путем посева на элективную питательную среду с фузидином
1. Реактивы, приборы, стекло
1.1. Чашки Петри, ГОСТ 7900-56
1.2. Натрий хлористый, ГОСТ 4233-77 (Михайловский завод химреактивов)
1.3. Куриное яйцо
1.4. Фузидин-натрий-натриевая соль фузидиевой кислоты (Пензенский комбинат медицинских препаратов «Биосинтез»)
1.5. Питательный агар для культивирования микроорганизмов, сухой, код ОКП 93 8511 0197 ФС 42-188 ВС-88 (НПО «Питательные среды», Махачкала)
1.6. Физиологический раствор (9 г NaCl на 1 л воды)
1.7. Ватный тампон, укрепленный на проволоке
2. Элективная питательная среда (приготовление и посев)
2.1. Приготовление элективной среды: к 850 мл расплавленного мясо-пептонного агара добавляют 85 мл NaCl, затем среду стерилизуют, остужают до 50 градусов и добавляют 150 г желточной взвеси (желток асептически извлекают из яйца, взбалтывают с 200 мл изотонического раствора хлорида натрия). Перед заливкой чашек Петри во флаконы вносят 0,0002 г/л антибиотика фузидина. Все тщательно перемешивают, готовую среду разливают в стерильные чашки, подсушивают в термостате при 37 °С в течение 10 минут.
2.2. На поверхность среды засевают исследуемый материал (клетки эпителия слизистой оболочки носа), который забирают с помощью стерильных ватных тампонов, смоченных в физиологиче-
5
ском растворе, и учитывают результаты через 24 часа инкубации в термостате при 37 °С.
2.3. Рост колоний на данной среде позволяет отнести бактерионосителя к резидентному типу, т. к. имеет место преимущественный рост стафилококка с персистентными свойствами.
Е. Идентификация чистой культуры: определение резидентной стафилококковой микрофлоры
При дифференциации резидентной стафилококковой микрофлоры от транзиторной, кроме учета микробной обсемененности, рекомендуется определять у выделенных штаммов чувствительность к фузидину, а также персистентные свойства (антилизоцимная, ан-тиинтерфероновая, антикомплементарная активности), как наиболее информативные биологические характеристики (А. с. СССР № 1449587 «Способ выявления возбудителя при гнойно-воспалительных процессах»; патент РФ №2010860 «Способ определения антикомплементарной активности микроорганизмов»).
1. Реактивы, приборы, стекло
1.1. Чашки Петри, ГОСТ 7900-56
1.2. Питательный агар для культивирования микроорганизмов, сухой, код ОКП 93 8511 0197 ФС 42-188 ВС-88 (НПО «Питательные среды», Махачкала)
1.3. Физиологический раствор (9 г NaCl г на 1 л воды)
1.4. Официнальные диски с фузидином (Минмедпром РФ объединение «Мосмедпрепарат» им. А. Я. Карпова)
1.5. Яичный лизоцим, регистрационный номер 76/506/6 (Фармацевтическое акционерное общество «Ферейн», Москва)
1.6. Культура Micrococcus luteus (№211001 по каталогу ГИСК им. Л. А, Тарасевича)
1.7. Препарат человеческого лейкоцитарного интерферона (ПО «Иммунопрепарат», Уфа)
1.8. Культура Corynebacterium xerosis (№181 по каталогу ГИСК им. Л. А. Тарасевича)
1.9. Сыворотка крови доноров (станция переливания крови)
1.10. Культура Е. coli (№ 212 по каталогу ГИСК им. Л. А. Тарасевича)
1.11. Хлороформ фармакопейный ФС X - 160 (Проблемная лаборатория органического синтеза, Башкортостан)
1.12. Пробирки, ГОСТ 10515, диаметр 15 мм, высота 145—150 мм
1.13. Термостат
1.14. Центрифуга ЦЛС - 3
6
2. Определение свойств стафилококков
2.1. Чувствительность к фузидину
2.1.1. Чувствительность стафилококков к фузидину (ФУЗ) определяют методом диффузии в агар с использованием официальных дисков согласно «Методическим указаниям по определению чувствительности микроорганизмов к антибиотикам» (М3 СССР 10.03.83 №267583).
2.1.2. Определяют диаметр стерильной зоны вокруг дисков в мм и учитывают результаты следующим образом: < 12 - устойчивые, (13—19) - умеренно-устойчивые, > 20 - чувствительные.
2.2. Антилизоцимная активность (АЛА)
2.2.1. Антилизоцимную активность определяют чашечным методом, для этого готовят разведение лизоцима: взвешивают 10 мг лизоцима, добавляют 10 мл физиологического раствора. К 0,5 мл полученного разведения добавляют 9,5 мл физиологического раствора (50 мкг/мл). Готовят разведения лизоцима: к 0,1 мл полученного разведения добавляют 0,9 мл физиологического раствора (1 мкг/мл); к 0,2 мл - 0,8 мл физиологического раствора (2 мкг/мл); к 0,3 мл разведения лизоцима - 0,7 мл физиологического раствора (3 мкг/мл) и т. д.
2.2.2. Заливают чашки Петри, добавляя к каждому разведению 4 мл 1,5 %-ного питательного агара.
2.2.3. Готовят контроль, добавляя 1мл физиологического раствора к 4 мл 1,5 %-ного питательного агара.
2.2.4. Чашки подсушивают в термостате при 37 °С в течение 10—15 минут.
2.2.5. Готовят 1 млрд, взвесь исследуемых культур в физиологическом растворе и наносят в виде бляшек на поверхность приготовленных сред.
2.2.6. Чашки помещают в термостат при 37 °С на 18—24 часа.
2.2.7. Выросшие макроколонии обрабатывают парами хлороформа, наливая его в крышку чашки Петри (в течение 10 минут).
2.2.8. Готовят 1млрд. взвесь суточной агаровой культуры Micrococcus luteus в физиологическом растворе, разливают по 0,1 мл в пробирки и заливают каждую чашку вторым слоем, добавляя к индикаторной культуре микрококка 3 мл 0,7 %-ного питательного агара.
7
2.2.9. Чашки помещают в термостат на 24 часа при 37 °С и проводят учет результатов опыта по наличию роста микрококка вокруг колоний исследуемых культур. Учитывают уровень выраженности признака по принятой градации: 0 мкг/мл, 1 мкг/мл, 2 мкг/мл,
3 мкг/мл, 4 мкг/мл, 5 мкг/мл. За уровень антилизоцимной активности исследуемых культур принимают максимальное значение концентрации лизоцима в среде, при которой еще наблюдается рост индикаторного штамма.
2.5. Антиинтерфероповая активность (АИА)
2.3.1. Ампулу интерферона разводят в 4 мл физиологического раствора.
2.3.2. Готовят рабочие разведения: 1,0 мл разведенного интерферона (10 уел. ед.); к 0,5 мл разведения интерферона добавляют 0,5 мл физиологического раствора (5 уел. ед.); к 0,25 мл - 0,75мл (2 уел. ед.); к 0,125 мл - 0,875 мл (1 уел. ед.).
2.3.3. Заливают чашки Петри, добавляя к каждому разведению
4 мл 1,5 %-ного питательного агара.
2.3.4. Готовят контроль, добавляя 1 мл физиологического раствора к 4 мл 1,5 %-ного питательного агара.
2.3.5. Чашки подсушивают в термостате при 37 °С в течение 10—15 минут.
2.3.6. Готовят 1 млрд, взвесь исследуемых культур в физиологическом растворе и наносят в виде бляшек на поверхность приготовленных сред.
2.3.7. Чашки помещают в термостат при 37 °С на 24 часа.
2.3.8. Выросшие макроколонии обрабатывают парами хлороформа, наливая его в крышку чашки Петри (в течение 10 минут).
2.3.9. Готовят 1млрд. взвесь суточной агаровой культуры Согупе-bacterium xerosis в физиологическом растворе, разливают по 0,1 мл в пробирки и заливают каждую чашку вторым слоем, добавляя к индикаторной культуре микрококка 3 мл 0,7 %-ного питательного агара.
2.3.10. Чашки помещают в термостат на 24 часа при 37 °С и проводят учет результатов опыта по наличию роста коринебакте-рии вокруг колоний исследуемых культур. Учитывают уровень выраженности признака по принятой градации: Оусл. ед., 1 уел. ед., 2 уел. ед., 5 уел. ед., 10 уел. ед. За уровень «антиинтерфероновой» активности исследуемых культур принимают максимальное значе-
8
ние концентрации интерферона в среде, при которой еще наблюдается рост индикаторного штамма.
2.4. Аитикомплементарная активность (АКА)
2.4.1. В чашки Петри разливают 1,5 % агар по 5мл. Чашки подсушивают в термостате при 37 °С в течение 10—15 минут. Готовят 1 млрд, взвесь исследуемых культур в физиологическом растворе и наносят в виде бляшек на поверхность приготовленных сред.
2.4.2. Чашки помещают в термостат при 37 °С на 18—24 часа.
2.4.3. Выросшие макроколонии обрабатывают парами хлороформа, наливая его в крышку чашки Петри (в течение 10 минут) и заливают чашки вторым слоем, содержащим 1,5 мл 1,5 %-ного агара и 1 мл комплемента (смесь пула сывороток 15—20 доноров, оттитрованная в гемолитической системе до активности 50 ед., 25 ед., 12,5ед/мл), конечная концентрация комплемента будет составлять соответственно 20; 10 и 5 гем. ед/мл.
2.4.4. Чашки инкубируют при 37 °С в течение 1 часа.
2.4.5. Готовят 1млрд. взвесь суточной агаровой культуры Е. coli 212 в физиологическом растворе, разливают по 0,1 м в пробирки и заливают каждую чашку вторым слоем, добавляя к индикаторной культуре эшерихии 3 мл 0,7 %-ного питательного агара.
2.4.6. Чашки инкубируют в термостате при 37 °С в течение 18— 24 часов.
2.4.7. Об антикомплементарной активности судят по наличию роста индикаторного штамма вокруг исследуемых культур тех штаммов стафилококков, где произошла инактивация комплемента. Учитывают уровень выраженности признака по принятой градации: 0 уел. ед., 5 уел. ед., 10 уел. ед. и 20 уел. ед.
3. Оценка штаммов стафилококков (вид, экотоп)
Для приведения значений всех изученных признаков к единому измерению полученные показатели переводят в баллы (табл. 1) и оценивают штамм стафилококка с помощью диагностической модели по формуле:
Д = х,а, + х2а2 + хпап + С, где
Д - дискриминантная функция, характеризующая резидентный или транзиторный тип стафилококковой микрофлоры;
х - значение признака в баллах;
а - коэффициент признака;