Методические рекомендации
Лабораторный контроль противоэпидемического режима стационаров и методика бактериологических исследований при возникновении гнойно-септических инфекций (ГСИ)
Купить Методические рекомендации — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические рекомендации предназначены для стажеров-бактериологов лабораторий лечебно-профилактических учреждений, для стажеров-бактериологов и эпидемиологов санитарно-эпидемиологических станций
Оглавление
1. Введение
2. Принципы и сущность лабораторного контроля противоэпидемического режима в стационарах
3. Условно-патогенные микроорганизмы-возбудители ГСИ
4. Микробиологические методы обнаружения условно-патогенных микроорганизмов
4.1. Материал и методика отбора проб для микробиологических исследований
4.2. Микробиологические методы исследования материала от персонала, больных и лиц, соприкасавшихся с ними
4.2.1. Микроскопия материала
4.2.2. Посев материала на питательные среды
4.2.2.1. Посев при качественном исследовании
4.2.2.2. Посев при количественных методах исследования
4.2.3. Выделение микроорганизмов, идентификация видов и дифференциация разновидностей микроорганизмов
4.2.4. Документация бактериологических исследований
4.3. Санитарно-микробиологические методы исследования материала из объектов окружающей среды в стационарах
5. Эпидемиологическая оценка результатов микробиологических исследований
Приложение № 1. Питательные среды
Приложение № 2. Приемы отбора и посева проб
Приложение № 3. Реактивы и методики проведения биохимических тестов
Приложение № 4. Образец направления клинического материала на бактериологическое исследование
Приложение № 5. Санитарный паспорт стационара
Приложение № 6. Методика проведения газохроматографического анализа
Приложение № 7. Легионеллез
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15
стр. 16

стр. 17
стр. 18

стр. 19
стр. 20
стр. 21
стр. 22
стр. 23

стр. 24
стр. 25
стр. 26

стр. 27
стр. 28

стр. 29
стр. 30
ЛЕНИНГРАДСКИЙ САНИТАРНО-ГИГИЕНИЧЕСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ ЛЕНИНГРАДСКАЯ ГОРОДСКАЯ САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКАЯ СТАНЦИЯ
Лабораторный контроль противоэпидемического режима стационаров и методика бактериологических исследований при возникновении гнойно-септических инфекций (ГСИ)
(Методические рекомендации для врачей-стажеров)
ЛЕНИНГРАД
1985
ЛЕНИНГРАДСКИЙ САНИТАРНО-ГИГИЕНИЧЕСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ ЛЕНИНГРАДСКАЯ ГОРОДСКАЯ САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКАЯ СТАНЦИЯ
Лабораторный контроль противоэпидемического режима стационаров и методика бактериологических исследований при возникновении гнойно-септических инфекций (ГСИ)
(Методические рекомендации для врачей-стажеров)
ЛЕНИНГРАД
19 85
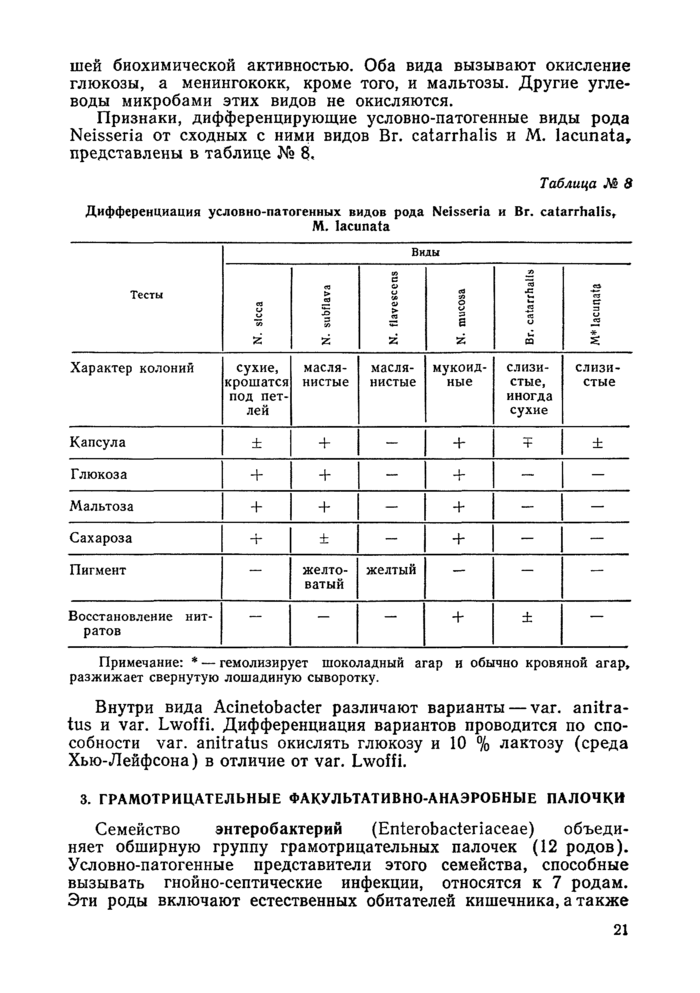
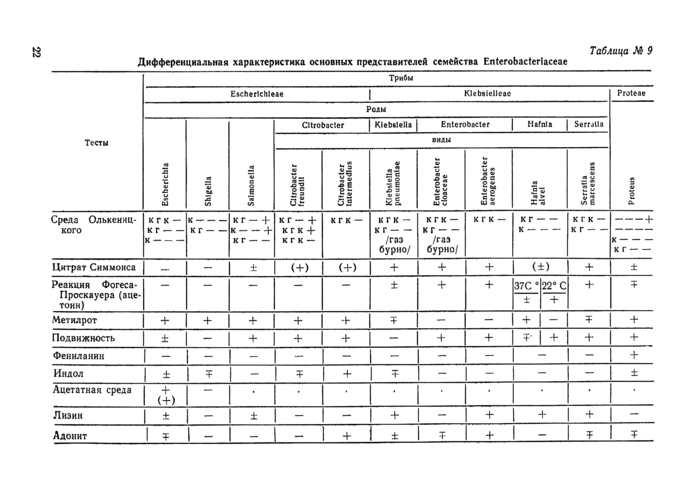
3. УСЛОВНО-ПАТОГЕННЫЕ МИКРООРГАНИЗМЫ — ВОЗБУДИТЕЛИ ГНОЙНО-СЕПТИЧЕСКИХ ИНФЕКЦИЙ
Гнойно-септические инфекции вызываются условно-патогенными микроорганизмами, среди которых основную роль играют некоторые виды факультативно-анаэробных грамположительных кокков и грамотрицательных палочек. Имеются данные об этиологической значимости грамотрицательных неспорообразующих анаэробных бактерий и грибов.
Основные виды условно-патогенных микроорганизмов, способных вызывать гнойно-септические инфекции, систематизированы по «Определителю бактерий Берджи», 1974 г. и представлены в таблице № 1.
Таблица № 1
|
ВОЗБУДИТЕЛИ ГНОЙНО-СЕПТИЧЕСКИХ ИНФЕКЦИЙ 1. ГРАМПОЛОЖИТЕЛЬНЫЕ ФАКУЛЬТАТИВНО-АНАЭРОБНЫЕ КОККИ | |||||||||||||||||||||||
|
|
2. ГРАМОТРИЦАТЕЛЬНЫЕ АЭРОБНЫЕ КОККИ И КОККОБАКТЕРИИ | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
|
3. ГРАМОТРИЦАТЕЛЬНЫЕ ФАКУЛЬТАТИВНО-АНАЭРОБНЫЕ ПАЛОЧКИ | ||||||||||||||||||||||||||||||||
|
|
Роды с неясным систематическим положением | ||||||||||||
|
|
4. ГРАМОТРИЦАТЕЛЬНЫЕ АЭРОБНЫЕ ПАЛОЧКИ И КОККИ | ||||||||||
|
|
Род с неясным систематическим положением | ||||||
|
5. ГРАМОТРИЦАТЕЛЬНЫЕ АНАЭРОБНЫЕ НЕСПОРООБРАЗУЮЩИЕ
ПАЛОЧКИ
| ||||||||||
|
12 |
6, ГРАМПОЛОЖИТЕЛЬНЫЕ АНАЭРОБНЫЕ НЕСПОРООБРАЗЯЮЩИЕ
кокки
|
Семейство |
Род |
Вид |
|
Peptococcaceae |
Peptococcus |
Р, asaccharolyticus |
|
Peptostreptococcus |
Pstr. anaerobins | |
7. ГРАМПОЛОЖИТЕЛЬНЫЕ АНАЭРОБНЫЕ СПОРООБРАЗУЮЩИЕ
ПАЛОЧКИ
|
Семейство |
Род |
Вид |
|
Bacillaceae |
Clostridium |
CL perfringens |
|
8. ГРИБЫ | ||
|
Семейство |
Род |
Вид |
|
Torulopsidaceae |
Candida |
С. albicans |
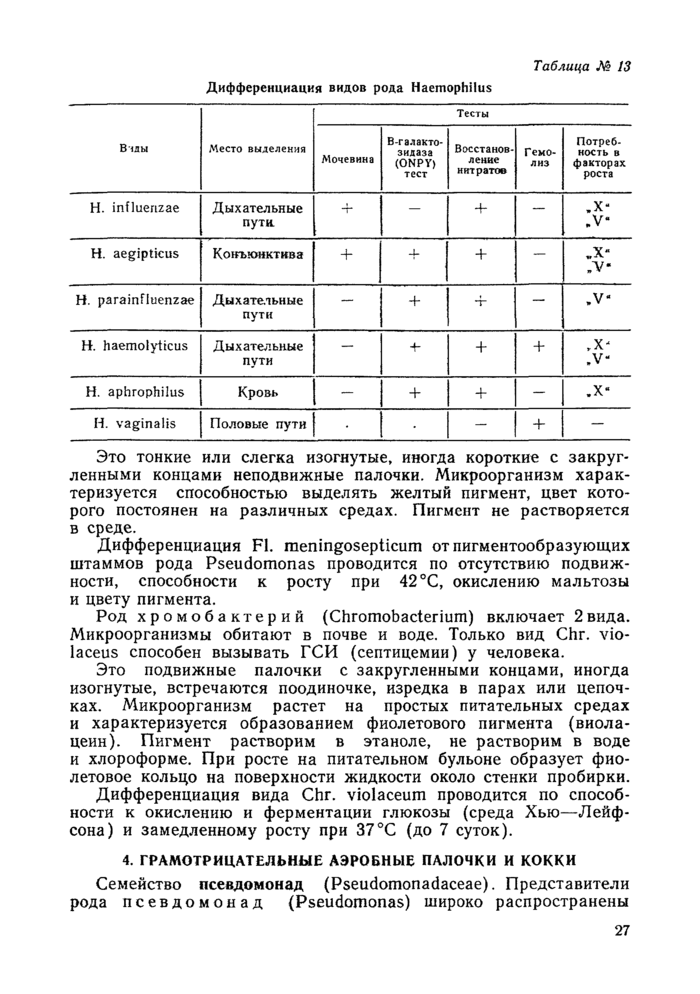
Удельный вес различных видов возбудителей в развитии Г СИ различен, наиболее частые возбудители — Staph, aureus, Esch. coli, Ps. aeruginosa, Pr. mirabilis, Pr. vugaris, Str. pneumoniae, Kl. pneumoniae, Bact. fragilis. Имеются данные о значении в патологии человека микроорганизмов семейства Legionellaceae (приложение № 7).
Частота обнаружения различных видов возбудителей варьирует в зависимости от локализации патологического процесса.
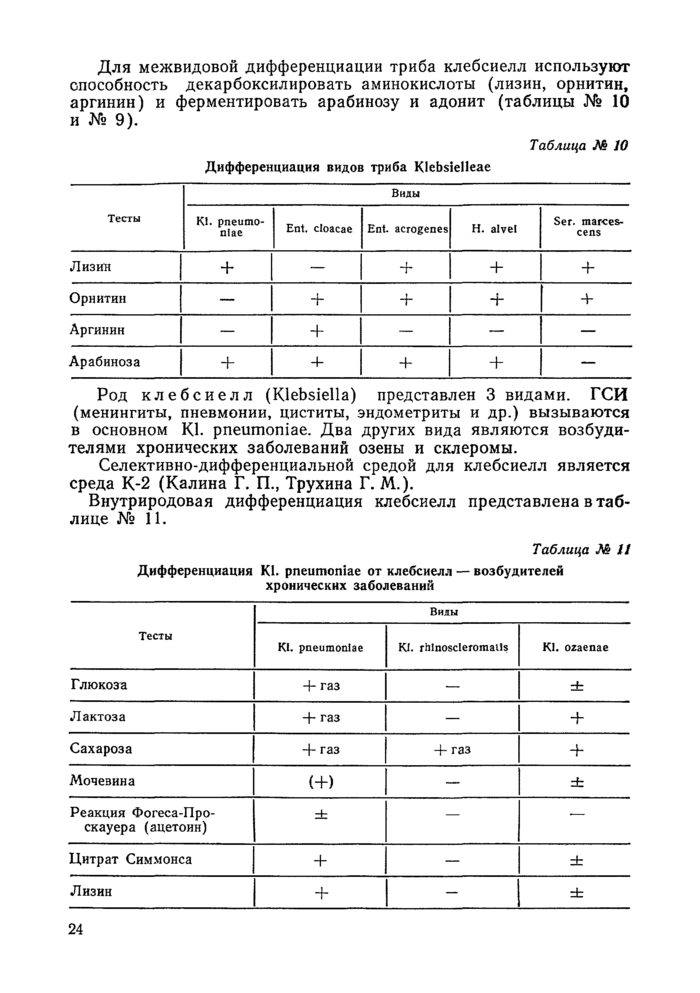
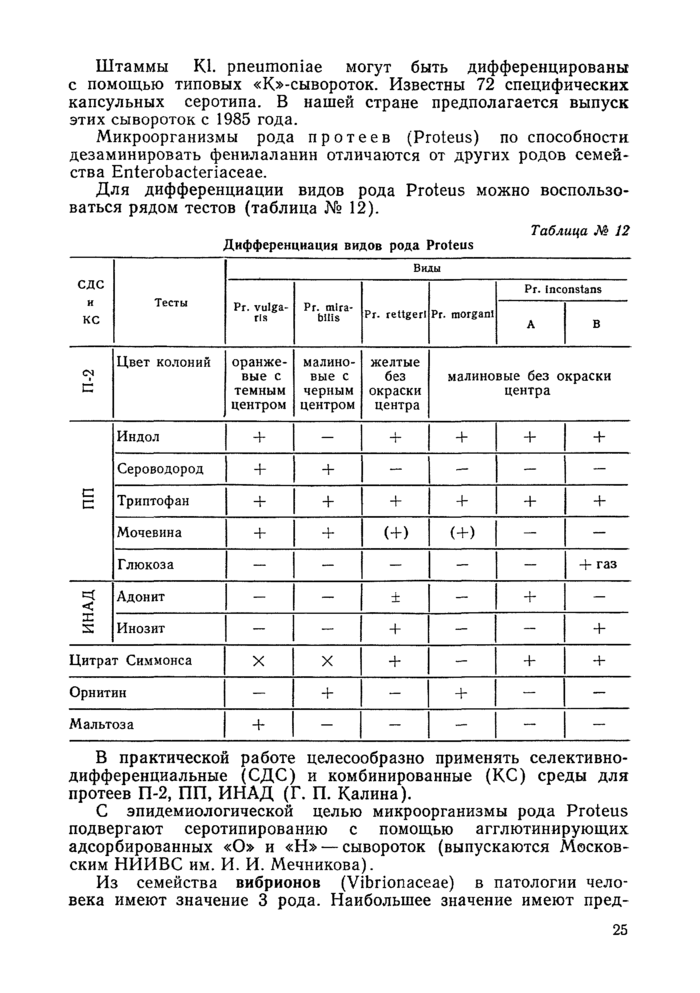
Краткая характеристика и дифференциальные признаки представителей различных групп микробов представлены в таблицах.
Условные обозначения в таблицах:
4- — наличие признака,
— = отсутствие признака,
Ч- = чаще наличие, qp чаще отсутствие,
(+) = замедленная реакция,
X = варианты,
. = не изучен, щ = щелочеобразование, к = кислота, г — газ.
= тест (среда Хыо-Лейфсона):
к
—==*окисление глюкозы в аэробных условиях и отсутствие ферментации в анаэробных:
13
к
— = окисление глюкозы в аэробных условиях и ферментация в анаэробных; к
— = отсутствие окисления и ферментации.
Среда Олькеницкого (3-х сахарный агар) — шифр среды:
глюкоза газообразование сахароза сероводород
I 2 и лактоза ^
3
КА — кровяной агар,
МПБ — мясо — пентонный бульон,
МПА — мясо — пептонный агар,
ЖСА — ж ел точно-солевой агар,
СКС — среда для контроля стерильности,
ТС — тиогликолевая среда,
К—Т — Китт — Тароцци среда,
ГПС — глюкозо-пептонная среда,
ЦХО — цитохромоксидаза,
ТТХ — трифенилтетразолий хлорид,
БГКП — бактерии группы кишечной палочки.
1. ГРАМПОЛОЖИТЕЛЬНЫЕ ФАКУЛЬТАТИВНО-АНАЭРОБНЫЕ КОККИ.
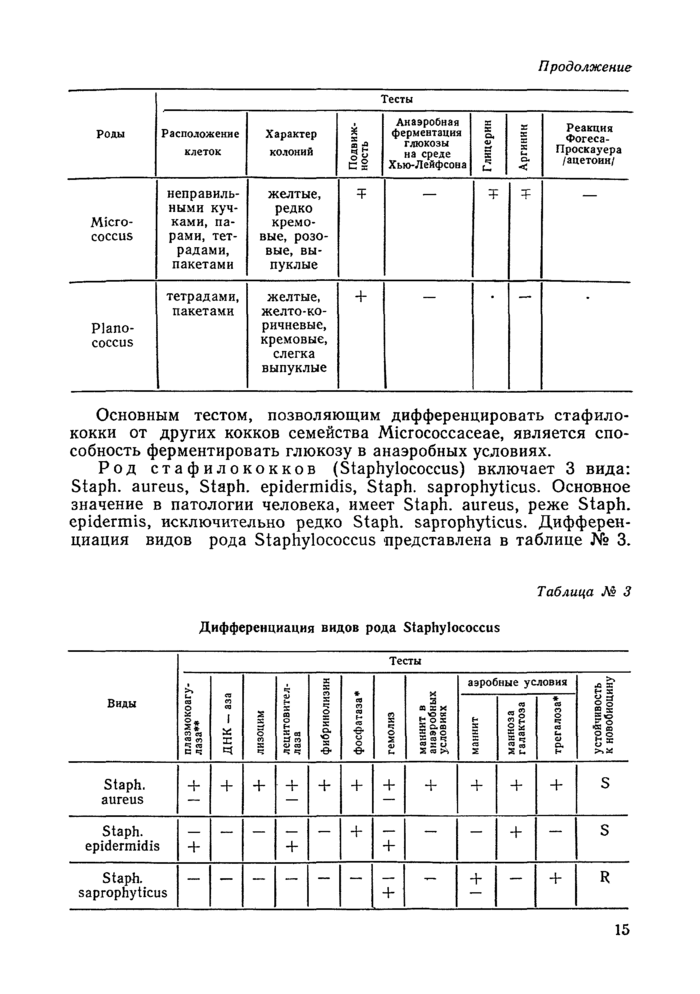
Семейство микрококков (Micrococcaceae) включает 3 рода:
1. Staphylococcus
2. Micrococcus
3. Planococcus
Наиболее частыми возбудителями ГСИ (фурункулы, пиодермии, пневмонии, эмпиемы, сепсис и др.) являются стафилококки. Представители двух других родов являются обычными обитателями почвы и воды. Дифференциация родов семейства микрококков представлена в таблице № 2.
Таблица Л§ 2
|
Дифференциация родов семейства Micrococcaceae | ||||||||||||||||||||||||
| ||||||||||||||||||||||||
|
14 | ||||||||||||||||||||||||
|
Продолжение | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
Основным тестом, позволяющим дифференцировать стафилококки от других кокков семейства Micrococcaceae, является способность ферментировать глюкозу в анаэробных условиях.
Род стафилококков (Staphylococcus) включает 3 вида: Staph, aureus, Staph, epidermidis, Staph, saprophyticus. Основное значение в патологии человека, имеет Staph, aureus, реже Staph, epidermis, исключительно редко Staph, saprophyticus. Дифференциация видов рода Staphylococcus представлена в таблице № 3.
Таблица № 3
|
Дифференциация видов рода Staphylococcus Тесты | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
15 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Условные обозначения:
* — свойства, рекомендованные международным суб-
комитетом по таксономии в 1976 г.,
** — свойства* рекомендованные международным субкомитетом по таксономии в 1965 г.,
R (резистентность) — м/с>2,0 мкг/мл или диаметр зоны задержки роста >>17 мм,
S (чувствительность) —м/с<0,6 мкг/мл или диаметр зоны задержки роста <17 мм*
По приказу М3 СССР № 1230 от 6/ХП. 79 г. обязательными являются тесты на плазмокоагулазу, фосфатазу, аэробную ферментацию маннита, отношение к новобиоцину.
Для наиболее точной идентификации штаммов, отклоняющихся от признаков, указанных в приказе № 1230, рекомендуется использовать полную схему дифференциации (таблица № 3).
Для характеристики значимости источников инфекции используют определение массивности обсеменения верхних дыхательных путей Staph, aureus (приказ № 720 М3 СССР от 31/УН—1978 г.). Обсеменение, выражающееся показателем 103 и более микробных клеток на тампоне, указывает на высокую обсемененность, при которой происходит выделение микроба во внешнюю среду.
Для эпидемиологических целей целесообразно дифференцировать золотистый стафилококк на варианты. Возможно разделение на 8 биоваров по сочетанию признаков: продукция лецитовител-лазы, наличие дельта — гемолизина и чувствительности к лечебному поливалентному стафилофагу (Акатов А. К., Зуева В. С., 1983 г.).
Наиболее целесообразной является дифференцировка стафилококков по чувствительности к фагам на фаговары. Для фаготи-пирования пользуются международным набором диагностических типовых стафилококковых бактериофагов (выпускаются НИИЭМ им. Н. Ф. Гамалеи АМН СССР). Набор включает 4 группы фагов:
1 группа — 29, 52, 52А, 79, 80;
2 группа — ЗА, ЗС, 55, 71;
3 группа —6, 42Е, 47, 53, 54, 75, 77, 83А, 84, 85;
4 группа — 42Д
вне групп — 81 и 187.
Методика и учет результатов фаготипирования представлены в наставлении к набору бактериофагов. Целесообразно наносить фаги репликатором на незасеянную чашку и после подсыхания капель фага засевать испытуемую культуру.
Изменение фагочувствительности циркулирующих штаммов стафилококка делает необходимым приготовление и использование набора местных фагов. С помощью полного набора фагов удается типировать 60—90 % стафилококков.
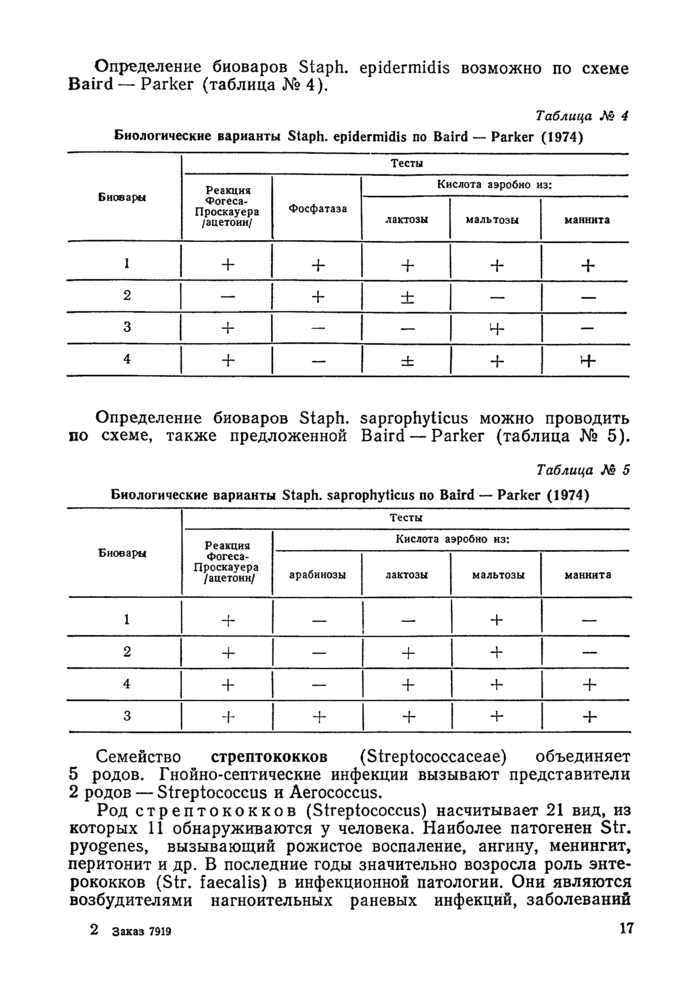
Определение биоваров Staph, epidermidis возможно по схеме Baird — Parker (таблица № 4).
|
Таблица № 4 Биологические варианты Staph, epidermidis по Baird — Parker (1974) | ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
Определение биоваров Staph, saprophyticus можно проводить по схеме, также предложенной Baird — Parker (таблица № 5).
|
Таблица № 5 Биологические варианты Staph, saprophyticus по Baird — Parker (1974) | |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
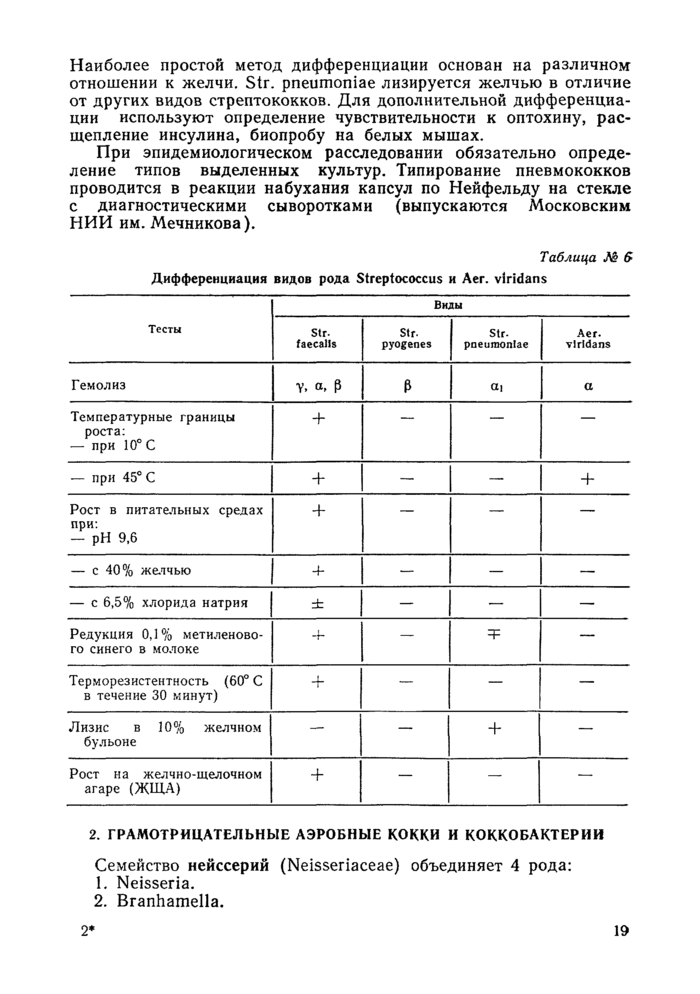
Семейство стрептококков (Streptococcaceae) объединяет 5 родов. Гнойно-септические инфекции вызывают представители 2 родов — Streptococcus и Aerococcus.
17
Род стрептококков (Streptococcus) насчитывает 21 вид, из которых 11 обнаруживаются у человека. Наиболее патогенен Str. pyogenes, вызывающий рожистое воспаление, ангину, менингит, перитонит и др. В последние годы значительно возросла роль энтерококков (Str. faecalis) в инфекционной патологии. Они являются возбудителями нагноительных раневых инфекций, заболеваний
2 Заказ 7919
полости рта, уха, легких. Str. pneumoniae — один из основных возбудителей инфекций дыхательных путей. Аег viridans выделяется при заболеваниях мочеполовой системы и эндокардитах.
Принадлежность микроорганизма к семейству стрептококков определяется по морфологии, характеру колоний, гемолизу на кровяном агаре, характеру роста в бульоне и отсутствию фермента каталазы.
На кровяном агаре стрептококки образуют, как правило, мелкие (1—2 мм в диаметре) полупрозрачные колонии. По характеру гемолиза стрептококки могут быть разделены на р — гемолитические стрептококки, образующие прозрачную зону гемолиза вокруг колоний; а-гемолитические стрептококки, дающие зеленоватое окрашивание и частичный гемолиз вокруг колоний <ц—гемолитические стрептококки, образующие менее выраженную сероватомутную зону гемолиза; у — негемолитические стрептококки.
В питательном бульоне для стрептококков характерен придонный, часто поднимающийся по стенке пробирки рост при сохранении прозрачности бульона. Иногда этот признак может быть замедлен.
Микроорганизмы семейства Streptococcaceae не продуцируют фермент каталазу, что является дифференциальным тестом от семейства Micrococcaceae.
Для дифференциации различных видов рода Streptococcus и Аег. viridans следует воспользоваться признаками, указанными в таблице № 6.
По полисахаридному антигену стрептококки в реакции преципитации дифференцируются на 17 серологических групп. Заболевания у человека чаще вызываются стрептококком группы А (Str. pyogenes), реже других групп (В, С, G).
При эпидемиологическом расследовании проводится типиро-вание выделенных стрептококков в реакции агглютинации на стекле по методу Гриффита с типовыми иммунными диагностическими сыворотками. Сложность получения типовых сывороток, частота спонтанной агглютинации делают этот метод недостаточно приемлемым для широкой практики.
Возможна дифференциация стрептококков группы А по содержанию дипопротеиназы более чем на 20 типов (А. А. Тотолян и И. М. Ионтова, 1983). Определение типа дипопротеиназы проводится в реакции ее нейтрализации. Для постановки реакции необходимо иметь набор сывороток, содержащих в достаточном титре антитела к различным типам липопротеиназ. В качестве антилипопротеиназ могут быть использованы человеческие сыворотки крови доноров, которые отбираются по содержанию антилипопротеиназ с помощью музейных штаммов стрептококков или сыворотки, экспериментально приготовленные иммунизацией животных.
Дифференциация пневмококков (Str. pneumoniae) от других видов стрептококков представлена в таблице № 6.
Наиболее простой метод дифференциации основан на различном отношении к желчи. Str. pneumoniae лизируется желчью в отличие от других видов стрептококков. Для дополнительной дифференциации используют определение чувствительности к оптохину, расщепление инсулина, биоиробу на белых мышах.
При эпидемиологическом расследовании обязательно определение типов выделенных культур. Типирование пневмококков проводится в реакции набухания капсул по Нейфельду на стекле с диагностическими сыворотками (выпускаются Московским НИИ им. Мечникова).
|
Таблица М & Дифференциация видов рода Streptococcus и Aer. viridans | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2. ГРАМОТРИЦАТЕЛЬНЫЕ АЭРОБНЫЕ КОККИ И КОККОБАКТЕРИЙ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
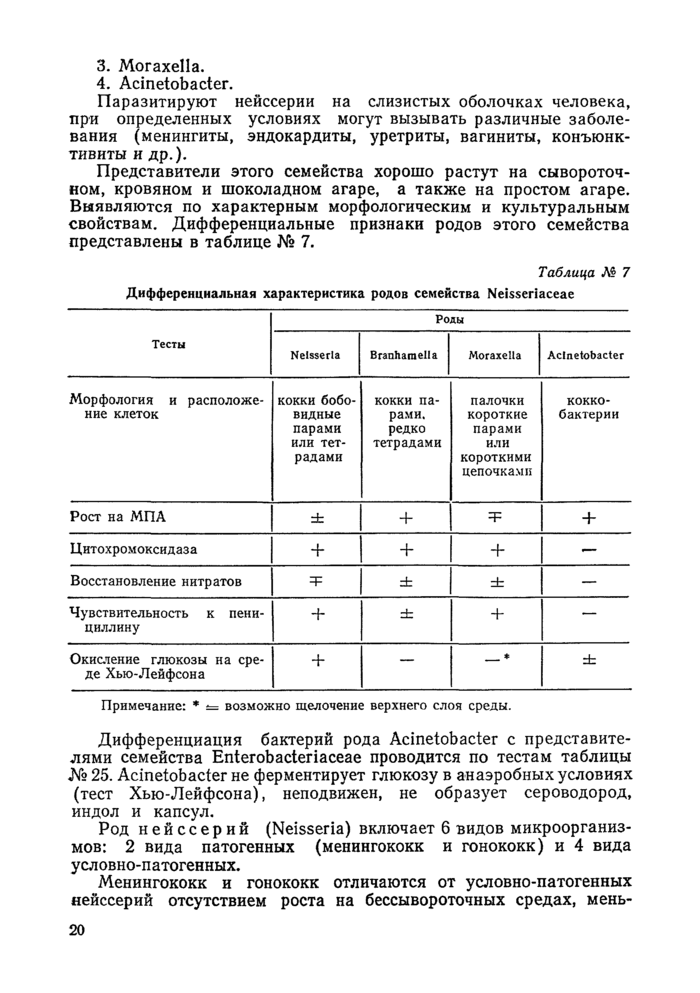
Семейство нейссерий (Neisseriaceae) объединяет 4 рода:
1. Neisseria.
2*
2. Branhamella.
19
Методические рекомендации составили:
Л. П. Зуева, Б, Г. Хайкина, М. Н. Дьякова. (Ленинградский санитарно-гигиенический медицинский институт)
В. Я. Кочеровец (Военно-медицинская ордена Ленина академия им. С. М. Кирова)
В. В. Карцев, А. Г. Набокова, А. Я. Герчикова, Т. Я. Шлыкова (Ленинградская городская санитарно-эпидемиологическая станция)
Г. Е. Афиногенов (Ленинградский научно-исследовательский институт травматологии и ортопедии им. Р. Р. Вредена)
2
3. Moraxella.
4, Acinetobacter.
Паразитируют нейссерии на слизистых оболочках человека, при определенных условиях могут вызывать различные заболевания (менингиты, эндокардиты, уретриты, вагиниты, конъюнктивиты и др.).
Представители этого семейства хорошо растут на сывороточном, кровяном и шоколадном агаре, а также на простом агаре. Выявляются по характерным морфологическим и культуральным свойствам. Дифференциальные признаки родов этого семейства представлены в таблице № 7.
|
Таблица № 7 Дифференциальная характеристика родов семейства Neisserlaceae | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
|
Примечание: * возможно щелочение верхнего слоя среды. | ||||||||||||||||||||||||||||||||||||||||
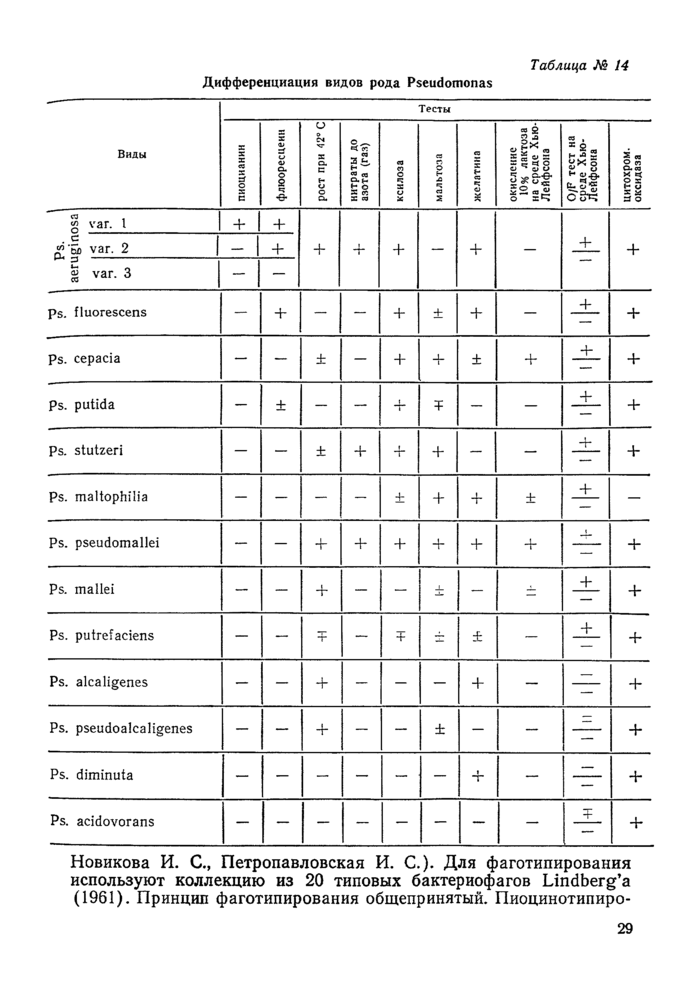
Дифференциация бактерий рода Acinetobacter с представителями семейства Enterobacteriaceae проводится по тестам таблицы № 25. Acinetobacter не ферментирует глюкозу в анаэробных условиях (тест Хью-Лейфсона), неподвижен, не образует сероводород, индол и капсул.
Род нейссерий (Neisseria) включает 6 видов микроорганизмов: 2 вида патогенных (менингококк и гонококк) и 4 вида
у сл овно-п атогенных.
Менингококк и гонококк отличаются от условно-патогенных нейссерий отсутствием роста на бессывороточных средах, мень-
20
ОГЛАВЛЕНИЕ
Стр*
1. Введение ....................
2. Принципы и сущность лабораторного контроля противоэпидемического
режима в стационарах................7
3* Условно-патогенные микроорганизмы — возбудители ГСИ . . . 10
4. Микробиологические методы обнаружения условно-патогенных микроорганизмов . 36
4.1. Материал и методика отбора проб для микробиологических исследований ...................39
4.2. Микробиологические методы исследования материала от персонала,
больных и лиц, соприкасавшихся с ними........45
4.2.1. Микроскопия материала ............45
4.2.2. Посев материала на питательные среды.......45
4.2.2Л. Посев при качественном исследовании.....45
4.2.2.2. Посев при количественных методах исследования . 48
4.2.3. Выделение микроорганизмов, идентификация видов и дифференциация разновидностей . 51
4.2.4. Документация бактериологических исследований .... 58
4.3. Санитарно-микробиологические методы исследования объектов
окружающей среды в стационарах ..........60
5. Эпидемиологическая оценка результатов микробиологических исследований ....................70
6. Приложения .............. 74
3
I. ВВЕДЕНИЕ
Проблема госпитальных инфекций стала одной из первоочередных проблем современной медицины и здравоохранения.
Под госпитальной инфекцией понимается любое клинически распознаваемое инфекционное заболевание, которое возникает у больного в результате пребывания в больнице или обращения в нее за лечебной помощью. В качестве синонимов этого термина нередко применяются понятия «внутрибольничная инфекциям «хирургическая инфекция», «раневая инфекция», «ятрогенная инфекция» и др.
Частота послеоперационных госпитальных инфекций в различных стационарах колеблется в широких пределах (от 2 до 30 % )-Этот вид патологии сопровождается высокой летальностью и способностью к эпидемическому распространению. Возникновение таких заболеваний наносит заметный экономический ущерб, увеличивая в 2—3 раза средний койко-день.
В течение длительного времени медиков интересовали только такие инфекционные болезни, которые вызываются патогенными возбудителями. В настоящее время все большее значение приобретают заболевания, вызываемые условно-патогенными микроорганизмами. Представлены они большим количеством видов, относящихся к различным родам и семействам.
Госпитальная инфекция, вызванная условно-патогенными микроорганизмами, проявляется в основном в виде нагноений и септических поражений.
Клиническими формами проявления гнойно-септических заболеваний являются: сепсис, менингит, отит, конъюнктивит, стоматит, абсцесс, флегмона, фурункулез, лимфаденит, мастит, пиодермия, панариций, остеомиелит, перитонит, цистит, уретрит, эндометрит, парапроктит и др.
Эти заболевания возникают в стационарах в тех случаях, когда создается комплекс условий, обеспечивающий реализацию механизма передачи возбудителя (экзогенная инфекция) или, приводящий к попаданию возбудителя из очагов инфекции или носитель-ства самого больного (эндогенная инфекция). Возникновение и развитие инфекционной болезни определяется также и услови-
ями, формирующими патогенность возбудителя и определяющими восприимчивость макроорганизма.
Успех борьбы с госпитальными гнойно-септическими заболеваниями зависит от решения ряда эпидемиологических и микробиологических задач, в частности системы и оперативности лабораторных исследований.
В задачу настоящих методических рекомендаций входит:
1. Унификация бактериологических методов исследования материала от больных гнойно-септическими заболеваниями и лиц, соприкасавшихся с ними.
2. Унификация санитарно-микробиологических методов исследования объектов внешней среды в стационарах.
3. Эпидемиологическая оценка результатов микробиологических исследований.
Настоящие методические рекомендации в значительной степени отражают работу кафедр эпидемиологии ЛСГМИ, микробиологии ВМедА им. С. М. Кирова, НИИ травматологии и ортопедии им. Р. Р. Вредена, санитарно-эпидемиологических и лечебно-профилактических учреждений г. Ленинграда; по разделу санитарной микробиологии частично использованы рекомендации Московского НИИ гигиены им. Ф. Ф. Эрисмана.
Методические рекомендации предназначены для стажеров-бак-териологов лабораторий лечебно-профилактических учреждений, для стажеров-бактериологов и эпидемиологов санитарно-эпидемиологических станций.
2. ПРИНЦИПЫ И СУЩНОСТЬ ЛАБОРАТОРНОГО КОНТРОЛЯ ПРОТИВОЭПИДЕМИЧЕСКОГО РЕЖИМА В СТАЦИОНАРАХ
Понятие лабораторный контроль стационаров включает микробиологическое обследование больных, персонала, различных объектов окружающей среды. Принято различать плановый лабораторный контроль, который проводится при отсутствии заболеваний, и лабораторный контроль по эпидемическим показаниям, который осуществляется при возникновении инфекционных заболеваний.
Техника исследований при проведении бактериологического контроля во многом однотипна, однако, задачи, объем, содержание исследований при плановом контроле и по эпидемическим показаниям существенно различаются.
Бактериологические исследования при отсутствии заболеваний проводятся с целью контроля противоэпидемического режима и подтверждения эффективности проводимых мероприятий по борьбе с инфекционными заболеваниями.
Исследования при возникновении гнойно-септических заболеваний проводятся с целью установления этиологии, выявления источников инфекции и факторов передачи.
Плановый бактериологический контроль базируется в основном на косвенных приемах: количественном учете общего уровня микробного обсеменения и определении санитарно-показательных микроорганизмов (стафилококки, бактерии группы кишечной палочки и др.). При проведении прямого выявления условно-патогенных микроорганизмов определяются те из них, которые являются наиболее частыми возбудителями ГСИ (стафилококки, синегнойная палочка, протей и др.).
Выявление общего содержания микроорганизмов в концентрациях, превышающих предельно допустимые, или прямая индикация потенциальных возбудителей свидетельствуют о том, что противоэпидемический режим в этом учреждении не выполняется должным образом. Результаты этих лабораторных исследований являются важным источником информации для эпидемиолога и должны вноситься в санитарный паспорт стационара (приложение № 5).
7
При плановых бактериологических исследованиях набор помещений, в которых производится отбор проб, и перечень предметов окружающей среды, подвергающихся обследованию, ограничен и четко определен (приказ М3 СССР № 720 от 31/VII—1978 г., приказ М3 СССР № 1230 от 6/ХП—1979 г., методические указания М3 СССР № 1201—74 от4/ХИ —74 г.).
Осуществляют плановый контроль бактериологические лаборатории санитарно-эпидемиологических станций, дезинфекционных станций и лечебно-профилактических учреждений. Отбор материала для исследования проводится персоналом лабораторий, стационаров и оперативных групп СЭС. Содержание, частота контроля и объекты исследования представлены в таблице N° 29.
По эпидемическим показаниям лабораторные исследования базируются на выявлении определенного штамма микроорганизма, послужившего возбудителем патологического процесса и циркулирующего в данном стационаре.
Для доказательства этиологической значимости микроорга* низма необходимо располагать данными о динамике, а в некоторых случаях (при исследовании мочи, мокроты, слизи носа и носоглотки) и о массивности его выделения от больного. Этим определяется необходимость повторного взятия и исследования материала от больного и применения количественных методов исследования.
При проведении эпидемиологического обследования важно знать не только вид выделенного микроорганизма, но и его тип, разновидность, б нов ар, т. е. особую метку госпитального штамма. Из этого следует, что микробные культуры, полученные от больных, персонала и из окружающей среды стационара, должны быть доступны для проведения дополнительной дифференциации. В связи с этим лаборатория должна располагать возможностями для хранения выделенных культур. В целях выявления госпитального штамма соответствующая группа культур подвергается дополнительному исследованию в этой же лаборатории или специально выделенном центре.
Выявление микробных штаммов единого серо-, фаго-, бактерио-цино- и антибиотико- вара из организма больного или персонала, а также на объектах окружающей среды позволяет путем сопоставления микробиологических и эпидемиологических данных обосновать этиологическую значимость данного микроорганизма в возникновении заболеваний, принадлежность выделенного микроорганизма к госпитальному штамму, выявить вероятный источник инфекции и факторы передачи.
Одним из важных условий успеха эпидемиологической диагностики является одномоментность забора материала от больных и из объектов окружающей среды. Это тем более необходимо, так как различные объекты окружающей среды являются чрезвычайно динамичными. Набор помещений и перечень объектов, подвергающихся лабораторному изучению при возникновении заболеваний, определяется в процессе эпидемиологического обследования. При
8
этом обследуются не только чистые предметы, но и бывшие в употреблении.
Лабораторные исследования по эпидемическим показаниям организует эпидемиолог СЭС, осуществляет их персонал бактериологических лабораторий СЭС или ЛПУ. Содержание, объем и частота исследований определяются результатами эпидемиологического обследования. Лабораторные исследования должны выполняться оперативно, четко и в полном объеме.