Методические рекомендации
Выделение и биотестирование костных рострегулирующих факторов
Купить Методические рекомендации — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
В методических рекомендациях приведены приемы выделения и очистки факторов, стимулирующих и тормозящих костеобразование и гемопоэз, из зрелой компактной костной ткани и способы тестирования их биологической активности. Рекомендации предназначены для биохимиков, патофизиологов, морфологов и других специалистов, работающих по проблеме регуляции остеогенеза и кроветворения.
Оглавление
1. Введение
2. Материалы и методы
2.1. Выделение и очистка костных рострегулирующих факторов
2.1.1. Подготовка костной ткани к декальцинации и экстрагированию
2.1.2. Экстрагирование костной ткани и фракционирование экстракта
2.2. Биотестирование белковых фракций на способность воздействовать на кроветворение
2.3. Биотестирование КРРФ на остеогенную активность
Заключение
Отрывной лист учета эффективности использования методов профилактики, диагностики, лечения
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 08.08.1990 | Утвержден | Минздрав РСФСР | |
|---|---|---|---|
| Разработан | Курганский Всесоюзный научный центр Восстановительная травматология и ортопедия | ||
| Издан | Типография издательства Советское Зауралье | 1990 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6
стр. 7

стр. 8
стр. 9
стр. 10

стр. 11
стр. 12
стр. 13

стр. 14

стр. 15

стр. 16
стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24
|
«СОГЛАСОВАНО» Заместитель начальника Главного управления научных учреждений Н. Н. САМКО. «8» августа 1990 г. |
«УТВЕРЖДАЮ» Заместитель министра Э. А. НОГОВИЦЫНА. «8» августа 1990 г. |
ВЫДЕЛЕНИЕ И БИОТЕСТИРОВАНИЕ КОСТНЫХ РОСТРЕГУЛИРУЮЩИХ ФАКТОРОВ
Методические рекомендации (с правом переиздания местными органами здравоохранения)
Курган, 1990 г.
|
«СОГЛАСОВАНО» Заместитель начальника Главного управления научных учреждений Н. Н. САМКО. «8» августа 1990 г. |
«УТВЕРЖДАЮ» Заместитель министра Э. А. НОГОВИЦЫНА. «-8» августа 1990 г. |
ВЫДЕЛЕНИЕ И БИОТЕСТИРОВАНИЕ КОСТНЫХ РОСТРЕГУЛИРУЮЩИХ ФАКТОРОВ
Методические рекомендации (с правом переиздания местными органами здравоохранения)
Курган, 1990 г.
вывать агрегаты, диссоциирующие в кислой среде (К- С. Десятниченко, Ю. П. Балдин, 1984), поэтому для их растворения и элюирования из колонки применяли буфер 0,02 fris-HCI, pH 4,0—4,5. Элюат собирали на коллекторе фракций порциями по 4 мл, оптическую плотность которых измеряли на спектрофотометре при 280 нм. Согласно этим измерениям и ориентируясь на кривую регистрирующего потенциометра, собирали фракции близкой молекулярной массы, величину которой устанавливали путем сравнения объемов выхода белков-маркеров: бычьего сывороточного альбумина, химотрипсиногена соевого ингибитора трипсина и РНК-азы. Для кодирования полученных фракций использовали округленные значения ММотн в кд, например: ICA, 50; ПСА, 30 и т. п.
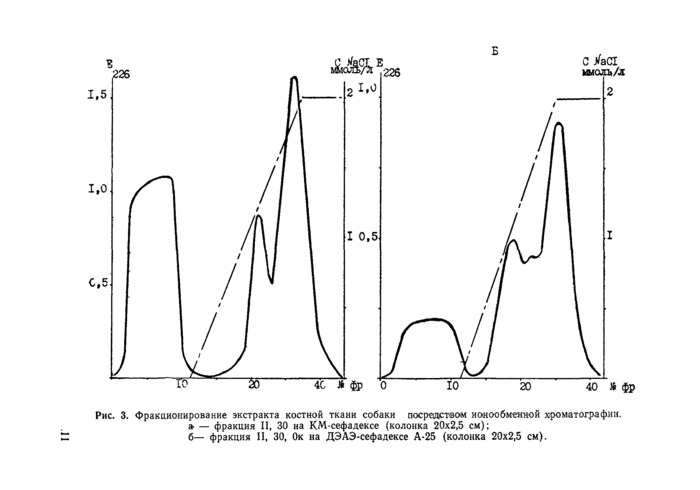
V—VI. Дальнейшую очстку выделенных на предыдущем этапе фракций осуществляли с помощью ионообменной хроматографии на колонках 15,0x1,5 см с КМ-сефадексом, используя для элюирования линейный градиент концентрации хлорида натрия от 0 до 2,0 моль/л в 0,05 М fris-HCI буфере, рН6,8. Регистрацию и отбор фракций для дальнейшей работы осуществляли как при гельфильтрации. Фракции, не проявлявшие сродства к катионообменнику, дополнительно хроматографировали на ДЭАЭ-сефадексе, используя для элюирования линейный градиент концентрации NaCI в тех же пределах в fris-HCI буфере pH 7,2. Для маркировки полученных белковых препаратов к обозначениям, присвоенным на предыдущем этапе фракционирования, добавляли значение концентрации NaCI, при котором они покидали ионообменник, и обозначение типа последнего. Например: ICA, 20, 1,5к; ПСА, 30, 2а; IIICA, 40 ОаОк. Хроматографические профили фракции II, 30 при очистке на КМ- и ДЭАЭ-сефадексе приведены на рис. 3.
V. По завершении фракционирования растворы белков обессоливали посредством диализа против дистиллированной воды, в диализных мешках концентрировали с помощью полиэтиленгликоля до объема 15—20 мл и лйофильно высушивали на установке СД2-1 (Hefo, Дания), предварительно намораживая раствор на внутренней поверхности флакона емкостью 25—50 мл во фризере СВ-10 той же фирмы.
В последнее время появилась возможность использовать для фракционирования смесей белков отечественные носители для гельпроникающей и ионообменной хроматографии,
10
|
Рис. 3. Фракционирование экстракта костной ткани собаки 1юере1дст©01м ионообменной хроматографии. ^ — фракция II, 30 на КМ-сефадексе (колонка 20x2,5 см); б— фракция II, 30, Ок на ДЭАЭ-сефадексе А-25 (колонка 20x2,5 см). |
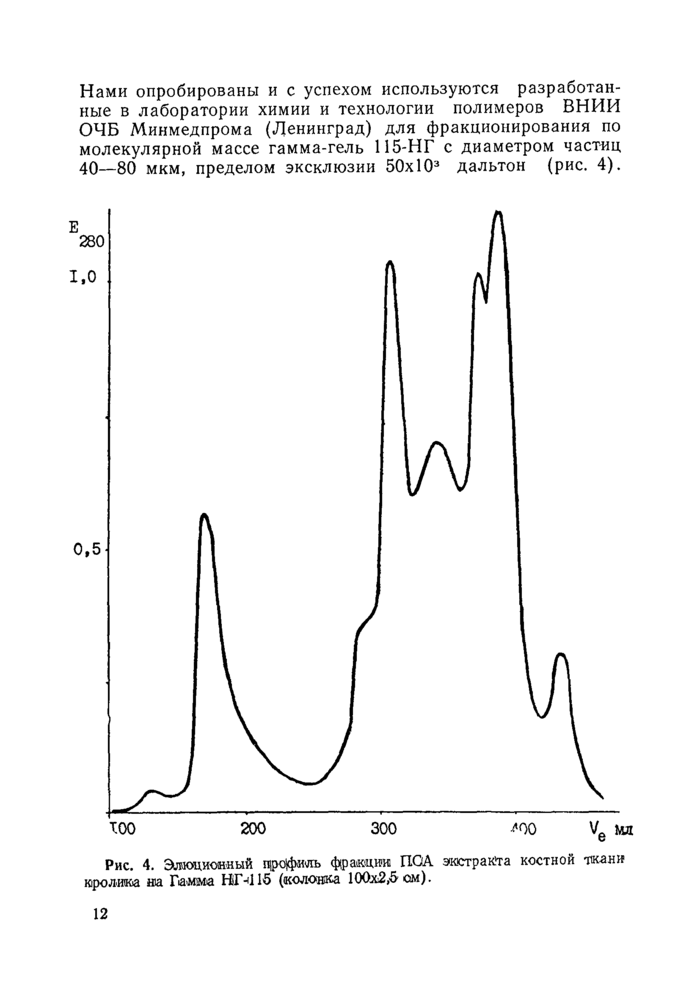
Нами опробированы и с успехом используются разработанные в лаборатории химии и технологии полимеров ВНИИ ОЧБ Минмедпрома (Ленинград) для фракционирования по молекулярной массе гамма-гель 115-НГ с диаметром частиц 40—80 мкм, пределом эксклюзии 50х103 дальтон (рис. 4).
|
Рис. 4. Эшяоцион«ый профиль фракции ПОА экстракта костной ткани кролика на Гамма Н1Г-416 (колонка 100x2,5 ом). |
Хорошие результаты показали также карбоксильный катионит СООН-ольвагель (обменная емкость по карбоксильным группам 0,3 мг-экв/мл, диаметр частиц 60—100 мкм) и ДЭАЭ-сферанит-ОН (обменная емкость по аминогруппам 0,2 мг-экв/мл, диаметр частиц 50—100 мкм).
На этапах выделения и очистки биологически активных факторов белковой природы из костной ткани необходим контроль за выходом белка на разных этапах процедуры выделения. Ввиду низкой концентрации и особенностей состава костных белков не могут быть применены наиболее часто применяемые высокочувствительные способы количественного определения белка: спектрофотометрия в дальней УФ-области, окрашивание специфическими красителями ку-масси G-250 и R-250, реакция с реактивом Фолина-Чиокал-теу (метод Лоури). Известен способ определения микроколичеств белка с 4-фенилспирофуран-2 (ЗН), Г-фталан-3,3’-дионом (флуорескамином), образующим с белком интенсивно флуоресцирующее соединение (R. Chen, 1974). Однако конъюгированию белка с флуорескамином мешают кислая среда (на этапе декальцинации костной ткани), высокая концентрация мочевины на этапе диссоциативного экстрагирования, и сульфата аммония на этапах высаливания отдельных фракций. Нами был предложен способ определения микроколичеств белка в экстрактах костной ткани на всех этапах выделения рострегулирующих факторов путем конъюгирования с флуорескамином и последующим измерением флуоресценции, отличающийся тем, что аликвоту экстракта диализируют против щелочного раствора аНС03, после чего измеряют количество белка по описанной ниже методике.
Принцип метода
Растворитель пробы белка посредством диализа замещается буферным раствором с pH, оптимальным для реакции с флуорескамином и не содержащим реагирующих с ним соединений, после чего проводят конъюгирование с флуорескамином и измерение флуоресценции, возбуждаемой УФ-лу-чами.
Оборудование
1. Флуориметр «Биан-130» (ЛОМО, Ленинград), включенный в измерительную схему иономера И-130 (ЗИП, Гомель) .
13
2. Диализный целлофан, например, «Диацель» (Химво-локно, Абалаково).
3. Диализный сосуд емкостью 2—3 л.
Реактивы
1. Раствор бикарбоната натрия, 0,05М, pH 8,3.
2. Раствор флуорескамина в ацетоне, 100 мг/100 мл. Готовится непосредственно перед анализом.
Подготовка пробы
Аликвоту экстракта костной ткани 0,2—0,5 мл разбавляют раствором бикарбоната натрия до 2 мл, заключают в диализный мешок и диализируют против 2—3 смен раствора бикарбоната, после чего содержимое диализного мешка переносят в мерный цилиндр 10 мл для определения коэффициента разведения.
Выполнение анализа
0.5 мл диализата смешивают с 0,1 мл свежеприготовленного раствора флуорескамина в ацетоне и через 10 мин. измеряют флуоресценцию при 490 нм, возбуждаемую УФ 365 нм. При необходимости пробу разбавляют раствором бикарбоната в 10 и более раз до концентрации белка в пределах 10—500 мкг/мл. Параллельно измеряют флуоресценцию конъюгата с каким-либо хорошо растворимым в слабощелочной среде белком известной концентрации.
При вычислении концентрации белка в исследуемой пробе учитывают степень разведения. Метод чувствителен не менее, чем к 5 мкг белка в пробе.
2.2. Биотестирование белковых фракций на способность воздействовать на кроветворение
Для отбора фракций на промежуточных этапах очистки и оценки гемопоэтической активности полученных препара* тов РРФ готовили растворы белков 1 мг/мл в 0,15 М NaCI, которые вводили подкожно белым беспородным мышам по 0,4—0,5 мл. Контрольные животные получали тот же объем раствора хлорида натрия. Животных помещали в клетки-от-садники не менее чем за 24 часа до эксперимента. Перед введением белкового препарата или физраствора из хвостовой вены мышей брали кровь и готовили мазки, которые су-правитально окрашивали раствором бриллиантового крези-14
лового синего в абсолютном этаноле 1 г/100 мл. Забор крови и приготовление мазков на ретикулоциты повторяли через 48 ч. после инъекции. При испытании фракций на промежуточных этапах очистки биотестирование этим ограничивалось. После введения окончательно очищенных препаратов через 48 ч. мышей забивали декапитацией, взвешиванием определяли массу тела животного и селезенки для подсчета селезеночного индекса (СИ):
QH _ масса селезенки, мг масса тела, г
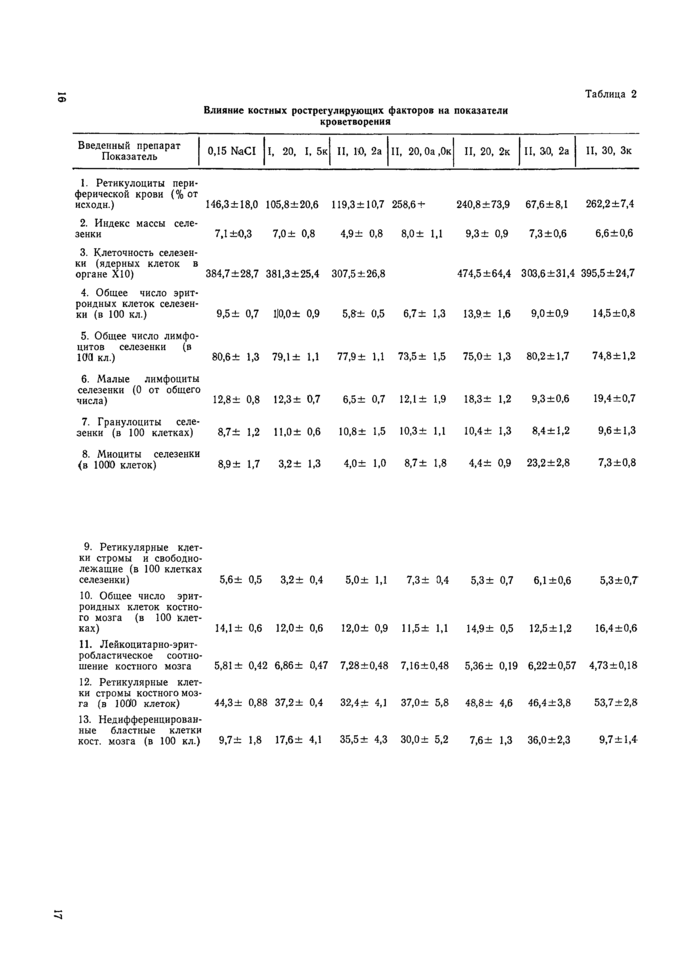
Готовили и окрашивали по Мей-Грюнвальду—Романовскому—Гимза мазки—отпечатки селезенки и костного мозга, определяли клеточность селезенки, для чего ее полностью гомогенизировали в 5 мл 0,5 М раствора уксусной кислоты, лизирующего эритроциты, но сохраняющего ядерные клетки, количество которых в селезенке рассчитывали после подсчета клеток гомогената в камере Горяева. В табл. 2 приведены некоторые гематологические показатели, характеризующие ряд выделенных нами КРРФ.
Для оценки функционального состояния ретикулоэндоте-лиальной системы используют так ’называемый конгорот-ин-декс. Для его измерения общепринятым методом дважды берут кровь у кролика посредством пункции желудочка сердца (В. С. Зудин, 1960 ). В целях упрощения и удешевления методики нами предложена следующая модификация измерения конгорот-индекс (КРИ).
Белым мышам линии CBI (не менее 5 животных в группе) внутрибрюшинно вводили по 0,3 мл 10%-ного раствора конгорот в 0,15 М NaCI. 1-ю группу животных забивали декапитацией через 15 минут после инъекции, 2-ю — через 60 минут. Кровь собирали в гепаринизированные пробирки, отделяли плазму центрифугированием, разбавляли ее в 2,5 раза 0,15М раствором NaCI и фотоколориметрировали при
500 нм. КРИ рассчитывали по формуле: КРИ = 100-
Е6о* 100
15
где Е15 и Е60 — средние значения оптических плотностей разведенной плазмы через 15 и 60 минут после инъекции конгорот соответственно.
2.3. Биотестирование КРРФ на остеогенную активность.
Многие аспекты физиологического действия КРРФ — до-зозависимость эффекта, влияние на репликацию (синтез
15
ф
Влияние костных рострегулнрующих факторов на показатели кроветворения
|
Таблица 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-а
ДНК) или биосинтез тканеспецифических белков — удобно исследовать в культуре остеогенных клеток с использованием меченых предшественников нуклеиновых кислот и белка и последующей радиоавтографией или счетом радиоактивности на автоматических |3- или у-счетчиках. Широкое распространение имеет методика оценки остеоиндуктивной активности трансплантатов внеклеточного матрикса кости, воссоединенного (реконструированного) с одной из белковых фракций экстракта костной ткани (Д. Д. Сумароков, М. R. Urist; А. Н. Reddi; J. Sampath и др., М. R. Urist с соавт. (1986 г.), с этой целью использовали также замещение циркулярного дефекта лучевой кости собаки реконструированным гомотрансплантатом декальцинированной костной ткани.
У кроликов циркулярный дефект малоберцовой кости высотой 4—6 мм замещается новообразованной костью в течение 5—6 недель (Г. А. Илизаров с соавт., 1984, 1985), что
можно ускорить введением биологически активных веществ, например, эритропоэтической сыворотки (Г. А. Илизаров с соавт., 1985). Эта модель была использована нами и для биотестирования остеогенной активности КРРФ. Кроликам в условиях обезболивания в условиях асептики производили разрез кожи в верхней трети голени по наружной поверхности, расслаивали мышцы и резецировали кусачками участок диафиза малоберцовой кости протяженностью 4 мм. Рану послойно зашивали, швы обрабатывали этанолом. Через 3 суток после операции животным в вену уха вводили раствор одной из белковых фракций из расчета 1 мг/1 кг массы тела или равный объем 0,15 М хлорида натрия. Рентгеновские снимки оперированной конечности получали тотчас после операции и один раз в неделю до конца наблюдения. Для оценки активности новообразования и резорбции костной ткани измеряли и записывали оптическую плотность рентгеновской тени малоберцовой кости на регистрирующем микрофотометре ИФО-451 в масштабе 1 : 5.
На рис. 5 приведены фотографии рентгеновских снимков в динамике замещения дефектов малоберцовой кости в контрольной группе и при испытании двух из выделенных нами КРРФ. В качестве меры активности репаративного остеогенеза мы рассматривали скорость изменения площади под денситографической кривой (рис. 6), принимая скорость заполнения дефекта (V) равной » гДе So и Б^площади
|
Рис. 5. Замещение стандартного дефекта малоберцовой кости кролика: ,а — сразу после операции, через 4 недели после операции; б — контроль; в — под вшиш-шем фракции П, 30, 2к; г — под влиянием фракции II, 10, 2а. |
под денситографической кривой соответственно сразу после операции и через время t после нее. Принято, что дифференциальное уравнение, описывающее процесс замещения дефекта, имеет вид:
Л, _ dSt/So v " dt
|
1 2So |
где а и b — основания трапеции, образованные денситограм-мо.й, при этом величина а может увеличиваться в динамике замещения дефекта в связи с частичной декальцинацией концов отломков, тогда как уменьшение b соответствует сокращению протяженности дефекта вследствие заполнения его новообразованной костной тканыо; Н — высота трапеции-денситограммы — обусловлена рентгеновской плотностью, увеличивающейся по мере минерализации новообразованной костной ткани.
19
Перед операцией, на 7-е, 14-е, 21-е, 28-е сутки после нее у кроликов исследовали периферическую кровь на содержание гемоглобина, гематокрит, количество эритроцитов, ретикуло1 цитов, лейкоцитов в единице объема и формулу белой крови. После эвтаназии на 21-е или 28-е сутки эксперимента готовили и окрашивали мазки-отпечатки селезенки и костного мозга метафизов большеберцовых костей оперированной и контрлатеральной конечностей. Для выполнения гистологических исследований кости голени пересекали в 1,5 см проксимальнее и дистальнее регенерата малоберцовой кости, фиксировали в 10%-ном нейтральном формалине, обезвоживали и заливали в парафин, после чего готовили серийные срезы малоберцовой кости, которые окрашивали гематоксилин-эозином. На гистологических препаратах измеряли протяженность проксимального и дистального отделов костного регенерата, высоту соединяющей их фиброзно-клеточной прослойки, наличие островков хондроидной ткани и периостальных наложений.
Гистологические исследования были выполнены на 26 кроликах контрольной и 4 опытных групп. В контроле через 21 день после операции дефект малоберцовой кости заполнен костно-соединительно-тканным регенератом. С концами спаяны балки новообразованной губчатой кости. Противолежащие костные отделы регенерата соединяет до 1 мм прослойка соединительной ткани, со стороны которой продолжается активное костеобразование. В составе регенерата выявляются островки хондроидной ткани. В одном случае в окружающих мягких тканях имеется выраженная воспалительная реакция, Она распространяется и на костную ткань регенерата. В другом наблюдении в концах отломков отмечается гибель остеоцитов на значительном протяжении и выраженная остеопластическая резорбция компактной кости.
В группе животных, получавших инъекции П, 30, 2к в тот же срок диастаз между отломками заполнен молодой губчатой костью, спаянной с концами последних. В части препаратов между костными отделами регенерата прослеживается фиброзно-клеточная прослойка 1—1,3 мм высотой. В расширенных сосудистых канальцах видно напластование молодой кости. Прогрессирующая периостальная реакция более выражена на поверхности дистального отломка. В другом наблюдении отмечены микроскопические островки хрящевой ткани в составе соединительно-тканной прослойки.
20
В методических рекомендациях приведены приемы выделения и очистки факторов, стимулирующих и тормозящих костеобразование и гемопоэз, из зрелой компактной костной ткани и способы тестирования их биологической активности. Рекомендации предназначены для биохимиков, патофизиологов, морфологов и других специалистов, работающих по проблеме регуляции остеогенеза и кроветворения.
Методические рекомендации составили: каед. мед. наук, ©едущий научный сотрудник К. С. Десятниченко, док. мед. наук, ведущий научный сотрудник Ю. П. Балдин, канд. мед. наук, ведущий научный сотрудник А. Н. Дьячков, научный сотрудник С. П. Изотова, младшие научные сотрудники С. Н. Лунева и Т. А. Силантьева, ст. лаборант О. Л. Карпенко Курганского Всесоюзного научного центра «Восстановительная травматология и ортопедия» (генеральный директор член-корр. АН СССР, профессор Г. А. Илизаров). 1
У кроликов, которым вводили раствор фракции П, 10, 2а, через 3 недели после операции прилегающие к отломкам отделы регенерата представляют собой сеть балок губчатой кости эндостального и периостального происхождения. Апикальные отделы этих образований соединяются между собой прослойкой, напоминающей дистракционный регенерат, но умеренно выраженной активности костеобразования- В составе новообразованных костных перекладин часто сохраняются остатки межклеточного вещества хряща и грубоволокнистой костной ткани. На поверхности костных отломков можно было отметить массивные периостальные напластования, в составе которых имеются островки хондроидной ткани. В одном наблюдении была отмечена бурная остеокластическая резорбций.
На препаратах той же группы через 28 дней после операции определяются конусообразные костные отделы регенерата. Их вершины сливаются с фиброзной прослойкой, соединяющей грубые пучки коллагеновых волокон. На вершинах костных балочек сохраняется вялотекущее, аппозиционное костеобразование. В этот же срок у животных, получавших фракции П, 20, 1, 5к и П, 30, 2к, дефект заполнен регенератом, состоящим в основном из молодой губчатой кости, в составе которой в ряде случаев сохраняется межклеточное вещество хряща. Репаративная реакция затухает, но на отдельных участках сохраняется прогрессирующая периостальная реакция, в костно-мозговых полостях обнаружен кроветворно-жировой костный мозг.
Для описания динамики состава красной крови на протяжении замещения дефектов малоберцовой кости использовали системный индекс красной крови (СИКК), вычисляемый
по формуле: СИКК “
где Нв, эр, рет — концентрация гемоглобина (Г/Л), эритроцитов (1012 клеток/л), ретикулоцитов (клеток/1000 эритр.) соответственно.
У кроликов до операции СИКК составлял 34,3±2,3. Падение СИКК примерно одинаково в контроле и во всех опытных группах и достигает максимума на 14-е сутки. К 21 дню эксперимента во всех группах намечается тенденция к повышению СИКК, однако только на конец эксперимента только
21
L ВВЕДЕНИЕ
Одним из важнейших биологических аспектов влияния чрескостного остеосинтеза по Г. А. Илизарову является механизм регуляции пролиферации и дифференцировки остеогенных клеток. Выполнение в ВКНЦ «ВТО» исследований общей реакции организма на травму показало, что местные условия, создаваемые чрескостным остеосинтезом, оптимизируют течение адаптивного процесса после скелетной травмы и оперативного вмешательства на опорно-двигательном аппарате, контролируемое нейрогуморальным путем, пролонгируют продуктивную анаболическую фазу репаративного остеосинтеза (Г. А. Илизаров с соавт., 1985 г. а, 1986 г. а, б; К. С. Десятниченко с соавт., 1983, 1984 а, 1988; К. С. Десятниченко, 1988, Н. В. Офицерова, 1988).
Появление активности, стимулирующей остеогенез, в сыворотке крови человека и животных с репаративным остеогенезом (Lorin-Epsctein, 1927; Г. С. Соловьев, В. В. Колпаков, 1973; П. В. Дунаев, Г. С. Соловьев, 1975; В. И. Филимонов с соавт., 1977; Н. П. Лепехова, 1978), а также способность имплантатов декальцинированного костного матрикса индуцировать эктопический остеогенез (Urist, 1965; 1968; А. Я. Фриденштейн, К. С. Лалыкина, 1974) позволили предположить существование во внеклеточном матриксе кости веществ, возбуждающих пролиферативную активность и дифференцировку клеток-предшественников костной ткани.
В исследованиях, выполняемых в ВКНЦ «ВТО» с 1979 года также была показана роль фракций неколлагеновых белков костной ткани в поддержании тканевого гомеостаза кости и крови (Г. А. Илизаров с соавт., 1982, 1985 б, 1986 а; К. С. Десятниченко с соавт., 1984 б, 1987; С. П. Изотова, К, С. Десятниченко, 1982; С. И. Щиралиева, С. П. Изотова,
3
1986). В отличие от проводившихся в то же время исследований костных рострегулирующих факторов (КРРФ) в ряде лабораторий других стран (Farley, Baylink, 1982; Shimizu-etal, 1983; Canalis, 1984) нами установлено, что мишенями действия и ингибитора, и стимулятора пролиферации являются не только остеогенные клетки, но и кроветворные, что подтверждает положение Г. А. Илизарова о единстве морфогенеза кости и крови на основе общих клеточных источников и регуляции (Г. А. Илизаров с соавт., 1980, 1982,
1986).
Кроме того, установлено, что в крови больных с переломами трубчатых костей на высоте репаративного процесса появляется белковая фракция с физико-химическими свойствами (высаливаемость солями аммония, сродство к ани-онообменнику, относительная молекулярная масса), которая при введении подкожно мышам более чем в 1,5 раза увеличивает у них количество ретикулоцитов в периферической крови через 48 часов после введения (К. С. Десятниченко с соавт., 1987 б). В сопоставлении с вышеизложенным и ранее выполненными исследованиями остеопоэтической активности сыворотки животных с активным остеогенезом (В. И. Филимонов о соавт., 1977; Н. П. Лепехова, 1978) эти данные позволяют предполагать, что КРРФ способны поступать, в кровеносное русло при определенных условиях, и при дистракционном остеосинтезе обеспечивают на молекулярном уровне стимулирующее влияние напряжения растяжения на остеогенез (Г. А. Илизаров с соавт., 1982, 1986).
В последующих исследованиях была поставлена цель добиться более глубокой очистки рострегулирующих факторов костного внеклеточного матрикса, углубить сведения о механизме их физиологического действия.
Перспективность клинического применения костных рострегулирующих факторов для лабораторной диагностики и фармакологического потенцирования влияния чрескостного остеосинтеза на репаративные процессы вызвала необходимость разработки и апробации методов выделения и очистки белковых фракций внеклеточного матрикса костной ткани и способов биотестирования на лабораторных животных их остеогенных и гемопоэтических потенций.
4
2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Выделение и очистка костных рострегулирующих факторов
2.1.L Подготовка костной ткани к декальцинации и эк~ страгированию.
В качестве источника КРРФ использовали зрелую компактную кость диафизов длинных трубчатых костей. Заведомо зная, что их содержание здесь меньше, чем в эпифизарной губчатой кости или, тем более, в эмбриональной костной ткани, мы предпочли этот объект, поскольку его намного легче очистить от параоссальных тканей, он значительно меньше содержит клеточного материала, т. е. больше уверенность в том, что источником выделяемых белков является минерализованный внеклеточный матрикс. В зависимости от размеров костей (к настоящему времени КРРФ выделен из костной ткани Человека, кролика, собаки и крысы) эпифизы отделяли с помощью пилы или кусачек. Диа-физы расщепляли вдоль, тщательно соскабливали надкостницу и эндост, измельчали кусачками до частиц с наибольшим размером, не превышающим 4—5 мм, которые отмывали последовательно в 0,1 %-ном растворе тритона Х-100 дистиллированной воде (3—5 раз) и 0,15 М растворе NaCI (2—3 раза). При отмывании кусочки кости перемешивали на магнитной мешалке, при каждой смене отмывающей жидкости декантировали частицы неминерализованной ткани.
2,1.2. Экстрагирование костной ткани и фракционирование экстракта.
Последовательность операций при выделении КРРФ из зрелой компактной ткани приведена на схеме (табл. 1). На первом этапе — декальцинации кости (1) — измельчённую и отмытую ткань помещали в диализные мешки из диацеля (ПО «Химволокно», Балаково) и декальцинировали путем диализа против 0,5 н. HCI. Противодиализат объемом 2 л/100 г ткани заменяли свежим через 24, 48 и 96 ч. диализа, который осуществляли при 4—6° С с перемешиванием противодиализата на магнитной мешалке общей продолжительностью 5—7 суток. После завершения декальцинации содержимое диализного мешка переносили в стеклянный или пластиковый сосуд, добавляли мочевину до концентрации
5
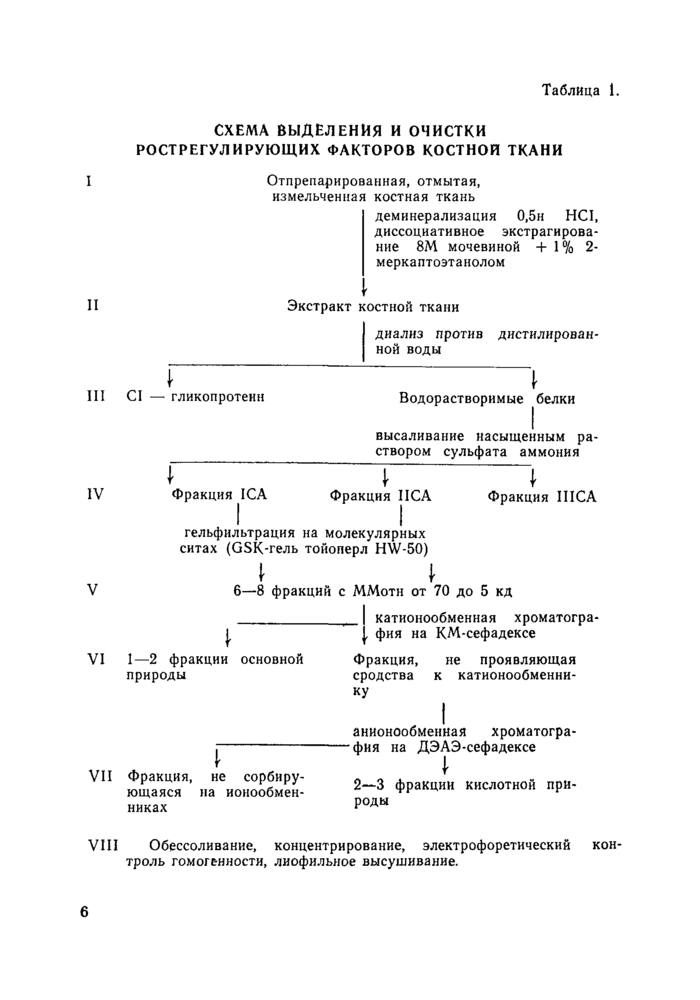
Таблица 1.
СХЕМА ВЫДЕЛЕНИЯ И ОЧИСТКИ РОСТРЕГУЛИРУЮЩИХ ФАКТОРОВ КОСТНОЙ ТКАНИ
I Отпрепарированная, отмытая,
измельченная костная ткань
деминерализация 0,5н HCI, диссоциативное экстрагирование 8М мочевиной + 1 % 2-меркаптоэтанолом
II Экстракт костной ткани
диализ против дистилирован-ной воды
III CI — гликопротеин
" I
Водорастворимые белки
высаливание насыщенным раствором сульфата аммония
IV Фракция ICA Фракция ПСА Фракция ШСА
гельфильтрация на молекулярных ситах (GSK-гель тойоперл HW-50)
I I
V 6—8 фракций с ММотн от 70 до 5 кд
_ катионообменная хроматогра-
, фия на КМ-сефадексе
VI 1—2 фракции основной Фракция, не проявляющая
природы сродства к катионообменни-
ку
анионообменная хроматография на ДЭАЭ-сефадексе
I
2—3 фракции кислотной природы
VII Фракция, не сорбирующаяся на ионообмен-никах
VIII Обессоливание, концентрирование, электрофоретический контроль гомогенности, лиофильное высушивание.
6
8 моль/л и 2-меркаптоэтанол до концентрации 1 мл/100 мл диализата. Проводили экстрагирование деминерализованного матрикса в присутствии этих веществ, вызывающих диссоциацию водородных и дисульфидных связей в супрамоле-кулярных комплексах внеклеточного матрикса, в течение 3—5 суток на холоде при постоянном перемешивании.
II. Экстракты отделяли от нерастворившихся частиц коллагенового матрикса декантированием и центрифугированием при 5000 g на центрифуге ЦЛР-1 в течение 1 часа. Супернатант помещали в диализный мешок и диализировали против дистиллированной воды на холоде в течение 24 ч. с трехкратной заменой противодиализата. При этой процедуре преципитирует так называемый GI-гликопротеин (Herring et al., 1974)—супрамолекулярный комплекс солюбилизированного при экстрагировании коллагена и некоторых неколлагеновых белков костной ткани. Его отделяли от белков, растворимых при низкой ионной силе, центрифугированием при 10000 об./мин.-1 в роторе типа 19 или SW-27 на препаративной ультрацентрифуге L-5-65 (Beckman, США) в течение 1,5—2 часов.
III. Полученный после центрифугирования супернатант фракционировали посредством высаливания сульфатом аммония, который в виде насыщенного раствора добавляли вначале до концентрации 1,2 моль/л (около 30% насыщения), выдерживали в холодильнике в течение ночи и собирали с помощью центрифугирования выпавший в осадок белок (ICA фракция). В супернатанте доводили содержание сульфата аммония до 2 моль/л (около 50% насыщения) и аналогичным путем собирали фракцию ПСА. Обе фракции сохраняли для дальнейшего фракционирования в виде суспензии в насыщенном растворе сульфата аммония. Оставшийся в экстракте белок может быть осажден при 75%-ном насыщении сульфатом аммония, но высокая плотность такого раствора затрудняет отделение белка посредством центрифугирования и ведет к дополнительному расходу осадителя. Для получения фракции ШСА мы предпочли другой путь — диализировали против воды и обессоленный раствор в диализном мешке концентрировали с помощью полиэтиленгликоля (м. в. 20000—* 40000).
IV. Фракции, полученные высаливанием, подвергали разделению по молекулярной массе с помощью гельфильтрации
7
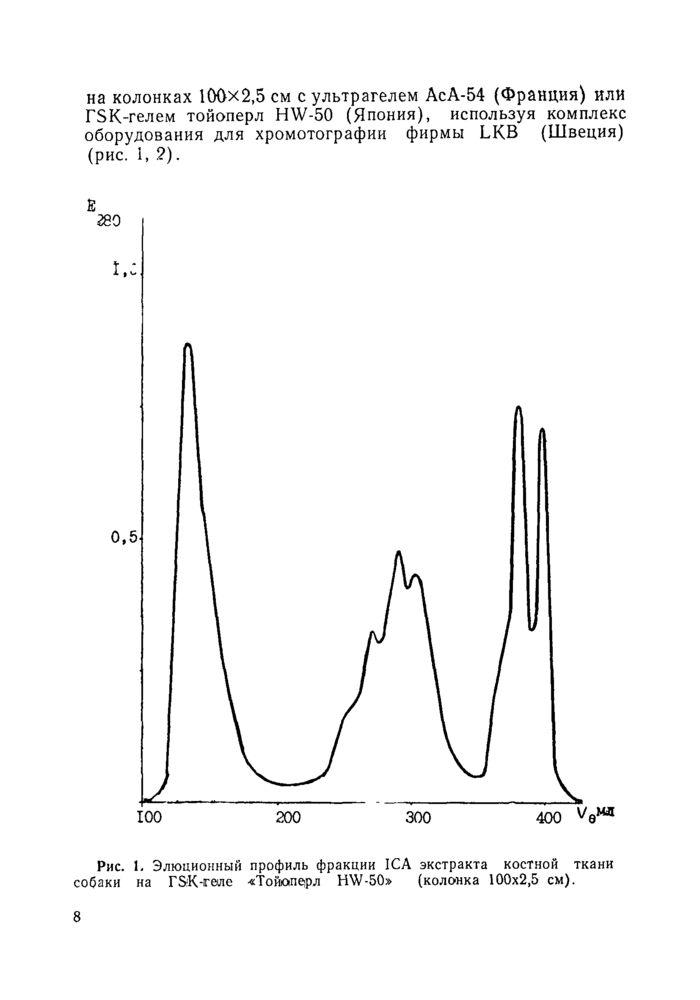
на колонках 100x2,5 см с ультрагелем АсА-54 (Франция) или rSK-гелем тойоперл HW-50 (Япония), используя комплекс оборудования для хромотографии фирмы LKB (Швеция) (рис. 1, 2).
Е
|
Рис. 1, Элюционный профиль фракции ICA экстракта костной ткани собаки на Г&К-геле «Тойк>пе|рл HW-БО» (колонка 100x2,5 см). |
8
|
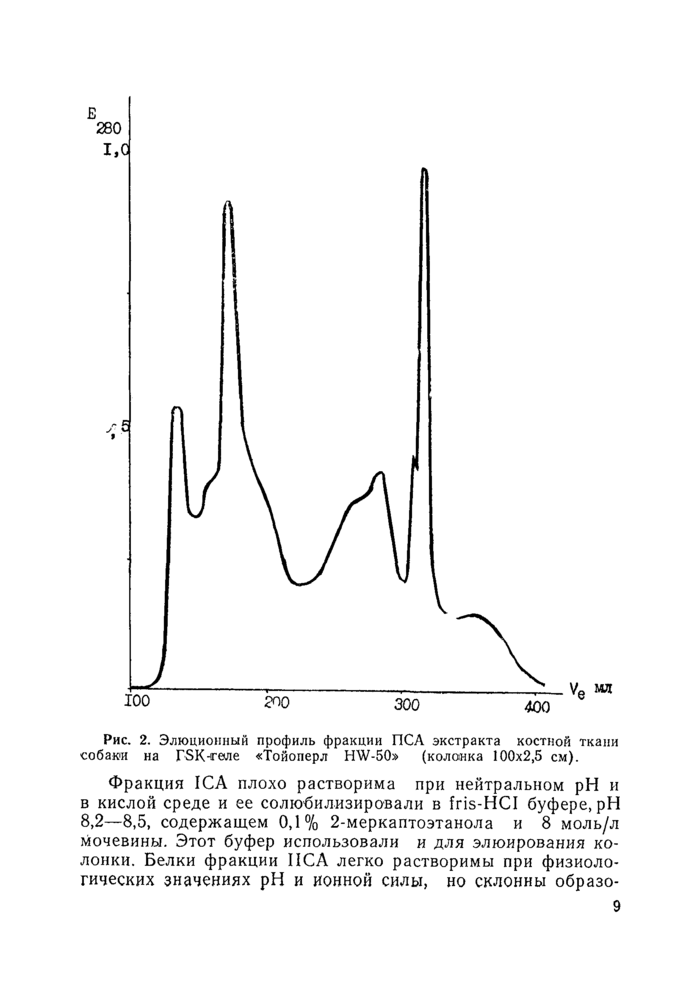
Рис. 2. Элюциоиный профиль фракции ПСА экстракта костной ткани собаки на ГЗК-геле «Тойоперл HW-50» (колонка 100x2,5 см). |
Фракция ICA плохо растворима при нейтральном pH и в кислой среде и ее солюбилизировали в fris-HCI буфере, pH 8,2—8,5, содержащем 0,1% 2-меркаптоэтанола и 8 моль/л мочевины. Этот буфер использовали и для элюирования колонки . Белки фракции ПСА легко растворимы при физиологических значениях pH и ионной силы, но склонны образо-
9
1