Методические рекомендации по микробиологическому исследованию молока и секрета вымени коров для диагностики мастита
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания предназначены для научно-исследовательских учреждений, ветеринарных лабораторий, занимающихся вопросами диагностики и лечения маститов.
Методические указания включают методы исследования молока и секрета вымени коров при диагностике мастита и содержат современные, доступные для практического использования микробиологические методики с подробным изложением рецептов питательных сред.
Оглавление
1. Общая часть
2. Специальная часть
2.1. Правила отбора и доставки проб молока
2.2. Правила доставки проб
2.3. Методы исследования молока (секрета вымени) коров на наличие возбудителей мастита
Приложение Рецепты питательных сред
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| Разработан | ВНИИ ветеринарной санитарии | |
| Разработан | Республиканская научно-производственная лаборатория РФ | |
| Утвержден | Российская академия сельскохозяйственных наук |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9
стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23
стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
РОССИЙСКАЯ АКАДЕМИЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ НАУК
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО МИКРОБИОЛОГИЧЕСКОМУ ИССЛЕДОВАНИЮ МОЛОКА И СЕКРЕТА ВЫМЕНИ КОРОВ ДЛЯ ДИАГНОСТИКИ МАСТИТА
Москва 1994
РОССИЙСКАЯ АКАДЕМИЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ НАУК
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО МИКРОБИОЛОГИЧЕСКОМУ ИССЛЕДОВАНИЮ МОЛОКА И СЕКРЕТА ВЫМЕНИ ДЛЯ ДИАГНОСТИКИ МАСТИТА
|
Москва |
- 1994 |
IU
проб молока готовят разведения 1:100 в стерильном физиологическом растворе.
В чашку Петри с кровяным новокаиновым или ДНК-новокаиновым агаром (рец. 4,5) вносят 0,1 см3 молока из разведения 1:100 и равномерно рассевают его стеклянным шпателем по всей поверхности питательной среды.
Засеянные чашки помещают в термостат крышками вниз и инкубируют при 37±1°С в течение 22-24 ч. На ДНК-новокаиновом агаре золотистый стафилококк растет в виде крупных круглых колоний с ровными краями, на новокаиновом кровяном агаре - вокруг колонии выражена зона гемолиза. Чашки с ДНК-новокаиновым агаром заливают I V раствором соляной кислоты, затем просматривают в проходящем свете. Обнаружение колоний, окруженных зоной просветления с четкими границами, или зоной гемолиза (на кровяном агаре), указывает на наличие в исследуемом материале золотистого стафилококка .
Для определения количества золотистого стафилококка в I см3 исследуемого материала подсчитывают колонии с зонами просветления по всей поверхности среды и полученное число колоний умножают на 10 (объем посевного материала 0,1 см3) и на степень разведения материала.
Например: высеяно 0,1 см8 молока из разведения 1:100.
В результате подсчета получено 15 колоний. Следовательно, в I см3 молока - 15000 микробных клеток золотистого стафилококка (15x10x100).
2.3.5.12. Оценка результатов
Стафилококки вида s. aureus , обладающие гемолитической активностью, плазмокоагулирующими свойствами или ДНК-азной активностью и разлагающие маннит в анаэробных условиях, относят к возбудителям мастита. В молоке коров, больных маститом, на и-
II
более часто содержатся стафилококки видов s, aureus, s hemo-lytic-us, s. epidermidis , Стафилококк вида S. saprophiticus является возбудителем мастита и может быть обнаружен в молоке как здоровых, так и больных коров вследствие его контаминации.
2.3.5ЛЗ. Фаготипироваиие стафилококка
В случае необходимости определения источника стафилококковой инфекции проводят фаготипироваиие культур стафилококков, выделенных из молока и секрета вымени коров, используя набор-стафилококковых бактериофагов животного происхождения, выпускаемый Научно-исследовательским институтом эпидемиологии и микробиологии им.Н.Ф.Гамалеи. Фаготипированию подлежат культуры стафилококков, вызывающие гемолиз эритроцитов крупного рогатого скота и свертывание плазмы крови кролика.
Постановка реакции
Содержащиеся во флаконах лиофильно высушенные фаги в объеме 0,1 см3 ресуспендируют в I см3 МПБ (с 0,4# глюкозы иЧ),4 хлористого кальция (CaCI^), получая основное разведение 10”* (1:10). Из основного разведения фага готовят два рабочих разведения, соответствующие I тест-разведению (ТР) и 100 ТР. Разведение, соответствующее одному ТР, указано на этикетке.
Основное разведение фагов 10”* хранят при температуре 4°С и используют в течение 1,5-2 месяцев. Разведение фага, соответствующее I ТР, следует готовить заново через каждые 7 суток из основного разведения 10”*.
Методика фаготипирования
Суточную агаровую культуру испытуемого штамма стафилококка засевают в 2,5 см3 бульона Хоттингера, Мартена или мясо-пептои-ного бульона (pH 7,2-7,4) и выращивают 3-5 ч при 37±1°С (до заметного помутнения среды). Одновременно готовят чашки с 1,2%-ныи агаром Хоттингера, содержащего 200 мг% аминного азота; 0,45%
12
глюкозы и 0,02% хлористого кальция. Хлористый кальций добавляют в ореад, охлажденную до 45°, перед разливом в чашки (рец. № 9).
В чашки Петри разливают по 15 смэ расплавленного агара и после застывания ее подсушивают 30-40 мин при 37£l°C. Выросшую трехчасовую бульонную культуру стафилококка вносят пастеровской пипеткой в чашки и орошают поверхность агара. Избыток культуры отсасывают пастеровской пипеткой и удаляют, после чего агар вновь подсушивают 40-60 мин при 37jtI°C.
Дно засеянной чашки расчерчивают карандашом по стеклу на квадраты по трафарету соответственно числу используемых фагов.
В каждый квадрат засеянной среды пастеровской пипеткой с тонко оттянутым концом или стандартной петлей наносят каплю соответствующего фага. Один квадрат оставляют для контроля без фага. После нанесения каждого фага петлю обжигают, пастеровскую пипетку утилизируют. После подсыхания капель фага чашки переворачивают дном кверху и инкубируют 5-6 ч при температуре 37j;I0C, а затем оставляют на 18-20 ч при комнатной температуре. Нанесение фагов на агар в чашки может быть проведено специальным аппаратом для фаготипирования стафилококков, который имеет 25 металлических стержней, вмонтированных в квадратную пластину, соединенную с поршнем. Основанием прибора служит площадка из органического стекла, на которой находится свободно передвигающаяся вторая площадка с гнездом для фиксирования засеваемой чашки и пластинки из фторопласта с резервуаром для фагов. В резервуары стерильной фторопластовой пластинки, помещенной в стерильную чашку Петри, наливают по 3-5 капель фагов (всегда в одном порядке). Чашку с агаром и пластинку с фагами помещают на подвижную пластинку. Поочередным передвижением площадки устанавливают под металлическими стержнями сначала пластинку с фагами, а затем чашку с агаром. Опуская и поднимая стержни о помощью пор-
13
шня, переносят капли фагов на чашку с агаром, едва касаясь его поверхности* Чашки меняют в зависимости от числа типируемых культур. Чашки с фагами оставляют на столе на 30-40 мин и затем их орошают четырехчасовой бульонной культурой стафилококков* После подсыхания культур чашки переворачивают крышкой вниз, инкубируют 5-6 ч при 37±1°С, а затем оставляют на 18-20 ч при комнатной температуре.
Для фаготипирования штаммов стафилококков вначале используют первое рабочее разведение, соответствующим I ТР. Культуры стафилококков, которые не лизировались хотя бы одним фагом, ти-пируют повторно аналогичными фагами в разведении 100 ТР.
Учет и регистрация результатов
Степень лизиса культуры разными разведениями фага регистрируют по следующей схеме: (++++) - сливной полный лизис, (+++) -неполный сливной лизис (незначительный рост культуры в зоне лизиса), (++) - наличие в месте нанесения капли фага свыше 50 пятен лизиса (колоний фага), (+) - от 20 до 50 пятен лизиса,
(±) “ менее 20, (-) - полное отсутствие лизиса. Для упрощения схемы учета степени лизиса обозначения ++++, +++, ++ и называемые "сильной реакцией", можно регистрировать одним обозначением ++*
Одна и та же культура стафилококка чаще лизируется не одним, а несколькими фагами, что создает для каждого штамма характерную фагомозаику.
Штаммы считают типируемыми, если хотя бы один фаг вызвал реакцию с оценкой не менее ++. Если при типировании культуры фагом в разведении I ТР получена слабая реакция с оценкой + или it то такой штамм типируют повторно фагом в разведении ТОО ТР. Результаты фаготипирования культур регистрируют в виде таблицы, указывая название штамма стафилококка, номера ш разведения фагов, с помощью которых был получен лизис культуры (I ТР или
14
100 TP).
Если культуры стафилококка лизируются одними и теми жо фагами и составляют одну мозаику, их следует считать идентичными.
В тех случаях, когда мозаика различается на 1,2 и более сильных реакций, следует исходить из следующего правила: если штаммы стафилококков при типировании в один и тот же день отличаются сильной реакцией по одному фагу, их следует считать идентичными, если разница составляет по двум и более фагам, штаммы следует признать разными.
Учет результатов проводится в соответствии с "Методическими указаниями по применению бактериофагов" (утв.Минздравом СССР II.04.1976 г.» согласовано с ГУБ МСХ СССР 16.09.1976 г.).
2.3.6. Выделение и идентификация стрептококков
2.3.6.1. Для выделения стрептококков из молока используют кровяной агар (рец. № I) или одну из следующих элективных сред-среду-Карташовой жидкую (рец. № 10), среду Карташовой плотную (рец. № II), среду Эдвардса (рец. №> 12).
На кровяном агаре стрептококки растут в виде мелких росии-чатых или мелких непрозрачных колоний с небольшой зеленоватобурой полупрозрачной зоной гемолиза или без гемолиза. В тонком слое 5-7]&-ного кровяного агара зона гемолиза выражена более четко и может быть абсолютно прозрачной.
При росте стрептококков в жидкой среде Карташовой цвет среды за счот ферментации лактозы переходит из синего в зеленый -На дне и по стенкам пробирки образуется крошковидный осадок, бульон остается прозрачным или наблюдается слабое его помутнение. При использовании плотной среды на фоне синего агара вырастают мелкие прозрачные колонии jp -формы, вокруг которых среда окрашивается в зеленый цвет.
На среде Эдвардса стрептококки растут в виде мелких (1-2 мм в диаметре) колоний бесцветные или серовато-синего цвета (рец.№ 12)*
15
2.3.6.2. В мазках из культур в жидких питательных средах стрептококки имеют вид цепочек различной длины, в мазках с плотных сред - стрептококки расположены попарно или в виде коротких цепочек*
Для дальнейшей дифференциации часть культуры пересевают на скошенный сывороточный агар.
2.3*6*3. Одним из характерных признаков стрептококков в отличие от стафилококков является отсутствие каталазной активности (каталазоотрицательные). Для определения каталазной активности выросшую на плотной среде культуру стрептококка снимают петлей и растирают в капле 10^-ной перекиси водорода (пергидроль разводят в соотношении 1:3) на предметном стекле. Выделение газа при растирании культуры стрептококков (в отличие от стафилококков) не происходит - реакция отрицательная.
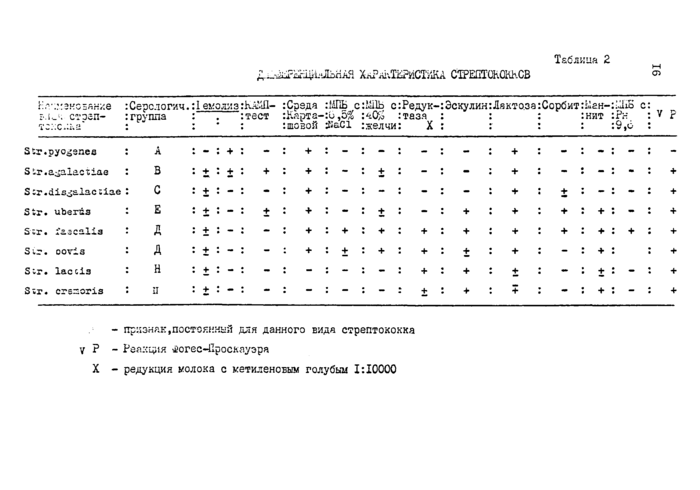
2*3.6.4-. Дифференциацию стрептококков проводят по тестам, указанным в таблице 2.
В молоке коров больных маститом наиболее часто обнаруживают Str. agalactiae,Str.di8galactiee,Str.uberi8STpenTQK0KKH StrЛас-tis, Str.cremorie(5tr. faecalie не являются возбудителями мастита и могут быть обнаружены в молоке как здоровых, так и больных коров вследствие его контаминации.
Для ускоренного обнаружения Str. agaiactiae в первую очередь проводят постановку КАМП-теста, который положительный у данного вида стрептококка и может быть у str. uberis.
2.3.6.5. Постановка КАМП-теста
Суточную агаровую или бульонную культуру гемолитического стафилококка засевают на кровяной агар с 7-8]£ дефибринирован-ной или нитратной крови крупного рогатого скота (рец. № I). Посев делают потлей в виде сплошной линии по диаметру чашки или. круговой линии по периферии кровяного агара в чашке Петри. Пор-
£ii:14Ц-,4ЛЬпАЯ АлРяЬТШС!jrlKА СТРШ1Тококксв
ы
сп
г:г*;::еноБание
стоеп-
тонслка'
:Серслогич. : груша
:1 емолиз :КАШ1-: . :тест
:Среда :Карта-:шовой
;МПЬ с -:6 ,Ъ% tfaCl
:*<ШЪ с:Редук-:Эскулин :40й :тазя :
:желчи: X :
::Лактоза
:Сорбит:Ыгн-: : нит
•:;JiB с:
: V :9,6 :
т**
г
Sir .pyogenes
: A
: -
:
+ :
: +
:
-
: -
: - :
: +
: - :
-
: - :
-
S Lr.a^aiactiae
: В
: +
:
+ : +
: +
•
-
: +
: - :
: +
а в •
-
: - :
S cr.dis^alaciiae
: С
: ±
;
- :
: +
:
-
: -
: - :
: +
: ± :
-
: - :
+
Str. uberds
: E
: +
•
- : +
: +
•
-
: +
: - : +
: +
: + :
+
• w ♦
+
Ssr. lascalis
: Д
: +
*
- :
: +
*
+
: +
: + : +
: +
: + :
+
: + :
+
Sir. oovis
: Д
: ±
:
- :
: +
•
+
: +
: + : +
: +
: - :
+
: ;
+
Sir. laccis
: Н
: +
:
- :
:
•
-
: -
: + : +
: +
: - :
+
: - :
+
Sir. crsmoris
: II
: +
:
- :
:
:
-
: -
: + : +
: +
* * •
+
; - :
+
|
ы сп | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- признак,постоянный для данного видя стрептококка V Р - Реакция £огес-йроскауэря
X - редукция молока с метиленовым голубым 1:10000
17
пендикулярно к линии диаметрального посева стафилококка или радиально к линии кругового посева, не доходя 5-6 мм, высевают ровными штрихами - полосками испытуемые культуры стрептококков.
На одной чашке можно проверять 8-10 и более культур. Посевы инкубируют 18-24 ч при температуре 37*1°С. КАМП-тест считают положительным, если четко выражена прозрачная зона гемолиза в виде полукруга или усеченного треугольника, образованных при контакте зон гемолиза культуры стафилококка и испытуемых культур стрептококков#
Для целенаправленного выделения str. agalactiae вместо подсеваемого^ -гемолитического стафилококка в кровяной агар может быть добавлен коммерческий стафилококковый^ -токсин (3%). Пересев стрептококка проводят со среды Карташовой* При этом вокруг колонии агалактийного стрептококка при положительном КАМП-тесте образуется прозрачная зона гемолиза*
2.3*6.6# Для определения устойчивости к желчи культуру стрептококков выращивают в МПБ с 10% сывороткой или в ШБ с I% глюкозы, затем 0,1 см3 культуры вносят в пробирки с 5 см3 МПБ, содержащего 40% желчи (рец* ft 13), инкубируют при температуре 37^1°С в течение 24 ч% Полное просветление бульона указывает на лизис культуры и отсутствие роста, помутнение - на рост.
2.3*6.7% Для определения редуцирующей способности культур стрептококков проводят посев культуры в пробирку с молоком, содержащим метиленовый голубой в концентрации 1:1000 (рец* ft 14). Посевы инкубируют в течение 24 ч при температуре 37±1°С. Обесцвечивание метиленового голубого указывает на наличие редуктазы.
2.3.6.8. Терморезистентность стрептококков определяют путем прогрева бульонной культуры стрептококков при 60°С в течение 30 мин. Пробирки с бульонной культурой ставят в водяную баню с указанным температурным режимом* После прогревания культуру вы-
18
севаюх в МПБ и инкубируют в термостате 24-48 ч. Наличие роста указывает на терморезистентность культуры, что характерно для str. faecaiis • Кроме того проверяют способность роста в МПБ о pH 9,6, в МПБ с 6,5%-ным хлористым натром, а также ферментацию лактозы, сорбита и маннита* При использовании среды Карташовой, в состав которой входит лактоза, исключает необходимость постановки теста на ферментацию лактозы. Ферментативные свойства стрептококков изучают на средах Гисса (рец. №№ 15,16).
Ввиду возможности контаминации молока str. faecaiis * являющимся постоянным обитателем кишечника животных, используют посев на среду с теллуритом калия с концентрацией 0,07%. str. faecaiis устойчив к указанной концентрации теллурита калия и образует колонии черного цвета; str. uberis от Str.ag^lactiae и str.dysgalactiae , вызывающих инфекционный мастит коров, используют посев на кровяной или сывороточный агар, содержащий 0,1% эскулина.
Str.uberis растет на агаре С эскулином, Str.agalactlae и Str.dysgalactiae - не растет на этой среде.
При выделении гемолитических стрептококков, дающих отрицательный КАМП-тест, для дифференциации str.pyogenes от указанных выше видов стрептококков применяют реакцию Фогес-Проокауэра ( уР). Все виды стрептококков, выделяемых из молока, дают положительную реакцию уР, за исключением str. pyogenes - группа А.
Для дифференциации str. lactis и str. crecaoris , встречающихся в молоке здоровых, а также больных коров, в качестве дополнительного теста используют тест на образование аммиака при гидролизе аргинина. С этой целью производят посев на среду с аргинином (рец. № 30). str.lactis гидролизует аргинин, str. сге-moris - не гидролизует.
При необходимости серологической идентификации выделенных
19
штаммов стрептококков, последние направляют в научно-исследовательские учреждения или республиканскую ветеринарную лабораторию. Серологическую идентификацию штаммов проводят с применением групповых диагностических специфических сывороток в реакции агглютинации в соответствии с наставлением по их применению, утвержденным ГУВ Госагропрома СССР 30 июня 1987 или в реакции преципитации с полисахаридным антигеном, выделенным из культур (по методу Ландсфильд ).
2.3#6.9. Оценка результатов
Оценку результатов исследования проводят в соответствии с данными таблицы 2. Срок лабораторного исследования - до 7 дней.
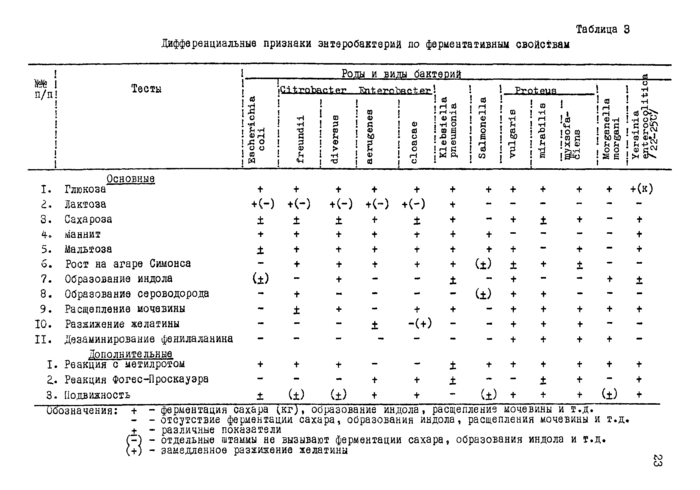
2.3.7. Выделение и идентификация энтеробактерий
2.3.7Л. Для выделения энтеробактерий из молока используют среду КОДИ (рец. № 17), на которую высевают 0,1-0,2 см3 исследуемого молока. Посевы на среде ЩЩ инкубируют при 3?£l°C в течение 16-24 ч. Изменение цвета среды из фиолетового в зеленый свидетельствует о наличии в молоке энтеробактерий.
2.3.7*2. Для идентификации бактерий рода jsaHerichia проводят посев иа пробирок с измененным (зеленым) цветом среды КОДА на среду Олькеницкого (рец. К? 18). Для подтверждения ставят реакцию* агглютинации.
Посев на среду Олькеницкого в пробирках проводят петлей на скошенную поверхность агара и внутрь столбика. Посевы инкубируют в термостате при 37jtI°C в точение 24 ч. Изменение цвета столбика (глюкоза +) и косяка (лактоза +) среды Олькеницкого из красного в желтый с образованием газа при отсутствии почернения внутри столбика свидетельствует о росте бактерий лактозоположительных энтеробактерий ( Escherichia,Citrobacter,, Knterobacter, Klebsiella )•
Методические указания разработаны доктором ветеринарных наук .профессором В.М.Карташовоч(ВНИИ ветеринарной санитарии, гигиены и экологги) и кандидатом ветеринарных наук Л.А, Тарановой (Республиканская научно-производственная лаборатория РФ)
Утверждены ceкциeй,,Ветеринарная санитария,гигиена и экология" Отделения ветеринарной медицины Россельхозакадемии.
Методические указания предназначены для научно-исследовательских учреждений,ветеринарных лабораторий,занимающихся вопросами диагностики и лечения маститов.
Ответственный за выпуск - главный специалист Отделения ветеринарной медицины Россельхозакадемии,кандидат ветеринарных наук В, Н,-Стара
(о) Россельхозакадемия,1994
20
В случав обнаружения роста культуры (осадок на дне пробирки) без изменения цвета среды КОДА или перехода цвета среды из фиолетового в сиреневый проводят посев культуры на плотные питательные среды (Эндо, Плоскирева) бактериологической петлей широкими штрихами для получения изолированных колоний.
2.3.7.3. Дифференциацию культур проводят в соответствии о тестами, предусмотренными таблицей № 3. Для этого проводят посев культур на среды Гисса (цветной ряд), цитратный агар Симонса (цитратный теса^(рец. № 19), среду Кларка (рец. N? 20) для постановки реакции на кислотообразование с метил-ротом и реакции Фо-гес-Проскауэра, среду с мочевиной (рец. № 21), в бульон Хоттин-гера (рец. № 27), среду с сернокислым железом (для обнаружения сероводорода) (рец. № 25), желатин (рец. № 28). Для одновременного учета ферментации лактозы, глюкозы, мочевины и образования сероводорода можно пользоваться средой Олькеницкого.
2.8.7.4. Путем посева на среду Олькеницкого можно ориентировочно определить ряд ферментативных свойств бактерий. При ферментации лактозы скошенная часть среды становится желтой, при ферментации глюкозы - становится желтым столбик среды, почернение внутри столбика указывает на выделение сероводорода, окрашивание косяка и столбика в малиновый цвет - на гидролиз мочевины.
Указанные ниже виды энтеробактерий имеют четко выраженные изменения:
Echerichia coli - столбик и косяк желтого цвета, по
чернения внутри столбика нет.
Proteus vulgaris - столбик и косяк малинового цвета,
внутри столбика почернение.
Citrobacter freundii - СТОЛбИК И КОСЯК Ж0ЛТОГО ЦВ0Т8, вну
три столбика почернение.
I. ОБЩАЯ ЧАСТЬ
3
1.1. Настоящие Методические указания включают метода исследования молока и секрета вымени коров при диагностике мастита и содержат современные! доступные для практического использования микробиологические методики с подробным изложением (в приложении) рецептов питательных сред*
1*2* Исследования молока (секрета вымени) коров в ветеринарных лабораториях выполняются по мере необходимости*
Б целях равномерной загрузки лабораторий массовые исследования на мастит проводят в соответствии с календарным планом» согласованным с Главным ветеринарным врачом района*
1.3. Наиболее частыми возбудителями мастита коров являются St.aureus* Str* agalactiae, E.coli, Pseudomonas aeruginosa , Corynebacterium bovis, Corinebacfcerium renale, Mycoplasma, Hocar-dia asteroidee, Candida albicans.
1.4. Результаты исследования патологического материала лаборатории сообщают хозяйствам в сроки, установленные настоящими Методическими указаниями.
Б заключении экспертизы указывают название возбудителя, его чувствительность к антибиотикам и рекомендации по лечению. Б необходимых случаях указывают на повторное направление материала для дополнительного исследования.
2. СПЕЦИАЛЬНАЯ ЧАСТЬ
2Л. Правила отбора и доставки проб молока (секрета вымени),
2.1.1. Отбор молока (секрета) для микробиологического исследования проводят ветеринарные специалисты хозяйств от коров с клинической и оубклшшчеокой формами мастита в соответствии с "Рекомендаднями по борьбе с маститом", утвержденными ГУБ МСХ СССР I июля 1983 г*
2*1.2. Для микробиологического исследования отбирают пробы секрета из пораженных четвертей вымени или пробы молока из четвертей» реагирующих на быстрый маститный тест (БМТ) - мастидин и дающих положительную пробу отстаивания.
2.1.3. Молоко (секрет вымени) для микробиологического исследования отбирают из четвертей вымени с соблюдением правил асептики. Перед взятием пробы молока соски вымени коров протирают ватным тампоном, смоченным 70° спиртом (этиловым или денатурированным), и выдаивают в конце дойки 5-10 см8 молока в стерильные пробирки с пробкой. При взятии пробы сосок не должен касаться края пробирки.
2.1 Л. Для выявления бактерионосителей среди животных, предназначенных для комплектования стада фермы отбирают пробы молока у коров, давших положительную реакцию с мастидином (БМТ).
2.2. Правила доставки проб
2.2.1. Взятые пробы молока доставляют в лабораторию не позднее 4 часов с момента взятия в специальных емкостях, обеспечивающих температуру не выше 8-Ю°С, или в термосах со льдом.
2.3. Методы исследования молока (секрета вымени) коров на наличие возбудителей мастита
2.3.1* Пробы молока (секрета вымени) исследуют на наличие возбудителей мастита сразу после доставки их в лабораторию. Оставшееся молоко хранят для учета пробы отстаивания при температуре 4*2°С*
2.3.2. Посев молока (секрета вымени) проводят пастеровской пипеткой в чашки Петри с плотной питательной средой с последующим растиранием материала по поверхности среды шпателем или стеклянной палочкой с оплавленным шаровидным концом, а также в пробирки о жидкими питательными средами.
5
2.3.3. Для диагностики мастита на первом этапе проводят исследование на наличие в молоке или секрете вымени стафилококков, стрептококков и энтеробактерий, на втором этапе при неудовлетворительном лечебном эффекте - псевдомонад, микоплазм, коринебак-терий, грибов рода Кандида и Нокардия.
2.3.4. В случае необходимости обнаружения в молоке возбудителей сибирской язвы, листериоза, туберкулеза, бруцеллеза и др. пользуются соответствующими методическими указаниями по диагностике данных заболеваний.
2.3.5. Выделение и идентификация стафилококков
2.3.5.1. Для выделения стафилококков проводят посев материала на кровяной агар (рец. № I), или кровяной агар с хлористым натрием (рец. № 2), или молочно-солевой агар (рец. № 3).
При использовании кровяного агара с новокаином (рец. № 4), или ДНК-новокаинового агара (рец. № 5) учитывают степень контаминации молока золотистым стафилококком. Посевы инкубируют 24 часа при температуре 37*1°С.
2.3.5.2. При просмотре культур на кровяном агаре учитывают рост крупных (2-4 мм) выпуклых колоний с гладкой блестящей или матовой поверхностью белого, кремового, желтого или лимонножелтого цвета, окруженные прозрачной или полупрозрачной (иногда двойной) зоной гемолиза, или без гемолиза. Из изолированных колоний делают мазки, окрашивают их по Граму и микроскопируют.
2.3.5.3. При обнаружении в мазках кокков, расположенных одиночно, в виде гроздевидных скоплений или тетракокков, что характерно для стафилококков, выделенную культуру проверяют на каталазную активность и при получении положительной реакции относят к стафилококкам.
2.8.5.4. Для определения каталазной активности колоний растирают в капле 10% раствора перекиси водорода, нанесенной
6
на предметное стекло. Стафилококки содержат фермент каталазу, которая при контакте с перекисью водорода вызывает интенсивное газообразование. Учитывая, что перекись водорода при хранении быстро разлагается, следует использовать свежеприготовленный раствор.
2.3.5.5. Гемолитические свойства стафилококков могут быть
учтены при первичном росте на кровяном агаре. Однако ввиду возможности одновременного роста на кровяном агаре другой микрофлоры, в присутствии которой может угнетаться или наоборот усиливаться гемолитическая активность стафилококков, а также в слу чае наличия ингибирующих веществ (новокаин, хлористый натр) в составе кровяного агара, рекомендуется произвести пересев изолированных колоний на другую чашку с кровяным агаром без ингибиторов. На кровяном агаре с эритроцитами крупного рогатого ско та или барана стафилококки вызывают гемолиз эритроцитов, образуя прозрачную зону вокруг колоний (^-гемолиз), или непрозрачную зону (^./.-гемолиз), иногда смешанную -гемолиз) зону;
отдельные штаммы золотистых стафилококков не вызывают гемолиз эритроцитов.
2.3.5.6. Для определения плазмокоагулирующих свойств стафилококков, обусловленных наличием фермента коагулаэы, ставят реакцию с цельной или сухой разведенной плазмой крови кролика.
Для этого используют колоний стафилококков, выросшие на одной иэ питательных сред, или культуру, отвитую на МПА и выращенную при 37±1°С в течение 18-24 ч.
Плазму крови кролика разводят стерильным физиологическим раствором в соотношении 1:5 и разливают в пробирки Флоринского по 0,5 см8. Сухую плазму разводят в соответствии с инструкцией по ее применению.
7
Культуру стафилококка снимают с агара бактериологической петлей и вносят в пробирки с разведенной плазмой. Для контроля одну пробирку с плазмой не засевают культурой, в другую засевают заведомо известной культурой плазмокоагулирующего стафилококка. Результаты учитывают через каждый час в течение 3-л часов, затем пробирки вынимают из термостата, выдерживают при комнатной температуре в течение 20-24 ч, после чего проводят окончательный учет результатов.
При положительной реакции плазмокоагуляции образовавшийся сгусток не выпадает из пробирки при ее наклоне или плавает в плазме. При отрицательном результате плазма остается жидкой и легко выливается из пробирки.
2.3.5.7. Определение ферментации маннита в анаэробных условиях.
3-4 капли испытуемой культуры стафилококка высевают в пробирку с 5 см3 0,15^-ным полужидким агаром, содержащим 0,5# маннита и индикатор Андреде иод вазелиновым маслом (рец. № 6), Посевы инкубируют при температуре 37° ±1°С. Результат учитывают через каждые 24 часа в течение 5 суток. Изменение цвета индикатора (появление розового окрашивания) указывает на ферментацию маннита в анаэробных условиях, что является дифференцирующим признаком для золотистого стафилококка.
2.3.5.8. Определение фосфатазной активности стафилококка
Для определения фосфатазы у стафилококковых культур проводят посев выделенной культуры в чашки Дотри со средой,
содержащей фенолфталеинфосфат, натрия (рец. № 7), Посевы инкубируют при температуре В7^1°С в течение 24 часов, после чего на крышку чашки с выросшей культурой вносят несколько капель 10#-ного водного раствора аммиака, чошку с культурой переворачивают дном кверху и закрывают крышкой с аммиаком. Под
8
дейстзиви паров аммиака фосфатазоположительные культуры приобретают розовый оттенок, фосфатазо-отрицательные культуры - желтый или остаются без изменений.
2.3.5.9. Определение ДНК-азной активности стафилококков Для определения фермента ДНК-азы проводят посев культуры стафилококка в чашки Петри со специальной средой (рец. № 5). Элективные свойства этой среды обусловлены ингибирующим действием новокаина на постороннюю микрофлору, дифференцирующие - наличием натриевой соли дезоксирибонуклеиновой кислоты, которая де-полимеризуется под действием дезоксирибонуклеазы (ДНК-азы) стафилококка, что выявляется после обработки поверхности среды соляной кислотой.
Посев культур проводят в одну чашку до 12-16 культур стафилококков. Культуры засевают штрихами по радиусу или в виде бляшек в центр квадрата, подложив под чашку трафарет, расчерченный на квадраты. Посевы инкубируют при 37jtI°C в течение 24 ч. По окончании культивирования чашку с выросшими культурами вынимают из термостата, наливают в нее 5-7 см3 IVраствора соляной кислоты и выдерживают (2-3 мин) при 22±2°С до момента появления просветлэнной зоны вокруг колоний-бляшек или вдоль штрихов (реакция положительная). Затем кислоту осторожно сливают, чтобы не смыть культуру и учитывают результаты.
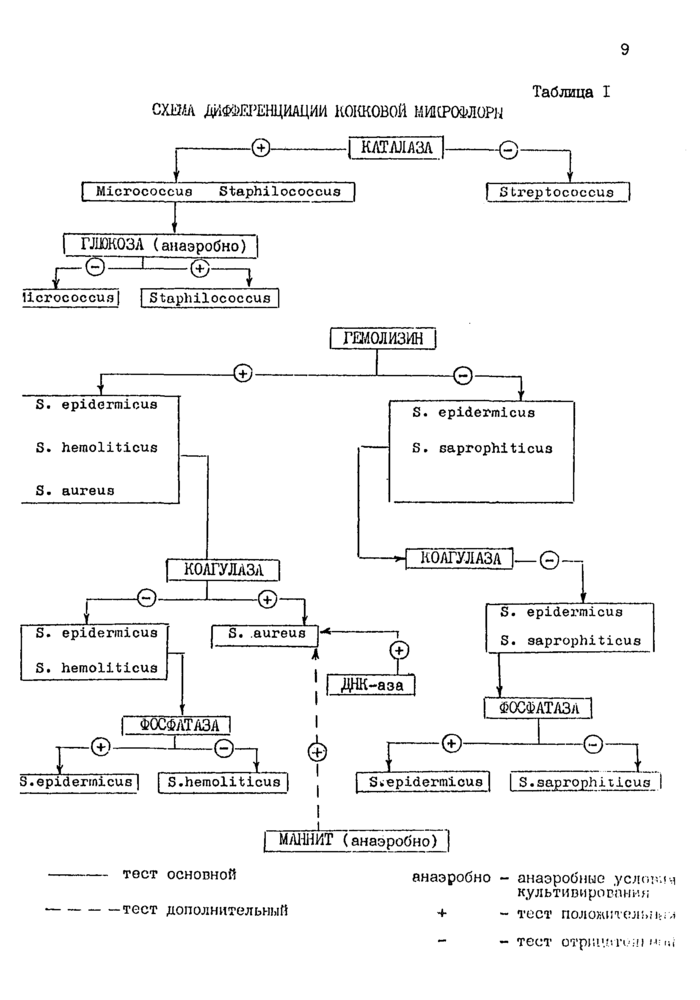
2*3.5.10. Дифференциацию кокковой микрофлоры, выделенной из молока или оекрета вымени воров, проводят на основании тестов,, указанных в таблице te I.
2.3.5.II. Количественный учет золотистого стафилококка При исследовании сборного молока для выделения и количественного учета стафилококков используют кровяной агар с новокаином. Если необходимо учесть количество только золотистого стафилококка, используют ДНК-новокаиновый агар. Из доставленных
СХЕМА ДИФФЕРЕНЦИАЦИИ КОККОВОЙ МИКРОФЛОРЫ
Таблица I
|
Streptococcus |
-©—-1 КАТАЛАЗА
( Micrococcus Staphilococcus |
I '
\ ГЛЮКОЗА (анаэробно)
—®—i
| МАННИТ (анаэробно) |
licrococcus[ | Staphilococcus~|
|
| МАННИТ (анаэробно) | |
--- тест основной анаэробно - анаэробные услов;
культивирования
* тест дополнительный ч- — тест положительн;;
- - тест отрицатои» о-