МУК 3.3.2.1063-01
Определение антикомплементарной активности препаратов иммуноглобулинов для внутривенного введения
Купить МУК 3.3.2.1063-01 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания предназначены для работников предприятий, осуществляющих контроль качества препаратов иммуноглобулинов для внутривенного введения
Оглавление
1. Область применения
2. Общие положения
3. Описание метода определения антикомплементарной активности
3.1. Приготовление реактивов
3.1.1. Приготовление цитратного раствора
3.1.2. Приготовление базового раствора кальция и магния
3.1.3. Приготовление базового раствора барбиталового буфера
3.1.4. Приготовление рабочего желатин-барбиталового буферного раствора
3.1.5. Приготовление эритроцитов барана
3.2. Постановка реакции определения антикомплементарной активности иммуноглобулинов
3.2.1. Приготовление 5%-ной суспензии эритроцитов барана
3.2.2. Титрование гемолитической сыворотки
3.2.3. Приготовление суспензии сенсибилизированных эритроцитов барана
3.2.4. Титрование комплемента
3.3. Определение антикомплементарной активности иммуноглобулина для внутривенного введения
3.4. Учёт результатов
3.4.1. Пример
3.4.2. Заключение
Приложение. Оборудование, реактивы
| Дата введения | 01.10.2001 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
Организации:
Measurement of anticomplementary activity of immunoglobulins for intravenous use
- ГОСТ 11293-89 Желатин. Технические условия
- ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
- ГОСТ 29228-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 2. Пипетки градуированные без установленного времени ожидания
- ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
- ГОСТ 3652-69 Реактивы. Кислота лимонная моногидрат и безводная. Технические условия
- ГОСТ 4209-77 Реактивы. Магний хлористый 6-водный. Технические условия
- ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
- ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9

стр. 10
стр. 11
стр. 12

стр. 13
стр. 14

стр. 15
стр. 16
стр. 17
Государственное санитарно-эпидемиологическое нормирование Российской Федерации
3.3.2. МЕДИЦИНСКИЕ ИММУНОБИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ
Определение антикомплементарной активности препаратов иммуноглобулинов для внутривенного введения
Методические указания МУК 3.3.2.1063—01
Издание официальное
Минздрав России Москва • 2001
3.3.2. МЕДИЦИНСКИЕ ИММУНОБИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ
Определение антикомплементарной активности препаратов иммуноглобулинов для внутривенного введения
Методические указания МУК 3.3.2.1063—01
МУК 3.3.2.1063—01
0,7 | 0.6 1 0,5
1 0,4
I °’3| 0,2
Ь 0,1
0,0
100 200 300 400 600 800 1600 3200
разведение гемолитической сыворотки
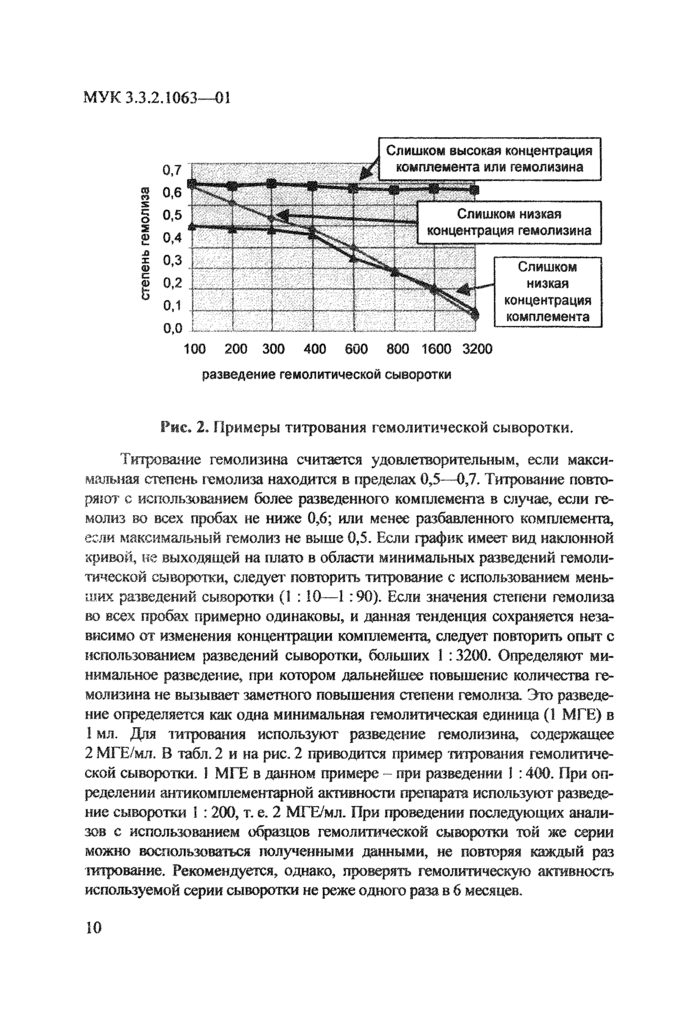
Рис. 2. Примеры титрования гемолитической сыворотки.
Титрование гемолизина считается удовлетворительным, если максимальная степень гемолиза находится в пределах 0,5—0,7, Титрование повторяют с использованием более разведенного комплемент в случае, если гемолиз во всех пробах не ниже 0,6; или менее разбавленного комплемента, если максимальный гемолиз не выше 0,5, Если график имеет вид наклонной кривой, не выходящей на плато в области минимальных разведений гемолитической сыворотки, следует повторить титрование с использованием меньших разведений сыворотки (1 :10—1:90). Если значения степени гемолиза во всех пробах примерно одинаковы, и данная тенденция сохраняется независимо от изменения концентрации комплемента, следует повторить опыт с использованием разведений сыворотки, больших I : 3200. Определяют минимальное разведение, при котором дальнейшее повышение количества гемолизина не вызывает заметного повышения степени гемолиза Это разведение определяется как одна минимальная гемолитическая единица (1 МГЕ) в
1 мл. Для титрования используют разведение гемолизина, содержащее
2 МГЕ/мл. В табл. 2 и на рис. 2 приводится пример титрования гемолитической сыворотки. 1 МГЕ в данном примере - при разведении 1 :400. При определении антикомгшементарной активности препарата используют разведение сыворотки 1 :200, т. е. 2 МГЕ/мл. При проведении последующих анализов с использованием образцов гемолитической сыворотки той же серии можно воспользоваться полученными данными, не повторяя каждый раз -титрование. Рекомендуется, однако, проверять гемолитическую активность используемой серии сыворотки не реже одного раза в 6 месяцев.
МУК 3.3.2.1063—01
|
Таблица 2 | ||||||||||||||||||||||||||||||||||||||||||||
|
3.2.3. Приготовление суспензии сенсибилизированных эритроцитов барана
Готовят необходимый объём раствора гемолизина, содержащий 2 МГЕ/мл, и равный объём 5 %-ной суспензии эритроцитов барана. Добавляют разведенный гемолизин к суспензии эритроцитов. Смесь инкубируют при 37 °С в течение 15 мин, хранят при температуре 4 *С и используют в течение 2 суток.
3.2.4. Титрование комплемента
Содержимое ампулы сухого комплемента растворяют в 1 мл 0,9 %-ного хлорида натрия. Отбирают 0,1 мл и готовят определенное разведение комплемента, например 1 :250, с использованием ЖББР. Проводят титрование комплемента, как показано в табл. 3, в двух повторностях. В каждую пробирку добавляют по 1,0 мл суспензии сенсибилизированных эритроцитов, тщательно перемешивают и инкубируют при 37 °С в течение 60 мин. Пробирки охлаждают 10 мин при 4°С и центрифугируют при 200 g (1,5—2 тыс. об./мин) в течение 10 мин. Измеряют оптическую плотность надосадочной жидкости при длине волны 541 нм и определяют степень гемолиза (У), используя формулу:
y = AnzAo5 где
Ак“А0
Ап - средняя оптическая плотность проб, по результатам двух повторностей;
Ак - средняя оптическая плотность контрольных проб с полным гемолизом;
11
МУК 33.2.1063—01
А0 - средняя оптическая плотность контрольных проб при отсутствии гемолиза.
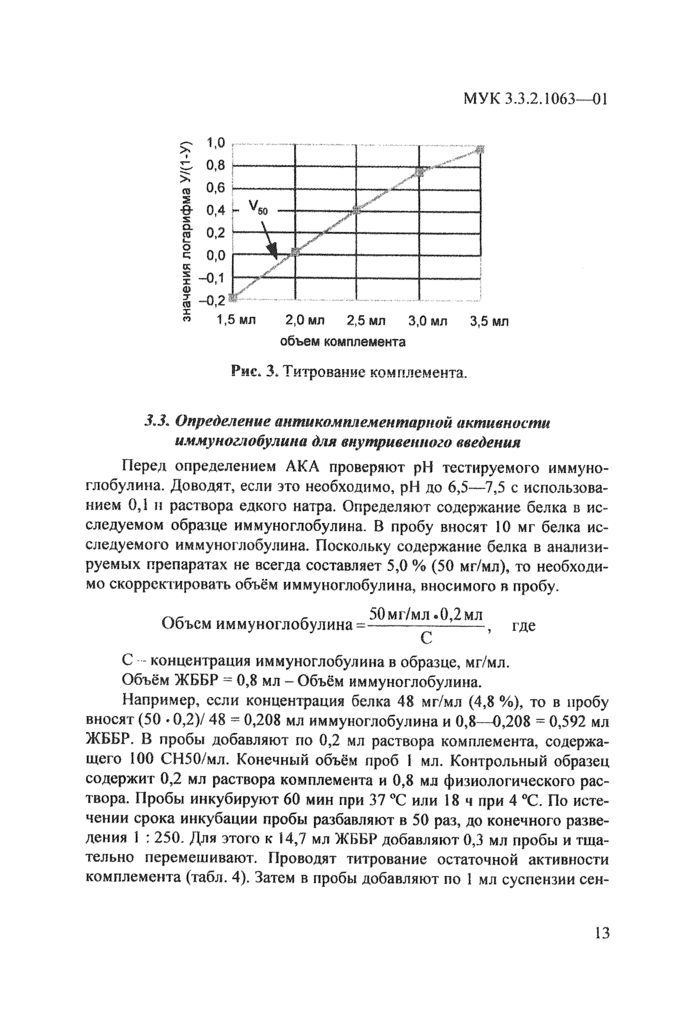
Результаты анализа учитывают, если в диапазон титрования входят значения 50 %-ного гемолиза (табл. 3, рис. 3). Реакцию повторяют с использованием меньшего разведения комплемента при максимальном гемолизе, не превышающем 0,5; или большего разведения, если минимальный гемолиз больше 0,5, а также в том случае, если полученный график не пересекает линию со значением ординаты 0. Определяют значения десятичного логарифма соотношения [У/(1-У)] с использованием стандартного вычислительного оборудования, или соответствующих справочников (например В. М. Брадис “Четырёхзначные математические таблицы”). Строят график на миллиметровой или логарифмической бумаге, откладывая по оси абцисс объём добавленного комплемента, а по оси ординат - значения логарифма [У/(1—У)]. Определяют объём комплемента, в котором содержится 1 СН50. Рассчитывают количество СН50/мл в исходном растворе комплемента, равное значению разведения комплемента, делённому на значение объёма раствора комплемента V50, приводящего к 50%-ному гемолизу. В примере, приведенном в табл. 3 и на рис. 3, 1СН50 находится в объёме 1,9 мл. Таким образом, содержание комплемента в исходном растворе с учётом разведения: 250 : 1,9 = 131,5 СН50/мл. Затем путём разведения готовят раствор комплемента, содержащий 100 СН50/мл. В приведенном примере раствор комплемента нужно разбавить в 1,315 раза, т. е. к 1 мл раствора комплемента добавить 0,315 мл ЖББР.
|
Таблица 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
МУК 3.3,2.1063—01
|
Рис* 3* Титрование комплемента. |
S3* Определение антикомплементарной активности иммуноглобулина для внутривенного введения
Перед определением АКА проверяют pH тестируемого иммуноглобулина, Доводят, если это необходимо, pH до 6,5—7,5 с использованием 0,1 и раствора едкого натра. Определяют содержание белка в исследуемом образце иммуноглобулина. В пробу вносят 10 мг белка исследуемого иммуноглобулина. Поскольку содержание белка в анализируемых препаратах не всегда составляет 5,0 % (50 мг/мл), то необходимо скорректировать объём иммуноглобулина, вносимого в пробу.
^ 50 мг/мл «0,2 мл
Объем иммуноглобулина =————- , где
С - концентрация иммуноглобулина в образце, мг/мл.
Объём ЖББР = 0,8 мл - Объём иммуноглобулина.
Например, если концентрация белка 48 мг/мл (4,8 %), то в пробу вносят (50 * 0,2)/ 48 = 0,208 мл и м му ноглобу л и на и 0,8—0,208 = 0,592 мл ЖББР. В пробы добавляют по 0,2 мл раствора комплемента, содержащего 100 СН50/мл. Конечный объём проб 1 мл. Контрольный образец содержит 0,2 мл раствора комплемента и 0,8 мд физиологического раствора. Пробы инкубируют 60 мин при 37 °С или 18 ч при 4 °С. По истечении срока инкубации пробы разбавляют в 50 раз, до конечного разведения 1 : 250. Для этого к 14,7 мл ЖББР добавляют 0,3 мл пробы и тщательно перемешивают. Проводят титрование остаточной активности комплемента (табл. 4). Затем в пробы добавляют по 1 мл суспензии сен-
13
МУК 3.3.2.1063—01
сибилизированных эритроцитов и инкубируют 60 мин при 37 °С. Далее пробы охлаждают, центрифугируют и измеряют оптическую плотность, как описано выше. Определяют значение степени гемолиза У и логарифма соотношения [У/(1-У)]. Строят график на миллиметровой или логарифмической бумаге, откладывая по оси абцисс объём внесенного образца, а по оси ординат - значения логарифма [У/(1-У)]. Определяют активность комплемента в опытных и контрольных пробах, как описано выше, т. е. находят объём образца, дающий степень гемолиза 0,5 (точка графика с ординатой 0). Рассчитывают содержание СН50 в исходных пробах с учётом разведения.
3.4,У чёт результатов
Активность комплемента в опытных и контрольных пробах определяют, как описано в п. 3.2.4. Рассчитывают количество комплемента, связанного иммуноглобулином пробы, по формуле:
где
Ак Аи
10
Ак - активность комплемента в контрольной пробе, СН50/мл;
А„ - активность комплемента в исследуемой пробе, СН50/мл;
10 - количество иммуноглобулина в пробе, мг.
Результаты теста учитывают, если активность комплемента в контрольной пробе находится в пределах от 80 до 120 СН50/мл. В противном случае проводят повторный анализ. Иногда активность комплемента в опытных пробах больше, чем в контрольной. В таком случае анти-комплементарную активность пробы считают равной нулю. Результаты выражают в количестве комплемента, связавшегося с 1 мг исследуемого иммуноглобулина, в СН50/мг.
3.4.1. Пример
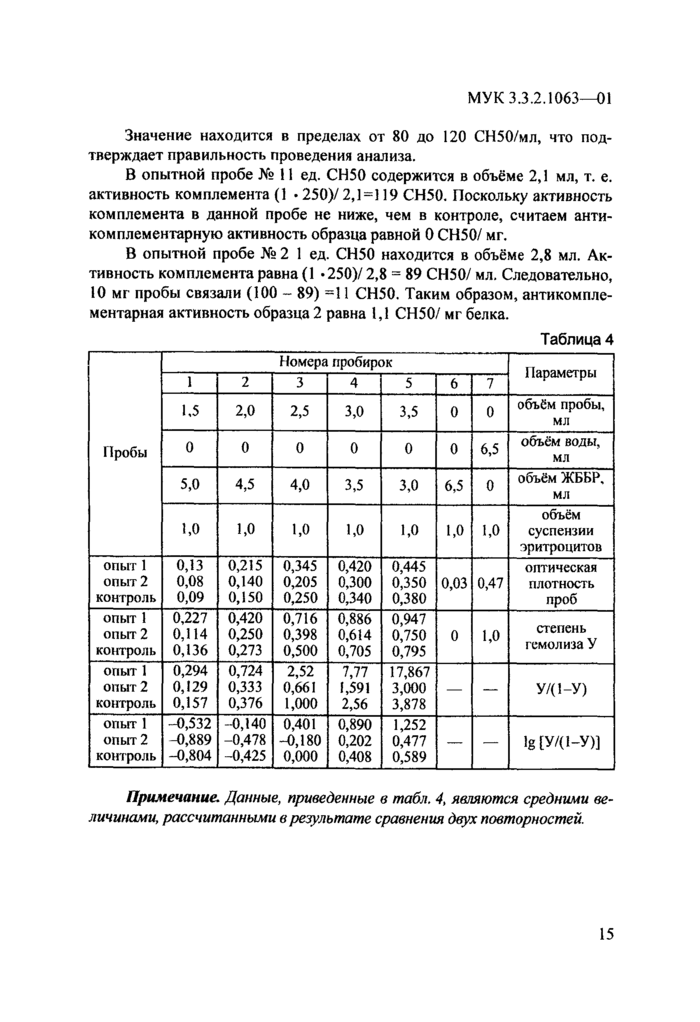
В табл. 4 приведен пример определения АКА двух образцов иммуноглобулина.
Активность комплемента в контрольной пробе, исходя из табл. 4 и рис 4, равна:
^^=100 СН50/МЛ, где
1 - количество СН50 в точке графика с ординатой 0;
2,5 - объём образца, вызывающий 50 %-ный гемолиз;
250 - конечное разведение образца.
14
МУК 3.3,2.1063—01
Значение находится в пределах от 80 до 120 СН50/мл, что подтверждает правильность проведения анализа.
В опытной пробе № 11 ед. СН50 содержится в объёме 2,1 мл, т. е. активность комплемента (1 • 250)/ 2,1=] 19 СН50. Поскольку активность комплемента в данной пробе не ниже, чем в контроле, считаем анти-комплементарную активность образца равной 0 СН50/ мг.
В опытной пробе № 2 1 ед. СН50 находится в объёме 2,8 мл. Активность комплемента равна (1 *250)/ 2,8 = 89 СН50/ мл. Следовательно, 10 мг пробы связали (100 - 89) =11 СН50. Таким образом, антикомпле-ментарная активность образца 2 равна 1,1 СН50/ мг белка.
|
Таблица 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Примечание. Данные, приведенные в табл. 4, являются средними величинами, рассчитанными в результате сравнения двух повторностей.
15
МУК 3.3.2.1063—01
ig [уо-у)1
объем образца
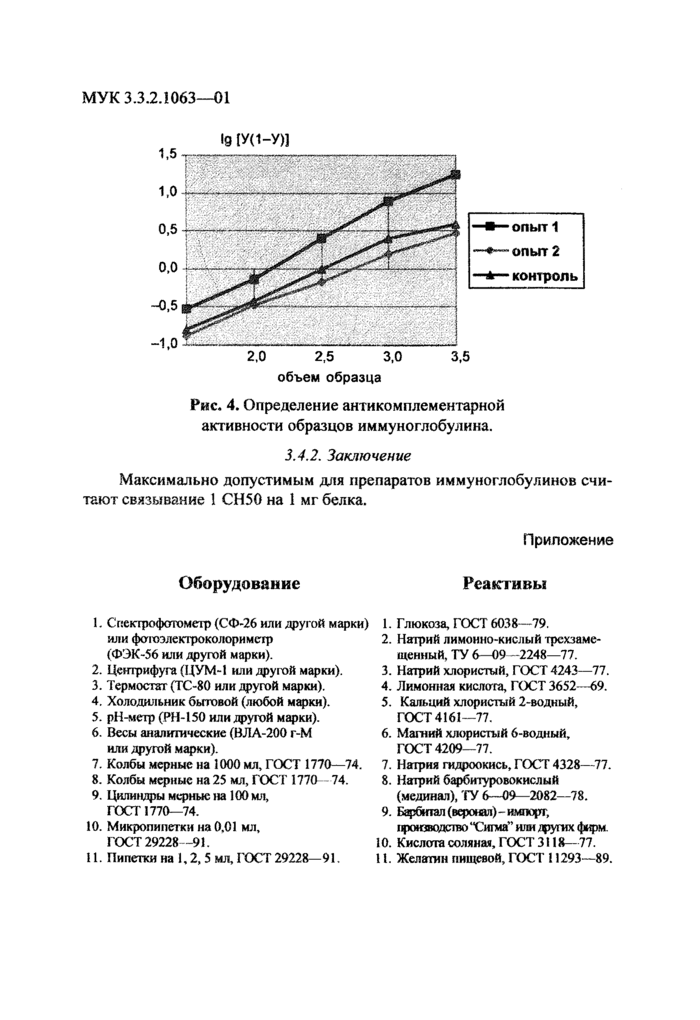
Рмс* 4. Определение антикомплементарной активности образцов иммуноглобулина.
ЗА.2. Заключение Максимально допустимым для препаратов иммуноглобулинов считают связывание 1 СН50 на 1 мг белка.
Приложение
1. Глюкоза, ГОСТ 6038-79.
2. Натрий лимонно-кислый трехзаме-щенный, ТУ 6—09—2248—77.
3. Натрий хлористый, ГОСТ 4243-77.
4. Лимонная кислота, ГОСТ 3652-69.
5. Кальций хлористый 2-водный, ГОСТ 4161-77.
6. Магний хлористый 6-водный,
7. Натрия гидроокись, ГОСТ 4328-77.
8. Натрий барбитуровокислый (мединал), ТУ 6—09—2082—78.
9. Барбигтал (верошл) - импорт, производство “Сигма” или других фирм.
10. Кислота соляная, ГОСТ 3118-77.
11. Желатин пищевой, ГОСТ 11293-89.
Оборудование Реантивы
1. Глюкоза, ГОСТ 6038-79.
2. Натрий лимонно-кислый трехзаме-щенный, ТУ 6—09—2248—77.
3. Натрий хлористый, ГОСТ 4243-77.
4. Лимонная кислота, ГОСТ 3652-69.
5. Кальций хлористый 2-водный, ГОСТ 4161-77.
6. Магний хлористый 6-водный,
7. Натрия гидроокись, ГОСТ 4328-77.
8. Натрий барбитуровокислый (мединал), ТУ 6—09—2082—78.
9. Барбигтал (верошл) - импорт, производство “Сигма” или других фирм.
10. Кислота соляная, ГОСТ 3118-77.
11. Желатин пищевой, ГОСТ 11293-89.
1. Спектрофотометр (СФ-26 или другой марки) или фогоэлектроколоримстр
(ФЭК-56 или другой марки).
2. Центрифуга (ЦУМ-1 или другой марки).
3. Термостат (ТС-80 или другой марки).
4. Холодильник бытовой (любой марки).
5. pH-метр (PH-150 или другой марки).
6. Весы аналитические (ВЛА-200 г-М или другой марки).
1. Колбы мерные на 1000 мл, ГОСТ 1770-74.
8. Колбы мерные на 25 мл, ГОСТ 1770-74.
9. Цилиндры мерные на 100 мл,
10. Микропипетки на 0,01 мл,
11. Пипетки на 1,2, 5 мл, ГОСТ 29228-91,
ББК51.9
0 60
О 60 Определение антикомплементарной активности препаратов иммуноглобулинов для внутривенного введения: Методические указания.—М.: Федеральный центр госсанэпиднадзора Минздрава России, 2001.—16 с.
ISBN 5—7508—0292—2
1. В разработке методических указаний принимали участие сотрудники Нижегородского государственного предприятия по производству бактерийных препаратов - фирмы “ИмБио”: к. м. н. Т. Л. Крайнова, д. б. н. В. В. Ана-стасиев, Т. В. Короткова, Т. Б. Змачинская, Л. М, Ефремова; Государственного научно-исследовательского института стандартизации и контроля медицинских биологических препаратов им. Л. А. Тарасевича: к. м. н. Л. В. Мина-кова, к. м. н. Л. К. Лаптева.
2. Утверждены Главным государственным санитарным врачом Российской Федерации - Первым заместителем Министра здравоохранения Российской Федерации Г. Г. Онищенко 12 июля 2001 г.
ББК51.9
Редакторы Акопова Н. Е., Барабанова Т. Л.
Технические редакторы Гарри Д. В., Григорьев А. А.
Подписано в печать 22.10.01 Формат 60x88/16 Печ. л. 1,0
Т ираж 3000 экз. Заказ 39
ЛР№ 021232 от 23.06.97 г.
Министерство здравоохранения Российской Федерации 101431, Москва, Рахмановский пер., д. 3
Оригинал-макет подготовлен к печати и тиражирован Издательским отделом Федерального центра госсанэпиднадзора Минздрава России 125167, Москва, проезд Аэропорта, 11.
Отделение реализации, тел. 198-61-01
ISBN 5—7508—0292—2
© Минздрав России, 2001 © Федеральный центр госсанэпиднадзора Минздрава России, 2001
МУК 3.3.2.1063—01Содержание
Содержание.......................................................................... 3
1. Область применения...............................................................................................4
2. Общие положения........................................... 4
3. Описание метода определения антикомплементарной активности...................5
3.1. Приготовление реактивов................................................................................6
3.2. Постановка реакции определения антикомплементарной
активности иммуноглобулинов.................................................................................7
3.3. Определение антикомплементарной активности иммуноглобулина
для внутривенного введения....................................................................................13
ЗАУчёт результатов.............................................................................................14
Приложение. Оборудование. Реактивы..................................................................16
3
МУК 3.3.2.1063—01
УТВЕРЖДАЮ Главный государственный санитарный врач Российской Федерации - Первый заместитель Министра здравоохранения Российской Федерации
Г. Г. Онищенко
12 июля 2001 г.
МУК 3.3.2.1063—01
Дата введения: 1 октября 2001 г.
3.3.2. МЕДИЦИНСКИЕ ИММУНОБИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ
Определение антикомплементарной активности препаратов иммуноглобулинов для внутривенного введения
Measurement of anticomplementary activity of immunoglobulins for intravenous use
Методические указания
1. Область применения
Настоящие методические указания предназначены для работников предприятий, осуществляющих контроль качества препаратов иммуноглобулинов для внутривенного введения.
Все положения настоящего документа распространяются на предприятия, производящие МИБП, независимо от их принадлежности и формы собственности.
2. Общие положения
Согласно требованиям ВОЗ, все серии иммуноглобулинов для внутривенного введения подлежат обязательному испытанию на антикомпле-ментарную активность (АКА). (Материалы ВОЗ, 1992.) При внутривенном введении иммуноглобулинов с высокой антикомплементарной активностью у реципиента могут возникнуть тяжелые анафилактоидные реакции. Уровень АКА и клиническая безопасность являются предметом обсуждения более 10 лет (S. Munkarious, J. Hooper, 1988). Большинство исследователей полагает, что уровень АКА in vitro будет иметь значение для прогноза возможного побочного действия препаратов in vivo. У раз-
4
МУК 3.3.2.1063—01
личных препаратов, производимых в мире, существенно различаются показатели AKA (J. Romer et all, 1982). Наличие значительных отличий в АКА дало основание отдельным авторам считать связь между АКА и безопасностью препарата при внутривенном введении сомнительной. Большинство же исследователей полагает, что данный тест является способом определения повреждения структуры иммуноглобулина и должен быть обязательно контролируемым параметром стабильности производства. Абсолютным критерием допуска к применению препаратов служит их переносимость при внутривенном введении.
Метод определения АКА основан на способности иммуноглобулинов связывать комплемент, препятствуя лизису сенсибилизированных эритроцитов.
Существует множество модификаций метода определения АКА. Методы определения и единицы измерения АКА, используемые различными авторами, трудно сравнимы.
Настоящие методические указания составлены с учетом требований Европейской фармакопеи 1997 г. Нами разработана модификация этого метода. Предлагаемый метод определения антикомплементарной активности иммуноглобулинов обладает достаточно высокой чувствительностью, хорошей воспроизводимостью и простотой выполнения. Важным преимуществом метода является выражение результатов определения в единицах комплемента, связавшегося с 1 мг белка иммуноглобулина. Это позволяет количественно оценивать как низкую, так и высокую антикомплементарную активность. Положительной чертой метода является также расширенный контроль реагентов, используемых для постановки реакции как комплемента, так и гемолитической сыворотки, что улучшает воспроизводимость результатов реакции. Настоящие рекомендации предназначены для определения антикомплементарной активности в препаратах иммуноглобулина для внутривенного введения на этапах его изготовления и хранения и вводятся взамен методических рекомендаций “Определение антикомплементарной активности препаратов иммуноглобулинов” (Нижний Новгород, 1988).
3. Описание метода определения антикомплементарной активности
Для измерения антикомплементарной активности иммуноглобулина фиксированное количество тестируемого материала (0,2 мл 5 %-ного раствора препарата, т. е. 10 мг иммуноглобулина) инкубируют с определенным количеством комплемента морской свинки (20 гемолитиче-
5
МУК 3.3.2.1063—01
ских единиц СН50), и затем определяют количество несвязавшегося комплемента; антикомплементарную активность выражают как расход СН50 на 1 мг иммуноглобулина. Допустимый предел связывания комплемента - не более 1 гемолитической единицы СН50 на 1 мг иммуноглобулина для внутривенного введения.
3, /. Приготовление реактивов
Для постановки реакции необходимы следующие компоненты.
ФС 42—2619—97
ФС 42—223ВС—94 ФС 42—9ВС—91
Вода дистиллированная очищенная, соответствующая требованиям Цитратный раствор
Базовый барбиталовый буферный раствор Базовый раствор кальция и магния Желатин-барбиталовый буферный раствор Эритроциты барана
Гемолитическая сыворотка (гемолизин) или любая аналогичная коммерческая сыворотка отечественного или импортного производства Комплемент морской свинки или любой аналогичный препарат отечественного или импортного производства 0,1 н раствор едкого натра Испытуемый иммуноглобулин
3,1.1. Приготовление цитратного раствора
20,5 г глюкозы, 8,0 г натрия лимонно-кислого трехзамещенного и 4,2 г натрия хлорида растворяют в 750 мл дистиллированной воды. pH раствора доводят до 6,1 10 %-ным раствором лимонной кислоты, объем - до 1000 мл дистиллированной водой. Стерилизуют текучим паром в течение 30 мин при температуре 100 °С. Хранят при температуре 4 °С в течение месяца.
3.1.2. Приготовление базового раствора кальция и магния
2,2 г хлорида кальция двухводного и 10,17 г хлорида магния шестиводного растворяют в дистиллированной воде и доводят объём раствора до 100 мл. Хранят при температуре 4 °С не более 1 месяца.
3.1.3. Приготовление базового раствора барбиталового буфера
В мерную колбу ёмкостью 2000 мл вносят 85 г хлорида натрия и 3,75 г барбитала натрия (мединала), добавляют 5,75 г барбитала (веронала), предварительно растворенного при нагревании в 200—300 мл дистиллированной воды, и устанавливают pH 7,3, используя 1 н соляную
6
МУК 3.3.2.1063—01
кислоту. Объём раствора доводят до 2000 мл дистиллированной водой. Стерилизуют текучим паром при 100 °С в течение 30 мин. Хранят при температуре 4 °С не более 1 месяца.
3,1,4. Приготовление рабочего желатин-барбиталового буферного раствора (ЖББР)
1 г желатина растворяют в 400 мл дистиллированной воды при нагревании на водяной бане при температуре 70—100 °С. Полученный раствор охлаждают и вносят в мерную колбу на 1000 мл, добавляют 1 мл базового раствора кальция и магния и 200 мл базового раствора барбиталового буфера. Объём раствора доводят до 1000 мл дистиллированной водой. Используют свежеприготовленным.
3.L5. Приготовление эритроцитов барана
Берут один объём крови барана и один объём цитратного раствора, перемешивают. Хранят при температуре 4 °С. Кровь можно использовать в течение 28 дней, но не ранее чем через 7 дней после взятия .
3.2. Постановка реакции определения антикомплементарной активности иммуноглобулинов
3.2. L Приготовление 5%-ной суспензии эритроцитов барана
Объём крови, необходимый для работы, отбирают стерильно и промывают физиологическим раствором. Промывку осуществляют с помощью центрифугирования суспензии в течение 10 мин при 200 g (1,5—2 тыс. об./мин). Осадок эритроцитов промывают не менее 3 раз 10-кратным (к объёму эритроцитов) количеством желатин-барбиталового буферного раствора (ЖББР) до получения бесцветной промывной жидкости. 5 %-ную суспензию эритроцитов готовят в том же самом буферном растворе. Плотность клеточной суспензии определяют следующим образом. К 0,2 мл суспензии эритроцитов добавляют 2,8 мл воды и центрифугируют гемолизированный раствор при 400 g (3—4 тысячи об./мин). Измеряют оптическую плотность раствора в кювете с толщиной слоя 10 мм, против воды. Плотность клеточной суспензии считают приемлемой, если оптическая плотность надосадочной жидкости при длине волны 541 нм составляет 0,62 ±0,01. Корректируют плотность суспензии до этого показателя добавлением желатин-барбиталового буферного раствора в соответствии с формулой:
V„* А
Vk
, где
0,62
МУК 3.3.2.1063—01
VK- конечный объём суспензии;
VH - начальный объём суспензии;
А - оптическая плотность исходной суспензии при длине волны 541 нм.
Если оптическая плотность ниже 0,61, то добавляют необходимое количество отмытых эритроцитов,
В случае проведения анализа с использованием фотоэлектроколориметра берут 0,5 мл суспензии эритроцитов и 7,0 мл воды. Измерение проводят в кювете с толщиной оптического слоя 10 мм, при длине волны 540 нм. Плотность клеточной суспензии считают приемлемой в случае, если величина поглощения находится в пределах 0,59 ±0,1. При других показаниях корректируют плотность суспензии, как описано выше.
3.2.2. Титрование гемолитической сыворотки
Антисыворотку к эритроцитам барана (гемолизин) предварительно разводят ЖББР 1:10 (0,5 мл гемолизина + 4,5 мл ЖББР). Готовят разведения гемолизина 1 : 100, 1 :200, 1 :300, 1 :400, 1 :600, 1 :800, 1 : 1600, 1 :3200 с использованием ЖББР. Постановку эксперимента осуществляют в соответствии с табл. 1. Пробы гемолизина берут в двух повторностях. В качестве контроля самопроизвольного гемолиза используют пробы, не содержащие гемолизина, в двух повторностях. Для установления 100 %-ного гемолиза используют контрольные пробы, в которые вносят дистиллированную воду вместо ЖББР (также в двух повторностях).
|
Таблица 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
8
МУК 3.3.2.1063-01
Во все пробы вносят по 0,5 мл 5 %-ной суспензии эритроцитов и инкубируют 15 мин при 37 °С. После инкубации в пробы вносят ЖББР и предварительно приготовленный раствор комплемента. Концентрацию раствора комплемент подбирают следующим образом (см. п. 3.2.4). Для начала рекомендуется провести титрование с использованием разбавленного в 100 раз комплемента (ампула сухого комплемента растворяется в 1 мл 0,9 %-ного раствора хлорида натрия и разводится ЖББР 1 : 100). Пробы инкубируют при 37 °С 60 мин. Затем пробы охлаждают 10 мин при 4 °С и центрифугируют при 200 g (1,5—2,0 тааобУмин) в течение 10 мин. Измеряют оптическую плотность надосадочной жидкости при длине волны 541 нм и рассчитывают степень гемолиза в каждой пробирке по формуле:
где
V/ _ Аа“ Ао
А г А(
Аа - оптическая плотность проб с разведениями гемолизина; Аг - оптическая плотность проб с полным гемолизом;
А0- оптическая плотность проб, не содержащих гемолизина.
разведение сыворотки
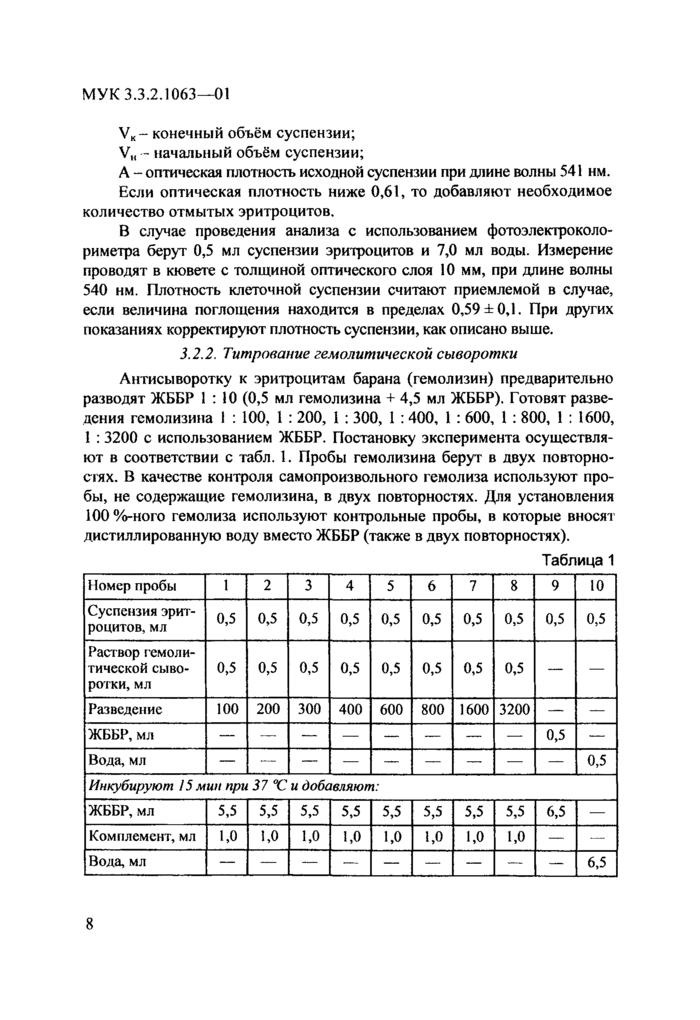
Рис, 1. Титрование гемолитической сыворотки.
Строят график, откладывая по оси ординат значения оптической плотности, а по оси абцисс - соответствующие значения разведения гемолитической сыворотки. График должен иметь вид наклонной кривой, выходящей на плато (рис. 1,2).
9