Методические указания по бактериологической диагностике колибактериоза (эшерихиоза) животных
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
1 Общие положения
2 Материал для исследования
3 Порядок исследования материала
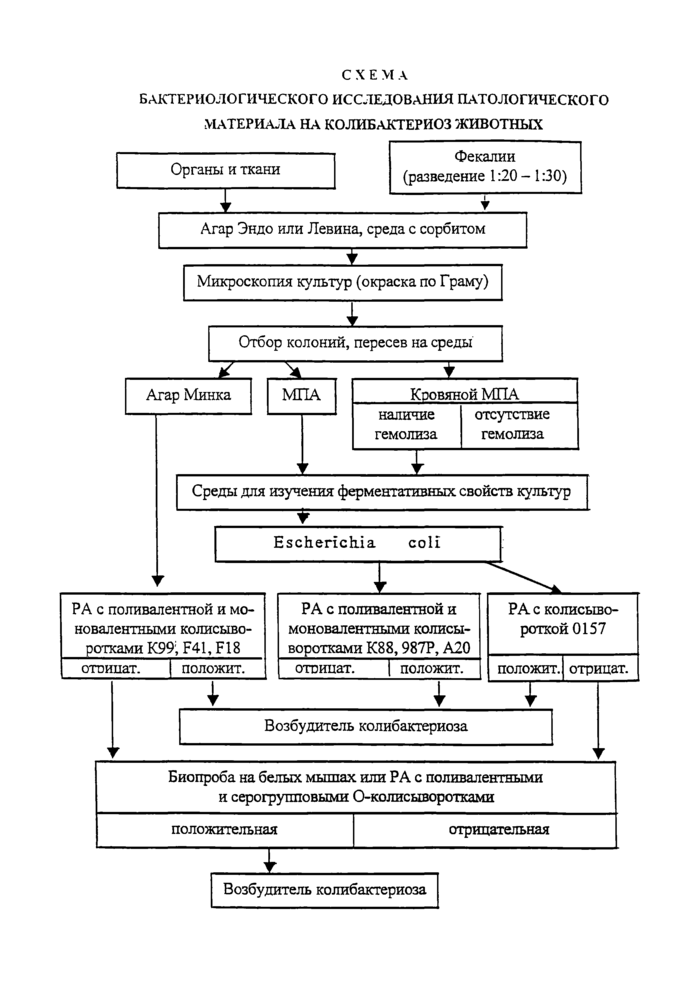
Схема бактериологического исследования патологического материала на колибактериоз животных
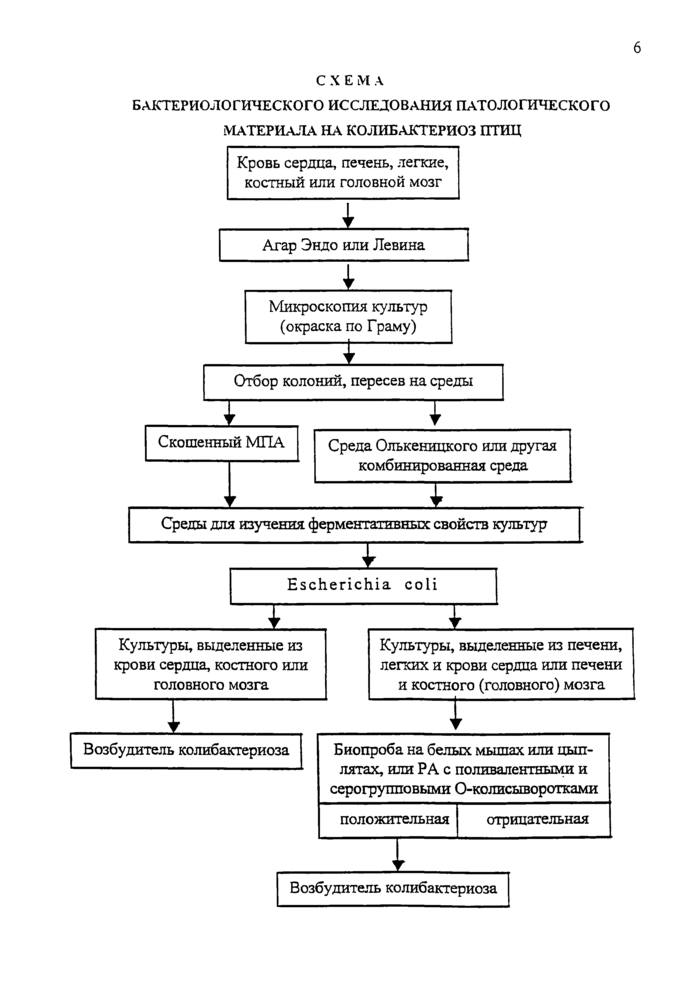
Схема бактериологического исследования патологического материала на колибактериоз птиц
4 Оценка результатов бактериологического исследования
Приложение 1. Справка: колибактериоз (эшерихиоз) животных
Приложение 2. Рецепты приготовления реактивов, питательных сред и методы определения ферментативных свойств культур бактерий
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 27.07.2000 | Утвержден | Министерство сельского хозяйства Российской Федерации | 13-7-2/2117 |
|---|---|---|---|
| Разработан | Департамент ветеринарии Минсельхозпрода Российской Федерации | ||
| Разработан | ВНИИ ветсанитарии, гигиены и экологии | ||
| Разработан | Московский государственный университет прикладной биотехнологии | ||
| Разработан | Государственный научный центр прикладной биотехнологии | ||
| Разработан | ЦНМВЛ Департамента ветеринарии Минсельхозпрода Российской Федерации | ||
| Разработан | ВГНКИ ветпрепаратов |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4
стр. 5
стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
УТВЕРЖДАЮ
|
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ (Минсельхоз России) ДЕПАРТАМЕНТ ВЕТЕРИНАРИИ |
^^Зам^^-^водителя Департамента Министерства сель-
озя^тва и продовольствия !рации
В.В.Селиверстов
“_25L” яию 2000 г.
107139, Москва, Орликов пер., 1VU Для телеграмм: Москва, 84 Минсельхозпрод Телекс 417738 ЛЕН Факс: (095)975-58-50
27.Q7.OQr. № и~%2/2Ш
На №____
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по бактериологической диагностике колибактериоза (эшерихиоза) животных
1. Общие положения
1.1. Колибактериоз (эшерихиоз, колидиарея, коли-инфекция) - остро протекающая инфекционная болезнь молодняка животных всех видов. Возбудителями болезни являются патогенные штаммы Escherichia coii, относящиеся к роду Escherichia, семейству Enterobacteriaceae.
1.2. Колибактериоз протекает в септической (колисептицемия) или энтерит-ной (колидиарея) формах; у поросят-отъемышей еще и форме отечной болезни (колиэнтеротоксемия) или колидиареи, у птиц - в септической форме. При септической форме возбудитель локализуется в крови, внутренних органах и тканях, кишечнике и регионарных брыжеечных лимфатических узлах; при энтеритной форме - в кишечнике и брыжеечных лимфатических узлах; при отечной болезни поросят - в тонком отделе кишечника, брыжеечных лимфатических узлах, реже -в паренхиматозных органах.
1.3. Ведущая роль в развитии колидиареи новорожденных телят, поросят и ягнят принадлежит энтеротоксигенным штаммам эшерихий с адгезивными антигенами К88, К99, 987Р, F41, F18, А20. Отечную болезнь поросят обусловливают эшерихии, продуцирующие вероцитотоксин VT2 и образующие адгезивный антиген F18a,b; в преобладающем большинстве случаев эти бактерии обладают гемолитическими свойствами. За счет адгезивных антигенов происходит прикрепление бактерий к эпителиальным клеткам ворсинок тонкого отдела кишечника и интенсивное их размножение (колонизация), приводящие к
развитию воспалительного процесса и гибели клеток с последующим проникновением эшерихий в регионарные лимфатические узлы, а иногда и в кровоток. Диарею животных с признаками геморрагического гастроэнтерита вызывают эшерихии серологических вариантов (сероваров) 0157:Н7 и 0157:Н-, образующие шигоподобные вероцитотоксины.
1.4. Диагноз на колибактериоз в хозяйствах устанавливают на основании эпизоотологических данных (возраст заболевших животных, массовость поражения, стационарность и пр.), клинических признаков болезни, патологоанатомических изменений и результатов бактериологического исследования материала от больных, павших или убитых с диагностической целью животных.
1.5. При бактериологической диагностике колибактериоза проводят выделение чистой культуры возбудителя болезни и изучение его морфологических, тинкториальных, культуральных, ферментативных, антигенных, патогенных, а при подозрении на отечную болезнь поросят - еще и гемолитических свойств.
2. Материал для исследования
2.1. Для посмертной бактериологической диагностики колибактериоза в лабораторию направляют 2-3 свежих трупа или убитых с диагностической целью больных животных (желательно не подвергавшихся лечению антибактериальными препаратами). В случае невозможности доставки целого трупа в лабораторию направляют от телят, ягнят и поросят долю печени с желчным пузырем; сердце, перевязанное лигатурой вблизи разреза сосудоа и аорты; селезенку, пораженный участок тонкого отдела кишечника, перевязанный с двух концов лигатурой, с 2-5 пакетами регионарных лимфатических узлов, голову, трубчатую кость. Кишечник вместе с регионарными лимфатическими узлами упаковывают отдельно в полиэтиленовый пакет.
2.2. Для прижизненной бактериологической диагностики колибактериоза в лабораторию направляют фекалии больных диареей животных (не менее чем от 5 животных с одной фермы), не подвергавшихся лечению антибактериальными препаратами. Пробы фекалий массой 1-2 г от каждого больного животного берут во время дефекации или из прямой кишки в стерильные пробирки с помощью прокипяченного резинового катетера, обвертывают их ватой и вместе с сопроводительной запиской упаковывают в пенал, коробку или полиэтиленовый пакет. При невозможности быстрой доставки проб фекалий в лабораторию (через 3-4 часа после взятия) их консервируют глицериновым раствором в соотношении 1:2 (приложение 2).
2.3. Для диагностики колибактериоза птиц в лабораторию направляют из неблагополучных птичников по 3-5 свежих трупа и 3-4 цыпленка с клиническими признаками болезни. Больную птицу убивают в лаборатории и подвергают бактериологическому исследованию.
11
свернувшегося молозива или молока; регионарные брыжеечные лимфатические узлы увеличены, набухшие, на разрезе розового или красно-вишневого цвета. На эндокарде (в области клапанов) и перикарде точечные, полосчатые или пятнистые кровоизлияния. Печень часто перерождена, увеличена, глинистого цвета, пульпа дряблая; селезенка не увеличена, темно-вишневого цвета, под капсулой могут быть точечные кровоизлияния; нередко отек и катаральное воспаление легких, в головном мозге гиперемия сосудов и отек ткани.
При отечной болезни поросят наблюдается отек век, подкожной клетчатки в области головы, катарально-геморрагическое воспаление слизистой желудка и кишечника, студенистая инфильтрация стенки кишечника, увеличение и геморрагическое воспаление брыжеечных лимфатических узлов, нередко серозный экссудат в грудной и брюшной полостях; гиперемия, отек легких и катаральная пневмония. У птиц - фибринозный перикардит, перигепатит, аэросаккулит, сальпингит, оварит, перитонит, иногда воспаление кишечника.
Возбудителями колибактериоза являются патогенные штаммы эшерихий, которые в отличие от непатогенных разновидностей имеют различные факторы патогенности. В частности, способность образования экзотоксинов (энтеротоксина, вероцитотоксина) и эндотоксина; адгезинов (фимбрий), за счет которых происходит прикрепление бактерий к клеткам энтероцитов ворсинок слизистой кишечника и их колонизация; патогенных ферментов (декарбоксилаз) и др.
Некоторые штаммы эшерихий проявляют свою патогенность за счет инвазивных свойств (способности проникновения через эпителиальные клетки слизистой кишечника или альвеол легких в лимфо-и кровоток), вызывая генерализованный (септический) процесс.
Эшерихии имеют сложное антигенное строение, которое определяет биологические особенности разных штаммов этого вида бактерий. Помимо адгезивного антигена, свойственного энтеротоксигенным штаммам, эшерихии содержат три основных типа антигенов: О, К и Н. О-антиген (соматический, термостабильный) состоит из полисахаридо-липидо-протеинового комплекса, который определяет серогрупповую принадлежность бактерий. В настоящее время известно свыше 160 серологических групп эшерихий. К-антиген (поверхностный) подразделяется на три вида антигенов, обозначаемых латинскими буквами L, В и А. Термолабильные L и В-антигены разрушаются приЮ0°С в течение 1 часа, А-антиген (капсульный) термостабильный, разрушается при автоклавировании (121°С) в течение двух часов, содержится у бактерий некоторых серологических групп (08,09,0101 и др.) Поверхностные (L, В. А) антигены препятствуют агглютинации бактерий соответствующей О-сывороткой, ввиду чего при серогрупповой типизации культур эшерихий их подвергают термической обработке: прогреванию в водяной бане или автоклавированию. Н-антиген (жгутиковый) содержится у подвижных штаммов эшерихий, имеет белковую природу и является термолабильным. Сочетание О, К и Н-антигенов характеризует серологический вариант (серовар) бактерий.
12
Приложение 2
РЕЦЕПТЫ
приготовления реактивов, питательных сред и методы определения ферментативных свойств культур бактерий
1. Глицериновый раствор для консервирования фекалий
Состав: глицерин нейтральный - 300 см3
натрий хлористый - 5 г
вода дистиллированная - 700 см3
Раствор стерилизуют при 1 атм (121°С) в течение 20 мин или прогревают в водяной бане (100°С) в течение 30-40 мин.
2. Забуференный физиологический раствор с pH 7,0-7,2
К 1 дм3 0,85%-ного раствора хлорида натрия добавляют 10 см3 смеси 1/15 М растворов двузамещенного фосфорнокислого натрия (Na2HP04' 12Н20) и одноза-мещенного фосфорнокислого калия (КН2Р04) в соотношении 7:3 или 8:2 (в зависимости от исходной величины pH воды), компоненты в колбе тщательно размешивают. Хранят раствор в темном месте в течение 6 мес.
3. Селективные среды Эндо, Левина
Коммерческие сухие среды готовят в соответствии с указаниями на этикет-
4. Селективная среда с сорбитолом (сорбитом) для выделения я идентификации E.coli сероваров 0157:Н7 и 0157:Н-
Коммерческая сухая среда изготовляется в Государственном научном центре прикладной микробиологии АМН (142279, пос. Оболенск, Серпуховского р-на Московской обл.). Готовят среду в соответствии с указанием на этикетке.
Эшерихии серогруппы 0157 (варианты 0157:Н7 и О 157H-) образуют на данной среде колонии серовато-белого цвета; колонии других серологических групп эшерихий - красно-малинового цвета
5. Среда Минка для выявления адгезивных антигенов эшерихий К88, F41, F18
Для приготовления среды вначале готовят следующие исходные растворы:
а) фосфатно-буферный раствор с pH 7,4-7,5. Для его приготовления предварительно получают 1/15 М растворы двузамещенного фосфорнокислого натрия (Na2HP04'12Н20) и однозамещенного фосфорнокислого калия (КН2Р04). С этой целью добавляют к 1 дм3 дистиллированной воды 23 г Na2HP04 (в первую колбу) и 9 г КН2Р04 (во вторую колбу), компоненты растворяют путем встряхивания колб. Колбы с полученными 1/15 М растворами солей закрывают резиновыми или корковыми пробками и хранят в темном месте при комнатной температуре в течение 6 месяцев. Для получения фосфатно-буферного раствора с pH 7,4— 7,5 к 1 дм3 дистиллированной воды добавляют 10 см3 смеси 1/15 М растворов
Ij
вают.
б) Раствор микроэлементов:
магний сернокислый (MgSCU 7Н20) - 1 г
марганец хлористый (МпС12 4Н20)С12 - 0,1 г
кальций хлористый (СаС1 2 6Н20) - 0,04 г
железо хлорное (FeCl3 6Н20) - 0,02 г
вода дистиллированная -100 см3
Na2HPO.i и КН2РОд в соотношении 9:1. компоненты в колбе тщательно перемеши
Компоненты тщательно размешивают в воде, отверстие колбы закрывают резиновой или корковой пробкой, хранят раствор микроэлементов при комнатной температуре в течение 1 мес.
в) 4%-ный раствор агара-агара. Для его приготовления в колбу с 1 дм3 дистиллированной воды добавляют 40 г предварительно отмытого агара-агара, колбу нагревают до полного расплавления агара, затем фильтруют через ватный фильтр и стерилизуют при 1 атм. (121°С) в течение 30 мин. Перед употреблением застывший агар расплавляют в водяной бане.
фосфатно-буферный раствор (pH 7,4-7,5) - 950 см3
раствор микроэлементов - 2 см3
40%-ный раствор глюкозы - 25 см3
10%-ный раствор дрожжевого экстракта - 10 см3
10%-ный раствор гидролизата казеина — 20 см3
Среду Минка готовят по следующему рецепту:
Примечание: для приготовления среды используют сухой очищенный дрожжевой экстракт и сухой гидролизат казеина.
6. Среда с мочевиной (по Преусу)
Состав: бульон Хоттингера или мартеновский бульон - 1000 см3 агар-агар - 15 г
глюкоза - 5 г
50%-ный водный раствор мочевины - 20 см3
0,2%-ный раствор бромтимолблау -12 см3
Компоненты в колбе размешивают, затем нагревают смесь до температуры 45-50° С, после чего к ней добавляют 1 дм3 расплавленного 2%-ного раствора агар-агара Готовую среду (2%-ный агар Минка) разливают в колбы по 100-200 см3 и стерилизуют при 0,5 атм (112° С) в течение 15 мин.у хранят среду не более 1,5 мес. Перед употреблением ее расплавляют в водяной бане и разливают в стерильные чашки Петри.
Приготовление: к стерильному расплавленному агару на бульоне Хоттингера или мартеновском бульоне с pH 6,9—7,0 добавляют глюкозу, растворы мочевины и индикатора бромтимолблау. Расплавленную среду разливают в стерильные пробирки по 5 см3 и стерилизуют однократно текучим паром 20-30 мин. или при 112° С 15 мин. Перед употреблением среду скашивают. Готовая среда имеет зеленовато-оливковый цвет. Посев с агаровой среды проводят обильный частыми штрихами.
При расщеплении мочевины среда приобретает синий цвет, при отсутствии
14
расщепления мочевины она окрашивается в желтый цвет.
6.1. Среда с мочевиной (по Кристенсену)
Состав: пептон - 1 г
натрия хлорид - 5 г
калий фосфорно-кислый однозамещенный (КН2РО4) - 2 г агар-агар - 20 г
глюкоза - 1 г
феноловый красный (0,2%-ный водный раствор) - 6 см3
мочевина (20%-ный водный раствор) - 100 см3
вода дистиллированная - 1 ООО см3
Приготовление: пептон, соли, индикатор и агар растворяют при нагревании, устанавливают pH 6,9-7,0, среду фильтруют через ватно-марлевый фильтр и стерилизуют при 0,5 атм (112° С) 15 мин. Раствор мочевины после фильтрования через фильтр Зейтца добавляют в стерильную среду и тщательно его перемешивают, готовую среду разливают в пробирки по 5 см3 и скашивают.
При расщеплении мочевины среда приобретает малиновый цвет, при отсутствии расщепления мочевины она окрашивается в желтый цвет.
7. Цитратный агар Симонса
среды Козера.
Состав среды ЬСозера:
натрий-аммоний фосфорнокислый двузамещенный (NaNHtHPO4-4H20) -1,5 г
калий фосфорнокислый однозамещенный (КН2Р04) - 1 г
магний сернокислый (MgS04'7Н20) — 0,2 г
натрий лимоннокислый СМа30бНз07'5Н20) - 3 г
дистиллированная вода — 1000 см3
Для определения способности бактерий усваивать цитратно-аммонийные соли используют коммерческую сухую среду, которую готовят согласно указаниям на этикетке препарата, или агар Симонса, приготовленный на основе жидкой
Для приготовления агара Симонса к 1 дм3 среды Козера добавляют 20 г агара-агара и 10 см3 индикатора бромтимолблау. Последний готовят из расчета: бромтимолблау - 1 г, 0,Ш раствор NaOH - 25 см3 (для получения указанного раствора к 100 см3 дистиллированной воды добавляют 0,4 г NaOH), дистиллированной воды - 475 см3.
Среду нагревают до полного расплавления агара, фильтруют через ватномарлевый фильтр, затем разливают в пробирки по 5 см3 и стерилизуют при 0,5 атм (112° С) в течение 15 мин. Готовая среда имеет зеленовато-оливковый цвет. Перед употреблением среду скашивают. Посев проводят культурой, выращенной на МПА.
Бактерии, способные усваивать цитратно-аммонийные соли, дают рост на агаре Симонса с изменением его в синий цвет. При отсутствии указанного свойства роста культуры не наблюдается и цвет среды не изменяется.
L5
8. Среда для обнаружения сероводорода
К L дм3 расплавленного стерильного 1,7%-ного МПА добавляют 0,2 г сернокислого железа (FeS04'7Н20); 0,3 г серноватистокислого натрия-тиосульфата (Na2S203'5Н20), I г лактозы, 12 см3 0,2%-ного водного раствора фенолрота. После размешивания компонентов среду разливают в стерильные пробирки по 6-7 см3 и стерилизуют текучим паром однократно в течение 20 мин. Готовая среда имеет бордово-красный цвет. Перед употреблением среду скашивают так, чтобы она имела столбик размером не менее 2,5-3 см.
Среду засевают агаровой культурой бактерий вначале на скошенную поверхность, а затем уколом в столбик. В случае образования сероводорода среда в столбике окрашивается- в черный цвет. При отрицательном результате почернения среды не наступает.
9. Среды и реактивы для определения индолообразования
Для исследования применяют одну из следующих сред:
- бульон на триптическом переваре казеина (1,2-1,4% аминного азота);
- МПБ или бульон Хоттингера (1,2-1,4% аминного азота);
- 2%-ную пептонную воду.
9.1. Реактивы для обнаружения индола
9.1.1. Реактив Эрлиха.
Состав: пара-диметиламинобензальдегид - L г
спирт этиловый. 96° — 95 см3
соляная кислота концентрированная — 20 см3
Приготовление и хранение: альдегид растворяют в спирте, затем, добавляют кислоту, хранят реактив в закрытом темном флаконе при температуре 4-6° С.
Применение реактива: к двухсуточной культуре бактерий, выращенной на любой из сред для определения индола, добавляют 0,5 см3 реактива Эрлиха, пробирку встряхивают и через 1-2 мин. учитывают результаты. В случае образования индола верхний слой жидкости приобретает розовый цвет, при отрицательной реакции он окрашивается в желтый цвет.
9.1.2. Реактив Ковача.
Состав: пара-диметиламинобензальдегид - 5 г
спирт амиловый -75 см3
соляная кислота концентрированная - 25 см3
Приготовление, хранение и применение реактива аналогичны реактиву Эрлиха. В случае образования индола за счет реактива Ковача верхний слой жидкости окрашивается в красный цвет, при отрицательной реакции - в желтый цвет.
9.13. Индикаторные бумажки для определения индола.
Предварительно готовят следующий реактив:
пара-диметиламинобензальдегид — 5 г
концентрированная ортофосфорная кислота (Н3РО4) - 10 см3 спирт этиловый 96° - 50 см3
Приготовленный реактив переливают в эмалированный металлический кювет, в который помещают кусочки фильтровальной бумаги. Пропитанные реактивом бумажки высушивают на воздухе при комнатной температуре, затем нареза-
16
ют полосками размером 0,7-0.8 х 10-12 см. Бумажки имеют желтый цвет. Хранят их в банке из темного стекла, закрытой резиновой или корковой пробкой.
Для приготовления индикаторных бумажек можно использовать реактив Эрлиха или Ковача.
Применение: после посева изучаемой культуры бактерий на любую из сред для определения индола помещают в пробирку полоску индикаторной бумажки, верхний конец которой прижимают ватной пробкой. Нижний конец бумажки должен быть на расстоянии не менее 3-4 см от поверхности среды. Засеянные пробирки инкубируют в термостате в течение двух суток. При наличии индолооб-разования нижний конец индикаторной бумажки окрашивается в малиново-красный цвет, при отрицательной реакции цвет бумажки не изменяется.
10. Комбинированные среды для первичной идентификации культур
10.1. Агар Клиглера.
Коммерческая сухая среда готовится в соответствии с указаниями на этикетке. Готовая к употреблению среда имеет красновато-бурый или оранжевокрасный цвет, при скашивании среды оставляют столбик высотой не менее 2-2,5 см.
Состав: агар питательный сухой - 25 г
лактоза —Юг
сахароза —10 г
глюкоза — 1 г
аммоний-железо /11/ сульфат
[FeS04 • (NRO2SO4 • 6Н20] - 0,2 г
натрий тиосульфат (Na2S203'5Н20) — 0,3 г
мочевина —10 г
феноловый красный (0,4%-ный водный раствор) — 4 см3 вода дистиллированная — 1000 см3
10.2. Трехсахарный агар с мочевиной по Олькенипкому.
Приготовление: соли предварительно растворяют в небольшом объеме дистиллированной воды. Углеводы и мочевину также растворяют в небольших объемах воды при подогревании в водяной бане. Сухой питательный агар расплавляют в оставшемся объеме воды при нагревании и помешивании. Затем все ингредиенты смешивают с расплавленным агаром, фильтруют через ватно-марлевый фильтр, устанавливают pH 7,2-7,4. После добавления индикатора среду хорошо перемешивают, разливают в пробирки по 6-7 см3. Стерилизуют текучим паром 3 дня подряд по 20 мин. или при 0,5 атм. (112° С) 15 мин. Среду скашивают, оставляя столбик не менее 2-2,5 см. Готовая среда бледно-розового цвета.
О ферментации лактозы в среде Клиглера и Олькеницкого судят по появлению желтой окраски в скошенной части агара, а о ферментации глюкозы - по окрашиванию столбика в аналогичный цвет. В культурах, ферментирующих лактозу и сахарозу, вся среда (столбик и косяк) приобретает желтый цвет. Газообразование устанавливают по наличию пузырьков в среде, разрывов агара или его отслоению от стенок пробирки. При образовании сероводорода происходит почернение среды в столбике, а при значительной его продукции - почернение всей
реды. В случае гидролиза мочевины происходит окрашивание столбика и косяка реды в малиновый цвет.
Учет ферментативных свойств культуры проводят через 24 и 48 часов.
3
3. Порядок исследования материала
Бактериологическое исследование проводят в соответствии с прилагаемыми ниже схемами.
3.1. Первый день - посевы из паренхиматозных органов, костного и головного мозга, брыжеечных лимфатических узлов, соскобов со слизистой тонкого кишечника павших и убитых животных делают на подсушенную среду Эндо или Левина, а также на плотную среду с сорбитом (сорбитолом) для обнаружения эшерихий сероваров 0157:Н7 и 0157:Н-. Посевы проводят путем проведения разрезанной поверхности кусочка органа (из предварительно профламбированного участка) по поверхности питательной среды или отпечатков разрезанной поверхности органа. Кровь, костный мозг, желчь наносят на поверхность среды пастеровской пипеткой и равномерно растирают их стеклянным шпателем.
При исследовании трупов птиц посевы делают из крови сердца, легких, печени, костного или головного мозга на среду Эндо или Левина. От погибших по-росят-отъемышей с признаками отечной болезни или диареи проводят посевы суспензии из соскобов со слизистой оболочки пораженного участка тонкого кишечника, регионарных брыжеечных лимфатических узлов и паренхиматозных органов.
3.1.1. Каждую пробу фекалий (не более 0,5 г) от больных диареей или соскобов со слизистой кишечника погибших животных, взятую стерильным скальпелем, помещают в отдельную пробирку, содержащую 10 см3 стерильного 0,85%-ного раствора хлорида натрия; тщательно размешивают стеклянной палочкой и выдерживают 10-15 мин при комнатной температуре для осаждения крупных частиц. Надосадочную жидкость засевают бактериологической петлей частыми, широкими штрихами на поверхность плотной селективной среды в чашках с целью получения роста изолированных колоний бактерий.
Перед посевом материала на среду Эндо или Левина ее поверхность орошают 1-2 см3 96° спирта-ректификата для задержки роста роящейся формы протея. Невпитавшийся спирт отсасывают пастеровской пипеткой при наклонном положении чаШки, после чего среду подсушивают в термостате в течение 10-15 мин, а затем используют для посева. Засеянные чашки помещают в термостат (37°С) на 18-24 часа.
3.2. Второй день - извлечение из термостата чашки с культурами на агаре Эндо или Левина просматривают и отбирают 10 типичных для эшерихий колоний (5 — выросших после посева фекалий или соскобов со слизистой кишечника и 5 -из других органов и тканей, в том числе брыжеечных лимфатических узлов): круглые с гладкой, выпуклой поверхностью, ровными краями диаметром 2-4 мм, красно-малинового цвета на агаре Эндо и темно-фиолетового цвета на агаре Левина с металлическим блеском или без него, а затем нумеруют их. Из отобранных колоний готовят мазки, окрашивают их по Граму и микроскопируют. При наличии в мазках мелких грамотрицательных палочек с закругленными концами, не образующих спор, расположенных одиночно и попарно, пересевают эти колонии на пластинчатый МПА и среду Минка в чашках, разделенных карандашом для стекла на 10 секторов (каждую колонию на две среды и соответствующий прону-4
мерованный секторУ При этом в обязательном порядке пересевают лактозоположительные колонии, имеющие слизистую тягучую консистенцию, если такие колонии содержатся в культуре.
С чашек с культурами на среде с сорбитом, выделенных из разных органов и тканей животного, отбирают 3-4 колонии, характерные по структуре и цвету для эшерихий сероваров 0157:Н7 и 0157:Н- (средних размеров S-формы, сероватобелого цвета). Из этих колоний готовят мазки, окрашивают их по Граму и микро-скопируют. В случае типичных для эшерихий клеток бактерий указанные колонии пересевают в пробирки со скошенным МПА.
При исследовании на отечную болезнь поросят дополнительно пересевают с агара Эндо или Левина 5-6 колоний на кровяной агар в чашке, разделенной на соответствующее количество секторов, для изучения гемолитических свойств культур.
Лакгозоположительные колонии на плотной селективной среде (Эндо или Левина), выросшие после посева материала от птиц, не пересевают на пластинчатый МПА и среду Минка. Для родовой и видовой идентификации культур и изучения их свойств отбирают 2-3 типичные для эшерихий колонии (с культур, выделенных из разных органов и тканей одной погибшей или убитой с диагностической целью птицы), из которых готовят мазки, окрашивают их по Граму и микро-скопируют. При наличии в мазках морфологически характерных для эшерихий клеток бактерий пересевают эти колонии на скошенный МПА или среду Ольке-ницкого, или другую комбинированную среду.
Во всех случаях засеянные чашки и пробирки помещают в термостат (37°С) на 16-20 часов.
3.3. Третий день — полученные на пластинчатом и скошенном МПА, а также кровяном МПА культуры (обладающие гемолитическими свойствами) в количестве двух-трех от каждого животного и выделенные из разных органов и тканей или фекалий подвергают изучению по биохимическим тестам с целью родовой и видовой идентификации. Для этого их засевают на среды Гисса с глюкозой, лактозой и индикатором Андреде, среду с мочевиной, агар Симонса, среду с сернокислым железом (тест на сероводород), бульон Хотгингера или МПБ (тест на индол), а также в 2 пробирки со скошенным МПА для определения серогрупповой принадлежности или изучения патогенных свойств культур в биопробе (в случае необходимости).
Для идентификации культур по ферментативным свойствам можно использовать комбинированные среды (Олькеницкого, Клиглера или др.), полужидкие среды с сахарами и индикатором ВР, бумажные диски СИБ или системы мультимикротестов.
Засеянные пробирки инкубируют при 37°С в течение 48 часов, ежедневно учитывая изменения в средах.
3.4. Четвертый день - проводят предварительный учет результатов изучения ферментативных свойств культур. Бактерии рода Escherichia ферментируют с образованием кислоты и газа глюкозу, лактозу (за исключением отдельных штаммов), не растут на агаре Симонса и не утилизируют цитратно-аммонийные соли, не расщепляют мочевину, образуют индол и не образуют сероводород.
СХЕМА
БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ПАТОЛОГИЧЕСКОГО МАТЕРИАЛА НА КОЛИБАКТЕРИОЗ ЖИВОТНЫХ
СХЕМ А
БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ПАТОЛОГИЧЕСКОГО МАТЕРИАЛА НА КОЛИБАКТЕРИОЗ ПТИЦ
6
Культуры, отклоняющиеся по отдельным ферментативным свойствам от бактерий рода Escherichia, подвергают дополнительному изучению в соответствии с тестами и дифференциальной схемой, изложенными в “Методических указаниях по бактериологической диагностике смешанной кишечной инфекции молодняка животных, вызываемой патогенными энтеробактериями”, утвержденными Департаментом ветеринарии МСХиП РФ 11 октября 1999 г.
Изоляты, отнесенные к виду Escherichia coli, исследуют в РА на стекле с агглютинирующими антиадгезивными колисыворотками: вначале с комплексной, а в случае положительной реакции - с моновалентными сыворотками. При этом культуры, выросшие на пластинчатом МПА, изучают с сыворотками К88, 987Р и А20; культуры на среде Минка- с сыворотками К99, F41, F18. РА проводят в соответствии с действующим наставлением по применению указанных сывороток.
3.4.1. Обнаружение эшерихий с адгезивными антигенами можно проводить ускоренным методом согласно «Методическим указаниям по ускоренной индикации морганелл, сальмонелл и энтеропатогенных эшерихий с адгезивными антигенами в патологическом материале, кормах и объектах внешней среды в реакции коагтлютинации», утвержденными Департаментом ветеринарии МСХиП РФ 11 октября 1999 г. (приложение 3). Для приготовления коагтлютинирующих диагно-стикумов используют 6 типов агглютинирующих антиадгезивных сывороток, указанных в п.3 .4.
3.4.2. Культуры эшерихий на скошенном МПА, полученные после пересева серовато-белых колоний на среде с сорбитом (не ферментирующие этот многоатомный спирт), исследуют с агглютинирующей колисывороткой Q157 в РА на стекле. Реакцию ставят с живыми культурами. При положительной реакции для исключения самоагглютинации клеток бактерий культуру исследуют с 0,85%-ным раствором хлорида натрия. В контроле с физиологическим раствором агглютинация бактерий должна отсутствовать.
3.4.3. Культуры эшерихий, не агглютинирующиеся с моновалентными антиадгезивными колисыворотками и колисывороткой серогруппы 0157, подвергают исследованию на патогенность в биопробе на белых мышах (или цыплятах) или серологическому типированию по 0-антигену с набором поливалентных и серогрупповых О-колисывороток в соответствии с действующим наставлением по применению этих сывороток.
Для биопробы используют две культуры на скошенном МПА, выделенные из разных органов и тканей или фекалий одного животного. Каждую культуру смывают 0,85%-ным стерильным раствором хлорида натрия, готовят суспензии в концентрации 1 млрд микробных клеток/см3 по оптическому или бактерийному стандарту, затем смешивают их в равном объеме и вводят смесь бактерий внутри-брюшинно по 0,5 см3 трем белым мышам массой 14-16 г или трем цыплятам 2,5-3-х недельного возраста (при исследовании материала от птиц). При определении патогенности культур, выделенных от птиц, для биопробы используют культуры, выделенные от двух-трех цыплят каждого птичника Наблюдение за зараженными мышами и цыплятами проводят в течение трех суток.
3.5. Пятый день - проводят окончательный учет результатов изучения фер-8
ментативных свойств культур, предварительный учет результатов биопробы и определение серогрупповой принадлежности культур эшерихий с поливалентными и моновалентными О-колисыворотками в РА на стекле (в случае необходимости).
Для РА используют 2-3 культуры эшерихий на скошенном МПА, которые не агглютинировали с колисывороткой 0157. С этих культур готовят суспензии в 0,85%-ном растворе хлорида натрия, переливают их в чистые сухие пробирки, устанавливают концентрацию бактерий 2-3 млрд микробных клеток/см3, а затем часть суспензии (1,5-2 см3) переливают еще в одну чистую сухую пробирку. Пробирки с суспензиями одних и тех же культур бактерий маркируют одноименными номерами, после чего их подвергают термической обработке: прогреванию в водяной бане (100°С) в течение 1 часа (большую часть суспензии) и автоклавированию (меньшую часть суспензии) при 1 атм (121°С) в течение 2 часов с целью разрушения поверхностного термостабильного А-антигена, содержащегося у некоторых штаммов эшерихий серогрупп 08, 09, 0101. РА с колисыворотками этих се-рогрупп ставят с прогретыми при 100°С и автоклавированными антигенами.
3.6. Шестой день - проводят предварительный учет результатов биопробы, постановку пробирочной РА с антигенами эшерихий, давшими положительную реакцию в РА на стекле.
3.7. Седьмой день - окончательный учет результатов определения патогенных свойств культур эшерихий в биопробе на мышах или цыплятах и серогрутшо-вой типизации культур в пробирочной РА. Культуры, отнесенные к одной из патогенных серогрупп или вызывающие гибель двух и более мышей или цыплят,, считают патогенными и признают возбудителями колибактериоза.
4. Оценка результатов бактериологического исследования
4.1. Бактериологический диагноз на колибакгериоз считается установленным в каждом из следующих случаев:
- выделения чистых культур эшерихий не менее чем из двух таких органов и тканей как: селезенки, крови сердца, костного мозга, головного мозга свежего трупа или убитого клинически больного животного без определения их патогенности для белых мышей или цыплят и установления серогрупповой принадлежности;
- выделения из исследуемого материала культур эшерихий, содержащих какой-либо из следующих адгезивных антигенов: К88, К99, 987Р, F41, F1'8, А20;
- выделения из патологического материала культур эшерихий, относящихся к патогенным серогруппам или обладающих патогенностью для белых мышей или цыплят;
- выделения культур эшерихий от поросят-отьемышей, погибших с признаками отечной болезни, из содержимого тонкого отдела кишечника и брыжеечных лимфатических узлов, обладающих гемолитическими свойствами.
4.2. Результаты бактериологического исследования формулируют: «Из присланного материала (указать какого) выделен возбудитель колибактериоза» (ука-
зать тип адгезивного антигена или серогруппу в случае их установления) или «Из присланного патологического материала (указать какого) возбудитель колибакте-риоза не выделен».
4.3. Общий срок бактериологического исследования патологического материала до 7 суток.
* * *
С утверждением настоящих Методических указаний на территории Российской Федерации не действуют «Методические указания по бактериологической диагностике колибактериоза (эшерихиоза) животных», утвержденные Главным управлением ветеринарии МСХ СССР 12 декабря 1991 года.
* * *
Методические указания разработаны В.И. Белоусовым (Департамент ветеринарии Минсельхозпрода Российской Федерации), Л.С. Кавруком (ВНИИ ветса-нитарии, гигиены и экологии), Ю.А. Малаховым, О.А. Тугариновым, М.К. Пирожковым (ВГНКИ ветпрепаратов), Э.А. Светочем (Государственный научный центр прикладной микробиологии), М.А. Сидоровым (Московский государственный университет прикладной биотехнологии), В.А. Седовым, Л.А. Тарановой, В.Е. Завьянцевым (ЦНМВЛ Департамента ветеринарии Минсельхозпрода Российской Федерации).
10
Приложение I
СПРАВКА: КОЛИБАКТЕРИОЗ (ЭШЕРИХИОЗ) ЖИВОТНЫХ
Колибактериоз (эшерихиоз) - широко распространенная инфекционная болезнь сельскохозяйственных животных и пушных зверей. Колибактериозом болеют преимущественно новорожденные животные первых дней и недель жизни, цыплята в возрасте от 1 до 90 дней. У взрослой птицы болезнь может возникать в период начала яйцекладки. У большинства видов животных болезнь протекает в кишечной (энтеритной) или септической формах; у поросят-отьемышей в форме диареи или в форме отечной болезни; у птиц - в септической форме. Течение бо-лезйи преимущественно острое и сопровождается высокой смертностью молодняка. При кишечной форме колибактериоза (колидиареи) возбудитель локализуется в желудочно-кишечном тракте и брыжеечных лимфатических узах, регионарных пораженным участкам кишечника. При септической форме - в различных внутренних органах и тканях.
Клинические признаки колибактериоза характеризуются потерей аппетита, профузным поносом, учащенной дефекацией, нарастающей слабостью, депрессией и интоксикацией. При затяжном течении болезни наблюдается обезвоживание организма, западание глазных яблок, серозно-гнойное истечение из носовых отверстий, иногда пневмония, артриты. У телят при сверхостром течении болезни понос может отсутствовать. Дыхание и сердцебиение учащены, температура тела в пределах нормы, в отдельных случаях отмечается кратковременное повышение ее, в предагональном состоянии она ниже нормы. Отечная болезнь у поросят-отьемышей проявляется развитием отеков подкожной клетчатки век, носовой части головы, подчелюстного пространства; нарушением координации движения, судорогами, парезами; застойной гиперемией кожи в области пятачка, ушей, конечностей и живота; кратковременным повышением температуры тела в начале заболевания с последующим снижением ее до нормы. У щенков пушных зверей - потеря аппетита, понос с выделением жидкого зловонного кала желто-зеленого цвета, содержащим пузырьки газа и слизь; взъерошенность шерстного покрова, нарастающая слабость, иногда поражение органов дыхания и центральной нервной системы (судороги, возбуждение, сменяющееся угнетением). У цыплят колисеп-тицемия протекает обычно без признаков диареи с явлениями нарастающей слабости, поражения органов дыхания, парезами, параличами, нередко возникают артриты. У взрослой птицы наблюдается угнетение, потеря аппетита, затрудненное дыхание, хрипы, (иногда диарея), снижение или прекращение яйцекладки, парезы, параличи, развиваются артриты.
Патологоанатомические изменения зависят от продолжительности болезни и формы ее проявления. При подостром течении колибактериоза трупы животных истощены, слизистые оболочки анемичны, глазные яблоки запавшие; при сверхостром и остром течении болезни признаки истощения отсутствуют. В желудке, тонком отделе кишечника, слепой и прямой кишках картина катарального или катарально-геморрагического воспаления, на слизистой могут быть язвы, многочисленные точечные, полосчатые и пятнистые кровоизлияния; в сычуге сгустки