Методические рекомендации
Методические рекомендации по изготовлению и использованию питательных сред и растворов для микробиологических целей, культивирования клеток и вирусов
Купить Методические рекомендации — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические рекомендации предназначены для использования в работе НИВИ, НИВС и ветеринарно-диагностических лабораторий
Оглавление
1. Назначение и цели применения питательных сред
2. Принципы питания микроорганизмов
Доноры водорода
Акцепторы водорода
3. Разделение микроорганизмов на группы по типам питания
Главные и минорные биоэлементы
Факторы роста
4. Подбор состава бактериологических питательных сред
5. Определение потребностей питания
6. Стабильность среды
7. Техника изготовления питательных сред
II. Приготовление полуфабрикатов питательных сред
1. Приготовление мясной воды
2. Приготовление пептона Мартена
3. Мясной перевар по Хоттингеру
Биохимический состав перевара Хоттингера
Приготовление триптического перевара неполного расщепления
Приготовление триптического перевара полного расщепления
4. Печеночный экстракт
5. Сердечный экстракт
6. Дрожжевой экстракт
7. Определение триптофана
Определение свободного триптофана по методу М.А. Пешкова
Ход определения
Расчет
III. Основные и специальные среды для бактериологических исследований
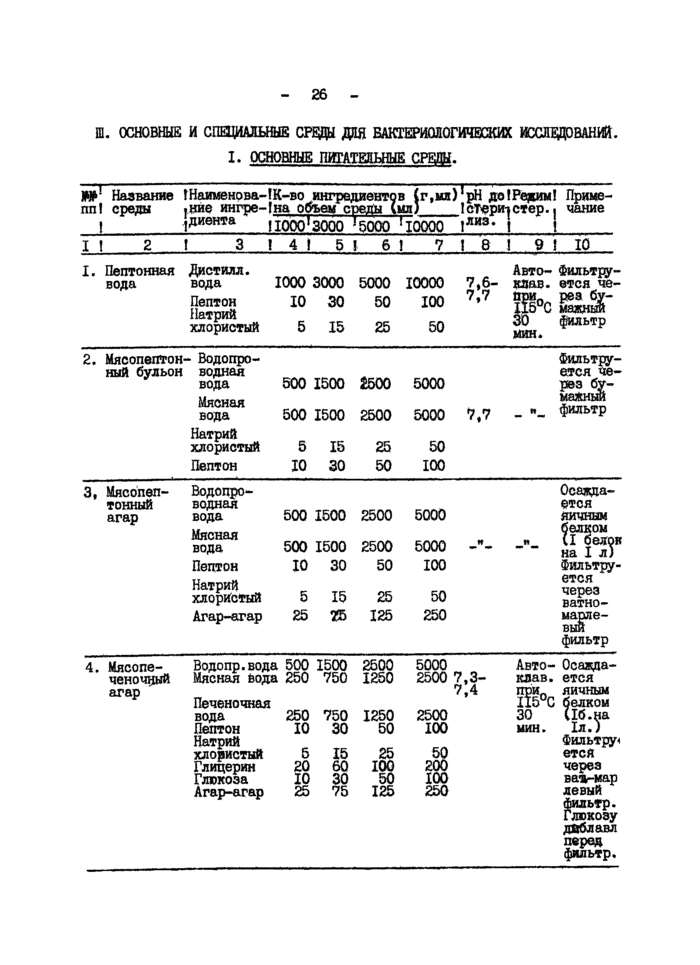
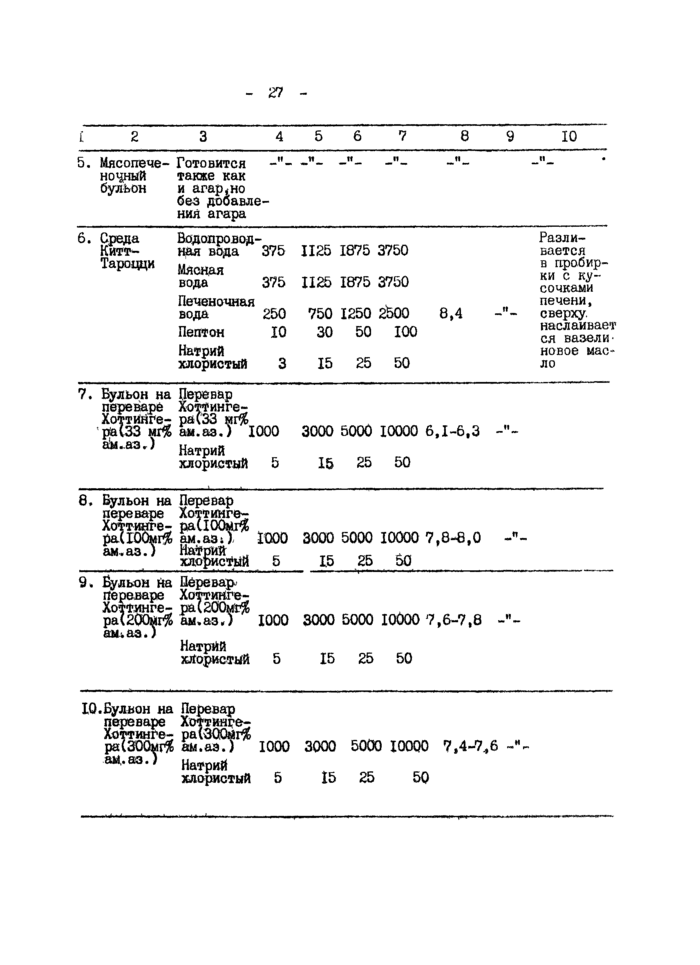
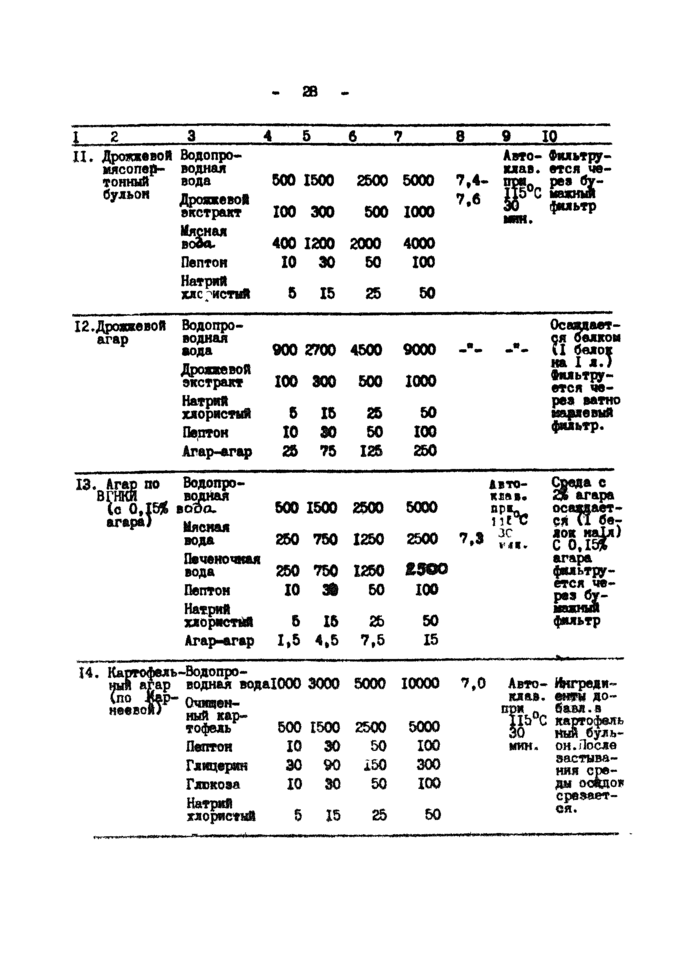
1. Основные питательные среды
2. Питательные среды для изучения метаболизма микроорганизмов
3. Питательные среды для культивирования коли-паратифозной группы бактерий
4. Питательные среды для культивирования кампилобактерий
5. Питательные среды для культивирования бруцелл
6. Питательные среды для культивирования микобактерий
7. Среды для культивирования микоплазм
8. Питательные среды для культивирования грибов
9. Питательные среды для культивирования простейших
10. Питательные среды для культивирования анаэробов
11. Питательная среда для культивирования коринебактерий
12. Питательная среда для культивирования гемофильных бактерий
IV. Биологический контроль питательных сред
V. Определение показателей эффективности
II. Растворы и питательные среды для культивирования клеток и вирусологических исследований
Введение
VII. Способы стерилизации питательных сред, растворов
Соотношение показаний манометра и температуры кипения воды
Показатели температуры плавления порошков-индикаторов
Использованная литература
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27
стр. 28
стр. 29
стр. 30
ВСЕСОЮЗНАЯ ОРДЕНА ЛЕНИНА И ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ АКАДЕМИЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ НАУК имени В. И. ЛЕНИНА
ОТДЕЛЕНИЕ ВЕТЕРИНАРИИ
ВСЕСОЮЗНЫЙ ОРДЕНА ЛЕНИНА НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ЭКСПЕРИМЕНТАЛЬНОЙ ВЕТЕРИНАРИИ имени Я. Р. КОВАЛЕНКО
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
1986
1986
по изготовлению и использованию питательных сред и растворов для микробиологических целей, культивирования клеток и вирусов
Москва
ВСЕСОЮЗНАЯ ОРДЕНА ЛЕНИНА И ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ АКАДЕМИЯ СЕЙЬСКОХОЗЯЙСТВШНЫХ НАУК ИМЕНИ 0.И,ЛЕНИНА
ОВДЕДЕНИЕ ВЕТЕРИНАРИИ
ВСЕСОЮЗНЫЙ ОРДЕНА ЛЕНИНА НАУЧНО-ИССЛВДОВАТЕЛЬОШЙ ИНСТИТУТ ЭКСПЕРИМЕНТАЛЬНОЙ ВЕТЕРИНАРИИ ИМ.Я,Р.КОВАЛЕНКО
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
по изготовлению и использованию питательных сред и растворов для микробиологических целей, культивирования клеток и вирусов
Москва - 1986
- 9 -
при которой они находились в исходной среде), чтобы определить их оптимальные концентрации и необходимость для роста или его стимуляции.
3» Определив оптимальные концентрации, сначала заменяют основной сложный компонент среды, поставляющий азот (например, казеин), на полцую смесь аминокислот в тех же концентрациях, которые использовали в средах для аналитического определения веществ.
4. Если эта смесь обеспечивает рост бактерий, поочередно варьируют концентрацию каждой аминокислоты от нуля до концентрации, превышающей ту,, которая установлена в среде для аналитического определения, Таким образом определяют оптимальную концентрацию каждой аминокислоты в присутствии других. Если же наблюдается ингибирующий эф** факт, то соответетвующую аминокислоту исключают из среды.
5. Заменяют сложный фактор роста, например, дрожжевой экстракт, полным набором известных витаминов и затем варьируют отдельно уровень каждого компонента смеси, как и в случае аминокислот. Если в исходной Среде в качестве источника аминокислот и витаминов используют дрожжевой экстракт, то стараются заменить его полной смесью аминокислот с полным набором известных витаминов и затем варьируют в среде уровень каждого компонента отдельно,
6. Если бактерии не растут на полученной таким путем среде, то это можно объяснись тем, что они нуждаются в неидентифицированном факторе роста, Шн тем, что нарушено соотношение известных факторов роста. Можно также предполагать потребность бактерий в известных факторах роста (пептидах, производных витаминов, жирных кислотах, Нуклеотидах, неорганических ионах и др.), которые содержатся в неочищенных Компонентах комплексной среды, но отсутствуют в смесях испытываемых синтетических веществ. В этом случае необходимо детально выяснить Потребность бактерий в питательных веществах.
7. Если работу начинают с использованием синтетической среды и не наблюдают хорошего роста бактерий на втором этапе, то заменяют источник азота на 10$-ный гидролизат казеина. Если это способствует росту, поступают, как указано на этапе 4; если же интенсивность роста все еще недостаточна, добавляют к среде 1$-ный дрожжевой экстракт.
В случае стимуляции роста, поступают, как указано на этапе 5,
Для роста бактерий, необходимы благоприятные осмотические условия и подходящая для данного- организма концентрация водородных ионов. Для этого иногда приводится вводить в среду химические добавки. Даже если какая-то среда благоприятна ДЯя начального этапа роста, не исключено , что в результате химических изменений, вызываемых метаболизмом самих бактериальны^ клеток, дальнейшее развитие популяций в этой
-10-
среде прекратится. Например, в средах, содержащих глюкозу, в результате брожения могут накапливаться органические кислоты, которые будут подавлять рост бактерий. С другой стороны, использование или распад анионных компонентов среды в результате деятельности микробов может привести к подщелачиванию среды. Чтобы не дометить чрезмерных изменений концентрации водородных ионов, в среду часто добавляют буферы или нерастворимые карбонаты, чшце всего используют фосфатные буферы, состоящие из смеси одно замещенно го и дву замещенного фосфатов (К^НРО^ и КН^РО^). Первая из этих солей слабокислая, а вторая - слабощелочная, так что если в растворе они будут содержаться в эквимолярных количествах, то такой раствор будет приблизительно нейтральным (р!Ы>(8),
фосфаты широко используются при приготовлении питательных сред, так как это единственные неорганические соединения, обладающие буферным действием в физиологически важном диапазоне - около нейтрального значения pH, и так как они малотоксичнь, для организма, кроме того они служат источником фосфора - -одного из элементов, необходимых для роста. В высоких концентрациях фосфаты начинают подпилить реет культуры, поэтому толерантность данного микроорганизма ставит предел количеству фосфатного буфера, которое можно использовать в среде. Как правило, бактерий и грибы могут зьщерживать до 5 г фосфатов калия на I л среды.
Если культура интенсивоно продуцирует кислоту, то тех ограниченных количеств фосфатного буфера, которые можно добавлять в среду, оказывается недостаточно для поддержания нужного pH. В таких случаях для нейтрализации кислот по мере их накопления можно добавлять карбонаты в качестве "резервной щелочи". В присутствии ионов водорода карбонат превращается в бикарбонат, а бикарбонат в угольную кислоту, которая спонтанно распадается на С02 и воду. Так как Н^СОд - кислота чрезвычайно слабая и так как образующаяся при ее распаде С02 уходит в атмосферу, добавление в среду карбонатов предотвращает накопление в н^й ионов, а значит и свободных кислот. Такие растворимые карбонаты как &а2^3' сильноосновными, не подходят для культуральных
сред. Наоборот, нерастворимые карбонаты используются для приготовления многих сред.
В некоторых случаях для поддержания относительно постоянного pH в культуральной среде, нельзя использовать ни буферы, ни нерастворимые карбонаты. Особая трудность возникает, например, если в среде в очнь больших количествах образуются кислоты, я добавлять углсклс-пкЯ (нерастворимый карбонат) нельзя, те большие затруднения ветре-
Таблица I
Десять глазных, биоздементоэ, их источники м некоторые из выполняемых кми функций у шкрэорс&низмов
функция в метаболизме
СГоттшаях., 1982)
Элемент ; Источник
|
С Органические соединения, 00^ О 0^, Н^, органические соединения, СО^ Н н2, Н^О, органические соединения Ы N&SЛ/УУо* органические соеди нения S *0*4 * $*% орган;* чес- кие;; соединения серы Р ПРО2" К К* -к| -Ч?Зе Се3+ S*e 3e2+, Эе3* |
Основные компоненты клеточного материала клетки 1 I Компонент цистеина, метионина, тиашнлирофосфата, ко-фермента А, биотина и -липоевой кислоты Компонент нуклеиновых кислот, фосфолипидов януклеотидов Основной неорганический катис i в клетке, кофактор некоторых ферментов Кофактор многих ферментов (например, киназ); присутствует в клеточных стенках, мембранах и эфирах фосфорной кислоты Кофактор ферментов, присутствует в экзоферментах (амилазе, протеазе); Са-дипиколинат является важным компонентом эндоспор Содержится в цитохромах, ферредоксинах и других желе-зосеропротецдах, кофактор ферментов (некоторые дегвдро-таэы |
- 12 -
чаются, когда нужно поддерживать pH в слабощелочных средах, в кото* рых рост бактерий приводит к образованию веществ с основными свойствами* Дело в том, что в области pH от 7,2 до 8,5 фосфатные буферы неэффективны, а других подходящих буферов для этого диапазона pH не существует. Поэтому иногда приходится периодически или непрерывно доводить pH культуры до нужной величины, стерильно добавляя в среду сильную щелочь или кислоту.
Многие органио щ лучше развиваются в нейтральных средах или слабокислых, который можно создать с помощью подходящих буферов*
Нередко в процессе стерилизации питательных сред выпадает осадок. Особенно часто это происходит, если среда содержит относительно высокие концентрации фосфатов (образуются нерастворимые комплексы фосфатов с некоторыми катионами, особенно с кальцием и железом). Обычно это не сказывается на* питательной ценности среды, но осадок может затруднить наблюдение за развитием микроорганизмов или количественную оценку их роста. Образование осадка можно избежать, если отдельно стерилизовать концентрированные растворы солей кальция и железа, а затем добавлять их к уже простерилизованной и охлажденной среде. Эту трудность также можно обойти, добавив в среду небольшое количество вещества, которое образует с этими металлами растворимый комплекс (хелат) и предотвращает тем самым образование ими нерастворимого комплекса с фосфатами. Чаще всего для этого используют этилен-диаминтетрауксусную кислоту (ЭДТА) в концентрации около 0,01$.
Стабильность спелы {Перт С.Дж., 1978)
Главные факторы, влияющие на стабильность среды - это природа его компонентов; способность взаимодействовать их друг с другом; температура, особенно во время стерилизации нагреванием; pH среды, кислород, свет.
Аминокислоты, в частности, триптофан, глутамин и аспарагин являются наиболее лабильными, и по этой причине их нельзя стерилизовать нагреванием, а используют для стерилизации ультрафильтрование. Глутамин полностью разлагается до $ -кетопирролидина при нагревании в водном растворе до Ю0°С и рН=7,0 и выдерживании при таких условиях в течение 3-х часов,даже при 37°С разложение глутамина идет g заметной скоростью. Цистеин в присутствии кислород?, быстро превращается в цистин, растворимость которого значительно ниже (около 0,2$ при 20°С), чем у цистеина. Однако с точки зрения питательной ценности цистеин и цистин взаимозаменяемы.
Из водорастворимых витаминов тиамин, рибофлавин, лиридокснн
-13-
больше всего подвержены распаду. При доступе кислорода и 37°С растворенный в воде тиамин окисляется в течение недели приблизительно на 50% и теряет биологическую активность. Он распадается при автоклавировании в течение 5 мин. при 121°С. Рибофлавин разрушается в процессе автоклавирования при 121°С в течение I ч. при рН=7,0, но при кислых значениях pH он более устойчив. Рибофлавин светочувствителен и под действием комнатного рассеяного света при 32°С может разрушиться аа I ч. на 50$, однако имются данные и о менее интенсивном разложении рибофлавина - на 13% за 157 ч. Чувствительностью к свету обладают также фолиевая кислота и пиридоксин, но они теряют активность в меньшей степени, чем рибофлавин.
Сахара тоже способны До некоторой степени разлагаться при автоклавировании в присутствии неорганических солей и органических сое,-динений, что часто сопровождается окрашиванием в коричневый цвет. Глюкозиды с фуранозидными группами, например сахароза, при кислых значениях pH и при нагреве Гидролизуются, что во многих случаях не оказывает пагубного действия на культуру, однако для поддержания постоянных условий этого следует избегать. Чистые растворы сахаров обычно устойчивы К автоклавированию.
.Из неорганических солей соли аммония следует автоклавировать при pH ниже 7,0., Иначе некоторая часть аммиака улетучивается. В средах определенного химического состава основные потери ионов магния, калия, аммония, натрия и фосфата в форме ионов могут происходить при Осаждении недостаточно хорошо растворимых солей: смешанной фосфорнокислой соли магния и аммония, фосфорнокислой соли магния и калия, фосфорнокислой соли магния и натрия. В течение нескольких первых часов после приготовления раствора осаждение может и не происходить. По этой причине соль магния нужно автоклавировать отдельно от фосфатов» Растворимость сульфата кальция составляет примерно 0,2%, а фосфатная соль слабо растворима. В средах, не содержащих комплексооб -разутащих агентов, фактически все ионы железа способны выпасть в осадок, создавая недостаток железа в среде, если не проводят сильного подкисления раствора. Фильтры Зейтца могут абсорбировать ионы железа и создавать таким образом дефицит по железу. Естественные среды содержат обычно аминокислоты и другие соединения, хелатирующие мик роэлементы. Многие минимальные среды, рекомендованные в литературе, имеют Тот недостаток, что не содержат к о мл л ек со о б р ' зующ их агентов, предотвращающих осаждение железа и других микроэлементов. Для жизни облигатных аэробов необходим кислород. Аэробные микроорганипш хорошо растут на поверхности агара на чашках или в тонком слог жилкой
|
Таблица 2 | ||||||||||||||||||||||||||||||||
|
- 15 -
среды* В неперемешиваемых жедких культурах рост обычно происходит только у поверхности, а в глубине создаются анаэробные условия, и рост таы невозможен* Поэтому для получения больших популяций в жидких культурах среду необходимо аэрировать. С этой целью в лабораториях используют различные устройства для встряхивания, которые аэрируют среду, непрерывно перемешивая ее.
Многие строгие анаэробные микроорганизмы весьма чувствительны К молекулярному кислороду и быртро гибнут при контакте с ним. Поэтому соприкосновение Таких культур с воздухом должно быть сведено к миницуцу или полностью исключено Анаэробные условия создаются путем наслаивания вазелинового или парафинового масла (уменьшается диффузия кислорода из воздух**), введения в среду кусочков печени, фарша и других веществ (окислителей кислорода, находящегося в среде) и регенерацией среды (освобождение питательной среды от кислорода путем прогревания ее в кипящей водяной бане и последующего быстрого охлаждения) перед посевом микробов.
7. Техника изготовления питательных сред
1. Необходимо тщательно промывать посуду водой и обязательно проверять на нейтральность.
2. Следует строго соблюдать порядок внесения ингредиентов и момент внесения в соответствий с инструкциями и прописью. В противном случае могут выпасть осадки.
3. Определение pH питательной среды (колориметрическим способом о помощью компаратора Михаэлиса,либо потенциометрически с помощью потенциометра). Устанавливая pH с£еды, следует делать это осторожным внесением щелочи или кислоты, не допуская перещелачивания или закисления. Внесение кислоты при перещелачивании ухудшает качество среды. Внесение щелочи при избытке кислоты может послужить причиной образования осад >в после стерилизации.
4. Следует иметь В Виду, чг*о при установлении реакции среды подщелачиванием едким натром, pH после кипячения и стерилизации падает на 0,2, а при изготбвлении сред с настЪем печени, вйтамин-В комплексом^! снижается на 0,3-0,4, Поэтому при изготовлении среды устанавливают pH на 0,2-0,4 выше заданного, кипятят, ока не понизится на
О,2-0,2, снова проверяют pH, исправляют в случае необходимости и тогда уже среду подвергают Стерилизации в автоклаве. Учитывая, что i в этом случае pH может измёниться (на 0,1-0,2), обязателшо проверяют рй после стерилизации.
Если глюкоза или другой сахар входит в состав среды, имею^ой pH 7,9-8,1, то Ш избежание гидролиза углевода (сопровождайся резким
- -
от-
закислением среды до pH 6,0-5,0) растворы сахаров стерилизуют дельно и вносят в среду стерильно перед посевом.
5. Осветление питательных сред. Для обеспечения прозрачности питательных сред в некоторых случаях рекомендуется предварительная стерилизация гидролизатов при различных зонах pH с последующей фильтрацией выпадающих осадков. Однако к этому приему лучше прибегать в тех случаях, когда не удается добиться прозрачности сред при изготовлении их из хорошо отстоявшихся Сне подвергшихся стерилизации) гидролизатов, экстрактов и т.д., а также осветления можно добиться с помощью яичного белка или кровяной сыворотки. Для этого на каждые 1-2 л среды, остуженной до 50°С, прибавляют белок одного куриного яйца или 25-30 мл кровяной сыворотки. Яичный белок нужно предварительно хорошо размешать с двойным объемом холодной воды.
Среду хорошо размешивают и кипятят 10-15 мин.(Биргер M.Q.)*
При изготовлении питательного агара необходимо вносить агар-агар при нейтральной реакции. Агар-агар, растворяемый при кислой реакции, после автоклавирования среды не застынет. Агар-агар лучше вносите в момент изготовления среды, а не добавлять его в стерильный бульон и снова подвергать стерилизации* Во избежание ухудшения качества среды следует стремиться К сокращению времени тепловой обработки (варкА, стерилизация).
В агар-агаре могут встречаться ингибиторы роста* Они удаляются при промывке агар-агара (Матвеев М.И.Сред.)1973).
6. Фильтрование питательных сред. Жидкие и полужидкие питательные среды фильтруют через фильтровальную бумагу, предварительно смоченную водой, или фильтровальное полотно, агаровые среды * через ватно-марлевый фильтр. Вата предварительно замачивается в воде и отжимается*
7. Разливка питательных сред в пробирки, флаконы, колбы, матрасы, бутыли.
II. Приготовление полуфабрикатов питательных сред X. Приготовление мясной воды Мясная вода (мясной экстракт) является полуфабрикатом-основой для приготовления1 многих бактериологических сред; мясопептонного бульона, агаров различных концентраций и др. Она содержит белки, углеводы, витамины, минеральные вещества. Для приготовления мясной воды лучше всего использовать говяжье мясо высших сортов от молодых животных (высокие питательныесвойства t прозрачность). Мясная водаиз мпов старых животных плохо фильтруется, имеет серый цвет, дает большой осадок, токсинообраэование на средах из такой воды ниже.
-17-
Приготовление: I. Мясная вода готовится в разных концентрациях. Для этого берут следующие соотношения мясного фарша и воды:
Пропись: мясной фарш 1,0 кг
(мясная вода 1:1)
дистиллиро ванная или холодная водопроводная вода 1,0 л
Пропись: мясной фарш 0,5 кг
(мясная вода 1:2)
дистиллиро ванная или холодная водопроводная вода 1,0 л
Пропись: мясной фарш 0,25 "кг
(мясная вода 1:4)
дистиллированная или холодная водопроводная вода 1,0 л
Во всех случаях на выкипание добавляется 10# воды.
Мясную воду можно готовить двумя способами:
1- й способ: мясной фарш нужно варить сразу же, нагревая его до кипения. За это время фарш уваривается, уменьшается в объеме, особенно это заметно при приготовлении мясной воды 1:1. Фарш до варки размешивается с трудом, после варки свободно. При этом вес мяса уменьшается на 30-40#, главным образом за счет вытеснения воды, ранее связанной с белками. Фарш из красного становится серым. После этого варить еще один час.
Для определения готовности мясной воды нужно профильтровать небольшое ее количество через бумажный фильтр, если жидкость готова, то мясная вода будет прозрачная,
2- Й способ: мясной фарш заливается мясной водой и экстрагируется в течение 18-24 часов при +4°С. Варить как описано выше.
Отстоявщуюся прозрачную часть мясной воды темно-золотого цвета (1:1) или соломенно-желтого (1:2 или 1:4) фильтрует через полотняный или складчатый бумажный фильтр. В этой воде после автоклавирования обычно не выпадает осадок и такую воду можно сразу затаривать с необходимой концентрацией пептона и хлористого натра, что удобно при последующем приготовлении сред.
Готовую мясную воду разливают в стерильные бутыли с ватно * марлевыми пробками на 3/4 емкости.
Стерилизуют при I2I°C (I атмосфера) 30 мин.
В результате стерилизации в мясной воде снижается количество витаминов. Этого можно избежать, сохраняя мясцу» воду нестиридь -
- 18 -
но, добавив в виде консервантов хлороформ или соляную и уксусную кислоты.
Хлороформ добавляют к мясной воде с pH 6,2-6,5 в количестве 1%$ если pH иной, то его доводят соляной кислотой.
Соляная кислота добавляется в количестве 0,7 мл (уд,в.1,19) на 100 ш мясной воды, pH мясной воды после добавления дислоты 1,9# Процент образующейся соли после нейтрализации - 0,5$, и мясолептонный бульон полностью обеспечивается необходимым количеством хлорида натрия Уксусная кислота добавляется в количестве 1,4 мл на 100 цл мясной воды (уд.в. 1,00551, что дает рН*3,71 с содержанием хлористого натра после нейтрализации 2,0&.
Биохимический состав мясной воды
Общий азот 198-360
Остаточный азот мг% 145-330
Аминный азот мг$ 45-98
Сухой остаток % 1,56-3,06-
Полипептиды % 1,55-2,35
2. Приготовление пептона ;Ларгена
Мартеновский пептон - это пептон частичного переваривания. Он получается путем неродного гидролиза белков стенок свийых желудков, ферментами желудочных желез, главнъы образом. Пепсином в присутствии соляной кислоты. Этот гидролиз ведется в условиях, близких к перевариванию белков в желудке организма животных. Он характеризуется наличием сильно кислой реакции: р$Ы2,23 (1,3-2,51. Такая кислотность способствует набуханию белков, благодаря чему облегчается действие протеолитических ферментов и в связи с отим ускоряется процесс гидролитического ршцеплбния белка. Кроме того указанно* кислотность является благоприятной для перевода неактивного пепсиногеня в активный протеолитический фермент - пепсин, оптимальное значение pH для которого 1,5-2,5 при 40°С, Пепсин легко расщепляет мышечные белки, а также альбумины и глобулины.
Продукты гидролиза белка пепсином часто называют пептонами. Пептоны - смесь более или менее сложных полиггепт шов, в состав которых входят Также свободные аминокислоты, в частности триптофан. Гидролиз при помощи ферментов (пепсина) отличается большей мягкостью, чем кислотный, что сохраняет лпбильнах.ф-дкто^-^юсто...
Для л ри г ото яления; йпртеновс кого пептон а берут с вежие 01' грине) свиные желудки с ^скулистыми упругими стенками, без содержимого.
Методические рекомендации подготовили сотрудники лаборатории технологии клеточных культур и питательных сред Всесоюзного ордена Ленина научно-исследовательского института экспериментальной ветеринарии им.Я.Р.Коваленко: зав.лабораторией9 профессор Л. П. Дьяконов, ст.н.сотр.
А. Ф. Конюхов, канд.вет.наук S.H.Василевич, ст.ветврач-байтериолог Е.И.Костина, аспирант О.Ш.Расулев, ст.н.сотр. Всесоюзного научно-исследовательского и технологического института биологической прошшенности Госагропрома СССР (ШШ) канд.биол,наук Л.А.Коротеева.
Методические рекомендации предназначены для использования в работе НИВИ, НИВС и ветеринарно-диагностических лабораторий. Утверждены секцией "Биология* иммунология и биотехнология в ветеринарии" Отдаления ветеринарии ВАСХНИЯ, Протокол # 2 от 14,У,86 г.
* в -
в большим количеством слизи, без катаральных явлений. Желудки, пропитанные желчь», отбрасываются. Отбор желудков лучше Делать утром, когда животных забивают натощак.
|
Общий азот мг% |
450-600 |
|
Аминный азот мГ% |
130*150 |
|
Свободный триптофан мг$ |
65,5 |
|
Пептон % |
0,6-4,0 |
|
Степень расщепления % |
20-25% |
|
Приготовление основного (кислого) |
пептона |
|
Пропись: фарт евиных желудков |
250,0 г |
|
водопроводная вода +45°С |
1,0 л |
|
соляная кислота уд. в Л, 19 |
19,0 ш |
Переваривание можно считать законченным, когда ^арщ станет гомогенным, осадок незначительным, серого цвета и надосадочная жидкость приобретает соломенно-желтый цвет. При этом у нее должны *ыть следующие показатели, характеризующие химический состав пептона:
I, Получение фарша. Желудки складывают слизистой внутрь, тщательно очищают от жира, вытирают сухой чистой тряпкой и проверяют наличие катаральных явлений, металлических предметов,
Дхл получения фарша можно использовать и мороженные желудки, но нм дают сначала оттаять при комнатной температуре и после этого обрабатывают как свежие.
2. После получения фарта приготовление пептона ведут двумя способами:
1- й способ (ручной). Х^Фарщ расфасовывают по бутылям; 2)3алива~ ют подкисленной и подогретой до +45°С водой, тщательно перемешивают щ ставят в термостат при *45°С + 50°С;,3)Перамешивание фарша в течению первых суток производят каждые два часа.
При ручном способе переваривание длится 18-32 часа. Если же пережаривание проводится при +37°С, то оно еще больше удлиняется.
Переваривание ечитатется законченным при наличии гомогенного оерого осадка в небольшом количестве, плохо оседающем при взбалтывании, соломенно-желто го цвета надосадочной жидкости и соответствуй щих химических показателях.
2- й способ (механический), Фарш закладывают в полиэтиленовый баки.'емкостью 40 д, лйлш'шшт подкисленной; и подогретой до +48-50°г .водой, ставят на турбомаги'при +45 С1 * Так как турбина! и меньше и-диамбтру, чем'баки и их нужно 'отцентрировать по ото: лгнию к капо: ?у, 'то : боди'нужно' О'СТааЛЯТЬ' на Подставках нести:;..: ; г г т.:й
СОДЕРЖАНКЕ cfP-
I* I« Назначение и цели применения питательных сред......3
2. Принципы питания микроорганизмов. * ....... 3
3. Разделение микроорганизмов на группы по типам писания * . 4
4. Подбор состава бактериологических питательных сред . . . в
5. Определение потребностей питания В
6. Стабильность среди..... , , , 12
7. Техника изготовления питательных сред........ 15
11« Приготовление полуфабрикатов питательных сред 16
1. Мясная вода...................... 16
2. Пептон Мартена........... IB
3. Мясной перевар по Хоттингеру .............. 20
4. Печеночный экстракт , . ......... . 23
5. Сердечный экстракт................. 24
6. Дрожжевой экстракт.......... . . 24
7. Определение триптофана ........ ..... .... 24
III. Основные и специальные бактериологические питательные среды -
расчеты и методы их приготовления.............26
1. Основные питательные среды ............. • 26
2. Питательные среды для изучения метаболизма микроорганизм
мо в...... 30
3. Питательные среды для культивирования коли-ппратифоэной
группы бактерий ...... ..... , ......... 33
4. Питательные среды для культивирования кампилобактврий . . 37
5. Питательные среды для культивирования бруцелл......39
6. Питательные среды для культивирования микобактерий . ... 41
7. Питательные среды для культивирования микоплазм ..... 46
8. Питательные среды для культивирования грибов ...... 49
9. Питательные среды для культивирования простейших .... 10
10. Питательные среды для культивирования анаэробов .... 53
11. Питательная среда для культивирования коринебяктерий . . 53
12. Питательная среда для культивирования гемофильных бактерий . ....... . . . . . о4
IV. Биологический контроль питательных сред ..........
У, Определение показателей эффективности ..... ...... 54
У1. Растворы и питательные среды для культивирования клеток и гг вирусов ....... .............. ..... .00
Введение ........ ...... 56
Таблица пересчета проводимость-сопротивление ...... 57
1, Солевые растворы . ......... 58
2, Питательные среды ....... ............ ЬО
УЛ .Способы стерилизации питательных сред* растворов Ьб
/спольз этонная литература....... 68
- 3 -
Назначение и цеди применения питательных сред
Виноградова И.Н. (1973) предлагает следующую классификацию питательных сред, применяемых для бактериологической диагностики;
1. Среды для культивирования: универсальные простые и с лож-ные специальные; для токсинообразования.
2. Среды для выделения и накопления: консервирующие, обогащения и элективные.
3. Среды для идентификации: дифференциальные и элективно-дифференциальные.
Байрак В.А, с соавторами (1j80) по назначению выделяют среды обычные, или простые, для выращивания большинства микроорганизмов; специальные - для культивирования микробов, не растущих или плохо растущих на обычных питательных средах; диф{еренциально-диагностические - употребляемые для определения родовых или видовых особенностей исследуемых бактериальных культур (гемолитических, сахаро-литичес^их, протеолитических, редуцирующих И других свойств); селективные - для вьщеления микробов одного рода или вида из материала, содержащего смесь разных видов микроорганизмов, па которых одни виды хорошо растут, а Другие не растут; среды обогащения (на-копитательные).
Питательные среды применяют для выращивания микробов, выделения их в чистой культуре, изучения ряда свойств микробов и длительного сохранения с вежевьщеленных и производственных культур (Биргер М.О./ред,/, 1982).
Принципы питатния микроорганизмов
Бактерии, как и другие организмы, нуждаются для своего роста в определенных питательных веществах. В состав таких питательных веществ должны входить все те химические элементы, которые необходимы для построения клеточногоsматериала, для активности ферментов и для работы транспортных систем. Кроме того, питательные вещества должны поставлять организму материал, используемый для генерирования биологически полезной энергии (Готтшалк Г.,1982).
Питанием называют использование питательных веществ, необходимых для роста, организма (Джавец Э, с соавтор.,1982).
Доноры водорода (Н+). Все способны^ к химическому синтезу организмы нуждаются в источнике энергии, в доноре Н* (т.е.веществе, способном к окислению). Громе того, фотосинтезирующие организмы нуждаются в донорах П* для осуществления фотосинтеза.
Акцепторы водорода.Акц пторы Н* необходимы для окислительно™ восстановительных реакций, проходящих с образованием энепгии. Дг
- 4 -
аэробов требуется газообразный кислород (0г>). Анаэробы нуждаются в других неорганических веществах (сульфатах, нитритах, карбонатах) или органических соединениях. В последнем случае это любой источник углерода либо образовавшийся после него в процессе катаболизма фрагмент. Однако в отдельных случаях требуется уникальный акцептор водорода, который должен присутствовать в питательной среде. (Джавец Э. с соавт. ,1982).
Разделение микроорганизмов на группы по типам питания
Наиболее полезна, хотя и относительно проста, классификация, основанная на 2-х параметрах - природе источника энергии и природе основного источника углерода. По источнику энергии все организмы делятся на два типа: фотосинтезирующие организмы, способные использовать энергию света и называемые фототрофами, и организмы, нуждающиеся в химических источниках энергии - хемотрофы. Организмы, способные использовать в качестве главного источника энергии углерод СО2* называются автотрофами, а те которым нужны органические источники углерода - гетеротрофами. На основе этих критериев можно разделить все организмы по типу питания на четыре главных категории:
1. Фотоавтотрофы **• используют свет как источник энергии и СО^ в качестве основного источника углерода. Эта категория включает большинство фотосинтезирующих организмов: высшие растения, водоросли и многие фотосинтезирующие бактерии.
2. Фотогетеротрофы - используют свет в качестве источника энергии и какое-нибудь органическое вещество как основной источник углерода. Сюда относятся некоторые пурпурные и зеленые бактерии.
3. Хемоавтотрофы - используют химический источник энергии и
СО^ в качестве основного источника углерода. Они получают энергию в результате окисления таких восстановленных неорганических веществ, как HgjVOjJ, Н£, восстановленные формы серы »£^з/
или закисное железо. В эту групг^г входят только представители бактерий.
4. Хемогетеротрофы - используют химический источник энергии и органическое вешество в качестве основного источника углерода. Здесь и углерод и энергия обычно могут быть результатом метаболизма одного и того же органического соединения. К хемо^етеротрофам относятся все многоклеточные животные, простейшие, грибы и подавляющее большинство бактерий. Внутри этой очень сложной группы возможны дальнейшие подразделения. Одно из них основано на том, в каком химическом состоянии органический материал поступает внутрь клетки. Псмотрофы (бактерии и грибы) получают питательные вещества в рас-
творенном виде, а фаготрофы (простейшие) могут поглощать твердые частицы пищи путем фагоцитоза.
Главные и минорные биоэлементы. Только небольшое число элементов периодической системы требуется организмам в относительно высоких концентрациях (1СГ%). Это десять главных биологических элементов, которые наряду с некоторыми из выполняемых ими функций приведены в табл Л. Углерод, кислород, водород и азот - основные компоненты органических соединений, содержащихся в тканях различных организмов, которые могут использоваться бактериями а форме органических и неорганических соединений. Метаболизм соединений, содержащих углерод, водород, кислород имеет важное значение не только потому, что эти элементы являются основными компонентами клетки, но и потому3 что эти соединения служат важными субстратами для получения микроорганизмами энергии. Снабжение водородом и кислородом осуществляется за счет поступающей в клетку воды. Источники углерода многочисленны И разнообразны. На первом месте стоят сахара, многоатомные спирты И кислоты. Углерод является составной частью всех органических соединений, в том числе белков, пептонов, аминокислот. Большинство организмов, которые зависят от органических источников углерода (а, возможно, ш все они), нуждаются в очень небольших количествах COg* так как это соединение необходимо для биосинтетических реакций.
Азот требуется в больших количествах, поскольку его содержание
у бактерий составляет примерно 10% (в расчете на сухую биомассу).
Различными микроорганизмами шгут быть использованы очень многие,
если не все источники азота, включая неорганические и органические
его формы ШЩ а/ гг а/ и л/ *
' u2, п g, /гНд, /VHg). Метаболизм источника азота
обеспечивает главным образом синтез белков, нуклеиновых кислот и полимеров клеточной стенки. В клеточном белке аминокислоты составляют 1-0% от всего белка, на основании чего мЬжно приблизительно оценить количество аминокислот, необходимых ь качестве факторов роста. Исключение составляет глутаминовая кислота или глутамин, ко-торые количественно играют большую роль в аминокислотном метаболизме и содержание которых в среде должно значительно превышать содержание остальных аминокислот (Перт С.Дж.,1978), Некоторые бактерии, нуждающиеся в нескольких аминокислотах, растут луле при внесении в среду одной или более аминокислот в форме пептидов. Часто аминокислоты действуют как ингибиторы роста. Антагонизм между аминокислотами при их потреблении наблюдали в следующих группах'
- 6 -
I) фенилаланин, тирозин, триптофан; 2) серин, треонин, аланин, глицин; 3) глутаминовая кислота, аспарагиновая кислота; 4) валин, лейцин, изолейцин; 5) норлейцин, метионин. Этот антагонизм связан с конкуренцией за общую пермеазу. Для некоторых организмов ферментативный гидролизат казеина становился ингибитором роста лри концентрации выше 100 мкг/мл (Перт С.Дж., 1978).
Все питательные среды имеют в своей основе вещества, содержащие азот. В качестве азотистого субстрата для изготовления питательных сред служат в основном белки животного происхождения - мясо (преимущественно говяжье), рыба, мясо-костная цука, казеин. С таким же успехом применяют для этой цели заменители полноценного мяса - плаценту, кровяные сгустки, а также дрожжи; можно использовать и белки растительного происхолщения (соевые бобы* горох, ячмень и т.д.) (Биргер М.О./ред./, 1982).
Сера вносится в среду в форме одного из неорганических веществ, в частности, сульфата или в виде цистеин- или метионина. При аэробных условиях цистеин почти нацело превращается э цистин (Перт С.Дж., 1982).
Фосфор обычно вносят в среду в виде неорганических фосфатов. Кроме того, можно использовать органические фосфаты, такие, как глицерофосфат и фосфолипиды (Перт С.Дж,, 1982).
Остальные четыре главных биоэлемента - ото ионы металлов (K,Afg, Са, Уе), исиользуемые в качестве кофакторов ферментов, а также компонентов металлокомплексов.
При образовании биомассы микроорганизмов потребности в калии соответствует выходу биомассы и приблизительно составляет 60 г сухой биомассы на I г калия. Большая часть калия, вероятно, связана с РНК, так что потребность в калии увеличивается под влиянием тех факторов, которые, подобно скорости роста, ведут к увеличению содержания РНК в биомассе. Потребность в калии может менятся обратно изменению pH. Только один щелочной металл способен заменить собой калий - это рубидий, хотя такая замена снижает максимальную скорость роста. Действие ионов калия может тормозиться ионами аммония (Перт С.Дж., 1982).
Магний является кофактором многих ферментов (например, киназ); присутствует в клеточных стенках, мембранах и эфирах фосфорит кислоты. Экономический коэффициент в расчете на ионы потребленного магния варьирует от 300 до 900 г сухой биомассы в расчете на I г
- 7 -
магния и обратно пропорционален количеству РНК в биомассе (Пирт С.Дж. f 1982).
Экзоферменты, такие, как амилазы, протеазы, представляют собой кальций содержащие бедки, а дипиколинат кальция служит важным компонентом эндоспор. Ионы двух- и трехвалентного железа входят в состав компонентов электропереносящей цепи, таких, как цитохрош и железо-серопротеиды. Калий, магний, кальций и железо требуются в относительно больших количествах, и поэтому их соли всегда Должны включаться в состав культуральных сред.
Помимо десяти главных биоэлементов, микроорганизмам требуется ряд других элементов, но в малых количествах (табл.2). Ионы цинка и марганца необходимы всем микроорганизмам. Цинк имеет особенно важное значение, поскольку РНК- и ДНК-полимеразы относятся к цинкпротеидам. У большинства шкрорганизмов потребность в ионах натрия и хлора невелика. Большинство патогенных бактерий развивается в средах, содержащих 0,5% хлорида натры (Пяткин К.Д, .Кривошеин Ю.С., 1981). Биологическое значение хлорида натрия состоит в том, что он создает условия изотонии, необходимые для нормального течения всех жизненных процессов в микробной Клетке (Синюшина Д.Н., Самсонова М.Н., 1981).
Микроорганизмам с особым типом метаболической активности необходимы 2-а.Жл, //а,СЛ( , &CiCof(XitWthfi . Молибденпротеиды играют важную роль в азотном обмене и в окислении формиата. Селенит или се-Ленид нужен для образования формиатдегидрогеназы клеток £ йсЯсоасЙ-ю, с oti при анаэробном росте, однако Недостаток селена не оказывает влияния на рост указанной бактерии. Кобальт требуется всем микроорганизмам, у которых протекают реакции^ зависимые от витамина 6^*
Медь присутствует в ряде ферментов, поносящих электроны от субстратов к кислороду. В очень редких случаях микроорганизмам требуются вольфрам и никель.
Факторы роста. Однако, многие бактерии ^ишены способности синтезировать все органические соединения, необходимые для рост*!, и зависят от наличия в среде определенных факторов роста. Все эти факторы можно объединить в три группы (Готтшлак Г.,1982):
1) Витамины и родственные соединения, требующиеся в малых количествах;
2) Аминокислоты;
3) Цурины и пкримидины.
Общим Свойством всех микроорганизмов является потребность в витаминах и родственных соединениях. Чаще наблюдается потребность в таких витаминах, как биотин, пар'мамино бензойная кислота, тиамин, i -котиновая кислота и витамин Bj£. Потребность в факторах роста точно
~ 8 -
установлена не для всех микроорганизмов. Поэтому микробиологи часто добавляют в среду дрожжевой экстракт и пептон в качестве полноценных и дешевых источников таких факторов (Готтшалк Г., 1982),
4. Подбор состава бактериологических питательных спел
Главная цель при при подборе среды для выращивания любого микроорганизма состоит в том, чтобы создать сбалансированную смесь необходимых питательных веществ в таких концентрациях, при которых рост будет наилучшим. На первый взгляд может показаться* что нужно сделать среду как можно более богатой, добавив в нее все вещества в большом избытке. Однако, во-первых, в повышенных количествах многие питательные вещества начинают подавлять роет или оказываются токсичными. При высоких концентрациях подобный эффект дают такие органические субстраты, как соли жирных кислот (например, уксусной кислоты) и даже сахара. Подавлять рост могут и некоторые неорганические компоненты, если они окажутся в избытке. Во-вторых, даже если микроорганизм и может расти в среде с высоким содержанием питательных веществ, то в результа те метаболической активности растущей популяции среда в конце концов настолько изменится, что условия будут весьма неблагоприятными и популяция станет физиологически аномальной или просто погибнет. Этб может быть обусловлено сильным изменением pH, накоплением токсичных органических метаболитов, а в случае строгих аэробов - исчерпанием запасов кислорода. Таким образом, разумно ограничить общий рост культуры, вводя одно из питательных веществ в лимитирующем количестве.
При приготовлении питательных сред целесообразно составить сначала их минеральную основу, содержащую все. те питательные вещества, которые можно дать любому организму в неорганической форме. Затем в эту основную среду можно ввести добавки - источник углерода, источник энергии, источник азота и необходимые ростовые факторы. Состав этих добавок, естественно, зависит от потребностей выращиваемого организма.
Среда, в которую входят только определенные химические соединения, называется синтетической.
5. Определение потребностей питания
Основные этапы определения потребностей гетеротрофных бактерий в питательных веществах заключаются в следующем.
1. Бактерии следует выращивать на такой среде.(комплексной или синтетической), о которой известно, что она поддерживает^ост.
2. Если начинают выращивать бактерии нз комплексной среде, то варьируют концентрации всех компонентов (от нуля до самой большой