Методические указания по диагностике, профилактике и лечению отравлений сельскохозяйственных животных нитратами и нитритами
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
1. Условия накопления нитратов и нитритов в кормах и пути поступления их в организм сельскохозяйственных животных
2 Токсическое действие
3 Диагностика отравлений
4 Лечение сельскохозяйственных животных при нитратно-нитритном отравлении
5. Профилактика отравлений
Приложение 1. Временные предельно допустимые остаточные количества нитратов и нитритов в комбикормах для сельскохозяйственных животных (мг/кг)
Приложение 2. Клиническая картина отравления животных
Приложение 3. Определение нитритов
Приложение 4. Методика определения нитритов в комбикормах
Приложение 5. Методика определения нитратов в кормах, крови и патологическом материале, овощах и бахчевых культурах
Приложение 6. Колориметрический метод определения метгемоглобина в крови
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 25.08.1977 | Утвержден | Главное управление ветеринарии Минсельхоза СССР | |
|---|---|---|---|
| Разработан | Всесоюзный ордена Ленина институт экспериментальной ветеринарии | ||
| Разработан | Львовский зоотехническо-ветеринарный институт | ||
| Издан | Министерство сельского хозяйства СССР | 1979 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА СССР
ГЛАВНОЕ УПРАВЛЕНИЕ ВЕТЕРИНАРИИ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по диагностике, профилактике и лечению отравлений сельскохозяйственных животных нитратами и нитритами
МОСКВА «КОЛОС» 1979
Методические указания разработаны научными сотрудниками Всесоюзного ордена Ленина института экспериментальной ветеринарии (доктор ветеринарных наук Д. Д. Полоз, кандидат технических наук В. Н. Полякова) и Львовского зоотехническо-ветеринарного института (доктор биологических наук 3. П. Скородинский, кандидат ветеринарных наук 3. Г. Олейник) и доработаны с учетом поступивших замечаний и предложений.
Утверждены Главным управлением ветеринарии Министерства сельского хозяйства СССР 25 августа 1977 г.
© Министерство сельского хозяйства СССР, 1979
ПАТОЛОГОАНАТОМИЧЕСКИЕ ИЗМЕНЕНИЯ
Характерное паталогоанатомическое изменение у всех видов животных (в том числе птиц) при отравлении нитритами — темно-коричневый с шоколадным оттенком цвет крови (метгемоглобине-мия). На слизистой трахеи часто выявляют разной величины кровоизлияния. Места с кровоизлияниями темнб-коричневого, а без них — серо-стального цвета. В просвете трахеи часто отмечают скопление пенистой жидкости, иногда с примесью крови. Легкие неспавшиеся, переполнены кровью, с очагами эмфиземы.
Сердце увеличено, переполнено плохо свернувшейся кровью, с точечными кровоизлияниями. Мочевой пузырь обычно пуст или содержит незначительное количество мочи.
Слизистые оболочки преджелудков гиперемированы, иногда с кровоизлияниями и очагами некроза. В стенке рубца иногда отмечают обширные инфильтраты. Кишечник в состоянии катарального или даже геморрагического воспаления.
Мышцы светло-красной или розовой окраски, на их разрезе отчетливо выступает вытекающая из сосз'дов темно-коричневая кровь.
При сверхостром течении нитратно нитритного отравления патологоанатомические изменения выражены недостаточно, а на первый план выступает шоколадный цвет крови. При отравлении нитратами, без их восстановления в нитриты, шоколадный цвет крови отсутствует.
При гистологических исследованиях выявляют скопление форменных элементов крови в паренхиматозных органах, расширение сосудов в селезенке и легких, скопление макрофагов с большим содержанием гемосидерина, дистрофические изменения в сердечной мышце, печени и эпителии почечных канальцев. В почках также обнаруживают очаги некроза эпителия проксимальных канальцев, отечность и скопление лимфоидных клеток вокруг поврежденных канальцев.
Приложение 3
ОПРЕДЕЛЕНИЕ НИТРИТОВ1
Метод основан на извлечении нитритов из проб дистиллированной водой и взаимодействии их с альфа-нафтиламином и сульфани-ловой кислотой в кислой среде с образованием азосоединения розово-красного цвета.
Реакция специфична для нитритов. Чувствительность определения 0,01 мг NaNC>2 в 1 л раствора.
1. Реактивы и растворы
Сульфаниловая кислота, ч.д.а., ГОСТ 5821 — 69 Альфа-нафтиламин, ч.д.а., ГОСТ 8827 — 57
Уксусная кислота, концентрированная (ледяная), х.ч., ГОСТ 61-69 Натрий азотистокислый NaN02, х.ч. ГОСТ 4197-66.
Приготовление реактива Грисса: а) 0,5 г сульфани-ловой кислоты растворяют в 150 мл 12%-ного раствора уксусной кислоты; б) 0,1 г альфа-нафтиламина растворяют (при нагревании) в 20 мл дистиллированной воды, фильтруют и смешивают со 150 мл 12 % -ного раствора уксусной кислоты. Перед употреблением одну часть раствора «а» смешивают с равной по объему частью раствора «б». Растворы «а» и «б» хранят отдельно.
Приготовление стандартного раствора нитрита натрия: 0,15 г высушенного при температуре 70 — 80°С NaN02 растворяют в 1 л дистиллированной воды, свободной от нитритов. Раствор хранят в холодном месте, он устойчив в течение месяца: 1 мл этого раствора содержит 0,100 мг NO"£.
Приготовление рабочего раствора нитрита натрия: 25 мл полученного стандартного раствора переносят в мерную колбу на 500 мл и доводят объем до метки дистиллированной водой. Раствор должен быть свежеприготовленным. 1 мл этого раствора содержит 0,0050 мг NO^f. Этот раствор используют для построения шкалы стандартов или калибровочной кривой.
2. Приборы и посуда
Химические пробирки Пипетки на 1 и 10 мл Мерные колбы на 1000 и 500 мл Конические колбы
Химические стаканы Мешочки или пленка для диализа Цилиндры на 10, 50 и 100 мл Фотоэлектроколориметр
3. Ход определения
Для исследования берут 10 г измельченного растительного или животного материала.
Пробы растительного происхождения, образующие при извлечении нитритов неокрашенные растворы, переносят в конические колбы и заливают дистиллированной водой (50 мл). Нитриты извлекают в течение часа, часто встряхивая содержимое колбы. Затем раствор фильтруют, пробу еще раз смывают 30 мл дистиллированной воды, объединяют эту часть раствора с первой, пропуская через тот же фильтр. Доводят объем фильтрата до 100 мл и берут 10 мл для анализа на нитриты.
Извлечение нитритов из проб патологического материала и кормов растительного происхождения, дающих при извлечении окрашенные растворы, проводят методом диализа. Для этого измельченные пробы кормов, органов и тканей или пробы крови помещают в мешочки или пленку для диализа и погружают в сосуд с 50 мл дистиллированной воды на 2 часа. Затем диализат фильтруют в калиброванный сосуд, а мешочек с пробой еще раз погружают в 20 мл дистиллированной воды на полчаса в тот же сосуд. Этот диализат, фильтруя, объединяют с первым, доводят объем фильтрата до 100 мл. 10 мл фильтрата отбирают в пробирку для анализа на нитриты.
В пробирку с 10 мл анализируемого фильтрата добавляют 0,5 мл реактива Грисса и через 15 мин либо визуально сравнивают окраску анализируемого раствора со стандартной шкалой, приготовленной по таблице (см. ниже), либо определяют оптическую плотность анализируемого раствора на фотоэлектроколориметре при зеленом светофильтре №5 (длина волны 536 ммк), в кюветах 10 мм, раствор для сравнения — дистиллированная вода.
4. Построение калибровочной кривой
Для приготовления шкалы стандартов в 10 химических пробирок наливают рабочий раствор в количествах, указанных в таблице.
Затем в пробирки доливают воду до объема 10 мл, в каждую пробирку наливают по 0,5 мл реактива Грисса. Через 15 мин сравнивают с этой шкалой стандартов окраску раствора опытной пробирки.
15
|
Таблица для приготовления шкалы стандартов | ||||||||||||||||||||||||||||||||||||
|
Для построения калибровочной кривой также через 15 мин после развития цвета определяют оптическую плотность раствора в первых семи пробирках на фотоэлектроколориметре, как указано выше. Затем на оси абсцисс откладывают количество NOJ2 в мг, а на оси ординат — найденные значения оптической плотности растворов и проводят кривую через точки пересечения.
Оптическую плотность окрашенного раствора в опытной пробирке определяют только при наличии прозрачного и бесцветного фильтрата. В противном случае возможно только визуальное определение (сравнение опытной пробирки со стандартной шкалой).
Расчет проводят по формуле:
v Ух-В.1000
х—w—
где: А' — содержание нитритов (нитрит-ионов), мг/кг;
В — содержание нитрит-ионов, найденное путем визуального сравнения со шкалой стандартов или по калибровочной кривой, мг;
А — навеска анализируемого образца, г;
У1 — общий объем фильтрата, мл;
У2 — объем фильтрата, взятый для анализа, мл.
При необходимости пересчета в нитрит натрия найденное количество нитрит-ионов умножают на пересчетный коэффициент 1,5; при этом получается количество нитрита натрия (мг/кг)
Приложение 4
МЕТОДИКА
ОПРЕДЕЛЕНИЯ НИТРИТОВ В КОМБИКОРМАХ
(Утверждена Главным управлением ветеринарии Министерства сельского хозяйства СССР 10 декабря 1976 г.)
1. Принцип метода
Метод заключается в извлечении нитритов из корма дистиллированной водой, осаждении белков при одновременном обесцвечивании экстракта и проведении колориметрической реакции, основанной на взаимодействии диазотнрованных нитритов с альфа-нафтиламином.
Чувствительность метода —10 мкг нитрита натрия в 100 мл колориметрируемого раствора, что равно 2 мг/кг, точность определения 87%.
2. Реактивы и растворы
1UCI «82/ — Ь8 ГОСТ 4232 — 65 ГОСТ 5821 —69 ГОСТ 61-69 ГОСТ 4206 — 66 ГОСТ 10163 — 62 ГОСТ 4197 — 66 МРТУ 6-09-1678 — 64 ТУ 6-09-2540 — 72 ГОСТ 199 — 68 МРТУ 6-09-1678 — 64 ГОСТ 4174 — 69 и серноватистокислого
Альфа-нафтиламин (1-нафтиламнн), х. п. Калий йодистый, х.ч. или ч.д.а.
Кислота сульфаниловая безводная, х.ч. Кислота уксусная ледяная, х.ч.
Кислота серная концентрированная, х.ч. Крахмал растворимый, ч.д.а Натрий азотистокислый, х.ч.
Натр едкий, фнксанал
Натрий серноватистокислый, фиксанал
Натрий уксуснокислый, ч.д.а.
Калий марганцевокислый, фиксанал Цинк сернокислый, ч.д.а.
0,1 н. раствор марганцевокислого калия
натрия.
Растворы готовят из фиксаналов, согласно правилам приготовления титрованных растворов, то есть содержащееся в ампуле вещество (1/10 грамм-эквивалента) количественно переносят в мерную колбу емкостью 1000 мл, растворяют в дистиллированной воде и доводят объем раствора до метки.
1 н. раствор едкого натра. 2
Раствор готовят из фиксанала, согласно правилам приготовления титрованных растворов, доводя объем раствора до 100 мл.
1%-ный раствор крахмала.
1 г крахмала растворяют в 100 мл холодной дистиллированной воды, нагревают до кипения и фильтруют через бумажный фильто. Раствор пригоден к употреблению в течение года.
0,05М раствор азотистокислого натрия.
Раствор готовят из перекристаллизоваиного и высушенного при 105°С до постоянного веса реактива, предназначенного для при-готовления стандартного раствора. 1,725 г азотистокислого натрия количественно переносят в мерную колбу емкостью 500 мл, растворяют дистиллированной водой, доводят объем раствора в колбе до метки.
4,5%-ный раствор сернокислого цинка.
4,5 г сернокислого цинка растворяют в дистиллированной воде, доводят объем раствора до 100 мл.
12%-ный раствор уксусной кислоты.
12 мл ледяной уксусной кислоты смешивают с 75 мл дистиллированной воды и доводят объем раствора до 100 мл.
Раствор сульфаниловой кислоты.
0,5 г сульфаниловой кислоты растворяют в 150 мл 12%-ного раствора уксусной кислоты.
Раствор альфа-нафтиламина.
0,2 г альфа-нафтиламина кипятят с 20 мл воды, фильтруют, и к фильтрату добавляют 180 мл 12%-ного раствора уксусной кислоты. Раствор хранят в темной, плотно закрытой склянке. Нельзя смешивать свежеприготовленный раствор альфа-нафтиламина с раствором, хранившимся длительное время. Раствор альфа-нафтиламина должен быть бесцветным.
Серная кислота, разведенная 1 : 5.
10 мл концентрированной серной кислоты смешивают в колбе из термостойкого стекла с 50 мл дистиллированной воды.
Стандартный раствор азотистокислого натрия (нитрита натрия).
Готовят непосредственно перед построением калибровочной кривой (поскольку он нестойкий) из предварительно перекристаллизо-ванного и высушенного при 105°С до постоянного веса реактива. В реактиве, даже перекристаллизованном, содержание азотистокислого натрия не составляет 100%. Поэтому до приготовления стандартного раствора определяют фактическое содержание азотистокислого натрия в сухом реактиве. С этой целью в коническую колбу с притертой пробкой емкостью 250 — 300 мл вносят 50 мл 0,1 н. раствора марганцевокислого калия, 5 мл разведенной 1 :5 серной кислоты и 100 мл дистиллированной воды. Затем, медленно
18
перемешивая содержимое, в колбу вносят по каплям 10 мл 0,05М раствора азотистокислого натрия. Колбу закрывают пробкой и встряхивают 5 мин. После этого в колбу вносят 2 г йодистого калия, перемешивают и титруют содержимое колбы 0,1 н. раствором серио-Батистокислого натрия. В конце титрования (при значительном просветлении раствора) прибавляют 1—2 мл 1%-ного раствора крахмала. Конец титрования определяют по исчезновению синей окраски титруемого раствора. Одновременно ставят контрольную пробу, в которую вместо 10.мл 0.05М раствора азотистокислого натрия добавляют 10 мл дистиллированной воды.
1 мл серноватистокислого натрия соответствует 0,00345 г азотистокислого натрия.
Расчет ведут по формуле:
(М — М1)-0,00345-У-100
где: М — количество раствора серноватистокислого натрия, пошедшее на титрование контрольной пробы, мл;
М{ — количество серноватистокислого натрия, пошедшее на титрование испытуемой пробы, мл; а — навеска азотистокислого натрия, взятая для приготовления 0,05М раствора (для 500 мл равна 1,725 г);
У— объем 0,05М раствора азотистокислого натрия, в котором растворена навеска «а»;
У1 — объем 0,05М раствора азотистокислого натрия, взятого для исследования (10 мл).
Для приготовления стандартного раствора берут такое количество реактива, которое содержит 1 г чистого вещества азотистокислого натрия. Например, при содержании чистого вещества в реактиве 98% навеска составит 1,0204 г
Навеску переносят количественно в мерную колбу емкостью 1000 мл и дистиллированной водой доводят объем до метки (раствор 1). 100 мл раствора 1 переносят в чистую мерную колбу емкостью 1000 мл и объем доводят дистиллированной водой до метки (раствор 2). Из полученного раствора 2 переносят 100 мл в мерную колбу емкостью 1000 мл и объем раствора в колбе доводят дистиллированной водой до метки (раствор 3); 1 мл раствора 3 содержит 10 мкг азотистокислого натрия (нитрита натрия).
19
3. Приборы и посуда
Фотоэлектроколориметр (ФЭК М-1, ФЭК-56, ФЭК-57) 1 щт.
Шуттель-аппарат 1 шт.
Центрифуга лабораторная 1 шт.
Колбы мерные емкостью 1000 мл 4 шт.
Колбы мерные емкостью 200 мл 10 шт.
Колбы мерные емкостью 100 мл (с притертой пробкой) 10 шт.
Колбы конические емкостью 500 мл 10 шт.
Колбы конические емкостью 250 — 300 мл
(с притертой пробкой) 11 шт.
Воронки химические о 10 см 10 шт.
Воронки химические о 5 см 15 шт.
Стаканы химические на 250 мл 5 шт.
Бюксы стеклянные 5 шт.
Пипетки измерительные емкостью 1 мл 10 шт
Пипетки измерительные емкостью 5 мл 10 шт.
Пипетки измерительные емкостью 10 мл 10 шт.
Бюретки измерительные емкостью 25 мл 2 шт.
Бюретки измерительные емкостью 50 мл 2 шт.
Чашки выпарительные о 10 см 5 шт.
Фильтры бумажные беззольные 0 15 см 1000 шт.
4. Построение калибровочной кривой
В шесть мерных колб емкостью 100 мл вносят 1,0; 2,0; 4,0; 6,0; 8,0; 10,0 мл стандартного раствора азотистокислого натрия (раствор 3). В седьмую колбу, контрольную, вносят 50 мл дистиллированной воды. Объем жидкости в колбах доводят до 50 мл, прибавляя в первую колбу 49,0 мл дистиллированной воды, во вторую 48,0 мл и т. д. Содержимое колб охлаждают, помещая их на 20 мин в морозильную камеру холодильника. Затем во все колбы с интервалом 2 мин вносят по 5 мл сульфаниловой кислоты и колбы вновь помещают в морозильную камеру холодильника на 20 мин. После этого в них вносят по 5 мл раствора альфа-нафтиламина и по 5 мл 2М раствора (ацетата) уксуснокислого натрия. Содержимое каждой колбы перемешивают, выдерживают 1—2 мин (до получения розовой окраски), доводят объем дистиллированной водой до метки. Через 12 мин после внесения в колбу уксуснокислого натрия растворы колориметрируют.
Параллельно с внесением реактивов в испытуемые колбы вносят реактивы в контрольную колбу (7).
Полученные розовые растворы имеют максимум светопоглоще-ния при длине волны проходящего света, равной 520 нм. Поэтому
20
при фотометрировании используют зеленый светофильтр, употребляя кювету с расстоянием между рабочими гранями 2 см.
Измерения проводят с помощью фотоэлектроколориметра. Результаты измерений в виде точек откладывают на графике, где по вертикали указаны показатели экстинцин, а по горизонтали — количества NaNC>2 (мкг) в 100 мл кол ор и метр и р уем ого раствора.
Калибровочную кривую строят по результатам измерений не менее трех, лучше пяти серий стандартных растворов NaN02.
Срок действия калибровочной кривей 6 месяцев. Он зависш от технического состояния ФЭК, «старения» фотоэлементов. После очередного ремонта ФЭК или замены фотоэлементов необходимо построить новую калибровочную кривую.
5. Подготовка образца
Получение вытяжки. 20 г хорошо измельченного корма вносят в колбу на 500 мл, заливают 150 мл дистиллированной воды. Колбу встряхивают до образования однородной массы. Пробу выдерживают при температуре 18 — 20°С один час, периодически перемешивая ее содержимое. Затем пробу фильтруют через хорошо промытый горячей дистиллированной водой беззольный фильтр. При этом стараются не переносить взвешенные частицы корма на фильтр (фильтрование можно заменить центрифугированием). Остаток кор ма в колбе дважды промывают 25—30 мл дистиллированной воды. Все три порции фильтрата собирают в мерную колбу на 200 мл. Объем жидкости в колбе доводят до метки (фильтрат 1).
Осаждение белков. 50 мл фильтрата 1 вносят в мерную колбу емкостью 100 мл, добавляют 1 мл 1 н. раствора едкого натра и 4 мл 4,5%-ного раствора сернокислого цинка. Смесь в колбе нагревают 10 мин на кипящей водяной бане, после чего охлаждают и содержимое колбы доводят дистиллированной водой до метки. Раствор перемешивают и фильтруют через беззольный фильтр (фильтрат 2).
6. Ход определения
50 мл фильтрата 2, соответствующего 2,5 г корма, вносят в мерную колбу на 100 мл. pH его должен быть около 7,0. Фильтрат охлаждают, помещая колбу на 20 мин в морозильную камеру холодильника. Затем в колбу вносят 5 мл раствора сульфаниловой кислоты и вновь помещают ее на 20 мин в морозильную камеру холодильника, после чего добавляют 5 мл раствора альфа-нафтнл-амина и 5 мл 2М раствора уксуснокислого натрия. После каждого добавления реактивов содержимое колбы перемешивают. При наличии в корме нитритов содержимое колбы окрашивается в розовый
21
цвет3. Колбу выдерживают 1 — 2 мин и объем доводят дистиллированной водой до метки. Измеряют оптическую плотность раствора на ФЭК при зеленом светофильтре и кювете с расстоянием между рабочими гранями равным 2,0 см. По калибровочной кривой находяг количество NaN02 (мкг), которое содержится в 100 мл колориметри-руемого раствора.
£■1000
а31000
Е_
а
мг/кг(
Расчет ведут по формуле:
где: £ — количество NaN02, найденное по калибровочной кривой, соответствующее экстинции испытуемого раствора, мкг; а — навеска корма (г), соответствующая объему фильтрата 2, взятого для исследования;
1000— (в числителе) перевод мкг в мг;
1000— (в знаменателе) перевод г в кг.
Интенсификация сельскохозяйственного производства пепосрсд-ственно связана с внесением в почву повышенных количеств азотных удобрений (селитры — калийная, натриевая, аммиачная). Использование больших количеств азотных удобрений способствует накоплению солей азотной кислоты (нитратов) в почве, воде и кормах. Нитраты превращаются в соли азотистой кислоты (нитриты) и поступают в организм сельскохозяйственных животных, создавая возможность возникновения острой или хронической интоксикации.
I. УСЛОВИЯ НАКОПЛЕНИЯ НИТРАТОВ
И НИТРИТОВ В КОРМАХ И ПУТИ ПОСТУПЛЕНИЯ ИХ В ОРГАНИЗМ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Уровень накопления нитратов и нитритов в почве и растениях зависит от почвенно-климатических условий, вида и количества внесенного удобрения, а также от технологии подготовки кормов.
В условиях засухи содержанке нитратов в кормах повышается в связи с резким снижением активности ферментов азотистого обмена — нитратредуктазы и нитритредуктазы. Активность нитрат-редуктазы снижается также при отсутствии в почве калия, молибдена, серы н недостаточной освещенности растений; повышает активность этого фермента длительное воздействие солнечных лучей. На уровень накопления нитрат-ионов (нитратов) влияет вид азотного удобрения.
Внесение аммиачной селитры в почву в количестве 150 кг/га способствует накоплению нитратов выше допустимых количеств в кукурузе и кормовой свекле, внесение удобрений в количестве 100 кг/га азота вызывает в злаковых растениях накопление нитратов также выше допустимых норм.
Нитраты больше всего кумулируются в стеблях кукурузы, в семенных корзинках подсолнечника, в корнеплодах и ботве свеклы, растениях овса, пшеницы, ржи, а также во многих сорных азот-
Приложение 5
МЕТОДИКА4
ОПРЕДЕЛЕНИЯ НИТРАТОВ В КОРМАХ, КРОВИ И ПАТОЛОГИЧЕСКОМ МАТЕРИАЛЕ, ОВОЩАХ И БАХЧЕВЫХ
КУЛЬТУРАХ
(Утверждена главным управлением ветеринарии Министерства сельского хозяйства СССР 29 июня 1977 г.)
1. Принцип метода
Метод основан на извлечении нитратов из проб дистиллированной водой, восстановлении нитратов до нитритов металлическим цинком в уксуснокислом растворе и взаимодействии последних с реактивом Грисса, с образованием азосоединения розово-красного цвета.
Реакция специфична для нитритов. Чувствительность определения 40 мкг нитрат-ионов в пробе.
2. Реактивы и растворы
Сульфаниловая кислота, ч.д.а., ГОСТ 5821 — 69 Альфа-нафтиламин, ч.д.а., ГОСТ 8827 — 57
Уксусная кислота, концентрированная (ледяная), х.ч., ГОСТ 61-69 Калий азотнокислый KN03, х.ч., ГОСТ 4217 — 65 Цинковая пыль
Марганец сернокислый, ч,д.а., ГОСТ 435 — 67
Приготовление реактива Грисса. а) 0,5 г сульфани-ловой кислоты растворяют в 150 мл 12%-ного раствора уксусной кислоты;
б) 0,1 г альфа-нафтиламина растворяют при нагревании в 20 мл дистиллированной воды, фильтруют и смешивают со 150 мл 12%-ного раствора уксусной кислоты. Растворы хранят отдельно на холоде в течение 2 месяцев. Перед употреблением одну часть раствора «а» смешивают с равной по объему частью раствора «б».
Приготовление стандартного раствора нитрата калия. Растворяют 1,630 г нитрата калия, высушенного до постоянного веса при 105°С, в дистиллированной воде в мерной колбе на 1 л и доводят объем раствора до метки дистиллированной водой. 1 мл этого раствора содержит 1 мг нитрат-ионов (NOJ").
фиксирующих растениях, достигая максимальных количеств в первые 25 — 30 дней после внесения в почву, и удерживаются на этом уровне более двух месяцев. Содержание нитратов в корнеплодах в 6 — 35 раз больше, чем в ботве.
Некоторые способы технологии подготовки к скармливанию кормовой свеклы, кукурузы и других кормов с высоким содержанием нитратов (длительная варка, нарушение технологии силосования, внесение молочнокислых заквасок) обусловливают превращение нитратов в нитриты — соединения, значительно более токсичные для сельскохозяйственных животных.
Нитраты и нитриты поступают в организм животных при скармливании им кормов и выпаивании воды, содержащих эти соли, а также при попадании в организм животных самих удобрений при нарушении правил их транспортировки и хранения.
2. ТОКСИЧЕСКОЕ ДЕЙСТВИЕ
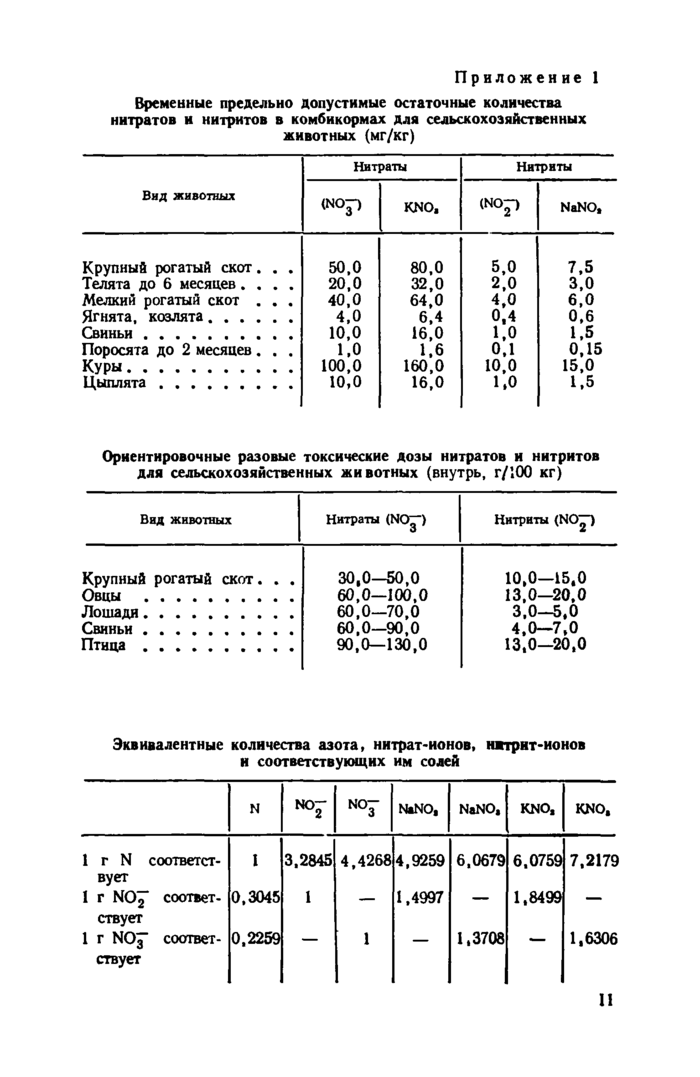
2.1. Отравление животных нитратами и нитритами наблюдается в случае поступления этих веществ в организм в концентрациях выше предельно допустимых (см. приложение 1).
2.2. Жвачные животные наиболее чувствительны к нитратам, а животные с однокамерным желудком — к нитритам. Молодняк более чувствителен к нитратам и нитритам, чем взрослые животные. Для телят небезопасно содержание нитратов в воде 100 мг/л и более, а у поросят-сосунов интоксикация возникает при содержании нитратов в количестве 50 мг/л и более. Безопасный уровень содержания нитратов в зеленых кормах составляет до 0,5%, а при их содержании выше 0,6% возникает отравление животных, часто со смертельным исходом.
В желудочно-кишечном тракте, особенно в преджелудках, под влиянием оксиредуктазных ферментов микрофлоры нитраты восстанавливаются до аммиака через стадию образования нитритов. Задержка восстановления нитратов на промежуточной стадии приводит к накоплению нитритов в желудочно-кишечном тракте, всасыванию их в кровь и отравлению животных. Нитриты токсичнее нитратов более чем в 10 раз.
Отравление свиней наблюдается при скармливании им кормов, содержащих нитриты, образовавшиеся из нитратов в основном во внешней среде под влиянием ферментов микрофлоры (при загнивании и плесневении растений).
Всосавшись в кровь, нитриты окисляют двухвалентное железо гемоглобина в трехвалентное, образуя метгемоглобин, точнее нитро-зогемоглобин, резко понижают кислородную емкость организма животных. Нормально в крови животных содержится небольшое
6
количество метгемоглобина — около 1—2% (до 5%) от общего количества гемоглобина. При образовании в крови 30 — 40% метгемоглобина возникают симптомы интоксикации, а если его количество превышает 60%, возможна гибель животных вследствие паралича сосудодвигательного центра.
Кроме образования метгемоглобина, нитриты вызывают резкое расширение сосудов, что сопровождается понижением кровяного давления. Депрессорное действие нитритов усугубляет вызванную метгемоглобинемией аноксию, особенно чувствительных к кислородному голоданию тканей таких органов, как мозг, сердце и беременная матка. Кроме гемоглобина, нитриты блокируют другие железосодержащие ферменты: миоглобин, каталазу. В то же время активируют пероксидазу.
При длительном поступлении нитратов или нитритов в несмер-тельнкх дозах у животных могут быть аборты, снижение молочной продуктивности, замедление роста, потери веса, гиповитаминоз. У жвачных животных снижается уровень рубцовой ферментации и изменяется соотношение летучих жирных кислот (ЛЖК).
Нитраты сами по себе сравнительно малотоксичны для животных, однако при поступлении их в организм крупного рогатого скота в больших количествах (см. приложение 1) возникает интоксикация за счет быстрого расщепления до аммиака, проявляющаяся сильным беспокойством животных и тимпанней. Эта форма интоксикации в основном наблюдается вскоре после первой дачи кормов с высоким содержанием нитратов.
2.3. При длительной варке свеклы имеющиеся в ней нитраты превращаются в нитриты в результате химического взаимодействия с сахарами. Предварительное добавление в корма продуктов молочнокислого брожения, содержащих активные ферменты (оксидоредуктазы), также приводит к превращению нитратов в нитриты.
Установлено, что мочевина в значительной степени предохраняет организм от токсического действия нитратов.
3. ДИАГНОСТИКА ОТРАВЛЕНИЙ
3.1. Диагностика отравлений животных нитратами и нитритами должна быть комплексной и основываться на анамнестических данных, клинических симптомах интоксикации и результатах химико-токсикологических и патологоанатомических исследований. Необходимо также предварительно исключить сходные по клиническому проявлению инфекционные заболевания.
3.2. Основные признаки в дифференциальной диагностике нит-ратно-нитритных отравлений: метгемоглобинемия (шоколадный цвет крови), высокое содержание нитритов и нитратов в крови и патологическом материале, метгемоглобина в крови. У крупного рогатого
7
скота при отравлении нитратами устанавливается высокое содержание аммиака в крози.
Содержание 30% и более метгемоглобина от общего количества гемоглобина в крови указывает на интоксикацию, а 60 — 70%—на возможную причину гибели животных.
3.3. Для отравления нитратами характерно высокое содержание их в кро^и и патологическом материале и отсутствие или незначительное количество нитритов.
3.4. При китратио'Нитритном отравлении нитраты и нитриты обнаруживаются в содержимом рубца, желудка, кишечника, п слюне, моче, крови, печени, сердечной н скелетных мышцах и других органах и тканях. У здоровых животных среднее содержание нитратов в желудочно-кишечном тракте, паренхиматозных органах и крови около 50 мг/кг, нитритов — около 8 мг/кг; в моче эти показатели почти в два раза выше. Содержание нитратов в органах и тканях здоровых животных может значительно колебаться (от следов до 150 мг/кг) в зависимости от состава рациона и вида животного.
При обнаружении в пробах патологического материала нитратов в количестве более 300 мг/кг (в моче более 400 мг/кг), а нитритов в количестве около 50 мг/кг (в крови более 80, моче более 100 мг/кг! можно предполагать отравление животных.
При постановке прижизненного диагноза на нитратно-ннтритное отравление животных для анализа на содержание нитратов н нитритов отбирают пробы крови и мочи; при падеже животных для анализа берут пробы паренхиматозных органов, крови и содержимого желудка.
В кормах н патологическом материале нитриты определяют методами, основанными на специфической реакции нитритов с реактивом Грисса (см. приложения 3 и 4).
Нитраты устанавливают методом, основанным на восстановлении их в нитриты с определением последних с помощью реактива Грисса (см. приложение 5).
При постановке диагноза на отравление животных нитритами отбирают пробы крови для определения в них метгемоглобина (кровь стабилизируют гепарином или оксалатом натрия).
Метгемоглобин в крови определяют методом Горна (см. приложение 6).
4, ЛЕЧЕНИЕ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ ПРИ НИТРАТНО-НИТРИТНОМ ОТРАВЛЕНИИ
4.1. Специфическое средство лечения при нитратно-нитритной интоксикации с наличием метгемоглобинемии — метиленовая синь в дозе I г на 100 кг массы животного. Препарат вводят внутривенно
8
в виде 1%-ного раствора, приготовленного па изотоническом растворе натрия хлорида (0,9%) или глюкозы (5%). При необходимости через 5 — 8 часов инъекцию повторяют.
4.2. Эффективным средством является также хромосмон — 1%-ный раствор метиленовой сини на 25%-ном растворе глюкозы, который вводят внутривенно из расчета I мл на 1 кг массы животного. При внутривенном введении растворов необходимо избегать попадания указанных средств под кожу.
4.3. Наряду с внутривенным введением раствора метиленовой сини хороший терапевтический эффект дает парэнгеральное введение 5%-ного раствора аскорбиновой кислоты в дозе 10 мл на 100 кг массы животного.
4.4. Кроме того, при подострых или хронических отравлениях необходимр применять витамин А и обволакивающие средства в принятых дозах.
4.5. В крайне тяжелых случаях сначала следует парэнтерально ввести на 100 кг массы животного 2 мл 5%-ного раствора эфедрина гидрохлорида, 3 мл цнтитона (0,15%-нын раствор цитизина) и 2 мл 10%-ного раствора коразола, а затем при улучшении общего состояния целесообразно ввести внутривенно раствор мсти* лековон сини (в виде хромосмона) (дозы см. п. 4.2.).
4.6. Для ускорения восстановления нитратов в конечные нетоксичные продукты жвачным животным дают внутрь раствор патоки или сахара, разведенную молочную или уксусную кислоту в общепринятых дозах. В конце первых или на вторые сутки применяют лечебные средства против атонии преджелудкоз (натрия сульфат, настойка чемерицы и др.).
5. ПРОФИЛАКТИКА ОТРАВЛЕНИЙ
5.1. Кормовые культуры, выращенные в условиях, когда в почву вносилось большое количество азотных удобрений (более 150 кг/га), особенно в засушливые годы, следует использовать для кормления животных только после количественного определения в них нитратов и нитритов.
5.2. Корма, содержащие нитраты и нитриты выше предельно допустимых концентраций, можно скармливать животным в смеси с другими кормами при условии содержания этих веществ б рационе не выше предельно допустимых количеств.
5.3. Кроме того, необходимо осуществлять следующие мероприятия:
— обеспечивать полноценность рациона животных по содержанию углеводов за счет мелассы или свеклы, а также достаточным количеством витаминов, особенно витаминами А и каротином;
9
— не выгонять голодных животных на пастбища, предварительно скармливать им корма с высоким содержанием сухих веществ и углеводов;
— не допускать водопоя животных из источников, вода которых содержит более 1 мг/л нитритов и 45 мг/л нитратов;
— постепенно приучать жвачных животных к пастбищам, на которые внесено повышенное количество азотных удобрений, а также дополнительно вводить в рацион углеводы;
— у жвачных животных, приученных к скармливанию кормов с высоким содержанием нитратов, не допускать продолжительного (более 2 суток) перерыва в использовании таких кормов;
— зеленую массу с высоким содержанием нитратов (более 3% нитрат-ионов на сухое вещество) следует использовать для силосования;
— в силосе должно содержаться не более 40% сухих веществ, что способствует уменьшению количества нитратов вследствие их редукции до нетоксичных соединений.
5.4. Не допускать: хранения кормов вблизи склада минеральных удобрений; использования транспортных средств, загрязненных минеральными удобрениями, для перевозки кормов; случайного поедания животными минеральных удобрений.
5.5. Не допускать условий, способствующих редукции нитратов в нитриты в кормах, для чего:
— свеклу варить только в измельченном виде, вареные корнеплоды извлекать из отвара, быстро охлаждать и хранить не более 6 часов; не скармливать животным свекольного отвара;
— не обрабатывать зеленые корма и комбикорма молочнокислыми продуктами во избежание ферментного превращения нитратов в нитриты;
— регулярно очищать кормушки и емкости кормоцехов от остатков кормов.
5.6. Систематически разъяснять работникам сельского хозяйства о токсичности нитратов и нитритов, о правилах хранения и нормативах использования азотных удобрений, о мерах по предотвращению образования во внешней среде нитритов из нитратов, об организации мероприятий по охране внешней среды от загрязнения нитратами и нитритами, о рациональном использовании культурных пастбищ, а также об охране животных от отравлений.
Приложен не 1
Временные предельно допустимые остаточные количества нитратов и нитритов в комбикормах для сельскохозяйственных животных (мг/кг)
|
Вид животных |
Нитраты |
Нитриты | ||
|
<NOP |
KNO, |
(М°р |
NaNO, | |
|
Крупный рогатый скот. . . |
50,0 |
80,0 |
5,0 |
7,5 |
|
Телята до 6 месяцев.... |
20,0 |
32,0 |
2,0 |
3,0 |
|
Мелкий рогатый скот . . . |
40,0 |
64,0 |
4,0 |
6,0 |
|
Ягнята, козлята ...... |
4,0 |
6,4 |
0,4 |
0,6 |
|
Свиньи .......... |
10,0 |
16,0 |
1.0 |
1.5 |
|
Поросята до 2 месяцев. . . |
1,0 |
1.6 |
0.1 |
0,15 |
|
Куры........... |
100,0 |
160,0 |
10,0 |
15,0 |
|
Цыплята........ . |
10,0 |
16,0 |
1.0 |
1.5 |
Ориентировочные разовые токсические дозы нитратов и нитритов для сельскохозяйственных животных (внутрь, г/100 кг)
|
Вид животных |
Нитраты (NOjp |
Нитриты (NO£") |
|
Крупный рогатый скот. . . |
30,0—50,0 |
10,0—15.0 |
|
Овцы .......... |
60,0—100,0 |
13,0—20,0 |
|
Лошади.......... |
60,0—70,0 |
3,0—5,0 |
|
Свиньи .......... |
60,0—90,0 |
4,0—7,0 |
|
Птица.......... |
90,0—130,0 |
13.0—20,0 |
Эквивалентные количества азота» нитрат-ионов, нитрит-ионов и соответствующих им солей
|
N |
№Г |
NOJ |
NaNO, |
NaNO, |
KNO, |
KNO. | |
|
1 г N соответствует |
I |
3,2845 |
4,4268 |
4,9259 |
6,0679 |
6.0759 |
7,2179 |
|
1 г N0^* соответствует |
0,3045 |
1 |
— |
1,4997 |
— |
1,8499 | |
|
1 г NOJ- соответствует |
0,2259 |
1 |
1.3708 |
1,6306 11 |
Приложение 2
КЛИНИЧЕСКАЯ КАРТИНА ОТРАВЛЕНИЯ ЖИВОТНЫХ
Клинические симптомы отравления у животных возникают после превращения более 25% гемоглобина в метгемоглобин. При этом развиваются аноксия и соответствующие явления интоксикации Животные отказываются от приема корма, становятся беспокойными. Слизистые оболочки глаз и ротовой полости вишневого цвета с коричневым оттенком, температура тела в пределах нормы или несколько понижена. Дыхание и пульс учащенные. Затем наступают тремор и слабость скелетной мускулатуры, нарушение координации движения, слюнотечение, рвота (у свиней), диарея, явления асфиксии, судороги, коматозное состояние. Смертность высокая.
В острых случаях интоксикаций, вызванных дачей большого количества зеленой массы, полученной на чрезмерно удобренных азотными удобрениями площадях, отмечается сильное беспокойство животных. Крупный рогатый скот часто ложится, встает, бьег задними ногами по животу. Вид животного испуганный. Обильное потовыделение, частые позывы к мочеиспусканию, дыхание и пулы: учащенные, частые и сильные сокращения рубца, бурная перистальтика, разжижение каловых масс.
При хроническом нитратно-нитритном отравлении отмечают уменьшение или даже прекращение лактации, аборты, бледность видимых слизистых оболочек. Шерсть становится матовой, взъерошенной. Появляется общая слабость, расстройство сердечной деятельности. Поносы сменяются запорами, наступает истощение и смерть.
-У коров и свиноматок отмечаются аборты и мертворождаемость. Телята и поросята погибают в первые дни после рождения или в течение первой недели жизни от неподдающихся лечению энтеритов, а иногда вовсе без симптомов заболевания. Животные теряют в весе. Оставшиеся в живых поросята выздоравливают очень медленно. После исключения из рациона кормов с высоким содержанием нитратов (4 — 8% нитрат-ионов на сухое вещество) больные животные выздоравливают через 5 — 7 дней, а выделение новых больных прекращается.
Отравление нитратами (без их редукции в нитриты) встречается редко, в основном у свиней и крупного рогатого скота. Протекает остро и хронически с высоким процентом смертельных исходов. При нитратном отравлении отсутствуют признаки мет-гемоглобинемии. Взятая из вены кровь имеет вишнево-красный цвет, а в некоторых случаях, особенно при затяжном течении, бывает даже ярко-красной.
12
1
Методика подготовлена и апробирована в лаборатории фармакологии и токсикологии Всесоюзного ордена Ленина института экспериментальной ветеринарии В. Н. Поляковой.
14
2
Методика разработана во Всесоюзном научно-исследовательском институте ветеринарной санитарии кандидатом биологических наук 3. И. Пилипец.
17
3
Реакция высокочувствительна. Интенсивность окраски изменяется пропорционально количеству азотистокислого натрия в пределах от 10 до 120 мкг в 100 мл колориметрируемого раствора. Содержание выше 120 мкг азотистокислого натрия в 100 мл колориметрируемого раствора, как правило, встречающееся при токсических концентрациях нитритов в корме, дает кратковременное интенсивное окрашивание пробы с последующим выпадением оранжево-коричневого осадка и просветлением раствора. В этом случае фильтрат 2 разбавляют в 10—100 раз, что учитывается в формуле, и повторяют анализ, вновь отбирая для исследования 50 мл раствора. Исходный объем — 50 мл испытуемого раствора — обязательное условие постановки реакции.
4
Методика подготовлена и апробирована в лаборатории фармакологии и токсикологии Всесоюзного ордена Ленина института экспериментальной ветеринарии В. Н. Поляковой.
23