Рекомендации по организации и проведению контроля качества питательных сред для ветеринарных лабораторий
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Рекомендации предназначены для специалистов ветеринарных лабораторий, осуществляющих диагностику заразных болезней животных и санитарно-гигиенические исследования в области ветеринарного надзора и контроля
Оглавление
Предисловие
Введение
1. Проверка документации и визуальный контроль при приобретении сухих (дегидратированных) питательных сред
Термины и определения
2. Контроль условий и сроков хранения питательных сред
3. Контроль питательных сред на этапе приготовления
3.1. Оценка внешнего вида готовой среды
3.2. Измерение рН
3.3. Определение стерильности
4. Контроль биологических свойств питательных сред
4.1. Подготовительный этап контроля биологических свойств питательных сред
Питательные среды
Тестовый штамм
Методика приготовления суспензий с заданной концентрацией клеток тестовых микроорганизмов
Методика выполнения десятикратных разведений
Схема разведения и высева культуры тест-штамма
Методики посевов
Рисунок не приводится
4.2. Качественный контроль
Оценка результатов качественного контроля
4.3. Количественный контроль
4.3.1. Определение влияния питательной среды на типичность роста микроорганизмов
4.3.2. Определение ингибирующих свойств среды
4.3.3. Определение эффективности питательной среды
4.3.4. Определение показателя чувствительности питательной среды
5. Действия при выявлении несоответствий при контроле питательной среды
6. Требования к порядку и процедуре ведения эталонных бактериальных культур
Приложение 1 (рекомендуемое). Журнал приготовления и контроля питательных сред
Приложение 2. Лист контроля температурного режима
Приложение 3. Журнал учета результатов количественного контроля питательных сред
Приложение 4. Журнал учета результатов качественного контроля питательных сред
Приложение 5. Протокол контроля качества питательных сред
Приложение 6. Классификация питательных сред
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 14.02.2011 | Утвержден | Россельхознадзор |
|---|---|---|
| Разработан | Центральная научно-методическая ветеринарная лаборатория |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12
стр. 13

стр. 14

стр. 15
стр. 16
Утверждаю Заместитель Руководителя Россел ьхоз надзора Н.А.ВЛАСОВ 14 февраля 2011 года
РЕКОМЕНДАЦИИ ПО ОРГАНИЗАЦИИ И ПРОВЕДЕНИЮ КОНТРОЛЯ КАЧЕСТВА ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ВЕТЕРИНАРНЫХ ЛАБОРАТОРИЙ
ПРЕДИСЛОВИЕ
Рекомендации разработаны: ФГУ Центральная научно-методическая ветеринарная лаборатория.
Рекомендации предназначены для специалистов ветеринарных лабораторий, осуществляющих диагностику заразных болезней животных и санитарно-гигиенические исследования в области ветеринарного надзора и контроля.
Рекомендации по организации и проведению контроля качества питательных сред для ветеринарных лабораторий разработаны в соответствии с требованиями ГОСТ Р 51758-2001 (Среды питательные для ветеринарных целей. Методы биологических испытаний), МУК 4.2.2316-08 (Методы контроля бактериологических питательных сред).
ВВЕДЕНИЕ
Правила организации и проведения контроля качества питательных сред в ветеринарных лабораториях Российской Федерации (далее - Правила) устанавливают процедуры внутреннего контроля качества питательных сред, которые используются для проведения диагностических и санитарно-гигиенических исследований по микробиологическим показателям.
В государственных ветеринарных лабораториях Российской Федерации разрешены для применения питательные среды, зарегистрированные в установленном порядке и внесенные в перечень разрешенных для применения питательных сред.
Контроль качества питательных сред должен осуществляться высококвалифицированными специалистами на всех этапах технологического процесса, начиная с момента закупки среды до непосредственного использования в анализе, и включать следующие этапы:
1. Проверку документации и визуальный контроль питательных сред при их получении.
2. Контроль условий и сроков хранения питательных сред.
3. Контроль питательных сред на этапе приготовления.
4. Контроль биологических свойств питательных сред.
Применение питательных сред без подтверждения их качества не допускается. Результаты выполнения процедур контроля качества должны быть документально подтверждены.
1. Проверка документации и визуальный контроль при приобретении сухих (дегидратированных) питательных сред
Данный этап контроля позволяет избежать закупок питательных сред у фирм, не имеющих надлежащих документов, удостоверяющих и гарантирующих их качество, а также выявить грубые нарушения, возникшие при транспортировке (разгерметизация упаковки, несоответствие внешнего вида обезвоженной среды или отдельных компонентов описанию изготовителя и др.). Контроль осуществляют при каждом поступлении в лабораторию питательных сред.
При приобретении питательных сред необходимо затребовать у производителей и (или) продавцов копии лицензии на право производства и реализации данных питательных сред. Обязательным условием при поставках питательных сред является наличие следующих сопроводительных документов:
1) копии сертификата соответствия на реализуемую среду;
2) паспорта отдела контроля организации-изготовителя на реализуемую серию препарата;
3) инструкции по применению.
Питательные среды и биологические препараты импортного производства должны иметь
Международный сертификат качества серии ИСО 9000 или EN 29000.
При получении питательных сред необходимо проверить целостность упаковки и наличие этикеток на упаковках (оценивается визуально). Сопроводительная документация должна быть на русском языке и содержать следующую информацию:
- наименование среды и ее назначение;
- наименование предприятия-изготовителя;
- номер серии;
- номер протокола контрольных испытаний;
- дата изготовления;
- срок годности;
- состав среды;
- условия хранения;
- рецептура приготовления;
- описание внешнего вида и консистенции сухой и готовой среды;
- условия и длительность хранения готовой среды.
В случае обнаружения каких-либо отклонений необходимо сообщить руководителю лаборатории, производителю продукции, а в случае возникновения разногласий - в ФГУ "ВГНКИ".
Термины и определения
Питательные среды - это субстраты, используемые для культивирования в искусственных условиях различных микроорганизмов.
Партия питательной среды - питательная среда, изготовленная из определенной партии сырья, предварительно испытанного на соответствие требуемым качествам.
Партия питательных сред - полностью прослеживаемая партия материала, представляющая собой определенное количество полуготового продукта или конечного продукта, являющегося однородным по типу и качеству, соответствующего производственным требованиям (контролю процесса производства) и тестам контроля качества, произведенного в течение одного определенного периода производства и которому приписан один номер партии.
Серия - определенное количество питательной среды, полученной в результате одного технологического цикла, одновременно расфасованное и оформленное документом о качестве с указанием номера контроля. Основным требованием к серии является ее однородность.
Срок годности - период, в течение которого питательная среда должна полностью удовлетворять всем требованиям соответствующего государственного стандарта.
Срок хранения - период времени, в течение которого свойства продукта при правильном хранении (в соответствии с указаниями на этикетке) должны оставаться в пределах требований спецификации.
2. Контроль условий и сроков хранения питательных сред
Контроль условий и сроков хранения питательных сред позволяет обеспечить правильность хранения сред, а также своевременное пополнение их запаса. Контроль запасов на складе лаборатории и в отделах осуществляется не реже одного раза в неделю. Сухие питательные среды и реактивы необходимо хранить в сухом защищенном от света месте при температуре и влажности воздуха, рекомендуемых производителем.
При проверке особое внимание уделяют сохранению герметичности вскрытых упаковок со средами, т.к. повышение влажности и комкование сухой питательной среды существенно ухудшают ее качество. Если питательная среда упакована в пакет из ламинированной бумаги и весь объем среды не используется за один раз, то после вскрытия пакета оставшуюся часть среды желательно перенести в чистую сухую емкость из оранжевого стекла (или другого светозащитного инертного материала) с плотно закрывающейся крышкой. Емкость необходимо промаркировать.
Готовые питательные среды хранят при температуре 2 - 8 °С. Срок хранения готовой питательной среды не должен превышать срока, установленного изготовителем.
Приготовленные в лаборатории питательные среды должны быть промаркированы с указанием названия среды, даты ее приготовления. Дату приготовления питательной среды заносят в журнал приготовления и контроля питательных сред (Приложение 1).
При организации контроля условий хранения питательных сред предпочтительно использование
должно быть однонаправленным, т.е. запасы эталонной культуры не должны пополняться за счет (из) запасов рабочей культуры;
- контроль эталонного штамма на соответствие паспортным данным и отсутствие диссоциации необходимо проводить перед восполнением запасов рабочей культуры;
- штамм с измененными свойствами для дальнейшей работы не используют;
- для целевого использования пригодны культуры эталонного штамма, прошедшие в процессе хранения с момента высева не более 2 пассажей.
Ведение эталонных бактериальных культур без создания запаса эталонной культуры для длительного хранения
Процесс ведения эталонных культур состоит из следующих блоков:
- восстановление и контроль лиофилизированной культуры;
- создание запаса рабочей культуры;
- хранение культуры в полужидком агаре при 4 - 8 °С;
- восполнение запаса рабочей культуры;
- подготовка культуры для целевого использования;
- контроль видовых и паспортных свойств.
Хранение запаса рабочей культуры в полужидком агаре при 4 - 8 °С не требует специального оснащения, но порождает необходимость восполнения запасов рабочей культуры путем получения ее субкультур на среде хранения каждые 3 месяца.
Дополнительные пассажи через питательные среды могут привести к диссоциации штамма и потере тестовых свойств. Восполнять запас рабочей культуры разрешается только 3 раза (конец 3, 6 и 9 месяца с момента его создания). Это ограничивает срок использования эталонной культуры, полученной из 1 ампулы одним годом, по истечении которого необходимо вскрыть новую ампулу с тестовой культурой.
<...> нагревают над пламенем горелки. Влажным концом стерильного ватного тампона прикасаются к нагретой части, в результате чего появляются трещины. Конец ампулы накрывают трехслойной марлевой салфеткой, смоченной 70%-ным этиловым спиртом и хорошо отжатой, и обламывают пинцетом.
После вскрытия ампула остается накрытой той же салфеткой в течение 1 - 2 мин. Затем салфетку осторожно снимают и вместе с остатками стекла погружают в дезинфицирующий раствор. В ампулу вносят питательный бульон до первоначального объема, для регидратации культуры. Содержимое ампулы перемешивают, переносят стерильной пастеровской пипеткой или наконечником в пробирку с питательным бульоном или иной оптимальной для данной культуры питательной средой и инкубируют при оптимальной для тестового штамма температуре в течение 18-24 часов.
После инкубации из питательного бульона делают высев петлей на скошенный питательный агар в две пробирки. Оставшуюся бульонную культуру используют для оценки степени диссоциации эталонного штамма.
Одну пробирку с посевом используют для постановки тестов на соответствие полученного штамма видовым, паспортным свойствам. Второй посев на скошенном питательном агаре используют для создания запасов рабочей культуры.
Культура с измененными свойствами в работу не допускается.
Создание запасов рабочей культуры
При удовлетворительном прохождении контрольных тестов культуру со скошенного питательного агара засевают уколом в столбик с полужидким агаром - в 13 - 14 пробирок (из расчета 1 пробирка на 1 неделю) и в 1 пробирку для восполнения запасов рабочей культуры через 3 месяца на следующий квартал. Пробирки инкубируют 18-24 часа при оптимальной для эталонного штамма температуре. При наличии роста пробирки закрывают резиновыми пробками и закладывают на хранение при температуре 4 - 8 °С.
Одну из пробирок с культурой, предназначенной для восполнения рабочих запасов, маркируют и хранят отдельно. Запасы рабочей культуры желательно хранить в отдельном холодильнике.
Допускается хранение культур в морозильных камерах с добавлением криопротекторов.
Восполнение запасов рабочей культуры
Восполнение запасов рабочей культуры производится в конце третьего, шестого и девятого месяца с момента вскрытия ампулы (каждые 3 месяца).
Для восполнения запасов рабочей культуры используется субкультура на среде хранения, полученная ранее при создании запасов или при очередном их восполнении. Из пробирки с культурой, предназначенной для восполнения запасов, производят посев в питательный бульон. Посевы инкубируют при оптимальной для эталонного штамма температуре в течение 18-24 часов. После инкубации из питательного бульона делают высев петлей в две пробирки со скошенным питательным агаром и
инкубируют при оптимальной для эталонного штамма температуре 18-24 часа. Оставшуюся бульонную культуру используют для оценки степени диссоциации. Один из посевов используют для постановки тестов на соответствие полученного штамма видовым и паспортным свойствам. Второй посев на скошенном питательном агаре используют для восполнения запасов рабочей культуры.
При удовлетворительном прохождении контрольных тестов культура закладывается на хранение. Восполнение запасов рабочей культуры проводят только 3 раза. По истечении года использования микроорганизмов.
Подготовка культуры для целевого использования в анализе
Пробирку с культурой в полужидком агаре следует использовать в течение 1 недели, т.е. в начале каждой недели следует брать новую пробирку из запаса рабочей культуры. Накануне использования культуру с полужидкого агара высевают в пробирку со скошенным питательным агаром. Посевы инкубируют при оптимальной для эталонного штамма температуре в течение 18-24 часов.
Оценка степени диссоциации эталонного штамма микроорганизма
Из 18 - 24-часовой бульонной культуры делают 10-кратные разведения физиологическим раствором. Из 5 и 6 разведения засевают по 0,1 мл на 2 чашки питательного агара, предварительно подсушенного в термостате. Посевной материал распределяют шпателем по поверхности агара до полного исчезновения влаги и инкубируют в термостате при оптимальном режиме в течение 18-24 часов.
Выбирают чашки, на которых выросло от 30 до 100 колоний. Проверку тест-штаммов на диссоциацию проводят путем визуального просмотра изолированных колоний на чашках в прямом и косонаправленном свете через бинокулярную лупу или микроскоп на малом увеличении.
При обнаружении диссоциации (по размеру, прозрачности, S-R-диссоциации, и др.) подсчитывают количество измененных колоний и общее количество просмотренных колоний. Общее количество просмотренных колоний должно быть не менее 30. Затем рассчитывают процент диссоциации по формуле:
количество измененных колоний
% диссоциации =--------------------------------------х 100%
общее количество просмотренных колоний
Если процент диссоциированных колоний превышает 25%, то данная культура не пригодна для дальнейшего использования.
Если для микроорганизма характерен полиморфизм формируемых им колоний, то оценка S-R-диссоциации не проводится.
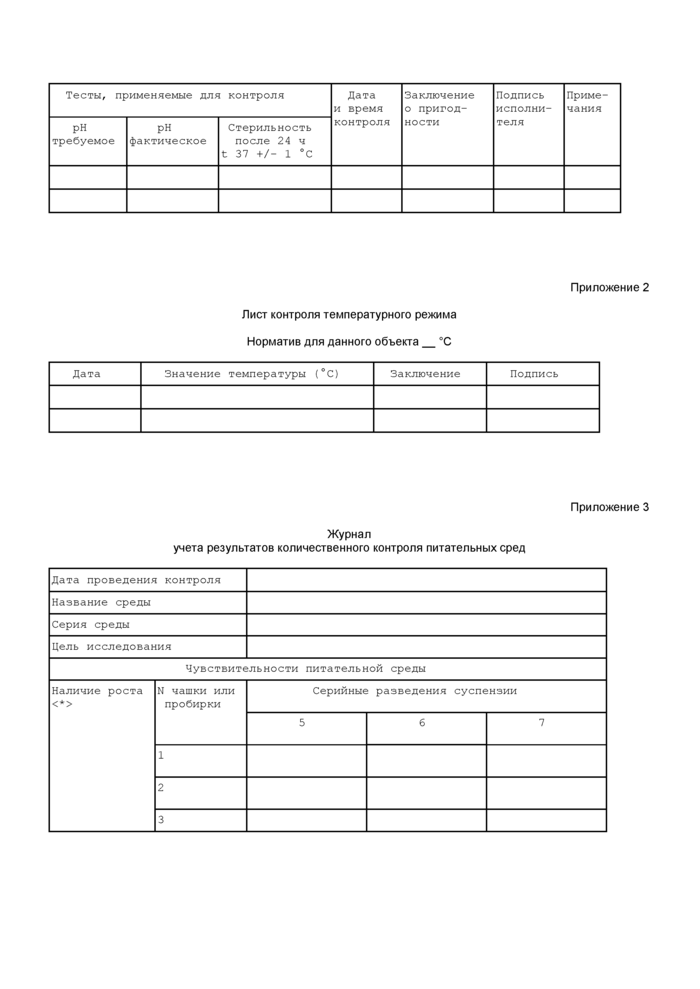
Приложение 1 (рекомендуемое)
Журнал
приготовления и контроля питательных сред
Четная страница
|
N п/п |
Дата приготов ления |
Наименование питательной среды |
Количество среды, л |
Серия, дата выпуска препарата, из которого приготовлена питательная среда |
Нечетная страница
|
Тесты, применяемые для контроля |
Дата и время контроля |
Заключение о пригодности |
Подпись исполни теля |
Приме чания | ||
|
рн требуемое |
рн фактическое |
Стерильность после 24 ч t 37 +/- 1 °С | ||||
Приложение 2
Лист контроля температурного режима Норматив для данного объекта_°С
|
Дата |
Значение температуры (°С) |
Заключение |
Подпись |
Приложение 3
Журнал
учета результатов количественного контроля питательных сред
|
Дата проведения контроля | ||||
|
Название среды | ||||
|
Серия среды | ||||
|
Цель исследования | ||||
|
Чувствительности питательной среды | ||||
|
Наличие роста <*> |
N чашки или пробирки |
Серийные разведения суспензии | ||
|
5 |
6 |
7 | ||
|
1 | ||||
|
2 | ||||
|
3 | ||||
|
Заключение: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Приложение 4
Журнал
учета результатов качественного контроля питательных сред
|
Дата |
Название |
Серия |
Тест-штамм |
Характер роста |
Заключение |
Исполнитель |
|
среды |
среды |
(Ф.И.О.) |
Приложение 5
ПРОТОКОЛ N_
контроля качества питательных сред от_
Название среды N партии
дата приготовления среды стерильность:
Ростовые свойства:
Заключение:
Подпись:
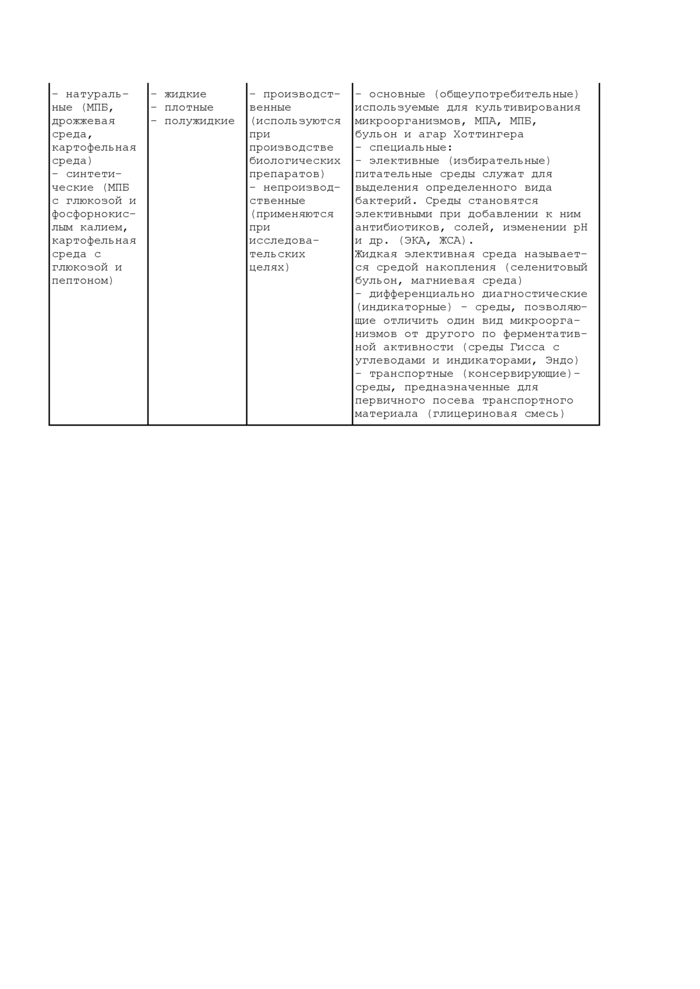
Приложение 6
|
КЛАССИФИКАЦИЯ ПИТАТЕЛЬНЫХ СРЕД | ||||||||||||||||
|
|
- натураль- |
- жидкие |
- производст- |
- основные (общеупотребительные) |
|
ные (МПБ, |
- плотные |
венные |
используемые для культивирования |
|
дрожжевая |
- полужидкие |
(используются |
микроорганизмов, МПА, МПБ, |
|
среда. |
при |
бульон и агар Хоттингера | |
|
картофельная |
производстве |
- специаль ные: | |
|
среда) |
биологических |
- элективные (избирательные) | |
|
- синтети- |
препаратов) |
питательные среды служат для | |
|
ческие (МПБ |
- непроизвод- |
выделения определенного вида | |
|
с глюкозой и |
ственные |
бактерий. Среды становятся | |
|
фосфорнокис- |
(применяются |
элективными при добавлении к ним | |
|
лым калием. |
при |
антибиотиков, солей, изменении pH | |
|
картофельная |
исследова- |
и др. (ЭКА, ЖСА). | |
|
среда с |
тель ских |
Жидкая элективная среда называет- | |
|
глюкозой и пептоном) |
целях) |
ся средой накопления (селенитовый бульон, магниевая среда) - дифференциально диагностические (индикаторные) - среды, позволяющие отличить один вид микроорганизмов от другого по ферментативной активности (среды Гисса с углеводами и индикаторами. Эндо) - транспортные (консервирующие)-среды, предназначенные для первичного посева транспортного материала (глицериновая смесь) |
автоматических термометров, измеряющих температуру с интервалом не реже одного раза в сутки, с сохранением и передачей информации на компьютер. Результаты проверок заносят в листы контроля (Приложение 2).
3. Контроль питательных сред на этапе приготовления
Для приготовления питательных сред и растворов, используемых при микробиологическом анализе, допускается применение химических веществ по степени чистоты не ниже ЧДА (чистая для анализа).
Основным фактором, определяющим качество и дальнейшую пригодность питательной среды, является правильность ее приготовления.
Приготовление сред должно осуществляться со строгим соблюдением рецептуры приготовления и условий стерилизации, определенных изготовителем.
Контроль питательных сред на этапе приготовления включает:
- оценку внешнего вида готовой среды;
- измерение pH питательной среды до и после автоклавирования;
- определение стерильности (отсутствия контаминации) готовой среды;
- постановку качественного контроля биологических свойств среды.
Оценку состояния работ по контролю питательных сред на этапе приготовления проводят на основании данных, зарегистрированных в Журнале приготовления, и контроля питательных сред. Контролю подвергают каждую серию приготовленной среды.
3.1. Оценка внешнего вида готовой среды
Оценку внешнего вида готовой питательной среды проводят визуально. Цвет, прозрачность и консистенция приготовленной среды должны быть типичны для данной питательной среды и соответствовать нормативной документации изготовителя.
На некоторые наиболее часто встречающиеся ошибки при приготовлении сред указывают:
- потемнение среды вследствие перегревания или недостаточного перемешивания;
- неполное растворение (комки) порошкообразной среды;
- образование осадка.
3.2. Измерение pH
Значение водородного показателя определяют с помощью pH-метров для агаризованных и жидких питательных сред. Определение проводят согласно инструкции по использованию приборов.
Величину водородного показателя измеряют у стерилизованной среды, а при работе с плотной средой измеряют у стерилизованной среды после ее отвердения. Результаты регистрируют в журнале (Приложение 1).
Отклонение pH среды за пределы диапазона, указанного в паспорте, приводит к ухудшению ее биологических свойств, вплоть до полной непригодности.
Отклонения водородного показателя или другие проблемы с pH могут быть вызваны:
- перегревом, в том числе при стерилизации;
- недостаточным перемешиванием (менее 15 минут);
- использованием щелочного стекла;
- загрязнением емкостей, в которых готовилась среда;
- дистиллированной водой низкого качества.
3.3. Определение стерильности
Определение стерильности (для стерилизуемых сред) и отсутствия контаминации (для нестерилизуемых сред) проводят путем выдержки в течение 48 - 72 часов при температуре 35 - 37 °С.
Каждую новую приготовленную партию питательной среды подвергают контролю. Для проверки качества питательной среды от партии приготовленной продукции в пробирках, чашках Петри и флаконах составляют выборку. Объем составляемой выборки определяется в зависимости от общего количества приготовленных единиц в партии и должен соответствовать нормам, установленным в таблице 1.
Таблица 1
ОБЪЕМ ВЫБОРКИ ОТ ОБЩЕГО КОЛИЧЕСТВА ПАРТИИ ПИТАТЕЛЬНОЙ СРЕДЫ
|
Количество единиц в партии |
Объем выборки |
|
От 1 до 10 единиц |
1 единица |
|
От 10 до 100 единиц |
2 единицы |
|
Более 100 единиц |
3-5 единиц |
По истечении срока инкубации на исследуемых питательных средах должны отсутствовать визуально определяемые признаки роста микроорганизмов, после чего среда может быть использована для проведения исследований.
Результаты регистрируют в журнале (Приложение 1).
4. Контроль биологических свойств питательных сред
Контроль биологических свойств готовых питательных сред включает два этапа: качественный и количественный контроль.
Целью качественного контроля является выявление грубых нарушений технологии приготовления, приводящих к выраженному снижению ростовых и (или) дифференцирующих свойств.
В процессе качественного контроля оценивают принципиальную способность тестового штамма расти на данной среде, а также наличие характерных признаков для дифференциально-диагностических сред.
Качественный контроль среды проводят после каждой варки.
Количественный контроль позволяет выявлять относительные изменения (ухудшение) ростовых свойств из-за ряда причин, возникающих на этапах транспортирования, хранения, приготовления, стерилизации, а также при нарушении технологических требований в процессе производства питательных сред, в результате которых они оказываются менее эффективными. Количественный контроль также может служить инструментом выбора более эффективной среды среди продукции, предлагаемой на современном рынке.
Количественный контроль выполняется:
- при поступлении каждой партии среды (разные серии питательных сред одного производителя иногда имеют различие по качеству, поэтому контролю подлежит каждая серия среды поступившей партии) или используемых реактивов;
- за месяц до окончания срока годности среды.
Этапы контроля биологических свойств питательных сред фиксируются в журналах установленного образца.
Форма журнала учета количественного контроля питательных сред представлена в Приложении 3.
Форма журнала учета качественного контроля питательных сред представлена в Приложении 4.
Результаты количественного контроля качества питательных сред оформляются в виде протокола, который хранится в отделе приготовления питательных сред (Приложение 5).
4.1. Подготовительный этап контроля биологических свойств питательных сред
Питательные среды
Для контроля следует использовать свежеприготовленные среды одной варки. Среды готовят согласно инструкции изготовителя.
Жидкие питательные среды разливают в пробирки по 7 - 7,5 мл. Плотные питательные среды разливают в чашки Петри слоем не менее 2 мм и предварительно асептически подсушивают одним из следующих способов:
1. Перевернутые чашки Петри с приоткрытыми крышками выдерживают в стерильном термостате или сушильном шкафу при температуре 25 - 50 °С до исчезновения капель влаги с поверхности агара.
Среды не пересушивать!
2. Чашки Петри с полуоткрытыми крышками помещают в ламинарный шкаф на 30 мин.
Тестовый штамм
Эталонные (тестовые) штаммы следует получать из официально признанной коллекции микроорганизмов. Культуру тестового штамма готовят накануне исследования. Для этого ее высевают со среды хранения (например, с полужидкого агара) на пробирки со скошенным питательным агаром или специальной средой. Посевы инкубируют 18-24 часа при оптимальной для тестового штамма температуре. Из полученной суточной агаровой культуры готовят суспензию микроорганизма методом десятикратных разведений для количественного контроля. В случае необходимости (при длительном хранении) культуру необходимо предварительно освежить в мясо-пептонном бульоне (МПБ).
Для качественного контроля приготовление суспензии тестовой культуры не требуется.
Методика
приготовления суспензий с заданной концентрацией клеток тестовых микроорганизмов
Приготовление суспензий с заданной концентрацией клеток тестовых культур осуществляется с использованием оптического стандарта мутности на 10 ед. и соответствующего 1 млрд, микробных клеток/мл.
В стерильную бактериологическую пробирку вносят 3 - 4 мл разбавителя. В качестве разбавителя может быть использован физиологический раствор или пептонно-солевой разбавитель. Агаровую тестовую культуру петлей переносят в пробирку и растирают по внутренней поверхности пробирки, постепенно смешивая с содержащимся в ней разбавителем.
Возможно приготовление бактериальной взвеси методом смыва выросшей культуры со скошенного агара 5 мл разбавителя.
Полученную взвесь микроорганизмов интенсивно встряхивают, добиваясь полного и равномерного распределения клеток. Мутность полученной взвеси сравнивают с мутностью оптического стандарта, который также предварительно тщательно встряхивают.
При визуальном несоответствии мутности приготовленной суспензии стандарту ее доводят либо добавлением агаровой культуры, либо добавлением разбавителя. После каждого внесения культуры или разбавителя суспензию тщательно встряхивают.
При совпадении мутности приготовленной суспензии и мутности оптического стандарта считается, что концентрация клеток тестовой культуры в данной суспензии примерно соответствует значению, указанному для данного стандарта 9
(1 X 10 мк.кл./мл).
Для получения суспензии с нужной концентрацией тестового микроорганизма выполняют серийные разведения полученной стандартной суспензии методом десятикратных разведений.
Методика выполнения десятикратных разведений
В соответствии с выбранной степенью разведения культуры, отбирают необходимое количество пробирок и вносят в каждую пробирку по 4,5 куб. см стерильного разбавителя.
В первую пробирку, содержащую 4,5 куб. см разбавителя, не касаясь
стенок пробирки и поверхности разбавителя стерильной пипеткой вносят 0,5 куб. см хорошо гомогенизированной суспензии тестовой культуры,
9
содержащую 10 клеток в 1 куб. см и тщательно перемешивают пипетированием. Пипетирование следует производить новой стерильной
пипеткой, либо суспензию можно перемешать с помощью перемешивающего устройства (вортекса). Полученное первое разведение в 1 мл содержит
-1
0,1 мл исходного образца (разведение в 10 раз - 10 ). В следующую (вторую)
пробирку, также содержащую 4,5 мл разбавителя, не касаясь стенок пробирки и поверхности разбавителя, новой пипеткой вносят 0,5 мл хорошо
перемешанного первого разведения. Смесь тщательно перемешивают пипетированием. Получаем второе разведение, в 1 мл этой суспензии
-2
содержится 0,01 мл исходного образца (разведение в 100 раз - 10 ).
Процедуру приготовления разведений продолжают по описанной схеме до получения суспензии с необходимым показателем разведения.
|
0,5 мл 0,5 мл 0,5 мл 0,5 мл 0,5 мл 0,5 мл 0,5 мл |
|
-1 -2 10 10 -3 10 -4 10 -5 10 - 6 -7 10 10 |
Схема разведения и высева культуры тест-штамма
Куль тура тест-штамма 1 млрд. клеток
Методики посевов
Посев в жидкую питательную среду
Данный метод посева используется при количественном контроле качества жидких и полужидких питательных сред. Суспензию требуемого разведения тестовой культуры тщательно перемешивают, чтобы добиться ее однородности. Посевную дозу суспензии асептически помещают при помощи пипетки в пробирку с исследуемой питательной средой и перемешивают. Инкубируют в термостате при оптимальной для тестового штамма температуре.
Посев прямым поверхностным методом
Суспензию требуемого разведения тестовой культуры тщательно перемешивают, чтобы добиться ее однородности. Посевную дозу суспензии асептически помещают при помощи пипетки на поверхность заранее подготовленной питательной среды. Стерильным шпателем культуру распределяют по поверхности питательного агара, чтобы добиться равномерного распределения инокулята. После впитывания инокулята чашки переворачивают и инкубируют в термостате при оптимальной для тестового штамма температуре.
Дробный посев на поверхность агаровой среды
Дно чашки Петри делят на три-четыре сектора. Культуру петлей вносят в первый сектор и штрихами распределяют по его поверхности. Затем петлю стерилизуют в пламени горелки, остужают. Стерильной петлей касаются поверхности агара в засеянном секторе и затем проводят штрихообразный посев по поверхности среды во втором секторе. Петлю вновь прожигают и, как описано выше, засевают третий и четвертый секторы.
Рисунок не приводится.
Помимо указанных, при посеве допускается применять иные методы посева.
4.2. Качественный контроль
Данный вид контроля, основанный на оценке характера роста тестовых культур, проводят следующим образом: накануне исследования готовят тестовую культуру. Для этого ее высевают со среды хранения на пробирки со скошенным питательным агаром. Посевы инкубируют 18-24 часа при оптимальной для тест-штамма температуре.
Суточную агаровую культуру тестового штамма пересевают в контролируемые жидкие, полужидкие или плотные питательные среды с помощью общепринятых методик. Для плотных сред метод посева должен обеспечить получение изолированных колоний микроорганизмов. Пробирки и чашки с посевами инкубируют при оптимальном для тест-штамма режиме.
Оценка результатов качественного контроля
Среду считают пригодной, если по истечении срока инкубации тестовый штамм дает хорошо различимый рост со всеми типичными для него отличительными признаками, которые предполагается выявлять на данной среде. Этими признаками могут быть: помутнение жидкой или полужидкой среды, изменение цвета, образование газа, при этом должны наблюдаться характерные структура и окраска колоний, наличие и диаметр зоны изменения цвета, прозрачность среды вокруг колоний.
4.3. Количественный контроль
Количественный контроль питательных сред проводится по следующим показателям:
1) влияние питательной среды на типичность микроорганизмов;
2) ингибирующие свойства среды;
3) эффективность среды;
4) показатель чувствительности среды.
Показатели количественного контроля питательных сред могут варьировать в зависимости от вида и назначения питательной среды. Показатели, по которым проводится контроль сред в зависимости от их назначения, представлены в таблице 2.
Таблица 2
ОСНОВНЫЕ ГРУППЫ ПИТАТЕЛЬНЫХ СРЕД И ПОКАЗАТЕЛИ, ПО КОТОРЫМ ПРОВОДИТСЯ ИХ КОЛИЧЕСТВЕННЫЙ КОНТРОЛЬ
|
Питательные среды |
Влияние питательной среды на типичность микроорганизмов |
Ингиби рующие свойства среды |
Эффек тив ность среды |
Чувст витель ность среды |
|
Основные общеупотребительные среды (плотные, полужидкие, жидкие): МПА, МПБ, МПЖ, ПЖА, б-н Хоттингера и др. |
+ |
+ | ||
|
Обогащенные среды: сывороточный агар и кровяной агар, сывороточный бульон |
+ |
' |
' |
+ |
|
Дифференциально-диагностические питательные среды: среда Эндо, среда Левина, агар Плоскирева, и др. <*> |
+ |
+ |
+ | |
|
Элективные (избирательные среды): | ||||
|
- жидкие среды |
+ |
+ |
+ |
+ |
|
- плотные |
+ |
+ |
— |
+ |
|
Среды для культивирования анаэробов |
+ |
+ |
- |
+ |
<*> Для сред Гисса проводится только качественный контроль.
4.3.1. Определение влияния питательной среды на типичность роста микроорганизмов
Влияние питательной среды на типичность тестовых культур определяют путем сравнения свойств, характерных для данного тест-штамма, с характеристиками тестовой культуры, полученными при культивировании на испытуемой среде.
Оценку влияния питательной среды на типичность проводят по культурально-морфологическим и биохимическим признакам.
При оценке характера роста культур в жидких средах учитывают степень помутнения среды, формирование пленки на поверхности среды или кольца, придонно-пристеночный рост, образование осадка и другое. В полужидких средах - равномерное зональное помутнение среды, рост по уколу, сталактитовый рост, в виде елочки и другое; на плотных средах - форму, структуру, характер роста колоний, диаметр.
Методом световой микроскопии определяют морфологию микроорганизмов - форму (кокки, палочки), наличие полиморфизма, размер, отношение к краскам, расположение (одиночное, парное, гроздевидное, цепочки и др.), наличие структурных элементов (капсул, жгутиков, спор, включений и др.), подвижность.
При оценке биохимических свойств учитывают способность ферментировать углеводы, образовывать сероводород, индол, наличие токсинообразования, гемолиза, пигментообразования и др. Данные свойства определяют по общепринятым методикам. При изучении биохимических свойств отбирают не менее 3 колоний с чашки.
4.3.2. Определение ингибирующих свойств среды
Показатель ингибирующих свойств характеризуется:
- минимальным разведением культуры, при посеве из которого полностью отсутствует рост и (или) проявление типичных свойств посторонней микрофлоры на испытуемой среде при его наличии на среде выращивания (ингибирующие свойства);
величиной отношения среднего числа сформировавшихся колоний тест-штамма на "неингибиторной" среде (среда выращивания) к среднему числу колоний на испытуемой "ингибиторной" среде (показатель ингибиции) с учетом разведения.
Ход определения.
Ингибирующее действие плотных сред определяется в отношении микроорганизмов-ассоциантов, путем посева по 0,1 мл микробной взвеси из соответствующего разведения культуры на 3 чашки с испытуемой средой и на 3 чашки со средой выращивания используемого штамма. Микроорганизмы-ассоцианты, то есть те микроорганизмы, рост которых подавляется на данной среде, указываются в паспорте среды. Степень разведения культуры зависит от штамма и степени ингибиции конкретной среды, что также указано в паспорте среды.
Ингибирующее действие жидких/полужидких селективных (элективных) питательных сред определяют, используя монокультуры и смеси культур. Оценку качества таких сред проводят в сравнении с "нулевым" посевом, т.е. посевом из контролируемой среды без соответствующей инкубации на среду выращивания.
Для этого добавляют в 2 - 3 пробирки с испытуемой питательной средой по 0,1 мл микробной взвеси из определенного разведения культуры микроорганизма-ассоцианта и после пипетирования среды осуществляют посев по 0,1 мл взвеси из каждой пробирки на три чашки с плотной питательной средой, оптимальной для используемого штамма ("нулевой посев").
Затем посевы (и в чашках, и в пробирках) инкубируют при соответствующих условиях, после чего содержимое каждой из трех засеянных пробирок с жидкой/полужидкой средой перемешивают и повторно высевают по 0,1 мл на три чашки с плотной питательной средой. Посевы инкубируют в тех же условиях.
Показатель ингибиции для жидких/полужидких селективных сред выражают отношением среднего числа колоний, образовавшихся на плотных средах при "нулевом посеве", к среднему числу колоний на той же среде после инкубирования посевного материала в жидкой питательной среде.
4.3.3. Определение эффективности питательной среды
Эффективность среды - выход микробных клеток из 1 мл питательной среды (в млрд./мл) и прирост числа микроорганизмов относительно засеянного (показатель эффективности).
Оценку качества накопительных питательных сред по показателю эффективности производят путем подсчета количества микробных клеток в среде после соответствующей инкубации.
Ход определения
В жидких/полужидких средах обогащения определение эффекта накопления проводят по методике, описанной для определения показателя ингибиции. Из
-4 -5 -6 -7
соответствующего разведения культуры (10 ,10 ,10 ,10 ), по 1 мл
взвеси вносят в 3 пробирки с 9 мл жидкой/полужидкой испытуемой накопительной средой.
Содержимое пробирок перемешивают и из каждой пробирки производят высев по 0,1 мл взвеси культуры на 3 чашки с питательной средой, оптимальной для данного микроорганизма ("нулевой посев").
После соответствующей инкубации посевов в накопительной среде (3 - 6 часов и более), независимо от видимых изменений, из каждой пробирки после перемешивания производят высев на чашки с плотной питательной средой (по 0,1 мл на чашку). В случае обильного роста культуры в жидкой среде ее перед посевом на чашки необходимо развести. Степень разведения учитывают при обработке результатов.
Через 18 - 20 и более часов инкубации производят подсчет сформировавшихся колоний на чашках, засеянных из исходных взвесей культуры ("нулевой посев") и после обогащения в жидкой (полужидкой) среде в течение определенного времени.
Прирост числа микроорганизмов в накопительной среде в процессе инкубации посевов в течение соответствующего времени (t) определяют по формуле (%):
п х К t
Э =------,
п
0
где:
Э - показатель эффективности (прирост);
п - среднее число колоний на чашках после инкубации культуры в жидкой/ t
полужидкой накопительной среде;
п - среднее число колоний при "нулевом посеве";
0
К - степень разведения.
Оценка результатов
За положительный результат испытаний эффективности среды принимают кратное увеличение числа выросших колоний относительно "нулевой посев".
4.3.4. Определение показателя чувствительности питательной среды
Чувствительность среды - максимальное разведение культуры, обеспечивающее визуально обнаруживаемый рост <*> колоний искомого штамма при культивировании в течение определенного времени и определенной температуре на всех засеянных чашках (пробирках) с питательной средой.
<*> О наличии роста микроорганизма судят как по формированию видимых колоний, так и по изменениям самой среды: помутнение, газообразование, появление осадка, пленки, изменение цвета.
По 0,1 мл микробной суспензии, из каждого разведения, высевают на три подсушенные чашки Петри (или пробирки) с плотной средой или в три пробирки с 10 мл жидкой/полужидкой питательной средой (при посеве в жидкие/полужидкие питательные среды обогащения посевная доза может составлять 0,5 или 1,0 мл микробной взвеси в каждую пробирку с 9,5 или 9,0 мл среды соответственно).
Посевы помещают в соответствующие условия.
После инкубации производят учет результатов.
Учет результатов: для плотных сред - через 12 - 24 - 48 часов инкубации; для жидких (среды обогащения) и транспортных (до посева на среду выращивания) - через 3 - 6 часов и далее.
В случае отсутствия визуально обнаруживаемого роста (для подтверждения его наличия) в жидких средах обогащения после соответствующей инкубации посевов, из каждой пробирки производят высев на чашки с питательным агаром, разделенной на 4 - 8 секторов, на каждой из которой засевают по одной бактериологической петле (d - 2 мм) культуры из каждой пробирки со средой.
Оценка результатов
За чувствительность питательной среды принимают показатель максимального разведения культуры, дающего рост микроорганизма в испытуемой среде. Среду считают пригодной, если по истечении срока инкубации тестовый штамм дает хорошо различимый рост со всеми типичными для него отличительными признаками.
5. Действия при выявлении несоответствий при контроле питательной среды
При обнаружении нарушений требований к питательным средам при их поступлении в лабораторию, таких как:
- отсутствие этикеток на упаковке;
- разгерметизация упаковки со средой;
- комкование среды;
- просроченной срок годности;
- несоответствие внешнего вида обезвоженной среды или отдельных компонентов описанию изготовителя;
- отсутствие лицензии на право производства и реализации данных питательных сред;
- отсутствие копии сертификата соответствия на реализуемую среду;
- отсутствие сертификата качества серии ИСО 9000 или EN 29000 для сред импортного производства;
- отсутствие сопроводительной документации;
- отсутствие паспорта отдела контроля организации-изготовителя на реализуемую серию препарата;
- отсутствие инструкции по применению, следует направлять рекламацию по адресу изготовителя или дистрибьютора.
Если питательные среды в процессе хранения в лаборатории стали комковаться, не соответствовать заявленным производителем требованиям, значит среды хранились в несоответствующих для них условиях (при повышенной влажности, при неплотно закрытой крышке, при длительном хранении банки без крышки) или были использованы после срока годности, то в данном случае производитель не несет ответственности за данные среды.
При получении неудовлетворительных результатов количественного контроля хотя бы по одному из пунктов, получен его неудовлетворительный результат, составляется рекламация на данную партию среды.
При неудовлетворительных результатах качественного контроля, среда данной варки для исследований не применяется и подлежит уничтожению. О полученном неудовлетворительном результате сообщается в отдел приготовления питательных сред и проводится количественный контроль серии безводной среды, используемой при варке. В случае получения неудовлетворительного результата количественного контроля, данная серия среды бракуется.
6. Требования к порядку и процедуре ведения эталонных бактериальных культур
Общие положения
Ведение эталонных культур должно обеспечивать максимальное сохранение типовых свойств штаммов, что достигается соблюдением принципов их культивирования, контроля и хранения.
Основные принципы ведения эталонных бактериальных культур:
- эталонные штаммы следует получать из официально признанной коллекции микроорганизмов (пункт
4.1);
- количество пассажей тестового микроорганизма на питательных средах с момента его восстановления до момента его целевого использования должно быть, по возможности, минимальным;
- движение культур с момента ее восстановления после лиофилизации до целевого использования