Методические указания по бактериологической диагностике сальмонеллезов животных
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Книга предназначена для ветеринарных врачей, фельдшеров, а также лаборантов ветеринарных диагностических лабораторий
Оглавление
Предисловие
1. Общие положения
2. Материал для исследования
3. Ход исследования материала
Посмертная диагностика
Прижизненная диагностика
Приложение 1. Рецепты рекомендуемых консервирующих смесей, питательных сред и индикаторов
Приложение 2. Методика испытания культур на чувствительность к О-бактериофагу
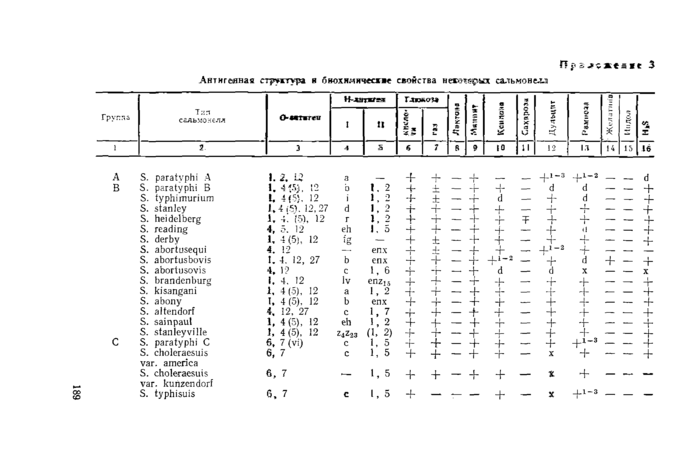
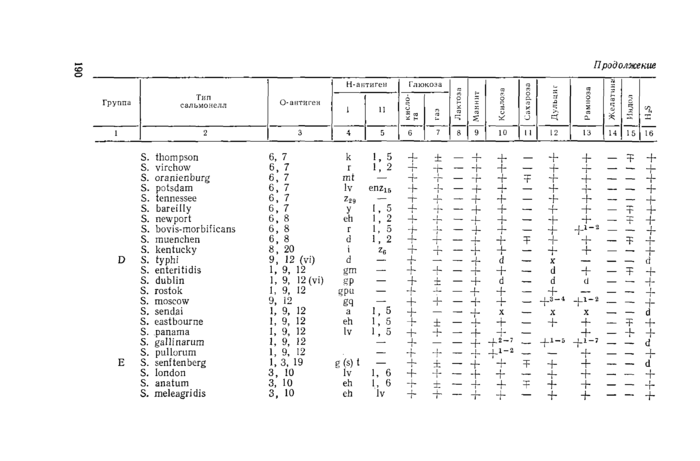
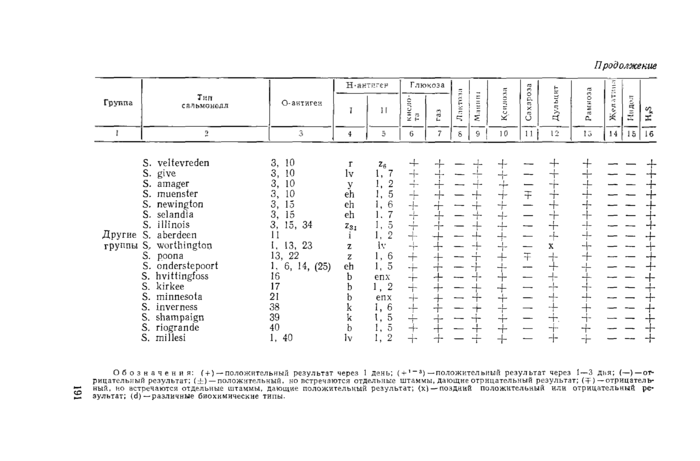
Приложение 3. Антигенная структура и биохимические свойства некоторых сальмонелл
Предметный указатель
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 30.12.1971 | Утвержден | Главное управление ветеринарии Минсельхоза СССР | |
|---|---|---|---|
| Издан | Агропромиздат | 1986 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
стр. 18
стр. 19
стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26
СПРАВОЧНИК
ЛАЮРАТОРНЫЕ
ИССЛЕДОВАНИЯ
В ВЕТЕРИНАРИИ
•
БАКТЕРИАЛЬНЫЕ
ИНФЕКЦИИ
Под редакцией Б. И. АНТОНОВА
МОСКВА АГРОПРОМИЗДДТ 1986
характерных колоний не получено, то при просмотре чашек с посевами из жидких питательных сред проводят отбор подозрительных колоний и исследуют в указанном выше порядке.
Если характерных и подозрительных колоний нет ни в чашках с прямыми посевами, ни в чашках с высевом из жидких питательных сред, дают ответ об отрицательном результате исследования.
Четтртый день исследования. Проводят учет ферментативной активности культур, нересеяиных накануне на цветной ряд, и сер о логи че-ск ое исследив а и и е и л,
Прижизненная диагностика,
L Исследован пе ф е к а л иИ
Первый день исследования (посев материала па питательные среды). Фекалии засевают в чашки Петри с плотными дифференциальными средами (Эндо, Плоек прев а, Левина, висмуг-сульфитвый агар).
Так как не все серологические тйпы сальмонелл од ш га кон о хорошо растут на упомянутых средах, посев следует проводить на две чаш км с двумя различными средами. На каждую чашку следует брать новую порцию посевного материала в таком, количестве, чтобы получить изо-лированнын рост колоний.
Если фекалии доставлены в консерванте, то капли взвеси наносят пастеровской пипеткой на поверхность дифференциальных питательных сред, у креп чашки, тщательна растирают стекляш-гым шп;а;гелем ага небольшой площади, а зятем, оторвав шпатель от п it г а тельной среды, не п рожи пей его, дел шот посев па остальной поверхности среды.
Фекалии, доставленные без консерванта, суспендируют в фи а кол о* ги чес к ом растворе в соотношении I :: 10, отстаивают в течение 20—30 мин я сегат из верхнего слоя: надосадочнон жидкости, как указано выше.. Учитывая, что такие ьд активные среды, как среда Плоски ревя и ииемут-сульфитный агар, подавляют рост кишечных сапрофитов, целесообразно уаелииить количество посевного материала на этих средах в 2—3 раза по сравнению со средами Эндр и Левина,
Н со 6 ходи м ы м уел о он ем для т > л у ч ш з и я и зол и р он а и н. ы х кол он и й является отсутствие конденсат на поверхности питательной среды., что достигается разливом среды, охлажденной до температуры 50=С, и ее шшеушнншнтем. Готовить среду лучше накануне.
Ьдмоиреметшо проводят посев фекалий в среды обогащения (селе-шггонзя. Кауфмана или Мюллера), при этом соблюдают соотношение посевного материала к среде 1 : 5.
Засеянные чашки и пробирки помещают в термостат при температуре 37°С на 18—20 ч.
Учитывая возможность неудачи первичного посева (отсутствие роста или сплошной рост), материал хранят в холодильнике, пока не будут просмотрены чашки с посевами.
Второй день исследования. Через 18—24 ч просматривают посевы на чашках Петри и отбирают подозрительные колонии, а также делают высев из сред обогащения на чашки Петри с плотными дифференциальными средами.
При обнаружении т чашках роста типичных кол опий изучают 2—3 колош ж. а при: наличии подозрительных колоний изучают 3—5 колоний с каждой чашки. Изучаемые колонии, снимают и пересекают в пробирки па трех у г л вводную среду с мочевиной {рецепт среды см. в приложении) или короткий цветной ряд. (среды Гисса с глюкозой? лактозой, сахарозой, маннитом) и М.ПА. И а трехуглевод ну ю среду с мочевиной посев делают сначала штрихом' по скошенной поверхности, а затем уколом в глубину столбика.
182
Одновременно может быть проведена предварительная реакция агглютинации с салшонеллезкшш агглютинирующими сыворотками.
Третий день исследования. Изучают выделенные культуры по биохимическим свойствам, просматривают чашки Петри с посевами из сред обогащения и отбирают подозрительные колонии, которые Пересе-и.чют на трехуглеводную среду с мочевиной.
Сели характерных и подозрительных колоний нет в чашках с прямыми посевами, а также в чашках с высевом т сред обогащения, дают mwt об отрицательном результате исследования.
Изучение выделенных культур начинают с учета их ферментативной лктпкпоети на трехуглеводной среде с мочевиной (предварительно следуст убедиться в чистоте пультурьт),
На этой среде при ферментации глюкозы изменяется цвет среды в столбике, при ферментация лактозы и сахарозы — в скошенной части агара. Если при ферментации сахаров, помимо кислоты,образуется газ— и среде появляются пузырьки. При расщеплении мочевины изменяется цвет всей среды.
Если культуры, засеянные на трех углеводную среду с мочевиной, сбраживают лактозу, сахарозу, глюкозу с образованием газа (столбик и косяк — синие при применении среды с реактивом ВР), они принадлежат к разновидностям кшпечион па ланки. Если культура расщепляет мочевину (среда оранжевого цвета), она относится к роду протея.
Культуры, не расщепляющие лактозу, сахарозу и мочевину, иофер-ментщтощие глюкозу (столбик зеленое а т ^ гол у бш am г о цвета,, косяк — розовый], тдощштшцшы из спльмоцеллы. Такие культуры пересевают ini цщ':ишн ряд., и для определении серпводоцодв и и и до да — но МПБ или 1%-nyJo шштшшую воду.
Четвертый Оми* исследшиния. Проводят учет ферментзтпшкш активности культур, пересеямпых с трехугдсводной среды с мочевиной* и серологическое исследование их.. Таким образом, на четвертый день закапчивают исследование культур, ш.одеденных из первичного посева.
В тех случаях, когда сальмонелл из первичных посевов не выделено, проводят идштмфцкщшо культур,, высеянных накануне на трехугле-подпую среду с мочевиной, по ферментации лактозы, сахарозы, глюкозы и мочевины, Прц подозрении на наличие сальмонелл делают пересев иа Цветной ряд, а также МПБ или \% -иую пептонную воду для определении. сероводорода и индола.
Пятый день исследования. Проводят учет биохимических и серологических свойств культур, пересеянных накануне с трехуглеводнрй среды с мочевиной.
2. И. с с л е д о в а н и е кров и.
Первый день исследования. Кровь засевают в б—7 пробирок, и:ли 2—В флакона МПБ с 10—=20% бычьей желчи в соотношении посевного материала к среде 1:10. При. отсутствии желчи кровь может быть засеяна и обычный МПБ,
Посев крови следует проводить сразу же после взятия. Для посева также можно использовать сгустки крови (после измельчения).
Засеянные пробирки или флаконы помещают в термостат при температуре 37QG иа JS—-24 ч.
Второй день исследования. Через !8—.24 ч делают высев из бульона с желчью или обычного МПБ im чашки Петри с плотными дифференциальными средами. Засек иные жидкие среды продолжают инкубировать.
Третий Вень исследования. Просматривают посевы на дифференциальных средах и отбирают подозрительные колонии, дальнейшее изучение которых проводят, как описано выше.
183
При отсутствии роста подозрительных колоний делают- повторный высев из жидких сред на 2-, 5- и 7-е сут.
Дополнительные исследования. В случае выделения культур саль-монелл с отклонениями от типичных свойств для их окончательной идентификации проводят дополнительные исследования.
Эти отклонения могут быть следующими:
а) культура дает четкую реакцию агглютинации с О- и Н-сыворот-ками, но нетипична по ферментативным свойствам;
б) культура типична по ферментативным свойствам, но не агглютинирует или слабо реагирует с О- и Н-сальмонеллезиыми сыворотками.
В первом случае прежде всего необходимо убедиться в чистоте культуры, для чего проводят рассев ее на чашки Петри с МПА и одной из дифференциальных сред, затем отбирают 5—6 наиболее типичных колоний и изучают их биохимические свойства и серологическую характеристику.
Во втором случае необходимо проверить, не ян лягте я ли культура одной из раапстаидпостщ бактерий из рада эшернхнн с замедленной фер-межатнв.пой активностью. Для этого проводят посев культуры в среды Гнсса с лактозой н сахарозой, которые инкубируют в термостате пр и 37иС до 21 сут с ежедневным учетом результатов. Для болей быстрого
был в л е к и я фе р м: е ч та'п тип ш i а к тмин ос т з т к у л ьту р р еком сил у ете я а асе -ватъ а-iх в среды Гнсса с 4% лактозы и с. 4% сахарозы. Необходимо также проверить отношение таких культур к салицину (сальмонеллы не ферментируют салицин). Следует иметь в виду, что S. typhisuis не ферментирует маннит.
В случае, когда культура типична по своим ферментативным свой
ствам, но не дает четкой агглютинации, рекомендуются повторные пассажи культуры (4—5) па 10% -ный желчный бульон и скошенный агар, после чего проводят рассев на чашку Петри с МПА с последующим отбором типичных колоний.
испытать в отношении к сальмонеллез ному U-фагу согласно шзструшшм по его применению (см. приложение). Чувствительность культуры, к бактериофагу укапывает на. принадлежность ее к роду Salmonella..
При .серологической идентификации сальмонелл иногда возникает
Если культура не агглютинируется О- и Н-сыззороткамп, ее следует
трудность в определении жгутикового антигена или одной из его фаз, что может быть связано с угнетением или утратой Н-антиген а (потери подвижности) либо с преобладанием в популяции какой-либо одной фазы. При этом следует помнить, что для некоторых сальмонелл характерно отсутствие подвижности (S. pul!. о rum, S, gallinarum) или первой фазы (S, choleraesuis var. kunzendorf, S. typhimurium var. binus).
Для выявления специфической фазы жгутикового Н-антигена можно использовать феномен роения в чашках Петри по Свену — Гарду. Для чего исследуемую культуру в штде бляшки засевают в центр чашки с 0,8—1%-пым питательным агаром (см, приложение); К остуженному до 50°С агару (перед тем как залипают чашку) добавляют 2—3 капли агглютинирующей Н-сыворотки той фазы жгутикового антигена, которая была выявлена у данной культуры и которую желательно подавить. Через 24 ч инкубации при 37°С бактерии с искомой фазой Н-антигена оказываются на периферии макроколонии.
Если подозрительная на сальмонеллы культура имеющимися моно-рецепторными ейворотками не типируется, ее необходимо направить в вышестоящую лабораторию.
Следует отметить, чтоб идентификации культур, подозрительных на принадлежность к сальмонеллам, наиболее важное значение имеет под-
роГмюс изучение биохимических свойств (ферментация дульцита, ара-оинозы, рамнозы, раффинозы, салицина, адонита, инозита; расщепление мочевины, рост на бульоне Штерна, реакция Фогеса — Проскауэра и с м('|иловым красным). Использование в целях идентификации культур только метода агглютинации подозрительных колоний на стекле прямо г чашки первичного посева или даже со среды Ресселя может явиться не I очником серьезных диагностических ошибок, так как ряд бактерий других родов семейства Enterobacteriaceae (например, родов Escherichia и др.) могут иметь общие антигены с сальмонеллами.
В необходимых случаях проводят биологическое исследование. Наиболее восприимчивыми лабораторными животными являются белые мьшш (массой 15—18 г). Культуру вводят подкожно белым мышам в .ч • .:е 0,2—0,3 мл при концентр ши и 50—100 млн. микробных тел в 1 мл. Животные гибнут в сроки от 3 до 10 сут.
Диагноз на сальмонеллез основывается на зшшоотологических, клинических, патолого анатомических данных, а также результатах бактериологических и серологических исследований.
Приложение 1
Рецепты рекомендуемых консервирующих смесей, питательных сред
и индикаторов
1. Консервирующие смеси.
Глицериновая смесь. К 1 л физиологического раствора добавляют 0,5 л х. ч. нейтрального глицерина и устанавливают pH 8,0, добавляя 20% раствора фосфорнокислого натрия (Na2HP04).
Смесь стерилизуют в течение 15 мин при температуре 112°С. После стерилизации pH должен быть равен 7,6—7,8.
Фосфатная буферная смесь. На 1 л дистиллированной воды добавляют фосфорнокислого однозамещенного калия (КН2Р04) 0,45 г и фосфорнокислого двузамещенного (выветренного) натрия (Na2HP04) 5,34 г. Смесь разливают и стерилизуют в автоклаве при 1 атм в течение 30 мин.
2. Среды обогащения.
Селенитовая среда. Состав среды (г): натрий кислый селенистокислый (без примеси теллура) (NaHSe03)—4, пептон — 5, натрий фосфорнокислый двузамещенный безводный (Na2HPC>4) — 7, йатрий фосфорнокислый однозамещенный (NaH2PG4)—3, лактоза (химически чистая) — 4, дистиллированная вода — 1000.
Приготовление среды. Среду готовят из двух основных растворов. Сначала экспериментально определяют точную пропорцию Na2HP04 и NaH3P04, которая с используемыми образцами пептона и кислого селенистокислого натрия давала бы pH не выше 7,0, что регулируется изменением соотношения фосфатов. Такую предварительную подтитровку необходимо делать всякий раз, когда меняется серия любого из входящих в среду основных ингредиентов (пептон, кислый ссленистокислый натрий, фосфаты). Когда такое соотношение установлено, к приготовленному раствору фосфатов добавляют пептон и лактозу.
Разливают во флаконы по 50 мл и стерилизуют текучим паром в течение 2 дн. По 30 Мин или при температуре 112°С в течение 30 мин.
Отдельно на стерильной дистиллированной воде готовят 10%-ный раствор кислого селенистокислого натрия. Перед началом работы на каждый флакон с 50 мл основного раствора добавляют 2 мл раствора кислого селенистокислого натрия. Приготовленную среду разливают в сте-
185
рильные пробирки по 5—7 мл и закрывают плотно пригнанными пробками. Стерилизация готовой среды не допускается.
Основной раствор среды может храниться в холодильнике в течение 1—2 мес. Раствор кислого селенистокислого натрия готовят ex tempore.
При использовании селенитовой среды для исследования мочи и молока среду следует готовить с удвоенным количеством входящих в нее ингредиентов, и исследуемый материал засевают в соотношении к среде 1:1.
Примечание. При использовании фосфатов с кристаллизационной водой количество их соответственно должно быть изменено.
Среда Мюллера. В стерильные флаконы отвешивают по 4,5 г мела, стерилизуют сухим жаром. Наливают в каждый флакон по 90 мл бульона и стерилизуют при 1 атм в течение 30 мин. В каждый флакон в асептических условиях ex tempore добавляют по 2 мл раствора Люголя и 10 мл раствора гипосульфита (серноватистокислого натрия — Na2S203).
Для приготовления среды Мюллера используют бульон из перевара Хоттингера, содержащий 130—150 мг% аминного азота. Очень важное значение имеет pH среды. В связи с тем что некоторые сорта мела вызывают довольно значительные изменения pH бульона после автоклавирования, следует обязательно проверить реакцию каждой новой партии среды после стерилизации для установления pH 7,2—7,4.
С этой целью достаточно провести проверку в одном из флаконов и определить необходимый для подтитровки данного количества среды объем кислоты (или щелочи).
Раствор Люголя: 100 мл дистиллированной воды, 20 г йодистого калия и 25 г йода.
Раствор гипосульфита: в измерительный цилиндр насыпают 50 г серноватистокислого натрия и добавляют дистиллированной воды до 100 мл, переливают в бутыль, стерилизуют текучим паром.
Среда Кауфмана. К 500 мл стерильной среды Мюллера добавляют 25 мл стерильной бычьей желчи и 5 мл 0,1%-ного водного раствора бриллиантового зеленого. Разливают в стерильные пробирки с соблюдением правил асептики. Стерилизовать не нужно.
Среда Киллиана. К 100 мл стерильного МПБ (pH 6,7—6,9, не выше 7,3) прибавляют 1 мл 0,1%-ного водного раствора бриллиантового зеленого и разливают по пробиркам.
Желчный бульон. К 800 мл МПБ добавляют 200 мл нативной желчи крупного рогатого скота, разливают, стерилизуют текучим паром 2 раза по 30 мин, pH готового бульона 7,5—7,6.
3. Дифференциальные питательные среды.
Среды Плоскирева, Эндо, Левина, висмут-сульфит-агар, а также среды с индикатором ВР и сахарами (глюкозой, лактозой, сахарозой или маннитом) выпускаются сухими, и их готовят по прописи, указанной на этикетке.
Трехуглсводная среда с мочевиной. Сухого препарата с лактозой и индикатором ВР берут 45 г, глюкозы х. ч,— 1,1, сахарозы х. ч.— 10, мочевины — 10 г, воды дистиллированной — 1 л. Смесь растворяют при нагревании до кипения и разливают в стерильные пробирки по 5—6 мл. Стерилизуют при 0,5 атм в течение 20 мин (загружать в горячий автоклав). Среду скашивают так, чтобы остался небольшой столбик (не менее 3 см высотой).
Л. Дополнительные питательные среды.
Среда с. повышенным содержанием лактозы. Состав среды: воды itIк шллпропаппой — 100 мл, пептона — 0,5%, хлористого натрия — 0.5, реактива Андрадэ—I, лактозы — 4%.
(Mrch растворяют, разливают в пробирки и стерилизуют при 0,5 .11 и п течение 20 мин .или текучим паром 3 дня подряд по .20 мни. Среду с повышенным содержанием сахарозы готовят аналогично. г -редо длп посева по Свену — Гарду: бульона мясо-исптош-юго или псроЕшра Хоттингера — 100 мл, агар-агара “ 0.5—0Й8%.
()'j м е 11 ii i I 11 отж атм и ага р - а га р доб ав.л я ют в бул ьо л, к и п ят я т до расплавления агар-агара, проверяют pH (7,2—7,4). Фильтруют через бумажный фильтр, разливают в стерильные большие пробирки по 20 мл. Стерилизуют при 1 атм в течение 30 мин.
Среда Штерна (глицерин-фуксин-бульон). К 100 мл МПБ (pH 7,2 7,1) добавляют 5—6 капель насыщенного спиртового раствора
or ионного фуксина, 2 мл свежеприготовленного 10%-ного водного рас тора иемьте грившего сульфита натрия и 1 мл глицерина. Бульон р.илипают и пробирки п дробно стерилизуют. Средд имеет золотисто-anviii.iii цвет, ее хранят в темноте не более 10—12 дн.
fljm'kt Питтеfm с рам нити. В 1 л дистиллированной йоды раствори kit 0,5 г трехосновного л тшшшцк целого натрия, 5 г хлористого натрия, U,05 г -пептона и 5 г рамнозы (нзодулышт). Жидкость кипятят, фильтруют, разливают в пробирки и дробно стерилизуют текучим паром 3 д|т подрал по Ш мни.
.Засеваю г ('роды с номощын иж'теропской пипетки одной каплей смыва (фп.шолощчеекпм распюрпм) суточной агаровой культуры. При добавлении к суточной культуре бактерий па среде Биттсра с рампозой 2 капель 0,5% ши о ешцпонош ржчпгфм меч ил рота она немедленно приобретает окраску: красную — мри максимально возможной кислотности, розовую или оранжевую — при меньшей кислотности, желтую — при рМ, близкой к 7.
Среду Бнттера с арабинозой готовят аналогично с добавлением соот-м( гот пующего сахара.
5. Прш отопление индикаторных бумажек.
Па ипдал. ('мети мают и а ради мстпламидобепзальдегид (3—5 г), '> г и гк им я и спирт {М)“ ni.iii (50 мл), фосфорную кислоту (очищенную кон-ш и I рмропаппую) (10 мл),
. tiiicM даюг рас i норм i ься порошку. ]1олучешюй тепловатой жидки, мао смачивают полоски фильтровальной бумаги, высушивают и нарезают узкими полосками.
Цвет бумажки — желтый. При наличии индола цвет бумажки меняется от сиренево-розового до интенсивно малинового. Появление других ни? той и а шщжштщной бумаге не учитывают.
Па, щпмодорт)' Лист фпльтршалынш бумаги смачивают в следующем растворе: дистиллированной воды — 100 мл, уксуснокислого свинца— 20 мл, дву угле к и слой сады— 1 г.
Бумагу высушивают, нарезают полосками. После обработки бумага остается белой, при наличии сероводорода — чернеет.
Приложение 2
Методика испытании культур на чувствительность к О-бактериофагу
Две капли -1 или 18-часовой бульонной культуры испытуемого штамма (можно использовать взвесь суточной агаровой культуры на физиологическом растворе) наносят топко оттянутой пастеровской пи-
187
леткой па хорошо подсушенный .МПА. (pH 7,2—7,4) в чашке Потри* После подсыхании: на одну из капель, петлей или пастеровской пипеткой мен мл его диаметра наносят О-бактериофаг, а. на другую в качестве контроля — каплю бульона..
Фаг нанося.! н срази еденный или в разведенки I. : 5 {в завис и мости, от указанна на этикетке)., На одной чашке, таким образом, можно испытать одновременно 8—J0 культур* Чашку с наиссеимымн культурами н О-бактериофагом помещают па 18—20 ч в термостат при 37°С, после ' [ е го у чмты в аетс я р ел у л ьта т. Пол ож и тел 1>;ы ы й рез у л ь1 i ат рея к ци и и р и появлении на месте, нанесения фага четко очерченной зоны слёшпого лизиса оцени иают т\ -|--|Н—|-, при наличии отдельных негативных колоний, отчетливо видимых глазом, в зависимости от их количества реакцию оценивают на Н—|—К И—К +*
При отсутствии лизиса в местах нанесения фага будет сплошной рост культуры, как в контроле.
О-фаг может также быв ь нс пользой до i дли предварительного испытания культуры. Для этого подозрительные колонии, выросшие на. ч аш ке с д ифференци ал ьи ой цр едой 111л ос кп р с в а, Эндо, и нем у г - су л ьфн -тным агаром ч др.), снимают и .пересевают на один т секторов чашки Петри с МПА (pH 7,2—7,4), В центре каждого засеянного сектора тонкой пастйроаскон пн печкой или пе глей наносят каплю О-фа г э,. чаянии помещают в термостат и па следующий день проводят учет результатов. На одной чашке одновременно может быть испытано 5—6 колоний.
Культура, лизировавшаяся фагом, является подозрительной на сальмонвдлсзиую и может быть прямо с чашки испытана в реакции агглютинации с поливалентной еальмонеллезной сывороткой. В случае положительного результата реакций агглютинации культуру засевают на скошенный агар и на пестрый ряд для изучения биохимических свойств и антигенной структуры (с помощью сальмонеллеэных моно-рсцепторных сывороток), без чего не представляется возможным деть око н ч ятел ы г ы й пун ет о гарии аллеле и ост ея зс у л ьту р ы к о л р сд ел е е j. i. i ому серологическому типу рода сальмонелла. Культуры, не чувствительные к О-бактериофагу, подлежат также дальнейшему изучению (биохимическому и серологическому). Большую помощь О-фаг может оказать при и зу ч ей и и атн и и ч j i ы х , г р у дно ди а ги ости р у омы х к у л ьту р. Ати п и я и ые сальмонеллез ные культуры: в большинстве случаев чувствительны к Онфагу, в то время как культуры, лишь сходные с сальмонелл шивши по биохимическим свойствам (и а пример, лактазопегаткшше Е. col Г), как правило, не лизируются этим фагом.
С ал ьмо пел л ез tti j й О-б а ктери офа г в качестве э ксп ер и мента л ь i т ого препарата готовится в отделе эпидемиологии кишечных инфекций Центрального научно-исследовательского института эпидемиологии Министерства здравоохранения СССР (Всесоюзный сальмонеллезный центр).
П уь >ъж* 3
|
Антнгеявая ст^хтура н бвохнмичесжве свойства некотарых сальмонелла | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
|
А |
S. paratyphi А |
i. |
7 »т |
a |
— |
+ |
+ |
— |
_L |
— |
— |
+ l-3 |
+ l-2 |
— |
— |
d | |
|
В |
S. paratyphi В |
i. |
12 |
b |
I. 2 |
+ |
± |
— |
+ |
+ |
— |
d |
d |
— |
— |
+ | |
|
S. typhimurium |
i. |
4 f 55, 12 |
i |
1, 2 |
± |
— |
+ |
d |
— |
+ |
d |
— |
— |
+ | |||
|
S. Stanley |
i. |
4 ,'5V 12,27 |
d |
1, 2 |
+ |
+ |
— |
+ |
+ |
— |
+ |
1 |
— |
— |
+ | ||
|
S. heidelberg |
l. |
4: (51, 12 |
г |
1, 2 |
+ |
+ |
— |
+ |
+ |
=F |
_L |
+ |
— |
— |
+ | ||
|
S. reading |
4, |
5. 12 |
eh |
). 5 |
+ |
+ |
— |
+ |
+ |
— |
+ + |
(i |
— |
— |
+ | ||
|
S. derby |
1, |
4’(5)7 12 |
*g |
— |
+ |
± |
— |
+ |
+ |
— |
+ |
— |
— |
+ | |||
|
S. abortusequi |
4. |
12 |
enx |
-f- |
± |
— |
f |
+ |
— |
+1-2 |
—L 1 |
— |
— | ||||
|
S. abortusbovis |
I. |
4,'12, 27 |
b |
enx |
~T |
+ |
— |
+ |
+ l-2 |
— |
+ |
d |
+ |
— |
+ | ||
|
S. abortusovis |
4, |
1? |
c |
1, 6 |
( T |
—. |
+ |
d |
— |
d |
X |
— |
X | ||||
|
S. brandenburg |
1. |
4. 12 |
Iv |
enzi.5 |
~r |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | ||
|
S. kisangani |
1, |
4(5), 12 |
a |
1, 2 |
+ |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | ||
|
S. abony |
I. |
4(5), 12 |
b |
enx |
+ |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | ||
|
S. altendorf |
4, |
12, 27 |
c |
1, 7 |
+ |
+ |
— |
+ |
+ |
— |
+ |
— |
— |
+ | |||
|
S. sainpaul |
1, |
4(5), 12 |
eh |
1, 2 |
+ |
+ |
— |
И" |
+ |
— |
+ |
+ |
— |
— |
+ | ||
|
S. Stanleyville |
1, |
4(5), 12 |
Z4Z23 |
(1. 2) |
~t~ |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | ||
|
С |
S. paratyphi C |
6, |
7 (vi) |
c |
1, 5 |
~b |
— |
+ |
+ |
— |
+ |
+X-3 |
— |
— |
+ | ||
|
S. choleraesuis |
6, |
7 |
c |
1, 5 |
+ |
+ |
— |
+ |
+ |
— |
X |
+ |
— |
— |
+ | ||
|
var. america S. choleraesuis |
6, |
7 |
r _ |
1, 5 |
+ |
+ |
_ |
+ |
+ |
_ |
% |
+ |
_ |
T- _ _ |
__ | ||
|
t—* |
var. kurizendorf | ||||||||||||||||
|
00 со |
S. typhisuis |
6, |
7 |
c |
1, 5 |
+ |
— |
— |
— |
+ |
— |
X |
+1-3 |
— |
— |
— |
CD
О
|
Продолжение | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
|
S. |
thorn pson |
6, |
7 |
k |
1, 5 |
4- J |
± |
— |
+ |
+ |
— |
+ |
+ |
— |
=F |
+ |
|
S. |
virchow |
6, |
7 |
r |
1, 2 |
+ |
— |
4~ |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
oranienburg |
6, |
7 |
mt |
— |
+ |
i _ |
— |
+ |
+ |
T |
+ |
+ |
— |
— |
+ |
|
S. |
potsdam |
6, |
7 |
lv |
enzl5 |
+ |
-L. |
— |
+ |
+ |
— |
+ |
4- |
— |
— |
+ |
|
S. |
tennessee |
6, |
7 |
z29 |
— |
+ |
T |
— |
+ |
+ |
— |
+ |
4~ |
— |
— |
+ |
|
S. |
bareilly |
6, |
7 |
У |
1, 5 |
+ |
+ |
— |
+ |
+ |
— |
f ~r |
+ |
— |
T |
+ |
|
S. |
newport |
6, |
8 |
eh |
1, 2 |
4- |
T |
— |
+ |
+ |
— |
+ |
+ |
— |
4= |
+ |
|
S. |
bovis-morbificans |
6, |
8 |
r |
1, 5 |
4- |
_u 1 |
— |
+ |
+ |
— |
+ |
J.l-2 |
— |
— |
+ |
|
S. |
muenchen |
6, |
8 |
d |
1, 2 |
+ |
[ T |
— |
+ |
+ |
T |
+ |
+ |
— |
=F |
+ |
|
S. |
kentucky |
8, |
20 |
i |
4 |
+ |
\ _ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ |
|
S. |
typhi |
9, |
12 (vi) |
d |
— |
+ |
— |
— |
+ |
d |
— |
X |
— |
— |
—. |
d |
|
S. |
enteritidis |
1, |
9, 12 |
gm |
— |
+ |
+ |
— |
+ |
+ |
— |
d |
+ |
— |
T |
~h |
|
S. |
dublin |
1, |
9, 12 (vi) |
gP |
— |
4~ |
± |
— |
+ |
d |
— |
d |
d |
— |
— |
+ |
|
S. |
rostok |
1, |
9, 12 |
gP“ |
— |
4~ |
-1- |
— |
+ |
+ |
— |
+ |
— |
— |
— |
4~ |
|
S. |
moscow |
9, |
12 |
gq |
— |
+ |
_L i |
— |
+ |
+ |
— |
+3-4 |
+1"* |
— |
— |
+ |
|
S. |
sendai |
1, |
9, 12 |
a |
1, 5 |
+ |
— |
—> |
+ |
X |
— |
X |
X |
_ |
— |
d |
|
S. |
eastbourne |
1, |
9, 12 |
eh |
1, 5 |
+ |
± |
— |
+ |
+ |
— |
+ |
+ |
— |
=F |
+ |
|
S. |
.panama |
1, |
9, 12 |
lv |
1, 5 |
~h |
+ |
— |
+ |
+ |
— |
+ |
— |
-L i |
+ | |
|
S. |
gallinarum |
1, |
9, 12 |
— |
_L |
— |
— |
+ |
-f2-7 |
— |
+1-5 |
+ l-7 |
— |
— |
d | |
|
S. |
pullorum |
1, |
9, 12 |
— |
+ |
+ |
— |
+1-2 |
— |
— |
+ |
— |
— |
+ | ||
|
S. |
senf ten berg |
1, |
3, 19 |
g(s) 1 |
— |
+ |
± |
— |
+ |
+ |
~r T |
+ |
+ |
— |
— |
d |
|
S. |
london |
3, |
10 |
lv |
1, 6 |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
anatum |
3, |
10 |
eh |
1, 6 |
+ |
± |
— |
+ |
+ |
T |
+ |
+ |
— |
— |
т |
|
S. |
meleagri dis |
3, |
10 |
eh |
lv |
4~ |
+ |
— |
i T |
4- |
— |
4- |
-h |
— |
— |
4- |
Продолжение
|
Группа |
Tim са.ч ьмсыёлл |
О-антиген |
Hi" ea:H |
Til ген |
Глюкоза |
S |
u X- |
! Сахароза |
b K >> n |
та n 9 ! ^ CC О, |
N- й |
m Ж. 1 X | ||||
|
T |
1 J 1 |
1 ^ ь |
n c3 £- | |||||||||||||
|
I |
2 |
3 1 |
4 1 , |
□ |
6 |
7 |
8 |
9 |
] 0 |
11 |
12 |
13 |
H |
16 |
1 6 | |
|
S. |
veltevreden |
3, 10 |
г |
z6 |
_ I p |
+ |
+ |
+ |
+ |
-h |
+ | |||||
|
S. |
give |
3, 10 |
lv |
1, 7 |
-L 1 |
+ |
— |
1 |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
amager |
3, 10 |
У |
1, 2 |
1 |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
muenster |
3, 10 |
eh |
1, 5 |
-L 1 |
+ |
— |
+ |
+ |
T |
+ |
+ |
— |
— |
+ | |
|
S. |
newington |
3, 15 |
eh |
1, 6 |
1 |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
selandia |
3, 15 |
eh |
1. 7 |
) 1 |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
Illinois |
3, 15, 34 |
z34 |
I, 5 |
~r |
+ |
— |
+ |
“b |
— |
+ |
+ |
— |
— |
+ | |
|
Другие S, |
aberdeen |
11 |
i |
1, 2 |
1 1 |
-f |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
-j- | |
|
группы S, |
Worthington |
1, 13, 23 |
z |
lv |
1 |
+ |
— |
+ |
+ |
— |
X |
+ |
— |
— |
+ | |
|
S. |
poona |
13, 22 |
z |
1, 6 |
+ |
+ |
— |
i 1 |
+ |
T |
+ |
+ |
— |
— |
4- | |
|
S. |
onderstepoort |
k 6, 14, (25) |
eh |
1, 5 |
1 1 |
+ |
— |
+ |
+ |
— |
+ |
+ |
—■ |
— |
+ | |
|
S. |
hvittingfoss |
16 |
b |
enx |
1 T |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
kirkee |
17 |
b |
1, 2 |
+ |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
minnesota |
21 |
b |
enx |
1 |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
Inverness |
38 |
k |
1, 6 |
+ |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
shampaign |
39 |
k |
1, 5 |
[ 1 |
+ |
— |
+ |
4~ |
— |
+. |
+ |
— |
— |
+ | |
|
S. |
riogrande |
40 |
b |
1, 5 |
1 1 |
+ |
— |
+ |
+ |
— |
+ |
+ |
— |
— |
+ | |
|
S. |
millesi |
1, 40 |
lv |
1, 2 |
1 1 |
+ |
— |
_L 1 |
+ |
— |
+ |
+ |
— |
— |
+ | |
Обозначения: (+ )— положительный результат через 1 день; ( +1 “3) —положительный результат через 1 — 3 дня; (—)—отрицательный результат; (±) — положительный, но встречаются отдельные штаммы, дающие отрицательный результат; (Т) —отрицательный, но встречаются отдельные штаммы, дающие положительный результат; (х) —поздний положительный или отрицательный результат; (d)—различные биохимические типы.
ББК 48.73 Л 12
УДК 619:616.9—08 (031)
Составители: В. И. Лнтошх?, В. В. Борисова, Я. М. Волкова, Л. Я. Каменева, Л. Я. Кошеленко, Г. Л. Михальский, В. В. Поповцев, Л. Я. Прянишникова, В. Е. Храпова
Лабораторные исследования в ветеринарии. Бакте-Л12 риальные инфекции: Справочник/Сост. Б. И, Антонов, В. В. Борисова, П. М. Волкова и др.; Под ред. Б. И. Антонова.— М.: Агропромиздат, 1986.— 352 с.
В книге даны методы лабораторных исследований патологического матер нала с целью определении возбудители инфекционной болезни Она изложены но единой схеме; бактериологические п блктгриоскоп ичсск но исследовании, био проба, идентификация и дифференциация возбудителей. Методы унифицированы и гтандартнэнрованы.
Для ветврачей и фельдшеров, л я бор ниток ветеринарных лабораторий.
3805020000—079 ББК 48.73
Л 035(01)—86
© ВО «Агропромиздат», 1986
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
|
Агар глкжозо-кровяной 227 — дрожжевой 27 — картофельный 82 — кровяной 230 — молочно-солевой 228 — мясо-пептон ный печеном no- глюк озо - глицериновый (МПП1ТА) 82 — печеночно-аминопептидиый 85 — печеночн о-глюкозо-глицериновый (ГИТА) 82 — плоти ы й печейочно-сыворо-точпый 85 — полужидкий печеночно-сывороточный 85 — полужидкий с дефибриннро-ванной кровью 248 — сывороточпо-дскстрозный 85 — шоколадный 239 Бульон глюкозо-сывороточпый 227 — дрожжевой 27 — мисо-псптопиый печеночный (МППБ) 82 — печеночпо-глкжозо-глицери-новый 82 — с желчью 10%-ный 186, 227 — 40%-ный 230 Вода мясная 82 — печеночная 82 Выбор питательных сред 271 Гель агаровый 1%-ный 31 Дезагрегация ткани 314 Жидкость Карлу а 309 Индикатор для определения анаэробных условий 39 Консервирующая смесь глицериновая 185 --фосфатная буферная 185 Лизис желчью 225 |
Метод выявления калеулообра-зования 13, 14 — определения вирулентности сибиреязвенных культур 14 — флуоресцирующих антител (МФА) 189 Молоко с метиленовым синим 228 — с 0,02%-ныт метиленовым сипим 230 Обнаружение индола 217 Окраска мазков гематокенлил-эозином 309 — — по Козловскому 81 --ио методу Гипса 239 — — по Романовскому — Гнм-зе 309 — — по Стампу 81 --по Фельгену 309 --по Шуляку — Шину 82 Определение гемолитической активности 8 — концентрации углекислого газа 85 Получение и подготовка эритроцитов барана для постановки РСК и РДСК 86 Приготовление индикаторных бумажек 187 Раствор антибиотиков 272 — веронал-мединаловый буферный 329 — верее}]а 282 — гидролизата лактоальбумина 0,5%-ный 283 — гидролизата мышечных белков 0,3%-пып 282 — глицерина 216 — двууглекислого натрия 282 — дву хромовокислого калия 279 — поли этиленгликоля 326 — Тироде 281 — трипсина 283 — уксусной кислоты 282 |
347
ПРЕДИСЛОВИЕ
\\ деле выполнения решений партии и правительства по дальнейшему развитию животноводства, а также задач, поставленных Продо-ши|ы’ I пен пой программой страны, ветеринарной службе большую помощь оказывают ветеринарные лаборатории.
Ветеринарные лаборатории осуществляют диагностику инфекционных и паразитарных болезней животных, выявляют нарушения опмеил веществ в их организме, проводят исследования, направленные н I предупреждение отравлений, помогая тем самым специалистам сов--миоп, колхозов и других хозяйств успешно осуществлять лечебно-|||нн|шлактические мероприятия. От того, насколько своевременно tiiiniiTCH диагноз, разработаны и рекомендованы, профилактические и лечебные меры, зависит успех ликвидации болезней, сохранность ши одонья животных и повышение их продуктивности.
I Ьследнее время в лабораториях появилось много приборов и приспособлений, облегчающих труд специалистов и позволяющих проводить исследования на более современном и качественном уровне, с болы мой достоверностью. В связи с этим многие ранее действовавшие методические указания переработаны.
Кроме того, ежегодно для лабораторной практики предлагаются новые методы диагностики. В отечественной и зарубежной литературе ИМГ10ЯШЮ публикуется большое количество материалов о новых метола,ч исследований, предлагаются различные модификации существующих методик, вводятся дополнительные диагностические тесты.
Ветеринарные лаборатории в своей работе не могут использовать всего многообразия имеющихся в литературе методов исследования или и I за того, что они недостаточно апробированы, или из-за сложности применяемого оборудования. Иногда методы, предлагаемые различными авторами, при определении одних и тех же показателей дают несовпадающие результаты.
В связи с этим в справочник включены методы лабораторных исследований патологического материала, получаемого от больных, убитых или павших сельскохозяйственных животных, апробированные i Митральной ветеринарной лабораторией и утвержденные Главным у правлением ветеринарки Министерства сельского хозяйства СССР, К и и е ' а с од о р ж: и т методик ески е указ анн я п о ди агностике и: кфекдп ошшх Полезней бактериальной этиологии, а также методические указания по применению культур клеток в диагностических исследованиях.
Методики изложены по единой схеме: взятие и пересылка патологи-чм'кого материала, методы его обработки и обогащения; бактериоско-ипческие исследования, включая световую и люминесцентную микроскопию; выделение культур возбудителей инфекционных болезней на ниппельных средах; заражение лабораторных животных как с целью выделения чистой культуры возбудителя, так и определения степени ее наI(ценности; гистологические исследования; идентификация и дифференциация возбудителей с использованием различных методов; сероло-I пческие исследования для определения вида возбудителя.
3
Приведенные в справочнике методы лабораторных исследований унифицированы и стандартизированы. В широком смысле слова унификация и стандартизация подразумевают применение для различных исследований одних и тех же аппаратов, приборов, инструментов, посуды, реактивов, исключая, конечно, специальные методы исследования; применение стандартных (унифицированных) питательных сред и диагностикумов; разработку методических указаний по единой форме. Все это позволяет лабораторным работникам с меньшей затратой сил и средств, на высоком методическом и техническом уровне, качественно и в срок проводить диагностические исследования. Таким образом, стандартизация методов исследования явится способом наведения строгого тюрпдка в работе ветеринарных лабораторий.
Книга предназначена для ветеринарных врачей, фельдшеров, а также лаборантов в старин а рных диагностических л абораторн й.
В справочник не вошли материалы по диагностике туберкулеза., так как они пересматриваются и дополняются, поэтому их публикация будет осуществлена в последующих изданиях.
САЛЬМОНЕЛЛЕЗЫМетодические указания по бактериологической диагностике сальмонеллезов животных
(Рекомендованы Главным /правлением ветеринарии Минсельхоза СССР 30 декабря 1971 rj
1. Общие положения.
Сальмонеллезом болеют все виды животных, в том числе птица.
Возбудители сальмонеллезов относятся к роду Salmonella семейства Enterobacteriaceae. По культурально-морфологическим свойствам сальмонеллы являются грамотрицательными палочками, хорошо красятся всеми анилиновыми красками, не образуют спор и капсул, обладают^ как правило,, выраженной подвижностью, за исключением некоторых серологических типов и их вариантов (S. gallEuarum и др-), хорошо растут и а обычных питательных средах при pH 7,0—7,4, опти-м а л ьи а я тем п с р ату р а р ос т а — 3 7 ''С.
И а I ]л астм н ч атом ага р е с ал ьм оне л л ы об раз уют се р о о а то - б ел ы е с голубоватым оттенком колонии диаметром 1—3 мм S-, Е и промеж у* точной О (SR)-формы, Колонии S*-формы гладкие,. блестящие, кут пот lj образные, с ровными краями. Колонии R-формы матовые, с неровными фестончатым я краями и плоской неровной поверхностью-. Культуры в R-форме могут отличаться от культуры в S-форме также по биохимическим и серологическим свойствам.
Сальмонеллы характеризуются в целом следующими ферментативными свойствами: не ферментируют сахарозу, не разлагают адонит, подавляющее большинство не расщепляют салицин и не разлагают лактозу, не образуют индола, не расщепляют мочевину, не дают реакцию Фо-геса — Проскауера, дают положительную реакцию с метиловым красным, большинство продуцируют сероводород. Глюкозу быстро ферментируют все типы сальмонелл с образованием газа, однако встречаются штаммы S. typhimurium, S. typhisuis, S. derby, S. abortus-equi, S. thompson, S. dubiin, S. anatum, S. gallinarum, разлагающие глюкозу без образования газа. Подавляющее большинство сальмонелл ферментирует маннит.
Антигенная структура бактерий рода Salmonella очень разнообразна. У сальмонелл различают два основных антигенных комплекса: О-ан-
177
тигеи — еоман-Ечеекин, термоетабяльвын и Н-антиген — жгутиковый, терА1олкбнлы1мн. .Послш-шн имеет .две фазы: первую м вторую,
В ос кой у к л а сс к ф и к а пн к с а л ьмои ел л пол m vena их а к т и ген к а я структура, представленная в схеме Кауфмана — Уайта, по которой определяют группу н серотип возбудят ел.я. Но данной схеме п настоящее время насчитывают более 1.200 серотипов сальмонелл.
Возбудители сальмонеллезов у животных и птиц принадлежат про-имущественно ес серологическим- группам В» Clf Qt ЬьЕа:.
С р ел i-i к р у п т а о го. р огато гос кот а. л а t а б о л сер а с г i р о с т р a i m ш S, d и b Пп, S, typhi'iiuiriuni н др.
Сеиныё являются резервуаром бол иного числен различных серологических типов сальмонелл, среди которых наиболее распространены S. choJeraesuis, $. typliibuis, S, riubJiri, S. шпспсЬел н др,
У овец главным образом обнаруживают S. aboriusovis, S, typhirnun-ii:m, у лошадей—S- abortnseqnL у птиц — S. pul Jon пн, S. grdlm mi т, S> typliimurium, S, ana turn, S. I on don я др,, у пушных зверей — S. ty-pbimurimn, S, choleraesuis, S, dublnr
У собак о кошек обнаруживают весьма разнообразные типы сальмонелл, но наиболее часто серотипы, встречающиеся у сельскохозям-ств е и ны х жи в от и ы х*
У животных сальмонеллезы, могу г проявляться в виде, трех основных форм: первичные сальмонеллезы, вторичные и бдктерионоентель-етт.ю5 которое притекает без видимых клинических признаков.
Первичные сальмонеллезы характеризуются клиническими признаком и, св о не т пев .1 к ы м я о е т р еде л ен \ i ом у виду .ж п в отн ы х, и вью ы я аю тх я он р еде л е п. ны мк в ид а м i в с .ал ьм он ел л,
Вторичные сальмонеллезы /наслаиваются на основное заболевание и осложняют его (чума свш-ien, пас тер ел лез и др.,), .при этом характерные для оадшонедлевов клинические признаки обычно слабо выряжены или отсутствуют.
Бактерионосители сальмонелл — животные, которые, будучи внешне зл о р < ш ы м и. ш дел я ют б а кте р и з i с фе к ил i з я. м л, м оч о i\ - Вов и у трен и и х органах таких жииотешех возбудителя обнаруживают главным образом в печени (в желчи, слизистой желчного пузыря, .в лимфатических узлах печени), в мезентериальных лимфатических узлах, а также в содержимом слепой кишки.
Бактерионосители являются основным резервуаром езльмопедлезной мифекцнм i-е представляют особую опасность как источник инфекции не только для молодняка сельскохозяйственных же*потных» но также и как источил к юксикоянфекцли для людей при употреблении в шшу продуктов от таких животных.
2. Материал для исследования.
Для посмертной диагностики сальмонеллезов в лабораторию направляют свежие трупы, мелких животных и птиц, от трупов крупных животных — паренхиматозные органы или части их (печень с желчным пузырем и лимфатическими узлами,, селезенку, почку), мезентериальные лимфатические узлы, трубчатую кость; при подозрении ни хроническую форму от св я ней, кроме того, направляют слепую кишку с содержимым, и от телят— измененные участии легких; в случае аборта —-свежий, .плод.
Материал для исследования следует брать в возможно более ранние сроки после гибели животного (не позднее 12 ч). Не рекомендуется брать материал от животных, подвергавшихся лечению штгибшпшзмм.
'[’руны направляют в лабораторию а водонепроницаемой таре. Пробы
178
< Ч и ■' п г о 11 доставляют в чистой, по возможности стерильной посуде (ки-М1ГЧИПК отдельно от других органов) в свежем виде; при невозможности r>ui i|u)n доставки материал консервируют 30%-ным водным раствором глицерина.
./(ли прижизненной диагностики в лабораторию направляют фекалии, кровь, истечения из матки при абортах, а для серологического исследования по РА — сыворотку крови.
Период бдктернешЕИ при сальмонеллезах очень короткий* поэтому крут, для прижизненной диагностики необходимо брать в Наиболее ранние сроки заболевания {на I —46* день)* Кровь берут стерильным шприцем нэ яремной вены больного животного (теленка) в количестве б -10 мл. Посев на среды целесообразно проводить сразу же после взя-ши крови.
Для обнаружения сальмонелл пробы фекалий отбирают после дефекации из последней порции. При наличии в фекалиях крови, слизи,
1 ноя, пленок их необходимо включить в пробу. Можно брать фекалии непосредственно из прямой кишки с помощью стерильной стеклянной ректальной трубки (трубки Цимана) или деревянной палочки с ватным пли марлевым тампоном на конце. Отобранные пробы помещают в стерильную посуду.
При невозможности посева в. течение 3—4 ч фекалии помещают в пробирку с консервирующим раствором. В качестве консерванта примени ют глицериновую смесь о ли буферный раствор фосфорнокислых солей (pH 8,0). В пробирку наливают 5 мл консерванта* количество же опущенных фекалий должно составлять Чш обьша консерванта (при-итщ лепке. консервирующих растворов см. в приложении).
Исследование фекалий следует начинать в возможно более ранние сроки. Лишь в исключительных случаях допускается хранение материа-■па не более суток в холодильнике при 2—6°С.
3. Ход исследования материала.
Посмертная диагностика.
Первый день исследования. Посевы на питательные среды делают из кропи сердца, печени, желчного пузыря, селезенки, почки, измененных лимфатических узлов и кос/мюго мозга; при подозреЕгии на хроническое течение болезни делают дополнптелыпяс посевы из легких — от телят, слепой кишки — от свиней, измененных желтков яичника — от кур. Патологический материал засевают па МПБ, чашки Петри с МПА и одной из дифференциальных сред (Эндо, Плоски рев а, Левина, висмут-сульфитный агар). При подозрении на хроническое течение сальмонеллеза посевы обязательно проводят и на одну из сред накопления (селенитовая, Мюллера, Кауфмана, Килли an а).
Посев на чашки делают кусочком исследуемого органа. Для этого поверхность органа прижигают шпателем, а затем отрезают стерильными ножницами. На каждую чашку берут новую порцию любого посевного материала. На МПБ посев производят пастеровской пипеткой.
Посевы также можно делать из суспензии, для чего кусочки органов тщательно растирают в стерильной ступке (кишечник отдельно от других органов), заливают физиологическим раствором хлорида натрия is соотношении 1 : 4—1 : 5, полученную взвесь отстаивают 20—30 мин и из верхней части надосадочной жидкости делают посевы пастеровской пипеткой.
Засеянные пробирки и чашки помещают в термостат при температуре 37°С на 18—20 ч.
179
Наряду с высевом на питательные среды проводят микроскопическое исследование методами световой и люминесцентной микроскопии.
Для световой микроскопии мазки готовят из трупного материала и органов абортированных плодов и окрашивают по Граму.
Для исследовании методом флуоресцирующих антител готовят мазки-отпечатки из патологического материала и обрабатывают их согласно «Наставлению по лабораторной диагностике рожи свиней, листе-риоза, вибриоза и сальмонеллезов сельскохозяйственных животных с помощью флуоресцирующих сывороток».
Второй день исследования. Через 18—24 ч просматривают посевы на плотных средах в чашках Петри и отбирают подозрительные колонии, а также делают высевы из жидких питательных сред на плотные дифференциальные среды..
Для отбора подозрительных колоний посевы на чашках со средами Эндо а Плоски рев а и Левина просматривают невооруженным глазом с помощью лупы в проходящем дневном или искусственном свете; посевы на чашках с висмут-сульфитным агаром просматривают в падающем свете.
Сальмонеллы на среде Эндо растут в виде прозрачных, слегка голубоватых нежных колоний, иногда слегка розоватых. На среде Плоски-рева они также бесцветны, но выглядят несколько более плотными и могут быть слогкд мупюшгшми. На среде Левина они прозрачные, иногда с небольшим фиолетовым оттек коде На висмут-сульфитном агаре почти все сальмонеллы растут в виде черных колоний с характерным металлическим блеском, при этом наблюдается прокрашиванием черный цвет участка среды под колонией. Исключение составляют сальмонеллы из группы С, которые при роете на висмут-сульфитном агаре образуют светлые нежные зеленоватые колонии. Просмотр чашек с- висмут-сульфитным агаром проводят через 24 и 4.8 ч после посева.
Рост на МПБ и МПА некоторых возбудителей сальмонеллезов животных имеет различия.
Возбудители сальмонеллезов телят, свиней и птиц на МПА в первые сутки роста образуют округлые колонии средней величины сероватого цвета с голубым оттенком в тонком слое среды. При длительном хранении культуры колонии становятся' мутноватыми, отдельные образуют слизистые валы.. МПБ мутнеет, впоследствии на дне пробирки образуется осадок, а на поверхности — часто пленка и пристеночное кольцо.
Возбудитель сальмонеллеза овец в отличие от других сальмонелл растет на питательных средах довольно скудно в виде просвечивающихся мелких колоний с приподнятым центром и радиальной исчерченно-стью без валика. На МПБ вызывает равномерное помутнение с незначительным осадком без пленки и пристеночного кольца. При добавлении к средам сыворотки крови (5—10%) или глюкозы (0,2%) рост улучшается,
Возбудитель сальмонеллезного аборта кобыл в МПБ образует равномерную муть со слизистым осадком, на МПА — серовато-белые колонии, легко снимающиеся петлей с поверхности агара, также могут образовываться и шероховатые, сухие, врастающие в среду колонии.
При обнаружении роста типичных или подозрительных колоний их исследование начинают с изучения морфологии в мазке, окрашенном по Граму. Все отобранные культуры пересевают ил цветной ряд, состоящий из полужидких или жидких с поплавками сред Г веса е глюкозой, лактозой, сахарозой, маннитом,, а также на МПБ или 1%-иую кептоиную воду для определения образования нидола и сероводорода, С этой целью под пробку в пробирку с бульшюм или пецтешшй водой помещают две ин-
180
кикаторшлс бумажки. При наличии индола соответствующая бумажка к I) ап i W, п р и выдй'Л енпи се р о во до р ода — другая бум а.ж к а чер г itifii (iipi!i’nTii?y[eiine индикаторных бумажек см., в приложении)- Определение индола можно проводить и с помощью реакции Эрлиха, Дли этого к 5 мл бульшшой культуры приливают 2 мл эфира, встряхивают и дают отсто-н!Еься. Затем подслои эфира пастеровской пипеткой подшш-пшот 0.5—
I мд реактива (парадимегпламидобетшальдегида — lt0 г, спирта 961'-ио-i'i’ 1.00 мл, соляной кислоты к, ч.— 20 мл). Образование красного кольца на границе эфира и бульона указывает на наличие индола.
Подвижность сальмонелл определяют при посеве культуры уколом в полужидкий агар (0,2% агар-агара) или при посеве в полужидкие среды Гпсса. Неподвижные микробы растут только по ходу укола, подвижные дают диффузный рост и помутнение всей среды.
Одновременно необходимо проводить реакцию агглютинации с моно рецепторными сальмонеллезными сыворотками.
' В случае выявления типичных серологических свойств дают предварительный ответ на сальмонеллез.
Третий день исследования. Проводят идентификацию выделенных культур по биохимическим свойствам на цветном ряду, изучение антигенной структуры в реакции агглютинации на стекле с монорецепторными сальмонеллезными сыворотками, просмотр чашек Петри с посевами из жидких питательных сред.
Если на цветном ряду обнаружены бактерии, не ферментирующие лактозу и сахарозу, ферментирующие глюкозу, не образующие индола, то такую культуру подвергают испытанию в реакции агглютинации на стекле с сальмонеллезными агглютинирующими поливалентными О-сыворотками групп В, Clf С2 DA, Е1( а в случае необходимости и других (редких) групп.
Реакцию агглютинации ставят следующим образом: на обезжиренное предметное стекло наносят каплю сыворотки, затем петлей вносят 20-часовую агаровую культуру и тщательно растирают ее. О-агглюти-нация наступает немедленно, и агглютинат имеет вид плотных, с трудом разбивающихся комочков и зернышек.
При получении положительной реакции с одной из поливалентных О‘ с ы в о р оток ста в ят р е а к i lh to я г г л юти л а ц и i i р зз дел ь и о с к а жд ой из О-сыворотоКл входящих в шушвзлщгтуш, для определения, я какой из групп по схеме Кауфмана — Уайта принадлежит культура.
После установления О-гругты такую культуру непмтывжот с ме> норецепториыми Нюыво ротками, сначала первой фазы, а затем — второй. При этом Н-сыворотки применяют в порядке, соответствующем распространению типов сальмонелл в данной местности. И-агглютинация наступает быстро, и агглютинат имеет вид крупных, рыхлых, легко разбивающихся хлопьев.
Для агглютинации с О-сыворотками культуру следует брать с верхней части скошенного агара, для агглютинации с Н-сыворотками — с нижней части агара, где расположены наиболее подвижные особи.
Б лаборатории нельзя готовить смеси из отдельных монорептор-ных О- и Н-сывороток, так как они не подлежат разведению.
Если выделенная культура обладает типичными морфологическими, культуральными и биохимическими свойствами и дает четкие результаты в реакции агглютинации с определенными монорецепторными сыворотками, дают ответ о выделении сальмонелл установленного серологического типа (характеристику биохимических и серологических свойств сальмонелл см. в приложении 3).
Если в первичных посевах на твердых питательных средах роста
181