Наставление по диагностике бруцеллеза животных (редакция 1982 года)
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
Предисловие
1. Общие положения
2. Взятие материала от животных и пересылка его для лабораторных исследований
3. Бактериологическая диагностика бруцеллеза
4. Методы серологической диагностики бруцеллеза
Приложение 1
1. Методы окраски бруцелл
2. Приготовление питательных сред
3. Определение концентрации углекислого газа
Приложение 2
1. Приготовление фенолизированных растворов хлорида натрия для РА
2. Приготовление физиологического раствора хлорида натрия с добавлением ионов магния и кальция (для РСК и РДСК)
3. Получение и подготовка к работе эритроцитов барана для постановки РСК и РДСК
4. Титрование комплемента в гемолитической системе в РСК
5. Титрование гемолизина
6. Бруцеллезные антигены, используемые в серологических реакциях
Предметный указатель
| Дата введения | 13.11.1991 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 30.12.1982 | Утвержден | Минсельхоз СССР | |
|---|---|---|---|
| Издан | Агропромиздат | 1986 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18
стр. 19
стр. 20
стр. 21

стр. 22
стр. 23
стр. 24
стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
СПВ4ВОЧНИК
ЛАБСШОРНЬЕ
ИССЛЕДОВАНИЯ В ВЕТШ/1НАРИИ
БАКТЕИ^АЛЬНЫЕ
ИНТЕКЦИИ
СПРАВОЧНИК
ЛАБОРАТОРНЫЕ
ИССЛЕДОВАНИЯ
В ВЕТЕРИНАРИИ
•
БАКТЕРИАЛЬНЫЕ
ИНФЕКЦИИ
Под редакцией Б. И. АНТОНОВА
МОСКВА АГРОПРОМИЗДАТ 1986
препараты. Молоко, консервированное генцианвиолетом, высевают на среды без бактериостатических веществ.
3.4.3. Для выращивания культур посевы помещают в термостат при 37—38°С.
При исследовании материала от крупного рогатого скота половину пробирок и чашек с посевом инкубируют в атмосфере с повышенным содержанием углекислого газа (10—15%), другую — в обычных атмосферных условиях.
ДЛя выделения возбудителя инфекционного эпидидимита баранов (бруцелла овис) все посевы инкубируют в атмосфере, содержащей 10—15% углекислого газа. Для создания атмосферы с повышенным содержанием углекислого газа пробирки с посевом заливают парафином или помещают в эксикатор (микроапаэростат). Перед парафинированием пробирки закрывают горящими ватными пробками, пронося последние над пламенем горелки. Затем верхнюю часть пробирки обрезают, а оставшуюся часть углубляют на 0,5—1 см внутрь пробирки и заливают расплавленным парафином.
Необходимое содержание углекислого газа в эксикаторе можно получить путем:
заполнения части объема углекислым газом из баллона или аппарата Киппа;
внесения бикарбоната натрия и серной или соляной кислоты (0,48 г бикарбоната натрия и 5 мл 25%-ного раствора серной кислоты или 0,4 г бикарбоната натрия и 0,35 мл концентрированной соляной кислоты на 1 л объема);
сжигания ваты, смоченной спиртом. При этом пробирки и чашки с посевами должны занимать не более половины объема эксикатора.
Для определения концентрации углекислого газа в эксикаторе можно использовать химический метод (см. приложение 1, п. 3).
3.4.4. Посевы выдерживают в термостате при 37—38°С в течение 30 дн. Первый просмотр посевов проводят через 18—24 ч. Пробирки с агаром и бульоном, заросшие посторонней микрофлорой, отбраковывают.
В дальнейшем для обнаружения роста бруцелл посевы просматривают каждые 3—4 дня визуально, при необходимости — через лупу или при малом увеличении микроскопа. При отсутствии роста часть поверхности агара орошают конденсационной жидкостью.
При значительном росте посторонней микрофлоры (80% и более пробирок с посевом) бактериологическое исследование прекращают.
Во время просмотра посевов обращают внимание на характер роста микробов. На поверхности агара бруцеллы образуют мелкие, блестящие, выпуклые, с ровными краями и гладкой поверхностью просвечивающиеся колонии, имеющие в отраженном свете голубоватый оттенок, в падающем — сероватый. С возрастом колонии мутнеют и приобретают более темную окраску, что связано с появлением пигмента.
В бульоне бруцеллы образуют равномерное помутнение и пристеночное кольцо, возвышающееся над уровнем бульона, а в дальнейшем — небольшой осадок на дне пробирки. В отраженном свете пристеночное кольцо имеет голубоватый оттенок.
При обнаружении роста на жидких средах и отсутствии характерного роста на агаре из каждой пробирки готовят мазки, которые окрашивают одним из специальных методов и делают пересев на чашку с плотной средой для выделения чистой культуры. Пересевы на чашках культивируют так же, как и высевы из патологического материала.
Выделенные культуры идентифицируют по типкториальным (окраска мазков по Граму и одним из специальных методов), морфологи-
ческим, культуральным свойствами в реакции агглютинации на стекле с позитивной бруцеллезной сывороткой.
При постановке реакции агглютинации на обезжиренное предметное стекло наносят каплю бруцеллезной сыворотки в разведении I : 50 и каплю той же сыворотки в разведении 1 : 2 (для выявления слабоагглю-тинабельных культур). В каждую каплю сыворотки бактериологической петлей вносят агаровую культуру и тщательно растирают ее. Одновременно ставят контроль с негативной сывороткой в тех же разведениях.
При положительной реакции через 1—3 мин в капле позитивной сыворотки образуются хлопья или комочки, а сама жидкость просвет^ ляется, что особенно заметно при покачивании стекла. В контроле наблюдается равномерное помутнение без образования хлопьев.
При отрицательной реакции агглютинации с культурой из одной колонии дополнительно исследуют не менее трех-четырех подозрительных колоний.
Культуры, обладающие типичными для бруцелл морфологическими, тенториальными и культуральными свойствами и дающие положительную реакцию агглютинаций с позитивной сывороткой, относят к бр у цел лам.
Первичные культуры возбудителя инфекционного эпидидимита баранов подвергают серологической и идентификации. Для этого проводят гипериммунизашио двух кроликов массой 2—3 кг путем двукратного с интервалом 7—8 дн. внутривенного введения им по 2 мл взвеси 2-суточной исследуемой культуры, содержащей 3—4 млрд, микробных клеток в 1 мл физиологического раствора. Через 10—12 дн. после второго введения от кроликов получают сыворотку крови и исследуют ее в реакции длительного связывания комплемента (РДСК) с овисным антигеном.
Культура возбудителя инфекционного эпидидимита баранов вызывает образование антител в крови кроликов (положительная РДСК). Отрицательный результат РДСК с овисным антигеном означает, что изучаемая культура не относится к возбудителю инфекционного эпидидимита баранов.
3.5. Биологическое исследование.
3.5.1. Биологическое исследование проводят на морских свинках (не менее двух) массой 350—400 г, предварительно проверенных на бруцеллез исследованием сыворотки их крови в РА с отрицательным результатом в разведении 1 : 5.
3.5.2. Для постановки биологической пробы используют тот же материал, что и для бактериологического исследования.
Из органов и содержимого желудка абортированного плода готовят суспензию на стерильном физиологическом растворе в соотношении 1 : 10 и вводят подкожно с внутренней стороны бедра морской свинке в дозе 1 мл.
Из плаценты и плодных оболочек (предварительно обработанных тампонами, смоченными дезинфицирующим раствором, и подсушенных сухими стерильными тампонами) вырезают кусочки размером 0,5Х X0,5 см, фламбируют их на пламени горелки, растирают в ступке со стерильным песком и заливают физиологическим раствором в соотношении 1 : 10. Полученную суспензию вводят морской свинке в дозе 1 мл.
Содержимое гигром (бурс) вводят морской свинке подкожно в дозе 0,2—0,3 мл. При этом необходимо учитывать возможность гибели животного от сопутствующей микрофлоры, особенно стрептококков.
Пробы молока центрифугируют 30 мин при 3000 об/мин. Морской
свинке вводят подкожно 2—3 мл материала из верхнего слоя (сливки) и осадка молока после центрифугирования.
3.5.3. На 15-, 25- и 40-й дн. после заражения у морских свинок берут I—2 мл крови из ушной вены путем надреза или из сердца путем пункции и сыворотку крови исследуют в пробирочной РА в разведениях от 1 : 10 до 1 : 80.
При положительной реакции агглютинации (в разведении 1 : 10 и выше) морских свинок убивают, в случае необходимости получения культуры возбудителя материал от них исследуют бактериологически. Высевы делают пастеровскими пипетками в одну пробирку с бульоном и в две пробирки с агаром из паховых, парааортальиых лимфатических узлов (правых и левых), селезенки (2 высева), печени и костного мозга. Посевы культивируют, как описано в подпунктах 3.4.3 и 3.4.4.
При отрицательной РА у морских свинок в указанные выше сроки биопробу считают отрицательной, подопытных животных убивают.
3.5.4. При выделении культуры бруцелл на питательных средах из исходного материала биологическое исследование по данной экспертизе прекращают, а ранее зараженных морских свинок убивают.
3.6. Результат исследования на бруцеллез считают положительным при выделении культуры возбудителя или при получении у морской свинки положительной РА в разведении сыворотки крови 1 : 10 и выше, если из исходного материала культура не выделена.
При положительных результатах бактериоскопии и отрицательных результатах бактериологического исследования и биопробы материал считают подозрительным на бруцеллез.
3.7. Сроки исследования: бактериологического — до 1 мес, биологического — до 2 мес.
3.8. В районных и межрайонных ветеринарных лабораториях все выделенные культуры бруцелл после их идентификации подлежат уничтожению путем автоклавирования при 1,5 атм в течение 1 ч.
3.9. При необходимости определения вида бруцелл, а также в целях дифференциации полевых штаммов от вакцинных выделенные от животных культуры направляют в республиканские, областные, зональные ветеринарные лаборатории или ветеринарные научно-исследовательские учреждения, в которых имеются лаборатории или отделы, занимающиеся изучением бруцеллеза животных и имеющие разрешение органов здравоохранения на работу с микроорганизмами второй группы.
4. Методы серологической диагностики бруцеллеза.
4.1. Серологическая диагностика бруцеллеза заключается в обнаружении специфических антител в сыворотке крови животных при помощи реакции агглютинации в пробирках (РА), реакции связывания комплемента (РСК), реакции длительного связывания комплемента на холоде (РДСК), пластинчатой реакции агглютинации с роз бенгал анти; геном (роз бенгал проба, РБП) и в молоке коров при помощи кольцевой реакции (КР).
4.2. Постановка и учет результатов реакции агглютинации в пробирках (РА).
4.2.1. Реакцию агглютинации в пробирках с бруцеллезным антигеном применяют при диагностике бруцеллеза у крупного рогатого скота, овец, коз, лошадей, буйволов, верблюдов, оленей, собак, пушных зверей и животных других видов.
4.2.2. Компоненты реакции агглютинации:
испытуемые сыворотки крови (см. подпункт 2.3.1);
позитивная бруцеллезная сыворотка, изготовленная биопредприя-
тием или полученная от больного бруцеллезом животного. На этикетке флакона с такими сыворотками указывают титры в РА и РСК и дату изготовления:
негативная сыворотка (сыворотка крови здоровых животных)# изготовленная биопредприятием или полученная в лаборатории;
антиген бруцеллезный, единый для РА, РСК и РДСК (см. приложение 2, п. 6);
раствор хлорида натрия. При исследовании сывороток крови крупного рогатого скота, лошадей, верблюдов, собак, пушных зверей и морских свинок для разведения испытуемых сывороток и антигена используют фенолизированный (0,5%-ный) физиологический раствор хлорида натрия (0,85%-ный), при исследовании сывороток крови овец, коз, буйволов — 5%-ный и оленей — 10%-ный фенолизированный раствор хлорида натрия (см. приложение 2, п. 1).
4.2.3. Постановка реакции агглютинации.
Реакцию агглютинации проводят в объеме 1 мл в четырех разведениях:
при исследовании сывороток крови овен, коз, буйволов, оленей и собак — 1 : 25, 1 : 50, 1 : 100 и 1 : 200;
крупного рогатого скота, лошадей и верблюдов — 1 : 50, 1 : 100# 1 : 200 и 1 : 400;
пушных зверей и морских свинок — 1 г 10, 1 : 20, I : 40 и 1 : 80.
При массовых исследованиях допускается постановка реакции в первых двух разведениях.
Разлив компонентов, реакции проводят индивидуальными мерными пипетками или групповыми дозаторами Флоринского.
Для исследования каждой испытуемой сыворотки крови требуется 5 пробирок. В пробирках первого ряда делают основное разведение. Для этого сыворотку крови крупного рогатого скота, лошадей и верблюдов берут в дозе 0,1 мл, вносят в пробирки и добавляют к ней 2,4 мл соответствующего раствора хлорида натрия (получают разведение сыворотки 1 : 25). Сыворотку крови овец, коз, буйволов, оленей и собак берут в дозе 0,2 мл и добавляют 2,3 мл соответствующего раствора хлорида натрия (разведение 1 : 12,5), а сыворотку крови пушных зверей и морских свинок берут в дозе 0,3 мл и добавляют 1,2 мл соответствующего раствора хлорида натрия (разведение 1 : 5). Таким образом делают основное разведение испытуемых сывороток в пробирках первого ряда штатива (по 10 проб в ряду).
После приготовления основного разведения сывороток в первом ряду в пробирки третьего, четвертого и пятого рядов вливают по 0,5 мл соответствующего раствора хлорида натрия. Затем из пробирок первого ряда при помощи группового дозатора Флоринского переносят в пробирки второго и третьего рядов по 0,5 мл основного разведения сывороток (1 : 25, 1 : 12,5 или 1:5). В пробирках третьего ряда сыворотки смешивают с раствором хлорида натрия, по 0,5 мл этого разбавления переносят в пробирки четвертого ряда и так же из пробирок четвертого ряда — в пятый. Из пробирок пятого ряда по 0,5 мл жидкости удаляют. Таким образом делают последовательные двукратные разведения одновременно 10 сывороток.
После этого в каждую пробирку второго, третьего, четвертого и пятого рядов с разведенными сыворотками вносят при помощи группового дозатора Флоринского или другого дозирующег(уустройства по 0,5 мл антигена, предварительно разбавленного в соотношении 1 : 10 соответствующим раствором хлорида натрия. После добавления антигена разведение сывороток в каждой пробирке удваивается и в зависимости
от вида исследуемых животных будет составлять соотношения: 1 : 50; 1 : 100; 1 : 200 и I : 400; 1 : 25; 1 : 50; 1 : 100 и 1 : 200 или 1 : 10; 1 : 20; 1 : 40 и 1 : 80.
В пробирки первого ряда бруцеллезный антиген не вносят, и они служат контролем качества сыворотки. При наличии хлопьев, фибрина, эритроцитов и посторонних примесей результаты реакции агглютинации не учитывают.
При массовых исследованиях сыворотки разливают индивидуальной ми кропипеткой (с грушей) или групповыми дозаторами Флоринского в две пробирки в дозах 0,02 и 0,01 мл (сыворотки крупного рогатого скота, лошадей и верблюдов) или 0,04 и 0,02 мл (при исследовании сывороток овец, коз, буйволов, оленей и собак). Затем в каждую пробирку по 1,0 мл антигена, разведенного соответствующим раствором хлорида натрия в соотношении 1 : 20. При этом разведения сывороток будут соответствовать соотношениям 1 : 50 и 1 : 100 или 1 : 25 и 1 : 50.
При постановке реакции агглютинации одновременно с испытуемыми сыворотками ставят контроли:
с негативной сывороткой в тех же разведениях, как с испытуемыми; с позитивной бруцеллезной сывороткой в разведениях до ее предельного титра.
После добавления к испытуемым и контрольным сывороткам антигена штативы с пробирками осторожно встряхивают и помещают в термостат при 37—38°С на 16—20 ч, затем выдерживают при комнатной температуре в течение 1 ч, после чего проводят учет реакции.
4.2.4. Учет реакции агглютинации. Результаты реакции учитывают визуально и определяют в крестах по следующей схеме:
(+~1—1—Ь) — полное просветление жидкости, микробные тела антигена осели на дно пробирки в виде «зонтика», при легком встряхивании «зонтик» разбивается на хлопья и комочки, а жидкость остается прозрачной (100% агглютинации);
(“I—1—1“) — неполное просветление жидкости и хорошо выраженный «зонтик» (75% агглютинации);
(++) — просветление жидкости, «зонтик» умеренно выражен
(50% агглютинации);
(+) — едва заметное просветление жидкости, «зонтик»
выражен слабо, при встряхивании заметно небольшое количество хлопьев или комочков (25% агглютинации);
(—) — просветления жидкости и образования «зонтика»
не наступило, на дне пробирки виден «пунктик» осевших микробов антигена, при легком встряхивании образуется равномерная взвесь.
За титр антител принимают последнее разведение сыворотки, в котором произошла агглютинация не менее чем на 2 креста (++)• что соответствует количеству международных единиц (ME) антител в 1 мл сыворотки (например, сыворотка с конечным титром РА 1 : 100 содержит 100 ME, 1 : 200—200 ME и т. п.).
Для более объективной оценки результатов РА в крестах готовят стандарты мутности, соответствующие 0, 25, 50 и 75% просветления жидкости.
В четыре пробирки последовательно наливают 1, 2, 3 и 4 мл антигена, разведенного 1 : 10. Затем в том же порядке в три первых пробирки добавляют 3, 2 и I мл фенолизированного физиологического раствора. В четвертую пробирку раствор не добавляют. После встряхива-
ни я пробирок жидкость из каждой из них переносят по 0,5 мл в серологические пробирки и добавляют по 0,5 мл фенолизированного физиологического раствора. Полученные стандарты соответствуют 75, 50 и 25% просветления жидкости. В последней, четвертой, пробирке просветление отсутствует. Стандарты мутности готовят каждый раз при поставке РА и выдерживают в термостате одновременно с основной реакцией.
Степень просветления в пробирках с исследуемыми сыворотками определяют визуально путем сравнения со стандартами и результаты реакции выражают в крестах.
При массовых исследованиях сывороток в двух разведениях в,се сыворотки, давшие агглютинацию с оценкой не менее чем на 2 креста (4~Н в каком-либо из указанных разведений, исследуют повторно в четырех разведениях.
4.2.5. Диагностическая оценка реакции агглютинации.
Реакцию считают положительной при наличии агглютинации с сыворотками крови крупного рогатого скота, лошадей и верблюдов начиная с разведения 1 : 100 (100 МЕ антител); коз, овец, буйволову оленей и собак — с разведения 1 : 50 (50 ME); пушных зверей и морских свинок — с разведения 1 ; 10 (10 ME) с оценкой не менее чем на 2 креста.
Реакцию считают сомнительной при наличии агглютинации только в разведении 1 : 50 (50 ME) с сыворотками крови крупного рогатого скота, лошадей и верблюдов и в разведении 1 : 25 (25 ME) с сыворотками овец, коз, буйволов, оленей и собак с оценкой не менее чем на 2 креста.
При получении сомнительного результата реакции сыворотку крови данного животного исследуют повторно через 3—4 нед.
На неблагополучных по бруцеллезу фермах животных, при исследовании которых будет получена дважды сомнительная РА, относят к положительно реагирующим.
В заключении лаборатории о результатах исследования должна быть сообщена диагностическая оценка каждой пробы (положительная, сомнительная, отрицательная) и конечное разведение (титр) сыворотки, в котором получен соответствующий результат, выраженное в международных единицах (например: конечный титр сыворотки крови крупного рогатого скота 1 : 100 с оценкой 2 креста или более — «положительная 100 МЕ»; конечный титр сыворотки 1 : 50 с оценкой 2 креста или более — «сомнительная 50 МЕ»).
Суммарные результаты исследования испытуемых сывороток, серию антигена, срок его годности, а также предельный титр позитивной сыворотки записывают в журнал серологических исследований.
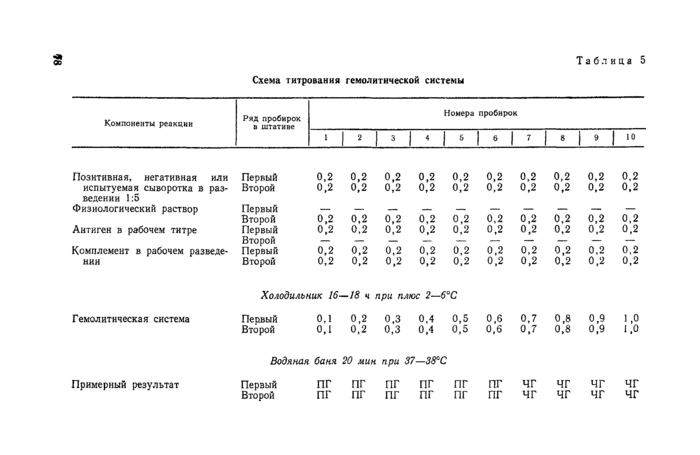
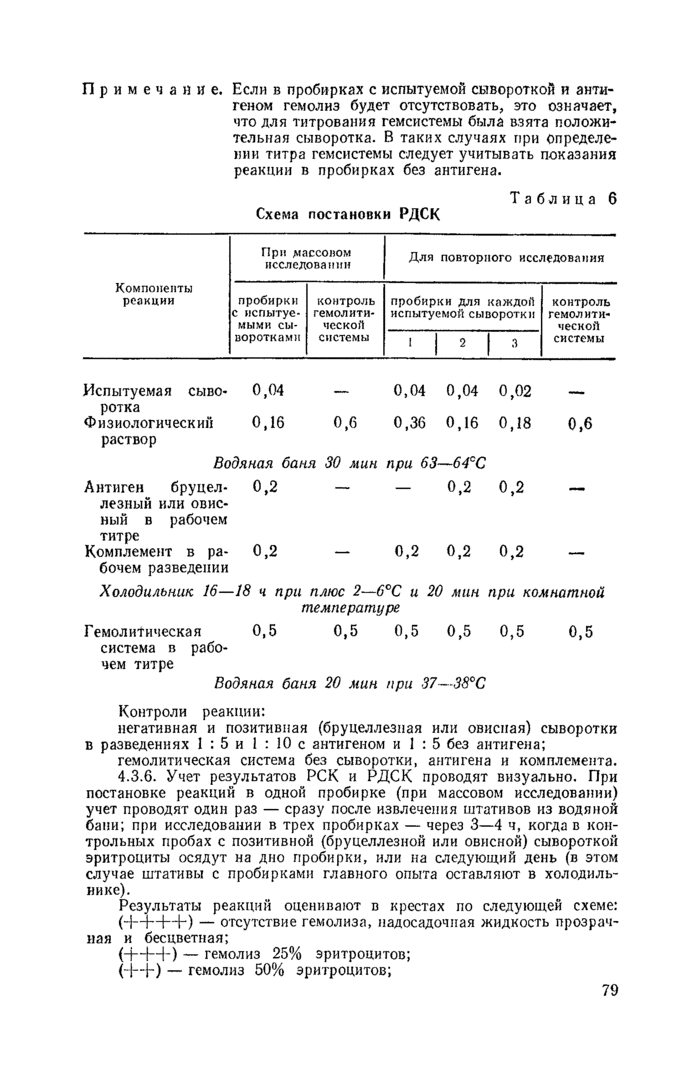
4.3. Постановка и учет реакции связывания комплемента (РСК) и реакции длительного связывания комплемента на холоде (РДСК).
4.3.1. Реакцию связывания комплемента применяют при диагностике бруцеллеза у крупного рогатого скота, овец, коз, свиней, лошадей, оленей, собак, пушных зверей и животных других видов.
Реакцию длительного связывания комплемента, как более чувствительную, применяют вместо РСК при исследовании на бруцеллез сывороток животных указанных видов, а также при диагностике инфекционного эпидидимита баранов.
4.3.2. Компоненты реакций и их подготовка к работе:
испытуемые сыворотки крови (см. подпункт 2.3.1);
позитивная бруцеллезная или овисная сыворотка, изготовленная
на биофабрике или полученная от больного животного. На этикетках
флаконов с сыворотками указывают титр в РСК (РДСК) и дату изготовления;
негативная сыворотка (сыворотка крови здоровых животных), изготовленная на биофабрике или полученная в лаборатории.
Испытуемые и контрольные (позитивную и негативную) сыворотки инактивируют в водяной бане в день постановки реакции:
для РСК — при 60—62°С в течение 30 мин (сыворотки крови ослов и мулов — при 64—65°С; буйволов — при 62—64°С в течение 30; свиней — при 60—62°С в течение 50 мин); для РДСК сыворотки крови животных всех видов — при 63—64°С в течение 30 мин;
антиген бруцеллезный, единый для РЛ, РСК и РДСК или овисный для РДСК в рабочем титре, указанном предприятием, его изготовившим (см. приложение 2, п. 6);
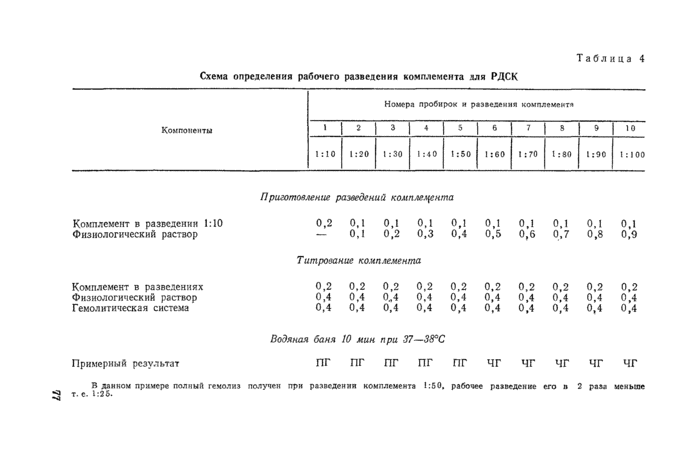
комплемент — сыворотка крови морской свинки (свежая, консервированная добавлением 4% борной кислоты или лиофильно высушенная). При использовании в качестве комплемента свежей или консервированной сыворотки и при получении каждой новой серии сухого комплемента проводят титрование его в гемолитической системе для определения активности (см. приложение 2, п. 4).
Сухой биофабричный комплемент растворяют в физиологическом растворе, как указано па этикетке. Ьерут такое количество ампул (флаконов), в которых содержится необходимое для проведения всего опыта количество комплемента. Содержимое ампул (флаконов) сливают в одну пробирку, осторожно смешивают, берут 0,5 мл и разводят физиологическим раствором I : 20 для титрования. Остальное количество комплемента хранят в холодильнике при 2—4°С;
гемолитическая сыворотка (гемолизин) — для РСК в удвоенном титре, для РДСК— в утроенном. Титрование гемолизина проводят периодически один раз в 3 мес и при использовании каждой новой серии (см. приложение 2, п. 5);
эритроциты барана — 2,5%-ная от осадка взвесь эритроцитов в физиологическом растворе для РСК и 3%-ная для РДСК (см. приложение 2, п. 3).
Для приготовления гемолитической системы соответствующую взвесь эритроцитов и гемолитическую сыворотку в рабочем разведении смешивают в равных объемах и выдерживают в термостате при 37°С в течение 15—20 мин. При смешивании гемолизин вливают во взвесь эритроцитов;
физиологический раствор — 0,85%-ный раствор химически чистого хлорида натрия в дистиллированной воде pH 7,3—7,4 или физиологический раствор, содержащий ионы магния и кальция (см. приложение 2, п. 2).
Рабочие разведения всех компонентов для РСК и РДСК готовят перед постановкой реакции и проверяют их на антикомплемснтарность и гемотоксичность по следующей схеме.
В реакции используют компоненты, не обладающие анти комплементарными и гемотоксическими свойствами.
4.3.3. Постановка реакции связывания комплемента.
Реакцию проводят в водяной бане при 37—38°С в объеме 1 мл (по 0,2 мл каждого компонента — сыворотки, антигена, комплемента, гемолизина и эритроцитов).
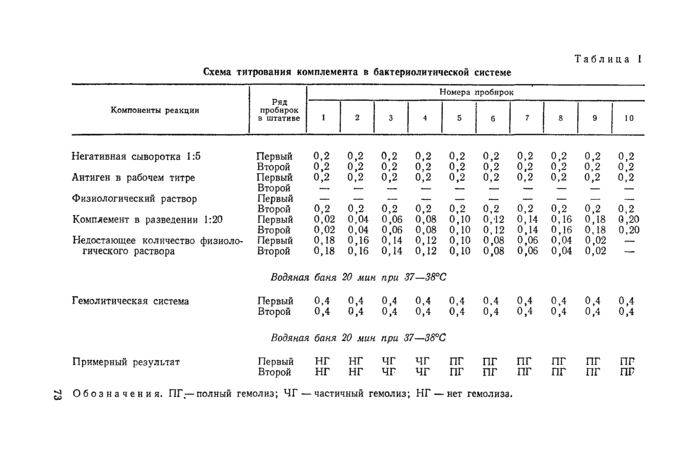
Перед постановкой главного опыта проводят титрование комплемента в бактериологической системе на позитивной (бруцеллезной) сыворотке, негативной сыворотке крови того вида животных, которых исследуют, и одной сыворотке, взятой из исследуемой партии.
| ||||||||||||||||||||||||||||||||||||||||||||||||
|
Водяная баня 10 мин при 37—*36°С Результат: Гемолиз Полная задержка гемолиза | ||||||||||||||||||||||||||||||||||||||||||||||||
Каждую сыворотку разводят 1 : 5 физиологическим раствором (1 мл сыворотки + 4 мл физиологического раствора), инактивируют, как указано в подпункте 4.3.2, и разливают по 0,2 м i в два ряда по 10 пробирок. Затем в пробирки каждого ряда вносят комплемент (разведенный 1 : 20) в возрастающих дозах от 0,02 мл до 0,2 мл с интервалом 0,02 мл и недостающее до 0,2 мл (в каждой пробирке) количество физиологического раствора.
После разлива комплемента в первый ряд пробирок с каждой сыворотки вносят по 0,2 мл антигена в рабочем разведении, а во второй ряд — по 0,2 мл физиологического раствора. Пробирки ставят в водяную баню при 37—-38°С на 20 мин. Затем во все пробирки добавляют по 0,4 мл гемолитической системы, встряхивают их, вновь ставят в водяную баню на 20 мин, после чего учитывают результат.
Схема титрования комплемента в бактериологической системе (на примере негативной сыворотки) представлена в таблице 1.
Примечание. Для удобства в работе и более точной дозировки вначале рекомендуется приготовить необходимые разведения комплемента в 10-кратных объемах в отдельных пробирках. Для этого в дополнительный ряд пробирок вносят комплемент, разведенный 1 : 20, в дозах 0,2; 0,4; 0,6 мл и т. д. до 2 мл, добавляют в каждую пробирку недостающее до 2 мл количество физиологического раствора, т. е. соответственно 1,8; 1,6; 1,4 мл и т. д. Из первой пробирки этого ряда переносят по 0,2 мл жидкости в первые пробирки с сыворотками, взятыми для титрования, из второй пробирки соответственно во вторые пробирки с сыворотками и т. д. Работу можно выполнять аппаратом Флоринского.
Титром комплемента в бактериолитической системе считают минимальное его количество, вызывающее полный гомолиз взвеси эритроцитов в пробирках с негативной и испытуемой сыворотками с антигеном
|
Схема титрования комплемента в бактериолитической системе | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Обозначения. ПГ—полный гемолиз; ЧГ — частичный гемолиз; НГ — нет гемолиза. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
и без антигена, а также в пробирках с позитивной сывороткой без антигена в течение 20 мин в водяной бане при 37—38°С, при задержке гемолиза в пробирках с бруцеллезной сывороткой и антигеном.
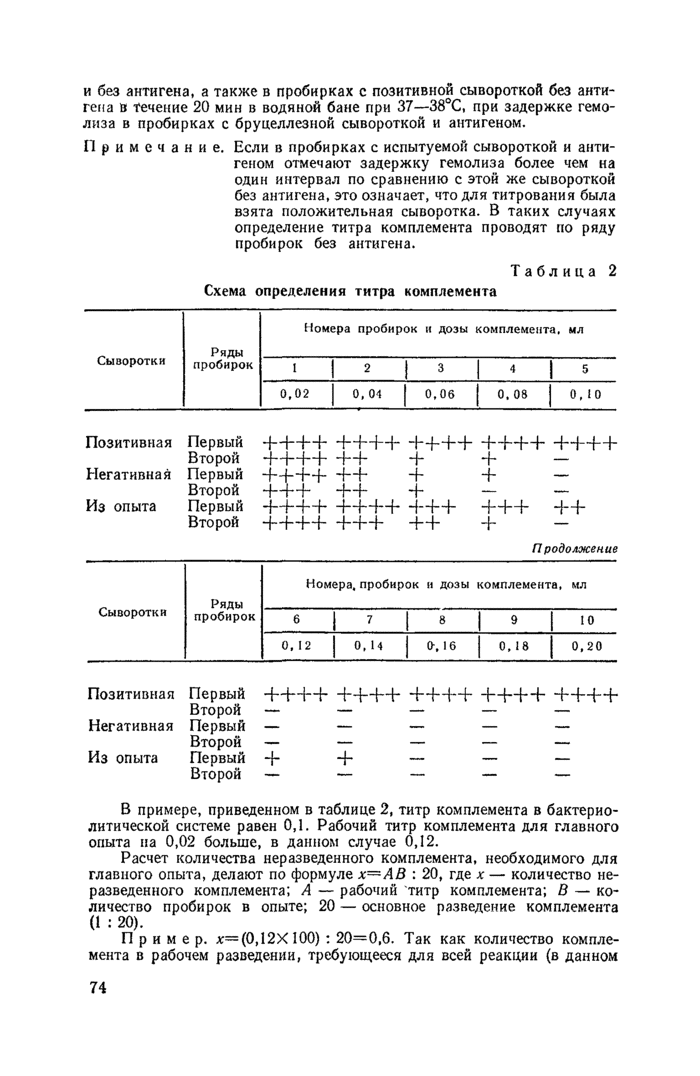
Примечание. Если в пробирках с испытуемой сывороткой и антигеном отмечают задержку гемолиза более чем на один интервал по сравнению с этой же сывороткой без антигена, это означает, что для титрования была взята положительная сыворотка. В таких случаях определение титра комплемента проводят но ряду пробирок без антигена.
Схема определения титра комплемента
|
Таблица 2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
В примере, приведенном в таблице 2, титр комплемента в бактерио-литической системе равен 0,1. Рабочий титр комплемента для главного опыта на 0,02 больше, в данном случае 0,12.
Расчет количества неразведенного комплемента, необходимого для главного опыта, делают по формуле х~АВ : 20, где х — количество неразведенного комплемента; А — рабочий титр комплемента; В — количество пробирок в опыте; 20 — основное разведение комплемента (1 ; 20).
Пример. х—(0,12X100) : 20= 0,6. Так как количество комплемента в рабочем разведении, требующееся для всей реакции (в данном
ББК 48.73 Л 12
УДК 619:616.9—08(031)
Составители: Б. И. Антонов, В. В. Борисова, Я. М. Волкова, »/7. Я. Каменева, Л. В. Кошеленко, Г. А. Михальский, В. В. Лоповцев, Л. И. Прянишникова, В. Е. Храпова
Лабораторные исследования в ветеринарии. Бакте-Л12 риальные инфекции: Справочник/Сост. Б. И. Антонов, В. В. Борисова, П. М. Волкова и др.; Под ред. Б. И. Антонова.— М.: Агропромиздат, 1986.— 352 с.
В книге даны методы лабораторных исследований патологического материала с целью определения возбудителя нпфекционноЛ болезни. Они изложены по единой схеме: бактериологические и бактериоскопнческие исследования, биопроба, идентификация и дифференциация возбудителей. Методы унифицированы и стандартизированы
Для ветврачей и фельдшеров, лаборантов ветеринарных лабораторий.
3805020000-079 035 (01)-86
305—86
ББК 48.73
© ВО «Агропромиздат», 1986
примере 100 пробирок), равно 20 мл (0,2Х 100), то к 0,6 мл неразведен-ного комплемента следует добавить 19,4 мл физиологического раствора.
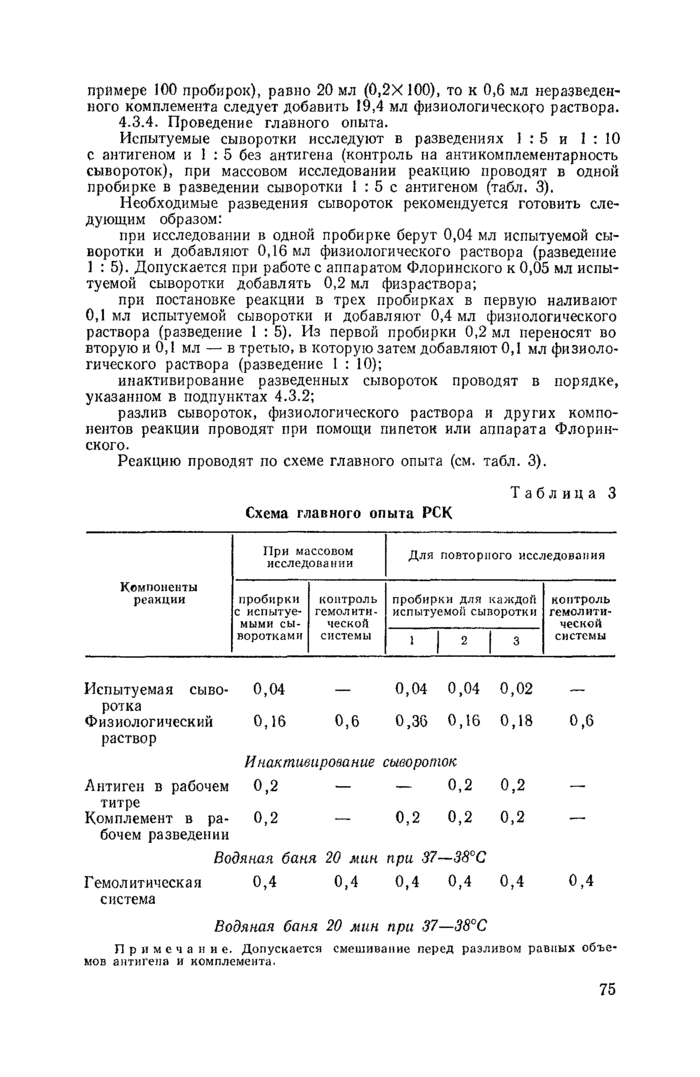
4.3.4. Проведение главного опыта.
Испытуемые сыворотки исследуют в разведениях 1:5 и 1 : 10 с антигеном и I : 5 без антигена (контроль на антикомплементарность сывороток), при массовом исследовании реакцию проводят в одной пробирке в разведении сыворотки 1:5с антигеном (табл. 3).
Необходимые разведения сывороток рекомендуется готовить следующим образом:
при исследовании в одной пробирке берут 0,04 мл испытуемой сыворотки и добавляют 0,16 мл физиологического раствора (разведение 1:5). Допускается при работе с аппаратом Флоринского к 0,05 мл испытуемой сыворотки добавлять 0,2 мл физраствора;
при постановке реакции в трех пробирках в первую наливают 0,1 мл испытуемой сыворотки и добавляют 0,4 мл физиологического раствора (разведение 1:5). Из первой пробирки 0,2 мл переносят во вторую и 0,1 мл — в третью, в которую затем добавляют 0,1 мл физиологического раствора (разведение 1 : 10);
инактивирование разведенных сывороток проводят в порядке, указанном в подпунктах 4.3.2;
разлив сывороток, физиологического раствора и других компонентов реакции проводят при помощи пипеток или аппарата Флоринского.
Реакцию проводят по схеме главного опыта (см. табл. 3).
Схема главного опыта РСК
|
Таблица 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Примечание. Допускается смешивание перед разливом равных объемов антигена и комплемента. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ПРЕДИСЛОВИЕ
В деле выполнения решении партии и правительства по дальнейшему развитию животноводства, а также задач, поставленных Продовольственной программой страны, ветеринарной службе большую помощь оказывают ветеринарные лаборатории.
Ветеринарные лаборатории осуществляют диагностику инфекционных и паразитарных болезней животных, выявляют нарушения обмена веществ в их организме, проводят исследования, направленные на предупреждение отравлений, помогая тем самым специалистам совхозов, колхозов и других хозяйств успешно осуществлять лечебнопрофилактические мероприятия. От того, насколько своевременно ставится диагноз, разработаны и рекомендованы профилактические и лечебные меры, зависит успех ликвидации болезней, сохранность поголовья животных и повышение их продуктивности.
Последнее время в лабораториях появилось много приборов и приспособлений, облегчающих труд специалистов и позволяющих проводить исследования на более современном и качественном уровне, с большой достоверностью. В связи с этим многие ранее действовавшие методические указания переработаны.
Кроме того, ежегодно для лабораторной практики предлагаются новые методы диагностики. В отечественной и зарубежной литературе постоянно публикуется большое количество материалов о новых методах исследований, предлагаются различные модификации существующих методик, вводятся дополнительные диагностические тесты.
Ветеринарные лаборатории в своей работе не могут использовать всего многообразия имеющихся в литературе методов исследования или из-за того, что они недостаточно апробированы, или из-за сложности применяемого оборудования. Иногда методы, предлагаемые различными авторами, при определении одних и тех же показателей дают несовпадающие результаты.
В связи с этим в справочник включены методы лабораторных исследований патологического материала, получаемого от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные Главным управлением ветеринарии Министерства сельского хозяйства СССР. Книга содержит методические указания по диагностике инфекционных болезней бактериальной этиологии, а также методические указания по применению культур клеток в диагностических исследованиях.
Методики изложены по единой схеме,- взятие и пересылка патологического материала, методы его обработки и обогащения; бактериоско-пические исследования, включая световую и люминесцентную микроскопию; выделение культур возбудителей инфекционных болезней на питательных средах; заражение лабораторных животных как с целью выделения чистой культуры возбудителя, так и определения степени ее патогенности; гистологические исследования; идентификация и дифференциация возбудителей с использованием различных методов; серологические исследования для определения вида возбудителя.
Приведенные в справочнике методы лабораторных исследований унифицированы и стандартизированы. В широком смысле слова унификация и стандартизация подразумевают применение для различных исследований одних и тех же аппаратов, приборов, инструментов, посуды, реактивов, исключая, конечно, специальные методы исследования; применение стандартных (унифицированных) питательных сред и диагностикумов; разработку методических указаний по единой форме. Все это позволяет лабораторным работникам с меньшей затратой сил и средств, на высоком методическом и техническом уровне, качественно и в срок проводить диагностические исследования. Таким образом, стандартизация методов исследования явится способом наведения строгого порядка в работе ветеринарных лабораторий.
Книга предназначена для ветеринарных врачей, фельдшеров, а также лаборантов ветеринарных диагностических лабораторий.
В справочник не вошли материалы по диагностике туберкулеза, так как они пересматриваются и дополняются, поэтому их публикация будет осуществлена в последующих изданиях.
БРУЦЕЛЛЕЗ
Наставление по диагностике бруцеллеза животных
(Утверждено Главны/и управлением ветеринарии Минсельхоза 30 декабря 1982 г.)
1. Общие положения.
1.1. Бруцеллез — инфекционная, хронически протекающая болезнь животных.
Возбудитель — бактерии из рода бруцелла, в который входят шесть самостоятельных видов: мелитензнс (козье-овечий), абортус
(крупного рогатого скота), суис (свиной), овис (бараний), канис (собачий) и неотома (кустарниковых крыс). Микроорганизмы первых трех видов вызывают бруцеллез, бруцеллы вида овис — заболевание, называемое инфекционным эпидидимитом баранов.
От животных, больных бруцеллезом, могут заражаться люди, для которых наиболее опасен возбудитель бруцеллеза овец и коз.
1.2. Диагноз на бруцеллез у животных ставят на основании результатов бактериологических, серологических и аллергических исследований с учетом эпизоотологических данных и клинических признаков болезни, руководствуясь при этом «Инструкцией о мероприятиях по профилактике и ликвидации бруцеллеза животных».
1.2.1. При установлении диагноза на бруцеллез необходимо учитывать следующее:
различные виды возбудителя являются патогенными в основном для животных соответствующего вида, однако бруцеллы видов мелитен-зис и абортус могут мигрировать и на животных других видов;
клинические признаки бруцеллеза у животных не характерны. Наиболее частое клиническое проявление болезни у маточного поголовья — аборт, у свиноматок наблюдается мумификация плодов. При абортах отмечается утолщение плодных оболочек, образование на них фибринозных или гнойных хлопьев. Бруцеллез нередко сопровождается поражением суставов (артриты), синовиальной системы (тендо-вагиниты, бурситы), половой системы (у самок — эндометрит, вагинит, у самцов — орхит, эпидидимит);
патологоанатомическая картина при бруцеллезе не имеет характерных особенностей, позволяющих использовать их для диагностики этой болезни. Только у свиней на слизистой оболочке матки иногда находят желтовато-гнойные или казеозные узелки величиной с просяное зерно (так называемый «миллиарный бруцеллез матки»).
1.2.2. У баранов, больных инфекционным эпидидимитом, в семенниках и придатках обнаруживают воспалительно-некротические или гнойные очаги различной величины; отмечают заполнение полости мошонки серозно-гнойным транссудатом, разрастание фиброзной ткани, сращение придатка с семенником и общей влагалищной оболочкой, иногда атрофию семенника.
1.3. Диагностика бруцеллеза включает лабораторные (бактериологические и серологические) исследования материала и аллергические исследования животных в хозяйствах.
Плановые серологические и аллергические исследования являются основными методами выявления больных и подозрительных по заболеванию животных.
Бактериологическую диагностику проводят в случае аборта или при появлении у животных других признаков (бурситы, гигромы, орхиты, эпидидимиты и прочее), вызывающих подозрение на данное заболевание. Одновременно проводят серологическое исследование сывороток крови этих животных.
1.4. При отборе проб крови, молока и патологического материала, а также при проведении лабораторных исследований необходимо соблюдать меры, предупреждающие заражение людей и обсеменение объектов внешней среды, руководствуясь при этом действующими правилами и инструкциями по данному вопросу.
2. Взятие материала от животных и пересылка его для лабораторных исследований.
2.1. Материал для лабораторных исследований отбирают от каждого животного в отдельности.
2.2. На бактериологическое исследование на бруцеллез в лабора торию направляют абортированный плод с плодными оболочками (от свиноматок берут не менее 3 плодов) или желудок плода с содержимым (желудок перевязывают со стороны пищевода и со стороны двенадцатиперстной кишки), а также кусочки печени и селезенки.
При взятии содержимого гигром (бурс) в области поражения выстригают шерсть, кожный покров дезинфицируют 70°-ным спиртом и смазывают настойкой йода. Затем стерильным шприцем с иглой большого диаметра делают пункцию, отсасывают содержимое гигромы (бурсы) и переносят его в стерильную пробирку с резиновой пробкой.
Перед взятием проб молока у коров вымя обмывают теплой водой, соски обрабатывают 70°-пым спиртом. Для исследования из каждой доли вымени берут последние порции молока в количестве 10—15 мл в отдельные стерильные пробирки с резиновыми пробками.
У овец и коз пробы молока берут путем пункции цистерны вымени. Для этого животное фиксируют в боковом положении, вымя у основания соска протирают 70°-ным спиртом и смазывают настойкой йода. Стерильным шприцем с иглой делают пункцию у основания соска и после попадания иглы в цистерну (о чем судят по свободному движению конца иглы) набирают в шприц молоко и переносят его в стерильную пробирку с резиновой пробкой.
Молоко должно быть доставлено в лабораторию и исследовано в день взятия пробы. Если это невозможно, молоко консервируют сухой борной кислотой (0,1 г на 10 мл) или генцианвиолетом (0,4 мл 1%-ного спиртово-водного раствора краски на 10 мл молока). Консервированное молоко пригодно для исследования в течение 10 дн.
2.2.1. Для исследования на инфекционный эиидидимит в лабораторию направляют: от баранов — семенники с придатками; от овцематок — абортированные плоды с плодными оболочками, выделения из половых путей, взятые в первые 5 дн. после аборта.
2.2.2. Отобранные для бактериологического исследования пробы упаковывают в целлофан или пергаментную бумагу, помещают в непроницаемую тару (ящик, банка, полиэтиленовый пакет) и в тот же день направляют в лабораторию. Ог абортировавшего животного одновременно с патологическим материалом направляют кровь для серологического исследования на бруцеллез.
Если в течение 24—30 ч взятый материал доставить в лабораторию не представляется возможным, его консервируют стерильным 30%-ным водным раствором химически чистого глицерина.
Материал заливают консервирующей жидкостью в количестве, превышающем его объем в 4—5 раз. Крупные плоды направляют в неконсервированном виде.
2.3. На серологическое исследование в лабораторию направляют кровь (или сыворотку крови) и молоко.
2.3.1. Кровь у животных берут из яремной вены (у свиней — из ушной или хвостовой, у лисиц и песцов — из бедренной вены, у норок — путем отсечения подушечки среднего пальца задней лапы или кончика хвоста) в стерильные пробирки по 5—7 мл (от пушных зверей — по 1—2 мл). Пробирки нумеруют и составляют опись проб.
Сыворотку крови получают методом отстоя. Для свертывания крови и отстаивания сыворотки пробирки с кровью выдерживают 30—60 мин при 20—30°С, сгусток крови от стенок отделяют стальной спицей, а затем пробирки выдерживают при 4—10°С. Через 20—24 ч отстоявшуюся сыворотку сливают в сухие стерильные пробирки (лучше в пробирки
Флоринского) и направляют на исследование в лабораторию в свежем или консервированном виде.
Консервирование сывороток проводят:
добавлением 0,05 мл (I капля) 5 %-ного раствора фенола на каждый миллилитр сыворотки при постоянном перемешивании;
сухой борной кислотой (2—4% к объему сыворотки) до получения насыщенного раствора и образования на дне пробирки небольшого осадка кристаллов;
путем однократного замораживания.
Неконсервированная сыворотка пригодна для исследования в течение б дней со дня взятия крови с сохранением ее при 4—8°С.
Сыворотки, консервированные фенолом или борной кислотой, пригодны для исследования в течение 30 ди.;. замороженные сыворотки — в течение 3 дн. после однократного оттаивания.
Мутные, проросшие, гемолизированные сыворотки исследованию на бруцеллез не подлежат.
2.3.2. Для исследования на бруцеллез в кольцевой реакции пробу (10—15 мл) цельного свежего молока берут из Одного удоя от коровы (буйволицы) в стерильную пробирку. Пробы молока на рынках берут из каждой отдельной посуды (бидон, фляга и прочее) после тщательного его перемешивания. Пробирки нумеруют и составляют опись проб.
При направлении молока на исследование в лабораторию каждую пробу консервируют добавлением одной капли 10%-ного раствора формалина на 5—10 мл молока. Консервированное молоко пригодно для исследования в течение 2—3 сут. Перед исследованием его необходимо тщательно перемешать для равномерного распределения сливок. При массовом исследовании молока работу по отбору проб и постановке кольцевой реакции следует проводить непосредственно на ферме в специально отведенном помещении.
Не разрешается исследовать в кольцевой реакции молоко от коров (буйволиц), страдающих маститом или болезнями, сопровождающимися повышением температуры тела, а также молоко животных в первые 2 нед после родов.
2.4. На направляемый в лабораторию материал заполняют сопроводительный документ установленной формы.
3. Бактериологическая диагностика бруцеллеза.
3.1. Бактериологическую диагностику бруцеллеза проводят в случае аборта или при появлении у животных других признаков (бурситы, гигромы, орхнты, эпидидимиты и прочее), вызывающих подозрение на данное заболевание.
3.2. Бруцеллы обнаруживают тремя методами: бактериоскопией мазков из патологического материала, выделением культуры бруцелл на питательных средах и при необходимости путем постановки биологической пробы на морских свинках.
3.3. Бактериоскопическое исследование.
Из доставленного на исследование патологического материала делают по 2 мазка из каждого объекта. При исследовании абортированных плодов мазки готовят из содержимого желудка, жидкости брюшной и грудной полостей, печени, селезенки, а также котиледонов плодных оболочек. Из паренхиматозных органов, котиледонов и другого плотного материала делают мазки-отпечатки, жидкий материал наносят на предметные стекла пипеткой.
Мазки, фиксированные на пламени, окрашивают по Граму и одному из следующих специальных методов: по Стампу (модифицированный
метод Циля — Нильсена), Козловскому или Шуляку — Шин (см. приложение 1, п. 1). При микроскопии мазков учитывают, что бруцеллы — мелкие грамотрицательные, расположенные отдельно, попарно или кучно кокко-бактерии, окрашивающиеся по Стампу, Козловскому или Шуляку — Шин в красный цвет.
3.4. Бактериологическое исследование.
3.4.1. Для культивирования бруцелл используют мясо-пептонный печеночный бульон (МППБ), печеночно-глюкозно-глицериновый бульон (ПГГБ), мясо-пептонный печеночно-глюкозно-глицериновый агар (МППГГА), печеночно-глюкозно-глицериновый агар (ПГГА), картофельный агар, эритрит-агар или сывороточно-декстрозный агар (см. приложение 1, п. 2).
Культивирование возбудителя инфекционного эпидидимита баранов (бруцелла овис) проводят на плотных или полужидких печеночносывороточном или печеночно-аминопептидном агарах, а также на сыво-роточно-декстрозном агаре (см. приложение 1, п. 2).
3.4.2. Перед посевом материала кожу абортированного плода с поверхности по белой линии протирают тампонами, смоченными 5%-ным раствором фенола. Стерильными ножницами вскрывают брюшную стенку и грудную клетку плода, содержимое грудной и брюшной полостей набирают пастеровскими пипетками и высевают в одну пробирку с бульоном и в две пробирки с агаром, а содержимое желудка — в две пробирки с бульоном и не менее чем в пять пробирок с агаром.
Из печени и селезенки вырезают кусочки размером не менее 2,0X X 1,5x2,5 см, овлажняют их спиртом, обжигают с поверхности и растирают в стерильной ступке с песком. Затем в ступку добавляют равное количество стерильного физиологического раствора и вновь растирают. Полученную взвесь пастеровской пипеткой по 0,1—0,2 мл высевают на поверхность предварительно подсушенных плотных сред (в пробирках или чашках). Допускается высев материала пастеровской пипеткой непосредственно из органов (место прокола органа предварительно прижигают раскаленным шпателем). Из каждого органа делают посев в одну пробирку с бульоном и в две пробирки с агаром.
Если в лабораторию доставлен только желудок плода, высев проводят не менее чем в 10 пробирок с агаром.
При поступлении нескольких плодов от одного животного посевы делают из органов и тканей каждого плода отдельно.
Из плодной оболочки, плаценты вырезают кусочки тканей с утолщенными ворсинками и стенками, наличием на поверхности фибрина или гнойного экссудата (выбирают менее загрязненные участки без некротических изменений). Для уничтожения посторонней микрофлоры кусочки плаценты помещают в чашку Петри и заливают 3%-ным раствором гидроокиси калия на 30 мин. Затем их обмывают стерильным физиологическим раствором, готовят из этого материала суспензию в ступке со стерильным песком и делают посев пастеровской пипеткой на чашки со средой, содержащей бактериостатические препараты: генцианвиолет 1 : 200 000 (0,1 мл 0,5%-пого спиртового раствора на 100мл среды) или кристаллвиолет 1 : 100 000, генцианвиолет и малахитовую зелень в концентрации каждой краски I : 200 000, уксуснокислый натрий из расчета 0,125 мг на 1 мл среды.
Содержимое бурс (гигром) высевают в 3—4 чашки с плотной питательной средой, содержащей бактериостатические препараты.
Пробы молока центрифугируют 30 мин при 3000 об/мин. Верхний слой (сливки) и осадок набирают в пастеровскую пипетку и по 0,1 — 0,2 мл вносят в 3—4 чашки с агаром, содержащим бактериостатические
G4