Методические указания по обнаружению возбудителя сибирской язвы в сырье животного происхождения и объектах внешней среды
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Документ предназначена для ветеринарных врачей, фельдшеров, а также лаборантов ветеринарных диагностических лабораторий
Оглавление
1 Общие положения
2 Взятие материала для исследования
2.1 Отбор проб шерсти
2.2 Отбор проб кожевенно-мехового сырья
2.3 Отбор проб кормов
2.4 Отбор проб почвы
2.5 Отбор проб воды
3 Подготовка проб к исследованию
4 Методы обогащения и бактериологическое исследование
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 01.11.1979 | Утвержден | Главное управление ветеринарии Министерства сельского хозяйства СССР | |
|---|---|---|---|
| Издан | Издательство Колос | 1970 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12
стр. 13

стр. 14
|
СПРАВОЧНИК |
|
СПРАВОЧНИК
ЛАБОРАТОРНЫЕ
ИССЛЕДОВАНИЯ
В ВЕТЕРИНАРИИ
•
БАКТЕРИАЛЬНЫЕ
ИНФЕКЦИИ
Под редакцией Б. И. АНТОНОВА
МОСКВА АГРОПРОМИЗДАТ 1986
Бамия капсулообразования in vivo делают посев испытуемой культуры в среду ГКЙ. Среда состоит из раствора Хенкса с бикарбонатом натрия, к которому добавляют 40% стерильной, бычьей сыворотки, инактивированной при 56°С в течение 30 мин. При отсутствии раствора Хенкса можно пользоваться бульоном, приготовленным на переваре Хоттингера, к которому добавляют 40% стерильной инактивированной бычьей сыворотки и с помощью двууглекислой соды pH среды доводят до 7,2—7,4.
Пробирки с посевами закрывают стерильными резиновыми пробками и помещают в термостат при 37°С. Через 30—120 мин инкубирования у отдельных сибиреязвенных клеток начинается капсулообразование, а через 16—18 ч все или большинство сибиреязвенных клеток образуют капсулу. Для рыявления капсулообразования из посевов делают мазки.
Мазки фиксируют спирт-формалином (5 мл продажного формалина и 95 мл 96°-ного этилового спирта) 15 мин, окрашивают синькой Леффле-ра 5—10 мин и микроскопируют. При положительном тесте в мазках обнаруживают синие палочки и цепочки, окруженные розовой капсулой.
4.9.6. Метод выявления капсулообразования in vivo (ускоренная биологическая проба). Для исследования на капсулообразование in vivo испытуемую культуру в дозе 0,1—0,2 мл вводят.внутрибрюшинно четырем белым мышам. Через 1 и 2 ч после заражения убивают по одной мыши, вскрывают, из перитонеального экссудата и органов делают мазки-отпечатки для исследования на наличие капсульных палочек возбудителя сибирской язвы. Двух белых мышей оставляют под наблюдением до естественной гибели или на 10 дней, как при классической биологической пробе.
4.10. Выделенную культуру относят к Вас. anthracis при наличии характерных культурально-морфологических свойств, чувствительности к сибиреязвенному фагу, положительного теста «жемчужного ожерелья». При получении отрицательных или нечетких результатов по одному из вышеуказанных показателей дополнительно определяют подвижность, гемолитические свойства, капсулообразование in vitro или in vivo.
При идентификации культур учитывают их патогенность для лабораторных животных. При исследовании объектов внешней среды могут быть выделены сибиреязвенные культуры с ослабленной вирулентностью и авирулентные, которые не всегда вызывают гибель зараженных белых мышей.
4.11. Определение вирулентности сибиреязвенных культур. При необходимости определяют вирулентность выделенной культуры путем заражения кроликов массой 2—2,5 кг.
4.11.1. Для заражения готовят споровую культуру исследуемого штамма. Для этого суточную бульонную культуру засевают на одну из следующих сред: МПА, агар Хоттингера, голодный пшеничный или гороховый агар. Посевы выдерживают 3—4 дня в термостате при 37°С. Процесс спорообразования контролируют путем подсчета спор при микроскопии раздавленной капли или окрашенных мазков.
4.11.2. После образования спор у 90—100% микробов бакмассу смывают физиологическим раствором и определяют концентрацию спор по стандарту мутности или путем посева серийных разведений на МПА. Из суспензии спор с известной концентрацией готовят три рабочих разведения с содержанием 100, 1000 и 10 000 спор в 1 мл.
4.11.3. Для определения вирулентности культуры 2 кроликам вводят подкожно в области живота по 1 мл разведения с концентрацией 10 000 спор/мл.
4.11.4. При определении степени вирулентности культуры каждым
сл
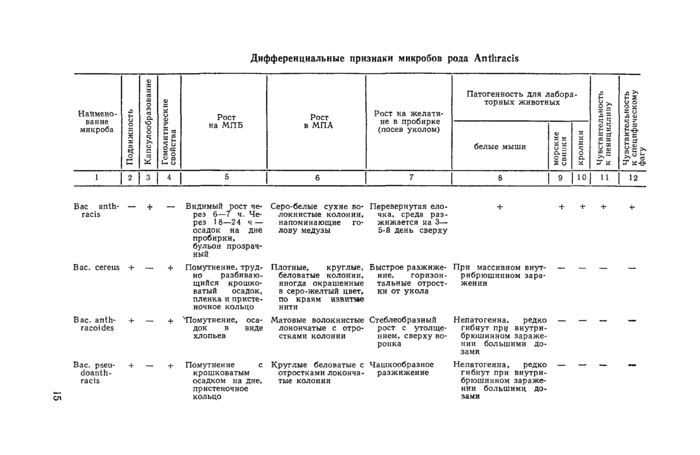
Дифференциальные признаки микробов рола Anthraeis
| |||||||||||||||||||||||||||||
|
Вве anth- — + rads + + | |||||||||||||||||||||||||||||
Вас. сегеиз + —
Bsc. snlh- + —
raeoidcs
Вас. pceu- + —
doanth-racls
— Видимый рост пере» 6—7 ч. Мере» 18—24 ч — осадок иа дне пробирки, бульон проарач-ный
♦ Помутнение, труд
но разбивающийся крошко-ватый осадок, пленка и пристеночное кольцо
♦ 'ТТомутисиие, оса
док в виде хлопьев
+■ Помутнение с крошковатым осадком на дне. пристеночное кольцо
Серо-белые сухие волокнистые колонии, напоминающие голову медузы
Плотные. круглые, беловатые колонии, иногда окрашенные в серо-желтый цвет, по краям извитые нити
Матовые волокнистые локончатые с отростками колонии
Круглые беловатые с отростками локомча-тые колонии
Перевернутая елочка. среда раз-жижается на 3— S-в день сверху
Быстрое pi сжижение. горизонтальные отростки от укола
Стеблеобразный рост с утолщением. саерху воронка
Чашкообразное
разжижение
При массивном виут-рибрюшинном заражении
Нелатогснна. редко гибнут при внутри-бр юти миом заражении большими дозами
Непвтогеииа, редко гибнут при виутри-брюшиииом заражении большими дозами
о
n&ydo*YCtnut
Наимено
вание
микроба
—
2
%
1
5.
-
*
1
Рост в МПБ
Рост па МПА
5
б
|
Т * "ГГ | |||||||||||
1§
22
21
12
|
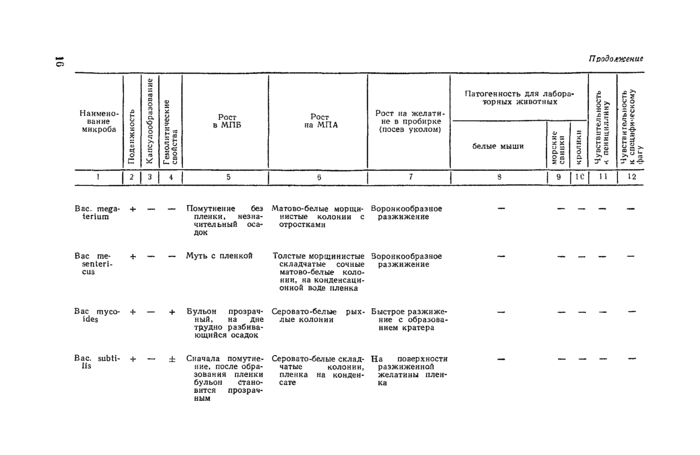
Вас. mega- |
4- — |
— Помутнение без |
|
tertum |
пленки, незначительный осадок | |
|
Вас пзе-lentert-ciu |
4- — |
— Муть с пленкой |
|
Вас myco- |
♦ — |
4- Бульон прозрач |
|
ide$ |
ный. иа дне трудно разбивающийся осадок |
Мято во* белые морщи* воронкообразное чистые колонии с разжижение отростками
Толстые морщинистые воронкообразное складчатые сочные разжижение матово-белые колонии. иа конденсационной иоде пленка
Серовато-белые рых- Быстрое разжижс* лые колонии иие с образова
нием кратера
Вас. subti- + IU
± Сначала помутит- Се ров а то-белые склад- На поверхности иие. после обра- чатыс колонии. разжиженной
зоваиия пленки пленка на комдем- желатины плен-
бульон ста мо- с а те ка
вится прозрачным
разведением (см. п. 4.11.2) в дозе I мл заражают подкожно в области живота по 2 кролика и наблюдают за ними в течение 10 дней.
Степень вирулентности Вас. anthracis определяют по дозе, вызвавшей гибель кроликов:
высоковнрулентные штаммы вызывают гибель кроликов при введении 100 или 1000 спор;
умеренно вирулентные — при введении 10 000 спор; слабовирулентиые и авирулентные штаммы не вызывают гибели кроликов в указанный срок.
ББК 48.73 Л 12
УДК 619:616.9—08(031)
Составители: Б. И. Антонов, В. В. Борисова, Я. М. Волкова, »/7. Я. Каменева, Л. В. Кошеленко, Г. А. Михальский, В. В. Лоповцев, Л. И. Прянишникова, В. Е. Храпова
Лабораторные исследования в ветеринарии. Бакте-Л12 риальные инфекции: Справочник/Сост. Б. И. Антонов, В. В. Борисова, П. М. Волкова и др.; Под ред. Б. И. Антонова.— М.: Агропромиздат, 1986.— 352 с.
В книге даны методы лабораторных исследований патологического материала с целью определения возбудителя нпфекционноЛ болезни. Они изложены по единой схеме: бактериологические и бактериоскопнческие исследования, биопроба, идентификация и дифференциация возбудителей. Методы унифицированы и стандартизированы
Для ветврачей и фельдшеров, лаборантов ветеринарных лабораторий.
3805020000-079 035 (01)-86
305—86
ББК 48.73
© ВО «Агропромиздат», 1986
ПРЕДИСЛОВИЕ
В деле выполнения решении партии и правительства по дальнейшему развитию животноводства, а также задач, поставленных Продовольственной программой страны, ветеринарной службе большую помощь оказывают ветеринарные лаборатории.
Ветеринарные лаборатории осуществляют диагностику инфекционных и паразитарных болезней животных, выявляют нарушения обмена веществ в их организме, проводят исследования, направленные на предупреждение отравлений, помогая тем самым специалистам совхозов, колхозов и других хозяйств успешно осуществлять лечебнопрофилактические мероприятия. От того, насколько своевременно ставится диагноз, разработаны и рекомендованы профилактические и лечебные меры, зависит успех ликвидации болезней, сохранность поголовья животных и повышение их продуктивности.
Последнее время в лабораториях появилось много приборов и приспособлений, облегчающих труд специалистов и позволяющих проводить исследования на более современном и качественном уровне, с большой достоверностью. В связи с этим многие ранее действовавшие методические указания переработаны.
Кроме того, ежегодно для лабораторной практики предлагаются новые методы диагностики. В отечественной и зарубежной литературе постоянно публикуется большое количество материалов о новых методах исследований, предлагаются различные модификации существующих методик, вводятся дополнительные диагностические тесты.
Ветеринарные лаборатории в своей работе не могут использовать всего многообразия имеющихся в литературе методов исследования или из-за того, что они недостаточно апробированы, или из-за сложности применяемого оборудования. Иногда методы, предлагаемые различными авторами, при определении одних и тех же показателей дают несовпадающие результаты.
В связи с этим в справочник включены методы лабораторных исследований патологического материала, получаемого от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные Главным управлением ветеринарии Министерства сельского хозяйства СССР. Книга содержит методические указания по диагностике инфекционных болезней бактериальной этиологии, а также методические указания по применению культур клеток в диагностических исследованиях.
Методики изложены по единой схеме,- взятие и пересылка патологического материала, методы его обработки и обогащения; бактериоско-пические исследования, включая световую и люминесцентную микроскопию; выделение культур возбудителей инфекционных болезней на питательных средах; заражение лабораторных животных как с целью выделения чистой культуры возбудителя, так и определения степени ее патогенности; гистологические исследования; идентификация и дифференциация возбудителей с использованием различных методов; серологические исследования для определения вида возбудителя.
Приведенные в справочнике методы лабораторных исследований унифицированы и стандартизированы. В широком смысле слова унификация и стандартизация подразумевают применение для различных исследований одних и тех же аппаратов, приборов, инструментов, посуды, реактивов, исключая, конечно, специальные методы исследования; применение стандартных (унифицированных) питательных сред и диагностикумов; разработку методических указаний по единой форме. Все это позволяет лабораторным работникам с меньшей затратой сил и средств, на высоком методическом и техническом уровне, качественно и в срок проводить диагностические исследования. Таким образом, стандартизация методов исследования явится способом наведения строгого порядка в работе ветеринарных лабораторий.
Книга предназначена для ветеринарных врачей, фельдшеров, а также лаборантов ветеринарных диагностических лабораторий.
В справочник не вошли материалы по диагностике туберкулеза, так как они пересматриваются и дополняются, поэтому их публикация будет осуществлена в последующих изданиях.
Методические указания по обнаружению возбудителя сибирской язвы в сырье животного происхождения и объектах внешней среды
(Утверждены Главным управлением ветеринарии Минсельхоза СССР 1 ноября 1979 г. взамен временных методических указаний от 7 августа 1969 г.)
1. Общие положения.
1.1. Исследования объектов внешней среды и сырья животного происхождения проводят:
при необходимости установить или подтвердить источник инфекции или фактор передачи возбудителя животному;
для выяснения обсемененности возбудителем сибирской язвы отдельных мест и объектов в случаях, предусмотренных соответствующими инструкциями;
в целях выяснения наличия возбудителя сибирской язвы в местах старых скотомогильников при проведении мелиоративных и гидротехнических работ;
для подтверждения результатов исследования шкурок мерлушки и козлика при получении положительной реакции преципитации.
2. Взятие материала для исследования.
2.1. Отбор проб шерсти. Для бактериологического исследования берут из разных мест не менее 5 образцов массой около 2 г каждый (лучше брать пучки загрязненной шерсти). Если, шерсть упакована в кипы, берут не менее 10 образцов из разных мест каждой кипы, а также скопившуюся внутри обшивки пыль. Образцы от одной кипы объединяют и упаковывают вместе.
2.2. Отбор проб кожевенно-мехового сырья. Для исследования берут кусочки размером 3X3 см с периферических незагнивших и незаплесневевших участков шкурок рядом с местами, откуда брали пробы для проверочно-контрольного исследования. При наличии на внутренней
стороне шкурки кровоподтеков или инфильтратов пробы берут и в этих местах.
2.3. Отбор проб кормов.
2.3.1. Концентрированные корма (зерно, отруби, комбикорм) отбирают в зависимости от условий их хранения.
При наличии незатаренных кормов первичные пробы отбирают из расчета 1 проба массой не менее 100 г на 4 м2 поверхности, но не менее 5 проб от каждого закрома, партии. Первичные пробы берут как из поверхностных, так и из глубоких слоев корма равномерно по всей площади.
Количество упаковочных единиц
При наличии затаренных кормов отбор проб проводят согласно следующей таблице.
От какого количества упаковочных единиц отбирают пробы
до 10........ от каждой упаковочной единицы
от 11 до 100 .... от 10 упаковочных единиц
от 101 и больше . . от 10 упаковочных единиц и
дополнительно по 3 из каждых 100 упаковочных единиц
Отбор проб проводят сухим стерильным пробным щупом. После взятия проб от каждого объекта (партий) щуп очищают и дезинфицируют огнем паяльной лампы.
2.3.2. Первичные пробы грубых кормов (сено, солома) берут из разных мест скирды (стога) при помощи ножниц и пинцета из расчета 1 проба массой не менее 40 г на 4 м2 плошади скирды.
2.3.3. Собранную зеленую массу берут, как указано в пункте
2.3.2, увеличив массу первичной пробы до 100 г.
2.3.4. Корнеплоды (клубнеплоды) в зависимости от величины отбирают из расчета 1—3 штуки на 4 м2 площади бурта, отсека. С отобранных корнеплодов скальпелем срезают поверхностный слой в местах, где имеются остатки земли.
2.3.5. Пробы силоса, хранящегося в ямах (траншеях), отбирают, как и пробы почвы (см. п. 2.4.1), вынутого из траншеи — как пробы зеленой массы (см. п. 2.3.3).
2.3.6. В лабораторию направляют среднюю пробу, которую составляют из хорошо перемешанных первичных проб данной партии, емкости и т. п. Масса средней пробы должна быть не более 500 г.
2.4. Отбор проб почвы.
2.4.1. Обследованию подлежат участки, подозреваемые в обсеменении возбудителем сибирской язвы. Обследуемую площадь разбивают на участки размером не более 16 м2. Почвенным буром отбирают пробы почвы массой 20—30 г каждая, по углам и в центре каждого участка.
Пробы почвы с территории, подозреваемой в поверхностном обсеменении сибиреязвенным возбудителем, берут на глубину до 15 см.
Перед взятием проб на территории скотомогильников верхний слой почвы на месте взятия пробы снимают на 2—3 см и пробу берут на глубину до 2 м через каждые 25 см.
2.4.2. Вынутую из глубины и не использованную для проб почву с целью обеззараживания смешивают с сухой хлорной известью, содержащей* 25% активного хлора, в соотношении 1 часть хлорной извести на
3 части почвы; если почва сухая, ее слегка увлажняют. Место отбора проб дезинфицируют раствором хлорной извести, содержащей 5% активного хлора, инструменты — огнем паяльной лампы.
2.5. Отбор проб воды.
2.5.1. Пробы воды из естественных и искусственных водоемов берут у поверхности (на глубине 10—15 см) и у дна при помощи батометра или специально приспособленной бутыли. Объем каждой пробы не менее 0,5 л, общий объем не менее 1 л.
Кроме того, берут пробы придонного осадка у береговой кромки, которые исследуют, как пробы почвы.
2.5.2. Перед взятием проб из водопровода кран обжигают горящим спиртовым тампоном. Открыв кран, набирают в стерильную посуду 0,5 л воды, затем в течение 10 мин спускают воду и берут еще 0,5 л в другую стерильную посуду.
2.6. Каждую отобранную пробу помещают в сухую стерильную стеклянную банку и закрывают стерильной крышкой, пробкой или пергаментом, можно использовать полиэтиленовые мешочки, которые завязывают шпагатом. Пробы воды наливают в стерильные стеклянные бутылки и закрывают стерильными резиновыми пробками. Пробы нумеруют (пробы шерсти — номером кипы), затем упаковывают во влагонепроницаемую тару и направляют в лабораторию с нарочным.
В сопроводительной к пробам указывают причину проведения исследования, какой материал и в каком количестве направляют, место и дату отбора материала, для проб шерсти и кормов дополнительно указывают их происхождение, объем (массу) партии, вид упаковки и количество упаковочных единиц. При направлении в лабораторию нескольких проб почвы, шерсти и т. п. к сопроводительной прилагают опись, где указывают номера проб и место отбора каждой пробы.
2.7. Отбор и упаковку проб проводят с соблюдением мер личной профилактики и общепринятых в бактериологической практике правил стерильности, не допуская рассеивания возбудителя при отборе и транспортировке проб.
3. Подготовка проб к исследованию.
3.1. При подготовке проб к исследованию и дальнейшей обработке используют только стерильные растворы, посуду, фильтры и т. п.
3.2. От каждой пробы шерсти отбирают наиболее загрязненные части, измельчают ножницами, вместе с пылью помещают в колбу и заливают 10-кратным (по массе) объемом физиологического раствора. Колбу закрывают, тщательно встряхивают в течение 10—15 мин и дают отстояться. Смыв фильтруют через 2—3 слоя марли для удаления грубых частиц.
3.3. Из разных мест присланной пробы шкурки берут кусочки массой в 1 г, освобождают от шерсти, помещают в фарфоровую ступку и заливают физиологическим раствором с таким расчетом, чтобы получить 10—15 мл суспензии. Спустя некоторое время (после достаточного размягчения материала) кусочки измельчают ножницами и оставляют при комнатной температуре еще на 2—3 ч.. После этого пробы хорошо растирают в той же жидкости до получения волокнистой мезги, затем мезгу удаляют, предварительно отжав ее пестиком на внутренней боковой поверхности ступки.
3.4. Пробу корма в количестве 50—100 г (грубые корма после измельчения ножницами) помещают в колбу необходимой емкости и заливают физиологическим раствором из расчета получения 15—20 мл смыва. Колбу закрывают, тщательно встряхивают в течение 10—15 мин,
дают отстояться 5—8 мин, не допуская набухания кормов, и фильтруют через 2—3 слоя марли.
3.5. Пробы почвы освобождают от корней, камешков и тщательно перемешивают. От каждой пробы берут 50—70 г, помещают в колбу, заливают физиологическим раствором, дистиллированной водой или 0,5%-ным раствором пирофосфата натрия из расчета получения 15— 20 мл смыва, хорошо встряхивают в течение 25 мин, дают отстояться 5—8 мин и фильтруют через 2—3 слоя марли.
3.6. Воду с илистыми частицами фильтруют через 2—3 слоя марли, чистую воду исследуют без предварительной подготовки.
4. Методы обогащения и бактериологическое исследование.
4.1. Смывы с шерсти, кормов, почвы, подготовленные, как указано в ,пп. 3.2, 3.4 и 3.5, а также пробы воды делят на две части.
4.2. Одну часть прогревают на водяной бане 30 мин при 65°С и фильтруют через 1—2 мембранных фильтра № Зв приборе Зейтца при небольшом вакууме. Осадок с каждого фильтра смывают 6—8 каплями физиологического раствора и высевают дробно на 3—4 чащки с МПА.
Мембранные фильтры перед использованием стерилизуют кипячением в дистиллированной воде 2 раза по 10 мин со сменой воды, фильтр Зейтца — обычным способом. Мембранные фильтры закладывают в фильтр Зейтца в стерильных условиях.
4.3. При проведении экспресс-анализа часть мембранного фильтра (см. п. 4.2) накладывают вверх поверхностью, через которую фильтровали материал, на чашку с 0,7%-ным МПА или с 2%-ным МПА, на последний предварительно наносят каплю МПБ, и помещают на 3 ч в термостат при 37°С. После этого фильтр снимают и делают смыв несколькими каплями физиологического раствора. Из смыва готовят мазки и проводят люминесцентно-серологическое исследование в соответствии с «Временным наставлением по применению флуоресцирующих сибиреязвенных сывороток «ОКВС», утвержденным Главным управлением ветеринарии Минсельхоза СССР 21 мая 1980 г.
4.4. Вторую часть смыва или пробы без предварительного прогревания фильтруют через мембранные фильтры и исследуют аналогично прогретой (см. п. 4.2). Кроме того, смывом с мембранных фильтров заражают двух белых мышей подкожно в дозе 0,2—0,3 мл и наблюдают за ними 10 сут. Из органов павших мышей делают мазки, которые окрашивают на капсулы, и посевы в МПБ и на МПА. (При проведении исследований методом флуоресцирующих антител с использованием адсорбированной сыворотки «ОКВС» заражение белых мышей исходным материалом не обязательно.)
4.5. Смывы с мучнистых кормов, которые трудно фильтруются через мембранные фильтры, центрифугируют 15 мин при 3000 об/мин. Высевы на 3—4 чашки с МПА делают из верхнего слоя надосадочной жидкости и осадка.
4.6. При отсутствии мембранных фильтров прогретые и непрогре-тые смывы, а также пробы воды центрифугируют 15 мин при 3000 об/мин, надосадочную жидкость удаляют и из осадка делают высевы на 3— 4 чашки с МПА.
4.7. Суспензией из шкурок, полученной, как указано в п. 3.3, заражают двух белых мышей подкожно в дозе 0,2—0,3 мл, с которыми поступают, как указано в п. 4.4.
Остаток суспензии центрифугируют 15 мин при 3000 об/мин, затем 2/3 надосадочной жидкости удаляют, оставшуюся жидкость с осадком
прогревают на водяной бане 30 мин при 65°С. После охлаждения осадок засевают дробно на 3—4 чашки с МПА.
4.8. Засеянные чашки инкубируют в термостате 18—24 ч при 37°С. После этого посевы просматривают и отбирают подозрительные колонии. Из этих колоний делают мазки для люминесцентной микроскопии и исследуют, как предусмотрено «Временным наставлением по применению флуоресцирующих сибиреязвенных сывороток «ОКВС» от 21 мая 1980 г. Всю дальнейшую работу с этими культурами проводят в соответствии с указанным наставлением.
4.9. При отсутствии флуоресцирующих сывороток из подозрительных колоний делают отвивки в МПБ и на МПА. Полученные чистые культуры идентифицируют по следующим тестам:
морфологии микроба;
характеру роста в МПБ и на МПА;
чувствительности к фагам «К» ВИЭВ или «Гамма-МВА»;
чувствительности к пенициллину (тест «жемчужного ожерелья»);
патогенности для белых мышей.
При необходимости определяют подвижность, гемолитическую активность, капсулообразоваиие in vitro и in vivo.
4.9.1. Фаготипирование проводят одним из следующих методов: стекающей капли, пробирочным или мнкрометодом с использованием сибиреязвенных фагов «Гамма-МВА» и «К» ВИЭВ. Исследования проводят в соответствии с наставлениями по применению указанных фагов, утвержденными Главным управлением ветеринарии Минсельхоза СССР.
4.9.2. Тест «жемчужного ожерелья». Перед постановкой пробы готовят 3 пробирки с 10 мл (или 3 колбы со 100 мл) МПА каждая, в две из которых стерильно добавляют пенициллин из расчета 0,5 ЕД/мл (первая) и 0,05 ЕД/мл (вторая), третья — контрольная. Агар разливают в чашки Петри и после застывания пробиркой с ровными краями делают насечки агара или вырезают пластинки (1,5Х 1,5 см), которые переносят на предметные стекла и помещают в чашку Петри. На каждую пластинку делают высев 3-часовой бульонной культуры. Чашки закрывают и помещают в термостат при 37°С на 3 ч. Через 3 ч посевы просматривают под микроскопом с сухой (объектив X 40) и иммерсионной системами. Перед просмотром зону роста накрывают покровным стеклом.
Сибиреязвенные микробы на МПА с пенициллином принимают шаровидную форму, а их цепочки имеют вид «жемчужного ожерелья». Спорообразующие сапрофитные аэробные микробы в аналогичных условиях вырастают в виде клеток обычной формы. На контрольном агаре сибиреязвенные микробы образуют длинные цепочки, состоящие из типичных палочек.
При отрицательном результате микроскопии через 3 ч инкубацию посевов продолжают до 6 ч, после чего исследуют повторно и делают заключительный учет теста.
4.9.3. Исследование на подвижность проводят микроскопически методом раздавленной капли или макроскопически путем посева исследуемой культуры уколом в столбик полужидкого агара (0,2—0,3%-ного). Посевы ставят на 24 ч в термостат при 37°С. Возбудитель сибирской язвы неподвижен (рост по уколу).
4.9.4. Гемолитическую активность определяют при посеве исследуемой культуры на 5%-ный кровяной агар или бульон. Результаты учитывают через 16—20 ч инкубации посевов в термостате при 37°С.
Возбудитель сибирской язвы гемолитической активностью не обладает.
4.9.5. Метод выявления капсулообразования in vitro. Для исследо-