Методические указания по лабораторной диагностике сапа
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
Предисловие
1. Общие положения
2. Серологическая диагностика
3. Бактериологическая диагностика
4. Гистологическое исследование
Предметный указатель
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 08.12.1982 | Утвержден | Главное управление ветеринарии Минсельхоза СССР | |
|---|---|---|---|
| Издан | Агропромиздат | 1986 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9
стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20
СПВ4ВОЧНИК
ЛАБСШОРНЬЕ
ИССЛЕДОВАНИЯ В ВЕТШ/1НАРИИ
БАКТЕИ^АЛЬНЫЕ
ИНТЕКЦИИ
СПРАВОЧНИК
ЛАБОРАТОРНЫЕ
ИССЛЕДОВАНИЯ
В ВЕТЕРИНАРИИ
•
БАКТЕРИАЛЬНЫЕ
ИНФЕКЦИИ
Под редакцией Б. И. АНТОНОВА
МОСКВА АГРОПРОМИЗДАТ 1986
2.5. Постановка главного опыта.
2.5.1. Испытуемые сыворотки исследуют в разведениях 1 : 5 и I : 10 с антигеном и в разведении 1 : 5 без антигена (контроль). Для этого каждую сыворотку (в том числе позитивную и негативную) разливают в 3 пробирки: 0,1 мл (контроль без антигена), 0,1 и 0,05 мл (опытные) — и добавляют по 0,4; 0,4 и 0,45 мл физраствора соответственно. Разведенные сыворотки инактивируют в водяной бане 30 мин: сыворотки лошади при 58—59°С, ослов и мулов — при 62—63°С.
2.5.2. В опытные пробирки вносят по 0,5 мл сапного антигена в рабочем разведении, в контрольные — по 0,5 мл физраствора, во все пробирки — по 0,5 мл комплемента в установленном титре. Штативы встряхивают и помещают в водяную баню на 20 мин при 37—38°С.
Затем во все пробирки вносят по 1 мл гемолитической системы, встряхивают и вновь помещают в баню на 20 мин при 37—38°С.
2.5.3. Одновременно с главным опытом ставят следующие контрол и:
позитивная и негативная сыворотка в тех же разведениях, что и испытуемые;
антиген в двойной дозе без сыворотки (на анти ком племеитарность);
антиген в двойной дозе без сыворотки и комплемента (на гемотоксичность);
гемсистема с физраствором.
2.5.4. При массовых исследованиях допускается разлив сывороток только в дозе 0,05 мл с последующей перестановкой сывороток, давших задержку гемолиза, как указано выше.
2.6. Учет реакции проводят 2 раза: сразу после бани и па следующий день при хранении реакции в холодильнике.
Сначала учитывают результаты контролей. Если в пробирках с позитивной сывороткой и антигеном, с двойной дозой антигена без сыворотки и комплемента, с гемсистемой и физраствором будет полная задержка гемолиза, а в пробирках с негативной сывороткой и антигеном, с сапной и негативной сыворотками без антигена и с двойной дозой антигена без сыворотки — полный гемолиз, постановку реакции считают правильной и проводят учет результатов.
Реакцию учитывают по степени задержки гемолиза эритроцитов, которую определяют по шкале, приготовленной перед учетом реакции. Для этого содержимое нескольких пробирок с полным гемолизом сливают в одну, затем гемолизированную жидкость и физраствор разливают в пробирки по следующей схеме.
|
Номера пробирок | ||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||
|
ванных эритроцитов | ||||||||||||||||||||||||||||||||||||||||||||
В соответствии с этой шкалой устанавливают степень задержки гемолиза эритроцитов в каждой пробирке.
2.7. Реакцию в крестах оценивают в зависимости от процента гемо лизированных эритроцитов, пользуясь следующей таблицей.
Процент гемолизиро-ваиных эритроцитов
++++
++
+
Оценка степени задержки гемолиза в крестах
0—10
10-40
40—70
70—90
90-100
Диагностическим титром сыворотки считается разведение ее 1 : 10. При задержке гемолиза эритроцитов в этом разведении сыворотки на +++4* и И—реакцию считают положительной независимо от результатов реакции с сывороткой в разведении 1 : 5; при задержке на -+—f- и Н--сомнительной, если задержка гемолиза с сывороткой в раз
ведении I : 5 соответствует Н~(-++ или ++4-. Во всех других случаях реакцию считают отрицательной.
Результат исследования отмечают в сопроводительной ведомости словами «положительно», «сомнительно» с указанием степени задержки гемолиза в крестах или «отрицательно».
3. Бактериологическая диагностика.
3.1. Бактериологическая диагностика включает микроскопическое, бактериологическое и биологическое исследования.
Учитывая благополучие страны по заболеванию лошадей сапом, исследование материала следует начинать с постановки биопробы (см. п. 3.4), так как при отсутствии патологоанатомических изменений микроскопическое и бактериологическое исследования малорезультативны.
3.2. Микроскопическое, исследование. Мазки готовят из гноя, пораженных тканей и окрашивают по Граму, синькой Леффлера (старой) или по Романовскому — Гимзе.
В положительных случаях обнаруживают грамотрицательные полиморфные палочки, часто расположенные попарно или нитями из нескольких члеников. При окраске по Романовскому — Гимзе и синькой Леффлера отмечают хорошо выраженную зернистость.
3.3. Бактериологическое исследование.
3.3.1. Высев из патологического материала делают с помощью пастеровской пипетки с грушей или шприца с длинной тонкой иглой (отдельного для каждого органа) в МПБ и на МПА с 2—4% глицерина (МПГБ, МПГА), pH 6,8-7,0.
Посевы инкубируют при 37—38°С. Рост обычно появляется на 1—2-е сут, иногда позже.
При росте возбудителя бульон мутнеет, на дне появляется слизистый серо-белый осадок, поднимающийся штопором при встряхивании пробирки, некоторые штаммы на поверхности бульона образуют пленку.
На агаре возбудитель сапа растет в виде гладких полупрозрачных колоний серовато-белого цвета с перламутровым оттенком, сливающихся затем в слизистый налет на поверхности среды.
В мазках из агаровых культур обнаруживают грамотрицательные палочки, часто нити, состоящие из 4—8 члеников; в мазках из жидких сред палочки бывают короче и толще, нередко коккоподобные.
3.3.2. Для идентификации возбудителя выделенную культуру после микроскопического исследования пересевают на глицериновый картофель, молоко, среды Гисса с глюкозой, лактозой, сахарозой, мальтозой
ПО
и маннитом, определяют подвижность (в раздавленной или висячей капле), а также ставят реакцию агглютинации на стекле с сапной сывороткой.
При культивировании на глицериновом картофеле получают наиболее характерный рост: вначале, через 2—3 сут, появляются мелкие полупрозрачные с желтоватым оттенком колонии, которые затем сливаются, образуя слизистый «медовый» налет. Цвет налета меняется от янтарно-желтого в первые 3 дня роста до буро-коричневого и красноватого к 6—8-му дню.
Возбудитель сапа медленно (на б—8-й дн.) свертывает молоко, разжижает желатину, сбраживает глюкозу и лактозу с образованием кислоты без газа, не сбраживает сахарозу, мальтозу, маннит, неподвижен.
РА с позитивной сапной сывороткой является вспомогательным тестом, потому что не все штаммы агглютинируются сапной сывороткой.
3.4. Биологическое исследование проводят на 2—3 золотистых хомячках или морских свинках, лучше самцах.
3.4.1. Гнойное отделяемое из язв, носовые выделения, гной из абсцессов, пунктат из лимфатических узлов, кровь, кусочки органов тщательно растирают в стерильной ступке с небольшим количеством физраствора в равномерную взвесь. Полученную суспензию (1 : 10) вводят подкожно в области шеи золотистым хомячкам в дозе 0,5—1 мл, морским свинкам — 3—5 мл.
Материалом, взятым стерильно (пунктат из лимфатических узлов или невскрывшихся абсцессов), золотистых хомячков и морских свинок можно заражать внутрибрюшинно в тех же дозах.
Наблюдение за зараженными животными ведут в течение 15 дн.
3.4.2. При наличии в исследуемом материале возбудителя сапа через 3—4 дня на месте подкожного введения материала образуется язва с уплотненными краями; зараженные животные малоподвижны, у них развивается ринит, конъюнктивит, орхит.
Гибель хомячков наступает через 5—7 дн., морских свинок — через 8—15 дн. У морских свинок заболевание может перейти в хроническую форму.
Животных с клиническими признаками болезни усыпляют эфиром, вскрывают, из сердца, селезенки, печени, семенников делают высев на питательные среды, как указано в подпункте 3.3.1. Аналогично поступают с павшими зараженными животными.
3.5. Диагноз считается установленным при получении одного из следующих показателей:
выделение культуры со свойствами, характерными для возбудителя сапа, хотя бы из одного зараженного лабораторного животного (без выделения культуры возбудителя из патологического материала);
выделение культуры со свойствами, характерными для возбудителя сапа, и развитие у зараженных лабораторных животных клинической картины и патологоанатомических изменений, типичных для данного заболевания.
3.6. Срок исследования—до 15 дн.
4. Гистологическое исследование.
4.1. Для исследования отбирают кусочки пораженных органов и тканей. При этом учитывают, что сапные узелки округлой формы, плотные, серовато-белого цвета, полупрозрачные в центре, с пояском гилеремированной и отечной ткани, величиной от просяного зерна (мил-лиарный сап) до лесного ореха. Более старые узелки инкапсулированы и обызвествлены или абсцедированы. При сапной пневмонии пораженные
участки легких отечны, серовато-желтого цвета, хорошо выражена междольчатая соединительная ткань, бронхи заполнены гнойно-слизистым экссудатом. При хроническом течении ткань легких сильно уплотнена.
На слизистых оболочках после отторжения некротизированного узелка обнаруживают язву с саловидиым дном, неровными припухшими краями, покрытую гноем; после рубцеватая язвы — характерный белый звездчатый шрам.
При отсутствии патологоаиатомических изменений берут кусочки легких, регионарных им лимфатических узлов, а также подчелюстных и заглоточных лимфатических узлов.
4.2. Отобранные кусочки фиксируют в 10%-ном растворе нейтрального формалина, проводку выполняют любым способом и приготовленные срезы окрашивают гематоксилин-эозином.
4.3. При микроскопическом исследовании гистопрепаратов в начальной стадии формирования сапного узелка на фоне серозно-фибрноз-ного экссудата находят скопления нейтрофильных лейкоцитов с пикно-тичными и зачастую гиперхромными ядрами. В сформированном сапном узелке в некротизированном центре видны глыбки хроматина распавшихся ядер (кариорексис), окруженные зоной эпителиоидных и ближе к периферии лимфоидных клеток, среди которых в небольшом количестве имеются фибробласты и коллагеновые волокна. На более поздних стадиях вокруг эпителиоидных клеток образуется соединительнотканная капсула. В перифокальной зоне кровеносные сосуды расширены, прилегающая ткань пропитана серозно-фибринозным экссудатом.
При экссудативной форме бронхопневмонии сапного происхождения просматриваются альвеолы, пропитанные серозно-фибринозным экссудатом, в котором расположены островки лейкоцитов и эпителйоид-ных клеток с ядрами в состоянии пикноза и рексиса. Бронхи заполнены слизью со опущенным респираторным эпителием и распадающимися лейкоцитами.
Для гранулемы носовой перегородки характерно расположение эпителиоидной и лимфоидной зоны в сторону подлежащих тканей.
4.4. Результаты гистологического исследования учитывают в комплексе с результатами других методов исследования патологического материала.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
е
|
Агар глюкозо-кровяной 227 — дрожжевой 27 — картофельный 82 — кровяной 230 — молочно-солевой 228 — мясо-пептонный печеночно* глюкозо - глицериновый (МППГГА) 82 — печеночно-аминопептидный 85 — печен очно-глюкозо-глицериновый (ГИТА) 82 — плотный печеночно-сывороточный 85 — полужидкий печеночно-сывороточный 85 — полужидкий с дефибриниро-ванной кровью 248 — сывороточно-декстрозный 85 — шоколадный 239 Бульон глюкозо-сывороточный 227 — дрожжевой 27 — мясо-пептон ный печеночный (МППБ) 82 — печен оч но-глюк озо-глицериновый 82 — с желчью 10%-ный 186, 227 — 40%-ный 230 Вода мясная 82 — печеночная 82 Выбор питательных сред 271 Гель агаровый 1%-ный 31 Дезагрегация ткани 314 Жидкость Карнуа 309 Индикатор для определения анаэробных условий 39 Консервирующая смесь глицериновая 185 --фосфатная буферная 185 Лизис желчью 225 |
Метод выявления капсулообра-зования 13, 14 — определения вирулентности сибиреязвенных культур 14 — флуоресцирующих антител (МФА) 180 Молоко с метиленовым синим 228 — с 0,02%-ньм метиленовым синим 230 Обнаружение индола 217 Окраска мазков гематоксилин-эозином 309 --по Козловскому 81 --по методу Гипса 239 --по Романовскому — Гим- зе 309 --по Стампу 81 --по Фельгену 309 --по Шуляку — Шину 82 Определение гемолитической активности 8 — концентрации углекислого газа 85 Получение и подготовка эритроцитов барана для постановки РСК и РДСК 86 Приготовление индикаторных бумажек 187 Раствор антибиотиков 272 — веронал-мединаловый буферный 329 — версена 282 — гидролизата лактоальбумииа 0,5%-ный 283 — гидролизата мышечных белков 0,3%-ный 282 — глицерина 216 — двууглекислого натрия 282 — двухромовокислого калия 279 — полиэтиленгликоля 326 — Тироде 281 — трипсина 283 — уксусной кислоты 282 |
|
— физиологический хлорида натрия с добавлением ионов магния и кальция (для постановки РСК и РДСК) 86 — Хенкса 281 — хлориду натрия феиолезиро-ванные для.РА 86 Реактив биуретовый 328 — йодистый калий 328 Реакция диффузной преципитации в геле 333 — с метилротом 218 — нейтрализации с целью выявления антител к вирусу инфекционного ринотрахеита и вирусной диареи 332 — непрямой гемагглютинации (РПГА) 332 — преципитации 8 — связывания комплемента (РСК) 334 — торможения гемагглютина-ции (РТГА) 332 — Фогеса — Проскауэра 218 — Эрлиха 181 — метиленового синего 226 Среда Биттера с рамнозой 187 — водно-сывороточная 145 — дифференциальная висмут-сульфат-агар 186 -- Левина 186 --Плоски рева 186 --трехуглеводная с мочевиной 186 --Эндо 186 — для обнаружения сероводорода 216 — для определения способности бактерий расщеплять мочевину 218 н — для посева по Свену — Гарду 187 — Дюбуа — Смита 90 — Заксе 243 — Игла 282, 324 |
— из гидролизата мышцы сердца крупного рогатого скота 252 — из куриного мяса 260 — Кларка 218 — Клиглера 217 — комбинированная Олькениц-кого 216 — Мартена 251, 260 — плотная ВИЭВ для изоляции кампилобактерий 125, 126 — сафранино-железо-новобиоци-новая 123, 124 — Симмонса 216 — с лактозой 252 — с повышенным содержанием лактозы 187 — с теллуритом калия 228 — триптический перевар бычьего сердца 337 — Ферворта — Вольфа в модификации С. И. Тарасова 146 — Флетчера 146 — 6,5%-ного хлорида натрия 228 — Хоттингера 259 — Эдварда 258 — энтерококковая дифференциально-диагностическая 228 Среды индикаторные с амидочерным 168 --с конгоротом 168 --с лакмусом 167 --с метил ротом 167 --с нейтральротом и метиленовой синью 167 --обогащения Кауфмана 186 --Киллиана 186 --Мюллера 186 -- селенитовая 185 — плотные питательные 252 Тест «жемчужного ожерелья» 6,7 Фаготипирование 17—28 Экстракт дрожжевой 252 Эритрит-агар 85 |
СОДЕРЖАНИЕ
©
Предисловие........................ 3
Методы диагностики бактериальных инфекций....... 5
Сибирская язва.................... 5
Методические указания по лабораторной диагностике сибирской язвы ..................... 5
Методические указания по обнаружению возбудителя сибирской язвы в сырье животного происхождения и объектах
внешней среды..................... 9
Временное наставление по применению сибиреязвенного бактериофага «К» ВИЭВ для определения возбудителя сибирской язвы..................... 17
Временное наставление по применению сибиреязвенного фага «Гамма-MBA» для определения возбудителя сибирской
язвы.......................... 28
Временные методические указания по постановке реакции диск-преципитации при диагностике сибирской язвы и идентификации ее возбудителя................ 29
Наставление по исследованию кожевенного и мехового сырья
на сибирскую язву реакцией преципитации ....... 31
Эмфизематозный карбункул................. 37
Методические указания по лабораторной диагностике эмфизематозного карбункула................. 37
Злокачественный отек.................... 40
Методические указания по лабораторным исследованиям
на злокачественный отек животных.......... 40
Брадзот овец........................ 44
Методические указания по лабораторной диагностике брад-
зота овец....................... 44
Инфекционная энтеротоксемия животных и анаэробная дизентерия ягнят......................... 48
Методические указания по лабораторной диагностике инфекционной энтеротоксемии животных и анаэробной дизентерии ягнят....................... 48
Столбняк.......................... 52
Методические указания по лабораторной диагностике столбняка .......................... 52
Ботулизм.......................... 53
Методические указания по лабораторной диагностике ботулизма .......................... 53
Некробактериоз ....................... 56
Методические указания по лабораторной диагностике некро-
бактериоза....................... 56
Копытная гниль овец и коз................ 58
Приложение к «Инструкции по профилактике и ликвидации копытной гнили овец и коз» .............. 58
Временные методические указания по обнаружению возбудителя копытной гнили в патологическом материале от больных овец с помощью непрямого метода иммунофлуоресценции .......................... 59
Бруцеллез......................... 60
Наставление по диагностике бруцеллеза животных ... 60
Паратуберкулез ...................... 89
Наставление по диагностике паратуберкулезного энтерита
(паратуберкулеза) крупного рогатого скота ....... 89
Методика обнаружения в патологическом материале возбудителей туберкулеза и паратуберкулеза методом люминесцентной микроскопии.................. 92
Временное наставление по' постановке реакции связывания комплемента для диагностики паратуберкулеза крупного рогатого скота и овец с антигеном Сибирского научно-исследовательского ветеринарного института ........ 94
Сап............................ 104
Методические указания по лабораторной диагностике сапа 104
Кампилобактериоз (вибриоз)................ 112
Извлечение из временной инструкции по диагностике, профилактике и ликвидации вибриоза крупного рогатого скота и овец........................ 112
Наставление по применению кампилобактериозных (вибриозных) люминесцирующих сывороток при лабораторной диагностике кампилобактериоза (вибриоза) животных .... 120
Рекомендации Центральной ветеринарной лаборатории по приготовлению и применению сафранино-жел зо-новобиоци-
Наставление по применению вибриозных агглютинирующих моноспецифических сывороток.............. 116
новой среды (СЖН) при лабораторной диагностике вибриоза 123 Временные рекомендации Центральной ветеринарной лаборатории по приготовлению и применению плотной среды ВИЭВ
для изоляции кампилобактерий............. 125
Наставление по применению кампилобактериозного (вибри-озного) антигена для реакции агглютинации с вагинальной
слизью (РАВС).................... 126
Лептоспироз......................... 128
Методические указания по лабораторной диагностике леп-
тоспнроза животных.................. 128
Методические указания по применению групповых агглютинирующих лептоспирозных сывороток.......... 146
Методические указания по применению флуоресцирующего
глобулина для диагностики лептоспироза ....... 148
Листериоз......................... 151
Наставление по лабораторной диагностике листериоза животных ......................... 151
Методические указания по применению набора лиофилизи-рованных бактериофагов для идентификации возбудителя
листериоза....... 169
Рожа свиней........................ 170
Методические указания по лабораторным исследованиям на
рожу свиней...................... 170
Наставление по применению сухих рожистых люминесцирующих сывороток (для прямого метода иммунофлуоресценции) .......................... 173
Пастереллез........................ 175
Наставление по лабораторной диагностике пастереллеза птиц 175
Сальмонеллезы....................... 177
Методические указания по бактериологической диагностике
сальмонеллезов животных................ 177
Наставление по применению наборов сывороток сальмонел-лезных О-комплексных и монорецепторных О и Н-агглюти-нирующнх для экспресс-идентификации сальмонелл в РА па
стекле......................... 192
Наставление по применению комплексной и групповых саль-монеллезных флуоресцирующих сывороток (для прямого метода иммунофлуоресценции)............... 195
Временная методика серологической диагностики сальмонеллеза овец в реакции непрямой (пассивной) гемагглютина-
ции (РИГА)...................... 205
Наставление по применению серогрупповых антигенов и сывороток В, С| и Di для диагностики сальмонеллеза в пробирочной реакции агглютинации (РА) ......... 207
Колибактериоз....................... 209
Методические указания по бактериологической диагностике колибактериоза (эшерихиоза) животных....... 209
Наставление по применению агглютинирующих О-коли-
сывороток....................... 218
Диплококковые заболевания............. . . 221
Методические указания по лабораторным исследованиям на пневмококковую (диплококковую) инфекцию животных 221
Стрентококкозы сельскохозяйственных животных...... 224
Методические указания по лабораторной диагностике стреп-
тококкоза животных.................. 224
Методические указания по лабораторной диагностике стрептококковой септицемии птиц............... 228
Методические указания по лабораторной диагностике стрептококкового полиартрита ягнят .............. 230
Методические указания по лабораторной диагностике мыта 233
Псевдомоноз........................ 235
Временное наставление по применению набора О-агглютини-рующих сывороток для диагностики псевдомоноза .... 235
Гемофил езы......................... 237
Временные методические указания по лабораторной диагностике гемофилезного полисерозита свиней....... 237
Временные методические указания по лабораторной диагностике гемофилезной плевропневмонии свиней..... 240
Методические указания по лабораторной диагностике контагиозного метрита лошадей................ 243
Микоплазмозы....................... 248
Методические указания по лабораторной диагностике инфекционной агалактии овец и коз............ 248
Методические указания по лабораторной диагностике инфекционной плевропневмонии коз............ 253
Наставление но диагностике респираторного микоплазмоза
птиц.......................... 257
Реакция агглютинации для диагностики респираторного микоплазмоза птиц с цельной кровью (ККРА) и сывороткой крови (СКРА)..................... 264
Наставление по постановке РСК при перипневмоиии крупного рогатого скота.................. 265
Дизентерия свиней..................... 268
Методические указания по лабораторным исследованиям на
дизентерию свиней, вызываемую трепонемой....... 268
Методические указания по определению чувствительности к антибиотикам возбудителей инфекционных болезней сельскохозяйственных животных................ 270
Методические указания по применению культур клеток в диагностических исследованиях.................. 279
Методические рекомендации по получению, культивированию и использованию в научных и производственных ветеринарных лабораториях первичных, перевиваемых и диплоидных культур
клеток животного происхождения.............. 279
Наставление по применению гидролизата мышечных белков ферментативного сухого (ФГМ-С) для питательных сред тканевых
культур.......................... 298
Рекомендации по профилактике, диагностике контаминнрования культур клеток микроорганизмами и меры по их деконтаминации 299
Методические указания по получению и применению в вирусологической практике перевиваемых линий клеток из лимфоидных
органов крупного рогатого скота и почек теленка...... 314
Методические рекомендации по очистке сыворотки крови крупного рогатого скота, используемой для культивирования клеточных
культур.......................... 326
Временное наставление по получению, контролю и использованию сыворотки крови животных для культивирования клеток и
вирусологических исследований............... 337
Предметный указатель................... 347
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ:
Бактериальные инфекции
Составители: Борис Иванович Антонов,
Валерия Валентиновна Борисова, Галина Михайловна Волкова и др.
Заведующий редакцией В. Г. Федотов. Редактор В. Н. Сайта над и. Художник А. И. Бершачевская. Художественный редактор М. Д. Северина. Технический редактор Е. В. Соломович. Корректоры Н. fl. Туманова, Т. Н. Бобрикова, М. В. Писарева
ИБ № 4308
Сдано в набор 13.06.85. Подписано к печати 06-12.85. Т-22156. Формат 84хЮ8‘/«- Бумага тип. №3. Гарнитура литературная. Печать высокая. Уел. псч. л. 18.18. Уел. кр.-отт. 18,48. Уч -изд. л. 27,27.. Изд. № 360 Тираж 2 9000. экз. Заказ Л1? 419 . Цена 1 р. 4 0 к.
Ордена Трудооого Красного Знамени ВО «АгропроМиздат», 107807, ГСП, Москва, Б-53, ул. Садовая-Сласская, 18 Набрано в ордена Октябрьской Революции и ордена Трудового Красного Знамени МПО «Первая Образцовая типография имени А. А. Жданова»Союзполиг-рафпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли: 1 13054, Москва, Валовая, 28
Отпечатано с матриц во Владимирской типографии СоюЗполиграфпрома при Государственном комитете СССР по долам издательств, полиграфии и книжной торговли, 600000, г. Владимир, Октябрьский проспект, д. 7.
ББК 48.73 Л 12
УДК 619:616.9—08(031)
Составители: Б. И. Антонов, В. В. Борисова, Я. М. Волкова, »/7. Я. Каменева, Л. В. Кошеленко, Г. А. Михальский, В. В. Лоповцев, Л. И. Прянишникова, В. Е. Храпова
Лабораторные исследования в ветеринарии. Бакте-Л12 риальные инфекции: Справочник/Сост. Б. И. Антонов, В. В. Борисова, П. М. Волкова и др.; Под ред. Б. И. Антонова.— М.: Агропромиздат, 1986.— 352 с.
В книге даны методы лабораторных исследований патологического материала с целью определения возбудителя нпфекционноЛ болезни. Они изложены по единой схеме: бактериологические и бактериоскопнческие исследования, биопроба, идентификация и дифференциация возбудителей. Методы унифицированы и стандартизированы
Для ветврачей и фельдшеров, лаборантов ветеринарных лабораторий.
3805020000-079 035 (01)-86
305—86
ББК 48.73
© ВО «Агропромиздат», 1986
ПРЕДИСЛОВИЕ
В деле выполнения решении партии и правительства по дальнейшему развитию животноводства, а также задач, поставленных Продовольственной программой страны, ветеринарной службе большую помощь оказывают ветеринарные лаборатории.
Ветеринарные лаборатории осуществляют диагностику инфекционных и паразитарных болезней животных, выявляют нарушения обмена веществ в их организме, проводят исследования, направленные на предупреждение отравлений, помогая тем самым специалистам совхозов, колхозов и других хозяйств успешно осуществлять лечебнопрофилактические мероприятия. От того, насколько своевременно ставится диагноз, разработаны и рекомендованы профилактические и лечебные меры, зависит успех ликвидации болезней, сохранность поголовья животных и повышение их продуктивности.
Последнее время в лабораториях появилось много приборов и приспособлений, облегчающих труд специалистов и позволяющих проводить исследования на более современном и качественном уровне, с большой достоверностью. В связи с этим многие ранее действовавшие методические указания переработаны.
Кроме того, ежегодно для лабораторной практики предлагаются новые методы диагностики. В отечественной и зарубежной литературе постоянно публикуется большое количество материалов о новых методах исследований, предлагаются различные модификации существующих методик, вводятся дополнительные диагностические тесты.
Ветеринарные лаборатории в своей работе не могут использовать всего многообразия имеющихся в литературе методов исследования или из-за того, что они недостаточно апробированы, или из-за сложности применяемого оборудования. Иногда методы, предлагаемые различными авторами, при определении одних и тех же показателей дают несовпадающие результаты.
В связи с этим в справочник включены методы лабораторных исследований патологического материала, получаемого от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные Главным управлением ветеринарии Министерства сельского хозяйства СССР. Книга содержит методические указания по диагностике инфекционных болезней бактериальной этиологии, а также методические указания по применению культур клеток в диагностических исследованиях.
Методики изложены по единой схеме,- взятие и пересылка патологического материала, методы его обработки и обогащения; бактериоско-пические исследования, включая световую и люминесцентную микроскопию; выделение культур возбудителей инфекционных болезней на питательных средах; заражение лабораторных животных как с целью выделения чистой культуры возбудителя, так и определения степени ее патогенности; гистологические исследования; идентификация и дифференциация возбудителей с использованием различных методов; серологические исследования для определения вида возбудителя.
Приведенные в справочнике методы лабораторных исследований унифицированы и стандартизированы. В широком смысле слова унификация и стандартизация подразумевают применение для различных исследований одних и тех же аппаратов, приборов, инструментов, посуды, реактивов, исключая, конечно, специальные методы исследования; применение стандартных (унифицированных) питательных сред и диагностикумов; разработку методических указаний по единой форме. Все это позволяет лабораторным работникам с меньшей затратой сил и средств, на высоком методическом и техническом уровне, качественно и в срок проводить диагностические исследования. Таким образом, стандартизация методов исследования явится способом наведения строгого порядка в работе ветеринарных лабораторий.
Книга предназначена для ветеринарных врачей, фельдшеров, а также лаборантов ветеринарных диагностических лабораторий.
В справочник не вошли материалы по диагностике туберкулеза, так как они пересматриваются и дополняются, поэтому их публикация будет осуществлена в последующих изданиях.
САПМетодические указания по лабораторной диагностике сапа
(Утверждены Главным управлением ветеринарии Минсельхоза СССР 8 декабря 1982 г.)
1. Общие положения.
1.1. Сап — заразная болезнь цельнокопытных, протекающая преимущественно в хронической форме и передающаяся человеку.
1.2. Возбудитель болезни Pseudomonas mallei — мелкая, часто зернистая, неподвижная, не образующая спор грамотрицательная палочка.
1.3. Основной метод лабораторной диагностики сапа — серологический — реакция связывания комплемента; другие методы исследования (микроскопический, бактериологический, биологический и гистологический) используются при необходимости.
1.4. Материалом для серологического исследования служит сыворотка крови; для микроскопического, бактериологического и биологического исследований — кровь, гнойное отделяемое язв, носовые выделения, пунктат лимфатических узлов, гной из абсцессов, от убитых животных — пораженные участки органов и тканей — легких, печени,-селезенки, лимфатических узлов, носовой перегородки, трахеи, бронхов и др., а при отсутствии патологоанатомических изменений — легкие с регионарными лимфатическими узлами, подчелюстные и заглоточные лимфатические узлы; для гистологического исследования используют кусочки органов и тканей, перечисленных выше.
2. Серологическая диагностика.
2.1. Серологическая диагностика сапа основана на обнаружении в сыворотке крови больных лошадей (ослов, мулов) специфических антител в реакции связывания комплемента.
2.2. В реакции используют следующие компоненты: сапной антиген, позитивную и негативную сыворотки, гемолитическую сыворотку (гемолизин) и комплемент, изготовленные на биофабрнке, 2,5%-ную
взвесь эритроцитов барана в физиологическом растворе, испытуемые сыворотки, свежие или консервированные борной кислотой (2% к объему) или мертиолятом (1:10 000), физиологический раствор (0,85%-ный раствор химически чистого хлорида натрия в дистиллированной воде), pH 6,8-7,2.
При отсутствии негативной сыворотки бнофабричного изготовления разрешается использовать сыворотку крови здоровой лошади.
2.3. Подготовка компонентов для реакции.
2.3.1. Перед постановкой реакции, исходя из титра, указанного на этикетке, готовят разведение каждого компонента в количестве, необходимом для всей реакции, т. е. для их титрования и постановки главного опыта.
В процессе работы не допускается дополнительно разводить компоненты, смешивать их с ранее разведенными и использовать в реакции без титрования.
2.3.2. Физиологический раствор, используемый для разведения компонентов, готовят накануне или в день постановки реакции и кипятят в течение 5 мин.
2.3.3. Гемолизин (с титром не ниже чем 1 : 1000) используют в реакции в удвоенном титре. Например, при титре гемолизина 1 : 1000 его берут 2 : 1000, т. е. для приготовления 100 мл берут 0,2 мл гемолизина и растворяют его в 99,8 мл физиологического раствора.
2.3.4. Перед работой отбирают необходимое количество ампул (флаконов) с комплементом, растворяют его в физрастворе, количество которого указано на этикетке, сливают в одну пробирку и получают основной раствор комплемента, который хранят в холодильнике на протяжении постановки реакции. Из этого раствора готовят разведение 1 : 20 для титрования.
2.3.5. Разведенные компоненты перед постановкой реакции проверяют на антикомплемснтарность и гемотоксичность по следующей схеме.
| |||||||||||||||||||||||||||||||||||||||
|
Обозначения. ПГ-полный гемолиз; НГ—нет гемолиза. | |||||||||||||||||||||||||||||||||||||||
2.3. G. После проверки компонентов готовят гемолитическую систему, смешивая в равных объемах 2,5%-ную взвесь эритроцитов и раствор гемолитической сыворотки, взятой в удвоенном титре. После приготовления гемолитическую систему выдерживают 25—30 мин при 37—38°С.
2.4. Титрование компонентов реакции.
2.4. !. Титрование гемолизина проводят при использовании новой серии или в случае подозрения на снижение его титра.
Из основного разведения гемолизина I : 100 (0,1 мл гемолизина и 9,9 мл физиологического раствора) готовят последующие разведения.
Схема разведения гемолизина следующая.
Основное разведение гемолизина 1:100, мл
0,2
0,1
0,1
0,1
0,1
0,1
Физиологический раствор, мл
0,8
0,9
1,15
1.4
1.05
1.9
Полученное разведение гемолизина
1:500
1:1000
1:1250
1:1500
1:1750
1:2000
Затем по 0,5 мл каждого разведения переносят в ряд пробирок, в каждую пробирку добавляют по 0,5 мл комплемента в разведении 1 : 20, по 0,5 мл 2,5%-ной взвеси эритроцитов и по 1,0 мл физиологического раствора. Штатив с пробирками встряхивают и помещают в водяную баню на 10 мин при 37—38°С.
Титром гемолизина считают наибольшее его разведение, при котором наблюдается полный гемолиз эритроцитов.
2.4.2, Титрование комплемента проводят в гемолитической и бак-териолитической системах.
Для титрования в гемолитической системе комплемент в разведении 1 *• 20 разливают в ряд пробирок в дозах от 0,1 до 0,37 с интервалом 0,03 мл. В каждую пробирку добавляют физиологический раствор до объема 0,5 мл, по 1,0 мл гемолитической системы и по 1,0 мл физиологического раствора. Пробирки встряхивают и ставят в водяную баню при 37—38°С на 10 мин (см. табл. 1).
|
Таблица 1 Схема титрования комплемента в гемолитической системе Номера пробирок | ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
|
Номера пробирок | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
|
Обозначения. ПГ — полный гемолиз; ЧГ-частичный гемолиз. | |||||||||||||||||||||||||||||||||||||||||||||||||
Титром комплемента в гемолитической системе считают наименьшее его количество, вызывающее полный гемолиз эритроцитов (в таблице 1 титр комплемента — 0,19). Титр комплемента должен быть не ниже 0,31. При использовании биофабричного комплемента титрование его в гемсистеме не обязательно.
Титрование комплемента в бакториолитической системе проводят перед каждой постановкой реакции. Комплемент титруют на позитивной (сапной), негативной и 1—2 сыворотках, взятых из опыта. Каждую сыворотку вносят в 2 ряда пробирок по 0,05 мл, добавляют по 0,45 мл физиологического раствора и инактивируют 30 мин при 58—59°С или сначала делают разведение сывороток 1 : 10, инактивируют и разливают в пробирки но 0,5 мл.
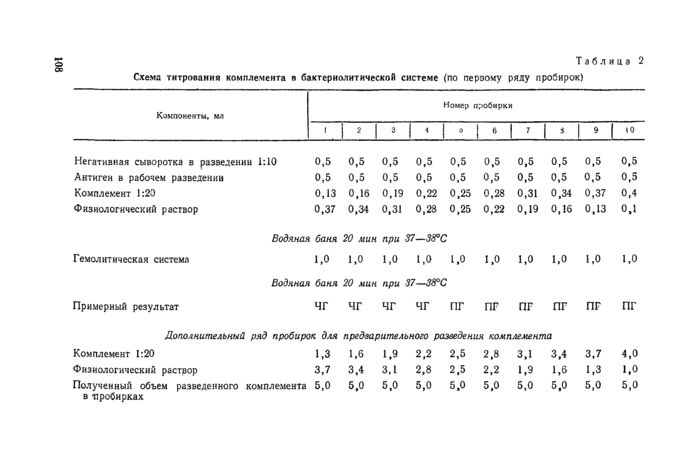
Внесение остальных ингредиентов и условия титрования показаны в таблице 2 на примере негативной сыворотки, при этом во вторые ряды сывороток вместо антигена вносят 0,5 мл физиологического раствора.
При работе с аппаратом Флоринского для разведения комплемента берут дополнительный ряд пробирок, в которых делают те же разведения комплемента, но объем увеличивают в 10 раз. Затем разливателем Флоринского переносят по 0,5 мл разведенного комплемента во все пробирки каждого ряда и вносят остальные ингредиенты, как указано в таблице 2.
Титром комплемента в бактериолитической системе считают минимальное количество его, необходимое для полного гемолиза эритроцитов барана в пробирках с нормальными сыворотками и сыворотками из опыта с антигеном и без антигена и в пробирках с сапной сывороткой без антигена при полной задержке гемолиза в пробирках с сапной сывороткой и антигеном.
При постановке главного опыта берут дозу комплемента, полученную при титровании.
Общее количество комплемента для главного опыта определяют по формуле х~ТП : 20, где х — количество комплемента, необходимое для постановки главного опыта; Т — титр комплемента в бактериолитической системе; П — количество пробирок в реакции; 20—разведение комплемента при титровании.
Например, в опыте 200 пробирок, титр комплемента (по таблице 2) — 0,25, расчет его на опыт (0,25X200) : 20=2,5 мл.
Необходимое количество разведенного комплемента для реакции равно 100мл (0,5X200), следовательно, к 2,5 мл основного раствора комплемента добавляют 97,5 мл физиологического раствора.
Таблица 2
Схема титрования комплемента в бактериолитической системе (по первому ряду пробирок)
|
Номер пробирки Компоненты. № | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Дополнительный ряд пробирок для предварительного разведения комплемента | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
|
в пробирках |