Наставление по лабораторной диагностике листериоза животных
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
Предисловие
А. Бактериологическая диагностика
I. Микроскопическое исследование
II. Люминесцентно-серологическое исследование
III. Бактериологическое исследование
IV. Идентификация возбудителя
V. Биологическое исследование
Б. Патологогистологическая диагностика
В. Серологическая диагностика
Приложение 1. Схема лабораторного исследования на листериоз
Приложение 2. Рецепты и способы приготовления индикаторных и элективных сред
Приложение 3. Методика выделения листерий из силоса
Предметный указатель
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| Издан | Агропромиздат | 1986 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20
стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29
СПВ4ВОЧНИК
ЛАБСШОРНЬЕ
ИССЛЕДОВАНИЯ В ВЕТШ/1НАРИИ
БАКТЕИ^АЛЬНЫЕ
ИНТЕКЦИИ
СПРАВОЧНИК
ЛАБОРАТОРНЫЕ
ИССЛЕДОВАНИЯ
В ВЕТЕРИНАРИИ
•
БАКТЕРИАЛЬНЫЕ
ИНФЕКЦИИ
Под редакцией Б. И. АНТОНОВА
МОСКВА АГРОПРОМИЗДАТ 1986
содержащимся в препаратах, оранжево-красное неспецифическое свечение, на фоне которого листерии выделяются сияющим зеленоватым цветом.
III. Бактериологическое исследование.
9. Из органов и обязательно головного мозга проводят обильные множественные посевы или предварительно готовят суспензию из головного мозга и паренхиматозных органов на физрастворе хлорида натрия в соотношении I : 5 и из нее делают посевы. Для культивирования листерий используют обычный или печеночный агар и бульон с добавлением 1% глюкозы и 2—3% глицерина (pH среды 7,2—7,4), а также кровяной агар и элективные среды (см. приложение 2).
При храпении патологического материала в холодильнике при 4°С происходит размножение и накопление листерий. Поэтому в качестве дополнительного метода рекомендуется часть исследуемого материала помещать в холодильник и сохранять в течение 30 дн. для проведения повторных исследований через каждые 10 дн. при отрицательном результате первичного посева.
При исследовании абортированных плодов посевы делают из содержимого желудка и внутренних органов.
При исследовании истечений из половых органов и молока посевы проводят на печеночный агар с добавлением 1% глюкозы и 2—3% глицерина в чашках Петри и МПБ с 10% хлорида натрия, из которого потом делают пересевы на твердые среды.
10. Посевы инкубируют в термостате при 37°С с ежедневным просмотром в первые 3—4 дня. При отсутствии роста наблюдение за посевами проводят в течение 2 нед.
Характерным для возбудителя листериоза является легкое помутнение бульона и появление мелких росинчатых колоний на агаре, наличие бета-гемолиза на кровяном агаре.
Просмотр посевов на твердых средах целесообразнее проводить в проходящем свете, что значительно облегчает работу. С этой целью осветитель типа ОИ-19 с голубым светофильтром устанавливают на расстоянии 20 см от микроскопа и наклоняют под углом 45° по отношению к плоскости зеркала. Зеркало помещают между осветителем и микроскопом наклонно под углом 12—15° на расстоянии 13 см от переднего края осветителя по ходу светового луча. Отраженный от зеркала свет направляют в объектив микроскопа, на предметный столик которого помещают чашку для просмотра. Колонии листерий в проходящем свете имеют в отличие от колоний других микроорганизмов голубую окраску с зеленоватым оттенком и мелкозернистую структуру.
Выделенные культуры изучают микроскопически с окраской ма зков по Граму, а также с применением прямого и непрямого методов флуоресцирующих антител, как указано в пп. 6, 7.
11. При получении смешанной культуры ее очищают общепринятыми методами (отсев отдельных характерных колоний, дробный рассев на плотные среды в чашках), а также путем заражения молодых белых мышей (массой до 16 г).
IV. Идентификация возбудителя.
12. Определение подвижности проводят методом висячей или раздавленной капли. На подвижность исследуют б—12-часовую бульонную культуру, выращенную при комнатной температуре (22сС). Листерии, выращенные при данной температуре, обладают активной подвижностью.
13. Для определения ферментативных свойств чистую культуру пересевают на пестрый ряд (глюкоза, мальтоза, рамноза, салицин, тре-
галоза, дульцит, инулин, раффиноза). Листерии разлагают с образованием кислоты (без газа) глюкозу, мальтозу, рамнозу, салицин, трега-лозу и не разлагают дульЦит, инулин, раффинозу.
14. Проба на каталазу. К суточной бульонной культуре добавляют равный объем свежеприготовленной 5%-ной перекиси водорода, при исследовании агаровой культуры в пробирку вносят несколько капель перекиси водорода. При наличии фермента каталазы перекись водорода разлагается с образованием пузырьков газа (пена).
Способность выделять фермент каталазу является характерным признаком листсрий.
15. Для дифференциации листерий от возбудителя рожи свиней можно использовать индикаторные среды; метод основан на редукции и оксидации красок в средах при выращивании листерий.
Исследуемую бульонную культуру или смыв агаровой культуры засевают в объеме 2—4 капель не менее чем на 2 из 5 следующих индикаторных сред: с лакмусом, нейтральротом в смесй с метиленовой синью, метилротом, конгоротом, амидочерным (приготовление сред см. приложение 2). Пробирки встряхивают и помещают в термостат при 37— 38°С вместе с контрольными (незасеянными) средами. Результат учитывают через 3, 6, 24 и 48 ч.
Возбудитель листериоза через 3—6 ч обесцвечивает среду с лакмусом и среду с нейтрал ьротом в смеси с метиленовой синыо до цвета бульона, лишь у поверхности на границе с воздухом остается окрашенный ободок. При встряхивании цвет частично восстанавливается, поэтому посевы просматривают, не встряхивая пробирки.
Среда с метилротом обесцвечивается через 3—6 ч, но восстановления цвета среды не происходит.
Обесцвечивание сред с конгоротом и с амидочерным происходит н более поздние сроки — через 6—48 ч, при этом исходный цвет среды после обесцвечивания не восстанавливается.
Контролем служат незасеянные индикаторные среды.
Возбудитель рожи свиней не обесцвечивает ни одну из вышеуказанных сред.
16. Серологическая идентификация листерий.
A. Поливалентная листериозная агглютинирующая сыворотка представляет собой смесь кроличьих листериозных агглютинирующих сывороток и содержит факторы (антитела) Н—АВ и О— II, V, VI, VII, IX. Поливалентная сыворотка в капельной реакции агглютинации на стекле агглютинирует все известные серотипы и подтипы листерий. Типовые сыворотки агглютинируют культуры листерий соответствующих типов («серогрупп»). Сыворотка 1-го серотипа («серогруппы») содержит 0-фактор II, а сыворотка 2-го серотипа («серогруппы») —
0-факторы V, VI.
Б. Предназначенную для идентификации чистую 24-часовую бульонную культуру, выращенную При 37°С, платиновой петлей засевают частым штрихом на обычный МПА в две пробирки так, чтобы получить рост по всей поверхности агара, и выращивают в темном месте при комнатной температуре (18—26°С) в течение 24—30 ч. Затем агаровую культуру смывают небольшим количеством физраствора, чтобы получить густую взвесь (около 10—15 млрд, микробных клеток в 1 мл).
B. Реакцию агглютинации ставят на чистых обезжиренных предметных стеклах. На предметное стекло наносят две капли: поливалентной сыворотки и физраствора. К ним добавляют по одной капле смыва культуры, смесь тщательно и быстро перемешивают бактериологической петлей или запаянным концом пастеровской пипетки, после чего стекла
плавно покачивают круговыми движениями. Одновременно для контроля один раз в день исследуют на стекле каплю сыворотки с добавлением капли физраствора.
Г. Учет результатов РА производят в течение 3 мин. Реакция может быть учтена ранее этого срока при появлении четкой положительной реакции (появление хлопьев) в капле с сывороткой и отрицательной реакции (отсутствие хлопьев) в контроле. Запоздалые реакции не учитывают.
Д. Исследуемую культуру признают листериозной при получении положительной реакции с поливалентной сывороткой и отсутствии агглютинации в контроле с физраствором, а также наличии характерных морфологических, культуральных и биохимических свойств.
Е. При наличии самоагглютинации РА ставят повторно по указанной выше методике, но при посеве на МПА в качестве посевного материала используют суточную бульонную культуру, выращенную при комнатной температуре, что предотвращает самоагглютинацию.
Ж. С помощью типовых («серогрупповых») сывороток определяют серотип («серогруппу)» идентифицированных культур листерий. С этой целью чистую бульонную 24-часовую культуру листерий засевают в
1—2 пробирки МПА, как указано в подпункте Б, и выращивают при 37°С 18—24 ч. Смыв с агаровой культуры делают так же, как и для РА с поливалентной сывороткой, и исследуют в РА одновременно с типовыми сыворотками 1-го и 2-го серотипов («серогрупп»). Техника постановки и учета РА описана в подпунктах В и Г.
3. Положительная РА с сывороткой 1-го серотипа свидетельствует о принадлежности культуры к 1-му серотипу («серогруппе»), а положительная РА с сывороткой 2-го серотипа указывает на принадлежность ее ко 2-му серотипу («серогруппе») листерий. В случае отрицательных или сомнительных показаний РА с сыворотками обоих серотипов, что возможно в результате изменчивости («диссоциации») культуры, для определения се типовой («серогрупповой») принадлежности ставят пробу роста.
И. Для постановки пробы роста используют обычный МПБ в пробирках по 4—5 мл с добавлением 1—1,25% стерильной типовой сыворотки, проверенной на стерильность путем экспозиции в термостате в течение 24 ч.
К- Для постановки пробы роста выращенную при 37°С суточную бульонную культуру листерий пересевают платиновой петлей в две пробирки МПБ — одну пробирку с сывороткой 1-го и одну пробирку с сывороткой 2-го серотипа, которые инкубируют при температуре 37°С в течение 24—48 ч.
Л. Если культура является смесью двух серотипов («серогрупп»), то из верхнего слоя бульона каждой пробирки проводят посев на МПА с целью получения изолированных колоний. Полученные из изолированных колоний каждой пробирки культуры снова испытывают по описанной выше методике в РА с типовыми («серогрупповыми») сыворотками. При этом из пробирки с сывороткой 1-го серотипа выделяют культуру 2-го серотипа («серогруппы»), а из пробирки с сывороткой 2-го серотипа — культуру 1-го серотипа («серогруппы»). Таким образом, с помощью пробы роста удается разделить смесь культур листерий двух серотипов.
17. Специфические свойства листерий проверяют также конъюнктивальной пробой на морских свинках или внутрикожной пробой на морских свинках или кроликах.
Конъюнктивальная проба. На конъюнктиву глаза морской свинки
наносят 2 капли испытуемой бульонной культуры с последующим легким массажем век ватным тампоном. Вирулентные штаммы листерий на
2—4-й день вызывают у морской свинки гнойный кератокоиъюнктивит. Пробу с каждым штаммом желательно ставить не менее чем на двух морских свинках.
Внутрикожная проба. В тщательно выстриженный участок кожи бока морской свинки или кролика вводят 0,3—0,5 мл бульонной культуры. Через 24—48 ч возникает воспаление с последующим некрозом и образованием струпа.
На одной морской свинке можно ставить конъюнктивальную и вну-трикожную пробу при изучении свойств одного штамма. При необходимости испытания нескольких культур в выстриженный участок кожи на правом и левом боку кролика можно инъецировать но 3 культуры с каждой стороны.
V. Биологическое исследование.
18. Биологическое исследование проводят на 2—3 белых мышах (массой 18 г). Суспензию из головного мозга и внутренних органов или культур вводят животным под кожу или виутрибрюшннио в дозе 0,3— 0,5 мл. Для повышения эффективности биопробы белым мышам за 3—4 ч до заражения инъецируют внутримышечно кортизон в дозе 5 мг. При положительной биопробе животные погибают через 2—6 сут после заражения. При вскрытии отмечают множественные некротические очажки в печени, селезенке, почках. В отдельных случаях этих поражений может не быть.
Очень чувствительны к подкожному заражению 5—6-дневные мыши-сосуны, которые гибнут через 18—36 ч.
К заражению листериями восприимчивы и кролики. Показательно внутривенное заражение кроликов культурой листерий в дозе 0,5— 1 млрд, микробных тел, при этом количество моноцитов в крови зараженных животных увеличивается в несколько раз.
Из внутренних органов павших животных делают мазки-отпечатки и высевы на питательные среды.
Срок наблюдения за подопытными животными — 14 сут.
19. Для дифференциации возбудителя листериоза от возбудителя рожи свиней пользуются следующей таблицей.
|
Признаки |
Возбудитель листериоза |
Возбудитель рожи свиней |
|
Подвижность |
Подвижен в молодой |
Неподвижен |
|
6—12-часовой культуре, выращенной при комнатной температуре | ||||||||||||||||||||||||
| ||||||||||||||||||||||||
20. Положительный ответ на листериоз дают при выделении грам-положительной полиморфной подвижной палочки, образующей каталазу и разлагающей с образованием кислоты глюкозу, мальтозу, рам-нозу и салицин; вызывающей (вирулентные штаммы) положительные конъюнктивальную и внутрикожную пробы у морских свинок и кроликов; дающей положительную РА с листериозной сывороткой; обладающей патогенностью для лабораторных животных (вирулентные штаммы), а также по результатам люминесцентно-серологического исследования (как указано в пп. 6 и 7).
Б. Патологогистологическая диагностика
21. Для патологогистологического исследования необходимо брать следующие материалы: кусочки головного (все отделы), продолговатого и спинного мозга, паренхиматозных органов.
Материал фиксируют в 10%-ном растворе нейтрального формалина с последующий заключением в парафин и окраской гематоксилин-эозином, или в жидкости Корнуа с окраской по Браше, или в 96°-ном спирте с окраской по Нисслю.
Гистологические изменения наиболее сильно проявляются в головном и спинном мозге, где хорошо выражены пролиферативные процессы, отек, дегенерация нейронов, нейронофагия. Наличие микрофокус-ного энцефалита, проявляющегося очагами, состоящими из скопления мопоцитариых и лимфоидных клеток с примесью сегментоядерных лейкоцитов, является отличительным признаком от энцефалита вирусного происхождения.
При септической форме болезни в печени, селезенке, надпочечниках — гранулемы, состоящие из клеток лимфоидно-гистиоцитарного типа.
При гистологическом исследовании органов ягнят часто находят зернистую дистрофию клеток печени и почек, воспалительные изменения в тонком отделе кишечника и сычуге, мелкоочаговую бронхопневмонию.
В. Серологическая диагностика
22. Реакция агглютинации. Реакцию агглютинации (РА) применяют для исследования сывороток животных с целью обнаружения листери-озпых агглютинирующих антител. Результаты РА используют при постановке диагноза в комплексе с другими данными (бактериологическое исследование, клинические признаки, эпизоотологические данные и латологоанатомичсские изменения) и для выявления животных-листе-риоиосителей.
Компоненты реакции и условия их применения. Для исследования используют сыворотки крови без признаков гнилостного распада и гемолиза. Сыворотки можно консервировать борной кислотой (1%), или 0,5% -ным раствором фенола (из расчета 0,1 мл раствора на 1 мл сыворотки). Для выявления динамики накопления антител надо исследовать парные сыворотки (сыворотки, взятые у одного и того же животного с интервалом в 14 дн.).
Применяют два антигена (первой и второй серогруппы), представляющие собой взвесь листерий, инактивированных кипячением в водяной бане в течение 1,5 ч. Перед употреблением антигены необходимо тщательно взбалтывать.
Для контроля используют первую и вторую серогрупповые листе-риозпые сыворотки и нормальную (отрицательную) сыворотку.
Компоненты реакции разводят физиологическим раствором поваренной соли.
Постановка реакции. Реакцию в объеме I мл ставят
на физиологическом растворе (с добавлением 0,5% фенола) параллельно с двумя антигенами в разведениях для свиней, овец и коз: 1 : 100,
1 : 200, 1 : 400, 1 : 800; для крупного рогатого скота и . лошадей:
1 : 200, 1 : 400, 1 : 800, 1 : 1600; для кроликов: 1 : 25, 1 : 50, 1 : 100,
1 : 200.
Контроля реакции:
а) антиген -J- положительная листериозпая сыворотка того же серотипа до предельного титра;
б) антиген + отрицательная сыворотка;
в) антиген 4* 0,5 мл физиологического раствора;
г) контроль испытуемой сыворотки на самоагглютинацию в наименьшем разведении.
В пробирки к каждому 0,5 мл соответствующего разведения сыворотки добавляют 0,5 мл суспензии антигена в концентрации I млрд/мл. Пробирки встряхивают и ставят в термостат на 4—б ч при 37°С, затем выдерживают 12—18 ч при комнатной температуре.
Учет реакции. Реакция признается положительной при обнаружении макроскопической агглютинации с оценкой не менее чем на
2 креста в разведениях сыворотки 1:200 для овец, коз и свиней; 1:400— для лошадей и крупного рогатого скота; 1 : 50 — для кроликов.
Реакция считается сомнительной при обнаружении макроскопической агглютинации с оценкой не менее чем на 2 креста в разведениях сыворотки 1:100 для овец, коз и свиней; I : 200 — для лошадей и крупного рогатого скота, 1 : 25—для кроликов.
Сыворотки, давшие сомнительную реакцию, исследуют повторно в тех же разведениях. При вторичном получении сомнительной реакции кровь от животных берут вновь через 3—4 недели.
Если титр сывороток (ранее давших сомнительную реакцию) не повысился, то при отсутствии в хозяйствах клинически больных или абортов у животных реакция считается отрицательной.
Оценка реакции:
(++++) — полное просветление жидкости при наличии четко выраженного зонтика, который при встряхивании разбивается на мелкие хлопья, комочки;
(Н—I—Ь) — те же явления, но надосадочиая жидкость слегка опалесцирует;
(Н—Ь) — просветление жидкости выражено слабее, имеется недостаточно четко сформированный зонтик, при встряхивании разбивается на мелкие хлопья и крупинки;
(-}-) — весьма незначительное просветление при наличии зонтика, при встряхивании — крупинки и комочки;
(—) — отрицательная; отсутствие просветления и зонтика.
Нарастание титров антител при исследовании парных сывороток свидетельствует о развитии листериозного процесса.
23. Реакция связывания комплемента. Реакция связывания комплемента (РСК) с листериозным антигеном УНИИЭВ применяется для исследования на листериоз сывороток крови всех видов животных.
Применение РСК не исключает применения других методов диагностики листериоза, однако ценность этой реакции состоит в том, что она ускоряет постановку диагноза и позволяет выявлять больных животных, не имеющих выраженных клинических признаков болезни (ли-стерионосителей).
Реакция производится в водяной бане в общем объеме 2,5 мл всех компонентов при температуре 37—38 С.
Компоненты реакции й условия их применения:
а) гемолизин с рабочим титром не ниже 1 : 1000;
б) листериозный антиген УНИИЭВ для РСК представляет собой однородную взвесь убитых листерий. При хранении антигена па дне флакона образуется белый осадок, а жидкость над осадком становится прозрачной. Перед употреблением антиген необходимо тщательно взбалтывать. Применяют его в рабочем титре, указанном на этикетке флакона. Срок годности антигена — 2 года при условии хранения его в темном прохладном месте (5—10°С);
в) позитивные листериозные сыворотки УНИИЭВ, полученные от гипериммунных кроликов, консервированные фенолом (0,5%), представляют собой жидкость соломенно-желтого цвета. Их используют в разведении 1:10 при титровании комплемента в бактериолитической системе и для контроля реакции в главном опыте после предварительной инактивации.
Примечание. Для контроля реакции можно пользоваться листе-риозными позитивными сыворотками, полученными в лабораториях от переболевших листериозом животных;
г) нормальные сыворотки заведомо здоровых животных применяют при титровании комплемента в бактериолитической системе и для контроля реакции в главном опыте так же, как и позитивные сыворотки после предварительной инактивации при указанном режиме и в таких же дозах.
Нормальные сыворотки применяют неконсервнрованные, с таким же сроком давности и тех же видов животных, как и испытуемые;
д) комплемент (свежая консервированная или сухая сыворотка крови морской свинки) применяется в титре, установленном в день постановки реакции путем титрования в бактериолитической системе;
е) взвесь эритроцитов барана в физиологическом растворе: 2,5% от рсадка или 5% от исходного объема дифибринированной крови. Для удобства работы лучше применять сенсибилизированные гемолизином эритроциты (гемолитическая система), которые готовят сразу в необходимом для всего опыта количестве путем смешивания равных количеств взвеси эритроцитов и гемолизина в рабочих разведениях. При добавлении гемолизина к взвеси эритроцитов компоненты тщательно смешивают путем двукратного переливания из одной посуды в другую и ставят в термостат на 30 мин.
Сенсибилизированные эритроциты применяют для РСК в дозе 1,0 мл;
ж) физиологический раствор (0,85% -ный раствор х. ч. поваренной соли в дистиллированной воде).
Титрование компонентов. Перед постановкой реакции проводят подтитровку компонентов реакции: гемолизина, листери-озного антигена и комплемента в гемолитической и бактериолитической системах.
А. Титрование гемолизина. Гемолизин титруют в следующих разведениях: из основного разведения 1 : 100 готовят разведения 1 : 500, 1 : 1000, 1 : 1500, 1 : 2000, 1 : 2500, 1 : 3000 и т. д.
Примечание. Выпускаемый биофабрикой гемолизин консервирован 1 : 1 глицерином. Поэтому при приготовлении основного разведения 1 : 100 берут 0,2 мл гемолизина и 9,8 физиологического раствора.
Комплемент входит в реакцию в разведении I : 20 с титром от 0,20 до 0,25 по 0,5 мл. Взвеси эритроцитов барана берут по 0,5 мл.
Взамен антигена и сыворотки в пробирки прибавляют по 1 мл физиологического раствора. Время течения реакции — 10 мин в водяной бане при температуре 37—38°С.
При титровании гемолизина ставят следующие контроли:
1) контроль гемолизина — гемолизин 1 : 100+эритроциты -f- физраствор до объема 2,5 мл в отсутствии комплемента;
2) контроль комплемента — комплемент + эритроциты + физраствор до объема 2,5 мл в отсутствии гемолизина;
3) контроль физраствора — эритроциты + физраствор до объема 2,5 мл в отсутствии гемолизина и комплемента.
Во всех контролях гемолиз эритроцитов должен отсутствовать.
Титром гемолизина считается наименьшее количество его, потребное для полного гемолиза 0,5 мл взвеси эритроцитов при комплементе 0,5 мл в разведении 1 : 20 с титром от 0,20 до 0,25.
Для титрования комплемента и постановки главного опыта гемолизин применяют в рабочем титре, который является четырехкратной дозой по сравнению с предельным титром. Например, если предельный 1*итр равен 1 : 3000, то в реакции следует применять разведение 1 : 750 или 1 мл гемолизина на 749 мл физиологического раствора.
Примечание. Ввиду стабильности титра гемолизина, выпускаемого биофабриками, при условии правильного хранения и соблюдения сроков годности титрование гемолизина при каждой реакции не обязательно.
Б. Титрование комплемента в гемолитической системе. Комплемент титруют в дозах: 0,1; 0,13; 0,16; 0,19; 0,22 и т. д. (с интервалом по 0,03 мл) до 0,49 мл основного его разведения. В каждую пробирку недостающее до 0,5 мл количество основного разведения комплемента доливают физиологическим раствором: в первую пробирку 0,4 мл, во вторую 0,37 мл и т. д. После этого во все пробирки добавляют по 1,0 мл физиологического раствора и по 1,0 мл сенсибилизированных эритроцитов (гемолитической системы). Реакция должна сопровождаться контрол ям и компонентов в смеси с эритроцитами (контроль гемолизина, контроль комплемента, контроль физраствора), а также контролем гемолитической системы при максимальной дозе комплемента (0,5 мл основного разведения). После тщательного смешивания компонентов путем встряхивания штативы с пробирками помещают на 10 мин в водяную баню при 37—38°С.
Титром комплемента в гемолитической системе считается наименьшее его количество, необходимое для полного гемолиза в указанных условиях 0,5 мл взвеси эритроцитов при рабочей дозе гемолизина (схема 1).
Если титр комплемента в гемолитической системе определяется дозой 0,25 и выше (основное разведение 1 : 20), то титрование в гемолитической системе повторяют, пользуясь основным разведением комплемента 1 : 10.
В. Титрование комплемента в бактерполитической системе. В бак-териолитической системе комплемент титруют начиная с дозы на один интервал ниже против его титра в гемолитической системе. Если титр комплемента в гемолитической системе определяется дозой 0,25 мл основного разведения, то в бактериолитической системе его титруют в дозах: 0,22, 0,25, 0,28 и т. д. до 0,49 мл того же основного разведения.
Каждую дозу комплемента исследуют с двумя листериозными и с
|
Комплемент в разведении 0,10 1:10 или 1:20 Физраствор до объема 0,5 мл 0,40 Сенсибилизированные эри- 1,0 троциты барана (гемолитическая система) Физраствор 1,0 |
| |||||||||||||||||||||||||
двумя нормальными сыворотками в присутствии антигена (в рабочем титре) и с контролем сывороток без антигена.
Инактивированные в разведении 1 : 10 листериозные нормальные сыворотки разливают по 0,5 мл в пробирки соответствующих рядов.
Таким образом, в бактериолнтнческой системе комплемент титруют в восьми рядах пробирок (по 10 пробирок в каждом ряду).
Требуемые разведения комплемента целесообразно готовить сразу для всего опыта титрования. Для этого берут дополнительный ряд пробирок, в которые разливают применяемые при титровании дозы комплемента в десятикратном объеме, т. е. 2,2; 2,5; 2,8 и т. д. до 4,9 мл. Недостающий до 5 мл объем жидкости в пробирках доливают соответствующим количеством физиологического раствора: 2,8; 2,5; 2,2 и т. д. Приготовленные таким способом разведения комплемента разливают пастеровской пипеткой или аппаратом Флоринского в соответствующие опытные пробирки по0,5мл: в первые пробирки всех восьми рядов — из первого разведения (доза основного разведения 0,22 мл); во вторые пробирки всех восьми рядов — из второго разведения (доза основного разведения 0,25 мл) и т. д. После разлива комплемента в первые из каждых рядов пробирки с листериозными и нормальными сыворотками наливают по
0.5 мл антигена в рабочем титре. Во вторые ряды пробирок с листериозными и нормальными сыворотками наливают по 0,5 мл физиологического раствора. Компоненты смешивают энергичными встряхиваниями штативов и помещают в водяную баню при 37—38°С на 20 мин (связывание комплемента). Затем во все пробирки добавляют по 1 мл сенсибилизированных эритроцитов, компоненты смешивают и штативы с пробирками снова ставят в водяную баню при 37—38°С на 20 мин (фаза гемолиза).
Титром комплемента в бактериолитической системе является минимальное его количество, обусловливающее полный гемолиз 0,5 мл взвеси эритроцитов с нормальными сыворотками с антигеном и без антигена, в пробирках с листериозными сыворотками — без антигена и не вызывающее гемолиза в пробирках с листериозной сывороткой с антигеном (схема 2).
Главный опыт
А. Разведение комплемента для главного опыта. Например, требуется исследовать 100 проб сыворотки. Титр комплемента в бактериолитической системе 0,31 мл основного разведения 1 : 10. Следовательно, одна доза чистого комплемента составляет 0,031 мл; для испытания каждой пробы сыворотки необходимы две дозы комплемента (с антигеном и
Схема 1
в гемолитической системе
|
0,28 |
0,31 |
0,34 |
0,37 |
|
0,22 |
0,19 |
0,16 |
0,13 |
|
1,0 |
1,0 |
1,0 |
1,0 |
|
1,0 |
1,0 |
1,0 |
1,0 |
|
38°С в |
течение 10 |
мин |
|
0,40 |
0,43 |
0,46 |
0,49 |
|
0,10 |
0,07 |
0,04 |
0,01 |
|
1,0 |
1,0 |
1,0 |
1,0 |
|
1,0 |
1,0 |
1,0 |
1,0 |
без антигена, т. е. 0,031 X2Х 100=6,2 мл чистого комплимента и 93,8 физиологического раствора.
Б. Основные условия постановки главного опыта. Реакцию ставят в общем объеме 2,5 мл всех компонентов, т. е. каждый компонент применяют в объеме 0,5 мл. Испытуемые сыворотки исследуют с антигеном и без антигена в дозе 0,05 мл (0,5 мл разведения 1:10) после предварительной инактивации в водяной бане при температуре 58—59°С и выше в зависимости от вида животных в течение 30 мин. Комплемент применяют в установленном титре. Время связывания в бактериолити-чсской системе в водяной бане — 20 мин, в гемолитической системе— 20 мин.
Схема 2
Титрование комплемента в бактериолитической системе
Комплемент в основ-0,220,250,280,31 0,340,370,400,430,460,49 ном разведении 1:10 Физраствор (дообъема 0,28 0,250,22 0,190,16 0,13 0,10 0,070,04 0,01 0,5 мл)
Антиген в рабочем0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 титре (первый ряд пробирок) или физиологический раствор (второй ряд пробирок без антигена)
Нормальная сыворот-0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 ка в разведении 1:10
Водяная баня при 37—38°С 20 цин
Сенсибилизированные 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 эритроциты барана
Водяная баня при 37—38°С 20 мин
В. Основные контроли главного опыта: 1) заведомо отрицательная и две положительные (листериозные) сыворотки с антигеном и без антигена в дозах по 0,05 мл;
ББК 48.73 Л 12
УДК 619:616.9—08(031)
Составители: Б. И. Антонов, В. В. Борисова, Я. М. Волкова, »/7. Я. Каменева, Л. В. Кошеленко, Г. А. Михальский, В. В. Лоповцев, Л. И. Прянишникова, В. Е. Храпова
Лабораторные исследования в ветеринарии. Бакте-Л12 риальные инфекции: Справочник/Сост. Б. И. Антонов, В. В. Борисова, П. М. Волкова и др.; Под ред. Б. И. Антонова.— М.: Агропромиздат, 1986.— 352 с.
В книге даны методы лабораторных исследований патологического материала с целью определения возбудителя нпфекционноЛ болезни. Они изложены по единой схеме: бактериологические и бактериоскопнческие исследования, биопроба, идентификация и дифференциация возбудителей. Методы унифицированы и стандартизированы
Для ветврачей и фельдшеров, лаборантов ветеринарных лабораторий.
3805020000-079 035 (01)-86
305—86
ББК 48.73
© ВО «Агропромиздат», 1986
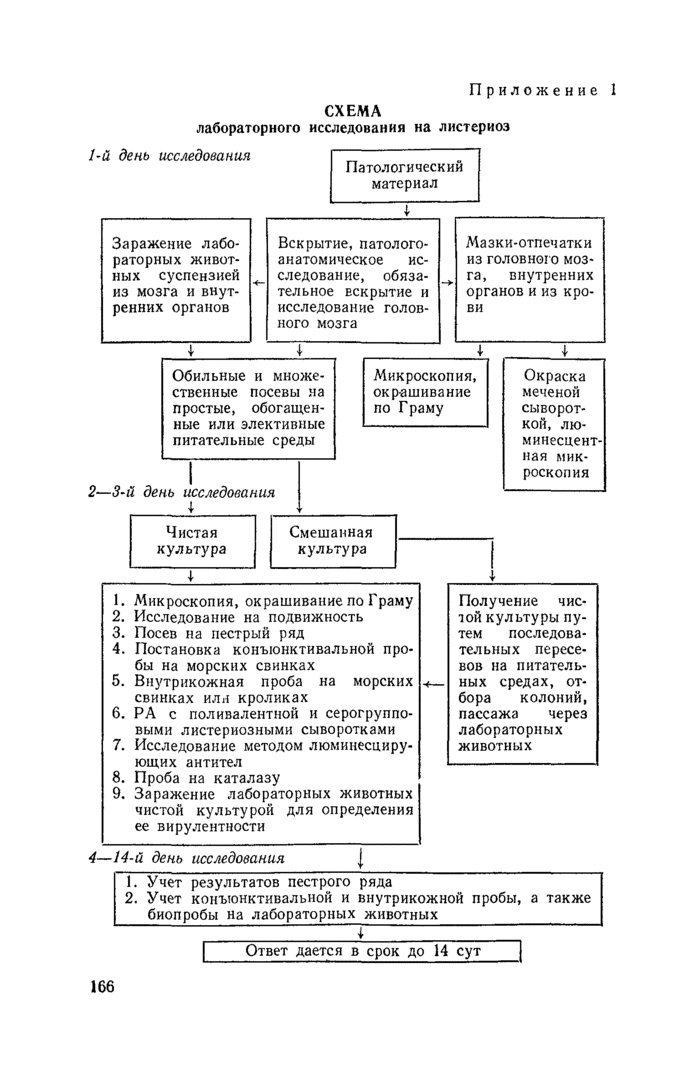
СХЕМА
лабораторного исследования на листериоз
ПРЕДИСЛОВИЕ
В деле выполнения решении партии и правительства по дальнейшему развитию животноводства, а также задач, поставленных Продовольственной программой страны, ветеринарной службе большую помощь оказывают ветеринарные лаборатории.
Ветеринарные лаборатории осуществляют диагностику инфекционных и паразитарных болезней животных, выявляют нарушения обмена веществ в их организме, проводят исследования, направленные на предупреждение отравлений, помогая тем самым специалистам совхозов, колхозов и других хозяйств успешно осуществлять лечебнопрофилактические мероприятия. От того, насколько своевременно ставится диагноз, разработаны и рекомендованы профилактические и лечебные меры, зависит успех ликвидации болезней, сохранность поголовья животных и повышение их продуктивности.
Последнее время в лабораториях появилось много приборов и приспособлений, облегчающих труд специалистов и позволяющих проводить исследования на более современном и качественном уровне, с большой достоверностью. В связи с этим многие ранее действовавшие методические указания переработаны.
Кроме того, ежегодно для лабораторной практики предлагаются новые методы диагностики. В отечественной и зарубежной литературе постоянно публикуется большое количество материалов о новых методах исследований, предлагаются различные модификации существующих методик, вводятся дополнительные диагностические тесты.
Ветеринарные лаборатории в своей работе не могут использовать всего многообразия имеющихся в литературе методов исследования или из-за того, что они недостаточно апробированы, или из-за сложности применяемого оборудования. Иногда методы, предлагаемые различными авторами, при определении одних и тех же показателей дают несовпадающие результаты.
В связи с этим в справочник включены методы лабораторных исследований патологического материала, получаемого от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные Главным управлением ветеринарии Министерства сельского хозяйства СССР. Книга содержит методические указания по диагностике инфекционных болезней бактериальной этиологии, а также методические указания по применению культур клеток в диагностических исследованиях.
Методики изложены по единой схеме,- взятие и пересылка патологического материала, методы его обработки и обогащения; бактериоско-пические исследования, включая световую и люминесцентную микроскопию; выделение культур возбудителей инфекционных болезней на питательных средах; заражение лабораторных животных как с целью выделения чистой культуры возбудителя, так и определения степени ее патогенности; гистологические исследования; идентификация и дифференциация возбудителей с использованием различных методов; серологические исследования для определения вида возбудителя.
Приведенные в справочнике методы лабораторных исследований унифицированы и стандартизированы. В широком смысле слова унификация и стандартизация подразумевают применение для различных исследований одних и тех же аппаратов, приборов, инструментов, посуды, реактивов, исключая, конечно, специальные методы исследования; применение стандартных (унифицированных) питательных сред и диагностикумов; разработку методических указаний по единой форме. Все это позволяет лабораторным работникам с меньшей затратой сил и средств, на высоком методическом и техническом уровне, качественно и в срок проводить диагностические исследования. Таким образом, стандартизация методов исследования явится способом наведения строгого порядка в работе ветеринарных лабораторий.
Книга предназначена для ветеринарных врачей, фельдшеров, а также лаборантов ветеринарных диагностических лабораторий.
В справочник не вошли материалы по диагностике туберкулеза, так как они пересматриваются и дополняются, поэтому их публикация будет осуществлена в последующих изданиях.
ЛИСТЕРИОЗ
Наставление по лабораторной диагностике листериоза животных
(Рекомендовано Главным управлением ветеринарии Минсельхоза СССР 29 октября 1971 г. с изменением от 31 июля 1974 г.)
1. Диагноз на листериоз ставят на основании комплекса эпизоото-логических данных, клинических признаков, патологоанатомических и патологогистологических изменений, а также результатов лабораторного исследования. Решающее значение принадлежит бактериологическому исследованию — выделению культуры листерий. Серологические методы (РА, РСК) могут быть применены для выяснения эпизоотической ситуации в хозяйствах; где диагноз на листериоз поставлен комплексным методом с выделением культуры.
2. Для исследования в лабораторию направляют трупы мелких животных или голову (головной мозг), паренхиматозные органы (часть печени, селезенку, почку, пораженные участки легких), абортированный плод и его оболочку.
Материал посылают свежий или консервируют в 30%-ном водном растворе глицерина.
Для прижизненной диагностики в лабораторию направляют кровь или сыворотку крови от больных и подозрительных но заболеванию животных для серологического исследования; истечения из половых органов абортировавших самок, молоко из пораженных долей вымени при наличии маститов — для бактериологического исследования.
А. Бактериологическая диагностика
3. Бактериологическая диагностика включает микроскопическое исследование исходного материала, посевы на питательные среды, идентификацию выделенных культур по культурально-биохимическим и серологическим свойствам, а также постановку биологической пробы на лабораторных животных.
I. Микроскопическое исследование.
4. Микроскопическому исследованию подвергают тонкие мазки-отпечатки из головного мозга, внутренних органов и тканей. При приготовлении мазков-отпечатков чистым предметным стеклом 3—4 раза прикасаются к поверхности среза органа. Мазки готовят непосредственно из материала, а также после подращивания проб в термостате в течение 4—6 ч.
Мазки окрашивают по Граму, а также методами флуоресцирующих антител, как указано в пп. 5—7.
Возбудитель листериоза — полиморфная, чаще палочковидная бактерия длиной 0,5—2,0 мкм; она хорошо окрашивается всеми анилиновыми красками, грамположительна (однако в старых культурах могут встречаться единичные грамотрицательные палочки).
И. Люминесцентно-серологическое исследование.
5. Люминесцентно-серологическое исследование проводят с использованием прямого и непрямого методов флуоресцирующих анти* тел. С помощью этих методов можно идентифицировать возбудителя в культурах, обнаружить листерии в органах и тканях, а также определить их серогрупповую принадлежность.
6. Окраска по прямому методу флуоресцирующих антител. Для проведения исследования необходимо иметь:
флуоресцирующие сыворотки против рожи свиней, листериоза серотипов 1, 4а, 46, 2, 3;
нефлуореецнрующее иммерсионное масло или его заменитель, приготовленный из деметилфталата чистого (100 мл), нафталина сублимированного (1,75 г) или тимола чистого (5,0 г);
глицерин с фосфатным буфером pH 8,0 (9 частей глицерина нейтрального и 1 часть фосфатного буфера pH 8,0);
физиологический раствор хлорида натрия с фосфатным буфером pH 7,4, приготовленный следующим образом: на аналитических весах отвешивают 9,078 г х. ч. однозамещенного фосфата калия, помещают его в мерную колбу и доводят дистиллированной водой до 1л; затем отвешивают 11,876 г двузамещенного фосфата натрия и в другой мерной колбе доводят объем дистиллированной водой до 1 л. При использовании двузамещенного фосфата натрия, содержащего 12 молекул воды, для получения 1 л раствора берут навеску 23,752 г, а безводного препарата — 9,476 г. Для получения буфера pH 7,4 смешивают 4 части раствора двузамещенного фосфата натрия и 1 часть раствора однозамещенного фосфата калия. Полученный буфер добавляют к физиологическому раствору (8,750 г хлорида натрия на 1 л дистиллированной воды) в соотношении 1 : 50. Если при смешении растворов фосфатов 4 ; 1 не получают нужный pH, то, изменяя соотношение растворов, достигают необходимой величины pH (при повышенной кислотности добавляют двузамещенный фосфат натрия, а при щелочном pH добавляют однозамещенный фосфат калия). Если при добавлении буфера в соотношении 1 : 50 к физиологическому раствору последний будет иметь pH ниже 7,4, то увеличением количества добавляемого буфера добиваются нужной реакции физиологического раствора;
спирт этиловый;
покровные стекла толщиной не более 0,2 мм;
предметные стекла, нелюминесцирующие и хорошо обезжиренные.
Перед применением флуоресцирующие сыворотки разводят физиологическим раствором хлорида натрия с фосфатным буфером pH 7,4 до рабочего разведения. Сыворотки в рабочем разведении могут храниться при температуре 2—4°С в течение 2 нед.
а) Определение возбудителя в культуре. Для исследования используют 18—24-часовые чистые или смешанные культуры, из которых готовят по три мазка на отдельных предметных стеклах ближе к узкому краю. Один из мазков используют для обработки рожистой люминес-цирующей сывороткой, два — для обработки листериозными люминес-цирующими сыворотками (серотипов 1, 4а, 46 и 2, 3).
Густые мазки для исследования непригодны, так как микробы в них могут светиться меиее интенсивно. Мазки готовят средней густоты (несколько десятков микробов в поле зрения микроскопа) размером не более 1 см2.
Место нанесения культуры очерчивают карандашом по стеклу с обратной стороны, подсушивают мазки на воздухе, маркируют и фиксируют этиловым спиртом в течение 15 мин; мазки для фиксации погру-
грают 9 вертикальном положении в стеклянный сосуд со спиртом. Каждое стекло отделяют металлической проволочкой или стеклянной соломкой.
После фиксации и испарения спирта мазки споласкивают физиологическим раствором хлорида натрия с фосфатным буфером pH 7,4. На слегка подсушенный мазок наносят 1—2 капли соответствующей лю-минесцирующей сыворотки в рабочем разведении. Мазки с сывороткой помещают во влажную камеру (в чашки Петри с влажной фильтровальной бумагой на дне) и выдерживают в термостате при температуре 37°С в течение 30 мин. Затем сыворотку отмывают, погружая мазки в кювету, содержащую физиологический раствор с фосфатным буфером pH 7,4, на 20 мин. Раствор в кювете периодически помешивают и меняют через 10 мин.
Отмытые мазки споласкивают дистиллированной водой и высушивают на воздухе. Для быстроты высушивания можно использовать настольный вентилятор.
На поверхность мазка наносят небольшую каплю глицерина с буфером pH 8,0, накрывают покровным стеклом, излишек глицерина удаляют. На покровное стекло наносят нефлуоресцирующее иммерсионное масло или его заменитель и проводят люминесцентную микроскопию. Люминесцентный микроскоп рекомендуется устанавливать в хорошо вентилируемой комнате с частично затемненным окном или в затемненной части комнаты.
Диагностическая опенка интенсивности свечения возбудителей рожи свиней и листериоза:
Н~Н~Н — яркая, сверкающая зеленая люминесценция морфологически типичных бактерий с более интенсивным свечением по их периферии (положительная);
H"_j—— отчетливо выраженная, достаточно яркая зеленоватая люминесценция морфологически типичных бактерий с более интенсивным свечением по их периферии (положительная);
(Н—h) — недостаточно яркая желтовато-зеленоватая люминесценция, периферический ободок выявляется с трудом (сомнительная);
(-|-) — люминесценция очень слабая, морфология бактерий различается с трудом (отрицательная);
(—) — люминесценция отсутствует, видны лишь тени бактерий (отрицательная).
Видовую принадлежность обнаруженного возбудителя устанавливают по известной сыворотке, вызвавшей специфическое свечение исследуемой культуры интенсивностью не ниже чем на три креста.
б) Обнаружение возбудителя в патологическом материале. Материал для исследования должен быть свежим.
Для люминесцентной микроскопии из паренхиматозных органов готовят суспензию на физиологическом растворе хлорида натрия в соотношении 1 : 5.
После осаждения крупных частиц в суспензию из разных участков ее поверхности готовят по 2—3 мазка на каждый вид сыворотки.
Мазки из головного и костного мозга готовят отдельно и после фиксации спиртом дополнительно обезжиривают ацетоном в течение 5 мин при 2—3-кратной смене его. В остальном обработку препаратов и люминесцентную микроскопию выполняют так, как указано при исследовании культур.
При обнаружении возбудителя с типичной морфологией, специфическим свечением интенсивностью не ниже чем на три креста ставят
положительный люминесцентно-серологический диагноз соответственно той сыворотке, которая вызвала свечение возбудителя.
При сомнительных или отрицательных результатах (слабое свечение на один или два креста, свечение микробов с атипичной морфологией или отсутствие свечения возбудителя в мазках) диагноз уточняют люминесцентной микросколией культур, выделенных из посевов патологического материала.
Если исследуемый материал или культура загрязнены кокковой микрофлорой, то последняя иногда может неспецифически связываться с флуоресцирующими листериозными антителами. В этом случае исследование повторяют и перед окрашиванием люмннесцирующей лис-териозной сывороткой препараты обрабатывают в течение 30 мин нормальной нелюминесцирующей сывороткой взрослой лошади.
При сомнительном или отрицательном результате люминесцентной микроскопии посевного материала проводят бактериологическое исследование.
7. Окраска по непрямому методу флуоресцирующих антител. Для
постановки реакции необходимо иметь:
материал для исследований (антиген) в виде микробной бульонной или агаровой культуры (500 млн. микробных тел), выращенной при 22—37°С в течение 16 ч, или мазков-отпечатков из органов и тканей павшего (убитого) животного;
гипериммунные кроличьи сыворотки: листериозные — серогрупповые и поливалентную;
флуоресцирующую сыворотку против глобулинов кролика; метиловый или этиловый спирт;
глицерин на забуференном физиологическом растворе 1 : 10 (pH 7,2-7,4);
дистиллированную воду; нефлуоресцирующее иммерсионное масло; тонкие, обезжиренные предметные стекла.
Для приготовления рабочего разведения сухую флуоресцирующую сыворотку против глобулинов кролика растворяют в указанном на этикетке ампулы объеме дистиллированной воды. После растворения сыворотку надо отцентрифугировать при 3—6 тыс. об/мин 30 мин для удаления крупных конгломератов.
Методика приготовления препаратов для люминесцентной микроскопии:
мазок из бактериальной культуры или тонкий мазок-отпечаток из органов высушивают на воздухе в течение 1 мин и фиксируют этиловым или метиловым спиртом также в течение 1 мин;
наносят каплю гипериммунной листериозной кроличьей сыворотки, покрывают покровным стеклом (разрезанным на 4 части IX 1 см) на 5 мин при температуре 20°С. Затем покровное стекло снимают и в течение 20—30 с препарат промывают дистиллированной водой. После этого препарат высушивают в сушильном шкафу при температуре 60—70°С в течение 2 мин;
наносят одну каплю флуоресцирующей сыворотки против глобу-
Разведенную сыворотку хранят в пробирке с резиновой пробкой или в запаянной ампуле при температуре 4°С в течение 2 нед. Перед нанесением на препарат флуоресцирующую сыворотку необходимо развести физиологическим раствором хлорида натрия (pH 7,2— 7,4) в соответствии с указанным на этикетке ампулы рабочим разведением в нужном для работы объеме. Разведенная до рабочего разведения сыворотка используется в тот же день.
линов кролика, покрывают покровным стеклом (разрезанным на 4 части 1X 1 см), экспозиция 5 мин при температуре20°С. Снимают покровное стекло и под сильной струей водопроводной воды промывают препарат 5—10 мин;
препарат высушивают в сушильном шкафу при температуре 60— 70°С в течение 2 мин.
Затем на препарат наносят каплю жидкости (1 часть нейтрального глицерина и 9 частей физраствора, забуференного фосфатным буфером, pH 7,2—7,4), накрывают покровным стеклом, па которое наносят одну каплю нефлуоресцирующего иммерсионного масла, и исследуют под люминесцентным микроскопом (объектив 90, окуляр 5—7—10) с системой светофильтров (ФС-1-4, БС-8-2).
Для обнаружения листерий в органах и тканях мазки обрабатывают поливалентной сывороткой, а для серологической типизации листерий готовят несколько мазков, половину которых обрабатывают сывороткой первой серогруппы, а другую — сывороткой второй ссро-группы.
Существует четыре серотипа листерий: 1,2, 3, 4. Четвертый серотип делится на 5 подтипов (а, б, с, д, е). Первые три (1,2, 3) серотипа входят в первую серогруппу, а вторая серогруппа включает все подтипы четвертого серотипа.
При исследовании материала необходимо ставить контроли с нормальной сывороткой, проверенной на отсутствие листериозпых антител, и с заведомо известной листсриозной культурой.
Обязательным контролем следует считать препарат с листернями, обработанными только люмипесцирующей аитивидовой сывороткой.
Штаммы листерий,. обработанные гомологичной листсриозной сывороткой, обладают свечением, в то время как штаммы, обработанные гетерологичной лнстериозиой сывороткой, не светятся при исследовании в люминесцентном микроскопе. Бактерии других видов, обработанные листериозной сывороткой, также не светятся.
Степень свечения оценивается в крестах:
(+4-++) — ярко выраженное золотисто-зеленоватое свечение, четко заметны морфологические особенности бактерий, хорошо видна темная центральная зона клетки;
(+++) — яркое свечение, хорошо заметны цвет и морфологические особенности клетки;
(-J-+) — выраженное свечение, но меньшей интенсивности;
(+) — заметное, но слабое свечение, цвет не ясен, морфологические особенности различаются плохо;
(—) — свечение не обнаруживается.
Свечение бактериальных клеток на 4 и 3 креста расценивается как положительный результат, на 2 креста — сомнительный. При получении сомнительного результата исследование необходимо повторить. Пробы, давшие дважды сомнительный результат, считать положительными.
8. При использовании метода флуоресцирующих антител для контрастирования фона препарат можно одновременно с флуоресцирующей сывороткой окрашивать бычьим альбумином, меченным родамином, в соответствии с Временным наставлением по его применению, утвержденным Минздравом СССР 14 апреля 1962 г. Совместное применение флуоресцирующей сыворотки н альбумина значительно повышает чувствительность и надежность иммунофлуоресцентиого анализа — меченый альбумин снижает неспецнфическос свечение фона, сообщая посторонним бактердям и тканям, а также прочим органическим частицам,